SERENASE DEPOT injektioneste, liuos 50 mg/ml, 100 mg/ml
Vaikuttavat aineet ja niiden määrät
50 mg/ml injektioliuos:
1 ml injektioliuosta sisältää 70,52 mg haloperidolidekanoaattia, mikä vastaa 50 mg:aa haloperidoliemästä.
100 mg/ml injektioliuos:
1 ml injektioliuosta sisältää 141,04 mg haloperidolidekanoaattia, mikä vastaa 100 mg:aa haloperidoliemästä.
Apuaineet, joiden vaikutus tunnetaan:
50 mg/ml ja 100 mg/ml injektioliuos:
1 ml injektioliuosta sisältää 15 mg bentsyylialkoholia ja enintään 1 ml:n seesamiöljyä.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, liuos.
Kliiniset tiedot
Käyttöaiheet
Serenase depot on tarkoitettu skitsofrenian ja skitsoaffektiivisen häiriön ylläpitohoitoon aikuispotilaille, joiden tila on vakautettu suun kautta otettavalla haloperidolilla (ks. kohta Farmakodynamiikka).
Annostus ja antotapa
Hoito pitää aloittaa ja annos titrata tiiviissä kliinisessä seurannassa.
Annostus
Yksilöllinen annos riippuu oireiden vaikeusasteesta sekä senhetkisestä suun kautta otettavasta haloperidoliannoksesta. Potilaan on käytettävä aina pienintä tehokasta annosta.
Haloperidolidekanoaattihoidon aloitusannos perustuu suun kautta otettavan haloperidolin vuorokausiannokseen, joten muista psykoosilääkkeistä siirtymiseen ei voida antaa tarkkoja ohjeita (ks. kohta Farmakodynamiikka).
Vähintään 18-vuotiaat aikuiset
Taulukko 1. Haloperidolidekanoaatin annossuositukset vähintään 18-vuotiaille aikuisille
Siirryttäessä suun kautta otettavasta haloperidolista
|
Hoidon jatkaminen
|
Antoväli
|
Lisälääkitys haloperidolin dekanoaattisuolattomalla lääkemuodolla
|
Erityiset potilasryhmät
Iäkkäät
Taulukko 2. Haloperidolidekanoaatin annossuositukset iäkkäille potilaille
Siirryttäessä suun kautta otettavasta haloperidolista
|
Hoidon jatkaminen
|
Antoväli
|
Lisälääkitys haloperidolin dekanoaattisuolattomalla lääkemuodolla
|
Munuaisten vajaatoiminta
Munuaisten vajaatoiminnan vaikutusta haloperidolin farmakokinetiikkaan ei ole tutkittu. Annosmuutoksia ei suositella, mutta munuaisten vajaatoimintaa sairastavien potilaiden hoidossa kehotetaan varovaisuuteen. Vaikeaa munuaisten vajaatoimintaa sairastavat potilaat saattavat tarvita tavanomaista pienemmän aloitusannoksen, jota suurennetaan pienemmin lisäyksin ja pidemmin väliajoin kuin potilailla, joilla ei ole munuaisten vajaatoimintaa (ks. kohta Farmakokinetiikka).
Maksan vajaatoiminta
Maksan vajaatoiminnan vaikutusta haloperidolin farmakokinetiikkaan ei ole tutkittu. Haloperidoli metaboloituu voimakkaasti maksassa, joten aloitusannos suositellaan puolittamaan ja säätämään annosta pienemmin lisäyksin ja pidemmin väliajoin kuin potilailla, joilla ei ole maksan vajaatoimintaa (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Pediatriset potilaat
Serenase depot ‑injektioliuoksen turvallisuutta ja tehoa lasten ja alle 18-vuotiaiden nuorten hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
Antotapa
Serenase depot on tarkoitettu annettavaksi vain lihakseen eikä sitä saa antaa laskimoon. Se annetaan injektiona syvälle pakaralihakseen. Injektiot suositellaan antamaan vuorotellen kumpaankin pakaralihakseen. Injektiotilavuudet yli 3 ml ovat potilaalle epämiellyttäviä, joten näin suuria tilavuuksia ei suositella. Ks. kohdasta Erityiset varotoimet hävittämiselle ja muut käsittelyohjeet ohjeet Serenase depot -injektioliuoksen käsittelyyn.
Vasta-aiheet
- Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille
- koomatila
- keskushermostolama
- Parkinsonin tauti
- Lewyn kappale -dementia
- etenevä supranukleaarinen halvaus
- tiedossa oleva QTc-ajan pidentyminen tai synnynnäinen pitkän QT-ajan oireyhtymä
- äskettäinen akuutti sydäninfarkti
- kompensoitumaton sydämen vajaatoiminta
- aiemmat kammioperäiset rytmihäiriöt tai kääntyvien kärkien takykardia (torsades de pointes)
- korjaamaton hypokalemia
- samanaikainen hoito QT-aikaa pidentävillä lääkevalmisteilla (ks. kohta Yhteisvaikutukset muiden lääkevalmisteiden kanssa sekä muut yhteisvaikutukset).
Varoitukset ja käyttöön liittyvät varotoimet
Iäkkäiden dementiapotilaiden lisääntynyt kuolleisuus
Psykoosilääkkeitä, haloperidolia mukaan lukien, käyttävillä psykiatrisilla potilailla on raportoitu harvinaisina tapauksina äkkikuolemia (ks. kohta Haittavaikutukset).
Psykoosilääkkeitä dementiaan liittyvän psykoosin hoitoon saaneilla iäkkäillä potilailla on tavallista suurempi kuolemanriski. Pääasiassa atyyppisiä psykoosilääkkeitä saaneilla potilailla tehtyjen seitsemäntoista lumekontrolloidun tutkimuksen (yleisin kesto 10 viikkoa) analyyseistä ilmeni, että vaikuttavaa ainetta saaneiden potilaiden kuolemanriski oli 1,6–1,7-kertainen lumelääkettä saaneisiin potilaisiin verrattuna. Tyypillisen 10 viikkoa kestäneen kontrolloidun tutkimuksen aikana psykoosilääkkeillä hoitoa saaneiden potilaiden kuolleisuus oli noin 4,5 % verrattuna noin 2,6 %:iin lumelääkeryhmässä. Vaikka kuolemansyy vaihtelikin, suurin osa kuolemista näytti olevan luonteeltaan kardiovaskulaarisia (esim. sydämen vajaatoiminta, äkkikuolema) tai infektioihin liittyviä (esim. keuhkokuume). Havainnointitutkimukset viittaavat siihen, että iäkkäiden potilaiden haloperidolihoitoon liittyy myös kuolleisuuden lisääntymistä. Tällainen yhteys saattaa olla haloperidolilla voimakkaampi kuin atyyppisillä psykoosilääkkeillä, se on suurimmillaan ensimmäiset 30 päivää hoidon aloittamisen jälkeen ja säilyy vähintään 6 kuukauden ajan. Sitä ei ole vielä selvitetty, missä määrin tämä liittyy lääkevalmisteeseen tai toisaalta potilaan ominaisuuksiin liittyviin sekoittaviin tekijöihin.
Serenase depot -injektioneste ei ole tarkoitettu dementiaan liittyvien käytöshäiriöiden hoitoon.
Kardiovaskulaariset vaikutukset
Haloperidolin käytön yhteydessä on raportoitu äkkikuolemien lisäksi QTc-ajan pitenemistä ja/tai kammioperäisiä rytmihäiriöitä (ks. kohdat Vasta-aiheet ja Haittavaikutukset). Näiden tapahtumien riski vaikuttaa lisääntyvän, jos käytetään suuria annoksia, jos pitoisuus plasmassa on suuri, jos potilaalla on tähän alttius tai jos valmiste annetaan parenteraalisesti, etenkin laskimoon.
Serenase depot -injektionestettä ei saa antaa laskimoon.
Hoidossa kehotetaan varovaisuuteen, jos potilaalla on bradykardiaa, sydänsairaus, potilaan suvussa on aiemmin todettu QTc-ajan pidentymistä tai jos potilas on käyttänyt runsaasti alkoholia. Hoidossa on oltava varovainen myös, jos pitoisuus plasmassa voi olla suuri (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet, hitaat CYP2D6-metaboloijat).
Ennen hoidon aloittamista suositellaan rekisteröimään EKG. Hoidon aikana on arvioitava kaikkien potilaiden EKG-seurannan tarve QTc-ajan pidentymisen ja kammioperäisten rytmihäiriöiden havaitsemiseksi. Jos QTc-aika pidentyy hoidon aikana, annosta suositellaan pienentämään. Jos QTc on yli 500 ms, haloperidolihoito on lopetettava.
Elektrolyyttitasapainon häiriöt, kuten hypokalemia ja hypomagnesemia, lisäävät kammioperäisten rytmihäiriöiden riskiä, joten ne on korjattava ennen kuin haloperidolihoito aloitetaan. Elektrolyyttien seurantaa suositellaan siksi ennen hoidon aloittamista ja säännöllisesti hoidon aikana.
Takykardiaa ja hypotensiota (mukaan lukien ortostaattista hypotensiota) on myös raportoitu (ks. kohta Haittavaikutukset). Jos potilaalla on ilmeistä hypotensiota tai ortostaattista hypotensiota, haloperidolin annossa suositellaan varovaisuutta.
Aivoverenkiertoon liittyvät tapahtumat
Dementiapotilailla tehdyissä satunnaistetuissa lumekontrolloiduissa kliinisissä tutkimuksissa joidenkin atyyppisten psykoosilääkkeiden käytön yhteydessä aivoverenkierron haittatapahtumien riski lisääntyi noin kolminkertaiseksi. Havainnointitutkimuksissa verrattiin aivohalvauksen esiintyvyyttä psykoosilääkkeille altistuneilla iäkkäillä potilailla aivohalvauksen esiintyvyyteen potilailla, jotka eivät olleet altistuneet tällaisille lääkevalmisteille. Psykoosilääkkeille altistuneilla potilailla aivohalvausten todettiin lisääntyneen. Esiintyvyyden lisääntyminen saattaa olla suurempaa kaikkien butyrofenonien, haloperidoli mukaan lukien, käytössä. Lisääntyneen riskin mekanismia ei tunneta. Riskin lisääntymistä muissa potilasryhmissä ei voida sulkea pois. Serenase depot ‑injektioliuoksen käytössä on oltava varovainen, jos potilaalla on aivohalvauksen riskitekijöitä.
Maligni neuroleptioireyhtymä
Haloperidoliin on liittynyt malignia neuroleptioireyhtymää. Se on harvinainen idiosynkraattinen tila, jolle on tyypillistä hypertermia, yleistynyt lihasjäykkyys, autonominen instabiliteetti, tajunnan vaihtelut ja suurentuneet seerumin kreatiinifosfokinaasipitoisuudet. Tämän oireyhtymän varhaisoire on usein hypertermia. Hoito psykoosilääkkeillä on lopetettava heti, ja tarkoituksenmukainen elintoimintoja tukeva hoito sekä potilaan tilan huolellinen valvonta on aloitettava.
Tardiivi dyskinesia
Tardiivia dyskinesiaa saattaa esiintyä joillakin pitkäaikaishoitoa saavilla potilailla tai lääkevalmisteen käytön lopettamisen jälkeen. Oireyhtymälle on tyypillistä lähinnä kielen, kasvojen, suun tai leukojen rytmiset pakkoliikkeet. Joissakin tapauksissa oireet saattavat jäädä pysyviksi. Oireyhtymä saattaa jäädä piileväksi, kun hoito aloitetaan uudelleen, annosta suurennetaan tai siirrytään toisen psykoosilääkkeen käyttöön. Jos potilaalle ilmaantuu tardiivin dyskinesian oireita ja löydöksiä, kaikkien psykoosilääkkeiden, myös Serenase depot ‑injektionesteen käytön lopettamista on harkittava.
Ekstrapyramidaalioireet
Ekstrapyramidaalioireita (esim. vapinaa, jäykkyyttä, voimakasta syljeneritystä, bradykinesiaa, akatisiaa, akuuttia dystoniaa) saattaa esiintyä. Haloperidolin käyttöön on liittynyt akatisian kehittymistä. Akatisialle tyypillistä on subjektiivisesti epämiellyttävä tai ahdistava rauhattomuus ja liikkumisen tarve, johon liittyy usein kyvyttömyys istua tai seistä paikallaan. Tällaista esiintyy todennäköisimmin muutaman ensimmäisen hoitoviikon aikana. Jos potilaalle kehittyy tällaisia oireita, annoksen suurentaminen voi olla haitallista.
Haloperidolihoidon ensimmäisinä päivinä voi esiintyä akuuttia dystoniaa, mutta sen ilmaantumista on raportoitu myös myöhemmin sekä annoksen suurentamisen jälkeen. Dystonisia oireita voivat olla mm. tortikollis, kasvojen vääntely, leukalukko, kielen ulostyöntäminen ja silmien poikkeavat liikkeet, okulogyyrinen kriisi mukaan lukien, näihin kuitenkaan rajoittumatta. Tällaisten reaktioiden riski on suurempi miehillä ja nuoremmilla ikäryhmillä. Akuutti dystonia saattaa edellyttää lääkevalmisteen käytön lopettamista.
Ekstrapyramidaalioireiden hoitoon voidaan tarpeen mukaan määrätä antikolinergisia parkinsonismilääkkeitä, mutta niiden määräämistä rutiininomaisesti ennaltaehkäisevänä hoitona ei suositella. Jos samanaikainen parkinsonismilääkitys on tarpeen, lääkitystä voi olla syytä jatkaa Serenase depot ‑hoidon lopettamisen jälkeenkin ekstrapyramidaalioireiden ilmaantumisen tai pahenemisen estämiseksi, jos parkinsonismilääkkeen erittyminen on nopeampaa kuin haloperidolin. Silmänpaineen kohoamisen mahdollisuus on syytä muistaa, jos antikolinergisia lääkkeitä, parkinsonismilääkkeet mukaan lukien, annetaan samanaikaisesti Serenase depot ‑injektioliuoksen kanssa.
Epileptiset kohtaukset/kouristukset
Haloperidolin laukaisemia epileptisiä kohtauksia on raportoitu. Haloperidolihoidossa kehotetaan varovaisuuteen, jos potilaalla on epilepsia tai epileptisille kohtauksille altistava sairaus (esim. alkoholivieroitus tai aivovaurio).
Maksa ja sappi
Haloperidoli metaboloituu maksassa, joten maksan vajaatoimintaa sairastavien potilaiden annosta kehotetaan muuttamaan ja hoidossa kehotetaan noudattamaan varovaisuutta (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka). Yksittäisiä useimmiten kolestaattisia maksan toiminnan poikkeavuuksia tai hepatiittitapauksia on raportoitu (ks. kohta Haittavaikutukset).
Umpieritysjärjestelmä
Tyroksiini saattaa lisätä haloperidolin toksisuutta. Hypertyreoosipotilaiden psykoosilääkehoidossa on noudatettava varovaisuutta ja siihen on aina liitettävä lääkehoito, jolla kilpirauhasen toiminta normalisoituu.
Psykoosilääkkeiden hormonaalisiin vaikutuksiin kuuluu hyperprolaktinemia, josta saattaa aiheutua galaktorreaa, gynekomastiaa sekä oligo- tai amenorreaa (ks. kohta Haittavaikutukset). Kudosviljelmillä tehdyt tutkimukset viittaavat siihen, että prolaktiini saattaa stimuloida ihmisen rintasyöpäsolujen kasvua. Kliinisissä ja epidemiologisissa tutkimuksissa ei ole osoitettu, että psykoosilääkkeiden käyttö olisi selvästi yhteydessä ihmisen rintasyöpiin, mutta potilaan hoidossa suositellaan varovaisuutta, jos asialla on merkitystä potilaan aiempien sairauksien suhteen. Serenase depot ‑injektioliuoksen käytössä on oltava varovainen, jos potilaalla on ennestään hyperprolaktinemia tai jos potilaalla on mahdollisesti prolaktiiniriippuvaisia kasvaimia (ks. kohta Prekliiniset tiedot turvallisuudesta).
Haloperidolin käytössä on raportoitu hypoglykemiaa ja antidiureettisen hormonin epäasianmukaisen erityksen oireyhtymää (SIADH) (ks. kohta Haittavaikutukset).
Laskimoveritulppa
Psykoosilääkkeiden käytön yhteydessä on raportoitu laskimoveritulppatapauksia. Psykoosilääkkeillä hoidettavilla potilailla on usein hankittuja laskimoveritulpan riskitekijöitä, joten kaikki mahdolliset laskimoveritulpan riskitekijät on tunnistettava ennen Serenase depot -hoidon aloittamista ja hoidon aikana, ja ehkäiseviin toimenpiteisiin on ryhdyttävä.
Hoidon aloitus
Jos potilaalle harkitaan Serenase depot ‑hoitoa, hoito on aloitettava suun kautta otettavalla haloperidolilla, jotta odottamattoman yliherkkyyden mahdollisuus haloperidolille vähenee.
Masennuspotilaat
Jos potilaan hallitseva oire on masennus, Serenase depot -hoitoa ei suositella käytettäväksi yksinään. Potilailla, joiden sairauteen liittyy sekä masennusta että psykooseja, hoitoon voidaan yhdistää masennuslääkkeitä (ks. kohta Yhteisvaikutukset).
Hitaat CYP2D6-metaboloijat
Serenase depot ‑valmisteen käytössä pitää olla varovainen, jos potilaan tiedetään olevan hidas sytokromi P450 (CYP) 2D6 ‑metaboloija ja jos potilas käyttää samaan aikaan jotakin CYP3A4:n estäjää.
Serenase depot -injektioliuoksen apuaineet
Serenase depot sisältää bentsyylialkoholia, joka saattaa aiheuttaa allergisia reaktioita. Serenase depot -valmisteen käytössä munuaisten tai maksan vajaatoimintaa sairastavien potilaiden tai raskaana olevien tai imettävien potilaiden hoitoon on oltava varovainen, koska siihen liittyy lääkkeen elimistöön kertymisen ja toksisuuden (metabolinen asidoosi) riski.
Serenase depot -valmiste sisältää seesamiöljyä, joka saattaa aiheuttaa harvinaisena haittavaikutuksena vakavia allergisia reaktioita.
Yhteisvaikutukset
Yhteisvaikutuksia on tutkittu vain aikuisille tehdyissä tutkimuksissa.
Kardiovaskulaariset vaikutukset
Serenase depot on vasta-aiheista yhdistelmänä lääkevalmisteiden kanssa, joiden tiedetään pidentävän QTc-aikaa (ks. kohta Vasta-aiheet). Esimerkkejä ovat
- ryhmän IA rytmihäiriölääkkeet (esim. disopyramidi, kinidiini)
- ryhmän III rytmihäiriölääkkeet (esim. amiodaroni, dofetilidi, dronedaroni, ibutilidi, sotaloli)
- tietyt masennuslääkkeet (esim. sitalopraami, essitalopraami)
- tietyt antibiootit (esim. atsitromysiini, klaritromysiini, erytromysiini, levofloksasiini, moksifloksasiini, telitromysiini)
- muut psykoosilääkkeet (esim. fentiatsiinijohdokset, sertindoli, pimotsidi, tsiprasidoni)
- tietyt sienilääkkeet (esim. pentamidiini)
- tietyt malarialääkkeet (esim. halofantriini)
- tietyt maha-suolikanavan lääkkeet (esim. dolasetroni)
- tietyt syöpälääkkeet (esim. toremifeeni, vandetanibi)
- tietyt muut lääkevalmisteet (esim. bepridiili, metadoni).
Tämä luettelo ei ole täydellinen.
Varovaisuutta tulee noudattaa käytettäessä Serenase depot ‑valmistetta yhdistelmänä lääkevalmisteiden kanssa, joiden tiedetään aiheuttavan elektrolyyttitasapainon häiriöitä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Lääkevalmisteet, jotka saattavat suurentaa haloperidolipitoisuuksia plasmassa
Haloperidoli metaboloituu useiden reittien kautta (ks. kohta Farmakokinetiikka). Tärkeimmät reitit ovat glukuronidaatio ja ketonin pelkistyminen. Metaboliaan osallistuu myös sytokromi P450 ‑entsyymijärjestelmä, etenkin CYP3A4 ja vähemmässä määrin CYP2D6. Toisesta lääkevalmisteesta aiheutuva näiden metaboliareittien estyminen tai CYP2D6-entsyymin aktiivisuuden väheneminen saattaa suurentaa haloperidolipitoisuuksia. CYP3A4-entsyymin eston ja CYP2D6-entsyymin vähentyneen aktiivisuuden vaikutus saattaa olla additiivinen (ks. kohta Farmakokinetiikka). Suppean ja osittain ristiriitaisen tiedon perusteella CYP3A4:n ja/tai CYP2D6:n estäjän samanaikainen käyttö saattaa suurentaa haloperidolin pitoisuutta plasmassa 20–40 %, mutta joissakin tapauksissa pitoisuuksien on raportoitu suurentuneen 100 %:iin saakka. Esimerkkejä lääkevalmisteista, jotka saattavat suurentaa haloperidolipitoisuutta plasmassa (kliinisen kokemuksen tai lääkkeiden yhteisvaikutusmekanismin perusteella), ovat:
- CYP3A4:n estäjät –alpratsolaami, fluvoksamiini, indinaviiri, itrakonatsoli, ketokonatsoli, nefatsodoni, posakonatsoli, sakinaviiri, verapamiili, vorikonatsoli
- CYP2D6:n estäjät – bupropioni, klooripromatsiini, duloksetiini, paroksetiini, prometatsiini, sertraliini, venlafaksiini
- sekä CYP3A4:n että CYP2D6:n estäjät: fluoksetiini, ritonaviiri
- mekanismi epäselvä – buspironi.
Tämä luettelo ei ole täydellinen.
Plasman suurentunut haloperidolipitoisuus saattaa lisätä haittavaikutusten riskiä, QTc‑ajan pitenemisen riski mukaan lukien (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). QTc-ajan on havaittu pidentyneen, kun haloperidolia on annettu yhdistelmänä metabolian estäjien ketokonatsolin (400 mg/vrk) ja paroksetiinin (20 mg/vrk) kanssa.
Jos potilas käyttää haloperidolia samanaikaisesti tällaisten lääkevalmisteiden kanssa, häntä suositellaan seuraamaan haloperidolin farmakologisten vaikutusten voimistumisen tai pitkittymisen oireiden tai löydösten havaitsemiseksi, ja Serenase depot ‑annosta suositellaan pienentämään siten kuin katsotaan tarpeelliseksi.
Lääkevalmisteet, jotka saattavat pienentää haloperidolipitoisuuksia plasmassa
Haloperidolin samanaikainen käyttö CYP3A4-entsyymin voimakkaiden indusorien kanssa saattaa pienentää plasman haloperidolipitoisuutta vähitellen siinä määrin, että hoidon teho saattaa heikentyä. Esimerkkejä ovat:
- karbamatsepiini, fenobarbitaali, fenytoiini, rifampisiini, mäkikuisma (Hypericum perforatum).
Tämä luettelo ei ole täydellinen.
Entsyymi-induktio voidaan havaita muutaman hoitopäivän jälkeen. Entsyymi-induktio on yleensä suurimmillaan noin 2 viikon kuluttua ja se voi jatkua vielä yhtä pitkään lääkevalmisteen käytön lopettamisen jälkeen. Yhdistelmäkäytössä CYP3A4:n indusorien kanssa suositellaan, että potilasta seurataan ja Serenase depot ‑annosta suurennetaan siten kuin katsotaan tarpeelliseksi. Kun CYP3A4:n indusorin käyttö lopetetaan, haloperidolipitoisuus saattaa suurentua vähitellen, joten Serenase depot ‑annosta saattaa olla tarpeen pienentää.
Natriumvalproaatin tiedetään estävän glukuronidaatiota, mutta se ei vaikuta haloperidolipitoisuuksiin plasmassa.
Haloperidolin vaikutus muihin lääkevalmisteisiin
Haloperidoli voi voimistaa alkoholin tai keskushermostoa lamaavien lääkevalmisteiden, kuten unilääkkeiden, rauhoittavien lääkkeiden ja voimakkaiden kipulääkkeiden, keskushermostoa lamaavaa vaikutusta. Myös yhdistelmäkäytössä metyylidopan kanssa keskushermostovaikutusten on raportoitu voimistuneen.
Haloperidoli saattaa antagonisoida adrenaliinin ja muiden sympatomimeettisten lääkevalmisteiden (esim. stimulanttien, kuten amfetamiinien) vaikutusta ja kumota adrenergisten salpaajien, kuten guanetidiinin, verenpainetta alentavat vaikutukset.
Haloperidoli saattaa antagonisoida levodopan ja muiden dopamiiniagonistien vaikutusta.
Haloperidoli on CYP2D6:n estäjä. Haloperidoli estää trisyklisten masennuslääkkeiden (esim. imipramiinin, desipramiinin) metaboliaa ja suurentaa siten näiden lääkevalmisteiden pitoisuuksia plasmassa.
Muun tyyppiset yhteisvaikutukset
Litiumin ja haloperidolin samanaikaisen käytön yhteydessä on raportoitu harvoin seuraavia oireita: enkefalopatia, ekstrapyramidaalioireet, tardiivi dyskinesia, maligni neuroleptioireyhtymä, akuutti aivo-oireyhtymä ja kooma. Valtaosa näistä oireista oli korjautuvia. On jäänyt epäselväksi, onko kyseessä erillinen kliininen tila.
Serenase depot ‑valmistetta ja litiumia samanaikaisesti käyttävän potilaan lääkitys on lopetettava välittömästi, jos hän saa tämäntyyppisiä oireita.
Haloperidolin on raportoitu estävän fenindionin antikoagulanttivaikutusta.
Raskaus ja imetys
Raskaus
Kohtalaisen laajat tiedot (yli 400 raskaudesta) haloperidolin käytöstä raskaana olevien naisten hoidossa eivät viittaa epämuodostumia aiheuttavaan, fetaaliseen tai neonataaliseen toksisuuteen. Sikiöaikaisen haloperidolialtistuksen jälkeisistä syntymävioista on kuitenkin yksittäisiä tapausselostuksia, jotka koskevat valmisteen käyttöä yhdistelmänä muiden lääkevalmisteiden kanssa. Eläinkokeissa on havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta). Varmuuden vuoksi Serenase depot ‑injektioliuoksen käyttöä on suositeltavaa välttää raskauden aikana.
Psykoosilääkkeille (haloperidoli mukaan lukien) kolmannen raskauskolmanneksen aikana altistuneilla vastasyntyneillä on ekstrapyramidaali- ja lääkevieroitusoireiden riski. Oireiden vaikeusaste ja kesto synnytyksen jälkeen voi vaihdella. Agitaatiota, hypertoniaa, hypotoniaa, vapinaa, uneliaisuutta, hengitysvaikeutta tai syömishäiriötä on raportoitu. Siksi vastasyntyneiden vointia pitää seurata huolellisesti.
Imetys
Haloperidoli erittyy rintamaitoon. Haloperidolihoitoa saaneiden äitien rintaruokittujen vastasyntyneiden plasmassa ja virtsassa on havaittu pieniä määriä haloperidolia. Haloperidolin vaikutuksista rintaruokittuihin imeväisiin ei ole riittävästi tietoja. On päätettävä, lopetetaanko rintaruokinta vai lopetetaanko Serenase depot ‑hoito ottaen huomioon rintaruokinnasta aiheutuvat hyödyt lapselle ja hoidosta koituvat hyödyt äidille.
Hedelmällisyys
Haloperidoli suurentaa prolaktiinipitoisuutta. Hyperprolaktinemia saattaa vaimentaa gonadotropiinien vapauttajahormonin (GnRH) erittymistä hypotalamuksesta, jolloin gonadotropiinin erittyminen aivolisäkkeestä vähenee. Tämä saattaa estää lisääntymistoimintoja heikentämällä steroidogeneesiä sekä mies- että naispotilaiden sukupuolirauhasissa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Serenase depot ‑injektioliuoksella on kohtalainen vaikutus ajokykyyn ja koneiden käyttökykyyn. Etenkin suurilla annoksilla ja hoidon alussa saattaa esiintyä jonkinasteista sedaatiota tai vireystilan heikentymistä. Alkoholi saattaa voimistaa tällaisia vaikutuksia. On suositeltavaa kehottaa potilaita olemaan ajamatta mitään ajoneuvoa ja käyttämättä koneita hoidon aikana, kunnes heidän herkkyytensä on tiedossa.
Haittavaikutukset
Haloperidolidekanoaatin turvallisuutta arvioitiin kolmessa vertailututkimuksessa (yhdessä tutkimuksessa haloperidolidekanoaattia verrattiin flufenatsiiniin, ja kahdessa tutkimuksessa haloperidolidekanoaattia verrattiin suun kautta otettavaan haloperidoliin), yhdeksässä avoimessa tutkimuksessa ja yhdessä annosvastetutkimuksessa, joihin osallistui 410 potilasta.
Näiden kliinisten tutkimusten yhdistettyjen turvallisuustietojen perusteella yleisimmin raportoituja haittavaikutuksia olivat ekstrapyramidaalioireet (14 %), vapina (8 %), parkinsonismi (7 %), lihasjäykkyys (6 %) ja uneliaisuus (5 %).
Lisäksi haloperidolin turvallisuutta arvioitiin kolmessa lumelääkekontrolloidussa kliinisessä tutkimuksessa, joihin osallistui 284 haloperidolihoitoa saanutta potilasta, ja 16 kaksoissokkoutetussa aktiivisella vertailuvalmisteella toteutetussa kliinisessä tutkimuksessa, joihin osallistui 1295 haloperidolihoitoa saanutta potilasta.
Taulukossa 3 luetellaan haittavaikutukset seuraavasti:
- haloperidolidekanoaatilla kliinisissä tutkimuksissa raportoidut
- haloperidolilla (dekanoaattisuolaton muoto) ja sen aktiivisella osalla kliinisissä tutkimuksissa raportoidut
- haloperidolidekanoaatin ja haloperidolin markkinoille tulon jälkeen raportoidut haittavaikutukset.
Haittavaikutusten esiintymistiheydet perustuvat (tai arvio perustuu) haloperidolidekanoaatilla tehtyihin kliinisiin tutkimuksiin tai epidemiologisiin tutkimuksiin, ja ne on luokiteltu seuraavan esitystavan mukaisesti:
Hyvin yleinen: ≥ 1/10
Yleinen: ≥ 1/100 – < 1/10
Melko harvinainen: ≥ 1/1 000 – < 1/100
Harvinainen: ≥ 1/10 000 – < 1/1 000
Hyvin harvinainen: < 1/10 000
Tuntematon: koska saatavissa oleva tieto ei riitä arviointiin.
Haittavaikutukset on esitetty elinjärjestelmän mukaan ja kussakin yleisyysluokassa vakavuuden mukaan alenevassa järjestyksessä.
Taulukko 3. Haittavaikutukset
Elinjärjestelmä | Haittavaikutus | ||||
Yleisyys | |||||
Hyvin yleinen | Yleinen | Melko harvinainen | Harvinainen | Tuntematon | |
Veri ja imukudos | Pansytopenia Agranulosytoosi Trombosytopenia Leukopenia Neutropenia | ||||
Immuunijärjestelmä | Anafylaktinen reaktio Yliherkkyys | ||||
Umpieritys | Antidiureettisen hormonin epäasianmukaisen erityksen oireyhtymä (SIADH) Hyperprolaktinemia | ||||
Aineenvaihdunta ja ravitsemus | Hypoglykemia | ||||
Psyykkiset häiriöt | Masennus Unettomuus | Psykoottiset häiriöt Agitaatio Sekavuustila Sukupuolinen haluttomuus Sukupuolivietin heikkeneminen Levottomuus | |||
Hermosto | Ekstra-pyramidaali-häiriö | Akatisia Parkinsonismi Kasvojen ilmeettömyys Vapina Uneliaisuus Sedaatio | Akinesia Dyskinesia Dystonia Hammasratas-ilmiö Hypertonia Päänsärky | Maligni neuroleptioireyhtymä Tardiivi dyskinesia Kouristukset Bradykinesia Hyperkinesia Hypokinesia Heitehuimaus Tahdosta riippumattomat lihassupistukset Motorinen toimintahäiriö Silmävärve | |
Silmät | Okulogyyrinen kriisi Näön sumeneminen Näköhäiriö | ||||
Sydän | Takykardia | Kammiovärinä Kääntyvien kärkien takykardia Kammiotakykardia Sydämen lisälyönnit | |||
Verisuonisto | Hypotensio Ortostaattinen hypotensio | ||||
Hengityselimet, rintakehä ja välikarsina | Kurkunpään turvotus Bronkospasmi Kurkunpään kouristus Hengenahdistus | ||||
Ruoansulatuselimistö | Ummetus Suun kuivuminen Syljen liikaeritys | Oksentelu Pahoinvointi | |||
Maksa ja sappi | Akuutti maksan vajaatoiminta Hepatiitti Kolestaasi Ikterus Poikkeavat tulokset maksan toimintakokeissa | ||||
Iho ja ihonalainen kudos | Angioedeema Kesivä ihotulehdus Leukosytoklastinen vaskuliitti Valoyliherkkyysreaktio Nokkosihottuma Kutina Ihottuma Liikahikoilu | ||||
Luusto, lihakset ja sidekudos | Lihasjäykkyys | Rabdomyolyysi Tortikollis Leukalukko Lihaskouristukset Lihasnykäykset Luurankolihasten kankeus | |||
Munuaiset ja virtsatiet | Virtsaumpi | ||||
Raskauteen, synnytykseen ja perinataalikauteen liittyvät haitat | Vastasyntyneen lääkeainevieroitus-oireyhtymä (ks. kohta Hedelmällisyys, raskaus ja imetys). | ||||
Sukupuolielimet ja rinnat | Sukupuoli-toimintojen häiriöt | Priapismi Amenorrea Galaktorrea Dysmenorrea Menorragia Erektiohäiriö Gynekomastia Kuukautishäiriö Rintarauhaskipu Epämukavat tuntemukset rinnoissa | |||
Yleisoireet ja antopaikassa todettavat haitat | Injektiokohdan reaktiot | Äkkikuolema Kasvojen turvotus Turvotus Hypertermia Hypotermia Kävelyhäiriöt Injektiokohdan absessi | |||
Tutkimukset | Painon nousu | EKG:ssä havaittava QT-ajan piteneminen Painon lasku | |||
Haloperidolin käytön yhteydessä on raportoitu sydänsähkökäyrässä todettavaa QT-ajan pitenemistä, kammioperäisiä rytmihäiriöitä (kammiovärinää, kammiotakykardiaa), kääntyvien kärkien takykardiaa ja äkkikuolemia.
Psykoosilääkkeiden luokkavaikutukset
Psykoosilääkkeiden käytössä on raportoitu sydänpysähdyksiä.
Psykoosilääkkeiden käytön yhteydessä on raportoitu laskimoveritulppatapauksia, myös keuhkoembolioita ja syviä laskimotukoksia. Esiintyvyys on tuntematon.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Yliannostus parenteraalisesti annettavan lääkkeen käytössä on epätodennäköisempää kuin suun kautta otettavalla lääkkeellä, joten seuraavat tiedot perustuvat suun kautta otettavaan haloperidoliin. Tiedoissa on myös otettu huomioon Serenase depot ‑injektioliuoksen vaikutuksen pidempi kesto.
Oireet ja löydökset
Haloperidoliyliannostuksesta aiheutuu lääkkeen tunnettujen farmakologisten ja haitallisten vaikutusten korostumista. Selkeimpiä oireita ovat vaikea-asteiset ekstrapyramidaalireaktiot, hypotensio ja sedaatio. Ekstrapyramidaalireaktiot ilmenevät lihasjäykkyytenä ja yleistyneenä tai paikallisena vapinana. Myös hypertensio pikemminkin kuin hypotensio on mahdollista.
Äärimmäisissä tapauksissa potilas vaikuttaa olevan koomassa, johon liittyy hengityslamaa ja hypotensiota, joka voi olla riittävän vaikea-asteista, jotta kehittyy sokin kaltainen tila. Kammioperäisten rytmihäiriöiden ja niihin mahdollisesti liittyvän QTc-ajan pidentymisen riski on otettava huomioon.
Hoito
Spesifistä vasta-ainetta ei ole. Hoito on elintoimintoja tukevaa. Yliannoksen hoitoon ei suositella dialyysiä, koska se poistaa elimistöstä vain hyvin pieniä haloperidolimääriä (ks. kohta Farmakokinetiikka).
Koomassa olevien potilaiden hengitystiet on pidettävä avoimina joko nieluputken tai intubaatioputken avulla. Hengityslama saattaa vaatia hengityksen avustamista.
EKG:tä ja elintoimintoja suositellaan seuraamaan ja jatkamaan seurantaa, kunnes EKG on normalisoitunut. Vaikea-asteisten rytmihäiriöiden hoitoon suositellaan asianmukaisia hoitotoimia.
Hypotensio ja verenkiertokollapsi voidaan kumota antamalla laskimoon nesteytystä, plasmaa tai albumiinikonsentraattia ja vasopressoreita, kuten dopamiinia tai noradrenaliinia. Adrenaliinia ei saa antaa, koska haloperidolin kanssa käytettynä se saattaa aiheuttaa voimakkaan hypotension.
Vaikea-asteisten ekstrapyramidaalireaktioiden hoitoon suositellaan parkinsonismilääkkeiden antamista ja jatkamaan niiden käyttöä usean viikon ajan. Parkinsonismilääkkeiden käyttö on lopetettava hyvin varovaisesti, koska ekstrapyramidaalioireiden ilmaantuminen on mahdollista.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: psykoosi- ja neuroosilääkkeet sekä unilääkkeet, psykoosilääkkeet, butyrofenonijohdokset. ATC-koodi: N05AD01.
Vaikutusmekanismi
Haloperidolidekanoaatti on haloperidolin ja dekaanihapon esteri, joka on butyrofenoniryhmään kuuluva pitkävaikutteinen psykoosilääke. Lihakseen injektiona annettu haloperidolidekanoaatti vapautuu lihaskudoksesta vähitellen ja hydrolysoituu hitaasti vapaaksi haloperidoliksi, joka siirtyy systeemiseen verenkiertoon.
Haloperidoli on voimakas keskushermoston tyypin 2 dopamiinireseptorien antagonisti. Suositusannoksina käytettynä sen alfa‑1-antiadrenerginen aktiivisuus on vähäinen eikä antihistaminergistä tai antikolinergistä aktiivisuutta ole.
Farmakodynaamiset vaikutukset
Haloperidoli salpaa mesolimbisen radan dopaminergistä signaalinvälitystä ja estää siten harhaluuloja ja hallusinaatioita. Keskushermoston dopamiinisalpaus vaikuttaa tyvitumakkeisiin (nigrostriataaliratoihin). Haloperidoli aiheuttaa tehokkaan psykomotorisen sedaation, mikä selittää sen suotuisan vaikutuksen manian ja muiden agitaatiotilojen hoidossa.
Haloperidolin vaikutus tyvitumakkeisiin todennäköisesti aiheuttaa sen käyttöön liittyvät ekstrapyramidaaliset motoriset haittavaikutukset (dystonia, akatisia, parkinsonismi).
Hyperprolaktinemia aiheutuu haloperidolin antidopaminergisista vaikutuksista aivolisäkkeen etuosan laktotrooppeihin, sillä prolaktiinierityksen dopamiinivälitteinen tooninen inhibitiovaikutus estyy.
Kliiniset tutkimukset
Kliinisissä tutkimuksissa potilaiden raportoitiin käyttäneen aiemmin pääasiassa suun kautta otettavaa haloperidolia ennen haloperidolidekanoaatin käyttöön siirtymistä. Pieni osa potilaista oli käyttänyt aiemmin jotakin muuta suun kautta annettavaa psykoosilääkettä.
Farmakokinetiikka
Imeytyminen
Kun haloperidolidekanoaatti annetaan depotinjektiona lihakseen, vapaata haloperidolia vapautuu elimistöön hitaasti ja pitkäkestoisesti. Pitoisuudet plasmassa suurenevat hitaasti, ja huippupitoisuus saavutetaan tavallisesti 3–9 päivää injektion jälkeen.
Plasman vakaan tilan pitoisuudet saavutetaan 2–4 kuukaudessa kuukausittain annettujen injektioiden jälkeen.
Jakautuminen
Plasman proteiineihin sitoutuu aikuisilla keskimäärin noin 88–92 % haloperidolista. Plasman proteiineihin sitoutumisessa on suurta vaihtelua yksilöiden välillä. Haloperidoli jakautuu nopeasti eri kudoksiin ja elimiin, minkä osoittaa suuri jakautumistilavuus (laskimoon annettuna keskimäärin 8–21 l/kg). Haloperidoli läpäisee helposti veri-aivoesteen. Se läpäisee myös istukan ja erittyy rintamaitoon.
Biotransformaatio
Haloperidoli metaboloituu voimakkaasti maksassa. Haloperidolin pääasiallisia metaboliareittejä ihmisellä ovat glukuronidaatio, ketonin pelkistyminen, oksidatiivinen N‑dealkylaatio ja pyridiinimetaboliittien muodostuminen. Haloperidolin metaboliiteilla ei katsota olevan merkittävää osuutta sen aktiivisuuteen, mutta pelkistymisreitti vastaa kuitenkin noin 23 %:a biotransformaatiosta eikä haloperidolin pelkistyneen metaboliitin muuntumista takaisin haloperidoliksi voida täysin sulkea pois. Sytokromi P450 ‑entsyymit CYP3A4 ja CYP2D6 osallistuvat haloperidolin metaboliaan. CYP3A4:n estyminen tai induktio tai CYP2D6:n estyminen saattavat vaikuttaa haloperidolin metaboliaan. CYP2D6-entsyymin aktiivisuuden väheneminen saattaa suurentaa haloperidolipitoisuuksia.
Eliminaatio
Lihakseen haloperidolidekanoaattina annetun haloperidolin terminaalisen eliminaation puoliintumisaika on keskimäärin 3 viikkoa, joka on pidempi kuin dekanoaattisuolattomilla muodoilla, sillä suun kautta otetun haloperidolin terminaalinen eliminaation puoliintumisaika on keskimäärin 24 tuntia ja lihakseen annetun 21 tuntia.
Laskimon ulkopuolelle annetun haloperidolin näennäinen puhdistuma on 0,9–1,5 l/h/kg, mutta CYP2D6:n välityksellä heikosti metaboloivilla se on alentunut. CYP2D6-entsyymin vähentynyt aktiivisuus saattaa suurentaa haloperidolipitoisuuksia. Skitsofreniapotilailla tehdyssä populaatiofarmakokineettisessä analyysissä arvioitiin, että haloperidolin puhdistuman vaihtelu yksilöiden välillä (variaatiokerroin, %) on 44 %. Laskimoon annetusta haloperidoliannoksesta 21 % eliminoitui ulosteisiin ja 33 % virtsaan. Alle 3 % annoksesta erittyy muuttumattomana aineena virtsaan.
Lineaarisuus/ei‑lineaarisuus
Lihakseen haloperidolidekanoaatti-injektioina annetun haloperidolin farmakokinetiikka on annosriippuvaista. Annoksen ja plasmassa olevan haloperidolipitoisuuden välinen suhde on suunnilleen lineaarinen annoksilla alle 450 mg.
Erityiset potilasryhmät
Iäkkäät
Haloperidolipitoisuudet plasmassa olivat iäkkäillä potilailla suuremmat kuin nuoremmilla aikuisilla, kun annos oli samansuuruinen. Suppeiden kliinisten tutkimusten tulokset viittaavat siihen, että iäkkäillä potilailla haloperidolin puhdistuma on pienempi ja eliminaation puoliintumisaika on pidempi. Tulokset ovat haloperidolin farmakokinetiikassa havaitun vaihtelun puitteissa. Iäkkäiden potilaiden annosta suositellaan muuttamaan (ks. kohta Annostus ja antotapa).
Munuaisten vajaatoiminta
Munuaisten vajaatoiminnan vaikutusta haloperidolin farmakokinetiikkaan ei ole tutkittu. Noin kolmannes haloperidoliannoksesta erittyy virtsaan lähinnä metaboliitteina. Alle 3 % annetusta haloperidoliannoksesta erittyy muuttumattomana aineena virtsaan. Haloperidolin metaboliiteilla ei katsota olevan merkittävää osuutta sen aktiivisuuteen, mutta haloperidolin pelkistyneen metaboliitin muuntumista takaisin haloperidoliksi ei voida täysin sulkea pois. Munuaisten vajaatoiminta ei oletettavasti vaikuta kliinisesti oleellisella tavalla haloperidolin eliminaatioon, mutta munuaisten vajaatoimintaa sairastavien potilaiden hoidossa kehotetaan varovaisuuteen, etenkin jos vajaatoiminta on vaikea-asteista, koska haloperidolin ja sen pelkistyneen metaboliitin puoliintumisaika on pitkä ja kertyminen elimistöön on mahdollista (ks. kohta Annostus ja antotapa).
Koska haloperidolin jakautumistilavuus on suuri ja se sitoutuu voimakkaasti proteiineihin, dialyysissa elimistöstä poistuu vain pieniä määriä haloperidolia.
Maksan vajaatoiminta
Maksan vajaatoiminnan vaikutusta haloperidolin farmakokinetiikkaan ei ole tutkittu. Haloperidoli metaboloituu voimakkaasti maksassa, joten maksan vajaatoiminta saattaa vaikuttaa merkittävästi sen farmakokinetiikkaan. Tämän vuoksi maksan vajaatoimintaa sairastavien potilaiden annosta kehotetaan muuttamaan, ja hoidossa kehotetaan noudattamaan varovaisuutta (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Farmakokineettiset/farmakodynaamiset suhteet
Terapeuttiset pitoisuudet
Monista kliinisistä tutkimuksista julkaistujen tietojen perusteella useimmat akuuttia tai kroonista skitsofreniaa sairastavat potilaat saavat hoitovasteen, kun pitoisuus plasmassa on 1–10 ng/ml. Osalla potilaista suuremmat pitoisuudet saattavat olla tarpeen, koska haloperidolin farmakokinetiikassa on suurta vaihtelua yksilöiden välillä.
Skitsofreniapotilaiden ensipsykoosin yhteydessä hoitovaste saatetaan saavuttaa haloperidolin lyhytvaikutteisilla lääkemuodoilla niinkin pienillä pitoisuuksilla kuin 0,6–3,2 ng/ml, mikä on arvioitu D2‑reseptorimiehityksen mittausten perusteella ja olettaen, että D2-reseptorimiehitys 60–80 % on tarkoituksenmukaisin hoitovasteen saavuttamisen ja ekstrapyramidaalioireiden rajoittamisen kannalta. Tämän suuruiset pitoisuudet saadaan keskimäärin annoksilla 1–4 mg/vrk.
Haloperidolin farmakokinetiikassa ja pitoisuus‑vaikutussuhteessa on suurta vaihtelua yksilöiden välillä, joten haloperidolidekanoaattiannos suositellaan säätämään yksilöllisesti potilaan vasteen mukaan. Tässä on otettava huomioon aika, joka annosmuutoksen jälkeen kuluu uuden vakaan tilan pitoisuuden saavuttamiseen plasmassa sekä hoitovasteen saavuttamiseen tarvittava lisäaika. Yksittäisissä tapauksissa voidaan harkita veren haloperidolipitoisuuden määrittämistä.
Kardiovaskulaariset vaikutukset
QTc-ajan pitenemisen riski lisääntyy suurempien haloperidoliannosten ja plasman haloperidolipitoisuuksien myötä.
Ekstrapyramidaalioireet
Ekstrapyramidaalioireita voi esiintyä hoitoannoksia käytettäessä, mutta ne ovat tavallisesti yleisempiä annoksilla, joista aiheutuvat pitoisuudet ovat suurempia kuin terapeuttiset pitoisuudet.
Prekliiniset tiedot turvallisuudesta
Paikallista siedettävyyttä, toistuvan altistuksen aiheuttamaa toksisuutta ja genotoksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille. Jyrsijöillä haloperidolin anto heikensi hedelmällisyyttä ja sen todettiin olevan jossain määrin teratogeeninen ja alkiotoksinen.
Haloperidolilla tehdyssä karsinogeenisuustutkimuksessa naarashiirillä havaittiin annosriippuvaista aivolisäkkeen adenoomien ja rintarauhasen karsinoomien lisääntymistä. Nämä kasvaimet saattavat aiheutua pitkittyneestä dopamiini-D2-antagonismista ja hyperprolaktinemiasta. Näiden jyrsijöillä todettujen kasvainlöydösten merkitystä ihmiselle aiheutuvan riskin kannalta ei tiedetä.
Haloperidolin on havaittu useissa julkaistuissa in vitro tutkimuksissa salpaavan sydämen hERG-kanavia. Monissa in vivo tutkimuksissa haloperidolin anto laskimoon pidensi joissakin eläinmalleissa QTc-aikaa huomattavasti annoksilla noin 0,3 mg/kg, joista aiheutuva huippupitoisuus (Cmax) plasmassa on vähintään 7−14-kertainen verrattuna kliinisissä tutkimuksissa useimmilla potilailla tehokkaiksi todettuihin terapeuttisiin pitoisuuksiin plasmassa (1–10 ng/ml). Nämä laskimoon annetut QTc-aikaa pidentäneet annokset eivät aiheuttaneet rytmihäiriöitä. Joissakin eläinkokeissa suuremmat laskimoon annetut haloperidoliannokset 1 mg/kg tai enemmän pidensivät QTc-aikaa ja/tai aiheuttivat kammioperäisiä rytmihäiriöitä plasman huippupitoisuuksilla, jotka olivat vähintään 38−137-kertaiset verrattuna kliinisissä tutkimuksissa useimmilla potilailla tehokkaiksi todettuihin terapeuttisiin pitoisuuksiin plasmassa.
Farmaseuttiset tiedot
Apuaineet
Bentsyylialkoholi, seesamiöljy.
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta.
Säilytys
Säilytä alkuperäispakkauksessa. Herkkä valolle. Tämä lääkevalmiste ei vaadi lämpötilan suhteen erityisiä säilytysolosuhteita.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
SERENASE DEPOT injektioneste, liuos
50 mg/ml (L:ei) 5 x 1 ml (44,45 €)
100 mg/ml (L:ei) 1 ml (19,15 €), 5 x 1 ml (81,83 €)
PF-selosteen tieto
50 mg/ml injektioliuos:
1 ml tai 3 ml injektioliuosta ruskeassa lasiampullissa.
1 ml:n ampullit: 1, 3 tai 5 ampullin pakkaukset.
100 mg/ml injektioliuos:
1 ml injektioliuosta ruskeassa lasiampullissa.
1 tai 5 ampullin pakkaukset.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Hieman kellanruskea, hieman viskoosinen injektioliuos, jossa ei ole näkyviä vierashiukkasia.
Käyttö- ja käsittelyohjeet
| 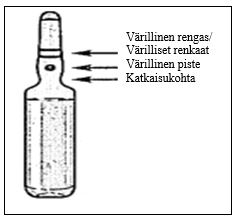 |
|
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
SERENASE DEPOT injektioneste, liuos
50 mg/ml 5 x 1 ml
100 mg/ml 1 ml, 5 x 1 ml
- Ylempi erityiskorvaus (100 %). Vaikeat psykoosit ja muut vaikeat mielenterveyden häiriöt (112), Älyllisesti kehitysvammaisilla esiintyvät käyttäytymisen häiriöt (113).
- Peruskorvaus (40 %).
ATC-koodi
N05AD01
Valmisteyhteenvedon muuttamispäivämäärä
11.11.2021
Yhteystiedot
Vision Exchange Building,Triq it-Territorjals, Zone 1, Central Business District
CBD 1070 Birkirkara
Malta
+44 (0) 1784 477 167
info@essentialpharmagroup.com