NOVOMIX 30 FLEXPEN injektioneste, suspensio, esitäytetty kynä 100 U/ml, NOVOMIX 30 PENFILL injektioneste, suspensio, sylinteriampulli 100 U/ml
Vaikuttavat aineet ja niiden määrät
NovoMix 30 Penfill
1 ml suspensiota sisältää 100 yksikköä lyhytvaikutteista (liukenevaa) aspartinsuliinia*/protamiinilla kiteytettyä aspartinsuliinia* suhteessa 30/70 (vastaten 3,5 mg). 1 sylinteriampulli sisältää 3 ml vastaten 300 yksikköä.
NovoMix 30 FlexPen
1 ml suspensiota sisältää 100 yksikköä lyhytvaikutteista (liukenevaa) aspartinsuliinia*/protamiinilla kiteytettyä aspartinsuliinia* suhteessa 30/70 (vastaten 3,5 mg). 1 esitäytetty kynä sisältää 3 ml vastaten 300 yksikköä.
* Aspartinsuliini on valmistettu Saccharomyces cerevisiae -hiivassa yhdistelmä-DNA-tekniikalla.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, suspensio.
Kliiniset tiedot
Käyttöaiheet
NovoMix 30 on tarkoitettu aikuisten ja 10-vuotiaiden ja sitä vanhempien lasten ja nuorten diabetes mellituksen hoitoon.
Annostus ja antotapa
Annostus
Insuliinianalogien, mukaan lukien aspartinsuliini, pitoisuus ilmaistaan yksiköissä, kun taas ihmisinsuliinin pitoisuus ilmaistaan kansainvälisissä yksiköissä.
NovoMix 30 -insuliinin annostus on yksilöllinen ja se määritetään potilaan tarpeiden mukaisesti. Verenglukoosin seurantaa ja insuliinin annoksen säätämistä suositellaan optimaalisen glukoositasapainon saavuttamiseksi.
Tyypin 2 diabeetikoille NovoMix 30 -insuliinia voidaan antaa yksinään. NovoMix 30 -insuliinia voidaan käyttää myös yhdessä oraalisten diabeteslääkkeiden ja/tai GLP-1-reseptoriagonistien kanssa. Suositeltu NovoMix 30 -insuliinin aloitusannos tyypin 2 diabeetikoille on 6 yksikköä aamiaisen yhteydessä ja 6 yksikköä päivällisen (iltaruoan) yhteydessä. NovoMix 30 voidaan myös aloittaa 12 yksiköllä kerran vuorokaudessa päivällisen (iltaruoan) yhteydessä. Kun NovoMix 30 -insuliinia käytetään kerran vuorokaudessa, yleensä suositellaan, että kun 30 yksikön annos saavutetaan, siirrytään kaksi kertaa päivässä tapahtuvaan antoon jakamalla annos kahteen yhtä suureen aamupalan ja päivällisen yhteydessä otettavaan annokseen. Jos anto kahdesti päivässä johtaa toistuviin päiväaikaisiin hypoglykemioihin, aamuannos voidaan jakaa aamulla ja lounasaikaan otettaviin annoksiin (annostus kolme kertaa päivässä).
Seuraavaa titrausohjeistoa suositellaan annoksen säätämiseen:
Veren glukoositaso ennen ateriaa | NovoMix 30 -annoksen muutos | |
< 4,4 mmol/l | < 80 mg/dl | -2 yksikköä |
4,4–6,1 mmol/l | 80–110 mg/dl | 0 |
6,2–7,8 mmol/l | 111–140 mg/dl | +2 yksikköä |
7,9–10 mmol/l | 141–180 mg/dl | +4 yksikköä |
> 10 mmol/l | > 180 mg/dl | +6 yksikköä |
Kolmen aiemman päivän matalinta ennen ateriaa mitattua verenglukoositulosta tulee käyttää. Annosta ei pidä lisätä, jos näiden päivien aikana on ollut hypoglykemiaa. Annosta voidaan muuttaa kerran viikossa kunnes tavoiteltu HbA1c saavutetaan. Edellisen annoksen riittävyyttä arvioidaan ennen ateriaa mitattavien veren glukoositasojen avulla.
Kun GLP-1-reseptoriagonisti lisätään NovoMix 30 - hoitoon tyypin 2 diabetesta sairastaville potilaille, joiden HbA1c on alle 8 %, suositellaan annosta pienennettävän 20 % hypoglykemiariskin minimoimiseksi. Potilaiden, joiden HbA1c on korkeampi kuin 8 %, annoksen pienentämistä pitää harkita. Myöhemmin annosta pitää säätää yksilöllisesti.
Tyypin 1 diabeetikoiden yksilöllinen insuliinintarve on yleensä 0,5‑1,0 yksikköä/kg/vrk. NovoMix 30 voi täysin tai osittain tyydyttää tämän tarpeen.
Annostuksen tarkistus voi olla tarpeen, jos potilaan fyysinen rasitus lisääntyy, tavanomainen ruokavalio muuttuu tai hänellä on muu samanaikainen sairaus.
Erityiset potilasryhmät
Iäkkäät (≥ 65-vuotiaat)
NovoMix 30 -insuliinia voidaan käyttää iäkkäiden potilaiden hoitoon. NovoMix 30 -valmisteen käytöstä yhdessä oraalisten diabeteslääkkeiden kanssa on kuitenkin niukasti kokemusta yli 75-vuotiaista potilaista.
Verenglukoosin seurantaa on tehostettava ja aspartinsuliiniannosta on säädettävä yksilöllisesti, jos potilas on iäkäs.
Munuaisten tai maksan vajaatoiminta
Munuaisten tai maksan vajaatoiminta saattaa vähentää potilaan insuliinin tarvetta.
Verenglukoosin seurantaa on tehostettava ja aspartinsuliiniannosta on säädettävä yksilöllisesti, jos potilaalla on munuaisten tai maksan vajaatoiminta.
Pediatriset potilaat
NovoMix 30 -insuliinia voidaan käyttää 10-vuotiaiden ja sitä vanhempien lasten ja nuorten hoitoon, kun halutaan käyttää sekoiteinsuliinia. NovoMix 30 -insuliinin käytöstä 6–9-vuotiaiden lasten hoidossa on niukasti kliinistä kokemusta (ks. kohta Farmakodynamiikka).
NovoMix 30 -insuliinin käytöstä alle 6-vuotiaille lapsille ei ole tietoa.
Siirtyminen muista insuliinivalmisteista
Potilaan vaihtaessa kaksifaasisesta ihmisinsuliinista NovoMix 30 -insuliiniin, aloitetaan samalla annoksella ja hoitomallilla. Tämän jälkeen annosta säädetään potilaan yksilöllisen tarpeen mukaan (katso titrausohjeistoa edellä olevasta taulukosta).
NovoMix 30 -valmistetta käytettäessä verenglukoosin tarkka seuranta on suositeltavaa siirtymisvaiheen aikana ja heti sitä seuraavina ensimmäisinä viikkoina (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Antotapa
NovoMix 30 on kaksifaasinen insuliinianalogisuspensio aspartinsuliinia. Suspensio sisältää pikavaikutteista ja pitkävaikutteista aspartinsuliinia suhteessa 30/70.
NovoMix 30 annetaan vain ihonalaisena pistoksena.
NovoMix 30 pistetään ihon alle reiteen tai vatsanpeitteisiin. Myös pakaran tai hartialihaksen aluetta voidaan käyttää. Pistoskohtia on vaihdeltava sovitun pistosalueen sisällä lipodystrofian ja ihoamyloidoosin vaaran pienentämiseksi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset). Eri pistoskohtien vaikutusta NovoMix 30 -insuliinin imeytymiseen ei ole tutkittu. Vaikutuksen kesto vaihtelee annoksen suuruuden, pistoskohdan, verenkierron, lämpötilan ja fyysisen rasituksen mukaan.
NovoMix 30 -insuliinin vaikutus alkaa nopeammin kuin kaksifaasisen ihmisinsuliinin ja pistos tulisi yleensä antaa välittömästi ennen ateriaa. Tarpeen vaatiessa NovoMix 30 -insuliinin voi pistää heti aterian jälkeen.
Yksityiskohtaiset käyttöohjeet on esitetty pakkausselosteessa.
NovoMix 30 Penfill
Anto insuliinin antolaitteella
NovoMix 30 Penfill on suunniteltu käytettäväksi Novo Nordiskin insuliinien antolaitteiden ja NovoFine- tai NovoTwist-neulojen kanssa. NovoMix 30 Penfill sopii vain insuliinikynällä ihon alle annettaviin pistoksiin. Jos anto ruiskulla on tarpeen, silloin on käytettävä injektiopulloa.
NovoMix 30 FlexPen
Anto FlexPen-kynällä
NovoMix 30 FlexPen on esitäytetty, värikoodattu kynä, joka on suunniteltu käytettäväksi NovoFine- tai NovoTwist-neulojen kanssa. FlexPen-insuliinikynällä voi valita 1–60 yksikön annoksen yhden yksikön välein. NovoMix 30 FlexPen sopii vain ihon alle annettaviin pistoksiin. Jos anto ruiskulla on tarpeen, silloin on käytettävä injektiopulloa.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
NovoMix 30 -insuliinia ei saa antaa laskimoon, koska seurauksena voi olla vakava hypoglykemia. Lihakseen pistämistä on vältettävä. NovoMix 30 -insuliinia ei saa käyttää insuliini-infuusiopumpuissa.
Potilaan tulisi kysyä neuvoa lääkäriltä ennen matkustamista aikavyöhykkeeltä toiselle, sillä insuliinin ottamisen ja aterioiden ajankohtia voidaan joutua muuttamaan.
Hyperglykemia
Riittämätön annostus tai hoidon keskeytyminen saattavat johtaa hyperglykemiaan ja diabeettiseen ketoasidoosiin erityisesti tyypin 1 diabeteksessa. Hyperglykemian ensimmäiset oireet ilmaantuvat yleensä vähitellen tuntien tai päivien kuluessa. Oireisiin sisältyvät jano, tihentynyt virtsaaminen, pahoinvointi, oksentelu, uneliaisuus, ihon punoitus ja kuivuminen, suun kuivuminen, ruokahaluttomuus sekä asetonin haju hengityksessä. Tyypin 1 diabeteksessa hoitamaton hyperglykemia johtaa lopulta diabeettiseen ketoasidoosiin, mikä saattaa johtaa kuolemaan.
Hypoglykemia
Aterian laiminlyöminen tai suunnittelematon, voimakas fyysinen rasitus voi johtaa hypoglykemiaan.
Hypoglykemiaa saattaa esiintyä, jos insuliiniannos on liian suuri suhteessa insuliinin tarpeeseen. Jos potilaalla on hypoglykemia tai epäillään olevan hypoglykemia, NovoMix-insuliinia ei saa pistää. Potilaan verenglukoosin tasaantumisen jälkeen tulee harkita annoksen säätämistä (ks. kohdat Annostus ja antotapa, Haittavaikutukset ja Yliannostus).
Kaksifaasiseen ihmisinsuliiniin verrattuna NovoMix 30 -insuliinilla saattaa olla voimakkaampi glukoosia alentava vaikutus jopa 6 tuntia pistämisen jälkeen. Saattaa olla tarpeen kompensoida tämä vaikutus säätämällä potilaskohtaisesti insuliiniannosta ja/tai ruoan määrää.
Potilaat, joiden verenglukoositasapaino paranee huomattavasti esim. tehostetun insuliinihoidon ansiosta, saattavat kokea muutoksen tavanomaisissa hypoglykemiasta varoittavissa oireissaan. Potilaille tulee kertoa asiasta ja antaa asianmukaista ohjausta. Tavanomaiset varoittavat oireet saattavat hävitä diabetesta pitkään sairastaneilta potilailta.
Glukoosipitoisuuksien tarkempi kontrolli saattaa lisätä hypoglykemioiden mahdollisuutta ja vaatii siksi erityishuomiota annoksen lisäyksen aikana, kuten kohdassa Annostus ja antotapa on kuvattu.
Koska NovoMix 30 tulee pistää aterian välittömässä yhteydessä, sen vaikutuksen alkamisnopeus tulee ottaa huomioon, jos potilaalla on muita sairauksia tai hänen saamansa muu hoito hidastaa ruoan imeytymistä.
Muut sairaudet, varsinkin tulehdukset ja kuumetilat, yleensä lisäävät potilaan insuliinin tarvetta. Munuais- tai maksasairaus tai lisämunuaisen, aivolisäkkeen tai kilpirauhasen toimintahäiriöt voivat aiheuttaa muutoksia insuliiniannokseen.
Kun potilaat siirtyvät käyttämään erityyppistä insuliinivalmistetta, hypoglykemiasta varoittavat oireet voivat tulla vaikeammin havaittaviksi tai erilaisiksi kuin aikaisempaa insuliinia käytettäessä.
Siirtyminen muista insuliinivalmisteista
Kun potilas siirtyy käyttämään toisentyyppistä tai toisen valmistajan insuliinia, on siirtyminen toteutettava tarkassa lääkärin valvonnassa. Kun muutetaan insuliinin vahvuutta, tavaramerkkiä (valmistaja), tyyppiä, alkuperää (eläininsuliini, ihmisinsuliini tai ihmisinsuliinianalogi) ja/tai valmistusmenetelmää (yhdistelmä-DNA-tekniikalla valmistettu insuliini vs. eläinperäinen insuliini), annostuksen muutos saattaa olla tarpeen. Toisentyyppisestä insuliinista NovoMix 30 -insuliiniin siirtyvien potilaiden päivittäisiä pistoskertoja voidaan joutua lisäämään tai annos saatetaan joutua muuttamaan verrattuna potilaan tavallisesti käyttämän insuliinivalmisteen annokseen. Jos annostuksen säätö on tarpeen, säätämisen tarve voi ilmaantua ensimmäisen annoksen tai muutamien ensimmäisten viikkojen tai kuukausien aikana.
Pistoskohdan reaktiot
Kuten mitä tahansa insuliinihoitoa käytettäessä, pistoskohdan reaktioita (kipu, punoitus, nokkosihottuma, tulehdus, mustelmat, turvotus ja kutina) voi esiintyä NovoMix 30 -valmistetta käytettäessä. Pistoskohdan jatkuva vaihtaminen pistosalueella vähentää näiden reaktioiden muodostumisriskiä. Reaktiot yleensä häviävät muutaman päivän tai viikon aikana. Harvoissa tapauksissa NovoMix 30 -hoito pitää lopettaa pistoskohdan reaktioiden vuoksi.
Iho ja ihonalainen kudos
Potilaita on ohjeistettava vuorottelemaan pistoskohtaa jatkuvasti lipodystrofian ja ihoamyloidoosin kehittymisen vaaran vähentämiseksi. Jos insuliinin pistämistä jatketaan niihin kohtiin, joilla esiintyy näitä muutoksia, on olemassa mahdollinen vaara, että insuliinin imeytyminen hidastuu ja verensokerin hallinta heikentyy. Injektiokohdan äkillisestä vaihtamisesta terveelle alueelle on ilmoitettu aiheutuvan hypoglykemiaa. Verensokerin seurantaa suositellaan pistoskohdan vaihtamisen jälkeen alueelta, jolla esiintyy muutoksia, terveelle alueelle, ja diabeteslääkkeiden annoksen muuttamista voidaan harkita.
NovoMix-valmisteen yhteiskäyttö pioglitatsonin kanssa
Sydämen vajaatoimintatapauksia on raportoitu esiintyneen, kun pioglitatsonia oli käytetty yhdessä insuliinin kanssa, erityisesti potilailla, joilla on riskitekijöitä sydämen vajaatoiminnan kehittymiselle. Tämä tulee pitää mielessä, jos harkitaan pioglitatsonin ja NovoMix-valmisteen yhteiskäyttöä. Jos valmisteita käytetään yhdessä, potilailta tulee seurata sydämen vajaatoiminnan, painonnousun ja turvotuksen merkkejä ja oireita. Pioglitatsonihoito tulee lopettaa, jos sydänoireet pahenevat.
Vahingossa tapahtuvien sekaannusten/lääkitysvirheiden välttäminen
Potilaat täytyy ohjeistaa aina tarkistamaan insuliinin etiketti ennen jokaista pistosta, jotta vältetään vahingossa tapahtuvat sekaannukset NovoMix-insuliinin ja muiden insuliinivalmisteiden välillä.
Insuliinin vasta-aineet
Insuliinin annostelu saattaa aiheuttaa vasta-ainemuodostusta. Tällaisten insuliinin vasta-aineiden olemassaolo saattaa harvoissa tapauksissa edellyttää insuliiniannoksen säätämistä korjaamaan hyper- tai hypoglykemiataipumusta.
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Yhteisvaikutukset
Useiden lääkkeiden tiedetään vaikuttavan glukoosiaineenvaihduntaan.
Seuraavat aineet saattavat vähentää potilaan insuliinin tarvetta:
Suun kautta otettavat diabeteslääkkeet, GLP-1-reseptoriagonistit, monoamiinioksidaasin (MAO:n) estäjät, beetasalpaajat, angiotensiinikonvertaasin (ACE:n) estäjät, salisylaatit, anaboliset steroidit ja sulfonamidit.
Seuraavat aineet saattavat lisätä potilaan insuliinin tarvetta:
Suun kautta otettavat ehkäisyvalmisteet, tiatsidit, glukokortikoidit, kilpirauhashormonit, sympatomimeetit, kasvuhormoni ja danatsoli.
Beetasalpaajat saattavat peittää hypoglykemian oireet.
Oktreotidi ja lanreotidi voivat joko lisätä tai vähentää insuliinin tarvetta.
Alkoholi saattaa tehostaa tai vähentää insuliinin verenglukoosia alentavaa vaikutusta.
Raskaus ja imetys
Raskaus
Kliinisiä kokemuksia NovoMix 30 -valmisteen käytöstä raskauden aikana on vähän.
Sikiövaurioita ja teratogeenisuutta koskevissa eläinten lisääntymistutkimuksissa ei ole havaittu eroa aspartinsuliinin ja ihmisinsuliinin välillä.
Raskaana olevien diabeetikkonaisten tehostettua verenglukoosikontrollia ja hoidon seurantaa suositellaan raskautta suunniteltaessa ja koko raskauden ajan. Insuliinin tarve yleensä vähenee raskauden ensimmäisen kolmanneksen aikana ja lisääntyy myöhemmin toisen ja kolmannen kolmanneksen aikana. Synnytyksen jälkeen insuliinin tarve palautuu nopeasti ennen raskautta olleisiin arvoihin.
Imetys
NovoMix 30 -insuliinin käyttöön ei liity mitään rajoituksia imetysaikana. Imettävän äidin insuliinihoito ei aiheuta vaaraa lapselle. NovoMix 30 -insuliinin annosta voidaan kuitenkin joutua tarkistamaan imetysaikana.
Hedelmällisyys
Hedelmällisyyttä koskevissa eläinten lisääntymistutkimuksissa ei ole havaittu eroa aspartinsuliinin ja ihmisinsuliinin välillä.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Potilaan keskittymis- ja reaktiokyky saattavat heikentyä hypoglykemian seurauksena. Tämä voi aiheuttaa vaaratilanteita silloin, kun keskittymis- ja reaktiokykyä erityisesti tarvitaan (esim. autolla ajo tai koneiden käyttö).
Potilaita tulee neuvoa ryhtymään varotoimiin hypoglykemian välttämiseksi ajon tai koneiden käytön aikana. Tämä on erityisen tärkeää niille diabeetikoille, joiden tuntemukset hypoglykemiasta varoittavista oireista ovat vähentyneet tai puuttuvat tai joilla on usein ollut hypoglykemia. Tällaisissa tapauksissa autolla ajamisen tai koneiden käytön tarkoituksenmukaisuutta on syytä harkita tarkkaan.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
NovoMix-insuliinia käyttävillä potilailla havaitut haittavaikutukset johtuvat pääasiassa aspartinsuliinin farmakologisesta vaikutuksesta.
Hoidon aikana yleisimmin raportoitu haittavaikutus on hypoglykemia. Hypoglykemian esiintymistiheys vaihtelee riippuen potilasaineistosta, annostuksesta ja glukoositasapainosta, ks. Tähdellä (*) merkittyjen haittavaikutusten kuvaus alapuolella.
Insuliinihoidon alkuvaiheessa saattaa esiintyä silmien taittohäiriöitä, turvotusta ja pistoskohdan reaktioita (kipu, punoitus, nokkosihottuma, tulehdus, mustelmat, turvotus ja kutina pistoskohdassa). Nämä oireet ovat yleensä ohimeneviä. Verenglukoositasapainon nopeaan korjaantumiseen voi liittyä tila, jota kutsutaan nimellä akuutti kivulias neuropatia. Se on yleensä tilapäinen. Insuliinihoidon tehostamisella aikaansaatuun äkilliseen glukoositasapainon paranemiseen saattaa liittyä diabeettisen retinopatian tilapäinen vaikeutuminen, kun taas pitkäaikaisen glukoositasapainon paraneminen vähentää diabeettisen retinopatian etenemisriskiä.
Haittavaikutusluettelo
Alla olevassa luettelossa esitetyt haittavaikutukset perustuvat kliinisistä tutkimuksista saatuihin tietoihin ja ne on luokiteltu MedDRA:n esiintymistiheyksien ja elinjärjestelmäluettelon mukaan. Esiintymistiheydet on määritelty seuraavasti: Hyvin yleinen (≥ 1/10); yleinen (≥ 1/100, < 1/10); melko harvinainen (≥ 1/1 000, < 1/100); harvinainen (≥ 1/10 000, < 1/1 000); hyvin harvinainen (< 1/10 000) ja tuntematon (koska saatavissa oleva tieto ei riitä arviointiin).
Immuunijärjestelmä | Melko harvinainen – Nokkosihottuma, ihottuma, iho-oireiden puhkeaminen |
Hyvin harvinainen – Anafylaktiset reaktiot* | |
Aineenvaihdunta ja ravitsemus | Hyvin yleinen – Hypoglykemia* |
Hermosto | Harvinainen – Perifeerinen neuropatia (kivulias neuropatia) |
Silmät | Melko harvinainen – Taittohäiriöt |
Melko harvinainen – Diabeettinen retinopatia | |
Iho ja ihonalainen kudos | Melko harvinainen – Lipodystrofia* |
Tuntematon – Ihoamyloidoosi*† | |
Yleisoireet ja antopaikassa todettavat haitat | Melko harvinainen – Turvotus |
Melko harvinainen – Pistospaikan reaktiot |
* ks. Tiettyjen haittavaikutusten kuvaus
† Myyntiintulon jälkeen ilmennyt lääkkeen aiheuttama haittavaikutus.
Tiettyjen haittavaikutusten kuvaus
Anafylaktiset reaktiot:
Yleistynyt yliherkkyysreaktio (sisältää laajalle levinnyttä ihottumaa, kutinaa, hikoilua, ruoansulatushäiriöitä, angioneuroottista turvotusta, hengitysvaikeuksia, sydämentykytystä ja verenpaineen alenemista) on hyvin harvinainen, mutta saattaa olla hengenvaarallinen.
Hypoglykemia:
Yleisimmin raportoitu haittavaikutus on hypoglykemia. Sitä saattaa esiintyä, jos insuliiniannos on liian suuri suhteessa insuliinin tarpeeseen. Vakava hypoglykemia saattaa johtaa tajuttomuuteen ja/tai aiheuttaa kouristuksia, tilapäisen tai pysyvän aivojen toimintahäiriön tai jopa kuoleman. Hypoglykemian oireet ilmaantuvat yleensä yllättäen. Oireisiin saattaa sisältyä kylmänhikisyys, kalpea ja viileä iho, uupumus, hermostuneisuus tai vapina, ahdistus, epätavallinen väsymys tai heikkous, sekavuus, keskittymisvaikeudet, uneliaisuus, kova nälkä, näköhäiriöt, päänsärky, pahoinvointi ja sydämentykytys.
Kliinisissä tutkimuksissa hypoglykemian esiintymistiheys on vaihdellut riippuen potilasaineistosta, annostuksesta ja glukoositasapainosta. Kliinisten tutkimusten aikana hypoglykemioiden kokonaismäärässä ei ollut eroa potilaiden välillä, hoidettiinpa heitä aspartinsuliinilla tai ihmisinsuliinilla.
Iho ja ihonalainen kudos:
Lipodystrofiaa (mukaan lukien lipohypertrofiaa ja lipoatrofiaa) ja ihoamyloidoosia voi ilmaantua pistoskohtaan. Ne viivästyttävät insuliinin paikallista imeytymistä. Pistoskohdan jatkuva vuorottelu sovitulla pistosalueella saattaa vähentää tai ehkäistä näitä muutoksia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Pediatriset potilaat
Kauppaantuonnin jälkeisessä käytössä ja kliinisissä tutkimuksissa lapsilla havaittujen haittavaikutusten määrä, tyyppi ja vaikeusaste ei ole eronnut väestössä yleensä havaituista haittavaikutuksista.
Muut erityiset potilasryhmät
Kauppaantuonnin jälkeisessä käytössä ja kliinisissä tutkimuksissa iäkkäillä potilailla ja munuaisten tai maksan vajaatoimintaa sairastavilla havaittujen haittavaikutusten määrä, tyyppi ja vaikeusaste ei ole eronnut väestössä yleensä havaituista haittavaikutuksista.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksistaseuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Insuliinin yliannostukselle ei ole olemassa erityistä määritelmää. Hypoglykemia saattaa kuitenkin kehittyä vaiheittain, jos potilas saa liian suuria annoksia verrattuna insuliinin tarpeeseen:
- Lievä hypoglykemia voidaan hoitaa antamalla suun kautta rypälesokeria tai sokeria sisältäviä tuotteita. Siksi on suositeltavaa, että diabeetikko pitää aina mukanaan sokeripitoisia tuotteita.
- Vakava hypoglykemia, jolloin potilas on tajuton, voidaan hoitaa antamalla glukagonia (0,5−1,0 mg) lihakseen tai ihon alle tai antamalla glukoosia laskimoon. Lihaksensisäisen ja ihonalaisen glukagoni-injektion voi antaa riittävän koulutuksen saanut henkilö. Laskimonsisäisen glukoosin antaa terveydenhuollon ammattilainen. Glukoosia on annettava laskimoon, jos glukagonin antoon ei tule vastetta 10−15 minuutin kuluessa. On suositeltavaa, että tajunnan palattua potilaalle annetaan suun kautta hiilihydraatteja hypoglykemian uusiutumisen estämiseksi.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Diabeteslääkkeet. Insuliinit ja insuliinijohdokset, insuliinisekoitteet. ATC-koodi: A10AD05.
NovoMix 30 on kaksifaasinen suspensio, josta 30 % on liukenevaa aspartinsuliinia (lyhyt(pika)vaikutteinen ihmisinsuliinianalogi) ja 70 % protamiinilla kiteytettyä aspartinsuliinia (pitkävaikutteinen ihmisinsuliinianalogi).
Vaikutusmekanismi ja farmakodynaamiset vaikutukset
Aspartinsuliinin verenglukoosipitoisuutta alentava vaikutus perustuu glukoosin soluunoton helpottumiseen, kun insuliini sitoutuu lihas- ja rasvasolujen insuliinireseptoreihin, ja samanaikaiseen maksan glukoosintuotannon estymiseen.
NovoMix 30 on kaksifaasinen insuliini, josta 30 % on lyhytvaikutteista (liukenevaa) aspartinsuliinia. Sen vaikutus alkaa nopeasti ja siksi sitä voi pistää lähempänä aterian ajankohtaa (0−10 minuuttia ateriasta) kuin lyhytvaikutteista (liukenevaa) ihmisinsuliinia. Kiteinen faasi (70 %) koostuu protamiinilla kiteytetystä aspartinsuliinista, jonka vaikutusprofiili muistuttaa NPH-ihmisinsuliinin vaikutusprofiilia.
Ihon alle annetun NovoMix 30 -injektion vaikutus alkaa 10−20 minuutin kuluessa pistämisestä. Vaikutus on voimakkaimmillaan 1−4 tunnin välillä injektion antamisesta. Vaikutus kestää 24 tuntia (Kuva 1).
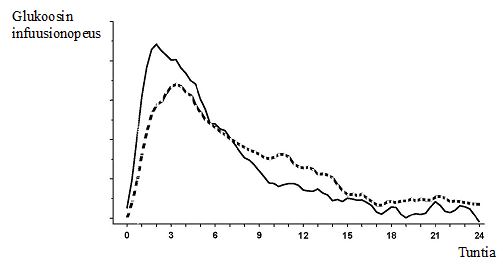
Kuva 1: NovoMix 30 -insuliinin (___) ja kaksifaasisen ihmisinsuliini 30:n (---) vaikutusprofiilit terveissä koehenkilöissä.
Kliininen teho ja turvallisuus
Tyypin 1 ja tyypin 2 diabeetikoilla tehdyssä kolme kuukautta kestäneessä tutkimuksessa glykoituneen hemoglobiinin arvot pysyivät tasapainossa yhtä hyvin käytettäessä NovoMix 30 -insuliinia kuin käytettäessä kaksifaasista ihmisinsuliini 30:a. Aspartinsuliini on moolitasolla yhtä tehokas kuin ihmisinsuliini. Kaksifaasiseen ihmisinsuliini 30:een verrattuna NovoMix 30 -insuliinin anto ennen aamiaista ja illallista johti alhaisempaan aterianjälkeiseen veren glukoosipitoisuuteen kummankin aterian (aamiainen ja illallinen) jälkeen.
Tyypin 1 ja 2 diabeetikoille suoritetun yhdeksän tutkimuksen meta-analyysin mukaan paastoverenglukoosi oli korkeampi potilailla, joita hoidettiin NovoMix 30 -insuliinilla kuin potilailla, joita hoidettiin kaksifaasisella ihmisinsuliini 30:lla.
Yhdessä tutkimuksessa 341 tyypin 2 diabeetikkoa oli satunnaistettu käyttämään joko NovoMix 30 -insuliinia yksinään tai yhdessä metformiinin kanssa, tai metformiinia yhdessä sulfonyyliurean kanssa. Ensisijaisessa tehokkuusmuuttujassa (HbA1c-arvo 16 viikon hoidon jälkeen) eivät potilaat, jotka käyttivät NovoMix 30 -insuliinia yhdessä metformiinin kanssa, poikenneet potilaista, jotka käyttivät metformiinia yhdessä sulfonyyliurean kanssa. Tässä tutkimuksessa 57 %:lla potilaista HbA1c:n lähtötaso oli yli 9 %. NovoMix 30 -insuliini yhdessä metformiinin kanssa alensi merkitsevästi enemmän näiden potilaiden HbA1c-arvoa kuin metformiini yhdessä sulfonyyliurean kanssa.
Toisessa tutkimuksessa tyypin 2 diabeetikot, jotka eivät olleet täysin tasapainossa pelkästään oraalisilla diabeteslääkkeillä, satunnaistettiin ryhmään, jossa NovoMix 30 -insuliinia annettiin kahdesti vuorokaudessa (117 potilasta) ja ryhmään, jossa annettiin glargininsuliinia kerran vuorokaudessa (116 potilasta). NovoMix 30 -hoito toteutettiin kohdassa Annostus ja antotapa esitetyn annossuosituksen mukaisesti. 28 viikon hoidon jälkeen HbA1c laski keskimäärin 2,8 % NovoMix 30 -insuliinilla (lähtötason keskiarvo = 9,7 %). NovoMix 30 -insuliinilla 66 % potilaista saavutti alle 7 % HbA1c-tason ja 42 % tason 6,5 %. FPG:n keskiarvo pieneni noin 7 mmol/l (lähtötason 14,0 mmol/l:sta 7,1 mmol/l:iin).
Meta-analyysin mukaan tyypin 2 diabeetikoiden yöllisten hypoglykemioiden ja vakavien hypoglykemioiden kokonaisriski oli pienentynyt käytettäessä NovoMix 30 -insuliinia verrattuna kaksifaasiseen ihmisinsuliini 30:een. Päiväaikaisten hypoglykemioiden kokonaisriski oli suurempi, jos potilaita hoidettiin NovoMix 30 -insuliinilla.
Pediatriset potilaat
16 viikkoa kestäneessä kliinisessä tutkimuksessa verrattiin aterianjälkeistä veren glukoositasapainoa kun annettiin aterian yhteydessä NovoMix 30 -insuliinia tai kaksifaasista ihmisinsuliini 30:a ja NPH-insuliinia nukkumaan mennessä. Tutkimuksessa oli 167 iältään 10−18-vuotiasta potilasta. Keskimääräinen HbA1c pysyi tutkimuksen ajan muuttumattomana molemmissa hoitoryhmissä, eikä hypoglykemioiden määrissä ollut eroja NovoMix 30- ja kaksifaasisen ihmisinsuliini 30 -ryhmien välillä.
Pienemmässä (54 potilasta) ja iältään nuoremmassa (6−12-vuotiaita) tutkimusryhmässä, jota tutkittiin kaksoissokkoutetusti ja vaihtovuoroisesti 12 viikkoa kummallakin hoitotavalla, hypoglykeemisten episodien määrä ja aterianjälkeisen verenglukoosin nousu olivat merkitsevästi vähäisempiä NovoMix 30 -hoidolla verrattuna hoitoon kaksifaasisella ihmisinsuliini 30:lla. Tutkimuksen päättyessä HbA1C oli merkitsevästi matalampi ryhmällä, jota hoidettiin kaksifaasisella ihmisinsuliini 30:lla kuin ryhmällä, jolle annettiin NovoMix 30 -insuliinia.
Farmakokinetiikka
Imeytyminen, jakautuminen ja eliminaatio
Aspartinsuliinissa proliiniaminohapon korvaaminen asparagiinihapolla paikassa B28 vaikuttaa siten, että heksameerien muodostustaipumus on pienempi kuin lyhytvaikutteisessa (liukenevassa) ihmisinsuliinissa. Liukoisen faasin aspartinsuliini muodostaa 30 % NovoMix 30 -insuliinin kokonaismäärästä. Tämä osa imeytyy ihonalaisesta kerroksesta nopeammin kuin kaksifaasisen ihmisinsuliinin sisältämä liukoinen insuliinikomponentti. Loput 70 % on protamiinilla kiteytettyä aspartinsuliinia, jonka pitkittynyttä imeytymistä kuvaava vaikutusprofiili on samanlainen kuin NPH-ihmisinsuliinilla.
Seerumissa olevan insuliinin huippupitoisuus on keskimäärin 50 % suurempi NovoMix 30 -insuliinilla kuin kaksifaasisella ihmisinsuliini 30:lla. Huippupitoisuus saavutetaan keskimäärin puolet lyhyemmässä ajassa kuin kaksifaasisella ihmisinsuliini 30:lla. Terveiden koehenkilöiden seerumin keskimääräinen huippupitoisuus 140 ± 32 pmol/l saavutettiin noin 60 minuutin kuluttua siitä, kun heille annettiin ihonalaisesti 0,20 yksikköä insuliinia painokiloa kohden. NovoMix 30 -insuliinin keskimääräinen puoliintumisaika (t½), joka heijastaa protamiiniin sitoutuneen fraktion imeytymisnopeutta, oli noin 8−9 tuntia. Insuliinipitoisuus palautui perusinsuliinitasolle 15-18 tunnin kuluttua ihonalaisesta pistoksesta. Tyypin 2 diabeetikoille huippupitoisuus saavutettiin noin 95 minuutin kuluttua pistoksesta ja selvästi nollan yläpuolella olevia pitoisuuksia todettiin vielä 14 tunnin kuluttua pistoksesta.
Erityiset potilasryhmät
NovoMix 30 -insuliinin farmakokinetiikkaa iäkkäiden potilaiden elimistössä ja munuaisten tai maksan vajaatoimintaa sairastavien potilaiden elimistössä ei ole tutkittu.
Pediatriset potilaat
NovoMix 30 -insuliinin farmakokinetiikkaa lapsissa ja nuorissa ei ole tutkittu. Liukoisen aspartinsuliinin farmakokineettisiä ja farmakodynaamisia ominaisuuksia lasten (6−12 vuotta) ja nuorten (13−17 vuotta), joilla on tyypin 1 diabetes, elimistössä on kuitenkin tutkittu. Aspartinsuliini imeytyi nopeasti molemmissa ikäryhmissä siten, että tmax oli samankaltainen kuin aikuisista mitattu. Cmax kuitenkin vaihteli ikäryhmien välillä, mikä korostaa aspartinsuliiniannoksen yksilöllisen säätämisen tärkeyttä.
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta, genotoksisuutta sekä reproduktiotoksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
In vitro -kokeissa, joissa testattiin myös sitoutumista insuliini- ja IGF-1-reseptoreihin sekä vaikutusta solun kasvuun, aspartinsuliini käyttäytyi lähes samoin kuin ihmisinsuliini. Tulokset osoittavat myös, että aspartinsuliini irtosi insuliinireseptoreista kuten ihmisinsuliini.
Farmaseuttiset tiedot
Apuaineet
Glyseroli
Fenoli
Metakresoli
Sinkkikloridi
Dinatriumfosfaattidihydraatti
Natriumkloridi
Protamiinisulfaatti
Kloorivetyhappo (pH:n säätämistä varten)
Natriumhydroksidi (pH:n säätämistä varten)
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
Ennen avaamista: 2 vuotta.
Käytön aikana tai mukana kuljetettava varalääke: Valmistetta voidaan säilyttää korkeintaan 4 viikkoa.
Säilytys
Ennen avaamista: Säilytä jääkaapissa (2°C - 8°C), ei kuitenkaan lähellä pakastelokeroa tai takaseinän kylmälevyä. Ei saa jäätyä.
NovoMix 30 Penfill
Käytön aikana tai mukana kuljetettavat varasylinteriampullit: Säilytä alle 30°C. Älä säilytä kylmässä. Ei saa jäätyä.
Pidä sylinteriampulli ulkopakkauksessa. Herkkä valolle.
NovoMix 30 FlexPen
Käytön aikana tai mukana kuljetettavat varakynät: Säilytä alle 30°C. Älä säilytä kylmässä. Ei saa jäätyä.
Pidä kynän suojus paikallaan. Herkkä valolle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
NOVOMIX 30 FLEXPEN injektioneste, suspensio, esitäytetty kynä
100 U/ml (L:ei) 5 x 3 ml (FlexPen) (44,32 €)
NOVOMIX 30 PENFILL injektioneste, suspensio, sylinteriampulli
100 U/ml (L:ei) 5 x 3 ml (Penfill) (38,91 €)
PF-selosteen tieto
NovoMix 30 Penfill
3 ml injektionestettä sylinteriampullissa (tyypin 1 lasia), joka sisältää bromobutyylistä valmistetun kumimännän ja bromobutyylistä/polyisopreenista valmistetun kumisulkimen. Sylinteriampullissa on lasikuula, jonka avulla suspensio saadaan sekoitettua tasaiseksi.
Pakkauskoot: 5 ja 10 sylinteriampullia. Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
NovoMix 30 FlexPen
Kertakäyttöisessä, polypropeenista valmistetussa esitäytetyssä moniannoskynässä on 3 ml injektionestettä sisältävä sylinteriampulli (tyypin 1 lasia), joka sisältää bromobutyylistä valmistetun kumimännän ja bromobutyylistä/polyisopreenista valmistetun kumisulkimen. Sylinteriampullissa on lasikuula, jonka avulla suspensio saadaan sekoitettua tasaiseksi.
Pakkauskoot: 1 (neulojen kanssa tai ilman), 5 (ilman neuloja) ja 10 (ilman neuloja) esitäytettyä kynää. Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Suspensio on sameaa, vaaleaa ja vesimäistä.
Käyttö- ja käsittelyohjeet
Jääkaapista ottamisen jälkeen on suositeltavaa antaa NovoMix 30 Penfill- tai NovoMix 30 FlexPen -valmisteen lämmetä huoneenlämpöiseksi, ennen kuin se sekoitetaan ensimmäisestä käyttökerrasta annettujen ohjeiden mukaisesti.
Älä käytä tätä lääkevalmistetta,jos neste ei ole sekoittamisen jälkeen tasaisen vaaleaa, sameaa ja vesimäistä.
Potilaalle tulee painottaa, että NovoMix 30 -insuliinisuspension sekoittaminen tasaiseksi välittömästi ennen käyttöä on välttämätöntä.
Jäätynyttä NovoMix 30 -insuliinia ei saa käyttää.
Potilasta tulee neuvoa hävittämään neula jokaisen pistoksen jälkeen.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Neulat, sylinteriampullit ja esitäytetyt kynät on tarkoitettu vain henkilökohtaiseen käyttöön.
Sylinteriampullia ei saa täyttää.
Korvattavuus
NOVOMIX 30 FLEXPEN injektioneste, suspensio, esitäytetty kynä
100 U/ml 5 x 3 ml
NOVOMIX 30 PENFILL injektioneste, suspensio, sylinteriampulli
100 U/ml 5 x 3 ml
- Ylempi erityiskorvaus (100 %). Diabetes, insuliinihoito (103).
- Peruskorvaus (40 %).
ATC-koodi
A10AD05
Valmisteyhteenvedon muuttamispäivämäärä
22.05.2023
Yhteystiedot
 NOVO NORDISK FARMA OY
NOVO NORDISK FARMA OY Linnoitustie 6
02600 Espoo
020 762 5300
www.novonordisk.fi
