NIMOTOP infuusioneste, liuos 0,2 mg/ml, tabletti, kalvopäällysteinen 30 mg
Vaikuttavat aineet ja niiden määrät
Nimotop 0,2 mg/ml infuusioneste: 50 ml sisältää 10 mg nimodipiiniä.
Nimotop® 30 mg tabletti: Yksi kalvopäällystetty tabletti sisältää 30 mg nimodipiiniä.
Täydellinen apuaineluettelo, katso kohta Apuaineet.
Lääkemuoto
Infuusioneste, liuos. Tabletti, kalvopäällysteinen.
Kliiniset tiedot
Käyttöaiheet
Subaraknoidaaliseen verenvuotoon liittyvän vasospasmin ja sen aiheuttaman iskeemisen neurologisen puutosoireiston ehkäisy ja hoito, kun vuodon aiheuttajana on aneurysman puhkeaminen.
Käyttörajoitus: Nimotop 0,2 mg/ml infuusioneste vain sairaalakäyttöön.
Tableteilla ei ole käyttörajoitusta.
Ehto
NIMOTOP infuusioneste, liuos
0,2 mg/ml 5 x 50 ml
- Vain sairaalakäyttöön.
Annostus ja antotapa
Annostus:
Nimotop 0,2 mg/ml infuusioneste:
Laskimonsisäinen kestoinfuusio aneurysmaattisessa subaraknoidaalivuodossa: Hoidon alussa nimodipiiniä annetaan 1 mg/tunti (5 ml Nimotop-infuusionestettä/tunti) noin kahden tunnin ajan (n. 15 mikrog/painokilo/h). Jos annos on hyvin siedetty ja erityisesti jos voimakasta verenpaineen laskua ei ilmene, nimodipiiniannos nostetaan kahden tunnin kuluttua 2 mg:aan/tunti (10 ml Nimotop-infuusionestettä/tunti, n. 30 mikrog/painokilo/h). Potilaille, jotka painavat selvästi alle 70 kg tai joiden verenpainetaso on labiili, hoito on aloittava annoksella 0,5 mg/tunti nimodipiinia (2,5 ml Nimotop-infuusionestettä/tunti, n. 7,5 mikrog/painokilo/h).
Aneurysmaattisessa subaraknoidaalivuodossa 5-14 vrk:n Nimotop-infuusionestehoidon jälkeen suositellaan siirtymään suun kautta annettavaan hoitoon. Vuorokausiannostus aikuisille on 6 x 2 tablettia (6 x 60 mg nimodipiinia) eli 2 tablettia n. 4 tunnin välein.
Intrasisternaali annostus: 1 ml Nimotop-infuusionestettä laimennettuna 19 ml:lla Ringerin liuosta (yht. 20 ml) ja lämmitettynä verenlämpöiseksi voidaan antaa intrasisternaalisesti leikkauksen aikana. Liuoslaimennos on käytettävä välittömästi valmistuksen jälkeen.
Nimotop 30 mg tabletti:
Aneurysmaattisen subaraknoidaalivuodon hoidossa 5 - 14 vrk:n Nimotop-infuusionestehoidon jälkeen (ks. Nimotop 0,2 mg/ml infuusioneste) suositellaan siirtymistä suun kautta annettavaan hoitoon. Nimotop 30 mg tablettien vuorokausiannostus aikuisille on 6 x 2 tablettia (6 x 60 mg nimodipiinia) eli 2 tablettia n. 4 tunnin välein.
Nimotop-valmisteen annosta on pienenettävä tarpeen mukaan potilailta, joilla ilmenee haittavaikutuksia. Tarvittaessa on harkittava hoidon lopettamista kokonaan.
Nimotop 0,2 mg/ml infuusioneste ja 30 mg tabletti:
Nimotopin annosta pienennettävä tarpeen mukaan potilailta, joilla ilmenee haittavaikutuksia. Tarvittaessa on harkittava hoidon lopettamista kokonaan.
Potilaat, joilla on maksan vajaatoiminta:
Nimotop 0,2 mg/ml infuusioneste:Vaikea maksan vajaatoiminta, etenkin maksakirroosi, saattaa johtaa nimodipiinin biologisen hyötyosuuden kasvuun, seurauksena pienentyneestä puhdistumasta. Tällaisissa tapauksissa annosta on tarvittaessa pienennettävä verenpainearvoja seuraten. Tarvittaessa on harkittava hoidon lopettamista kokonaan.
Nimotop 30 mg tabletti: Vaikea maksan vajaatoiminta, etenkin maksakirroosi, saattaa johtaa nimodipiinin biologisen hyötyosuuden kasvuun seurauksena vähentyneestä ensikierron metaboliasta ja pienentyneestä puhdistumasta. Teho ja haittavaikutukset, esim. verenpaineen lasku, voivat tällöin olla voimakkaampia. Tällaisissa tapauksissa annosta on tarvittaessa pienennettävä verenpainearvoja seuraten. Tarvittaessa on harkittava hoidon lopettamista kokonaan.
Kun valmistetta annetaan samanaikaisesti CYP 3A4 inhibiittorien tai CYP 3A4 indusoijien kanssa, annosta tulee muuttaa tarpeen mukaan (ks. kohta Yhteisvaikutukset).
Antotapa:
Nimotop-infuusioneste annetaan keskuslaskimokatetrin kautta infuusiopumppua käyttäen jatkuvana infuusiona. Nimotop-infuusioneste on annettava kolmitiehanan kautta yhdessä 5 % glukoosiliuoksen, fysiologisen (0,9 %) NaCl-liuoksen, Ringerin laktaattiliuoksen, Ringerin magnesiumlaktaattiliuoksen, Dextran 40 -liuoksen tai 6 % hydroksietyylitärkkelysliuoksen kanssa suhteessa noin 1:4 (Nimotop: laimennusneste). Myös 10 % mannitoliliuosta, 4 % humaanialbumiiniliuosta tai verta voidaan käyttää laimennusnesteenä. Laimennusnesteen infuusionopeudeksi suositellaan noin 40 ml/h.
Nimotop-infuusionestettä ei saa lisätä suoraan infuusiopulloon tai -pussiin tai sekoittaa muihin lääkkeisiin etukäteen. Nimotop-valmisteen käyttöä on jatkettava narkoosin, leikkauksen tai angiografian aikana. Nimodipiiniliuoksen polyetyleeniletkun yhdistämisessä laimennusnesteletkuun ja keskuslaskimokatetriin on käytettävä kolmitiehanaa.
Aneurysmaattisen subaraknoidaalivuodon hoidossa 5 - 14 vuorokauden Nimotop-infuusionestehoidon jälkeen hoitoa suositellaan jatkettavan Nimotop -tableteilla noin 7 vuorokauden ajan. Vuorokausiannostus aikuisille on 6 x 2 tablettia (6 x 60 mg nimodipiinia) eli 2 tablettia n. 4 tunnin välein.
Tabletit niellään kokonaisina nesteen kera ruokailuajoista riippumatta. Annosvälin tulee olla vähintään 4 tuntia. Greippimehua tulee välttää (ks. kohta Yhteisvaikutukset).
Hoidon kesto:
Profylaktinen käyttö
Aneurysmaattinen subaraknoidaalivuoto:
Hoito Nimotop-infuusionesteellä suositellaan aloittamaan viimeistään neljän vuorokauden sisällä subaraknoidaalivuodosta ja jatkamaan, kunnes suurin vaara vasospasmien kehittymiseen on ohitettu, eli noin 10-14 vrk:n ajan.
Nimotop-infuusionestehoidon jatkoksi suositellaan noin 7 päivän ajaksi hoitoa suun kautta aikuisille annoksella 6 x 60 mg nimodipiinia vuorokaudessa eli 2 tablettia n. 4 tunnin välein.
Terapeuttinen käyttö
Aneurysmaattisen subaraknoidaalivuodon seurauksena kehittyneen verisuonispasmin ja sen aiheuttamien iskeemisten neurologisten häiriöiden hoito Nimotop-infuusionesteellä suositellaan aloittamaan mahdollisimman aikaisessa vaiheessa ja jatkamaan vähintään 5 vrk:n ja enintään 14 vrk:n ajan.
Nimotop-infuusionestehoidon jatkoksi suositellaan noin 7 päivän ajaksi hoitoa suun kautta aikuisille annoksella 6 x 60 mg nimodipiinia vuorokaudessa eli 2 tablettia n. 4 tunnin välein (ks. Nimotop-tablettien valmisteyhteenveto).
Jos terapeuttisen ja profylaktisen käytön aikana vuotokohtaa joudutaan kirurgisesti operoimaan, Nimotop-infuusionesteen laskimonsisäistä käyttöä on jatkettava vähintään 5 vrk leikkauksen jälkeen.
Pediatriset potilaat: Nimotop-valmisteen turvallisuutta ja tehoa alle 18-vuotiaille potilaille ei ole vielä varmistettu. Tietoja ei ole saatavilla. Sen vuoksi Nimotop-valmistetta ei suositella pediatristen potilaiden hoidossa.
Vasta-aiheet
Nimotop-valmistetta ei saa käyttää, jos potilas on yliherkkä nimodipiinille tai valmisteen jollekin apuaineelle.
Nimotop tabletit: Nimodipiinia ei pidä käyttää samanaikaisesti rifampisiinin kanssa, koska nimodipiinin teho voi merkittävästi heikentyä samanaikaisessa käytössä (ks. kohta Yhteisvaikutukset) Oraalista nimodipiinia ei pidä käyttää samanaikaisesti epilepsialääkkeiden fenobarbitaalin, fenytoiinin tai karbamatsepiinin kanssa, koska nimodipiinin teho voi merkittävästi heikentyä samanaikaisessa käytössä annettuna (ks. kohta Yhteisvaikutukset).
Varoitukset ja käyttöön liittyvät varotoimet
Vaikka nimodipiinihoidon hoidon ei ole osoitettu aiheuttavan kallonsisäisen paineen kohoamista, on noudatettava varovaisuutta hoidettaessa potilaita, joilla on kohonnut kallonsisäinen paine tai selvästi todettava yleinen aivoedeema.
Varovaisuutta on noudatettava hoidettaessa potilaita, joilla on hypotensio (systolinen verenpaine alle 100 mm Hg).
Jos potilaalla on epästabiili angina pectoris tai potilaalla on ollut akuutti sydäninfarkti edeltävien 4 viikon aikana, lääkärin on verrattava hoidon mahdollisia riskejä (esim. sepelvaltimoverenkierron heikkeneminen ja sydänlihasiskemia) sen hyötyihin (esim. aivoverenkierron paraneminen).
Nimotop 0,2 mg/ml infuusioneste:
Nimotop-infuusioneste sisältää 23,7 tilavuusprosenttia etanolia. Yksi 10 ml:n annos tätä lääkevalmistetta annettuna yhden tunnin ajan 70 kg painavalle aikuiselle aiheuttaa etanolialtistuksen 28 mg/kg/tunti, joka saattaa nostaa veren alkoholipitoisuuden noin tasolle 4 mg/100 ml. Vertailun vuoksi, kun aikuinen juo lasillisen viiniä tai 500 ml olutta, veren alkoholipitoisuus on todennäköisesti noin 50 mg/100 ml. Samanaikainen anto esimerkiksi propyleeniglykolia tai etanolia sisältävien lääkevalmisteiden kanssa saattaa johtaa etanolin kumuloitumiseen ja aiheuttaa haittavaikutuksia, erityisesti pienille lapsille joiden metaboliakyky on alhainen tai kehittymätön.
Koska tätä lääkevalmistetta annetaan hitaana jatkuvana infuusiona, alkoholin vaikutukset voivat vähentyä.
Tämä lääkevalmiste sisältää 23 mg natriumia per 50 ml pullo, joka vastaa 1,15 % WHO:n suosittelemasta natriumin 2 g:n päivittäisestä enimmäissaannista aikuiselle.
Nimotop-infuusionesteen samanaikainen käyttö mahdollisesti nefrotoksisten lääkeaineiden, kuten aminoglykosidien, kefalosporiinien, tai furosemidin kanssa voi johtaa munuaisten toiminnan heikkenemiseen. Samoin lievä munuaisten vajaatoiminta voi edelleen pahentua nimodipiinin käytön yhteydessä. Munuaisten toiminnan huolellinen seuranta on tarpeen näissä tapauksissa ja hoidon keskeytystä on harkittava tarpeen mukaan (ks. kohta Yhteisvaikutukset).
Nimotop 30 mg tabletit:
Nimodipiini metaboloituu sytokromi P450 3A4 - entsyymin katalysoimana. Lääkkeet, joiden tiedetään joko indusoivan tai inhiboivan tätä entsyymiä, voivat sen vuoksi vaikuttaa nimodipiinin ensikierron metaboliaan ja nimodipiinin puhdistumaan (ks. kohta Yhteisvaikutukset sekä Annostus ja antotapa, maksan vajaatoiminta).
Lääkkeet, joiden tiedetään inhiboivan sytokromi P450 3A4 -entsyymiä ja voivan siksi johtaa suurempiin nimodipiinin pitoisuuksiin plasmassa, ovat esimerkiksi:
- makrolidiantibiootit (esim. erytromysiini, klaritromysiini ja telitromysiini)
- HIV-proteaasin estäjät (esim. ritonaviiri)
- eräät atsolisienilääkkeet (esim. ketokonatsoli ja itrakonatsoli)
- depressiolääkkeet nefatsodoni ja fluoksetiini
- kinupristiini/dalfopristiini, antibioottivalmiste
- simetidiini
- valproiinihappo.
Käytettäessä nimodipiinia samanaikaisesti näiden lääkeaineiden kanssa, verenpainetta on seurattava ja tarvittaessa harkittava nimodipiiniannoksen annostuksen pienentämistä.
Yhteisvaikutukset
Lääkeaineet, joilla on vaikutuksia nimodipiiniin
Nimotop 30 mg tabletit:
Nimodipiini metaboloituu sytokromi P450 3A4 -entsyymin katalysoimana ja tämä entsyymi toimii ohutsuolen limakalvossa sekä maksassa. Lääkkeet, joiden teidetään joko indusoivan tai inhiboivan tätä entsyymiä, voivat siksi vaikuttaa nimodipiinin ensikierron metaboliaaan ja nimodipiinin puhdistumaan (ks. kohta Annostus ja antotapa; Potillat, joilla on maksan vajaatoiminta).
Yhteisvaikutusten suuruus ja kesto on humioitava, kun nimodipiinia annetaan yhdessä seuraavien lääkeaineiden kanssa.
Rifampisiini
Muista kalsiumestäjistä saatujen kokemusten perusteella voidaan odottaa, että rifampisiini nopeuttaa nimodipiinin metaboliaa entsyymi-induktion vuoksi. Sen vuoksi nimodipiinin teho voi merkittävästi heikentyä samanaikaisessa käytössä rifampisiinin kanssa. Nimodipiinia ei siksi pidä käyttää samanaikaisesti rifampisiinin kanssa (ks. kohta Vasta-aiheet).
Sytokromi P450 3A4 -entsyymiä indusoivat epilepsialääkkeet, kuten fenobarbitaali, fenytoiini tai karbamatsepiini
Edeltävästi pitkään käytettynä epilepsialääkkeet fenobarbitaali, fenytoiini ja karbamatsepiini vähentävät selvästi suun kautta annetun nimodipiinin biologista hyötyosuutta. Nimodipiinia ei siksi pidä käyttää samanaikaisesti näiden epilepsialääkkeiden kanssa (ks. kohta Vasta-aiheet).
Jos nimodipiinia käytetään yhdessä seuraavien sytokromi P450 3A4 -entsyymin inhibiittorien kanssa, verenpainetta on tarkkailtava ja tarvittaessa on harkittava nimodipiiniannoksen pienentämistä (ks. kohta Annostus ja antotapa).
Makrolidiantibiootit (esim. erytromysiini, klaritromysiini ja telitromysiini)
Nimodipiinin ja makrolidiantibioottien yhteisvaikutuksia ei ole tutkittu. Eräiden makrolidiantibioottien tiedetään inhiboivan sytokromi P450 3A4 -entsyymiä ja yhteisvaikutuksen mahdolllisuutta ei voida poissulkea. Makrolidiantibiootteja on siksi käytettävä varoen yhdessä nimodipiinin kanssa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Makrolidiantibiooteista asitromysiini ei inhiboi CYP3A4-entsyymiä.
HIV-proteaasin estäjät (esim. ritonaviiri)
Nimodipiinin ja HIV-proteaasin estäjien mahdollisia yhteisvaikutuksia ei ole tutkittu. Tähän ryhmään kuuluvien lääkkeiden on raportoitu olevan voimakkaita sytokromi P450 3A4 -entsyymin inhibiittoreita. Sen vuoksi huomattavaa ja kliinisesti merkittävää nimodipiinin pitoisuuden suurenemista plasmassa ei voida poissulkea, jos nimodipiinia annetaan samanaikaisesti näiden proteaasin estäjien kanssa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Atsolijohdokset (esim. ketokonatsoli ja itrakonatsoli)
Nimodipiinin ja ketokonatsolin mahdollisia yhteisvaikutuksia ei ole tutkittu. Atsolijohdosten tiedetään inhiboivan sytokromi P450 3A4 -entsyymiä ja useita yhteisvaikutuksia on raportoitu muiden dihydropyridiinityyppisten kalsiumkanavan salpaajien kanssa. Sen vuoksi ei voida poissulkea nimodipiinin biologisen hyötyosuuden huomattavaa kasvua, mikä johtuu ensikierron metabolian vähenemisestä, jos suun kautta otettavaa nimodipiini käytetään samanaikaisesti atsolijohdosten kanssa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Nefatsodoni
Nimodipiinin ja nefatsodonin mahdollisia yhteisvaikutuksia ei ole tutkittu. Tämän depressiolääkkeen on raportoitu olevan voimakas sytokromi P450 3A4 -entsyymin inhibiittori. Sen vuoksi ei voida poissulkea mahdollista nimodipiinin pitoisuuden nousua plasmassa, jos sitä käytetään samanaikaisesti nefatsodonin kanssa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Kinupristiini/dalfopristiini
Nifedipiinista saatujen kokemusten perusteella myös nimodipiinin pitoisuudet plasmassa saattavat nousta annettaessa sitä yhdessä kinupristiinin/dalfopristiinin kanssa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Simetidiini
Nimodipiinin pitoisuudet plasmassa saattavat nousta annettaessa samanaikaisesti H2-salpaaja simetidiinin kanssa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Valproiinihappo
Nimodipiinin pitoisuudet plasmassa saattavat nousta annettaessa samanaikaisesti epilepsialääke valproiinihapon kanssa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Nimotop 30 mg tabletit ja 0,2 mg/ml infuusioneste:
Fluoksetiini
Käytettäessä depressiolääke fluoksetiinia ja nimodipiinia samanaikaisesti havaittiin noin 50 % suuremmat nimodipiinin pitoisuudet plasmassa. Fluoksetiinipitoisuudet laskivat merkittävästi, mutta sen aktiivisen metaboliitin, norfluoksetiinin, pitoisuudet eivät muuttuneet (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Nortriptyliini
Käytettäessä depressiolääke nortriptyliiniä ja nimodipiiniä samanaikaisesti havaittiin plasman nimodipiinipitoisuuksissa pientä laskua, nortriptyliinipitoisuuksien säilyessä ennallaan.
Nimodipiinin vaikutukset muihin lääkeaineisiin
Verenpainetta laskevat lääkeaineet
Nimodipiini voi voimistaa verenpainetta laskevaa vaikutusta kun sitä käytetään samanaikaisesti verenpainelääkkeiden kanssa, kuten:
- diureetit
- beetasalpaajat
- ACE:n estäjät
- angiotensiinireseptorin salpaajat (AT1)
- muut kalsiuminestäjät
- alfasalpaajat
- alfametyylidopa
- myös erektiolääkkeinä ja pulmonaalihypertension hoitoon käytettyjen PDE5-estäjien kanssa.
Jos samanaikainen käyttö on kuitenkin välttämätöntä, potilasta on seurattava erityisen huolellisesti.
Tsidovudiini
Eläinkokeessa apinoilla HIV-infektioiden hoitoon tarkoitetun tsidovudiinin (i.v.) ja nimodipiini-boluksen (i.v.) anto samanaikaisesti johti tsidovuodiinin AUC-arvon merkittävään kasvuun, samalla kun tsidovudiinin jakautumistilavuus ja puhdistuma pienenivät.
Nimotop 0,2 mg/ml infuusioneste
Beetasalpaajien samanaikainen parenteraalinen anto Nimotop-infuusionesteen kanssa saattaa johtaa molempien lääkkeiden negatiivisen inotrooppisen vaikutuksen voimistumiseen, mikä voi johtaa jopa sydämen vajaatoimintaan.
Infuusionesteen samanaikainen käyttö mahdollisesti nefrotoksisten lääkeaineiden kuten aminoglykosidien, kefalosporiinien tai furosemidin kanssa voi johtaa munuaisten toiminnan heikkenemiseen. Samoin lievä munuaisten vajaatoiminta voi edelleen pahentua nimodipiinin käytön yhteydessä. Munuaisten toiminnan huolellinen seuranta on tarpeen tällaisissa tapauksissa ja hoidon keskeytystä tulisi harkita tarpeen mukaan (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Muut yhteisvaikutukset
Koska Nimotop infuusioneste sisältääetanolia, voi sen ja alkoholin kanssa yhteensopimattomien lääkeaineiden kesken esiintyä interaktioita (ks. kohta Muut yhteisvaikutukset)
Lääkeaineet, joiden kanssa nimodipiinillä ei tutkitusti ole yhteisvaikutuksia:
Nimodipiinin ja haloperidolin samanaikainen käyttö pitkäaikaista haloperidolihoitoa saavilla potilailla ei johtanut lääkkeiden keskinäisiin interaktioihin.
Suun kautta annetun nimodipiinin samanaikainen käyttö diatsepaamin, digoksiinin, glibenklamidin, indometasiinin, ranitidiinin tai varfariinin kanssa ei aiheuttanut lääkkeiden keskinäisiä interaktioita.
Nimotop-tablettien yhteisvaikutukset ruoan kanssa
Greippimehu
Greippimehu inhiboi sytokromi P540 3A4 -entsyymiä. Sen vuoksi greippimehun ja dihydropyridiiniryhmään kuuluvan kalsiumkanavan salpaajien samanaikainen käyttö voi johtaa nimodipiinin kohonneeseen pitoisuuteen plasmassa ja hidastuneeseen eliminaatioon. Tämän vuoksi verenpainetta laskeva vaikutus voi olla suurempi. Greippimehun nauttimisen jälkeen tämä vaikutus voi kestää ainakin neljä vuorokautta. Greippiä tai greippimehua ei siksi pidä nauttia nimodipiinin käytön aikana (ks. kohta Annostus ja antotapa).
Raskaus ja imetys
Raskaus
Nimodipiinin käytöstä raskauden aikana ei ole riittävästi tietoa Jos nimodipiinia joudutaan antamaan raskauden aikana, hoidon hyödyt ja mahdolliset riskit on arvioitava huolellisesti.
Imetys
Nimodipiinin ja sen metaboliittien on osoitettu ilmenevän äidinmaidossa samansuuruisin pitoisuuksin kuin äidin plasmassa. Imettävien äitien ei pidä imettää lastaan lääkkeen käytön aikana.
Hedelmällisyys
Yksittäisissä koeputkihedelmöitystapauksissa kalsiumsalpaajat on yhdistetty palautuviin biokemiallisiin muutoksiin siittiöiden pääkappaleissa. Tämän ilmiön merkitystä lyhytkestoisessa hoidossa ei tiedetä.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Nimodipiini voi aiheuttaa haittavaikutuksia (kuten verenpaineen laskusta johtuvaa huimausta, ks. kohta Haittavaikutukset), jotka voivat heikentää suorituskykyä liikenteessä ja muissa tarkkuutta vaativissa tehtävissä. Nimotop-infuusionesteen käytön yhteydessä tällä ei yleensä ole merkitystä.
Haittavaikutukset
Nimodipiinin haittavaikutukset on taulukoitu alla esiintyvyystiheyksien mukaan. Haittavaikutukset on havaittu kliinisissä tutkimuksissa, joissa nimodipiinia annettiin akuutin subaraknoidaalisen verenvuodon hoitoon (lumekontrolloidut kokeet: nimodipiini N = 703, lume N = 692, kontrolloimattomat kokeet: N = 2496).
| Melko harvinainen (≥1/1000 ja <1/100) | |
| Veri ja imukudos | Trombosytopenia |
| Immuunijärjestelmä | Allerginen reaktio, ihottuma |
| Hermosto | Päänsärky |
| Sydän | Takykardia |
| Verisuonisto | Verenpaineen lasku, verisuonten laajeneminen |
| Ruoansulatuselimistö | Pahoinvointi |
| Harvinainen (≥1/10 000 ja < 1/1000) | |
| Sydän | Bradykardia |
| Ruoansulatuselimistö | Suolitukkeuma |
| Maksa ja sappi | Ohimenevä maksaentsyymien määrän nousu |
| Yleisoireet ja antopaikassa todettavat haitat | Injektio- ja infuusiopaikan oireet, infuusiopaikan laskimontukkotulehdus tai laskimotulehdus |
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Oireet:
Akuutteja yliannostuksen oireita voivat olla voimakas verenpaineen lasku ja taky- tai bradykardia. Suun kautta otetun yliannoksen jälkeen lisäksi ruoansulatuskanavan häiriöt ja pahoinvointi.
Toimenpiteet:
Akuutin yliannostuksen jälkeen nimodipiinin anto on lopetettava välittömästi. Ensiaputoimenpiteet ovat oireenmukaisia. Lääkehiili saattaa vähentää nimodipiinin imeytymistä, jos sitä annetaan 1–2 tunnin sisällä lääkkeen ottamisesta. Jos verenpaine laskee voimakkaasti, voidaan käyttää dopamiinia tai noradrenaliinia laskimonsisäisesti. Koska nimodipiinilla ei ole tunnettua spesifistä antidoottia, on muu hoitokin oireenmukaista.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä, ATC-koodi: C08CA06.
Nimodipiini on kalsiuminestäjä, joka kuuluu 1,4-dihydropyridiineihin. Sileiden lihassolujen supistuminen on riippuvaisia kalsium-ioneista, jotka tulevat soluun depolarisaation aikana hitaina solukalvon läpäisevinä ionivirtoina. Nimodipiini estää kalsium-ionien siirtymistä soluihin ja näin ollen se estää verisuonen sileän lihaksen supistumista. Eläinkokeissa nimodipiinilla on ollut suurempi vaikutus aivovaltimoihin kuin elimistön muihin valtimoihin. Nimodipiini läpäisee veri-aivo-esteen, koska se on erittäin lipofiilinen yhdiste.
Nimodipiinillä on erityisesti aivoihin kohdistuva antivasokonstriktiivinen ja anti-iskeeminen vaikutus. Erilaisten vasoaktiivisten yhdisteiden (esim. serotoniinin, prostaglandiinien ja histamiinin) tai veren ja/tai veren hajoamistuotteiden in vitro aiheuttama vasokonstriktio voidaan estää nimodipiinillä. Nimodipiinillä on myös neurofarmakologisia ja psykofarmakologisia vaikutuksia.
Akuuteista aivoverenkiertohäiriöistä kärsivillä potilailla tehdyt tutkimukset ovat osoittaneet, että nimodipiini laajentaa aivoverisuonia ja parantaa aivoverenkiertoa. Perfuusion paraneminen on säännönmukaisesti suurempaa aikaisemmin vaurioituneilla tai hypoperfusoituvilla alueilla kuin terveillä alueilla. Nimodipiini vähentää merkitsevästi iskeemisiä neurologisia vaurioita ja kuolleisuutta potilailta, joilla on subaraknoidaalinen verenvuoto.
Farmakokinetiikka
Imeytyminen
Nimodipiini imeytyy oraalisen annoksen jälkeen lähes täydellisesti. Nimodipiini ja sen ensimmäiset ensikierron metaboliatuotteet todetaan plasmassa 10-15 minuutin kuluttua tabletin ottamisesta. Vanhuksilla huippupitoisuudet plasmassa (Cmax) ovat useamman annoksen (3 x 30 mg/vrk) jälkeen 7,3-43,2 ng/ml ja vastaavat tmax -arvot 0,6-1,6 tuntia. Nuorilla ihmisillä saavutetaan keskimääräiset plasman huippupitoisuudet 16 ± 8 ng/ml ja 31 ± 12 ng/ml 30 mg:n ja 60 mg:n kerta-annoksen jälkeen. Plasman huippupitoisuudet ja biologinen hyötyosuus kasvavat suhteessa annokseen suurimpaan testattuun annostasoon saakka (90 mg).
Kun käytetään 0,03 mg/kg/h kestoinfuusiota, saavutetaan vakaassa tilassa keskimääräinen pitoisuus 17,6-26,6 ng/ml plasmassa. Laskimonsisäisen bolusannoksen jälkeen nimodipiinipitoisuus plasmassa laskee kaksivaiheisesti, puoliintumisajat ovat 5-10 minuuttia ja noin 60 minuuttia. Iv-annoksen jakautumistilavuuden (Vss, kaksitilamalli) on laskettu olevan 0,9-1,6 l/painokilo. Kokonaispuhdistuma (systeeminen) on 0,6-1,9 l/h/kg.
Proteiineihin sitoutuminen ja jakautuminen
Nimodipiini sitoutuu plasman proteiineihin 97-99 %:sti. Eläinkokeissa on todettu, että [14C] leimattu nimodipiini läpäisee istukan. Samanlainen jakautuminen on todennäköistä myös ihmisillä, vaikkakin kokeelliset todisteet puuttuvat. Rotalla nimodipiini ja/tai sen metaboliitit erittyvät maitoon suurempina pitoisuuksina kuin ne ovat emon plasmassa. Ihmisellä nimodipiinin pitoisuudet rintamaidossa ovat samaa suuruusluokkaa kuin pitoisuudet plasmassa.
Oraalisen ja iv-annoksen jälkeen selkäydinnesteessä todetut nimodipiinipitoisuudet ovat noin 0,5 % plasmassa mitatuista pitoisuuksista. Tämä vastaa suunnilleen plasmassa vapaana olevaa osuutta.
Biotransformaatio, eliminaatio ja erittyminen
Nimodipiini eliminoituu metaboloitumalla sytokromi P450 3A4 -entsyymin katalysoimana. Pääasiallinen mekanismi on dihydropyridiinirenkaan dehydrogenoituminen ja oksidatiivinen O-demetylaatio. Esteriketjun oksidatiivinen lohkeaminen, 2- ja 6- metyyliryhmien hydroksylaatio ja glukuronisaatio konjugaatioreaktiona ovat myös tärkeitä metaboliareittejä. Kolmella plasmassa esiintyvällä päämetaboliitilla ei ole joko ollenkaan tai on ainoastaan terapeuttisesti merkityksetön määrä aktiivisuutta jäljellä.
Maksaentsyymeihin kohdistuvia induktio- tai inhibitiovaikutuksia ei tunneta. Ihmisellä metaboliitit erittyvät noin 50 %:sti munuaisten ja 30 %:sti suoliston kautta. Eliminaation kinetiikka on lineaarista. Nimodipiinin puoliintumisaika on 1,1-1,7 tuntia. Terminaalisella puoliintumisajalla (5-10 h) ei ole merkitystä annosvälin määrittämisessä.
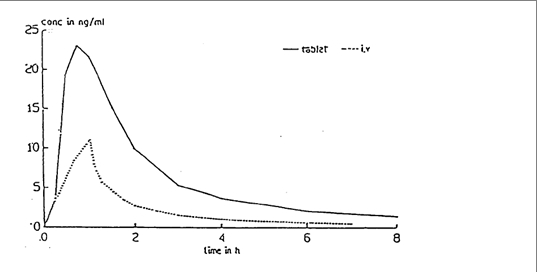
Keskimääräinen nimodipiinipitoisuus plasmassa 30 mg:n oraalisen tabletti-annoksen jälkeen ja 1 tunnin laskimonsisäiseen infuusioon 0,015 mg/kg:n annon jälkeen (n = 24 iäkästä vapaaehtoista).
Biologinen hyötyosuus
Voimakkaasta ensikierron metaboliasta (85-95 %) johtuen absoluuttinen biologinen hyötyosuus on 5-15 %.
Prekliiniset tiedot turvallisuudesta
Altistuksen ja toistuvan altistuksen aiheuttamaa toksisuutta, genotoksisuutta, karsinogeenisuutta ja uroksen ja naaraan hedelmällisyyttä koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille. 30 mg/kg/vrk ja sitä suuremmat annokset kantaville rotille estivät sikiön kasvua ja aiheuttivat sikiön painon laskua. 100 mg/kg/vrk annoksella esiintyi sikiökuolleisuutta. Teratogeenisuudesta ei havaittu näyttöä. Kaneilla ei esiintynyt sikiötoksisuutta eikä teratogeenisuutta 10 mg/kg/vrk annoksilla. Rotille tehdyn peri- ja postnataalisen vaiheen tutkimuksen mukaan kuolleisuutta ja hidastunutta fyysistä kehittymistä havaittiin 10 mg/kg/vrk ja sitä suuremmilla annoksilla.
Farmaseuttiset tiedot
Apuaineet
Nimotop 0,2 mg/ml infuusioneste: Apuaineet, joiden vaikutus tunnetaan: natrium 23 mg/50ml, etanoli 23,7 til.-%.Etanoli (96 %), makrogoli 400, natriumsitraatti, sitruunahappo, injektionesteisiin käytettävä vesi.
Nimotop 30 mg tabletti: Povidoni 25, mikrokiteinen selluloosa, maissitärkkelys, krospovidoni, magnesiumstearaatti, hypromelloosi, makrogoli 4000, titaanidioksidi (E171), keltainen rautaoksidi (E172).
Yhteensopimattomuudet
Nimotop 0,2 mg/ml infuusioneste: Koska Nimotop-infuusionesteen aktiivinen aine absorboituu polyvinyylikloridiin (PVC), tulee käyttää vain polyetyleeni (PE) infuusioletkustoja.
Nimotop 30 mg tabletti: Ei oleellinen.
Kestoaika
Nimotop 0,2 mg/ml infuusioneste: 4 vuotta.
Nimotop 30 mg tabletti:
Taitettavat rasiat, jotka sisältävät PP/alumiiniläpipainopakkauksia: 5 vuotta
Taitettavat rasiat, jotka sisältävät PVC/PVDC/alumiiniläpipainopakkauksia: 4 vuotta
Säilytys
Nimotop 0,2 mg/ml infuusioneste: Säilytä alle 25 °C. Ei erityistoimenpiteitä, jos infuusionestepullo säilytetään ulkopakkauksessa. Suojattava suoralta auringonvalolta, jos pullo poistetaan ulkopakkauksesta.
Nimotop 30 mg tabletti: Säilytä alle 25 °C.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
NIMOTOP infuusioneste, liuos
0,2 mg/ml 5 x 50 ml (5 kpl polyetyleeni (PE) infuusioletkustoja) (154,89 €)
NIMOTOP tabletti, kalvopäällysteinen
30 mg 100 fol (125,44 €)
PF-selosteen tieto
Nimotop 0,2 mg/ml infuusioneste: 5 x 50 ml, ruskea lasipullo, harmaa klorobutyylitulppa.
Nimotop 30 mg tabletti: 100 tablettia (10 x 10 tabl.), polypropyleeni/alumiini-läpipainopakkaus.
Valmisteen kuvaus:
Nimotop 0,2 mg/ml infuusioneste: Kirkas, kellertävä liuos.
Nimotop 30 mg tabletti: Keltainen, pyöreä, kalvopäällysteinen tabletti. Tabletin halkaisija 10 mm, korkeus 4,3-4,9 mm. Merkintä SK ja Bayer-risti.
Käyttö- ja käsittelyohjeet
Nimotop 0,2 mg/ml infuusioneste: Polyetyleeniletkusto, ks. kohta Yhteensopimattomuudet. Infuusionestepullon tulpan lävistämiseen suositellaan käytettäväksi vain silikonoituja neuloja tai kanyylejä.
Koska nimodipiini on lievästi herkkä valolle, tulisi infuusionesteen käyttöä suorassa auringonvalossa välttää. Jos suoraa auringonvaloa ei kuitenkaan voida välttää infuusion aikana, tulisi käyttää mustaa, ruskeaa, keltaista tai punaista ruiskua ja infuusioletkustoa, tai suojata infuusiopumppu ja -letkusto valoaläpäisemättömällä materiaalilla. Infuusioneste säilyy kuitenkin käyttökelpoisena hajavalossa tai keinovalossa 10 tuntia.
Nimotop 30 mg tabletti: Ei erityisvaatimuksia.
Korvattavuus
NIMOTOP infuusioneste, liuos
0,2 mg/ml 5 x 50 ml
NIMOTOP tabletti, kalvopäällysteinen
30 mg 100 fol
- Ei korvausta.
ATC-koodi
C08CA06
Valmisteyhteenvedon muuttamispäivämäärä
09.02.2024
Yhteystiedot
 BAYER OY
BAYER OY Tuulikuja 2, PL 73
02151 Espoo
020 785 21
www.bayer.fi
