MEMANTINE MERZ oraaliliuos 5 mg/pumpun painallus, tabletti, kalvopäällysteinen 5 mg+10 mg+15 mg+20 mg, 10 mg, 20 mg
Vaikuttavat aineet ja niiden määrät
Memantine Merz 5 mg+10 mg+15 mg+20 mg tabletit, kalvopäällysteiset (aloituspakkaus)
Memantine Merz 5 mg tabletit, kalvopäällysteiset: Kukin kalvopäällysteinen tabletti sisältää 5 mg memantiinihydrokloridia vastaten 4,15 mg memantiinia.
Memantine Merz 10 mg tabletit, kalvopäällysteiset: Kukin kalvopäällysteinen tabletti sisältää 10 mg memantiinihydrokloridia vastaten 8,31 mg memantiinia.
Memantine Merz 15 mg tabletit, kalvopäällysteiset: Kukin kalvopäällysteinen tabletti sisältää 15 mg memantiinihydrokloridia vastaten 12,46 mg memantiinia.
Memantine Merz 20 mg tabletit, kalvopäällysteiset: Kukin kalvopäällysteinen tabletti sisältää 20 mg memantiinihydrokloridia vastaten 16,62 mg memantiinia.
Memantine Merz 10 mg tabletit, kalvopäällysteiset
Kukin kalvopäällysteinen tabletti sisältää 10 mg memantiinihydrokloridia vastaten 8,31 mg memantiinia.
Memantine Merz 20 mg tabletit, kalvopäällysteiset
Kukin kalvopäällysteinen tabletti sisältää 20 mg memantiinihydrokloridia vastaten 16,62 mg memantiinia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Memantine Merz 5 mg/pumpun painallus oraaliliuos
1 g liuosta sisältää 10 mg memantiinihydrokloridia vastaten 8,31 mg memantiinia.
Yksi pumpun painallus (yksi painallus alaspäin) annostelee 0,5 ml liuosta, joka sisältää 5 mg memantiinihydrokloridia vastaten 4,16 mg memantiinia.
Apuaineet: Yksi millilitra oraaliliuosta sisältää 100 mg sorbitolia (E420), ks. kohta Varoitukset ja käyttöön liittyvät varotoimet.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Tabletti, kalvopäällysteinen. Oraaliliuos.
Kliiniset tiedot
Käyttöaiheet
Tämä lääkevalmiste on tarkoitettu kohtalaista tai vaikeaa Alzheimerin tautia sairastavien potilaiden hoitoon.
Ehto
Hoidon aloittavan ja sitä valvovan lääkärin tulee olla perehtynyt Alzheimerin taudin (dementian) diagnosointiin ja hoitoon.
Annostus ja antotapa
Hoidon saa aloittaa Alzheimerin taudin diagnosointiin ja hoitoon perehtynyt lääkäri, jonka tulee valvoa sitä.
Annostus
Hoito tulee aloittaa vain, mikäli potilaalla on hoitaja, joka valvoo lääkevalmisteen ottamista säännöllisesti. Diagnoosi on tehtävä voimassaolevien ohjeiden mukaisesti. Memantiinin siedettävyys ja annostus on arvioitava säännöllisesti, mieluimmin kolmen kuukauden kuluessa hoidon aloittamisesta. Sen jälkeen memantiinin kliininen hyöty sekä hoidon siedettävyys on arvioitava säännöllisesti voimassa olevien kliinisten ohjeiden mukaan. Ylläpitohoitoa voidaan jatkaa niin kauan kuin hoidosta on potilaalle terapeuttista hyötyä ja potilas sietää memantiinihoidon hyvin. Hoidon lopettamista on harkittava, kun terapeuttista vaikutusta ei enää ole tai jos potilas ei siedä hoitoa.
Aikuiset
Annoksen titraus
Tabletit, kalvopäällysteiset 10 mg ja 20 mg:
Enintään 20 mg kerran vuorokaudessa. Haittavaikutusten vaaran vähentämiseksi ylläpitoannokseen on siirryttävä vaiheittain lisäämällä annosta 5 mg viikossa ensimmäisten kolmen viikon ajan seuraavasti. Muut tablettivahvuudet ovat saatavilla annoksen titraamiseen ylöspäin.
Viikko 1 (päivät 1-7):
Potilaan tulee ottaa puolet 10 mg:n kalvopäällysteisestä tabletista tai 1 x 5 mg (5 mg) vuorokaudessa 7 vuorokauden ajan.
Viikko 2 (päivät 8-14):
Potilaan tulee ottaa yksi 10 mg:n kalvopäällysteinen tabletti (10 mg) vuorokaudessa 7 vuorokauden ajan.
Viikko 3 (päivät 15-21):
Potilaan tulee ottaa puolitoista 10 mg:n kalvopäällysteistä tablettia tai 1 x 15 mg (15 mg) vuorokaudessa 7 vuorokauden ajan.
Viikosta 4 lähtien:
Potilaan tulee ottaa kaksi 10 mg:n tai 1 x 20 mg kalvopäällysteistä tablettia (20 mg) vuorokaudessa.
Tabletit, kalvopäällysteiset 5 mg+10 mg+15 mg+20 mg (aloituspakkaus):
Suositeltu aloitusannos on 5 mg/vrk, jota lisätään asteittain ensimmäisten neljän viikon aikana seuraavalla tavalla, kunnes suositeltu ylläpitoannos on saavutettu:
Viikko 1 (päivät 1-7):
Potilaan tulee ottaa yksi 5 mg:n kalvopäällysteinen (valkoinen/luonnonvalkoinen, soikea) tabletti vuorokaudessa 7 päivän ajan.
Viikko 2 (päivät 8-14):
Potilaan tulee ottaa yksi 10 mg:n kalvopäällysteinen (vaaleankeltainen/keltainen, soikea) tabletti vuorokaudessa 7 päivän ajan.
Viikko 3 (päivät 15-21):
Potilaan tulee ottaa yksi 15 mg:n kalvopäällysteinen tabletti (oranssi, soikea) vuorokaudessa 7 päivän ajan.
Viikko 4 (päivät 22-28):
Potilaan tulee ottaa yksi 20 mg:n kalvopäällysteinen tabletti (vaaleanpunainen, soikea) vuorokaudessa 7 päivän ajan.
Oraaliliuos 5 mg/pumpun painallus:
Enintään 20 mg kerran vuorokaudessa. Haittavaikutusten vaaran vähentämiseksi ylläpitoannokseen on siirryttävä vaiheittain lisäämällä annosta 5 mg viikossa ensimmäisten kolmen viikon ajan seuraavasti:
Viikko 1 (päivät 1-7):
Potilaan tulee ottaa 0,5 ml (5 mg) eli yhden pumpun painalluksen verran oraaliliuosta vuorokaudessa 7 vuorokauden ajan.
Viikko 2 (päivät 8-14):
Potilaan tulee ottaa 1 ml (10 mg) eli kahden pumpun painalluksen verran oraaliliuosta vuorokaudessa 7 vuorokauden ajan.
Viikko 3 (päivät 15-21):
Potilaan tulee ottaa 1,5 ml (15 mg) eli kolmen pumpun painalluksen verran oraaliliuosta vuorokaudessa 7 vuorokauden ajan.
Viikosta 4 lähtien:
Potilaan tulee ottaa 2 ml (20 mg) eli neljän pumpun painalluksen verran oraaliliuosta kerran päivässä.
Ylläpitoannos
Suositeltu ylläpitoannos on 20 mg (2 ml liuosta, mikä vastaa neljää pumpun painallusta) vuorokaudessa.
Iäkkäät
Kliinisiin tutkimuksiin perustuva annostussuositus yli 65-vuotiaiden potilaiden osalta on 20 mg vuorokaudessa (kaksi 10 mg:n tablettia tai 2 ml eli neljän pumpun painalluksen verran oraaliliuosta kerran vuorokaudessa) edellä kuvatulla tavalla.
Munuaisten vajaatoiminta
Annosta ei tarvitse muuttaa potilailla, joilla on lievä munuaisten vajaatoiminta (kreatiniinin puhdistuma 50-80 ml/min). Potilailla, joilla on kohtalainen munuaisten vajaatoiminta (kreatiniinin puhdistuma 30-49 ml/min), annoksen tulee olla 10 mg (1 ml eli kahden pumpun painalluksen verran oraaliliuosta) vuorokaudessa. Jos vähintään 7 hoitopäivän jälkeen siedettävyys on hyvä, annoksen voi vaiheittain nostaa 20 mg:aan vuorokaudessa tavanomaisen annostusohjeen mukaan. Potilailla, joilla on vaikea munuaisten vajaatoiminta (kreatiniinin puhdistuma 5-29 ml/min), annoksen tulee olla 10 mg (1 ml eli kahden pumpun painalluksen verran oraaliliuosta) vuorokaudessa.
Maksan vajaatoiminta
Potilailla, joilla on lievä tai kohtalainen maksan vajaatoiminta (Child-Pugh A tai Child-Pugh B), annosta ei tarvitse muuttaa. Memantiinin käytöstä vaikeaa maksan vajaatoimintaa sairastavilla ei ole tietoa saatavilla. Memantine Merzia ei suositella annettavaksi vaikeaa maksan vajaatoimintaa sairastaville potilaille.
Pediatriset potilaat
Memantine Merzia ei suositella käytettäväksi alle 18-vuotiaiden hoidossa, koska tässä ikäryhmässä sen turvallisuuteen ja tehoon liittyviä tietoja ei ole saatavilla.
Antotapa
Memantine Merz otetaan kerran vuorokaudessa, joka päivä samaan aikaan. Kalvopäällysteiset tabletit ja oraaliliuos voidaan ottaa ruokailun yhteydessä tai tyhjään mahaan.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Varovaisuus on tarpeen potilailla, joilla on epilepsia, aikaisemmin todettu kouristuskohtauksia tai alttiutta kohtauksiin.
Muiden N-metyyli-D-aspartaatin (NMDA) antagonistien, kuten amantadiinin, ketamiinin tai dekstrometorfaanin, samanaikaista käyttöä on vältettävä. Nämä yhdisteet vaikuttavat samaan reseptorijärjestelmään kuin memantiini, joten haittavaikutuksia (lähinnä keskushermostoon liittyviä) saattaa esiintyä tavallista useammin tai ne voivat olla voimakkaampia (ks. myös kohta Yhteisvaikutukset).
Jotkin virtsan pH-arvoa nostavat tekijät (ks. kohta Farmakokinetiikka, Eliminaatio) voivat edellyttää potilaan tarkkaa seurantaa. Tällaisia tekijöitä ovat muun muassa äkilliset ruokavalion muutokset, esimerkiksi sekaravinnon syöjästä vegetaariksi, tai antasidien runsas käyttö. Virtsan pH-arvon nousu voi johtua myös munuaisperäisestä asidoosista (RTA) tai Proteus-bakteerien aiheuttamista vakavista virtsatietulehduksista.
Useimmissa kliinisissä kokeissa potilaat, joilla on hiljattain ollut sydäninfarkti, kompensoitumaton sydämen vajaatoiminta (NYHA III-IV) tai hallitsematon verenpainetauti, suljettiin pois. Tästä johtuen tällaisia potilaita koskevia tietoja on saatavana vain vähän, ja heitä on seurattava tarkkaan.
Apuaineet:
Tabletti
Tabletti sisältää alle 1 mmol natriumia (23 mg) per tabletti eli sen voidaan sanoa olevan ”natriumiton”.
Oraaliliuos
Suun kautta otettava oraaliliuos sisältää sorbitolia. Tätä lääkevalmistetta ei pidä antaa potilaille, joilla on perinnöllinen fruktoosi-intoleranssi (HFI).
Lisäksi tämä lääke sisältää kaliumia alle 1 mmol (39 mg) per annos, eli se on olennaisesti kaliumiton.
Yhteisvaikutukset
Memantiinin farmakologisista vaikutuksista ja vaikutustavasta johtuen voi syntyä seuraavia yhteisvaikutuksia:
- Vaikutustavan perusteella vaikuttaa siltä, että L-dopan, dopaminergisten agonistien ja antikolinergien vaikutuksia saattaa voimistaa memantiinin kaltaisten NMDA-antagonistien samanaikainen käyttö. Barbituraattien ja neuroleptien vaikutus voi heikentyä. Memantiinin anto samanaikaisesti kouristuksia ehkäisevien lääkeaineiden, dantroleenin tai baklofeenin, kanssa saattaa muuttaa niiden vaikutuksia. Annosta on ehkä säädettävä.
- Memantiinin samanaikaista käyttöä amantadiinin kanssa tulisi välttää farmakotoksisen psykoosin vaaran vuoksi. Aineet ovat kemiallisesti samantapaisia NMDA-antagonisteja. Tämä saattaa koskea myös ketamiinia ja dekstrometorfaania (ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet). Memantiinin ja fenytoiinin yhdistämisen mahdollisesta vaarasta on julkaistu yksi tapausselostus.
- Myös muut vaikuttavat aineet kuten simetidiini, ranitidiini, prokainamidi, kinidiini, kiniini ja nikotiini, jotka käyttävät samaa munuaisten kationikuljetusjärjestelmää kuin amantadiini, voivat mahdollisesti aiheuttaa interaktion memantiinin kanssa ja aiheuttaa plasmatason mahdollisen kohoamisen vaaran.
- Mahdollisesti hydroklooritiatsidin (HCT) seerumitaso alenee, kun memantiinia annetaan HCT:n tai HCT-yhdistelmävalmisteen kanssa.
- Markkinoilletulon jälkeen on havaittu yksittäisiä tapauksia kansainvälisen vakioidun suhdeluvun (INR) arvon noususta potilailla, jotka ovat saaneet varfariinia samaan aikaan memantiinin kanssa. Vaikka syy-seuraussuhdetta ei olekaan osoitettu memantiinin ja varfariinin välillä, on protrombiiniajan tai INR-arvon seuranta suositeltava potilaille, jotka saavat oraalista antikoagulanttihoitoa samanaikaisesti memantiinin kanssa.
Nuorilla terveillä koehenkilöillä tehdyissä farmakokineettisissä (PK) kerta-annostutkimuksissa ei havaittu olennaisia vaikuttavien aineiden yhteisvaikutuksia memantiinin ja glyburidin/metformiinin tai donepetsiilin välillä.
Nuorilla terveillä koehenkilöillä tehdyssä kliinisessä tutkimuksessa ei havaittu memantiinin olennaisesti vaikuttavan galantamiinin farmakokinetiikkaan.
Memantiini ei estänyt CYP 1A2-, 2A6-, 2C9-, 2D6-, 2E1-, 3A-isoentsyymejä, mono-oksygenaasia sisältävää flaviinia, epoksidihydrolaasia eikä sulfataatiota in vitro -tutkimuksessa.
Raskaus ja imetys
Raskaus
Memantiinista ei ole saatavana kliinisiä tietoja altistettujen raskauksien osalta. Eläinkokeissa on saatu viitteitä kohdussa tapahtuvan kasvun vähenemisen riskistä altistumistasoilla, jotka ovat samat tai hieman korkeammat kuin ihmisille aiheutuva altistus (ks. kohta Prekliiniset tiedot turvallisuudesta). Mahdollista vaaraa ihmisille ei tunneta. Memantiinia ei tule käyttää raskauden aikana, ellei se ole selvästi tarpeellista.
Imetys
Ei ole tiedossa, erittyykö memantiini äidinmaitoon, mutta aineen lipofiilisyys huomioon ottaen tämä on todennäköistä. Memantiinia käyttävien naisten ei pitäisi imettää.
Hedelmällisyys
Prekliinisissä tutkimuksissa memantiinin ei havaittu aiheuttavan miesten tai naisten hedelmällisyyteen liittyviä haittavaikutuksia.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Kohtalainen tai vaikea Alzheimerin tauti vaikuttaa tavallisesti haitallisesti ajokykyyn ja koneidenkäyttökykyyn. Lisäksi Memantine Merzilla on vähäinen tai kohtalainen vaikutus ajokykyyn ja koneidenkäyttökykyyn. Avohoidossa olevia potilaita on siksi kehotettava olemaan erityisen varovaisia.
Haittavaikutukset
Turvallisuustietojen yhteenveto
Kliinisissä tutkimuksissa, joissa potilaiden dementian aste vaihteli lievästä vaikeaan, hoidettiin 1784 potilasta Memantine Merzilla ja 1595 potilasta lumelääkkeellä. Haittavaikutusten kokonaisesiintyvyys oli ryhmissä samaa luokkaa, ja haittavaikutukset olivat tavallisesti lieviä tai kohtalaisia. Yleisimpiä haittavaikutuksia, joita esiintyi enemmän Memantine Merz -ryhmässä kuin lumeryhmässä, olivat huimaus (6,3 % / 5,6 %), päänsärky (5,2 % / 3,9 %), ummetus (4,6 % / 2,6 %), uneliaisuus (3,4 % / 2,2 %) ja kohonnut verenpaine (4,1 % / 2,8 %).
Seuraavassa taulukossa lueteltuja haittavaikutuksia on esiintynyt Memantine Merzia koskevissa kliinisissä tutkimuksissa ja sen tultua markkinoille. Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Taulukko haittavaikutuksista
Haittavaikutukset luokitellaan elinjärjestelmittäin seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1000, < 1/100), hyvin harvinainen (< 1/10000), tuntematon (koska saatavissa oleva tieto ei riitä arviointiin).
| ELINJÄRJESTELMÄ | TAAJUUS | HAITTAVAIKUTUKSET |
| Infektiot | Melko harvinainen | Sieni-infektiot |
| Immuunijärjestelmä | Yleinen | Yliherkkyys lääkevalmisteelle |
| Psyykkiset häiriöt | Yleinen | Uneliaisuus |
| Melko harvinainen | Sekavuus Aistiharhat1 | |
| Tuntematon | Psykoottiset reaktiot2 | |
| Hermosto | Yleinen | Huimaus Tasapainohäiriö |
| Melko harvinainen | Poikkeava kävely | |
| Hyvin harvinainen | Epileptiset kohtaukset | |
| Sydän | Melko harvinainen | Sydämen vajaatoiminta |
| Verisuonisto | Yleinen | Kohonnut verenpaine |
| Melko harvinainen | Laskimotukos/tromboembolia | |
| Hengityselimet, rintakehä ja välikarsina | Yleinen | Hengenahdistus |
| Ruoansulatuselimistö | Yleinen | Ummetus |
| Melko harvinainen | Oksentelu | |
| Tuntematon | Haimatulehdus2 | |
| Maksa ja sappi | Yleinen | Maksa-arvojen suureneminen |
| Tuntematon | Maksatulehdus | |
| Yleisoireet ja antopaikassa todettavat haitat | Yleinen | Päänsärky |
| Melko harvinainen | Väsymys |
1 Aistiharhoja on todettu lähinnä vaikeaa Alzheimerin tautia sairastavilla.
2 Markkinoilletulon jälkeen yksittäisiä tapauksia on raportoitu.
Alzheimerin tautiin voi liittyä masennusta, itsemurha-ajatuksia ja itsemurhia. Markkinoilletulon jälkeen tällaisia tapauksia on raportoitu Memantine Merzia saavilla potilailla.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haitta–tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Kliinisissä tutkimuksissa ja markkinoilletulon jälkeen on yliannoksista vain vähän kokemuksia.
Oireet
Suhteellisen suuriin yliannoksiin (200 mg tai 105 mg vuorokaudessa 3 päivän ajan) liittyy väsymystä, heikotusta ja/tai ripulia tai ei mitään oireita. Alle 140 mg:n yliannoksilla tai yliannoksilla, joiden annos ei ole tiedossa, potilailla on esiintynyt keskushermosto-oireita (sekavuus, uneliaisuus, huimaus, levottomuus, vihamielisyys, aistiharhat ja tasapainovaikeudet) ja ruoansulatuselimistön oireita (oksentelu ja ripuli).
Suurimmasta tunnetusta yliannostuksesta (2000 mg) potilas selvisi hengissä. Seurauksena oli keskushermostovaikutuksia (10 päivää kestänyt kooma ja myöhemmin kaksoiskuvia ja rauhattomuutta). Potilas sai oireenmukaista hoitoa, ja lisäksi käytettiin plasmafereesia. Potilas toipui eikä pysyviä vaurioita todettu.
Toisessa suuressa yliannostapauksessa potilas oli saanut 400 mg memantiinia suun kautta, jäi henkiin ja toipui. Yliannoksesta seurasi keskushermostovaikutuksia kuten levottomuutta, psykoosi, näköharhoja, kouristusherkkyyttä, uneliaisuutta, tokkuraisuutta ja tajuttomuus.
Hoito
Yliannostustapauksessa annetaan oireenmukaista hoitoa. Memantiinille ei ole spesifistä vastalääkettä. Tavanomaisia menetelmiä, kuten mahahuuhtelua, lääkehiilen antoa (lääkkeen enterohepaattisen imeytymisen estämiseksi), virtsan happamoittamista ja tehostettua diureesia, tulee käyttää vaikuttavan aineen poistamiseksi.
Keskushermoston liialliseen stimulaatioon viittaavien oireiden yhteydessä on harkittava symptomaattisia kliinisiä hoitoja.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Muut dementialääkkeet, ATC-koodi: N06DX01.
On saatu yhä enemmän todisteita siitä, että glutamatergisen hermovälityksen toimintahäiriöt erityisesti NMDA-reseptoreissa vaikuttavat sekä neurodegeneratiivisen dementian ilmenemiseen että taudin etenemiseen.
Memantiini on jänniteriippuvainen, kohtalaisen affiniteetin omaava ei-kilpaileva NMDA-reseptoriantagonisti. Se muuttaa patologisesti kohonneiden glutamaatin toonisten tasojen vaikutuksia, joista voi aiheutua hermoston toimintahäiriöitä.
Kliiniset tutkimukset
Keskeisessä monoterapiatutkimuksessa, jossa potilailla oli kohtalainen tai vaikea Alzheimerin tauti (Mini Mental State Examination -testin (MMSE) kokonaispistemäärä alkuvaiheessa 3-14), oli mukana 252 avohoitopotilasta. Tutkimus osoitti, että memantiini oli lumelääkettä tilastollisesti merkitsevästi tehokkaampi kuuden kuukauden hoidon jälkeen tärkeimmillä tehoa mittaavilla menetelmillä arvioituna (analysoitujen potilaiden Clinician´s Interview-Based Impression of Change so. lääkärin haastatteluihin perustuva käsitys potilaan tilassa tapahtuneista muutoksista (CIBIC-plus): p = 0,025; Alzheimerin tautia sairastavan potilaan päivittäistä toimintakykyä ja sen vaikeusastetta arvioiva mittari (ADCS-ADLsev): p = 0,003; Severe Impairment Battery -asteikko (SIB): p = 0,002).
Toisessa keskeisessä monoterapiatutkimuksessa, jossa memantiinilla hoidettiin lievää tai kohtalaista Alzheimerin tautia (MMSE-kokonaispistemäärä alkuvaiheessa 10-22), oli mukana 403 potilasta. Tärkeimmillä tehomuuttujilla arvioituna olivat tulokset memantiinia saaneilla potilailla tilastollisesti merkitsevästi paremmat kuin lumelääkettä saaneilla potilailla. Käytetyt arviointiasteikot olivat Alzheimerin taudin arviointiasteikko (ADAS-cog) (p = 0,003) ja CIBIC-plus (p = 0,004) viikolla 24 (Last Observation Carried Forward (LOCF) -analyysi). Kolmanteen monoterapiatutkimukseen satunnaistettiin kaikkiaan 470 lievää tai kohtalaista Alzheimerin tautia sairastavaa potilasta (MMSE-kokonaispistemäärä alkuvaiheessa 11-23). Etukäteen määritetyssä ensisijaisessa tehoanalyysissä ei saavutettu tilastollista merkitsevyyttä viikolla 24.
Kuuden III-vaiheen lumekontrolloidun puolen vuoden tutkimuksen (joista osa oli monoterapiatutkimuksia ja osassa potilaat käyttivät jatkuvasti samansuuruista annosta asetyylikoliiniesteraasin estäjää) meta-analyysissä kohtalaista tai vaikeaa Alzheimerin tautia sairastavilla potilailla (MMSE-kokonaispistemäärä < 20), saavutettiin memantiinilla tilastollisesti merkitsevästi parempi vaikutus kognitiiviseen suorituskykyyn, yleisvointiin ja toimintakykyyn. Kun tutkittiin niitä potilaita, joiden tila huononi samanaikaisesti kaikilla kolmella alueella, havaittiin, että memantiini esti tilan huononemista tilastollisesti merkitsevästi paremmin kuin lume. Huononemista todettiin kaikilla kolmella alueella kaksi kertaa niin monella lumelääkettä saaneella kuin memantiinia saaneella potilaalla (21 % / 11 %, p < 0,0001).
Farmakokinetiikka
Imeytyminen
Memantiinin absoluuttinen hyötyosuus on noin 100 %. Sen tmax on 3-8 tuntia. Ruoka ei vaikuta memantiinin imeytymiseen.
Jakaantuminen
Vuorokautiset 20 mg:n annokset johtavat plasmassa memantiinin vakaan tilan pitoisuuteen välillä 70-150 ng/ml (0,5-1 µmol). Yksilölliset erot ovat suuria. Annosteltaessa 5-30 mg:n vuorokausiannoksia määritettiin aivo-selkäydinneste/seerumisuhteen keskiarvoksi 0,52. Jakaantumistilavuus on noin 10 l/kg. Noin 45 % memantiinista on sitoutuneena plasman proteiineihin.
Biotransformaatio
Ihmisellä noin 80 % elimistössä olevasta memantiinista on muuttumatonta. Tärkeimmät metaboliitit ihmisessä ovat N-3,5-dimetyyli-gludantaani, 4- ja 6-hydroksimemantiinin isomeerinen seos ja 1-nitroso-3,5-dimetyyli-adamantaani. Nämä metaboliitit eivät toimi NMDA-antagonisteina. Sytokromi P 450:n aiheuttamaa metaboliaa ei ole havaittu in vitro -tutkimuksessa.
Tutkimuksessa, jossa käytettiin suun kautta annettua 14C-memantiinia, keskimäärin 84 % annoksesta poistui 20 päivän kuluessa ja yli 99 % erittyi munuaisten kautta.
Eliminaatio
Memantiini poistuu elimistöstä monoeksponentiaalisesti ja saavuttaa lopullisen t½:n 60-100 tunnissa. Vapaaehtoisilla, joiden munuaiset toimivat normaalisti, kokonaispuhdistuma (Cltot) oli 170 ml/min/1,73 m2 ja osa munuaisten kautta tapahtuvasta kokonaispuhdistumasta saavutettiin tubuluserityksellä.
Munuaisissa tapahtuvaan käsittelyyn liittyy myös uudelleenimeytymistä munuaistiehyistä, minkä aiheuttavat todennäköisesti kationiset kuljetusproteiinit. Mikäli virtsa on emäksistä, memantiinin puhdistuma munuaisten kautta voi vähentyä kertoimella 7-9 (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Virtsan muuttuminen emäksiseksi voi johtua muun muassa äkillisistä ruokavalion muutoksista, esimerkiksi sekaravinnon syöjästä vegetaariksi, tai antasidien runsaasta käytöstä.
Lineaarisuus
Vapaaehtoisilla tehdyissä tutkimuksissa on todettu, että farmakokinetiikka on lineaarista 10-40 mg:n annosvälillä.
Farmakokineettiset/farmakodynaamiset suhteet
Memantiinin 20 mg vuorokausiannoksella aivo-selkäydinnesteen pitoisuus vastaa memantiinin ki-arvoa (ki = inhibitiovakio), joka on 0,5 µmol ihmisen frontaaliaivokuoressa.
Prekliiniset tiedot turvallisuudesta
Rotilla tehdyissä lyhytaikaisissa tutkimuksissa memantiini on muiden NMDA-antagonistien tapaan aiheuttanut hermojen vakuolisaatiota ja nekroosia (Olney-leesioita) vasta annoksilla, jotka aiheuttavat erittäin korkeita huippupitoisuuksia seerumissa. Vakuolisaatiota ja nekroosia edelsivät ataksia ja muut prekliiniset oireet. Koska vaikutuksia ei ole todettu jyrsijöillä tai muilla eläimillä tehdyissä pitkäaikaistutkimuksissa, näiden havaintojen kliinistä merkitystä ei tunneta.
Silmän muutoksia havaittiin vaihtelevasti jyrsijöillä ja koirilla tehdyissä toistetun annoksen toksisuustutkimuksissa, mutta ei apinoilla tehdyissä tutkimuksissa. Memantiinin kliinisiin tutkimuksiin liittyvissä erityisissä silmätutkimuksissa ei havaittu silmämuutoksia.
Jyrsijöissä havaittiin memantiinin lysosomeihin kertymisestä johtuvaa fosfolipidoosia keuhkomakrofageissa. Vaikutus on tunnettu muilla kationiamfifiilisia ominaisuuksia omaavilla vaikuttavilla aineilla. Tämän kertymisen ja keuhkoissa havaitun vakuolisaation välillä on mahdollisesti yhteys. Vaikutus todettiin vain jyrsijöissä isoilla annoksilla. Näiden havaintojen kliinistä merkitystä ei tunneta.
Geenitoksisuutta ei ole havaittu memantiinille tehdyissä vakiotesteissä. Karsinogeenisuutta ei havaittu hiirillä ja rotilla tehdyissä elinikäistutkimuksissa. Memantiini ei ollut teratogeenista rotissa ja kaneissa edes emolle toksisilla annoksilla, eikä memantiinin ole todettu vaikuttavan haitallisesti hedelmällisyyteen. Rotilla tehdyissä kokeissa on havaittu sikiön kasvun vähenemistä altistumistasoilla, jotka ovat samat tai hieman korkeammat kuin ihmisille aiheutuva altistus.
Farmaseuttiset tiedot
Apuaineet
Tabletit
5/10/15/20 mg kalvopäällysteisten tablettien ydin
Mikrokiteinen selluloosa
Kroskarmelloosinatrium
Vedetön kolloidinen piidioksidi
Magnesiumstearaatti
5/10/15/20 mg kalvopäällysteisten tablettien päällys
Hypromelloosi
Makrogoli 400
Titaniumdioksidi (E 171)
10 mg kalvopäällysteisissä tableteissa lisäksi:
Rautaoksidi, keltainen (E 172)
15 mg ja 20 mg kalvopäällysteisissä tableteissa lisäksi:
Rautaoksidi, keltainen ja punainen (E 172)
Oraaliliuos
Kaliumsorbaatti
Sorbitoli (E420)
Puhdistettu vesi
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
Tabletit:
4 vuotta.
Oraaliliuos:
4 vuotta.
Avatun pullon sisältö on käytettävä 3 kuukauden kuluessa.
Säilytys
Tabletit:
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Oraaliliuos:
Säilytä alle 30 °C. Pulloa, johon on kiinnitetty pumppu, saa säilyttää ja kuljettaa vain pystyasennossa.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
MEMANTINE MERZ oraaliliuos
5 mg/pumpun painallus (L:ei) 50 ml (annospumppu) (31,33 €)
MEMANTINE MERZ tabletti, kalvopäällysteinen
5 mg+10 mg+15 mg+20 mg (L:ei) 7+7+7+7 fol (aloituspakkaus) (30,70 €)
10 mg (J) (L:ei) 30 fol (2,66 €), 100 fol (5,73 €)
20 mg (L:ei) 28 fol (3,85 €), 98 fol (8,09 €)
PF-selosteen tieto
10 mg tabletit: Läpipainopakkauksessa on 7,10, 14 tai 20 tablettia läpipainolevyä (Alu/PP) kohti. Pakkauskoot ovat 14, 28, 30, 42, 50, 56, 98, 100, 112 ja monipakkaukset, jotka sisältävät 840 (20 x 42), 980 (10 x 98) tai 1000 (20 x 50)tablettia.
20 mg tabletit: Pakkaukset sisältävät PVDC/PE/PVC/A1 -läpipainopakkauksia tai PP/A1 -läpipainolevyjä, joissa kussakin on 14 kalvopäällysteistä tablettia. Pakkauskoot: 14, 28, 42, 56, 98 tai monipakkaukset jotka sisältävät 840 (20 x 42) kalvopäällysteistä tablettia.
5 mg+10 mg+15 mg+20 mg tabletit (aloituspakkaus): Kukin pakkaus sisältää 28 kalvopäällysteistä tablettia neljässä PVDC/PE/PVC/Al- tai PP/Al-läpipainopakkauksessa, joissa kussakin on 7 Memantine Merz 5 mg kalvopäällysteistä tablettia, 7 Memantine Merz 10 mg kalvopäällysteistä tablettia, 7 Memantine Merz 15 mg kalvopäällysteistä tablettia ja 7 Memantine Merz 20 mg kalvopäällysteistä tablettia.
5 mg/pumpun painallus oraaliliuos: 50 ml (ja 10 x 50 ml) ruskeissa lasipulloissa (hydrolyyttisyysluokka II) ja 100 ml ruskeissa lasipulloissa (hydrolyyttisyysluokka III).
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
5 mg tabl.:
Valkoisia tai luonnonvalkoisia, soikeita, kalvopäällysteisiä tabletteja, joiden toisella puolella on kaiverrus ’5’ ja toisella puolella kaiverrus ’MEM’ (tabletin pituus: noin 8,0 mm, tabletin leveys: noin 4,0 mm).
10 mg tabl.:
Vaaleankeltaisia/keltaisia, soikeita, kalvopäällysteisiä tabletteja, joiden toisella puolella jakouurteen oikealla ja vasemmalla puolella on kaiverrus ”M” ja toisella puolella kaiverrukset ”1” ja ”0” jakouurteen vasemmalla ja oikealla puolella (tabletin pituus: noin 11,0 mm, tabletin leveys: noin 5,0 mm). Tabletti voidaan jakaa yhtä suuriin annoksiin.
15 mg tabl.:
Oranssin värisiä, soikeita, kalvopäällysteisiä tabletteja, joiden toisella puolella on kaiverrus ’15’ ja toisella puolella kaiverrus ’MEM’ (tabletin pituus: noin 12,0 mm, tabletin leveys: noin 6,3 mm).
20 mg tabl.:
Vaaleanpunaisia, soikeita, kalvopäällysteisiä tabletteja, joiden toisella puolella on kaiverrus ’20’ ja toisella puolella kaiverrus ’MEM’ (tabletin pituus: noin 13,0 mm, tabletin leveys: noin 7,0 mm).
Oraaliliuos:
Oraaliliuos on kirkas ja väritön tai vaaleankeltainen.
Käyttö- ja käsittelyohjeet
Ei erityisohjeita.
Memantine Merz 5 mg/pumpun painallus oraaliliuos
Ennen ensimmäistä käyttöä annostelupumppu kierretään kiinni pulloon. Kierrekorkki irrotetaan pullosta kääntämällä korkkia vastapäivään ja avaamalla se kokonaan (kuva 1).
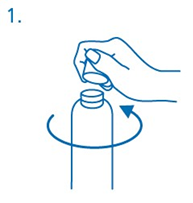
Annospumpun kiinnitys pulloon:
Annospumppu otetaan muovipussista (kuva 2) ja asetetaan pullon päälle työntäen samalla muovinen nousuputki varovasti pulloon. Annospumppu kierretään myötäpäivään lujasti kiinni pullonkaulaan (kuva 3). Se kierretään paikalleen vain kerran käytön alussa, eikä sitä pidä irrottaa.
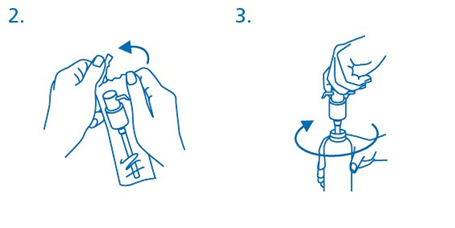
Annospumpun käyttö annosteluun:
Annospumpun päällä on kaksi asentoa, ja sitä on helppo kiertää vastapäivään (auki) ja myötäpäivään (kiinni). Annospumpun päätä ei saa painaa, kun se on kiinni-asennossa. Oraaliliuosta voi annostella vain auki-asennossa. Annostelua varten pumpun päätä pitää kiertää nuolen suuntaan noin kahdeksasosa kierrosta, kunnes tuntuu vastus (kuva 4).
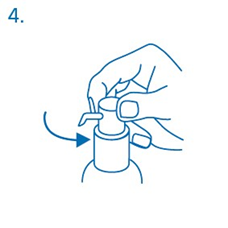
Sitten annospumppu on valmis käyttöön.
Annospumpun valmistelu:
Annospumpusta ei vielä ensimmäisellä painalluksella tule oikeaa oraaliliuosannosta. Siksi pumppu täytyy valmistella käyttöön painamalla sen pää pohjaan saakka viisi kertaa peräkkäin (kuva 5).
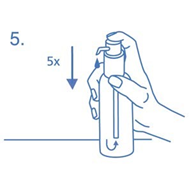
Pumpusta tässä vaiheessa tuleva oraaliliuos heitetään pois. Kun pumpun pään painaa seuraavan kerran pohjaan asti (vastaa 1 pumpun painallusta), pumpusta tulee oikeansuuruinen annos (1 pumpun painallus vastaa 0,5 ml:aa oraaliliuosta ja sisältää 5 mg memantiinihydrokloridia, joka on oraaliliuoksen vaikuttava aine; kuva 6).
Annospumpun oikea käyttö:
Pullo pitää asettaa tasaiselle vaakapinnalle, kuten pöydälle, ja sitä pitää aina käyttää pystyasennossa. Suuttimen alle pitää asettaa vesilasi tai lusikka, ja annospumpun pää pitää painaa rauhallisesti ja napakasti (ei liian hitaasti) pohjaan asti (kuva 7, kuva 8).
Otteen annospumpun päästä voi sitten irrottaa, ja pumppu on valmis seuraavaan painallukseen.
Annospumppua saa käyttää vain pullossa olevan memantiinihydrokloridiliuoksen annosteluun, ei muiden aineiden annosteluun eikä muihin säiliöihin kiinnitettynä. Ellei pumppu toimi kuvatulla tavalla, kun sitä käyttää ohjeiden mukaan oikeaan tarkoitukseen, potilaan pitää ottaa yhteys hoitavaan lääkäriin tai apteekkiin. Annospumppu on suljettava käytön jälkeen.
Korvattavuus
MEMANTINE MERZ oraaliliuos
5 mg/pumpun painallus 50 ml
MEMANTINE MERZ tabletti, kalvopäällysteinen
5 mg+10 mg+15 mg+20 mg 7+7+7+7 fol
10 mg 30 fol, 100 fol
20 mg 28 fol, 98 fol
- Peruskorvaus (40 %).
ATC-koodi
N06DX01
Valmisteyhteenvedon muuttamispäivämäärä
19.06.2025
Yhteystiedot
Junakatu 9, Logomo Byrå
20100 Turku
02 276 5000
www.lundbeck.fi
suomi@lundbeck.com
www.skitsofreniainfo.fi, www.masennusinfo.fi, www.migreeniinfo.fi
