LEVEMIR FLEXPEN injektioneste, liuos, esitäytetty kynä 100 U/ml, LEVEMIR PENFILL injektioneste, liuos, sylinteriampulli 100 U/ml
Vaikuttavat aineet ja niiden määrät
Levemir Penfill
1 ml liuosta sisältää 100 yksikköä detemirinsuliinia* (vastaten 14,2 mg). 1 sylinteriampulli sisältää 3 ml vastaten 300 yksikköä.
Levemir FlexPen
1 ml liuosta sisältää 100 yksikköä detemirinsuliinia* (vastaten 14,2 mg). 1 esitäytetty kynä sisältää 3 ml vastaten 300 yksikköä.
* Detemirinsuliini on tuotettu Saccharomyces cerevisiae -hiivassa yhdistelmä-DNA-tekniikalla.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, liuos.
Kliiniset tiedot
Käyttöaiheet
Levemir on tarkoitettu aikuisten ja 1-vuotiaiden ja sitä vanhempien lasten ja nuorten diabetes mellituksen hoitoon.
Annostus ja antotapa
Annostus
Insuliinianalogien, joihin detemirinsuliini kuuluu, pitoisuus ilmaistaan yksiköissä, kun taas ihmisinsuliinin pitoisuus ilmaistaan kansainvälisissä yksiköissä. Yksi yksikkö detemirinsuliinia vastaa yhtä kansainvälistä yksikköä ihmisinsuliinia.
Levemir-insuliinia voidaan käyttää yksinään perusinsuliinina tai yhdessä ateriainsuliinin kanssa. Sitä voidaan käyttää myös yhdessä oraalisten diabeteslääkkeiden ja/tai GLP-1-reseptoriagonistien kanssa.
Kun Levemir-insuliinia käytetään yhdessä oraalisten diabeteslääkkeiden kanssa tai GLP-1-reseptoriagonistien lisäksi, Levemir-insuliinia suositellaan käytettäväksi kerran vuorokaudessa, aloittaen annoksella 0,1–0,2 yksikköä/kg tai 10 yksikköä aikuispotilailla. Levemir-annos tulee määrittää yksilöllisesti potilaan tarpeiden mukaisesti.
Kun GLP-1-reseptoriagonisti lisätään Levemir-hoitoon, on suositeltavaa pienentää Levemir-annosta 20 % hypoglykemiariskin minimoimiseksi. Myöhemmin annosta tulee säätää yksilöllisesti.
Yksilöllisen annoksen säätämiseen suositellaan aikuisille seuraavaa kahta ohjetta:
Tyypin 2 diabetesta sairastavien aikuispotilaiden annoksen säätäminen:
Keskimääräinen itse mitattu plasman glukoosipitoisuus (P-Gluk) ennen aamiaista | Levemir-annoksen muutos |
> 10,0 mmol/l (180 mg/dl) | +8 yksikköä |
9,1–10,0 mmol/l (163–180 mg/dl) | +6 yksikköä |
8,1–9,0 mmol/l (145–162 mg/dl) | +4 yksikköä |
7,1–8,0 mmol/l (127–144 mg/dl) | +2 yksikköä |
6,1–7,0 mmol/l (109–126 mg/dl) | +2 yksikköä |
4,1–6,0 mmol/l (73–108 mg/dl) | Ei muutosta annokseen (tavoite) |
Jos yksi itse mitattu plasman glukoosipitoisuus | |
3,1–4,0 mmol/l (56–72 mg/dl) | -2 yksikköä |
< 3,1 mmol/l (< 56 mg/dl) | -4 yksikköä |
Yksinkertainen ohje, jonka avulla tyypin 2 diabetesta sairastava aikuispotilas voi säätää annosta itse:
Keskimääräinen itse mitattu plasman glukoosipitoisuus (P-Gluk) ennen aamiaista | Levemir-annoksen muutos |
> 6,1 mmol/l (> 110 mg/dl) | +3 yksikköä |
4,4–6,1 mmol/l (80–110 mg/dl) | Ei muutosta annokseen (tavoite) |
< 4,4 mmol/l (< 80 mg/dl) | -3 yksikköä |
Kun Levemir-insuliinia käytetään osana perusinsuliini-ateriainsuliinihoitoa, tulee Levemir-insuliinia antaa kerran tai kaksi kertaa vuorokaudessa potilaan tarpeiden mukaisesti. Levemir-insuliinin annos tulee määrittää yksilöllisesti.
Annoksen tarkistus voi olla tarpeen, jos potilaan fyysinen rasitus lisääntyy, tavanomainen ruokavalio muuttuu tai hänellä on muu samanaikainen sairaus.
Kun annosta muutetaan glukoositasapainon parantamiseksi, potilaita tulee neuvoa tiedostamaan hypoglykemiaoireet.
Erityiset potilasryhmät
Iäkkäät (≥ 65-vuotiaat)
Levemir-insuliinia voidaan käyttää iäkkäiden potilaiden hoitoon. Verenglukoosin seurantaa on tehostettava ja Levemir-insuliinin annosta on säädettävä yksilöllisesti, jos potilas on iäkäs.
Munuaisten tai maksan vajaatoiminta
Munuaisten tai maksan vajaatoiminta saattaa vähentää potilaan insuliinin tarvetta.
Verenglukoosin seurantaa on tehostettava ja Levemir-insuliinin annosta on säädettävä yksilöllisesti, jos potilaalla on munuaisten tai maksan vajaatoiminta.
Pediatriset potilaat
Levemir-insuliinia voidaan käyttää nuorilla ja lapsilla 1 ikävuodesta lähtien (ks. kohta Farmakodynamiikka). Kun perusinsuliini vaihdetaan Levemir-insuliiniksi, perus- ja ateriainsuliinien annosten pienentämistä pitää harkita yksilökohtaisesti hypoglykemiariskin minimoimiseksi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Verenglukoosin seurantaa on tehostettava ja Levemir-insuliinin annosta on säädettävä yksilöllisesti, jos potilas on lapsi tai nuori.
Levemir-insuliinin turvallisuutta ja tehoa ei ole osoitettu alle 1-vuotiailla lapsilla.
Tietoja ei ole saatavilla.
Siirtyminen muista insuliinivalmisteista
Potilaan vaihtaessa toisesta pitkä- tai ylipitkävaikutteisesta insuliinivalmisteesta, annosta ja annoksen ajoitusta voidaan joutua muuttamaan (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Verenglukoosin tarkka seuranta on suositeltavaa siirtymisvaiheen aikana ja heti sitä seuraavina ensimmäisinä viikkoina (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Muuta samanaikaisesti annettavaa diabeteksen lääkehoitoa (oraalisten diabeteslääkkeiden tai lisäksi käytettävän lyhyt/pikavaikutteisen insuliinivalmisteen annosta ja/tai annoksen ajoitusta) voidaan joutua säätämään.
Antotapa
Levemir on ylipitkävaikutteinen insuliinianalogi, jota käytetään perusinsuliinina. Levemir annetaan vain ihonalaisena pistoksena. Levemir-insuliinia ei saa antaa laskimoon, koska seurauksena voi olla vaikea hypoglykemia. Lihakseen pistämistä on vältettävä. Levemir-insuliinia ei saa käyttää insuliini-infuusiopumpuissa.
Levemir pistetään ihon alle vatsanpeitteisiin, reiteen, olkavarteen, hartialihaksen alueelle tai pakaraan. Pistoskohtia on vaihdeltava sovitun pistosalueen sisällä lipodystrofian ja ihoamyloidoosin vaaran pienentämiseksi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset). Vaikutuksen kesto vaihtelee annoksen suuruuden, pistoskohdan, verenkierron, lämpötilan ja fyysisen rasituksen mukaan. Injektio voidaan antaa mihin vuorokaudenaikaan tahansa, mutta se tulee antaa samaan aikaan joka päivä. Potilaille, jotka tarvitsevat kaksi annosta vuorokaudessa mahdollisimman hyvän verenglukoositasapainon saavuttamiseksi, ilta-annos voidaan antaa illalla tai nukkumaan mentäessä.
Yksityiskohtaiset käyttöohjeet on esitetty pakkausselosteessa.
Levemir Penfill
Anto insuliinin antolaitteella
Levemir Penfill on suunniteltu käytettäväksi Novo Nordiskin insuliinien annostelulaitteiden ja NovoFine- tai NovoTwist-neulojen kanssa. Levemir Penfill sopii vain insuliinikynällä ihon alle annettaviin pistoksiin. Jos anto ruiskulla on tarpeen, silloin on käytettävä injektiopulloa.
Levemir FlexPen
Anto FlexPen-kynällä
Levemir FlexPen on esitäytetty, värikoodattu insuliinikynä, joka on suunniteltu käytettäväksi enintään 8 mm pituisten, kertakäyttöisten NovoFine- tai NovoTwist-neulojen kanssa. FlexPen-insuliinikynällä voi valita 1–60 yksikön annoksen yhden yksikön välein. Levemir FlexPen sopii vain ihon alle annettaviin pistoksiin. Jos anto ruiskulla on tarpeen, silloin on käytettävä injektiopulloa.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai jollekin valmisteen apuaineelle (ks. kohta Apuaineet).
Varoitukset ja käyttöön liittyvät varotoimet
Potilaan tulisi kysyä neuvoa lääkäriltä ennen matkustamista aikavyöhykkeeltä toiselle, sillä insuliinin ottamisen ja aterioiden ajankohtia voidaan joutua muuttamaan.
Hyperglykemia
Riittämätön annostus tai hoidon keskeytyminen saattavat johtaa hyperglykemiaan ja diabeettiseen ketoasidoosiin erityisesti tyypin 1 diabeteksessa. Hyperglykemian ensimmäiset oireet ilmaantuvat yleensä vähitellen tuntien tai päivien kuluessa. Oireisiin sisältyvät jano, tihentynyt virtsaaminen, pahoinvointi, oksentelu, uneliaisuus, ihon punoitus ja kuivuminen, suun kuivuminen, ruokahaluttomuus sekä asetonin haju hengityksessä. Tyypin 1 diabeteksessa hoitamaton hyperglykemia johtaa lopulta diabeettiseen ketoasidoosiin, joka saattaa johtaa kuolemaan.
Hypoglykemia
Aterian laiminlyöminen tai suunnittelematon, voimakas fyysinen rasitus voi johtaa hypoglykemiaan.
Lapsilla pitää hypoglykemiariskin minimoimiseksi noudattaa huolellisuutta insuliiniannosten (erityisesti perusinsuliini-ateriainsuliinihoidossa) sovittamisessa ruokailuun ja fyysiseen aktiivisuuteen.
Hypoglykemiaa saattaa esiintyä, jos insuliiniannos on liian suuri suhteessa insuliinin tarpeeseen. Jos potilaalla on hypoglykemia tai epäillään olevan hypoglykemia, Levemir-insuliinia ei saa pistää. Potilaan verenglukoosin tasaantumisen jälkeen tulee harkita annoksen säätämistä (ks. kohdat Haittavaikutukset ja Yliannostus).
Potilaat, joiden verenglukoositasapaino paranee huomattavasti esim. tehostetun insuliinihoidon ansiosta, saattavat kokea muutoksen tavanomaisissa hypoglykemiasta varoittavissa oireissaan. Potilaille tulee kertoa asiasta ja antaa asianmukaista ohjausta. Tavanomaiset varoittavat oireet saattavat hävitä diabetesta pitkään sairastaneilta potilailta.
Muut sairaudet, varsinkin tulehdukset ja kuumetilat, yleensä lisäävät potilaan insuliinin tarvetta. Munuais- tai maksasairaus tai lisämunuaisen, aivolisäkkeen tai kilpirauhasen toimintahäiriöt voivat aiheuttaa muutoksia insuliiniannokseen.
Kun potilaat siirtyvät käyttämään erityyppistä insuliinivalmistetta, hypoglykemiasta varoittavat oireet voivat tulla vaikeammin havaittaviksi tai erilaisiksi kuin aikaisempaa insuliinia käytettäessä.
Siirtyminen muista insuliinivalmisteista
Kun potilas siirtyy käyttämään toisentyyppistä tai toisen valmistajan insuliinia, on siirtyminen toteutettava tarkassa lääkärin valvonnassa. Kun muutetaan insuliinin vahvuutta, tavaramerkkiä (valmistaja), tyyppiä, alkuperää (eläininsuliini, ihmisinsuliini tai ihmisinsuliinianalogi) ja/tai valmistusmenetelmää (yhdistelmä-DNA-tekniikalla valmistettu insuliini vs. eläinperäinen insuliini), annoksen muutos saattaa olla tarpeen. Toisentyyppisestä insuliinista Levemir-insuliiniin siirtyvien potilaiden annosta saatetaan joutua muuttamaan verrattuna potilaiden tavallisesti käyttämien insuliinien annokseen. Jos annoksen säätö on tarpeen, säätämisen tarve voi ilmaantua ensimmäisen annoksen tai muutamien ensimmäisten viikkojen tai kuukausien aikana.
Pistoskohdan reaktiot
Kuten mitä tahansa insuliinihoitoa käytettäessä, pistoskohdan reaktioita (kipu, punoitus, nokkosihottuma, tulehdus, mustelmat, turvotus ja kutina) voi esiintyä. Pistoskohdan jatkuva vaihtaminen pistosalueella voi auttaa vähentämään tai ehkäisemään näitä reaktioita. Reaktiot yleensä häviävät muutaman päivän tai muutaman viikon aikana. Harvoissa tapauksissa Levemir-hoito pitää lopettaa pistoskohdan reaktioiden vuoksi.
Iho ja ihonalainen kudos
Potilaita on ohjeistettava vuorottelemaan pistoskohtaa jatkuvasti lipodystrofian ja ihoamyloidoosin kehittymisen vaaran vähentämiseksi. Jos insuliinin pistämistä jatketaan niihin kohtiin, joilla esiintyy näitä muutoksia, on olemassa mahdollinen vaara, että insuliinin imeytyminen hidastuu ja verensokerin hallinta heikentyy. Injektiokohdan äkillisestä vaihtamisesta terveelle alueelle on ilmoitettu aiheutuvan hypoglykemiaa. Verensokerin seurantaa suositellaan pistoskohdan vaihtamisen jälkeen alueelta, jolla esiintyy muutoksia, terveelle alueelle, ja diabeteslääkkeiden annoksen muuttamista voidaan harkita.
Hypoalbuminemia
Vaikeasta hypoalbuminemiasta kärsivistä potilaista on niukasti tietoja. Näitä potilaita hoidettaessa suositellaan huolellista seurantaa.
Levemir-valmisteen yhteiskäyttö pioglitatsonin kanssa
Sydämen vajaatoimintatapauksia on raportoitu esiintyneen, kun pioglitatsonia oli käytetty yhdessä insuliinin kanssa, erityisesti potilailla, joilla on riskitekijöitä sydämen vajaatoiminnan kehittymiselle. Tämä tulee pitää mielessä, jos harkitaan pioglitatsonin ja Levemir-valmisteen yhteiskäyttöä. Jos valmisteita käytetään yhdessä, potilailta tulee seurata sydämen vajaatoiminnan, painonnousun ja turvotuksen merkkejä ja oireita. Pioglitatsonihoito tulee lopettaa, jos sydänoireet pahenevat.
Vahingossa tapahtuvien sekaannusten/lääkitysvirheiden välttäminen
Potilaat täytyy ohjeistaa aina tarkistamaan insuliinin nimilippu ennen jokaista pistosta, jotta vältetään vahingossa tapahtuvat sekaannukset Levemir-insuliinin ja muiden insuliinivalmisteiden välillä.
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Yhteisvaikutukset
Useiden lääkkeiden tiedetään vaikuttavan glukoosiaineenvaihduntaan.
Seuraavat aineet saattavat vähentää potilaan insuliinin tarvetta:
Suun kautta otettavat diabeteslääkkeet, GLP-1-reseptoriagonistit, monoamiinioksidaasin (MAO:n) estäjät, beetasalpaajat, angiotensiinikonvertaasin (ACE:n) estäjät, salisylaatit, anaboliset steroidit ja sulfonamidit.
Seuraavat aineet saattavat lisätä potilaan insuliinin tarvetta:
Suun kautta otettavat ehkäisyvalmisteet, tiatsidit, glukokortikoidit, kilpirauhashormonit, sympatomimeetit, kasvuhormoni ja danatsoli.
Beetasalpaajat saattavat peittää hypoglykemian oireet.
Sekä oktreotidi että lanreotidi voivat joko lisätä tai vähentää insuliinin tarvetta.
Alkoholi saattaa tehostaa tai vähentää insuliinin verenglukoosia alentavaa vaikutusta.
Raskaus ja imetys
Raskaus
Levemir-insuliinin käyttöä raskaana olevilla, diabetesta sairastavilla naisilla on arvioitu kliinisessä tutkimuksessa ja myyntiluvan myöntämisen jälkeisessä prospektiivisessa non-interventionaalisessa turvallisuustutkimuksessa (ks. kohta Farmakodynamiikka). Kauppaantuonnin jälkeen kerätyt tiedot Levemir-insuliinin käytöstä yli 4 500 raskaudessa eivät viittaa epämuodostumia aiheuttavan, fetaalisen tai neonataalisen toksisuuden riskin suurenemiseen. Levemir-hoitoa voidaan harkita käytettäväksi raskauden aikana, jos hoito on kliinisesti tarpeen.
Raskaana olevien diabeetikkonaisten tehostettua verenglukoosikontrollia ja hoidon seurantaa suositellaan raskautta suunniteltaessa ja koko raskauden ajan. Insuliinin tarve yleensä vähenee raskauden ensimmäisen kolmanneksen aikana ja lisääntyy myöhemmin toisen ja kolmannen kolmanneksen aikana. Synnytyksen jälkeen insuliinin tarve tavallisesti palaa nopeasti ennen raskautta olleisiin arvoihin.
Imetys
Ei tiedetä, erittyykö detemirinsuliini ihmisen rintamaitoon. Imetyksen kautta saadusta detemirinsuliinista ei ole odotettavissa metabolisia vaikutuksia rintaruokituille vastasyntyneille/imeväisille, sillä peptidinä detemirinsuliini hajoaa aminohapoiksi ihmisen ruoansulatuskanavassa.
Imettävien äitien insuliiniannosta ja ruokavaliota voidaan joutua muuttamaan.
Hedelmällisyys
Eläinkokeissa ei ole havaittu haitallisia hedelmällisyyteen liittyviä vaikutuksia.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Potilaan keskittymis- ja reaktiokyky saattavat heikentyä hypoglykemian seurauksena. Tämä voi aiheuttaa vaaratilanteita silloin, kun keskittymis- ja reaktiokykyä erityisesti tarvitaan (esim. ajaminen tai koneiden käyttö).
Potilaita tulee neuvoa ryhtymään varotoimiin hypoglykemian välttämiseksi ajon aikana. Tämä on erityisen tärkeää niille diabeetikoille, joiden tuntemukset hypoglykemiasta varoittavista oireista ovat vähentyneet tai puuttuvat tai joilla on usein ollut hypoglykemia. Tällaisissa tapauksissa ajamisen tarkoituksenmukaisuutta on syytä harkita tarkkaan.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Levemir-insuliinia käyttävillä potilailla havaitut haittavaikutukset johtuvat pääasiassa insuliinin farmakologisesta vaikutuksesta. Hoidetuista potilaista 12 %:lla arvioidaan esiintyvän haittavaikutuksia.
Hoidon aikana yleisimmin raportoitu haittavaikutus on hypoglykemia, ks. kohta Tähdellä (*) merkittyjen haittavaikutusten kuvaus.
Kliinisten tutkimusten perusteella tiedetään, että noin 6 %:lla Levemir-insuliinilla hoidetuista potilaista esiintyy vakavaa hypoglykemiaa, jolloin tarvitaan toisen henkilön apua.
Levemir-hoidon yhteydessä esiintyy reaktioita pistoskohdassa useammin kuin ihmisinsuliinihoidossa. Pistoskohdan reaktioita ovat kipu, punoitus, nokkosihottuma, tulehdus, mustelmat, turvotus ja kutina. Suurin osa pistoskohdan reaktioista on lieviä ja ohimeneviä eli ne normaalisti häviävät hoitoa jatkettaessa muutaman päivän tai muutaman viikon kuluessa.
Insuliinihoidon alkuvaiheessa saattaa esiintyä silmien taittohäiriöitä ja turvotusta; nämä oireet ovat yleensä ohimeneviä. Verenglukoositasapainon nopeaan korjaantumiseen voi liittyä tila, jota kutsutaan nimellä akuutti kivulias neuropatia. Se on yleensä tilapäinen. Insuliinihoidon tehostamisella aikaansaatuun äkilliseen glukoositasapainon paranemiseen saattaa liittyä diabeettisen retinopatian tilapäinen vaikeutuminen, kun taas pitkäaikaisen glukoositasapainon paraneminen vähentää diabeettisen retinopatian etenemisriskiä.
Taulukoitu haittavaikutusluettelo
Alla olevassa luettelossa esitetyt haittavaikutukset perustuvat kliinisistä tutkimuksista saatuihin tietoihin ja ne on luokiteltu MedDRA:n esiintymistiheyksien ja elinjärjestelmäluettelon mukaan. Esiintymistiheydet on määritelty seuraavasti: Hyvin yleinen (≥ 1/10); yleinen (≥ 1/100, < 1/10); melko harvinainen (≥ 1/1 000, < 1/100); harvinainen (≥ 1/10 000, < 1/1 000); hyvin harvinainen (< 1/10 000) ja tuntematon (koska saatavissa oleva tieto ei riitä arviointiin).
Immuunijärjestelmä | Melko harvinainen – Allergiset reaktiot, mahdollisesti allergiset reaktiot, nokkosihottuma, ihottuma, iho-oireiden puhkeaminen* |
Hyvin harvinainen – Anafylaktiset reaktiot* | |
Aineenvaihdunta ja ravitsemus | Hyvin yleinen – Hypoglykemia* |
Hermosto | Harvinainen – Perifeerinen neuropatia (kivulias neuropatia) |
Silmät | Melko harvinainen – Taittohäiriöt |
Melko harvinainen – Diabeettinen retinopatia | |
Iho ja ihonalainen kudos | Melko harvinainen – Lipodystrofia* |
Tuntematon – Ihoamyloidoosi*† | |
Yleisoireet ja antopaikassa todettavat haitat | Yleinen – Pistoskohdan reaktiot |
Melko harvinainen – Turvotus |
* ks. kohta Haittavaikutukset, Tiettyjen haittavaikutusten kuvaus.
† Myyntiintulon jälkeen ilmennyt lääkkeen aiheuttama haittavaikutus.
Tiettyjen haittavaikutusten kuvaus
Allergiset reaktiot, mahdollisesti allergiset reaktiot, nokkosihottuma, ihottuma, iho-oireiden puhkeaminen
Allergiset reaktiot, mahdollisesti allergiset reaktiot, nokkosihottuma, ihottuma ja iho-oireiden puhkeaminen ovat harvinaisia, kun Levemir-valmistetta käytetään basaali-bolus-hoitomallissa. Kolmessa kliinisessä tutkimuksessa ne ovat kuitenkin olleet yleisiä (todettu 2,2 % allergisia ja mahdollisesti allergisia reaktioita), kun Levemir-insuliinia on käytetty yhdessä oraalisten diabeteslääkkeiden kanssa.
Anafylaktiset reaktiot
Yleistynyt yliherkkyysreaktio (sisältää laajalle levinnyttä ihottumaa, kutinaa, hikoilua, ruoansulatushäiriöitä, angioneuroottista turvotusta, hengitysvaikeuksia, sydämentykytystä ja verenpaineen alenemista) on hyvin harvinainen, mutta saattaa olla hengenvaarallinen.
Hypoglykemia
Yleisimmin raportoitu haittavaikutus on hypoglykemia. Sitä saattaa esiintyä, jos insuliiniannos on liian suuri suhteessa insuliinin tarpeeseen. Vaikea hypoglykemia saattaa johtaa tajuttomuuteen ja/tai aiheuttaa kouristuksia, tilapäisen tai pysyvän aivojen toimintahäiriön tai jopa kuoleman. Hypoglykemian oireet ilmaantuvat yleensä yllättäen. Oireisiin saattaa sisältyä kylmänhikisyys, kalpea ja viileä iho, uupumus, hermostuneisuus tai vapina, ahdistus, epätavallinen väsymys tai heikkous, sekavuus, keskittymisvaikeudet, uneliaisuus, kova nälkä, näköhäiriöt, päänsärky, pahoinvointi ja sydämentykytys.
Iho ja ihonalainen kudos
Lipodystrofiaa (mukaan lukien lipohypertrofiaa ja lipoatrofiaa) ja ihoamyloidoosia voi ilmaantua pistoskohtaan. Ne viivästyttävät insuliinin paikallista imeytymistä. Pistoskohdan jatkuva vuorottelu sovitulla pistosalueella saattaa vähentää tai ehkäistä näitä muutoksia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Pediatriset potilaat
Kauppaantuonnin jälkeisessä käytössä ja kliinisissä tutkimuksissa lapsilla havaittujen haittavaikutusten määrä, tyyppi ja vaikeusaste ei ole eronnut diabetesta sairastavassa väestössä yleensä havaituista haittavaikutuksista.
Muut erityiset potilasryhmät
Kauppaantuonnin jälkeisessä käytössä ja kliinisissä tutkimuksissa iäkkäillä ja munuaisten tai maksan vajaatoimintaa sairastavilla potilailla havaittujen haittavaikutusten määrä, tyyppi ja vaikeusaste ei ole eronnut väestössä yleensä havaituista haittavaikutuksista.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Insuliinin yliannostukselle ei ole olemassa erityistä määritelmää. Hypoglykemia saattaa kuitenkin kehittyä vaiheittain, jos potilas saa liian suuria insuliiniannoksia verrattuna insuliinin tarpeeseen:
- Lievä hypoglykemia voidaan hoitaa antamalla suun kautta rypälesokeria tai sokeria sisältäviä tuotteita. Siksi on suositeltavaa, että diabeetikko pitää aina mukanaan sokeripitoisia tuotteita.
- Vaikea hypoglykemia, jolloin potilas on tajuton, voidaan hoitaa antamalla glukagonia (0,5–1 mg) lihakseen tai ihon alle tai antamalla glukoosia laskimoon. Lihaksensisäisen ja ihonalaisen glukagoni-injektion voi antaa riittävän koulutuksen saanut henkilö. Laskimonsisäisen glukoosin antaa terveydenhuollon ammattilainen. Glukoosia on annettava laskimoon, jos glukagonin antoon ei tule vastetta 10–15 minuutin kuluessa. On suositeltavaa, että tajunnan palattua potilaalle annetaan suun kautta hiilihydraatteja hypoglykemian uusiutumisen estämiseksi.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Diabeteslääkkeet. Insuliinit ja insuliinijohdokset, ylipitkävaikutteiset: ATC-koodi: A10AE05.
Vaikutusmekanismi ja farmakodynaamiset vaikutukset
Levemir-insuliini on liukeneva, ylipitkävaikutteinen insuliinianalogi, jolla on pitkittynyt vaikutusaika käytettäessä perusinsuliinina.
Levemir-insuliinin verenglukoosipitoisuutta alentava vaikutus perustuu glukoosin soluunoton helpottumiseen, kun insuliini sitoutuu lihas- ja rasvasolujen insuliinireseptoreihin, ja samanaikaiseen maksan glukoosin tuotannon estymiseen.
Levemir-insuliinin aika/vaikutusprofiili vaihtelee tilastollisesti merkitsevästi vähemmän kuin NPH (Neutral Protamine Hagedorn)-insuliinin aika/vaikutusprofiili ja on sen vuoksi ennakoitavampi. Tämän voi nähdä taulukon 1. yksilökohtaisista farmakodynaamisen kokonais- ja maksimivaikutuksen variaatiokertoimista (CV, Coefficient of Variation).
Taulukko 1. Levemir- ja NPH-insuliinin aika/vaikutusprofiilin yksilökohtainen vaihtelevuus
Farmakodynaaminen päätepiste | Levemir-insuliinin CV (%) | NPH-insuliinin CV (%) |
AUCGIR,0 - 24 h* | 27 | 68 |
GIRmax** | 23 | 46 |
* Kuvaajan alapuolinen pinta-ala ** Glukoosin infuusionopeuden p-arvo < 0,001 kaikissa Levemir-insuliinin vertailuissa
Levemir-insuliinin pitkittynyt vaikutus johtuu sen molekyylien voimakkaasta yhteenliittymisestä pistoskohdassa ja sitoutumisesta albumiiniin rasvahapposivuketjun välityksellä. Detemirinsuliini jakautuu perifeerisiin kohdekudoksiin hitaammin kuin NPH-insuliini. Näiden vaikutusta pidentävien mekanismien yhdistelmän ansiosta detemirinsuliinin imeytymis- ja vaikutusprofiili on toistettavampi kuin NPH-insuliinin.
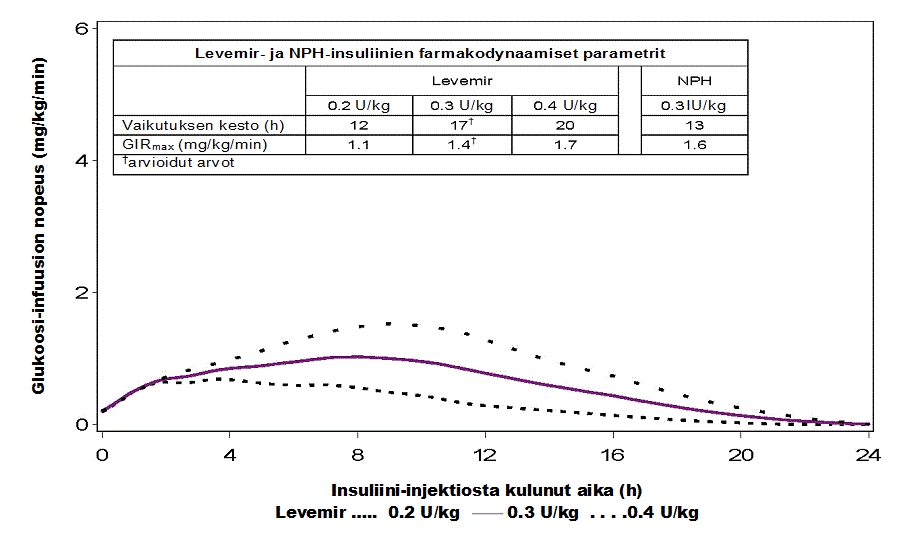
Kuva 1. Levemir-insuliinin vaikutusprofiilit tyypin 1 diabetesta sairastavissa potilaissa
Valmisteen vaikutus kestää 24 tuntiin saakka annoksesta riippuen, joten päivittäisiä antokertoja voi olla yksi tai kaksi. Jos valmistetta annetaan kahdesti vuorokaudessa, vakaa tila saavutetaan 2–3 antokerran jälkeen. Annosten ollessa 0,2–0,4 yksikköä/kg (U/kg), yli 50 % Levemir-insuliinin maksimitehosta on käytettävissä 3–4 tunnin - noin 14 tunnin aikavälillä annoksen ottamisesta.
Farmakodynaaminen vaste (maksimiteho, vaikutuksen kesto, kokonaisvaikutus) on suhteessa ihon alle annettuun annokseen.
Paastoplasman glukoosipitoisuuden (FPG) pienempi vaihtelu päivästä toiseen oli osoitettavissa verrattaessa Levemir-hoitoa NPH-hoitoon pitkäaikaisissa kliinisissä tutkimuksissa.
Tutkimukset tyypin 2 diabeetikoilla, joita hoidettiin perusinsuliinilla ja samanaikaisella oraalisella diabeteslääkkeellä osoittivat, että Levemir-insuliinia käytettäessä verenglukoositasapaino (HbA1C) vastaa NPH- ja glargininsuliinilla saavutettavaa tasoa ja Levemir-insuliinin käyttöön liittyi vähemmän painonnousua (katso alapuolella oleva taulukko 2.). Tutkimuksessa, jossa verrattiin glargininsuliiniin, Levemir-insuliinia oli mahdollista antaa kerran tai kaksi kertaa vuorokaudessa, kun taas glargininsuliini annettiin kerran vuorokaudessa. 55 % Levemir-insuliinilla hoidetuista potilaista lopetti 52 viikon hoidon kaksi kertaa vuorokaudessa annolla.
Taulukko 2. Painonmuutos insuliinihoidon jälkeen
Tutkimuksen kesto | Levemir-insuliini kerran vuorokaudessa | Levemir-insuliini 2 kertaa vuorokaudessa | NPH-insuliini | Glargininsuliini |
20 viikkoa | +0,7 kg | +1,6 kg | ||
26 viikkoa | +1,2 kg | +2,8 kg | ||
52 viikkoa | +2,3 kg | +3,7 kg | +4,0 kg |
Tutkimuksissa, joissa insuliinihoitoon on yhdistetty oraalinen diabeteslääke, yhdistelmähoito Levemir-insuliinin kanssa johti 61−65 % pienempään yöllisen hypoglykemian riskiin verrattuna NPH-insuliiniin.
Tyypin 2 diabeetikoille, jotka eivät saavuttaneet tavoitetta, kun heitä hoidettiin oraalisilla diabeteslääkkeillä, tehtiin avoin satunnaistettu kliininen tutkimus. Tutkimus aloitettiin 12 viikon sisäänajovaiheella, jonka aikana potilaat saivat liraglutidi + metformiini -hoitoa. Tänä aikana 61 % potilaista saavutti HbA1c -arvon, joka oli < 7 %. Ne 39 % potilaista, jotka eivät saavuttaneet tavoitetta, satunnaistettiin saamaan Levemir-insuliinia kerran päivässä lisättynä liraglutidi + metformiini -hoitoon tai he jatkoivat liraglutidi + metformiini -hoitoa 52 viikon ajan. Levemir-insuliinin lisääminen hoitoon pienensi HbA1c -arvoa edelleen 7,6 %:ista 7,1 %:iin 52 viikon jälkeen. Vakavia hypoglykemioita ei esiintynyt. Vakava hypoglykemiatapahtuma määritellään tilanteeksi, jolloin henkilö ei kyennyt hoitamaan itseään ja jos tarvittiin glukagonia tai laskimonsisäisesti annettua glukoosia. Katso taulukko 3.
Taulukko 3. Kliininen tutkimustieto – Levemir-insuliini lisättynä liraglutidi + metformiini -hoitoon
Tutkimusviikko | Satunnaistettu n=160 | Satunnaistettu n=149 | P-arvo | |
Keskimääräinen HbA1c:n muutos lähtöarvosta (%) | 0–26 viikkoa | -0,51 | 0,02 | < 0,0001 |
0–52 viikkoa | -0,50 | 0,01 | < 0,0001 | |
Potilaiden osuus, jotka saavuttivat HbA1c < 7 % -tavoitteen (%) | 0–26 viikkoa | 43,1 | 16,8 | < 0,0001 |
0–52 viikkoa | 51,9 | 21,5 | < 0,0001 | |
Painon muutos lähtöarvosta (kg) | 0–26 viikkoa | -0,16 | -0,95 | 0,0283 |
0–52 viikkoa | -0,05 | -1,02 | 0,0416 | |
Lievät hypoglykemiatapahtumat (potilasvuotta kohden) | 0–26 viikkoa | 0,286 | 0,029 | 0,0037 |
0–52 viikkoa | 0,228 | 0,034 | 0,0011 |
Liraglutidin (1,8 mg) lisäämisen tehon ja turvallisuuden vertaamiseksi lumelääkkeeseen tehtiin 26 viikkoa kestänyt satunnaistettu, kliininen kaksoissokkotutkimus. Tutkimus tehtiin riittämättömässä hoitotasapainossa olevilla tyypin 2 diabeetikoilla, joilla oli käytössään perusinsuliini metformiinin kanssa tai ilman metformiinia. Hypoglykemiariskin minimoimiseksi insuliiniannosta pienennettiin 20 % potilailla, joiden lähtötason HbA1c oli ≤ 8,0 %. Myöhemmin potilailla oli mahdollisuus nostaa insuliiniannostaan korkeintaan satunnaistamista edeltävälle tasolle. Levemir-insuliinia käytti perusinsuliinina 33 % (n=147) potilaista (97,3 % käytti metformiinia). Näillä potilailla liraglutidin lisäys johti suurempaan HbA1c:n laskuun (6,93 %:iin vs. 8,24 %:iin), suurempaan plasman glukoosipitoisuuden paastoarvon laskuun (7,20 mmol/l:iin vs. 8,13 mmol/l:iin) ja suurempaan painon laskuun (-3,47 kg vs. -0,43 kg) verrattuna lumelääkelisään. Näiden parametrien lähtöarvot olivat samanlaiset molemmissa ryhmissä. Havaittu lievien hypoglykemiatapahtumien esiintyvyys oli samankaltainen eikä vakavia hypoglykemiatapahtumia havaittu kummassakaan ryhmässä.
Perusinsuliini-ateriainsuliinihoitoa saavien tyypin 1 diabeetikkojen pitkäaikaisissa tutkimuksissa Levemir-insuliinia käyttäneiden diabeetikkojen paastoplasman glukoosipitoisuus oli parantunut NPH-insuliinia saaneisiin verrattuna. Levemir-insuliinilla saavutettu verenglukoositasapaino (HbA1c) vastasi NPH-insuliinilla saavutettua tasoa, yöllisen hypoglykemian riski oli pienempi eikä käyttöön liittynyt painonnousua.
Kliinisissä tutkimuksissa Levemir-insuliiniin ja NPH-insuliiniin liittyvät hypoglykemioiden esiintymistiheydet olivat samanlaiset basaali-bolushoidossa. Analysoitaessa yöllistä hypoglykemiaa tyypin 1 diabeetikoilla havaittiin Levemir-insuliinilla merkitsevästi pienempi lievän yöllisen hypoglykemian (mahdollisuus itsehoitoon ja kapillaariveren glukoosipitoisuus alle 2,8 mmol/l tai plasman glukoosipitoisuutena ilmaistuna alle 3,1 mmol/l) vaara kuin NPH-insuliinilla. Tyypin 2 diabeteksen yhteydessä eroa ei ollut.
Levemir-insuliinin käytön yhteydessä on havaittu vasta-ainemuodostusta. Sillä ei kuitenkaan näytä olevan vaikutusta verenglukoositasapainoon.
Raskaus
Myyntiluvan myöntämisen jälkeisessä prospektiivisessa non-interventionaalisessa turvallisuustutkimuksessa raskaana olevia naisia, joilla oli tyypin 1 tai tyypin 2 diabetes ja jotka olivat altistuneet Levemir-insuliinille (n = 727; elävänä syntyneitä lapsia oli 680) tai muille perusinsuliineille (n = 730; elävänä syntyneitä lapsia oli 668), seurattiin raskauden lopputulosten suhteen.
Levemir-insuliinin ja muiden perusinsuliinien välillä ei todettu tilastollisesti merkitseviä eroja epämuodostumapäätetapahtuman eri komponenteissa (merkittävästä synnynnäisestä epämuodostumasta johtuvissa raskaudenkeskeytyksissä, merkittävissä synnynnäisissä epämuodostumissa eikä vähäisissä synnynnäisissä epämuodostumissa). Tutkimuksen tulokset viittasivat siihen, että Levemir-insuliiniin ei liity suurentunutta haitallisten raskauden lopputulosten riskiä verrattuna muihin perusinsuliineihin, jos naisella on entuudestaan diabetes.
Levemir-insuliinia tutkittiin avoimessa, satunnaistetussa, kontrolloidussa kliinisessä tutkimuksessa raskaana olevilla tyypin 1 diabetesta sairastavilla naisilla (n = 310). Naisia hoidettiin perusinsuliini-ateriainsuliinihoitomallia käyttäen. Perusinsuliinina oli joko Levemir-insuliini (n = 152) tai NPH-insuliini (n = 158), molemmat yhdistettynä NovoRapid-insuliiniin.
Mitattaessa HbA1c-arvo raskausviikolla 36 Levemir ei ollut NPH-insuliinia huonompi ja HbA1c-keskiarvon lasku oli molemmilla samanlainen koko raskauden ajan.
Pediatriset potilaat
Levemir-insuliinin tehoa ja turvallisuutta on tutkittu 12 kuukauden ajan lapsille ja nuorille (n = 1 045 kokonaisuudessaan) tehdyssä kolmessa satunnaistetussa kontrolloidussa kliinisessä tutkimuksessa; tutkimuksissa oli 1–5-vuotiaita lapsia kaikkiaan 167. Tutkimukset osoittivat, että saavutettu verenglukoositasapaino (HbA1C) oli Levemir-insuliinilla verrattavissa NPH-insuliinilla ja degludekinsuliinilla saavutettuun tasapainoon, kun käytettiin perusinsuliini-ateriainsuliinihoitoa ja käytettiin 0,4 %:in vertailukelpoisuusmarginaalia (non-inferiority). Levemir-insuliinia ja degludekinsuliinia verranneessa tutkimuksessa hyperglykemiatapahtumien, joihin liittyi ketoosi, esiintymistiheys oli Levemir-hoidossa merkitsevästi suurempi, sillä Levemir-hoidossa esiintyi 1,09 tapahtumaa ja degludekinsuliinihoidossa 0,68 tapahtumaa potilasaltistusvuotta kohden. Levemir-insuliinia käytettäessä havaittiin vähemmän painonnousua (SD -arvo, paino sukupuoleen ja ikään suhteutettuna) kuin NPH-insuliinia käytettäessä.
Yli 2-vuotiaille lapsille tehtyä tutkimusta jatkettiin ylimääräisellä 12 kuukaudella (kokonaisuudessaan 24 kuukauden tutkimustiedot) vasta-ainemuodostuksen arvioimiseksi pitkäaikaisen Levemir-hoidon jälkeen. Ensimmäisen vuoden aikana insuliinin vasta-aineiden määrä lisääntyi. Sen jälkeen insuliinin vasta-aineiden määrä väheni tasolle, joka oli hieman tutkimusta edeltävää tasoa korkeampi. Tulokset osoittavat, että vasta-aineiden muodostuksella ei ollut negatiivista vaikutusta verenglukoositasapainoon eikä Levemir-annokseen.
Tyypin 2 diabetes mellitusta sairastavien nuorten potilaiden teho- ja turvallisuustiedot on ekstrapoloitu tyypin 1 diabetes mellitusta sairastavien lasten, nuorten ja aikuisten potilaiden tiedoista ja tyypin 2 diabetesta sairastavien aikuispotilaiden tiedoista. Tulokset tukevat Levemir-insuliinin käyttöä nuorilla tyypin 2 diabetes mellitusta sairastavilla potilailla.
Farmakokinetiikka
Imeytyminen
Huippupitoisuus seerumissa saavutetaan 6–8 tunnin kuluttua lääkkeen ottamisesta. Kun valmistetta annetaan kahdesti vuorokaudessa, vakaan tason pitoisuus seerumissa saavutetaan 2–3 antokerran jälkeen. Levemir-insuliinia käytettäessä imeytyminen vaihtelee potilaskohtaisesti vähemmän kuin käytettäessä muita perusinsuliinivalmisteita.
Ihon alle pistoksena annetun detemirinsuliinin absoluuttinen hyötyosuus on noin 60 %.
Jakautuminen
Levemir-insuliinin näennäinen jakautumistilavuus (noin 0,1 l/kg) osoittaa, että suuri osa detemirinsuliinista on verenkierrossa.
Proteiineihin sitoutumisesta tehtyjen in vitro- ja in vivo -tutkimusten tulokset viittaavat siihen, että detemirinsuliinin ja rasvahappojen tai muiden proteiineihin sitoutuvien lääkevalmisteiden välillä ei esiinny kliinisesti merkitsevää yhteisvaikutusta.
Biotransformaatio
Detemirinsuliini hajoaa samalla tavoin kuin ihmisinsuliini. Kaikki muodostuvat metaboliitit ovat inaktiivisia.
Eliminaatio
Terminaalinen puoliintumisaika ihon alle annetun pistoksen jälkeen määräytyy sen mukaan, miten nopeasti insuliini imeytyy ihonalaiskerroksista. Terminaalinen puoliintumisaika on 5–7 tuntia annoksesta riippuen.
Lineaarisuus
Pitoisuusarvot seerumissa (huippupitoisuus, imeytymisen määrä) ovat suhteessa ihon alle annettuun annokseen terapeuttisella annosalueella.
Liraglutidin ja Levemir-insuliinin välillä ei todettu farmakokineettisiä eikä farmakodynaamisia yhteisvaikutuksia, kun Levemir-insuliinia annosteltiin kerta-annoksena 0,5 yksikköä/kg tyypin 2 diabeetikoille, joiden liraglutidihoito annoksella 1,8 mg oli vakaassa tilassa.
Erityisryhmät
Iäkkäät (≥ 65-vuotiaat)
Levemir-insuliinin farmakokinetiikassa ei havaittu kliinisesti merkitsevää eroa iäkkäiden ja nuorten potilaiden välillä.
Munuaisten ja maksan vajaatoiminta
Levemir-insuliinin farmakokinetiikassa ei havaittu kliinisesti merkitsevää eroa munuaisten tai maksan vajaatoimintaa sairastavien potilaiden ja terveiden henkilöiden välillä. Koska Levemir-insuliinin farmakokinetiikkaa ei ole tutkittu laajasti näillä potilasryhmillä, plasman glukoosipitoisuutta on seurattava huolellisesti näissä potilasryhmissä.
Sukupuoli
Levemir-insuliinin farmakokineettisissä ominaisuuksissa ei ole kliinisesti merkitseviä eroja sukupuolten välillä.
Pediatriset potilaat
Levemir-insuliinin farmakokineettisiä ominaisuuksia tutkittiin pikkulasten (ikä 1–5 vuotta), lasten (ikä 6–12 vuotta) ja nuorten (ikä 13–17 vuotta) elimistössä ja tuloksia verrattiin tyypin 1 diabetesta sairastavien aikuisten tuloksiin. Farmakokineettisissä ominaisuuksissa ei havaittu kliinisesti merkitseviä eroja pikkulasten, lasten, nuorten ja aikuisten välillä.
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta, genotoksisuutta ja reproduktiotoksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille. Reseptoriaffiniteettitulokset ja in vitro -mitogeenisuustestit eivät viitanneet näyttöön lisääntyneestä mitogeenisestä vaikutuksesta ihmisinsuliiniin verrattuna.
Farmaseuttiset tiedot
Apuaineet
Glyseroli, fenoli, metakresoli, sinkkiasetaatti, dinatriumfosfaattidihydraatti, natriumkloridi, kloorivetyhappo (pH:n säätöön), natriumhydroksidi (pH:n säätöön), injektionesteisiin käytettävä vesi.
Yhteensopimattomuudet
Levemir-insuliiniin lisätyt aineet saattavat aiheuttaa detemirinsuliinin hajoamista, esim. jos lääkevalmiste sisältää tioleja tai sulfiitteja. Levemir-insuliinia ei saa lisätä infuusionesteisiin.
Tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
Ennen avaamista: 30 kuukautta.
Käytön aikana tai mukana kuljetettava varalääke: Valmistetta voidaan säilyttää korkeintaan 6 viikkoa.
Säilytys
Lääkevalmisteen säilytys, ks. kohta Kestoaika.
Ennen avaamista: Säilytä jääkaapissa (2 °C - 8 °C), ei kuitenkaan lähellä pakastelokeroa tai takaseinän kylmälevyä. Ei saa jäätyä.
Levemir Penfill
Käytön aikana tai mukana kuljetettavat varasylinteriampullit: Säilytä alle 30 °C. Älä säilytä jääkaapissa. Ei saa jäätyä.
Pidä sylinteriampulli ulkopakkauksessa. Herkkä valolle.
Levemir FlexPen
Käytön aikana tai mukana kuljetettava varakynä: Säilytä alle 30 ºC. Voidaan säilyttää jääkaapissa (2°C–8°C). Ei saa jäätyä.
Pidä kynän suojus paikoillaan. Herkkä valolle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
LEVEMIR FLEXPEN injektioneste, liuos, esitäytetty kynä
100 U/ml (L:ei) 5 x 3 ml (FlexPen) (56,43 €), 10 x 3 ml (FlexPen) (107,26 €)
LEVEMIR PENFILL injektioneste, liuos, sylinteriampulli
100 U/ml (L:ei) 5 x 3 ml (Penfill) (56,43 €)
PF-selosteen tieto
Levemir Penfill
3 ml liuosta sisältävä sylinteriampulli (tyypin 1 lasia), joka sisältää bromobutyylistä valmistetun kumimännän ja bromobutyylistä/polyisopreenista valmistetun kumisulkimen.
Pakkauskoot: 1, 5 ja 10 sylinteriampullia. Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Levemir FlexPen
3 ml liuosta sylinteriampullissa (tyypin 1 lasia), joka sisältää bromobutyylistä valmistetun kumimännän ja bromobutyylistä/polyisopreenista valmistetun kumisulkimen. Sylinteriampulli on esitäytetyssä, kertakäyttöisessä moniannoskynässä (valmistettu polypropeenista).
Pakkauskoot: 1 (neulojen kanssa tai ilman), 5 (ilman neuloja) ja 10 esitäytettyä kynää (ilman neuloja). Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Kirkas, väritön vesiliuos.
Käyttö- ja käsittelyohjeet
Älä käytä tätä lääkevalmistetta, jos huomaat, ettei se ole kirkasta ja väritöntä vesiliuosta.
Jäätynyttä Levemir-insuliinia ei saa käyttää.
Potilasta on kehotettava hävittämään neula jokaisen pistoksen jälkeen.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Neulat, sylinteriampullit ja esitäytetyt kynät on tarkoitettu vain henkilökohtaiseen käyttöön.
Sylinteriampullia ei saa täyttää uudelleen.
Korvattavuus
LEVEMIR FLEXPEN injektioneste, liuos, esitäytetty kynä
100 U/ml 5 x 3 ml, 10 x 3 ml
LEVEMIR PENFILL injektioneste, liuos, sylinteriampulli
100 U/ml 5 x 3 ml
- Ylempi erityiskorvaus (100 %). Diabetes, insuliinihoito (103).
- Peruskorvaus (40 %).
ATC-koodi
A10AE05
Valmisteyhteenvedon muuttamispäivämäärä
09.04.2021
Yhteystiedot
 NOVO NORDISK FARMA OY
NOVO NORDISK FARMA OY Linnoitustie 6
02600 Espoo
020 762 5300
www.novonordisk.fi
