INNOHEP injektioneste, liuos, kerta-annosruisku 8000 anti-Xa IU, 10000 anti-Xa IU, 12000 anti-Xa IU, 14000 anti-Xa IU, 16000 anti-Xa IU, 18000 anti-Xa IU
Vaikuttavat aineet ja niiden määrät
Tintsapariininatrium 20 000 anti-Xa IU/ml
Apuaineet, joiden vaikutus tunnetaan:
natriummetabisulfiitti (1,83 mg/ml) ja natrium (≤ 40 mg/ml).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste kerta-annosruiskussa
Kliiniset tiedot
Käyttöaiheet
Laskimoperäisten tromboembolioiden hoito aikuisille mukaan lukien syvä laskimotromboosi ja keuhkoembolia.
Laskimotromboembolian pitkäaikainen hoito ja sen uusiutumisen pitkäaikainen estohoito aikuisille syöpäpotilaille.
Muita hoitolinjoja (kuten leikkaus tai liuotushoito) voidaan käyttää tietyillä keuhkoemboliapotilaille (esim. potilaat joilla on epävakaa hemodynamiikka).
Annostus ja antotapa
Annostus
Aikuiset
Injektio ihon alle 175 anti‑Xa IU/kg kerran vuorokaudessa vähintään 6 vuorokauden ajan kunnes riittävä peroraalinen antikoagulaatio on saavutettu.
Pitkäaikainen hoito aikuisille syöpäpotilaille
Injektio ihon alle 175 anti-Xa IU/kg kerran vuorokaudessa. Suositeltava hoidon kesto on 6 kuukautta. Yli 6 kuukautta kestävän hoidon hyöty pitää arvioida potilaskohtaisesti.
Neuraksiaalinen anestesia
innohep-valmisteen hoitoannokset (175 IU/kg) ovat vasta-aiheisia potilaille, jotka saavat neuraksiaalisen anestesian ks. kohta Vasta-aiheet. Jos neuraksiaalinen anestesia tarvitaan, innohep-hoito on lopetettava vähintään 24 tuntia ennen toimenpidettä.
innohep-hoitoa ei saa jatkaa ennen kuin spinaalianestesiasta tai katetrin poistosta on kulunut vähintään 4-6 tuntia.
Vaihtokelpoisuus
Vaihto toiseen pienimolekyyliseen hepariinivalmisteeseen ks. kohta Varoitukset ja käyttöön liittyvät varotoimet.
Pediatriset potilaat
innohep-valmisteen tehoa ja turvallisuutta alle 18-vuotiaiden lasten hoidossa ei ole vielä varmistettu. Tällä hetkellä saatavilla olevat tiedot on kuvattu kohdassa Farmakokinetiikka, mutta annostussuosituksia ei voida antaa.
Munuaisten vajaatoiminta
Jos epäillään munuaisten vajaatoimintaa, munuaisten toiminta on arvioitava kreatiniinin puhdistuman perusteella, seerumin kreatiniiniin perustuvaa kaavaa käyttäen.
Käyttöä potilailla, joiden kreatiniinin puhdistuma on < 30 ml/min ei suositella, koska annostuksesta näille potilaille ei ole riittävää tietoa. Saatavissa olevan tiedon perusteella kumuloitumista ei tapahdu potilailla, joiden kreatiniinin puhdistuma on suurempi kuin 20 ml/min. Tarvittaessa innohep-hoito voidaan aloittaa näille potilaille mikäli hyödyn arvioidaan olevan riskiä suuremman ja anti-Xa:ta monitoroidaan (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet: Munuaisten vajaatoiminta). Tarvittaessa annosta on säädettävä anti-Xa aktiivisuuden mukaan. Jos anti-Xa aktiivisuus on halutulla tasolla tai sen yli innohep annosta pitää lisätä tai vähentää. Anti-Xa aktiivisuus on mitattava uudelleen 3-4 annoksen jälkeen. Annosmuutoksia pitää jatkaa kunnes haluttu anti-Xa aktiivisuus saavutetaan. Ohjeena: Kromogeenisellä määritelmällä mitattuna keskimääräinen aktiivisuus on ollut 0,5 – 1,5 IU/anti-Xa IU/ml terveillä vapaaehtoisilla ja potilailla joilla ei ole munuaisten vajaatoimintaa 4-6 tuntia annoksesta.
Iäkkäät potilaat
Iäkkäille potilaille käytetään innohep-valmisteen tavanomaisia annoksia. Varovaisuutta suositellaan hoidettaessa iäkkäitä potilaita, joilla on munuaisten vajaatoiminta. Jos epäillään munuaisten vajaatoimintaa, ks. kohdat Annostus ja antotapa: Munuaisten vajaatoiminta ja 4.4: Munuaisten vajaatoiminta.
Antotapa
Parenteraalisesti annosteltavat valmisteet on tarkastettava silmämääräisesti ennen annostelua. Valmistetta ei pidä käyttää jos siinä huomataan samentumista tai sakkaa. Neste saattaa säilytyksen aikana muuttua keltaiseksi, mutta se on silti täysin käyttökelpoista.
innohep-lääkehoito toteutetaan ihonalaisena pistoksena vatsan alueelle, reiden ulkosyrjään tai yläosaan, selän alaosaan tai käsivarteen. Valmistetta ei saa pistää arpien lähelle, napaan tai sen lähelle tai haavoihin. Pistettäessä vatsan alueelle potilaan tulee olla makuulla tai puoli-istuvassa asennossa ja vaihdella pistoskohtaa oikean ja vasemman puolen välillä. Ruiskussa olevaa ilmakuplaa ei pidä poistaa. Pistos on annettava ihopoimuun.
Ruiskun mitta-asteikon (0.05 ml väli) avulla annosta voidaan lisätä 1000 IU:n välein. Annos säädetään potilaan painon mukaan. Mahdollinen ylimäärä on poistettava ruiskusta ennen pistosta.
| Ohjeellinen annos eri painoluokille - 175 IU/kg ihonalaisena injektiona kerran päivässä | |||
| Kg* | Kansainvälinen yksikkö (IU) | Injisoitava määrä (ml) | |
| 20 000 IU/ml mitta-asteikollinen ruisku | 32-37 | 6000 | 0.30 |
| 38-42 | 7000 | 0.35 | |
| 43-48 | 8000 | 0.40 | |
| 49-54 | 9000 | 0.45 | |
| 55-59 | 10 000 | 0.50 | |
| 60-65 | 11 000 | 0.55 | |
| 66-71 | 12 000 | 0.60 | |
| 72-77 | 13 000 | 0.65 | |
| 78-82 | 14 000 | 0.70 | |
| 83-88 | 15 000 | 0.75 | |
| 89-94 | 16 000 | 0.80 | |
| 95-99 | 17 000 | 0.85 | |
| 100-105 | 18 000 | 0.90 | |
* yllä olevaa laskentakaavaa tulee käyttää annosmäärityksessä myös <32 kg:n tai >105 kg:n painoisille potilaille.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Nykyinen tai aiemmin sairastettu immuunivälitteinen, hepariinin aiheuttama trombosytopenia (tyyppi II) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Aktiivinen laaja verenvuoto tai laajalle verenvuodolle altistava tila, joka voidaan määritellä verenvuotona, johon liittyy jokin seuraavista:
a) ilmenee kriittisellä alueella tai elimessä (esim. intrakraniaalinen, intraspinaalinen, intraokulaarinen, retroperitoneaalinen, intra-artikulaarinen tai perikardiaalinen, intrauteriininen tai intramuskulaarinen lihasaitio-oireyhtymän yhteydessä),
b) aiheuttaa 20 g/l (1,24 mmol/l) tai suuremman hemoglobiinitason laskun, tai
c) johtaa kahden tai useamman yksikön kokoveren tai punasolujen siirtoon.
Septinen endokardiitti
innohep-valmisteen hoitoannokset (175 IU/kg) ovat vasta-aiheisia potilaille, jotka saavat neuraksiaalisen anestesian. Jos neuraksiaalinen anestesia tarvitaan, innohep-hoito on lopetettava vähintään 24 tuntia ennen toimenpidettä. innohep-hoitoa ei saa jatkaa ennen kuin spinaalianestesiasta tai katetrin poistosta on kulunut vähintään 4‑6 tuntia. Potilaita on tarkkailtava huolellisesti neurologisen vamman oireiden varalta.
Varoitukset ja käyttöön liittyvät varotoimet
Verenvuoto
Varovaisuutta on noudatettava hoidettaessa potilaita, joilla on lisääntynyt verenvuotoriski (ks. kohta Vasta-aiheet.). Samanaikaista käyttöä verihiutaleiden toimintaan tai hyytymisjärjestelmään vaikuttavien lääkevalmisteiden kanssa pitää joko välttää tai monitoroida tarkasti (ks. kohta Yhteisvaikutukset).
Lihakseen annettavat injektiot
innohep-valmistetta ei saa antaa lihakseen, vaan se annostellaan ihonalaisesti. Hematoomariskin vuoksi lihakseen annettavia injektioita pitää välttää innohep‑hoidon aikana.
Hepariinin aiheuttama trombosytopenia
Verihiutalearvot pitää määrittää ennen hoidon aloittamista ja tämän jälkeen säännöllisesti vasta-ainevälitteisestä hepariinin aiheuttamasta trombosytopeniariskistä (tyyppi II) johtuen. innohep-valmisteen käyttö pitää keskeyttää heti vasta-ainevälitteisen, hepariinin aiheuttaman trombosytopenian (tyyppi II) ilmetessä (ks. Vasta-aiheet ja 4.8). Verihiutaleiden määrä normalisoituu yleensä 2‑4 viikon kuluessa hoidon lopettamisesta.
Hoidettaessa pitkäaikaisesti syöpään liittyvää tromboosia on verihiutalearvoja seurattava säännöllisesti, erityisesti ensimmäisten kuukausien aikana. On myös huomioitava, että syöpä ja sen liitännäishoidot voivat aiheuttaa trombosytopeniaa.
Hyperkalemia
Hepariinivalmisteet voivat vähentää lisämunuaisen aldosteronieritystä johtaen hyperkalemiaan, erityisesti potilailla, joilla on diabetes mellitus, krooninen munuaisten vajaatoiminta, aiemmin alkanut metabolinen asidoosi, kohonneet veren kaliumarvot tai jotka käyttävät kaliumia säästäviä lääkkeitä. Hyperkalemian riski voi kasvaa myös pitkään jatkuneen innohep-hoidon aikana. Riskipotilaiden veren kaliumarvot mitataan ennen innohep-hoidon aloittamista ja kaliumarvoja seurataan säännöllisesti. Hepariinin käyttöön liittyvä hyperkalemia on yleensä ohimenevä, kun innohep-hoito keskeytetään. Jos innohep-hoito on elintärkeää, muita vaihtoehtoja on harkittava (esimerkiksi kaliumin saannin vähentäminen, toisten kaliumtasapainoon vaikuttavien lääkkeiden käytön lopettaminen).
Sydämen tekoläpät
Tutkimuksia ei ole riittävästi, joiden perusteella pystyttäisiin arvioimaan innohep-hoidon turvallisuutta ja tehoa läppätromboosin estossa potilaille, joilla on sydämen tekoläppä. innohep-injektionesteen käyttöä ei voida suositella tähän tarkoitukseen.
Munuaisten vajaatoiminta
Käyttöä potilailla, joiden kreatiniinin puhdistuma on < 30 ml/min ei suositella, koska annostuksesta näille potilaille ei ole riittävää tietoa. Saatavissa olevan tiedon perusteella kumulaatiota ei tapahdu potilailla, joiden kreatiniinin puhdistuma on suurempi kuin 20 ml/min. Tarvittaessa innohep-hoitoa voidaan harkita mikäli hyödyn arvioidaan olevan riskiä suuremman ja anti-Xa:ta monitoroidaan (ks. kohta Annostus ja antotapa). Vaikka anti‑Xa:n monitorointi soveltuu innohepin farmakodynaamisen vaikutuksen mittaamiseen, sen perusteella ei voi luotettavasti ennustaa potilaan verenvuotoriskiä.
Iäkkäät potilaat
Iäkkäiden potilaiden munuaisten toiminta saattaa olla heikentynyt (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet Munuaisten vajaatoiminta). Tämän vuoksi on oltava varovainen hoidettaessa iäkkäitä potilaita innohep-injektionesteellä.
Vaihtokelpoisuus
Farmakokineettisistä ja biologisen aktiivisuuden eroista johtuen pienimolekyylisiä hepariinivalmisteita ei pidä vaihtaa toisiinsa. Erityisesti pitkäaikaiskäytössä vaihto toiseen vaihtoehtoiseen pienimolekyyliseen hepariinivalmisteeseen on tehtävä varovaisuutta ja valmisteiden annostusohjeita noudattaen
Apuaineisiin liittyvät varoitukset
innohep 20 000 anti‑Xa IU/ml lääkevalmiste sisältää natriummetabisulfiittia. Harvinaisissa tapauksissa metabisulfiitit voivat aiheuttaa vakavia yliherkkyysreaktioita, mukaan lukien bronkospasmin. innohep-valmisteita, jotka sisältävät natriummetabisulfiittia, pitää käyttää varoen astmapotilaiden hoidossa.
Tämä lääkevalmiste sisältää sisältää ≤ 40 mg natrium per millilitra, joka vastaa 2 % WHO:n suosittelemasta natriumin 2 g:n päivittäisestä enimmäissaannista aikuisille.
Yhteisvaikutukset
Lääkkeet, jotka vaikuttavat verihiutaleiden toimintaan tai hyytymisjärjestelmään saattavat samanaikaisesti käytettynä tehostaa innohep-valmisteen antikoagulanttivaikutusta. Tällaisia ovat esim. verihiutaleiden aggregaation estäjät (esimerkiksi asetyylisalisyylihappo ja muut ei-steroidiset tulehduskipulääkkeet), trombolyyttiset aineet, K-vitamiini antagonistit, aktivoitu proteiini C, suorat Xa ja IIa estäjät. Mainittuja yhdistelmiä pitää välttää tai hoitoa niillä on seurattava tarkasti (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Raskaus ja imetys
Raskaus
Raskaana olevien naisten antikoagulanttihoito vaatii erikoislääkärin hoitoa.
Eläimillä tehdyt tutkimukset eivät viittaa suoraan tai epäsuoraan lisääntymistoksisuuteen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Tulokset yli 2200 raskaustapauksesta eivät osoita tintsapariinin aiheuttavan epämuodostumia tai toksisia vaikutuksia sikiön/vastasyntyneen terveydelle. Tintsapariini ei läpäise istukkaa. innohep-valmistetta voidaan käyttää kaikkien raskauskolmannesten aikana, jos se katsotaan kliinisesti tarpeelliseksi.
Epiduraalinen anestesia
Spinaalihematoomariskin vuoksi innohep-valmisteen hoitoannokset (175 IU/kg) ovat vasta-aiheisia potilailla, jotka saavat neuraksiaalisen anestesian. Sen vuoksi raskaana olevien naisten epiduraalianestesia voidaan toteuttaa vasta kun vähintään 24 tuntia on kulunut innohep-valmisteen hoitoannoksen antamisesta. Profylaktisia annoksia voi käyttää, edellyttäen, että innohep-annoksen ja neulan tai katetrin asettamisen välillä on vähintään 12 tunnin varoaika.
Raskaana olevat naiset, joilla on sydämen keinoläppä
Hoidon epäonnistumisia on raportoitu hoidettaessa raskaana olevia sydämen tekoläppäpotilaita täydellä innohep-annostuksella ja muilla pienimolekyylisillä hepariineilla. innohep-valmistetta ei suositella raskaana oleville naisille, joilla on sydämen tekoläppä.
Imetys
Eläinkokeet osoittavat, että innohep-valmisteen eritys rintamaitoon on vähäistä. Tietoja tintsapariinin erittymisestä äidinmaitoon ei ole käytettävissä. Vaikka pienimolekulaaristen hepariinien oraalinen imeytyminen on epätodennäköistä, riskiä imeväisikäisen lapsen kohdalla ei voida poissulkea. Laskimotromboemboliariskin potilailla vaara on erityisen korkea kuuden ensimmäisen viikon aikana synnytyksestä. Sen vuoksi on tärkeää arvioida, keskeytetäänkö imetys vai innohep-valmisteen käyttö ottaen huomioon rintaruokinnan hyödyt lapselle ja innohep-hoidon hyöty naiselle.
Hedelmällisyys
innohep-valmisteella ei ole tehty kliinisiä tutkimuksia koskien hedelmällisyyttä.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
innohep-valmisteella ei ole mitään tai juuri mitään vaikutusta ajokykyyn ja koneiden käyttökykyyn.
Haittavaikutukset
Useimmin raportoidut haittavaikutukset ovat verenvuotokomplikaatiot,
verenvuodosta johtuva anemia ja injektiokohdan reaktiot.
Verenvuotoa voi esiintyä eri elimissä ja vuodon vaikeusaste voi vaihdella.
Komplikaatioita voi esiintyä varsinkin korkeiden annosten yhteydessä. Vaikka laajat verenvuodot ovat harvinaisia, kuolemaa tai pysyvää haittaa on raportoitu joissain tapauksissa.
Vasta-ainevälitteistä hepariinin aiheuttamaa trombosytopeniaa (tyyppi II) voi esiintyä laajemmin 5-14 päivän kuluttua hoidon aloittamisesta. Sen lisäksi nopeaa trombosytopenian puhkeamista on kuvattu potilailla, jotka ovat aikaisemmin altistuneet hepariinille. Vasta-ainevälitteiseen hepariinin aiheuttamaan trombosytopeniaan (tyyppi II) voi liittyä valtimo-ja laskimotukos. innohep-valmisteen käyttö pitää keskeyttää kaikissa vasta-ainevälitteisissä hepariinin aiheuttamissa trombosytopeniatapauksissa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Harvinaisissa tapauksissa, innohep-valmiste voi aiheuttaa hypoaldosteronismista johtuvaa hyperkalemiaa. Potilaat, joilla on diabetes mellitus tai munuaisten vajaatoiminta, ovat riskiryhmässä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Hoidon yhteydessä voi joskus esiintyä vakavia allergisia reaktioita. Näitä voivat olla harvinaiset ihonekroositapaukset, toksinen ihon eruptio (esimerkiksi Stevens-Johnson oireyhtymä), angioedeema ja anafylaksia. innohep-valmisteen käyttö pitää välittömästi keskeyttää, jos on pienikin epäily vakavasta reaktiosta.
Haittavaikutusten esiintyvyyden arviointi perustuu kliinisten tutkimusten yhdistettyyn analyysiin ja spontaaniin raportointiin.
Haittavaikutukset on luetteloitu MedDRA SOC –luokituksen mukaisesti ja yksittäiset haittavaikutukset on listattu yleisyyden mukaan, alkaen yleisimmin raportoidusta. Jokaisessa luokassa, haittavaikutukset on esitetty haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Hyvin yleinen ≥ 1/10 Yleinen ≥1/100 ja <1/10 Melko harvinainen ≥1/1000 ja <1/100 Harvinainen ≥1/10 000 ja <1/1000 Hyvin harvinainen <1/10000
| Veri ja imukudos | |
| Yleinen ≥1/100 ja <1/10 | Anemia (mukaan lukien hemoglobiinin alenema) |
| Melko harvinainen ≥1/1000 ja <1/100 | Trombosytopenia (tyyppi I) (mukaan lukien verihiutaleiden määrän lasku) |
| Harvinainen ≥1/10 000 ja <1/1000 | Hepariinin aiheuttama trombosytopenia (tyyppi II) Trombosytoosi |
| Immuunijärjestelmä | |
| Melko harvinainen ≥1/1000 ja <1/100 | Yliherkkyys |
| Harvinainen ≥1/10 000 ja <1/1000 | Anafylaktinen reaktio |
| Aineenvaihdunta ja ravitsemus | |
| Harvinainen ≥1/10 000 ja <1/1000 | Hyperkalemia |
| Verisuonisto | |
| Yleinen ≥1/100 ja <1/10 | Verenvuodot Hematooma |
| Melko harvinainen ≥1/1000 ja <1/100 | Mustelma, ekkymoosi ja purppura |
| Maksa ja sappi | |
| Melko harvinainen ≥1/1000 ja <1/100 | Kohonneet maksaentsyymiarvot (mukaan lukien kohonneet transaminaasit, ALT, AST ja GGT) |
| Iho ja ihonalainen kudos | |
| Melko harvinainen ≥1/1000 ja <1/100 | Dermatiitti (mukaan lukien allerginen dermatiitti ja rakkulat) Ihottuma Kutina |
| Harvinainen ≥1/10 000 ja <1/1000 | Toksisten iho-oireiden puhkeaminen (mukaan lukien Stevens-Johnsonin oireyhtymä) Ihokuolio Angioedeema Urtikaria |
| Luusto, lihakset ja sidekudos | |
| Harvinainen ≥1/10 000 ja <1/1000 | Osteoporoosi (pitkäaikaishoidon yhteydessä) |
| Sukupuolielimet ja rinnat | |
| Harvinainen ≥1/10 000 ja <1/1000 | Priapismi |
| Yleisoireet ja antopaikassa todettavat haitat | |
| Yleinen ≥1/100 ja <1/10 | Injektiopaikan reaktiot (mukaan lukien injektiopaikan hematooma, verenvuoto, kipu, kutina, kyhmy, punoitus ja ekstravasaatio) |
Syöpäpotilaiden pitkäaikaishoito
Kliinisessa tutkimuksessa syöpäpotilaiden pitkäaikaishoidon (6 kuukautta) haittavaikutukset olivat verrattavissa muiden innohep-valmisteella hoidettujen potilaiden haittavaikutuksiin. Syöpäpotilailla on tavallisesti suurentunut verenvuotoriski, jota lisää korkea ikä, liitännäissairaudet, kirurgiset toimenpiteet ja samanaikainen lääkitys. Kuten oli odotettavissa verenvuototapahtumien ilmaantuvuus oli suurempi kuin aiemmin lyhytaikaisessa käytössä on havaittu ja samaa tasoa kuin syöpäpotilaiden pitkäaikaisessa antikoagulanttien käytössä.
Pediatriset potilaat
Markkinoille tulon jälkeen kerätyn ja yhdestä tutkimuksesta saadun rajallisen tiedon perusteella valmisteen haittavaikutusprofiili lapsilla ja nuorilla vaikuttaa olevan samankaltainen kuin aikuisilla.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Verenvuoto on yleisin yliannostukseen liittyvä komplikaatio. innohep-valmisteen lyhyen puoliintumisajan johdosta (ks. kohta Farmakokinetiikka), pienet verenvuodot voidaan hoitaa innohep-valmisteen käytön keskeyttämisellä. Vakavat verenvuodot voivat vaatia antidootin, protamiinisulfaatin, antamista. Potilaita on tarkkailtava huolellisesti.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Antitromboottiset lääkeaineet, hepariiniryhmä, ATC-koodi: B01AB10
Vaikutusmekanismi
Tintsapariininatrium on siasta valmistetusta hepariinista entsymaattisen depolymeroinnin avulla saatu pienimolekyylinen hepariini, jonka anti-Xa/anti-IIa suhde on 1,5 - 2,5. Kuten konventionaalinen hepariini, tintsapariininatrium estää antitrombiini III:n välityksellä eri hyytymistekijöiden, ennen kaikkea tekijän Xa vaikutusta.
Tintsapariininatriumin biologinen aktiivisuus on standardoitu nykyisten "matalan molekyylipainon hepariinien kansainvälisten standardien" mukaisesti ja ilmaistu anti-Xa:n kansainvälisinä yksikköinä (IU).
Tintsapariininatriumin anti-Xa-aktiivisuus on vähintään 70 ja enintään 120 IU/mg. Tintsapariininatriumin anti-IIa-aktiivisuus on noin 55 IU/mg. Tintsapariinin molekyylipaino on keskimäärin 6500 Daltonia.
Farmakodynaamiset vaikutukset
Tintsapariinin antitrombiiniaktiivisuus (anti-IIa) on korkea, anti-Xa/anti-IIa-suhde on alhainen ja trombiinin muodostumisen esto on lähes yhtä voimakas kuin fraktioimattoman hepariinin. Anti-Xa/IIa-aktiivisuuden lisäksi potilailla on todettu kudostekijätien estäjän (Tissue Factor Pathway Inhibitor, TFPI) induktio.
Kliininen teho ja turvallisuus
Akuutin syvän laskimotromboosin ja keuhkoembolian ensihoito
Kaksoissokkoutetussa kliinisessä tutkimuksessa tintsapariinia (175 IU/kg ihon alle kerran vuorokaudessa) verrattiin jatkuvana suonensisäisenä infuusiona annettavaan annossovitettuun hepariiniin proksimaalista laskimotromboosia sairastavien potilaiden ensihoidossa. Kaikilla potilailla aloitettiin oraalinen antikoagulaatiohoito varfariinilla toisena päivänä, ja heitä hoidettiin tintsapariinilla tai hepariinilla vähintään kuuden päivän ajan. Kuudella 213:sta tintsapariinia saaneesta potilaasta (2,8 %) ja 15:llä 219:stä hepariinia saaneesta potilaasta (6,9 %) ilmeni laskimotromboembolia (VTE) toistuvasti (p = 0,07) tutkimuksen kolmen kuukauden seurantajakson aikana. Vakavia verenvuotoja, joiden todettiin liittyvän alkuperäiseen hoitoon, esiintyi yhdellä tintsapariinia saaneella potilaalla (0,5 %) ja 11:llä hepariinia saaneella potilaalla (5,0 %), mikä vastaa 91 %:n riskin pienenemistä (p = 0,006). Kuolemantapauksia oli 10 tintsapariiniryhmässä (4,7 %) ja 21 hepariiniryhmässä (9,6 %), mikä vastaa 51 %:n riskin pienenemistä (p = 0,049).
Sokkouttamattomassa tutkimuksessa (THESEE) 612 potilasta, joilla oli oireinen keuhkoembolia, satunnaistettiin saamaan tintsapariinia (175 IU/kg ihon alle kerran vuorokaudessa) tai annossovitettua laskimonsisäistä hepariinia kahdeksan ensimmäisen hoitopäivän aikana. Suun kautta annettava antikoagulaatiohoito otettiin käyttöön päivinä 1-3, ja sitä annettiin vähintään 3 kuukauden ajan. Yhdistetyn päätetapahtuman (toistuva VTE, vakava verenvuoto ja kuolema) perusteella 9 potilasta 308 potilaasta hepariiniryhmässä (2,9 %) ja 9 potilasta 304 potilaasta tintsapariiniryhmässä (3,0 %) oli saavuttanut vähintään yhden päätetapahtuman päivänä 8 (absoluuttinen ero: -0,1 %; 95 % Kl: -2,7-2,6).
Akuutin syvän laskimotromboosin ja keuhkoembolian pitkäaikainen hoito
Satunnaistetun, avoimen kliinisen tutkimuksen osa-analyysissä ("Main-LITE-syöpä") tintsapariinia (175 IU/kg ihon alle kerran päivässä) verrattiin varfariiniin kolmen kuukauden hoidon ajan potilailla, joilla oli proksimaalinen laskimotromboosi. Syöpää sairastaneista 200 potilaasta (100 potilasta kummassakin ryhmässä) varfariiniryhmässä (16 %) esiintyi 12 kuukauden jälkeen enemmän uusiutuvia VTE:itä kuin tintsapariiniryhmässä (7 %) (absoluuttinen ero: -9,0; 95 % CI: -21,7-0,7). Kolmen kuukauden aikana vakavaa verenvuotoa raportoitiin 7 prosentilla potilaista molemmissa ryhmissä. Vuoden kuluttua kuolleisuus oli 47 % molemmissa ryhmissä.
Avoimessa satunnaistetussa tutkimuksessa, johon osallistui 241 potilasta, joilla oli akuutti proksimaalinen syvä laskimotromboosi ja joista 69:llä oli syöpä, tintsapariinia (175 IU/kg ihon alle kerran vuorokaudessa) verrattiin suun kautta otettavaan K-vitamiinin antagonistiin (VKA) 6 kuukauden ajan. Syöpää sairastavilla potilailla uusiutuneen VTE:n esiintyvyys oli pienempi tintsapariiniryhmässä (2/36 [5,5 %]) verrattuna seitsemään 33:sta [21,2 %]). Tintsapariiniryhmässä esiintyi yksi vakava verenvuoto, kun taas VKA-ryhmässä niitä oli 3.
Kontrolloidussa, avoimessa, satunnaistetussa kliinisessä tutkimuksessa (CATCH) tintsapariinin tehoa ja turvallisuutta verrattiin varfariiniin 6 kuukauden kuluttua akuutin, oireisen laskimotukoksen tai keuhkoembolian hoidosta aktiivista syöpää sairastavilla potilailla. Tutkimukseen osallistui 900 potilasta, joiden munuaistoiminta vastasi kreatiniinipuhdistumaa (CrCl), joka oli alle 20 ml/min. Tutkimukseen ei otettu mukaan potilaita, joiden trombosyyttimäärä oli alle 50 × 109/l. Tintsapariiniryhmän potilaat saivat täyden annoksen tintsapariini-injektioita (175 IU/kg ihon alle) kerran päivässä koko hoitojakson ajan (6 kuukautta), ja heitä verrattiin potilaisiin, jotka saivat tintsapariinia kerran päivässä 5-10 päivän ajan ja sen jälkeen annossovitettua varfariinia (INR: 2,0-3,0) 6 kuukauden ajan. Sokkoutettu komitea arvioi tehoa (alaraajojen laskimotukos ja keuhkoembolia) ja turvallisuutta (verenvuototapahtumat, hepariinin aiheuttama trombosytopenia ja kuolema). Uusiutunut VTE ilmeni 31 potilaalla 449 potilaasta tintsapariiniryhmässä ja 45 potilaalla 451 potilaasta varfariiniryhmässä (6 kuukauden kumulatiivinen ilmaantuvuus: 7,2 % tintsapariinilla verrattuna 10,5 % varfariinilla; riskisuhde [HR]: 0,65; 95 % CI: 0,41-1,03; p = 0,07). Oireinen laskimotukos ilmaantui 12 potilaalle tintsapariiniryhmässä ja 24 potilaalle varfariiniryhmässä (HR: 0,48; 95 %:n CI: 0,24-0,96; p = 0,04). Vakavissa verenvuototapahtumissa (HR: 0,89; 95 %:n CI: 0,40-1,99; p = 0,77) tai kuolleisuudessa kaikkiin syihin ei ollut merkittävää eroa (1.08; 95 % CI: 0,85-1,36; p = 0,54), mutta toisaalta kliinisesti merkittävän, ei-vakavan verenvuodon riski pieneni tilastollisesti merkitsevästi tintsapariiniryhmässä varfariiniryhmään verrattuna (HR: 0,58; 95 % CI: 0,40-0,84; p = 0,004).
CATCH-tutkimuksen ennalta määritellyssä toissijaisessa analyysissä, jossa kilpailevia tuloksia käytettiin regressioanalyysissä, joka koski aikaa ensimmäiseen kliinisesti merkitykselliseen verenvuotoon (clinically-relevant bleeding CRB; vakavat ja kliinisesti merkitykselliset, ei-vakavat tapahtumat), riski saada vähintään yksi CRB-tapahtuma kuuden kuukauden tutkimuksen aikana oli merkitsevästi pienempi tintsapariiniryhmässä (n = 60/449) kuin varfariiniryhmässä (n = 78/451), HR: 0,64; 95 %:n Cl: 0,45-0,89; p = 0,009. CRB:n kumulatiiviset ilmaantuvuusluvut erosivat näissä kahdessa ryhmässä lähes välittömästi, ja tintsapariinipotilaille aiheutuva hyöty jatkui kuuden kuukauden hoitojakson aikana (ks. kuva 1). Kaikkia hoitoryhmiä koskevassa monimuuttuja-analyysissä CRB:n riskin todettiin lisääntyvän iän ollessa > 75 vuotta (HR 1,83) ja kallonsisäisen pahanlaatuisuuden (HR 1,97) myötä.
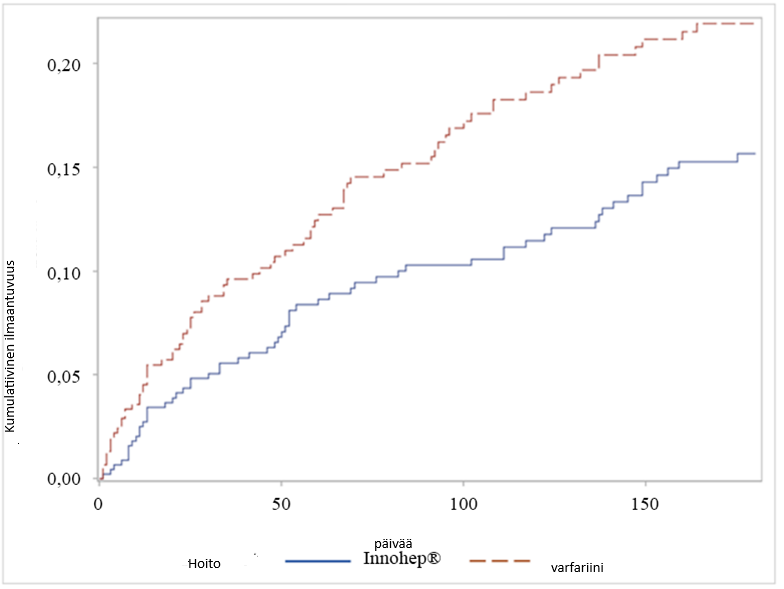
Kuva 1
CATCH-tutkimuksen toissijaisessa analyysissä arvioitiin munuaisten vajaatoiminnan (renal impairment, RI, määritelty glomerulussuodatusnopeudeksi [GFR] < 60 ml/min/1,73 m2) vaikutusta antikoagulaatiohoidon tehoon ja turvallisuuteen potilailla, joilla oli syöpään liittyvä tromboosi. Tämän analyysin tutkimuspopulaatioon kuului 864 potilasta (96 %), joille oli satunnaistamishetkellä saatavilla keskuslaboratorion määrittämä GFR-arvo. Näistä 131 potilaalla (15 %) oli lähtötilanteessa munuaisten vajaatoiminta (69 potilaalla tintsapariiniryhmässä ja 62 potilaalla varfariiniryhmässä). Munuaisten vajaatoimintaan liittyi antikoagulaatiohoitoa saavilla, syöpään liittyvää tromboosia sairastavilla potilailla tilastollisesti merkitsevästi lisääntynyt toistuva VTE ja vakava verenvuoto, mutta kliinisesti merkityksellisten verenvuotojen (CRB) tai kuolleisuuden ei havaittu lisääntyneen merkittävästi. Pitkäaikainen hoito täydellä terapeuttisella tintsapariiniannoksella ilman annoksen säätämistä munuaisten vajaatoimintaa sairastavilla potilailla ei lisännyt toistuvan VTE:n, CRB:n, vakavan verenvuodon tai kuolleisuuden esiintyvyyttä varfariiniin verrattuna.
Prospektiiviseen, avoimeen kliiniseen tutkimukseen ("TICAT") osallistui 247 potilasta, joilla oli aktiivinen syöpä ja äskettäin diagnosoitu laskimotukos ja/tai keuhkoembolia. Tintsapariinihoidon (175 IU/kg ihon alle kerran päivässä) keskimääräinen kesto oli 15,6 (SD: 13,2) kuukautta. Uusiutuvan VTE:n ilmaantuvuus väheni tutkimuksen aikana 4,5 prosentista ensimmäisten 6 kuukauden aikana (95 % CI: 2,2 % -7,8 %) 1,1 prosenttiin (95 % CI: 0,1 % -3,9 %) kuukausien 7-12 aikana (p = 0,08). Kliinisesti merkittävien verenvuotojen esiintyvyys oli 0,9 % potilaskuukautta kohti (95 % CI: 0,5 % -1,6 %) ensimmäisten 6 kuukauden aikana ja 0,6 % potilaskuukautta kohti (95 % CI: 0,2 % -1,4 %) kuukausien 7-12 aikana. Yksi potilas (0,4 %) kuoli toistuvaan keuhkoemboliaan ja kaksi potilasta (0,8 %) verenvuotoon.
Erityiset potilasryhmät
Munuaisten vajaatoiminta
Tintsapariinin turvallisuusprofiilia (175 IU/kg kerran vuorokaudessa) enintään 30 päivän ajan tutkittiin tutkimuksessa, johon osallistui 200 iäkästä laitoshoitoa saavaa potilasta, joiden CrCl oli > 20 ml/min. Anti-Xa-aktiivisuus plasmasta mitattiin säännöllisesti. Keski-ikä oli 85,2 vuotta (vaihteluväli 70-102 vuotta) ja keskimääräinen CrCl oli 51,2 ± 22,9 ml/min. Yhden kuolemantapauksen epäiltiin liittyvän antikoagulaatiohoitoon. Vakavia verenvuototapauksia raportoitiin kolme (1,5 %). Hepariinin aiheuttama trombosytopenia varmistui kahdella potilaalla (1 %). Anti-Xa-aktiivisuuden ja CrCI:n tai iän välillä ei havaittu korrelaatiota.
Farmakokinetiikka
Perustuen anti-Xa-aktiivisuuteen ihonalaisen annostelun jälkeen, absoluuttinen hyväksikäytettävyys on noin 90 % ja maksimaalinen anti‑Xa-aktiivisuus saavutetaan 4 ‑ 6 tunnin kuluessa. Eliminaation puoliintumisaika on noin 3,7 tuntia.
Tintsapariininatrium metaboloituu vähäisessä määrin maksassa depolymerisaation kautta ja erittyy munuaisten kautta muuttumattomana tai lähes muuttumattomana.
Erityiset potilasryhmät
Raskaana olevat naiset
Tintsapariinin farmakokineettistä toimintaa on tutkittu raskaana olevilla naisilla. Tiedot 55 raskaana olevan naisen peräkkäisestä farmakokineettisestä seurannasta osoittavat, että farmakokineettiset ominaisuudet eivät eroa ei-raskaana olevien naisten farmakokineettisistä ominaisuuksista.
Munuaisten vajaatoiminta
Tintsapariinin keskimääräinen molekyylipaino on korkea ja on olemassa kliinistä ja prekliinistä näyttöä tintsapariinin merkittävästä ei-renaalisesta eliminaatiosta.
Dialyysipotilaille annetun laskimonsisäisen bolusinjektion havaittu puoliintumisaika on lyhyempi kuin terveille vapaaehtoisille ihon alle annettuna (noin 2,5 tuntia verrattuna noin 3,7 tuntiin).
Prospektiivisessa tutkimuksessa selvitettiin, kumuloituuko tintsapariini (175 anti-Xa IU/kg ihon alle kerran päivässä) 10 päivän hoidon aikana 30 yli 70-vuotiaalle laitoshoidossa olevalle potilaalle, jotka saivat terapeuttisen annoksen akuutin tromboembolisen sairauden vuoksi. Plasman anti-Xa- ja anti-IIa-pitoisuudet sekä aktivoitu osittainen tromboplastiiniaika (APTT) määritettiin ennen ensimmäistä injektiota huipputasona eli 5 tuntia toisen injektion jälkeen (päivä 2) sekä päivinä 5, 7 ja 10. Tällöin plasman anti-Xa- ja anti-IIa-pitoisuudet olivat korkeimmillaan. Potilaat olivat keskimäärin 87-vuotiaita (vaihteluväli: 71-96 vuotta), heidän ruumiinpainonsa oli 62,7 kg (vaihteluväli: 38-90 kg) ja CrCl-keskiarvo oli 40,6 ± 15,3 ml/min (vaihteluväli: 20-72 ml/min). Koska yhdenkään potilaan anti-Xa-aktiivisuus ei ollut yli 1,5 IU/ml, annosta ei mukautettu. Keskimääräinen suurin anti-Xa-pitoisuus oli 0,66 ± 0,20 IU/ml (vaihteluväli: 0,26-1,04) päivänä 2. Anti-Xa- tai anti-IIa-aktiivisuus ei lisääntynyt asteittain sen jälkeen, kun tintsapariinia oli annettu toistuvasti päivittäin 10 päivän ajan. Anti-Xa- ja anti-IIa-aktiivisuuden ja iän, painon tai CrCl:n välillä ei havaittu korrelaatiota. Vakavia verenvuotoja ei esiintynyt, eikä tromboembolisia komplikaatioita tai kuolemantapauksia ollut.
Pediatriset potilaat
Tintsapariinin käytöstä saatujen alustavien tulosten mukaan tintsapariinin puhdistuma on nopeampi nuoremmilla lapsilla, mukaan lukien vauvat ja vastasyntyneet. Tästä johtuen nuoremmat lapset saattavat tarvita suuremman annoksen kuin vanhemmat lapset. Saatavilla oleva tieto ei ole kuitenkaan riittävä annostussuosituksen antamiseksi, ks. kohta Annostus ja antotapa.
Prekliiniset tiedot turvallisuudesta
Hepariinit eivät yleensä ole kovin toksisia, ei myöskään innohep. Tämä on todettu toksisuus- ja mutageenisuuskokeissa. Ainoa merkittävä löydös oli erittäin suurten subkutaanisten annosten aiheuttama injektiokohdan paikallinen verenvuoto.
Farmaseuttiset tiedot
Apuaineet
Natriummetabisulfiitti (E223), natriumhydroksidi, injektionesteisiin käytettävä vesi.
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta. Ruiskut ovat kertakäyttöisiä.
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
INNOHEP injektioneste, liuos, kerta-annosruisku
8000 anti-Xa IU (L:ei) 10 x 0,4 ml (suojakorkki ja turvapidike) (68,99 €), 30 x 0,4 ml (30 (3 x 10) x 0,4 ml, suojakorkki ja turvapidike) (192,50 €)
10000 anti-Xa IU (L:ei) 10 x 0,5 ml (suojakorkki ja turvapidike) (85,76 €), 30 x 0,5 ml (30 (3 x 10) x 0,5 ml, suojakorkki ja turvapidike) (239,97 €)
12000 anti-Xa IU (L:ei) 10 x 0,6 ml (suojakorkki ja turvapidike) (95,14 €), 30 x 0,6 ml (30 (3 x 10) x 0,6 ml, suojakorkki ja turvapidike) (266,38 €)
14000 anti-Xa IU (L:ei) 10 x 0,7 ml (suojakorkki ja turvapidike) (109,88 €), 30 x 0,7 ml (30 (3 x 10 ) x 0,7 ml, suojakorkki ja turvapidike) (308,08 €)
16000 anti-Xa IU (L:ei) 10 x 0,8 ml (suojakorkki ja turvapidike) (116,88 €), 30 x 0,8 ml (30 (3 x 10) x 0,8 ml, suojakorkki ja turvapidike) (327,80 €)
18000 anti-Xa IU (L:ei) 10 x 0,9 ml (suojakorkki ja turvapidike) (130,65 €), 30 x 0,9 ml (30 (3 x 10) x 0,9 ml, suojakorkki ja turvapidike) (366,76 €)
PF-selosteen tieto
Lasinen kerta-annosruisku (väritön, Ph.Eur. tyyppi I, silikonisoitu), neula 29G tai 27G, mäntä klorobutyylikumia, neulan suojakorkki styreenibutadieenikumia ja turvapidike käytetylle neulalle.
Pakkauskoot;
8000 anti-Xa IU kerta-annosruiskut (0,4 ml) 6×1, 10×1, 30×1, 30 (3×10) kpl
10 000 anti‑Xa IU kerta‑annosruiskut (0,5 ml): 6×1, 10×1, 30×1, 30 (3×10) kpl
12 000 anti-Xa IU kerta-annosruiskut (0,6 ml): 6×1, 10×1, 30×1, 30 (3×10) kpl
14 000 anti‑Xa IU kerta‑annosruiskut (0,7 ml): 6×1, 10×1, 30×1, 30 (3×10) kpl
16 000 anti-Xa IU kerta-annosruiskut (0,8 ml): 6×1, 10×1, 30×1, 30 (3×10) kpl
18 000 anti‑Xa IU kerta‑annosruiskut (0,9 ml): 6×1, 10×1, 30×1, 30 (3×10) kpl
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Väritön tai oljenvärinen, kirkas ja sakaton neste kerta-annosruiskussa.
Käyttö- ja käsittelyohjeet
Käyttämätön valmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
INNOHEP injektioneste, liuos, kerta-annosruisku
8000 anti-Xa IU 10 x 0,4 ml, 30 x 0,4 ml
10000 anti-Xa IU 10 x 0,5 ml, 30 x 0,5 ml
12000 anti-Xa IU 10 x 0,6 ml, 30 x 0,6 ml
14000 anti-Xa IU 10 x 0,7 ml, 30 x 0,7 ml
16000 anti-Xa IU 10 x 0,8 ml, 30 x 0,8 ml
18000 anti-Xa IU 10 x 0,9 ml, 30 x 0,9 ml
- Ylempi erityiskorvaus (100 %). Daltepariini ja tintsapariini (yli 6 kuukauden hoidossa): Aktiivisen syöpätaudin hoitoon liittyvän laskimon tromboembolian hoito ja pitkäaikainen estohoito erityisin edellytyksin (166).
- Rajoitettu ylempi erityiskorvaus reseptimerkinnällä (100 %). Rintasyöpä (115), Eturauhassyöpä (116), Leukemiat, muut pahanlaatuiset veri- ja luuydintaudit sekä pahanlaatuiset imukudostaudit (117), Gynekologiset syövät (128), Pahanlaatuiset kasvaimet, joita ei ole edellä erikseen mainittu (130). Merkintä lääkemääräyksen 'Perustelut'-kohdassa: Laskimotukos (E008) Tromboembolia (E007) Keuhkoembolia (E004).
- Peruskorvaus (40 %).
ATC-koodi
B01AB10
Valmisteyhteenvedon muuttamispäivämäärä
15.11.2024
Yhteystiedot
Karhumäentie 3
01530 Vantaa
020 721 8440
www.leo-pharma.fi
info.fi@leo-pharma.com
