DIGOXIN ORION tabletti 0,25 mg, DIGOXIN ORION MITE tabletti 0,0625 mg, DIGOXIN ORION SEMI tabletti 0,125 mg
Vaikuttavat aineet ja niiden määrät
Digoxin Orion mite 0,0625 mg tabletti: yksi tabletti sisältää 0,0625 mg digoksiinia.
Digoxin Orion semi 0,125 mg tabletti: yksi tabletti sisältää 0,125 mg digoksiinia.
Digoxin Orion 0,25 mg tabletti: yksi tabletti sisältää 0,25 mg digoksiinia.
Apuaineet, joiden vaikutus tunnetaan:
Digoxin Orion mite 0,0625 mg tabletti: yksi tabletti sisältää 58,131 mg laktoosimonohydraattia.
Digoxin Orion semi 0,125 mg tabletti: yksi tabletti sisältää 47,753 mg laktoosimonohydraattia.
Digoxin Orion 0,25 mg tabletti: yksi tabletti sisältää 95,525 mg laktoosimonohydraattia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Tabletti
Kliiniset tiedot
Käyttöaiheet
Sydämen vajaatoiminta
Digoksiini on tarkoitettu kroonisen sydämen vajaatoiminnan hoitoon, kun vallitsevana piirteenä on systolinen toimintahäiriö. Digoksiinin terapeuttinen hyöty on suurin potilailla, joilla on sydämen laajentuma.
Digoksiini on tarkoitettu erityisesti potilaille, joilla sydämen vajaatoimintaan liittyy eteisvärinä.
Supraventrikulaariset rytmihäiriöt
Digoksiini on tarkoitettu tiettyjen supraventrikulaaristen rytmihäiriöiden hoitoon, etenkin kroonisen eteislepatuksen ja eteisvärinän hoitoon.
Annostus ja antotapa
Annostus
Digoksiinin annos on määriteltävä jokaiselle potilaalle yksilöllisesti iän, kehon arvioidun rasvattoman massan ja munuaisfunktion mukaan. Suositusannokset ovat vain ohjeellisia.
Laskimoon annettavan digoksiinin ja suun kautta otettavien valmisteiden biologisen hyötyosuuden ero on otettava huomioon vaihdettaessa lääkemuodosta toiseen. Jos potilas siirtyy esimerkiksi suun kautta otettavasta valmisteesta laskimoon annettavaan valmisteeseen, annosta on pienennettävä noin 33 %.
Seuranta
Seerumin digoksiinipitoisuus ilmoitetaan tavanomaisina yksikköinä (ng/ml) tai SI-yksikköinä (nmol/l). Ng/ml-yksiköt muunnetaan nmol/l-yksiköiksi kertomalla ng/ml-yksiköt kertoimella 1,28. Seerumin digoksiinipitoisuus voidaan määrittää radioimmunologisesti. Verinäyte on otettava aikaisintaan 6 tunnin kuluttua viimeisestä digoksiinin annoksesta.
Optimaalisista pitoisuuksista seerumissa ei ole ehdottomia suosituksia. Pienet seerumin digoksiinin pitoisuudet (0,5–0,9 ng/ml) ovat vähentäneet kuolleisuutta ja sairaalahoidon tarvetta. Sairastavuus ja kuolleisuus olivat suurempia potilailla, joilla digoksiinin pitoisuudet olivat suurempia (> 1 ng/ml), vaikkakin tällaiset digoksiinin pitoisuudet vähensivät sydämen vajaatoiminnasta johtuvia sairaalahoitoja. Tästä syystä ja Digitalis Investigation Group -ryhmän tutkimuksen useiden jälkianalyysien perusteella optimaalinen digoksiinipitoisuus seerumissa saattaa olla 0,5 ng/ml (0,64 nmol/l) – 1,0 ng/ml (1,28 nmol/l).
Digoksiinin toksisuus liittyy yleisemmin yli 2 ng/ml digoksiinipitoisuuksiin. Seerumin digoksiinipitoisuus on kuitenkin tulkittava kliinisen arvioinnin perusteella. Toksisuutta voi ilmetä myös pienempien seerumin digoksiinipitoisuuksien vallitessa. Kliininen tila, seerumin kaliumpitoisuus ja kilpirauhasen toiminta ovat tärkeitä tekijöitä, kun päätellään, johtuvatko potilaan oireet digoksiinista (ks. kohta Yliannostus).
Muut sydänglykosidit, mm. digoksiinin metaboliitit, voivat häiritä käytettävissä olevia määritysmenetelmiä. Epäilysten on aina herättävä, jos pitoisuus ei näytä vastaavan potilaan kliinistä tilaa.
Potilasryhmät
Aikuiset ja yli 10-vuotiaat pediatriset potilaat
Ks. myös Digoxin 0,25 mg/ml injektioneste, liuos valmisteyhteenveto. Laskimoyhteyden kautta tapahtuva hoidon aloitus ja ylläpitohoito. |
Nopea peroraalinen aloitus
Jos on kliinisesti tarpeen, nopea digitalisaatio voidaan saavuttaa usealla eri tavalla, esimerkiksi 750–1 500 mikrog (0,75–1,5 mg) kerta-annoksena.
Jos tilanne on vähemmän kiireellinen tai toksisuuden riski on suurentunut, kuten esimerkiksi iäkkäillä potilailla, aloitusannos annetaan suun kautta 6 tunnin välein osa-annoksina niin, että noin puolet kokonaisannoksesta annetaan ensimmäisenä annoksena.
Kliininen vaste on arvioitava ennen jokaista uutta osa-annosta (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Hidas peroraalinen aloitus
Joillekin potilaille, esimerkiksi lievää sydämen vajaatoimintaa sairastaville, digitalisaatio voidaan toteuttaa hitaammin 250–750 mikrog/vrk (0,25–0,75 mg) annoksilla viikon aikana, minkä jälkeen käytetään asianmukaista ylläpitoannosta. Kliininen vaste pitäisi havaita viikon kuluessa.
Huom! Hitaan tai nopean peroraalisen aloituksen valinta riippuu potilaan kliinisestä tilasta ja hoidon kiireellisyydestä.
Ylläpitohoito
Ylläpitoannostus perustuu siihen suhteelliseen osuuteen, joka elimistön enimmäismäärästä poistuu eliminaation kautta vuorokaudessa. Seuraava kaava on ollut laajalti kliinisessä käytössä:
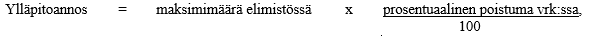
jossa maksimimäärä elimistössä = aloitusannos
prosentuaalinen poistuma vrk:ssa = 14 + (kreatiniinipuhdistuma / 5)
Kreatiniinipuhdistuma korjattuna vastaamaan kehon 70 kg painoa tai 1.73 m2 pinta-alaa. Jos tiedetään ainoastaan seerumin kreatiniinipitoisuus s-krea, kreatiniinipuhdistuma (korjattuna vastaamaan kehon 70 kg painoa) miehille voidaan laskea kaavasta
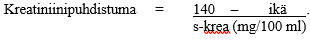
Huom: Jos seerumin kreatiniinipitoisuus ilmaistaan mikromol/l-yksiköissä, se voidaan muuttaa mg/100 ml yksiköiksi (mg %) seuraavasti:
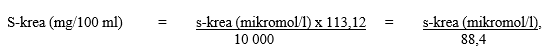
jossa 113,12 on kreatiniinin molekyylimassa.
Naisille kreatiniinipuhdistuman lopputulos on kerrottava 0,85:llä.
Huom! Näitä kaavoja ei voida käyttää kreatiniinipuhdistuman laskemiseen pediatrisille potilaille.
Käytännössä tämä tarkoittaa sitä, että useimpien sydämen vajaatoimintapotilaiden tarvitsema ylläpitoannos on 125–250 mikrog (0,125–0,25 mg) digoksiinia vuorokaudessa. Jos potilaan herkkyys digoksiinin haittavaikutuksille on suurentunut, 62,5 mikrog/vrk (0,0625 mg) tai tätä pienempi annos voi olla riittävä. Jotkut potilaat saattavat tarvita suuremman annoksen.
Vastasyntyneet, vauvaikäiset ja enintään 10-vuotiaat pediatriset potilaat (joille ei ole annettu sydänglykosidejä edeltävän 2 viikon kuluessa)
Jos sydänglykosideja on annettu digoksiinihoidon aloittamista edeltävien kahden viikon aikana, optimaaliset digoksiinin aloitusannokset ovat todennäköisesti jäljempänä suositeltuja pienempiä.
Digoksiinin munuaispuhdistuma on hidasta vastasyntyneillä (etenkin keskosilla) ja annos on pienennettävä sopivan suuruiseksi. Vastasyntyneitä vanhemmat lapset tarvitsevat yleensä suhteessa suurempia annoksia kuin aikuiset painon ja kehon pinta-alan perusteella, kuten alla olevassa annostustaulukossa on esitetty. Yli 10-vuotiaat lapset tarvitsevat aikuisten annoksia painoon suhteutettuna.
Ks. myös Digoxin 0,25 mg/ml injektioneste, liuos valmisteyhteenveto. Kaikkia pediatrisia suositusannoksia ei ole mahdollista toteuttaa käyttäen Digoxin Orion 0,25 mg, 0,125 mg tai 0,0625 mg tabletteja. |
Peroraalinen aloitus
Seuraavanlaisia aloitusannoksia suositellaan:
| 25 mikrog/kg/24 h |
| 30 mikrog/kg/24 h |
| 45 mikrog/kg/24 h |
| 35 mikrog/kg/24 h |
| 25 mikrog/kg/24 h |
Aloitusannos annetaan jaettuna useampaan osa-annokseen. Aluksi annetaan noin puolet kokonaisannoksesta ja loput kokonaisannoksesta 4–8 tunnin välein. Kliininen vaste on arvioitava ennen jokaista annosta.
Ylläpitohoito
Seuraavanlaisia ylläpitoannoksia suositellaan:
Keskoset: vuorokausiannos = 20 % aloitusannoksesta (laskimoon tai suun kautta).
Täysiaikaiset vastasyntyneet ja enintään 10-vuotiaat lapset: vuorokausiannos = 25 % aloitusannoksesta (laskimoon tai suun kautta).
Suositusannokset ovat ohjeellisia. Seerumin digoksiinipitoisuuksien määrityksiä ja huolellista kliinistä seurantaa (ks. kohta Annostus ja antotapa Seuranta) on käytettävä annosten muuttamisen perusteena pediatrisille potilaille.
Iäkkäät potilaat
Iäkkäillä potilailla taipumus munuaisten vajaatoimintaan ja kehon rasvattoman massan pienuus vaikuttavat digoksiinin farmakokinetiikkaan. Suuret seerumin digoksiinipitoisuudet ja niihin liittyvä toksisuus voivat ilmaantua melko nopeasti, elleivät käytetyt digoksiiniannokset ole pienempiä kuin muille kuin iäkkäille tarkoitetut annokset. Seerumin digoksiinipitoisuus on määritettävä säännöllisesti, ja hypokalemiaa on vältettävä.
Annossuositukset erityisryhmille
Ks. kohta Varoitukset ja käyttöön liittyvät varotoimet.
Vasta-aiheet
Digoksiinin käytön vasta-aiheita ovat:
- intermittoiva, täydellinen sydänkatkos ja toisen asteen eteis-kammiokatkos, etenkin, jos anamneesissa on Adams–Stokesin kohtauksia.
- sydänglykosidimyrkytyksen aiheuttamat rytmihäiriöt.
- supraventrikulaariset rytmihäiriöt, joiden taustalla on ylimääräinen eteisten ja kammioiden välinen johtorata, kuten Wolff–Parkinson–Whiten oireyhtymässä, ellei ylimääräisen johtoradan elektrofysiologisia ominaisuuksia ja digoksiinin mahdollisia haitallisia vaikutuksia näihin ominaisuuksiin ole arvioitu. Myös jos ylimääräinen johtorata on todettu tai sitä epäillään eikä anamneesissa ole aiempia supraventrikulaarisia rytmihäiriöitä, digoksiini on vasta-aiheista.
- kammiotakykardia ja kammiovärinä.
- hypertrofinen obstruktiivinen kardiomyopatia, ellei potilaalla ole samanaikaisesti eteisvärinä ja sydämen vajaatoiminta, mutta tällöinkin digoksiinin käytössä on noudatettava varovaisuutta.
- yliherkkyys digoksiinille, muille digitalisglykosideille tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Rytmihäiriöt
Digoksiinin toksisuus saattaa aiheuttaa rytmihäiriöitä, jotka saattavat muistuttaa niitä rytmihäiriöitä, joiden hoitoon digoksiinia käytetään. Esimerkiksi eteistakykardia, johon liittyy vaihtelevan asteinen eteis-kammiokatkos, vaatii erityistä huolellisuutta, sillä kliinisesti rytmi muistuttaa eteisvärinää.
Monet digoksiinin rytmihäiriöihin kohdistuvista suotuisista vaikutuksista johtuvat jonkinasteisesta eteis-kammiojohtumisen hidastamisesta. Jos potilaalla on entuudestaan epätäydellinen eteis-kammiokatkos, katkos pahenee todennäköisesti nopeasti. Täydellisessä sydänkatkoksessa idioventrikulaarinen korvausrytmi voi hidastua.
Sinus-eteisjohtumishäiriöt
Joissain sinus-eteisjohtumishäiriöissä (sairas sinus ‑oireyhtymä) digoksiini saattaa aiheuttaa tai pahentaa sinusbradykardiaa tai aiheuttaa sinus-eteiskatkoksen. Digitalishoidolle ei ole ehdotonta vasta-aihetta potilailla, joilla on sairas sinus ‑oireyhtymä. On kuitenkin selvää, että pienetkin digitalismäärät saattavat olla erittäin toksisia tietyille potilaille. Digitalisvalmisteita on käytettävä varoen, jos potilaalla on sairas sinus ‑oireyhtymä. Kun näitä potilaita on hoidettava, huolellinen seuranta (jatkuva EKG-seuranta) on tarpeen täysien terapeuttisten lääkepitoisuuksien yhteydessä. Jos on vähänkin näyttöä siitä, että digitalis provosoi sairas sinus ‑oireyhtymää, ja käytön jatkaminen on välttämätöntä, silloin on harkittava profylaktista, pysyvää tahdistinhoitoa.
Sydäninfarkti
Digoksiinin anto välittömästi sydäninfarktin jälkeen ei ole vasta-aiheista. Joillakin potilailla inotrooppisten lääkkeiden anto tässä tilanteessa voi kuitenkin johtaa epätoivottuun sydänlihaksen hapentarpeen suurenemiseen ja iskemiaan. Joissakin seurantatutkimuksissa on saatu viitteitä siitä, että digoksiinin käyttöön voi liittyä suurentunut kuoleman riski. Rytmihäiriöiden mahdollisuus on otettava huomioon potilailla, joilla saattaa olla hypokalemia sydäninfarktin jälkeen ja hemodynamiikka on todennäköisesti epävakaa. Myös sähköisen rytminsiirron rajoitukset tämän jälkeen on pidettävä mielessä.
Sydämen amyloidoosi
Digoksiinia on yleensä vältettävä, jos potilaalla on sydämen vajaatoiminta, johon liittyy sydämen amyloidoosi. Jos muut hoitovaihtoehdot eivät kuitenkaan sovellu potilaalle, digoksiinia voidaan käyttää kammiorytmin hallintaan potilailla, joilla on sydämen amyloidoosi ja eteisvärinä.
Myokardiittipotilaat
Digoksiini voi harvinaisissa tapauksissa aiheuttaa vasokonstriktiota, minkä vuoksi sen käyttöä on vältettävä myokardiittipotilaille.
Beri-beri-sydänsairaus
Digoksiinilla ei välttämättä saavuteta riittävää hoitovastetta beri-beri-sydänsairautta sairastaville potilaille, jos taustalla olevaa tiamiinin puutosta ei hoideta samanaikaisesti.
Konstriktiivinen perikardiitti
Digoksiinia ei pidä käyttää konstriktiivisen perikardiitin hoitoon, ellei sitä käytetä kammiorytmin hallintaan eteisvärinässä tai systolisen toimintahäiriön parantamiseen.
Rasituksensieto
Digoksiini parantaa rasituksensietoa, jos potilaalla on vasemman kammion systolinen toimintahäiriö ja normaali sinusrytmi. Tähän saattaa liittyä tai olla liittymättä hemodynamiikan paraneminen. Digoksiinin hyödyt supraventrikulaaristen rytmihäiriöiden hoidossa ilmenevät selkeimmin levossa ja vähemmän rasituksessa.
Hoidon keskeyttäminen
Jos potilas käyttää diureetteja ja ACE:n estäjää tai pelkkiä diureetteja, digoksiinihoidon keskeyttämisen on osoitettu johtavan kliinisen tilan heikkenemiseen.
Elektrokardiografia
Terapeuttisten digoksiiniannosten käyttö voi pidentää PR-aikaa ja laskea ST-väliä EKG-tutkimuksessa.
Digoksiini voi aiheuttaa vääriä positiivisia ST-T-muutoksia EKG-tutkimuksessa rasituskokeen aikana. Nämä elektrofysiologiset vaikutukset ovat lääkkeen odotettuja vaikutuksia eivätkä viittaa toksisuuteen.
Muut sydänglykosidit
Jos potilas on käyttänyt sydänglykosideja edeltävien kahden viikon aikana, suositeltua aloitusannosta on harkittava tarkasti. Aloitusannoksen pienentäminen on suositeltavaa.
Munuaisten vajaatoiminta
Annossuosituksia on harkittava tarkasti, jos potilas on iäkäs tai jos digoksiinin munuaispuhdistuma on pienentynyt muusta syystä. Sekä aloitusannoksen että ylläpitoannoksen pienentämistä on harkittava.
Seuranta
Digoksiinia käyttävien potilaiden seerumin elektrolyyttipitoisuuksia ja munuaisfunktiota (seerumin kreatiniinipitoisuutta) on seurattava säännöllisesti. Arviointitiheys riippuu potilaan kliinisestä tilasta.
Seerumin digoksiinipitoisuuden määrityksestä voi olla apua päätettäessä digoksiinihoidon jatkamisesta, mutta muut sydänglykosidit ja endogeeniset digoksiinin kaltaiset yhdisteet saattavat aiheuttaa ristireaktioita tutkimuksessa ja johtaa vääriin positiivisiin tuloksiin. Digoksiinihoidon väliaikainen keskeyttäminen ja keskeytyksen aikana tehtävä seuranta saattaa olla tarkoituksenmukaisempaa.
Vaikea hengitystiesairaus
Sydänlihaksen herkkyys digitalisglykosideille voi olla suurentunut, jos potilaalla on vaikea hengitystiesairaus.
Hypokalemia
Hypokalemia herkistää sydänlihasta sydänglykosidien vaikutuksille.
Hypoksia, hypomagnesemia ja hyperkalsemia
Hypoksia, hypomagnesemia ja merkittävä hyperkalsemia lisäävät sydänlihaksen herkkyyttä sydänglykosideille.
Kilpirauhassairaus
Digoksiinin anto kilpirauhassairautta sairastaville potilaille edellyttää huolellisuutta. Digoksiinin aloitus- ja ylläpitoannoksia on pienennettävä, jos kilpirauhasen toiminta on heikentynyt. Kilpirauhasen liikatoimintaan liittyy suhteellinen digoksiiniresistenssi, joten annosta on ehkä suurennettava. Tyreotoksikoosin hoidon aikana annostusta on pienennettävä samalla kun tyreotoksikoosi saadaan hallintaan.
Imeytymishäiriö
Jos potilaalla on imeytymishäiriö tai ruuansulatuskanavan rekonstruktio, digoksiiniannosta voidaan joutua suurentamaan.
Laktoosi
Potilaiden, joilla on harvinainen perinnöllinen galaktoosi-intoleranssi, saamelaisilla esiintyvä laktaasinpuutos tai glukoosi-galaktoosi-imeytymishäiriö, ei pidä käyttää tätä lääkettä.
Sähköinen rytminsiirto
Sähköisen rytminsiirron aiheuttamien vaarallisten rytmihäiriöiden riski on voimakkaasti suurentunut digitalismyrkytyksessä ja on suhteessa rytminsiirrossa käytettyyn energiaan.
Jos digoksiinia käyttävälle potilaalle tehdään elektiivinen sähköinen rytminsiirto, digoksiinihoito on keskeytettävä 24 tunnin ajaksi ennen rytminsiirtoa. Hätätilanteissa (esim. sydämenpysähdys) rytminsiirtoa on yritettävä pienimmällä tehokkaalla energiamäärällä.
Sähköinen rytminsiirto ei ole tarkoituksenmukaista rytmihäiriöiden hoidossa, jos niiden arvellaan johtuvan sydänglykosideista.
Laboratoriokokeisiin liittyvät häiriöt
Virheellisiä tuloksia kohonneista digoksiinin seerumipitoisuuksista voi syntyä riippumatta siitä, hoidetaanko heitä digoksiinilla, kun entsalutamidia saavilta potilailta otetut näytteet analysoidaan kemiluminesenssi-mikropartikkeli-immunomäärityksellä (CMIA). Jos tulokset ovat epävarmoja, on suositeltavaa vahvistaa digoksiinin seerumipitoisuudet vaihtoehtoisella määrityksellä, johon ei liity tunnettuja häiriöitä, jotta digoksiinin tarpeeton lopettaminen tai annoksen pienentäminen vältetään (ks. kohta Yhteisvaikutukset).
Yhteisvaikutukset
Yhteisvaikutukset voivat johtua vaikutuksista, jotka kohdistuvat munuaisteitse tapahtuvaan eritykseen, kudoksiin sitoutumiseen, plasman proteiineihin sitoutumiseen, jakautumiseen elimistössä, imeytymiskapasiteettiin suolistossa, P-glykoproteiinin aktiivisuuteen ja potilaan herkkyyteen digoksiinille. Yhteisvaikutuksen mahdollisuuden huomioiminen samanaikaisen lääkehoidon yhteydessä on paras varotoimenpide. Seerumin digoksiinipitoisuuden määritys on suositeltavaa, jos epäilyksiä yhteisvaikutuksista on.
Digoksiini on P-glykoproteiinin substraatti. Näin ollen P-glykoproteiinin estäjät saattavat suurentaa veren digoksiinipitoisuutta lisäämällä digoksiinin imeytymistä ja/tai vähentämällä sen munuaispuhdistumaa (ks. kohta Farmakokinetiikka). P-glykoproteiinin induktio voi pienentää plasman digoksiinipitoisuutta.
Vältettävät yhdistelmät
Yhdistelmät, joiden käyttö saattaa voimistaa digoksiinin vaikutuksia:
Digoksiini saattaa pidentää eteis-kammiojohtumisaikaa yhteiskäytössä beetasalpaajien kanssa.
Hypokalemiaa tai intrasellulaarista kaliumin puutosta aiheuttavat lääkkeet voivat lisätä herkkyyttä digoksiinille. Tällaisia aineita ovat mm. eräät diureetit, litiumsuolat, kortikosteroidit ja karbenoksoloni. Jos diureetteja (kuten loop-diureetteja tai hydroklooritiatsidia) käytetään samanaikaisesti, munuaisfunktiota ja seerumin elektrolyyttipitoisuuksia on seurattava tarkasti.
Kalsium voi aiheuttaa vakavia rytmihäiriöitä digitalisoiduille potilaille etenkin, jos kalsiumia annetaan nopeasti laskimoon.
Sympatomimeettisillä lääkkeillä on suoria positiivisia kronotrooppisia vaikutuksia, jotka voivat aiheuttaa sydämen rytmihäiriöitä ja myös johtaa hypokalemiaan, joka voi puolestaan aiheuttaa tai pahentaa sydämen rytmihäiriöitä. Digoksiinin ja sympatomimeettisten lääkkeiden samanaikainen käyttö voi suurentaa sydämen rytmihäiriöiden riskiä.
Yhdistelmät, joiden käyttö edellyttää varovaisuutta
Yhdistelmät, joiden käyttö saattaa voimistaa digoksiinin vaikutuksia: amiodaroni, daklatasviiri, dronedaroni, flekainidi, flibanseriini, pratsosiini, propafenoni, kinidiini, spironolaktoni, makrolidiantibiootit (esim. erytromysiini ja klaritromysiini), tetrasykliinit (ja mahdollisesti muut antibiootit), gentamisiini, isavukonatsoli, itrakonatsoli, posakonatsoli, ivakaftori, kanagliflotsiini, kiniini, mirabegroni, trimetopriimi, alpratsolaami, indometasiini, propanteliini, nefatsodoni, atorvastatiini, siklosporiini, epoprostenoli (ohimenevästi), karvediloli, ranolatsiini, ritonaviiri/ritonaviiriä sisältävät lääkitykset, simepreviiri, talepreviiri, telmisartaani, tikagrelori, vasopressiinireseptorin salpaajat (tolvaptaani ja konivaptaani), velpatasviiri, venetoklaksi, lapatinibi, vandetanibi, vemurafenibi ja osimertinibi.
Sydämen vajaatoimintapotilailla digoksiinin ja sennosidien samanaikaiseen käyttöön saattaa liittyä kohtalaisesti suurentunut digoksiinin toksisuuden riski.
Digoksiinia käyttävät potilaat ovat herkempiä suksametonin käytön vuoksi ilmenevän hyperkalemian vaikutuksille.
Lapatinibin ja suun kautta otetun digoksiinin samanaikainen käyttö suurensi digoksiinin AUC-arvoa. Digoksiinin ja lapatinibin samanaikainen käyttö edellyttää varovaisuutta.
Afferenttien ja efferenttien pikkuvaltimoiden tonusta muuttavat lääkkeet saattavat vaikuttaa glomerulussuodatukseen. Angiotensiinikonvertaasin estäjät (ACE:n estäjät) ja angiotensiinireseptorin salpaajat (ATR-salpaajat) vähentävät angiotensiini II -välitteistä efferenttien pikkuvaltimoiden supistumista, kun taas steroideihin kuulumattomat tulehduskipulääkkeet (NSAID) ja syklo-oksigenaasi-2-entsyymin (COX-2) estäjät vähentävät prostaglandiinivälitteistä afferenttien pikkuvaltimoiden laajenemista. ATR-salpaajat, ACE:n estäjät, NSAID-lääkkeet ja COX-2-estäjät eivät muuttaneet digoksiinin farmakokinetiikkaa merkittävästi tai eivät aiheuttaneet johdonmukaisia muutoksia sen farmakokineettisiin parametreihin. Nämä lääkkeet voivat kuitenkin vaikuttaa munuaisten toimintaan joillakin potilailla ja aiheuttaa siten sekundaarista digoksiinipitoisuuksien suurenemista.
Kalsiuminestäjät voivat suurentaa seerumin digoksiinipitoisuutta mutta eivät välttämättä aiheuta mitään muutosta. Verapamiili, felodipiini ja tiapamiili suurentavat seerumin digoksiinipitoisuutta. Nifedipiini ja diltiatseemi voivat suurentaa seerumin digoksiinipitoisuutta tai olla vaikuttamatta siihen. Isradipiini ei aiheuta muutoksia. Kalsiuminestäjien ja etenkin diltiatseemin ja verapamiilin tiedetään myös hidastavan impulssien johtumista sinussolmukkeen ja AV-solmukkeen läpi.
Protonipumpun estäjät (PPI) pystyvät suurentamaan plasman digoksiinipitoisuutta estämällä digoksiinin ulosvirtausta, jolloin plasman digoksiinipitoisuus suurenee. Omepratsoli estää digoksiinin metaboliaa ruoansulatuskanavassa, mikä suurentaa plasman digoksiinipitoisuutta. Samankaltaisia vaikutuksia on raportoitu vähäisemmässä määrin pantopratsolilla ja rabepratsolilla.
Yhdistelmät, joiden käyttö saattaa heikentää digoksiinin vaikutuksia: antasidit, bupropioni, eräät bulkkilaksatiivit, kaoliini-pektiini, akarboosi, neomysiini, penisillamiini, rifampisiini, jotkin solunsalpaajat, metoklopramidi, sulfasalatsiini, adrenaliini, salbutamoli, kolestyramiini, fenytoiini, mäkikuisma (Hypericum perforatum) ja enteraalinen täydennysravitsemus.
Bupropioni ja sen tärkein verenkierrossa oleva metaboliitti stimuloivat OATP4C1-välitteistä digoksiinin kuljetusta riippumatta siitä, annettiinko samanaikaisesti digoksiinia vai ei. Digoksiinin on todettu olevan aOATP4C1-substraatti proksimaalisten munuaistubulusten basolateraalisella puolella. Bupropionin ja sen metaboliittien sitoutuminen OATP4C1:een saattaa lisätä digoksiinin kuljetusta ja siten myös digoksiinin erittymistä munuaisten kautta.
Muut yhteisvaikutukset
Milrinoni ei muuta vakaan tilan digoksiinipitoisuutta seerumissa.
Seerumin digoksiinipitoisuuksien määrittäminen kemiluminesenssi-mikropartikkeli-immunomäärityksellä (CMIA) entsalutamidin käytön yhteydessä voi johtaa virheellisiin tuloksiin kohonneista digoksiinin seerumipitoisuuksista. Tulokset on vahvistettava muun tyyppisellä määrityksellä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Raskaus ja imetys
Hedelmällisyys
Digoksiinin vaikutuksesta ihmisen hedelmällisyyteen ei ole tietoa.
Teratogeenisyys
Ei tiedetä, onko digoksiinilla teratogeenisiä vaikutuksia.
Raskaus
Digoksiinin käyttö raskausaikana ei ole vasta-aiheista, mutta annostusta saattaa olla vaikeampi ennakoida raskaana olevilla naisilla, sillä digoksiinin annostusta täytyy joskus suurentaa raskauden aikana. Kuten kaikkien lääkkeiden yhteydessä, digoksiinin käyttöä raskauden aikana on harkittava vain, jos hoidon odotettavissa oleva kliininen hyöty äidille on sikiölle mahdollisesti koituvaa riskiä suurempi.
Voimakkaasta antenataalisesta digitalisaltistuksesta huolimatta sikiöillä ja vastasyntyneillä ei ole havaittu merkitseviä haittavaikutuksia, kun äidin seerumin digoksiinipitoisuus on pysynyt viitealueella. On spekuloitu, että digoksiinin suora vaikutus myometriumiin saattaa aiheuttaa suhteellista keskosuutta ja syntymäpainon pienuutta, mutta aiemmin todetun sydänsairauden vaikutusta ei voida sulkea pois. Äidille annetulla digoksiinilla on hoidettu onnistuneesti sikiön takykardiaa ja kongestiivista sydämen vajaatoimintaa.
Sikiöhaittavaikutuksia on raportoitu äideiltä, joilla on ollut digitalis-intoksikaatio.
Imetys
Digoksiini erittyy rintamaitoon, mutta määrät ovat hyvin pieniä eikä imetys ole vasta-aiheista.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Keskushermosto- ja näköhäiriöitä on ilmoitettu digoksiinia käyttävillä potilailla (ks. kohta Haittavaikutukset). Jos näitä haittavaikutuksia ilmenee, potilaiden on pidättäydyttävä ajamisesta, koneiden käyttämisestä ja muista vaarallisista tehtävistä.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Digoksiinin haittavaikutukset ovat yleensä annosriippuvaisia ja niitä esiintyy käytettäessä suurempia annoksia kuin terapeuttisen vaikutuksen saavuttamiseen tarvitaan.
Haittavaikutukset ovat harvinaisempia, kun digoksiinia käytetään suositusannoksin ja seerumin suositellulla terapeuttisella pitoisuusalueella, ja kun muut samanaikaiset lääkitykset ja sairaudet otetaan tarkoin huomioon.
Haittavaikutustaulukko
Haittavaikutukset on luokiteltu alla elinjärjestelmän ja esiintymistiheyden mukaan. Yleisyyden määritelmät ovat seuraavat:
Hyvin yleiset ≥ 1/10 Yleiset ≥ 1/100, < 1/10 Melko harvinaiset ≥ 1/1 000, < 1/100 Harvinaiset ≥ 1/10 000, < 1/1 000 Hyvin harvinaiset < 1/10 000, mukaan lukien yksittäiset raportit.
Hyvin yleiset, yleiset ja melko harvinaiset tapahtumat on selvitetty yleensä kliinisten tutkimusten tiedoista. Ilmaantuvuus lumehoidossa on otettu huomioon. Markkinoille tulon jälkeisen seurannan aikana havaitut haittavaikutukset on luokiteltu harvinaisiksi tai hyvin harvinaisiksi (mukaan lukien yksittäiset raportit).
Elinjärjestelmä | Yleisyys | Haittavaikutukset |
Veri ja imukudos | Hyvin harvinaiset | Trombosytopenia |
Aineenvaihdunta ja ravitsemus | Hyvin harvinaiset | Ruokahalun heikentyminen |
Psyykkiset häiriöt | Melko harvinaiset | Masentuneisuus |
Hyvin harvinaiset | Psykoottiset häiriöt, apatia, sekavuus | |
Hermosto | Yleiset | Hermoston häiriöt, huimaus |
Hyvin harvinaiset | Päänsärky | |
Silmät | Yleiset | Näköhäiriöt (näön hämärtyminen tai keltaisena näkeminen) |
Sydän | Yleiset | Rytmihäiriöt, johtumishäiriöt, bigeminia, trigeminia, PR-ajan piteneminen, sinusbradykardia |
Hyvin harvinaiset | Supraventrikulaarinen takyarytmia, eteistakykardia (johon voi liittyä SA- tai AV-katkos), supraventrikulaarinen takykardia (nodaalinen rytmihäiriö), kammioperäiset rytmihäiriöt, kammiolisälyönnit, EKG-tutkimuksessa ST-välin lasku | |
Ruoansulatuselimistö | Yleiset | Pahoinvointi, oksentelu, ripuli |
Hyvin harvinaiset | Suoli-iskemia, ruoansulatuskanavan nekroosi | |
Iho ja ihonalainen kudos | Yleiset | Ihottuma* |
Sukupuolielimet ja rinnat | Hyvin harvinaiset | Gynekomastiaa* |
Yleisoireet ja antopaikassa todettavat haitat | Hyvin harvinaiset | Väsymys, huonovointisuus, heikotus |
* Katso “Valittujen haittavaikutusten kuvaus”
Valittujen haittavaikutusten kuvaus
Iho ja ihonalainen kudos
Nokkosihottumaan tai tulirokkoihottumaan voi liittyä voimakas eosinofilia
Sukupuolielimet ja rinnat
Gynekomastiaa voi esiintyä pitkäaikaishoidon yhteydessä
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea Lääkkeiden haittavaikutusrekisteri PL 55 00034 Fimea
Yliannostus
Oireet ja löydökset
Toksisuuden oireet ja löydökset ovat yleensä samankaltaisia kuin kohdassa Haittavaikutukset kuvatut haittavaikutukset, mutta ne voivat olla yleisempiä ja vaikeampia. Digoksiinin toksisuuteen liittyvät oireet ja löydökset yleistyvät pitoisuuden ollessa yli 2,0 ng/ml (2,56 nmol/l). Yksilöllinen vaihtelu on kuitenkin suurta. Kliininen tila, seerumin elektrolyyttipitoisuus ja kilpirauhasen toiminta ovat tärkeitä tekijöitä, kun päätellään, johtuvatko potilaan oireet digoksiinista (ks. kohta Annostus ja antotapa). Hemodialyysipotilailla digoksiinin käyttöön liittyy suurentunut kuolleisuus. Tämä koskee etenkin potilaita, joilla ennen dialyysiä mitattu seerumin kaliumpitoisuus on matala.
Aikuiset
Kliiniset havainnot viittaavat siihen, että 10–15 mg:n digoksiiniannos aiheutti kuoleman puolelle aikuispotilaista, joilla ei ollut sydänsairautta. Yli 25 mg digoksiiniannos aikuiselle, jolla ei ollut sydänsairautta, johti kuolemaan tai pahenevaan toksisuuteen, joka reagoi vain digoksiinia sitovaan Fab-vasta-ainefragmenttiin (antitoksiiniin).
Sydänoireet
Sydänoireet ovat akuutin ja kroonisen toksisuuden yleisimpiä ja vakavimpia merkkejä. Sydänvaikutukset ovat huipussaan yleensä 3–6 tunnin kuluttua yliannostuksesta ja ne voivat kestää 24 tuntia tai pidempään. Digoksiinimyrkytys voi aiheuttaa lähes kaikentyyppisiä rytmihäiriöitä. Useanlaiset rytmihäiriöt samalla potilaalla ovat yleisiä. Näitä ovat mm. paroksysmaalinen eteistakykardia, johon liittyy ajoittainen eteis-kammiokatkos, nopea junktionaalinen rytmi, hidas eteisvärinä (kammiorytmi vaihtelee hyvin vähän) ja bifaskikulaarinen kammiotakykardia.
Kammiolisälyönnit ovat usein varhaisin ja yleisin rytmihäiriö. Myös bigeminia ja trigeminia ovat yleisiä. Sinusbradykardia ja muut bradyarytmiat ovat hyvin yleisiä. Myös ensimmäisen, toisen ja kolmannen asteen sydänkatkokset ja AV-dissosiaatio ovat yleisiä. Varhaisvaiheen toksisuus saattaa ilmetä vain PR-ajan pidentymisenä. Toksisuus saattaa ilmetä myös kammiotakykardiana.
Asystolian aiheuttama sydämenpysähdys tai digoksiinitoksisuudesta johtuva kammiovärinä johtaa yleensä kuolemaan. Akuutti massiivinen digoksiiniyliannostus voi johtaa lievään tai merkittävään hyperkalemiaan, joka johtuu natrium-kaliumpumpun (Na+-K+) estosta. Hypokalemia voi edistää digoksiinin toksisuutta (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Muut kuin sydänoireet
Ruuansulatuskanavan oireet ovat hyvin yleisiä sekä akuutissa että kroonisessa myrkytyksessä. Useimpien raporttien mukaan ruuansulatuskanavan oireet edeltävät sydänoireita noin puolella potilaista. Ruokahaluttomuuden, pahoinvoinnin ja oksentelun ilmaantuvuus on raportoinnin perusteella enintään 80 %. Näitä oireita esiintyy yleensä yliannostuksen varhaisvaiheessa.
Neurologisia oireita ja näköoireita esiintyy sekä akuutissa että kroonisessa myrkytyksessä. Huimaus, erilaiset keskushermostohäiriöt, väsymys ja huonovointisuus ovat hyvin yleisiä. Yleisin näköhäiriö on värinäön poikkeavuus (keltavihreänä näkeminen). Neurologisia oireita ja näköoireita voi esiintyä senkin jälkeen kun muut myrkytyksen oireet ovat hävinneet.
Kroonisessa myrkytyksessä sydämeen liittymättömät epäspesifiset oireet, kuten huonovointisuus ja heikotus saattavat vallita.
Pediatriset potilaat
Kliinisten havaintojen mukaan 6–10 mg:n digoksiiniannos aiheutti kuoleman puolelle 1–3-vuotiaista lapsipotilaista, joilla ei ollut sydänsairautta. Yli 10 mg digoksiiniannos 1–3-vuotiaalle lapselle, jolla ei ollut sydänsairautta, johti systemaattisesti kuolemaan, jos Fab-fragmenttihoitoa (antitoksiinia) ei annettu. Useimmat toksisuuden oireet ilmaantuvat lapsille digoksiinihoidon aloitusvaiheessa tai pian sen jälkeen.
Sydänoireet
Lapsilla voi esiintyä samoja rytmihäiriöitä tai rytmihäiriöyhdistelmiä kuin aikuisilla. Sinustakykardiaa, supraventrikulaarista takykardiaa ja nopeaa eteisvärinää esiintyy lapsilla harvemmin. Lapsilla esiintyy todennäköisemmin eteis-kammiojohtumishäiriöitä tai sinusbradykardiaa. Kammiolisälyöntisyys on harvinaisempaa, mutta suuren yliannostuksen yhteydessä on kuitenkin raportoitu ilmenneen kammiolisälyöntisyyttä, kammiotakykardiaa ja kammiovärinää.
Vastasyntyneillä sinusbradykardia tai sinuspysähdys ja/tai PR-ajan piteneminen ovat yleisiä toksisuuden merkkejä. Sinusbradykardia on yleistä vauvoilla ja pikkulapsilla. Vanhemmilla lapsilla eteis-kammiokatkokset ovat yleisimpiä johtumishäiriöitä.
Jos digoksiinia käyttävälle lapselle kehittyy rytmihäiriö tai sydämen johtumishäiriö, sen on oletettava johtuvan digoksiinista, kunnes jatkotutkimukset osoittavat toisin.
Muut kuin sydänoireet
Yleiset sydämeen liittymättömät oireet ovat samankaltaisia kuin aikuisilla eli ruuansulatuskanava-, keskushermosto- ja näköoireita. Pahoinvointi ja oksentelu eivät kuitenkaan ole yleisiä vauvoilla ja pikkulapsilla. Suositusannosten yhteydessä havaittujen haittavaikutusten lisäksi yliannostuksen jälkeen on raportoitu painonlaskua vanhemmissa ikäryhmissä ja painonkehityksen hidastumista vauvoilla, suoliliepeen valtimoiskemiasta johtuvaa vatsakipua, uneliaisuutta ja käytöshäiriöitä, myös psykoosia.
Hoito
Äskettäin tapahtuneen yliannostuksen (kuten itse aiheutetun tahattoman tai tarkoituksellisen myrkytyksen) jälkeen imeytyvää määrää voidaan vähentää mahahuuhtelulla. Mahahuuhtelu lisää vagaalista tonusta ja saattaa aiheuttaa tai pahentaa rytmihäiriöitä. Atropiiniesilääkitystä on harkittava, jos potilaalle tehdään mahahuuhtelu. Digitaliksen Fab-vasta-ainehoito (antitoksiini) tekee mahahuuhtelun yleensä tarpeettomaksi. Niissä harvoissa tilanteissa, joissa mahahuuhtelu on aiheellista, toimenpiteen saa suorittaa vain henkilö, jolla on asianmukainen koulutus ja asiantuntemus.
Jos potilas on ottanut massiivisen digitalisannoksen, hänelle on annettava lääkehiiltä toistuvasti imeytymisen estämiseksi ja digoksiinin sitomiseksi suolistossa enteroenteraalisen kierron aikana.
Jos potilaalla on hypokalemia, se on korjattava joko suun kautta tai laskimoon annettavilla kaliumlisillä tilanteen kiireellisyydestä riippuen. Jos potilas on ottanut suuren määrän digoksiinia, luurankolihaksista vapautuva kalium saattaa aiheuttaa hyperkalemian. Seerumin kaliumpitoisuus on mitattava ennen kaliumin antoa digoksiiniyliannostuksen yhteydessä.
Bradyarytmiat voivat reagoida atropiiniin, mutta väliaikainen sydämen tahdistus voi olla tarpeen. Kammioperäiset rytmihäiriöt voivat reagoida lidokaiiniin tai fenytoiiniin.
Dialyysi ei ole tehokas tapa poistaa digoksiinia elimistöstä, jos potilaalla on mahdollisesti henkeä uhkaava myrkytys.
Digoksiinispesifinen Fab-vasta-aine (antitoksiini) on tehokas digoksiinimyrkytyksen täsmähoito. Digoksiinispesifisten (lampaan) vasta-ainefragmenttien (Fab) anto laskimoon on johtanut digoksiinin, digitoksiinin ja niiden sukuisten sydänglykosidien aiheuttamien vakavien myrkytysoireiden nopeaan kumoutumiseen. Lisätietoja, ks. vasta-ainefragmenttien käyttöohjeet.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: sydänlääkkeet, sydänglykosidit
ATC-koodi: C01AA05
Vaikutusmekanismi
Digoksiini lisää sydänlihaksen supistuvuutta suoran vaikutuksen kautta. Vaikutus on annosvasteinen pienillä annoksilla ja osa vaikutuksista saadaan jopa hyvin pienillä annoksilla. Nämä vaikutukset ilmenevät myös terveessä sydänlihaksessa, vaikka ne eivät johdakaan fysiologiseen hyötyyn. Digoksiinin ensisijainen vaikutus on estää spesifisesti adenosiinitrifosfataasia ja täten natrium-kalium-vaihtoa (Na+-K+). Solukalvon ionien muuttunut jakauma lisää kalsiumionien soluun ottoa ja siten kalsiumin saatavuutta sydänlihaksen supistuksen aikana. Digoksiinin vaikutusvoimakkuus voi näin ollen lisääntyä huomattavasti, jos solunulkoinen kaliumpitoisuus on pieni. Hyperkalemialla on päinvastainen vaikutus.
Digoksiinilla on sama Na+-K+-vaihtomekanismia estävä perusvaikutus autonomisen hermoston soluissa. Digoksiini stimuloi näitä hermosoluja vaikuttamaan epäsuorasti sydämen toimintaan. Efferenttien vagusimpulssien lisääntyminen vähentää sympaattista tonusta ja impulssien johtumisnopeutta eteisen ja AV-solmukkeen läpi. Täten digoksiinin merkittävä hyöty on kammiorytmin hidastaminen.
Farmakodynaamiset vaikutukset
Epäsuorat sydämen supistuvuuden muutokset johtuvat myös laskimoiden myötäävyyden muutoksista, jotka ovat seurausta autonomisen aktiivisuuden muutoksista ja suorasta laskimostimulaatiosta. Suoran ja epäsuoran vaikutuksen vuorovaikutus ohjaa verenkierron kokonaisvastetta, joka ei ole sama kaikilla potilailla. Jos potilaalla on jokin supraventrikulaarinen rytmihäiriö, eteis-kammiojohtumisen neurogeenisesti tapahtuva hidastaminen on tärkeää.
Sydämen vajaatoimintapotilailla neurohormonaalisen aktivaation asteeseen liittyy kliinisen tilan heikentyminen ja suurentunut kuoleman riski. Digoksiini vähentää sekä sympaattisen hermoston että reniini-angiotensiinijärjestelmän aktivaatiota riippumatta inotrooppisista vaikutuksista ja voi täten vaikuttaa kuolleisuutta vähentävästi. On edelleen epäselvää, johtuuko tämä sympaattisen hermoston estovaikutuksista vai baroheijastemekanismeista.
Farmakokinetiikka
Imeytyminen
Laskimoon annetulla aloitusannoksella saavutetaan merkittävä farmakologinen vaikutus 5–30 minuutissa. Huippuvaikutus saavutetaan 1–5 tunnissa. Suun kautta otettu digoksiini imeytyy mahasta ja ohutsuolen yläosasta. Jos digoksiini otetaan ruokailun jälkeen, imeytyminen hidastuu, mutta imeytyvän digoksiinin kokonaismäärä ei yleensä muutu. Jos digoksiini otetaan runsaskuituisen aterian yhteydessä, suun kautta otetusta annoksesta imeytyvä määrä saattaa kuitenkin pienentyä.
Oraalisen annoksen jälkeen vaikutus alkaa 0,5–2 tunnin kuluessa ja huippu saavutetaan 2–6 tunnissa. Suun kautta otetun digoksiinin biologinen hyötyosuus on noin 63 % (tabletti) ja 75 % (oraaliliuos).
Jakautuminen
Digoksiinin alkuvaiheen jakautuminen sentraalisesta perifeeriseen tilaan kestää yleensä 6–8 tuntia. Tämän jälkeen seerumin digoksiinipitoisuus pienenee vähitellen riippuen digoksiinin eliminaatiosta. Jakautumistilavuus on suuri (Vdss = 510 litraa terveillä koehenkilöillä), mikä osoittaa, että digoksiini sitoutuu voimakkaasti elimistön kudoksiin. Digoksiinipitoisuudet ovat suurimpia sydämessä, maksassa ja munuaisissa. Pitoisuus sydämessä on keskimäärin 30-kertainen verrattuna systeemiseen verenkiertoon. Pitoisuus luurankolihaksissa on paljon pienempi, mutta tätä varastoa ei voida jättää huomiotta, sillä luurankolihaksia on 40 % kokonaispainosta. Plasman pienestä digoksiinipitoisuudesta noin 25 % sitoutuu proteiineihin.
Biotransformaatio
Digoksiinin päämetaboliitit ovat dihydrodigoksiini ja digoksigeniini.
Eliminaatio
Tärkein eliminaatioreitti on muuttumattoman lääkkeen eliminaatio munuaisteitse.
Digoksiini on P-glykoproteiinin substraatti. Enterosyyttien apikaalisen kalvon kuljettajaproteiini P-glykoproteiini voi rajoittaa digoksiinin imeytymistä. Proksimaalisten munuaistubulusten P-glykoproteiini näyttää olevan tärkeä tekijä digoksiinin munuaisteitse tapahtuvassa eliminaatiossa (ks. kohta Yhteisvaikutukset).
Terveillä tutkimushenkilöillä laskimoon annetusta digoksiiniannoksesta 60–75 % erittyi muuttumattomana virtsaan kuuden vuorokauden seurantajakson aikana. Digoksiinin kokonaispuhdistuman on osoitettu olevan suorassa suhteessa munuaisfunktioon. Vuorokausipoistuma (%) on siis kreatiniinipuhdistuman funktio, joka taas voidaan määrittää vakaasta seerumin kreatiniinipitoisuudesta. Digoksiinin kokonaispuhdistuman on osoitettu olevan 193 25 ml/min ja munuaispuhdistuman 152 24 ml/min terveillä tutkimushenkilöillä.
Pienellä osalla potilaista paksusuolen bakteerit muuttavat suun kautta otetun digoksiinin sydämen kannalta inaktiivisiksi pelkistymistuotteiksi ruuansulatuskanavassa. Näillä henkilöillä yli 40 % annoksesta saattaa erittyä digoksiinin pelkistymistuotteina virtsaan. Kahden päämetaboliitin munuaispuhdistuma on 79 13 ml/min (dihydrodigoksiini) ja 100 26 ml/min (digoksigeniini). Valtaosassa potilaista digoksiini erittyy kuitenkin muuttumattomana pääasiallisesti munuaisteitse.
Digoksiinin terminaalinen eliminaation puoliintumisaika on 30–40 tuntia potilailla, joiden munuaistoiminta on normaali.
Suurin osa digoksiinista sitoutuu kudoksiin eikä ole verenkierrossa, joten se ei poistu elimistöstä tehokkaasti sydän-keuhkokonehoidon aikana. Vain noin 3 % digoksiiniannoksesta poistuu elimistöstä 5 tunnin hemodialyysin aikana.
Erityisryhmät
Vastasyntyneet, vauvaikäiset ja enintään 10-vuotiaat lapset
Vastasyntyneillä digoksiinin munuaispuhdistuma on hidastunut ja annostus on muutettava sopivaksi. Tämä on otettava huomioon etenkin keskosia hoidettaessa, sillä munuaispuhdistuma heijastaa munuaistoiminnan kypsymistä. Digoksiinin puhdistuma on 3 kk kohdalla 65,6 30 ml/min/1,73 m2 ja vain 32 7 ml/min/1,73 m2 yhden viikon kohdalla. Vastasyntyneitä vanhemmat lapset tarvitsevat yleensä suhteessa suurempia annoksia kuin aikuiset painon ja kehon pinta-alan perusteella.
Munuaisten vajaatoiminta
Digoksiinin terminaalinen eliminaation puoliintumisaika on pidentynyt munuaisten vajaatoimintapotilailla ja saattaa olla anuriapotilailla noin 100 tuntia.
Prekliiniset tiedot turvallisuudesta
Karsinogeneesi, mutageneesi
Digoksiinin ei havaittu olevan genotoksista in vitro ‑tutkimuksissa (Amesin testi ja hiiren lymfoomatesti). Digoksiinin karsinogeenisuudesta ei ole tietoja.
Farmaseuttiset tiedot
Apuaineet
Digoxin Orion mite 0,0625 mg tabletti
Laktoosimonohydraatti
Maissitärkkelys
Indigokarmiini (FD&C Blue No. 2)
Muunnettu maissitärkkelys
Riisitärkkelys
Povidoni
Magnesiumstearaatti
Digoxin Orion 0,25 mg ja Digoxin Orion semi 0,125 mg tabletti
Laktoosimonohydraatti
Maissitärkkelys
muunnettu maissitärkkelys
Magnesiumstearaatti
Riisitärkkelys
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta
Säilytys
Säilytä alle 25 °C.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
DIGOXIN ORION tabletti
0,25 mg (L:kyllä) 90 fol (15,46 €)
DIGOXIN ORION MITE tabletti
0,0625 mg (L:kyllä) 90 fol (15,46 €)
DIGOXIN ORION SEMI tabletti
0,125 mg (L:kyllä) 90 fol (15,46 €)
PF-selosteen tieto
Digoxin Orion mite 0,0625 mg tabletti
90 tablettia. Valkoinen, läpinäkymätön PVC/alumiinifolioläpipainopakkaus.
60 tablettia. Valkoinen, läpinäkymätön PVC/alumiinifolioläpipainopakkaus.
30 tablettia. Valkoinen, läpinäkymätön PVC/alumiinifolioläpipainopakkaus.
Digoxin Orion semi 0,125 mg tabletti
90 tablettia. Valkoinen, läpinäkymätön PVC/alumiinifolioläpipainopakkaus.
60 tablettia. Valkoinen, läpinäkymätön PVC/alumiinifolioläpipainopakkaus.
30 tablettia. Valkoinen, läpinäkymätön PVC/alumiinifolioläpipainopakkaus.
Digoxin Orion 0,25 mg tabletti
90 tablettia. Valkoinen, läpinäkymätön PVC/alumiinifolioläpipainopakkaus.
60 tablettia. Valkoinen, läpinäkymätön PVC/alumiinifolioläpipainopakkaus.
30 tablettia. Valkoinen, läpinäkymätön PVC/alumiinifolioläpipainopakkaus.
Valmisteen kuvaus:
Digoxin Orion mite 0,0625 mg tabletti
Sininen, pyöreä, kaksoiskupera tabletti, jossa toisella puolella kaiverrus ”DO6” ja toisella puolella ei mitään merkintöjä.
Digoxin Orion semi 0,125 mg tabletti
Valkoinen, pyöreä, litteä tabletti, jossa toisella puolella kaiverrus ”DO12” ja toisella puolella ei mitään merkintöjä.
Digoxin Orion 0,25 mg tabletti*)
Valkoinen, pyöreä, kaksoiskupera tabletti, jossa toisella puolella jakouurre ja kaiverrus ”DO25” ja toisella puolella ei mitään merkintöjä.
*)Jakouurre on tarkoitettu vain nielemisen helpottamiseksi eikä jakamiseksi yhtä suuriin annoksiin.
Käyttö- ja käsittelyohjeet
Ei oleellinen.
Korvattavuus
DIGOXIN ORION tabletti
0,25 mg 90 fol
DIGOXIN ORION MITE tabletti
0,0625 mg 90 fol
DIGOXIN ORION SEMI tabletti
0,125 mg 90 fol
- Alempi erityiskorvaus (65 %). Krooninen sydämen vajaatoiminta (201), Krooniset sydämen rytmihäiriöt (207).
- Peruskorvaus (40 %).
ATC-koodi
C01AA05
Valmisteyhteenvedon muuttamispäivämäärä
16.08.2025
Yhteystiedot
 ORION OYJ ORION PHARMA
ORION OYJ ORION PHARMA Orionintie 1, PL 65
02101 Espoo
010 4261
www.orion.fi
etunimi.sukunimi@orionpharma.com
