DIFLUCAN jauhe oraalisuspensiota varten 40 mg/ml
Vaikuttavat aineet ja niiden määrät
Yksi millilitra käyttövalmista Diflucan-oraalisuspensiota sisältää 40 mg flukonatsolia.
Apuaineet, joiden vaikutus tunnetaan: Yksi millilitra käyttövalmista oraalisuspensiota sisältää 0,55 g sakkaroosia ja 2,38 mg natriumbentsoaattia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Jauhe oraalisuspensiota varten.
Kliiniset tiedot
Käyttöaiheet
Diflucan on tarkoitettu käytettäväksi alla mainituissa sieni-infektioissa (ks. kohta Farmakodynamiikka).
Diflucan on tarkoitettu aikuisille seuraavien sieni-infektioiden hoitoon:
- Kryptokokkimeningiitti (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
- Koksidioidomykoosi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
- Invasiivinen Candida-infektio
- Limakalvojen kandidoosi, mukaan lukien Candidan aiheuttama suu-nieluseudun ja ruokatorven kandidoosi, kandiduria ja krooninen mukokutaaninen kandidoosi
- Krooninen suun atrofinen kandidoosi (hammasproteeseihin liittyvät suun haavaumat), jos suuhygienia tai paikallishoito ei riitä
- Akuutit ja toistuvat Candida-vaginiitit, kun paikallishoito ei ole mahdollinen
- Candidan aiheuttama balaniitti, kun paikallishoito ei ole mahdollinen
- Ihon sieni-infektiot, mukaan lukien tinea pedis, tinea corporis, tinea cruris, tinea versicolor ja dermaaliset Candida-infektiot, kun systeeminen hoito on indikoitu
- Tinea unguinium (kynsien sieni-infektio), kun muiden lääkkeiden käyttö ei ole tarkoituksenmukaista
Diflucan on tarkoitettu aikuisille seuraavien sieni-infektioiden estohoitoon:
- Kryptokokkimeningiitin uusiutumisen estoon potilaille, joilla taudin uusiutumisriski on suuri
- Suu-nieluseudun tai ruokatorven kandidoosin uusiutumisen estoon HIV-potilaille, joilla taudin uusiutumisriski on suuri
- Vähentämään toistuvien Candida-vaginiittien (4 tai useampi vaginiittijakso vuodessa) esiintymistä
- Sieni-infektioiden estohoitoon potilaille, joilla on pitkittynyt neutropenia kuten hematologista syöpää sairastavat, syöpälääkkeitä saavat potilaat tai hematopoeettisen kantasolusiirron saaneet potilaat (ks. kohta Farmakodynamiikka).
Diflucan on tarkoitettu 0–17-vuotiaille lapsille (täysiaikaiset vastasyntyneet, imeväiset, leikki-ikäiset, lapset ja nuoret):
Diflucan-valmistetta käytetään suunielun ja ruokatorven limakalvojen kandidoosin, invasiivisen kandidoosin ja kryptokokkimeningiitin hoitoon ja Candida-infektioiden estohoitoon immuunipuutteisille potilaille. Diflucan-valmistetta voidaan käyttää myös ylläpitohoitona estämään kryptokokkimeningiitin uudelleenpuhkeamista lapsipotilaille, joilla taudin uusiutumisriski on suuri (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Hoito voidaan aloittaa ennen kuin bakteeriviljelyn ja muiden laboratoriokokeiden tuloksia on saatu, mutta infektiolääkehoitoa on muutettava tulosten mukaisesti, kun tulokset saadaan.
Hoitosuositukset sienilääkkeiden asianmukaisesta käytöstä on huomioitava.
Annostus ja antotapa
Annostus
Annos tulee perustua sieni-infektion luonteeseen ja vaikeusasteeseen. Toistuvaa annostelua vaativien infektioiden hoidon tulisi jatkua, kunnes kliiniset oireet tai laboratoriokokeet osoittavat, että aktiivinen sieni-infektio on parantunut. Liian lyhyt hoitoaika saattaa johtaa aktiivisen infektion uusiutumiseen.
Aikuiset
Käyttöaiheet | Annostus | Hoidon kesto | |
Kryptokokkoosi | - Kryptokokki-meningiitin hoito. | Kyllästysannos: 1. päivänä 400 mg Seuraavat annokset: 200–400 mg kerran päivässä. | Tavallisesti vähintään 6–8 viikkoa. Henkeä uhkaavissa infektioissa annos voidaan nostaa 800 mg/vrk. |
- Ylläpitohoitona estämään kryptokokkimeningiitin uudelleenpuhkeamista potilaille, joilla uusiutumisriski on suuri. | 200 mg kerran päivässä | Pysyvästi 200 mg kerran päivässä | |
Koksidioidomykoosi | 200–400 mg kerran päivässä | Yksilöllinen, 11–24 kuukautta tai pidempään. Annosta 800 mg päivässä voidaan harkita tietyissä infektioissa ja erityisesti aivokalvosairauksissa. | |
Invasiivinen kandidoosi | Kyllästysannos: 1. päivänä 800 mg Seuraavat annokset: 400 mg kerran päivässä | Kandidemiassa hoitoa suositellaan yleensä jatkettavaksi 2 viikon ajan ensimmäisen negatiivisen veriviljelytuloksen saamisen ja kandidemiasta johtuvien oireiden häviämisen jälkeen. | |
Limakalvojen kandidoosin hoito | - Suunielun kandidoosi | Kyllästysannos: 1. päivänä 200–400 mg Seuraavat annokset: 100–200 mg kerran päivässä | 7–21 vuorokautta (kunnes suun ja nielun kandidoosi on remissiossa). Tarvittaessa hoitoa voidaan jatkaa pitempäänkin, jos potilaan immuunivaste on voimakkaasti heikentynyt. |
- Ruokatorven kandidoosi | Kyllästysannos: 1. päivänä 200–400 mg Seuraavat annokset: 100–200 mg kerran päivässä | 14–30 vuorokautta (kunnes ruokatorven kandidoosi on remissiossa). Tarvittaessa hoitoa voidaan jatkaa pitempäänkin, jos potilaan immuunivaste on voimakkaasti heikentynyt. | |
- Kandiduria | 200–400 mg kerran päivässä | 7–21 vuorokautta. Tarvittaessa hoitoa voidaan jatkaa pitempäänkin, jos potilaan immuunivaste on voimakkaasti heikentynyt. | |
- Krooninen atrofinen kandidoosi | 50 mg kerran päivässä | 14 vuorokautta | |
- Krooninen limakalvojen ja ihon kandidoosi | 50–100 mg kerran päivässä | 28 vuorokautta. Tarvittaessa hoitoa voidaan jatkaa pitempäänkin infektion vaikeusasteen tai taustalla olevan immuunipuutoksen ja infektion mukaan. | |
Limakalvojen kandidoosin uusiutumisen esto HIV-potilaille, joilla taudin uusiutumisriski on suuri | - Suunielun kandidoosi | 100–200 mg kerran päivässä tai 200 mg 3 kertaa viikossa | Jatkuva hoito potilaille, joilla on krooninen immuunipuutos. |
- Ruokatorven kandidoosi | 100–200 mg kerran päivässä tai 200 mg 3 kertaa viikossa | Jatkuva hoito potilaille, joilla on krooninen immuunipuutos. | |
Sukupuolielinten kandidoosi | - Akuutti Candida-vaginiitti - Candidan aiheuttama balaniitti | 150 mg | Kerta-annos |
- Toistuvan Candida-vaginiitin hoito ja estohoito (4 tai useampi vaginiittijakso vuodessa) | 150 mg joka kolmas päivä. Yhteensä kolme annosta (päivinä 1, 4 ja 7). Sen jälkeen ylläpitoannos 150 mg kerran viikossa. | Ylläpitoannos: 6 kuukautta. | |
Ihon sieni-infektiot | - tinea pedis, - tinea corporis, - tinea cruris, - Candida-infektiot | 150 mg kerran viikossa tai 50 mg kerran päivässä | 2–4 viikkoa, tinea pedistä hoidettaessa voidaan tarvita 6 viikon hoitojakso |
- tinea versicolor | 300–400 mg kerran viikossa | 1–3 viikkoa | |
50 mg kerran päivässä | 2–4 viikkoa | ||
- tinea unguium (onychomycosis) | 150 mg kerran viikossa | Hoitoa jatketaan, kunnes infektoitunut kynsi on uusiutunut (tilalle on kasvanut uusi terve kynsi). Sormien kynnet kasvavat uudelleen tavallisesti 3–6 kuukaudessa ja varpaiden kynnet 6–12 kuukaudessa. Kasvunopeus saattaa kuitenkin vaihdella huomattavasti yksilöllisesti ja iän mukaan. Kroonisen tulehduksen onnistuneesta hoidosta huolimatta kynnet voivat toisinaan jäädä epämuotoisiksi. | |
Candida-infektioiden esto potilaille, joilla on pitkittynyt neutropenia | 200–400 mg kerran päivässä | Lääkitys tulee aloittaa useita päiviä ennen oletetun neutropenian kehittymistä, ja sitä on jatkettava seitsemän päivää sen jälkeen, kun neutrofiilien määrä on noussut yli 1000 solua/mm3 | |
Erityisryhmät
Iäkkäät potilaat
Annos on sovitettava potilaan munuaistoiminnan mukaan (ks. Munuaisten vajaatoiminta).
Munuaisten vajaatoiminta
Diflucan erittyy pääasiassa virtsaan muuttumattomana vaikuttavana aineena. Kerta-annoshoidossa noudatetaan normaaleja annossuosituksia. Potilaille (mukaan lukien pediatriset potilaat), joilla on munuaisten vajaatoiminta ja joille flukonatsolia annetaan toistuvasti, hoito tulisi aloittaa 50–400 mg:n suuruisella annoksella, perustuen kyseisen käyttöaiheen suositeltuun päiväannokseen. Tämän käyttöaiheen mukaisen kyllästysannoksen jälkeen vuorokausiannos muutetaan seuraavan taulukon mukaan:
Kreatiniinipuhdistuma (ml/min) | Annossuositusprosentti |
> 50 | 100 % |
≤ 50 (ei hemodialyysia) | 50 % |
Hemodialyysi | 100 % jokaisen hemodialyysikerran jälkeen |
Hemodialyysissä käyvälle potilaalle tulee antaa suositusannos (100 %) jokaisen hemodialyysin jälkeen. Päivinä, jolloin dialyysiä ei tehdä, potilaalle tulee antaa alempi, kreatiniinipuhdistuman mukaan laskettu annos.
Maksan vajaatoiminta
Tietoja käytöstä potilaille, joilla on maksan vajaatoiminta, on vain vähän. Tämän vuoksi flukonatsolia tulee käyttää varoen potilaille, joilla maksan toiminta on heikentynyt (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset).
Pediatriset potilaat
Pediatrisilla potilailla ei saa ylittää 400 mg:n enimmäisvuorokausiannosta.
Kuten aikuisten samankaltaisten infektioiden hoidossa, hoidon kesto määräytyy kliinisen ja mykologisen vasteen perusteella. Diflucan annetaan yhtenä kerta-annoksena vuorokaudessa.
Munuaisten vajaatoimintaa sairastavien lasten hoito, ks. annostus kohdassa Munuaisten vajaatoiminta. Flukonatsolin farmakokinetiikkaa ei ole tutkittu munuaisten vajaatoimintaa sairastavilla lapsilla (”Täysiaikaisena syntyneet” lapset, joilla usein ilmenee ensisijaisesti munuaisten epäkypsyyttä, katso alla oleva annostus).
Imeväiset, leikki-ikäiset ja lapset (ikä 28 päivää – 11 vuotta):
Käyttöaihe | Annostus | Suositus |
- Limakalvojen kandidoosit | Aloitusannos: 6 mg/kg Seuraavat annokset: 3 mg/kg kerran päivässä | Aloitusannos voidaan antaa ensimmäisenä hoitopäivänä, jotta vakaan tilan pitoisuus saavutetaan nopeammin. |
- Invasiivinen kandidoosi - Kryptokokkimeningiitti | Annos: 6–12 mg/kg kerran päivässä | Infektion vaikeusasteen mukaan. |
- Ylläpitohoitona estämään kryptokokkimeningiitin uudelleenpuhkeamista lapsipotilaille, joilla uusiutumisriski on suuri | Annos: 6 mg/kg kerran päivässä | Infektion vaikeusasteen mukaan. |
- Immuunipuutteisten potilaiden kandidoosin estohoito | Annos: 3–12 mg/kg kerran päivässä | Kehittyneen neutropenian laajuuden ja keston mukaan (ks. Aikuisten annostus). |
12–17-vuotiaat nuoret:
Lääkettä määräävän lääkärin on arvioitava (aikuiselle tai lapselle) sopivin annostus painon ja puberteetin kehitysvaiheen mukaan. Kliiniset tiedot viittaavat siihen, että flukonatsolipuhdistuma on lapsilla suurempi kuin aikuisilla. Aikuisten annokset 100 mg, 200 mg ja 400 mg vastaavat lapsilla annoksia 3 mg/kg, 6 mg/kg ja 12 mg/kg, joilla saadaan verrannollinen systeeminen altistus.
Diflucan-valmisteen turvallisuutta ja tehoa pediatristen potilaiden sukupuolielinten kandidoosin hoidossa ei ole vielä varmistettu. Pediatristen käyttöaiheiden turvallisuustieto löytyy kohdasta Haittavaikutukset. Jos hoitoa on välttämätöntä antaa 12–17-vuotiaille nuorille, annostuksen tulee olla sama kuin aikuisille.
Täysiaikaisena syntyneet, 0–27 päivän ikäiset vastasyntyneet:
Flukonatsoli poistuu vastasyntyneen elimistöstä hitaasti.
Flukonatsolin farmakokinetiikasta täysiaikaisena syntyneillä vastasyntyneillä on vain vähän tietoa, joka tukisi tätä annostusta (ks. kohta Farmakokinetiikka).
Ikäryhmä | Annostus | Suositus |
Täysiaikaisena syntyneet vastasyntyneet (ikä 0–14 päivää) | Sama annos (mg/kg) kuin vastasyntyneille, leikki-ikäisille ja lapsille 72 tunnin välein | Enimmäisannosta, 12 mg/kg 72 tunnin välein, ei saa ylittää |
Täysiaikaisena syntyneet vastasyntyneet (ikä 15–27 päivää) | Sama annos (mg/kg) kuin vastasyntyneille, leikki-ikäisille ja lapsille 48 tunnin välein | Enimmäisannosta, 12 mg/kg 48 tunnin välein, ei saa ylittää |
Antotapa
Flukonatsolia voidaan antaa joko suun kautta (kapselit, jauhe oraalisuspensiota varten ja siirappi) tai laskimoinfuusiona (infuusioneste, liuos), antoreitti riippuu potilaan kliinisestä tilasta. Vuorokausiannosta ei tarvitse muuttaa, kun siirrytään iv-annosta oraaliseen antoon tai päinvastoin.
Lääkärin tulee määrätä sopivin lääkemuoto ja vahvuus potilaan iän, painon ja annoksen mukaan. Kapseleita ei ole tarkoitettu käytettäviksi imeväisille ja pikkulapsille. Näille potilaille sopii paremmin saatavilla oleva suun kautta annettava nestemäinen flukonatsolivalmiste.
Diflucan-oraalisuspensio voidaan ottaa ruokailuista riippumatta.
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet lääkevalmisteen saattamisesta käyttökuntoon ennen lääkkeen antoa. Käyttövalmis oraalisuspensio on valkoinen tai luonnonvalkoinen, miedosti appelsiinintuoksuinen suspensio.
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet jauheesta valmistettavan oraalisuspensioannoksen muuntamiseen milligrammoista millilitrassa (mg/ml) millilitroiksi painokiloa kohti (ml/kg) pediatrisilla potilailla.
Laske aikuispotilaan annos millilitroina valmisteen vahvuuden perusteella siten, että annos vastaa annostussuositusta milligrammoina.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle, sen sukuisille atsoliyhdisteille tai kohdassa Apuaineet mainituille apuaineille.
Toistuvaa antoa koskeneen yhteisvaikutustutkimuksen perusteella terfenadiinia ei saa antaa samanaikaisesti potilaille, jotka saavat Diflucan-valmistetta toistuvasti vähintään 400 mg/vrk. Flukonatsolia käyttäville potilaille ei saa antaa samanaikaisesti muita QT-aikaa tunnetusti pidentäviä ja sytokromi P450 (CYP) 3A4 -entsyymin kautta metaboloituvia lääkkeitä, kuten sisapridia, astemitsolia, pimotsidia, kinidiiniä ja erytromysiiniä (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset).
Varoitukset ja käyttöön liittyvät varotoimet
Tinea capitis
Flukonatsolin tehoa on tutkittu pälvisilsan (tinea capitis) hoidossa lapsilla. Se ei ollut griseofulviinia tehokkaampi, hoitoon vastasi alle 20 % potilaista. Tämän vuoksi Diflucan-valmistetta ei tule käyttää pälvisilsan hoitoon.
Kryptokokkoosi
Flukonatsolin teho muiden kryptokokkoosi-infektioiden (esim. keuhko- ja ihokryptokokkoosin) hoidossa on osoitettu rajallisesti, minkä vuoksi annossuosituksia ei voi antaa.
Syvät endeemiset mykoosit
Flukonatsolin teho muiden syvien endeemisten mykoosien kuten parakokkidioidomykoosin, lymfokutaanisen sporotrikoosin ja histoplasmoosin hoidossa on osoitettu vain rajallisesti, minkä vuoksi annossuosituksia ei voi antaa.
Munuaiset
Varovaisuutta on noudatettava Diflucan-valmisteen annossa potilaalle, jolla on munuaisten toimintahäiriö (ks. kohta Annostus ja antotapa).
Lisämunuaisten vajaatoiminta
Ketokonatsolin tiedetään aiheuttavan lisämunuaisten vajaatoimintaa. Sitä voi esiintyä myös flukonatsolin käytön yhteydessä, vaikka tämä onkin harvinaista.
Samanaikaiseen prednisonihoitoon liittyvä lisämunuaisten vajaatoiminta, ks. kohta Yhteisvaikutukset ”Flukonatsolin vaikutus muihin lääkevalmisteisiin”.
Maksa ja sappi
Varovaisuutta on noudatettava Diflucan-valmisteen annossa potilaalle, jolla on maksan toimintahäiriö.
Diflucan-valmisteen käyttöön on harvinaisissa tapauksissa liittynyt vakavaa maksatoksisuutta, myös kuolemantapauksia, ensisijaisesti potilailla, joilla on ollut jokin vakava perussairaus. Flukonatsoliin liittyvässä maksatoksisuudessa ei ole havaittu ilmeistä yhteyttä kokonaisvuorokausiannokseen, hoidon kestoon eikä potilaan sukupuoleen tai ikään. Flukonatsolin maksatoksisuus on tavallisesti korjaantunut hoidon lopettamisen jälkeen.
Potilasta, jonka maksan toimintakoetulokset ovat poikkeavia flukonatsoli-hoidon aikana, on seurattava vakavamman maksavaurion kehittymisen varalta. Potilaalle tulee kertoa vakavaan maksasairauteen viittaavista oireista (merkittävä voimattomuus, anoreksia, pitkäaikainen pahoinvointi, oksentelu ja keltaisuus), joiden ilmetessä potilaan tulee heti lopettaa flukonatsoli-hoito ja hakeutua lääkärin vastaanotolle.
Sydän
Joidenkin atsoleiden, myös flukonatsolin, käyttöön on liittynyt QT-ajan pitenemistä EKG:ssä. Flukonatsoli pidentää QT-aikaa estämällä suoraan nopean kaliumionikanavan ionivirtaa (Ikr). Sytokromi P450 (CYP) 3A4:n estyminen saattaa voimistaa muiden lääkevalmisteiden (kuten amiodaronin) QT-aikaa pidentävää vaikutusta. Valmisteen markkinoilletulon jälkeisessä seurannassa Diflucan-hoitoa saaneilla potilailla on hyvin harvinaisissa tapauksissa ilmennyt QT-ajan pitenemistä ja kääntyvien kärkien takykardiaa (torsade de pointes). Ilmoitukset koskivat vakavasti sairaita potilaita, joilla oli useita sekoittavia riskitekijöitä, kuten rakenteellinen sydänsairaus, elektrolyyttihäiriöitä ja samanaikaisia lääkityksiä, jotka ovat voineet vaikuttaa asiaan. Potilailla, joilla on hypokalemia ja pitkälle edennyt sydämen vajaatoiminta, on tavanomaista suurempi hengenvaarallisten kammioperäisten rytmihäiriöiden ja kääntyvien kärkien takykardian (torsades de pointesin) riski.
Varovaisuutta on noudatettava Diflucan-valmisteen annossa potilaalle, jolla on jokin sydämen rytmihäiriöitä mahdollisesti edistävä tila.
Diflucan-valmistetta saaville potilaille ei saa antaa samanaikaisesti muita QT-aikaa tunnetusti pidentäviä ja sytokromi P450 (CYP) 3A4 -entsyymin kautta metaboloituvia lääkkeitä (ks. kohdat Vasta-aiheet ja Yhteisvaikutukset).
Halofrantiini
Halofantriinin on osoitettu pidentävän QTc-aikaa suositeltuina hoitoannoksina käytettynä, ja se on CYP3A4:n substraatti. Flukonatsolin ja halofantriinin samanaikaista käyttöä ei suositella (ks. kohta Yhteisvaikutukset).
Ihoreaktiot
Hilseileviä ihoreaktioita, kuten Stevens-Johnsonin oireyhtymä ja toksinen epidermaalinen nekrolyysi, on kehittynyt flukonatsolihoidon aikana vain harvoin. Yleisoireista eosinofiilista oireyhtymää (DRESS) on raportoitu. AIDS-potilaille kehittyy muita herkemmin vaikeita ihoreaktioita monille lääkkeille. Flukonatsolihoito on lopetettava, jos potilaalle, jota hoidetaan flukonatsolilla pinnallisen sieni-infektion vuoksi, ilmenee oletettavasti flukonatsolista johtuva ihottuma. Jos potilaalle, jolla on invasiivinen/systeeminen sieni-infektio, ilmaantuu ihottuma, häntä on seurattava tarkoin, ja jos potilaalle ilmaantuu rakkulamaisia leesioita tai erythema multiforme, flukonatsolihoito on lopetettava.
Yliherkkyys
Joissakin harvinaisissa tapauksissa on ilmoitettu anafylaksiaa (ks. kohta Vasta-aiheet).
Sytokromi P450
Flukonatsoli on keskivahva CYP2C9:n ja CYP3A4:n estäjä. Flukonatsoli on myös vahva CYP2C19:n estäjä. Diflucan-hoitoa saavaa potilasta on tarkkailtava, jos häntä hoidetaan samanaikaisesti lääkkeellä, jolla on kapea terapeuttinen ikkuna ja joka metaboloituu CYP2C9:n, CYP2C19:n tai CYP3A4:n välityksellä (ks. kohta Yhteisvaikutukset).
Terfenadiini
Samanaikaista flukonatsoli- (annos alle 400 mg/vrk) ja terfenadiinihoitoa saavia potilaita on seurattava tarkoin (ks. kohdat Vasta-aiheet ja Yhteisvaikutukset).
Kandidiaasi
Tutkimukset ovat osoittaneet Candida-lajien, C. albicans ‑lajia lukuun ottamatta, aiheuttamien infektioiden esiintyvyyden lisääntyneen. Ne ovat usein luontaisesti resistenttejä flukonatsolille (esim. C. krusei ja C. auris) tai alentuneesti herkkiä flukonatsolille (C. glabrata). Tällaisiin infektioihin tarvitaan hoidon epäonnistumisen jälkeen muunlaista sienilääkehoitoa. Lääkettä määrääviä lääkäreitä kehotetaan siksi ottamaan huomioon eri Candida-lajien flukonatsoliresistenssin esiintyvyys.
Apuaineet
Diflucan jauhe oraalisuspensiota varten sisältää sakkaroosia, eikä sitä saa antaa potilaille, joilla on harvinainen perinnöllinen fruktoosin tai glukoosi-galaktoosin imeytymishäiriö tai sakkaroosi-isomaltaasin puutos. 10 ml:n annos sisältää sokeria 5,5 grammaa tai enemmän. Tämä tulee ottaa huomioon diabetespotilailla. Lääkevalmiste saattaa vahingoittaa hampaita, jos valmistetta käytetään yli 2 viikon ajan.
Diflucan jauhe oraalisuspensiota varten sisältää natriumbentsoaattia. 60 ml:n pullossa oleva käyttövalmis oraalisuspensio sisältää 83 mg natriumbentsoaattia/pullo, joka vastaa 2,38 mg/ml.
Natriumbentsoaatti voi lisätä vastasyntyneen (enintään 4 viikon ikäisen) ihon ja silmien keltaisuutta.
Käyttövalmis oraalisuspensio sisältää alle 1 mmol natriumia (23 mg) per 20 ml (suositeltu enimmäisannos) eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Seuraavien lääkevalmisteiden samanaikainen käyttö on vasta-aiheista:
Sisapridi: Sydäntapahtumia, mukaan lukien kääntyvien kärkien takykardiaa (torsade de pointes), on ilmoitettu potilailta, jotka saivat samanaikaisesti flukonatsolia ja sisapridia. Kontrolloidussa tutkimuksessa todettiin, että 200 mg x 1/vrk flukonatsolia ja 20 mg x 4/vrk sisapridia samanaikaisesti käytettynä suurensivat merkittävästi sisapridipitoisuutta plasmassa ja pidensivät QTc-aikaa. Flukonatsolia ja sisapridia ei saa käyttää samanaikaisesti (ks. kohta Vasta-aiheet).
Terfenadiini: Koska atsoli-sienilääkkeitä yhdessä terfenadiinin kanssa saaneilla potilailla on ilmennyt vakavia sydämen rytmihäiriöitä, jotka johtuivat QTc-ajan pitenemisestä, yhteisvaikutustutkimuksia on tehty. Tutkimuksessa, jossa flukonatsoliannos oli 200 mg/vrk, ei osoitettu QTc-ajan pitenemistä. Toinen tutkimus, jossa flukonatsolin vuorokausiannokset olivat 400 mg ja 800 mg, osoitti, että kun flukonatsoliannos on 400 mg/vrk tai enemmän, samanaikaisesti annetun terfenadiinin pitoisuus plasmassa suurenee merkittävästi. Flukonatsolia ei saa käyttää 400 mg:n tai sitä suurempina annoksina terfenadiinin kanssa (ks. kohta Vasta-aiheet). Jos terfenadiinin kanssa samanaikaisesti käytetty flukonatsoliannos on alle 400 mg/vrk, potilasta on seurattava tarkoin.
Astemitsoli: Flukonatsolin ja astemitsolin samanaikainen anto voi pienentää astemitsolin puhdistumaa. Astemitsolipitoisuuden suureneminen plasmassa voi aiheuttaa QT-ajan pitenemistä ja harvinaisissa tapauksissa kääntyvien kärkien takykardiaa (torsade de pointes). Flukonatsolia ja astemitsolia ei saa käyttää samanaikaisesti (ks. kohta Vasta-aiheet).
Pimotsidi: Vaikka flukonatsolin ja pimotsidin yhteiskäyttöä ei ole selvitetty in vitro eikä in vivo
-tutkimuksissa, niiden samanaikainen anto voi estää pimotsidin metaboliaa. Pimotsidipitoisuuden suureneminen plasmassa voi aiheuttaa QT-ajan pitenemistä ja harvinaisissa tapauksissa kääntyvien kärkien takykardiaa (torsade de pointes). Flukonatsolia ja pimotsidia ei saa käyttää samanaikaisesti (ks. kohta Vasta-aiheet).
Kinidiini: Vaikka flukonatsolin ja kinidiinin yhteiskäyttöä ei ole selvitetty in vitro eikä in vivo -tutkimuksissa, niiden samanaikainen anto voi estää kinidiinin metaboliaa. Kinidiinin käyttöön on liittynyt QT-ajan pitenemistä ja harvinaisissa tapauksissa kääntyvien kärkien takykardiaa (torsade de pointes). Flukonatsolia ja kinidiiniä ei saa käyttää samanaikaisesti (ks. kohta Vasta-aiheet).
Erytromysiini: Flukonatsolin ja erytromysiinin samanaikainen käyttö voi suurentaa sydäntoksisuuden riskiä (QT-ajan piteneminen, kääntyvien kärkien takykardia) ja siten sydänperäisen äkkikuoleman riskiä. Flukonatsolia ja erytromysiiniä ei saa käyttää samanaikaisesti (ks. kohta Vasta-aiheet).
Seuraavien lääkevalmisteiden samanaikaista käyttöä ei suositella:
Halofantriini: Flukonatsoli voi suurentaa halofantriinin pitoisuutta plasmassa CYP3A4:ään kohdistuvan estovaikutuksen vuoksi. Flukonatsolin ja halofantriinin samanaikainen käyttö voi suurentaa sydäntoksisuuden riskiä (QT-ajan piteneminen, kääntyvien kärkien takykardia) ja siten sydänperäisen äkkikuoleman riskiä. Tätä yhdistelmää tulee välttää (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Samanaikainen käyttö tulee toteuttaa varoen:
Amiodaroni: Flukonatsolin samanaikainen käyttö amiodaronin kanssa saattaa pidentää QT-aikaa. Flukonatsolin ja amiodaronin samanaikaisessa käytössä pitää olla varovainen, etenkin jos käytetään suuria flukonatsoliannoksia (800 mg).
Seuraavien lääkevalmisteiden samanaikainen käyttö vaatii varotoimia ja annoksen muuttamista:
Muiden lääkevalmisteiden vaikutus flukonatsoliin
Rifampisiini: Flukonatsolin ja rifampisiinin samanaikainen anto pienensi flukonatsolin AUC-arvoa 25 % ja lyhensi sen puoliintumisaikaa 20 %. Rifampisiinia ja flukonatsolia samanaikaisesti saavien potilaiden flukonatsoliannoksen suurentamista on harkittava.
Yhteisvaikutustutkimusten mukaan suun kautta otettavan flukonatsolin samanaikainen ottaminen ruoan, simetidiinin ja mahahappolääkkeiden kanssa tai luuydinsiirtoa varten annetun koko kehon sädehoidon jälkeen ei heikennä flukonatsolin imeytymistä kliinisesti merkittävästi.
Hydroklooritiatsidi: Farmakokineettisessä yhteisvaikutustutkimuksessa hydroklooritiatsidin toistuva anto flukonatsolia samanaikaisesti saaville terveille vapaaehtoisille suurensi flukonatsolin pitoisuutta plasmassa 40 %. Tämänsuuruisen vaikutuksen ei pitäisi edellyttää flukonatsolin annostuksen muuttamista potilailla, jotka saavat samanaikaisesti diureetteja.
Flukonatsolin vaikutus muihin lääkevalmisteisiin
Flukonatsoli on keskivahva sytokromi P450 (CYP) -isoentsyymien 2C9:n ja 3A4:n estäjä. Flukonatsoli on myös vahva isotsyymin CYP2C19:n estäjä. Jäljempänä mainittujen havaittujen/dokumentoitujen yhteisvaikutusten lisäksi on riski, että flukonatsolin kanssa samanaikaisesti annettavien muiden CYP2C9, CYP2C19 ja CYP3A4:n kautta metaboloituvien lääkeaineiden pitoisuudet plasmassa suurenevat. Siksi varovaisuutta on noudatettava näitä lääkeaineyhdistelmiä käytettäessä ja potilasta on seurattava tarkoin. Flukonatsolin entsyymejä estävä vaikutus säilyy 4−5 päivää flukonatsolihoidon päättymisen jälkeen sen pitkän puoliintumisajan vuoksi (ks. kohta Vasta-aiheet).
Abrositinibi: Flukonatsoli (CYP2C19:n, 2C9:n ja 3A4:n estäjä) suurensi altistusta abrositinibin aktiiviselle rakenneosalle 155 %. Jos flukonatsolia annetaan samanaikaisesti, säädä abrositinibiannosta abrositinibin valmistetietojen ohjeiden mukaisesti.
Alfentaniili: Flukonatsolin (400 mg) ja laskimonsisäisen alfentaniilin (20 mikrog/kg) samanaikainen anto terveille vapaaehtoisille suurensi alfentaniilin AUC10-arvon 2-kertaiseksi perustuen todennäköisesti CYP3A4:n estoon. Alfentaniiliannosta on tarvittaessa pienennettävä.
Amitriptyliini, nortriptyliini: Flukonatsoli lisää amitriptyliinin ja nortriptyliinin vaikutusta. 5-nortriptyliini ja/tai S-amitriptyliini voidaan mitata yhdistelmähoitoa aloitettaessa ja yhden viikon kuluttua hoidon aloittamisesta. Amitriptyliinin/nortriptyliinin annosta on tarvittaessa muutettava.
Amfoterisiini B: Flukonatsolin ja amfoterisiini B:n samanaikainen anto infektioista kärsiville normaaleille ja immuniteetiltaan heikennetyille hiirille tuotti seuraavia tuloksia: lievä additiivinen antifungaalinen vaikutus systeemisessä C. albicans -infektiossa, ei yhteisvaikutuksia kallonsisäisessä Cryptococcus neoformans -infektiossa ja näiden kahden lääkeaineen antagonismi systeemisessä Aspergillus fumigatus -infektiossa. Näistä tutkimuksista saatujen tulosten kliinistä merkitystä ei tiedetä.
Antikoagulantit: Kuten muillakin atsoli-sienilääkkeillä, markkinoilletulon jälkeisessä seurannassa on ilmoitettu flukonatsolia ja varfariinia samanaikaisesti saaneilta potilailta protrombiiniajan pitenemisen yhteydessä verenvuototapahtumia (mustelmamuodostusta, nenäverenvuotoa, maha-suolikanavan verenvuotoa, verta virtsassa ja ulosteessa). Samanaikaisen flukonatsoli-/varfariinihoidon aikana protrombiiniaika pidentyi jopa kaksinkertaiseksi, todennäköisesti varfariinin CYP2C9-välitteisen metabolian estymisen takia. Protrombiiniaikaa on seurattava tarkoin potilailta, jotka käyttävät samanaikaisesti kumariinityyppistä antikoagulanttia tai indandioniantikoagulanttia ja flukonatsolia. Antikoagulanttiannosta on tarvittaessa muutettava.
Bentsodiatsepiinit (lyhytvaikutteiset) esim. midatsolaami, triatsolaami: Flukonatsoli aiheutti midatsolaamin suun kautta tapahtuneen annon jälkeen huomattavaa midatsolaamipitoisuuden suurenemista ja psykomotoristen vaikutusten lisääntymistä. Flukonatsolin (200 mg) ja midatsolaamin 7,5 mg) samanaikainen anto suun kautta suurensi midatsolaamin AUC-arvon 3,7-kertaiseksi ja pidensi sen puoliintumisajan 2,2-kertaiseksi. Flukonatsolin (200 mg/vrk) ja triatsolaamin (0,25 mg) samanaikainen anto suun kautta suurensi triatsolaamin AUC-arvon 4,4-kertaiseksi ja pidensi sen puoliintumisajan 2,3-kertaiseksi. Triatsolaamin vaikutuksen tehostumista ja pidentymistä on havaittu samanaikaisen flukonatsolihoidon aikana. Jos flukonatsolihoitoa saava potilas tarvitsee samanaikaista bentsodiatsepiinihoitoa, tulee bentsodiatsepiiniannoksen pienentämistä harkita, ja potilasta on seurattava asianmukaisesti.
Karbamatsepiini: Flukonatsoli estää karbamatsepiinin metaboliaa, ja karbamatsepiinipitoisuuden seerumissa on havaittu suurenevan 30 %. Potilaalle voi kehittyä karbamatsepiinitoksisuutta. Karbamatsepiiniannosta on tarvittaessa muutettava pitoisuusmääritysten/vaikutuksen mukaan.
Kalsiuminestäjät: Tietyt kalsiuminestäjät (nifedipiini, isradipiini, amlodipiini, verapamiili ja felodipiini) metaboloituvat CYP3A4:n välityksellä. Flukonatsoli voi suurentaa systeemistä altistusta kalsiuminestäjille. Tiheää haittavaikutusseurantaa suositellaan.
Selekoksibi: Samanaikainen hoito flukonatsolilla (200 mg/vrk) ja selekoksibilla (200 mg) suurensi selekoksibin Cmax-arvoa 68 % ja AUC-arvoa 134 %. Selekoksibiannos on tarvittaessa puolitettava, jos sitä käytetään samanaikaisesti flukonatsolin kanssa.
Syklofosfamidi: Syklofosfamidi/flukonatsoli-yhdistelmähoito suurentaa bilirubiini- ja kreatiniinipitoisuuksia seerumissa. Tätä yhdistelmää voidaan käyttää, kunhan seerumin bilirubiini- ja kreatiniinipitoisuuksien suurenemisriskiin kiinnitetään erityistä huomiota.
Fentanyyli: Yksi fentanyylin ja flukonatsolin yhteisvaikutuksesta mahdollisesti johtunut kuolemaanjohtanut fentanyylimyrkytys on ilmoitettu. Lisäksi terveillä vapaaehtoisilla tutkimushenkilöillä flukonatsolin osoitettiin viivästyttävän merkittävästi fentanyylin eliminaatiota. Fentanyylipitoisuuden suureneminen voi aiheuttaa hengityslaman. Potilaita tulee seurata tarkkaan mahdollisen hengityslamariskin vuoksi. Fentanyylin annostusta on tarvittaessa muutettava.
HMG-CoA-reduktaasin estäjät: Myopatian ja rabdomyolyysin riski suurenee (annosriippuvainen), jos flukonatsolia annetaan yhdessä CYP3A4:n kautta metaboloituvien HMG-CoA-reduktaasin estäjien (esim. atorvastatiini ja simvastatiini) tai CYP2C9:n kautta metaboloituvien HMG-CoA-reduktaasin estäjien (esim. fluvastatiini) kanssa (statiinin metabolia maksassa vähenee). Jos samanaikainen hoito on tarpeen, potilasta on tarkkailtava myopatian ja rabdomyolyysin oireiden varalta ja kreatiinikinaasiarvoa on seurattava. HMG-CoA-reduktaasin estäjien käyttö on lopetettava, jos potilaan kreatiinikinaasiarvo suurenee huomattavasti tai hänellä diagnosoidaan myopatia/rabdomyolyysi tai näitä epäillään. HMG-CoA-reduktaasin estäjien annosta voi olla tarpeen pienentää statiinin valmisteyhteenvedon mukaisesti.
Ibrutinibi: Keskivahvat CYP3A4:n estäjät (kuten flukonatsoli) suurentavat ibrutinibipitoisuutta plasmassa ja saattavat suurentaa toksisuusriskiä. Jos tämä yhdistelmä ei ole vältettävissä, pienennä ibrutinibiannosta 280 mg:aan (2 kapselia) kerran vuorokaudessa niin kauan kuin CYP3A4:n estäjähoito jatkuu ja seuraa potilasta kliinisesti tarkoin.
Ivakaftori (yksistään tai yhdistelmänä saman terapeuttisen lääkeryhmän valmisteiden kanssa): Samanaikainen käyttö ivakaftorin (kystisen fibroosin transmembraanisen konduktanssinsäätäjän (CFTR) voimistaja) kanssa lisäsi ivakaftorille altistumista 3‑kertaisesti ja hydroksimetyyli-ivakaftorille (M1) altistumista 1,9‑kertaisesti. Ivakaftorin (yksistään tai yhdistelmänä) annosta on tarpeen pienentää ivakaftorin (yksistään tai yhdistelmänä) valmisteyhteenvedon mukaisesti.
Olaparibi: Keskivahvat CYP3A4:n estäjät (kuten flukonatsoli) suurentavat olaparibipitoisuutta plasmassa, joten samanaikaista käyttöä ei suositella. Jos tämä yhdistelmä ei ole vältettävissä, olaparibiannos on rajoitettava 200 mg:aan kahdesti vuorokaudessa.
Immunosuppressantit (kuten siklosporiini, everolimuusi, sirolimuusi ja takrolimuusi):
Siklosporiini: Flukonatsoli suurentaa siklosporiinin pitoisuutta ja AUC-arvoa merkittävästi. Samanaikainen hoito flukonatsolilla (200 mg/vrk) ja siklosporiinilla (2,7 mg/kg/vrk) suurensi siklosporiinin AUC-arvon 1,8 kertaiseksi. Tätä yhdistelmää voidaan käyttää pienentämällä siklosporiiniannosta siklosporiinipitoisuuden mukaan.
Everolimuusi: Vaikka in vitro ja in vivo –tutkimuksia ei ole tehty, voi flukonatsoli suurentaa everolimuusipitoisuutta seerumissa CYP3A4:ään kohdistuvan estovaikutuksen vuoksi.
Sirolimuusi: Flukonatsoli suurentaa sirolimuusipitoisuutta plasmassa oletettavasti estämällä sirolimuusin metaboloitumista CYP3A4:n ja P-glykoproteiinin välityksellä. Tätä yhdistelmää voidaan käyttää, kun sirolimuusiannosta muutetaan vaikutuksen/pitoisuusmääritysten mukaan.
Takrolimuusi: Flukonatsoli voi jopa 5-kertaistaa suun kautta otetun takrolimuusin pitoisuuden seerumissa, koska se estää takrolimuusin CYP3A4-välitteistä metaboliaa suolistossa. Takrolimuusin laskimonsisäisessä annostelussa ei ole havaittu merkittäviä farmakokineettisiä muutoksia. Kohonneeseen takrolimuusipitoisuuteen on liittynyt munuaistoksisuutta. Suun kautta annetun takrolimuusin annostusta on pienennettävä takrolimuusipitoisuuden mukaan.
Losartaani: Flukonatsoli estää losartaanin metaboloitumisen aktiiviseksi metaboliitikseen (E-31 74), joka vastaa suurimmaksi osaksi losartaanihoidon aikana ilmenevästä angiotensiini II -reseptorin salpauksesta. Potilaan verenpainetta on seurattava jatkuvasti.
Lurasidoni: CYP3A4:n kohtalaiset estäjät (esim. flukonatsoli) voivat suurentaa lurasidonipitoisuutta plasmassa. Jos samanaikaista käyttöä ei voida välttää, lurasidoniannosta pienennetään lurasidonin valmisteyhteenvedon mukaisesti.
Metadoni: Flukonatsoli voi suurentaa metadonipitoisuutta seerumissa. Metadoniannosta on tarvittaessa muutettava.
Tulehduskipulääkkeet (NSAIDit): Flurbiprofeenin Cmax-arvo suureni 23 % ja AUC-arvo 81 %, kun sitä annettiin yhdessä flukonatsolin kanssa verrattuna pelkkään flurbiprofeenin antoon. Samoin farmakologisesti aktiivisen isomeerin [S-(+)-ibuprofeeni] Cmax-arvo suureni 15 % ja AUC-arvo 82 %, kun raseemisen ibuprofeenin (400 mg) kanssa annettiin samanaikaisesti flukonatsolia verrattuna pelkän raseemisen ibuprofeenin antoon.
Vaikka asiaa ei olekaan erikseen tutkittu, flukonatsoli voi suurentaa systeemistä altistusta sellaisille muille tulehduskipulääkkeille (NSAIDit), jotka metaboloituvat CYP2C9:n välityksellä (esim. naprokseeni, lornoksikaami, meloksikaami, diklofenaakki). Näihin tulehduskipulääkkeisiin liittyvien haittavaikutusten ja toksisuuden tiheää seurantaa suositellaan ja niiden annosta on ehkä muutettava.
Fenytoiini: Flukonatsoli estää fenytoiinin maksametaboliaa. Toistuvan, samanaikaisen flukonatsolin (200 mg) ja laskimonsisäisen fenytoiinin (250 mg) annon jälkeen, fenytoiinin AUC24-arvo suureni 75 % ja Cmax-arvo 128 %. Samanaikaisessa annossa on seurattava fenytoiinipitoisuutta seerumissa fenytoiinitoksisuuden välttämiseksi.
Prednisoni: Eräässä tapauksessa prednisonihoitoa saaneelle maksansiirtopotilaalle kehittyi akuutti lisämunuaiskuoren vajaatoiminta, kun kolme kuukautta kestänyt flukonatsolihoito lopetettiin. Flukonatsolihoidon lopettaminen luultavasti lisäsi CYP3A4-aktiivisuutta, jolloin prednisonin metabolia lisääntyi. Pitkäaikaista flukonatsoli- ja prednisonihoitoa saavaa potilasta on seurattava tarkoin lisämunuaiskuoren vajaatoiminnan varalta, kun flukonatsolihoito lopetetaan.
Rifabutiini: Flukonatsoli suurentaa rifabutiinipitoisuutta seerumissa, mikä suurentaa rifabutiinin AUC-arvoa jopa 80 %. Flukonatsolia ja rifabutiinia samanaikaisesti saaneilta potilailta on ilmoitettu uveiittia. Yhdistelmähoidossa on otettava huomioon rifabutiinitoksisuuden oireet.
Sakinaviiri: Flukonatsoli suurentaa sakinaviirin AUC-arvoa noin 50 % ja Cmax-arvoa noin 55 %, koska sakinaviirin metabolia maksassa CYP3A4:n välityksellä estyy ja P-glykoproteiinin toiminta estyy. Yhteisvaikutuksia sakinaviirin/ritonaviirin kanssa ei ole tutkittu ja ne saattavat olla huomattavia. Sakinaviirin annosta on ehkä muutettava.
Sulfonyyliureat: Flukonatsolin on osoitettu pidentävän samanaikaisesti suun kautta annettujen sulfonyyliureoiden (esim. klooripropamidi, glibenklamidi, glipitsidi, tolbutamidi) puoliintumisaikaa seerumissa terveillä vapaaehtoisilla. Samanaikaisessa annossa suositellaan verensokeriarvojen tiheää seurantaa ja sulfonyyliurea-annoksen asianmukaista pienentämistä.
Teofylliini: Lumekontrolloidussa yhteisvaikutustutkimuksessa 200 mg flukonatsolia 14 päivän ajan pienensi plasman keskimääräistä teofylliinipuhdistumaa 18 %. Jos potilas saa suuria teofylliiniannoksia tai teofylliinitoksisuuden riski on muutoin suurentunut, potilasta on tarkkailtava flukonatsolihoidon aikana teofylliinitoksisuuden merkkien varalta. Hoitoa on muutettava, jos toksisuuteen viittaavia oireita kehittyy.
Tofasitinibi: Tofasitinibialtistus suurenee, kun sitä käytetään yhdessä sellaisten lääkevalmisteiden kanssa, jotka aiheuttavat sekä CYP3A4:n kohtalaisen estymisen että CYP2C19:n voimakkaan estymisen (esim. flukonatsoli). Tästä johtuen, suositellaan tofasitinibiannoksen pienentämistä 5 mg:aan kerran vuorokaudessa, kun sitä käytetään samanaikaisesti näiden lääkevalmisteiden kanssa.
Tolvaptaani: Altistuminen tolvaptaanille lisääntyy merkittävästi (200 % AUC:ssä, 80 % Cmax:ssa), kun tolvaptaania (CYP3A4-substraatti) annetaan yhdessä flukonatsolin (kohtuullinen CYP3A4:n estäjä) kanssa. Myös haittavaikutusten riski lisääntyy merkittävästi. Erityisesti voimakkaan diureesin, kuivumisen ja akuutin munuaisten vajaatoiminnan riskit lisääntyvät. Samanaikaisen käytön yhteydessä tolvaptaaniannosta on pienennettävä tolvaptaanin määräämistä koskevien ohjeiden mukaisesti ja potilasta on seurattava usein tolvaptaaniin liittyvien haittavaikutusten varalta.
Vinka-alkaloidit: Vaikka asiaa ei olekaan tutkittu, flukonatsoli saattaa suurentaa vinka-alkaloidien (esim. vinkristiini ja vinblastiini) pitoisuutta plasmassa ja aiheuttaa neurotoksisuutta, mikä saattaa johtua CYP3A4:ään kohdistuvasta estovaikutuksesta.
A-vitamiini: Ilmoituksen mukaan yhdelle potilaalle, joka sai yhdistelmähoitoa tretinoiinilla (A-vitamiinin happomuoto) ja flukonatsolilla, kehittyi keskushermostoon liittyviä haittavaikutuksia, jotka ilmenivät aivojen valekasvaimena, joka hävisi flukonatsolihoidon loputtua. Tätä yhdistelmää voidaan käyttää, mutta keskushermostoon kohdistuvien haittavaikutusten ilmaantuvuus on pidettävä mielessä.
Vorikonatsoli (CYP2C9, CYP2C19 ja CYP3A4:n estäjä): Vorikonatsolin Cmax-arvo suureni keskimäärin 57 % (90 % CI: 20 %, 107 %) ja AUCτ-arvo 79 % (90 % CI: 40 %, 128 %), kun tutkimuksessa 8 terveelle vapaaehtoiselle miehelle annettiin suun kautta samanaikaisesti vorikonatsolia (1. päivänä 400 mg x 2/vrk, sen jälkeen 200 mg x 2/vrk 2,5 päivän ajan) ja flukonatsolia (1. päivänä 400 mg/vrk, sen jälkeen 200 mg/vrk 4 päivän ajan). Pienempää annosta ja/tai annostelutiheyttä, jolla tämä vaikutus voitaisiin välttää, ei ole määritetty. Vorikonatsoliin liittyvien haittavaikutusten seurantaa suositellaan, jos vorikonatsolia annetaan potilaalle heti flukonatsolihoidon jälkeen.
Tsidovudiini: Flukonatsoli suurentaa tsidovudiinin Cmax-arvoa 85 % ja AUC-arvoa 75 %, koska suun kautta annettavan tsidovudiinin puhdistuma pienenee noin 45 %. Yhdistelmähoito flukonatsolin kanssa pidensi myös tsidovudiinin puoliintumisaikaa noin 128 %. Yhdistelmähoitoa saavaa potilasta on seurattava tsidovudiiniin liittyvien haittavaikutusten kehittymisen varalta. Tsidovudiiniannoksen pienentämistä voi harkita.
Atsitromysiini: Avoimessa, satunnaistetussa kolmen hoitoryhmän vaihtovuoroisessa tutkimuksessa arvioitiin 18 terveellä tutkimushenkilöllä, miten suun kautta annettu 1200 mg:n atsitromysiinikerta-annos vaikuttaa suun kautta annetun 800 mg:n flukonatsolikerta-annoksen farmakokinetiikkaan ja miten flukonatsoli vaikuttaa atsitromysiinin farmakokinetiikkaan. Flukonatsolin ja atsitromysiinin välillä ei ollut merkittäviä farmakokineettisiä yhteisvaikutuksia.
Suun kautta otettavat ehkäisyvalmisteet: Kahdessa farmakokineettisessä tutkimuksessa on tutkittu suun kautta otettavan yhdistelmäehkäisyvalmisteen ja erisuuruisten flukonatsoliannosten yhteiskäyttöä. Tutkimuksessa, jossa käytettiin 50 mg:n flukonatsoliannosta, ei todettu merkityksellistä vaikutusta hormonipitoisuuksiin. Sen sijaan tutkimuksessa, jossa flukonatsoliannos oli 200 mg/vrk, etinyyliestradiolin AUC-arvo suureni 40 % ja levonorgestreelin 24 %. Flukonatsolin toistuva anto näillä annoksilla ei siis todennäköisesti vaikuta suun kautta otettavan yhdistelmäehkäisyvalmisteen tehoon.
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi
Ennen hoidon aloittamista potilaalle on ilmoitettava sikiölle mahdollisesti aiheutuvasta riskistä.
Kerta-annoshoidon jälkeen suositellaan yhden viikon lääkkeetöntä odotusjaksoa (vastaa 5–6 puoliintumisaikaa) ennen raskaaksi tuloa (ks. kohta Farmakokinetiikka).
Pidemmissä hoitojaksoissa ehkäisyä voidaan harkita tarpeen mukaan naisille, jotka voivat tulla raskaaksi, koko hoitojakson ajan ja viikon ajan viimeisen annoksen jälkeen.
Raskaus
Havainnoivien tutkimusten mukaan spontaanin keskenmenon riski on suurentunut naisilla, joita on hoidettu flukonatsolilla raskauden ensimmäisen ja/tai toisen kolmanneksen aikana verrattuna naisiin, joita ei ole hoidettu flukonatsolilla tai joita on hoidettu paikallisesti atsoleilla saman ajanjakson aikana.
Tiedot useista tuhansista raskaana olevista naisista, jotka ovat saaneet ensimmäisen raskauskolmanneksen aikana kumulatiivisen flukonatsoliannoksen ≤ 150 mg, eivät osoita sikiön epämuodostumia koskevan kokonaisriskin lisääntyvän. Yhdessä laajassa havainnoivassa kohorttitutkimuksessa altistumiseen suun kautta otettavalle flukonatsolille ensimmäisen raskauskolmanneksen aikana liittyi hieman suurentunut luuston ja lihasten epämuodostumien riski. Lisäys vastaa noin yhtä lisätapausta 1 000:tta enintään 450 mg kumulatiivisia annoksia saanutta naista kohden verrattuna atsoleja paikallisesti saaneisiin naisiin ja noin neljää lisätapausta 1 000:tta yli 450 mg:n kumulatiivisia annoksia saanutta naista kohden. Suun kautta otettavan 150 mg:n flukonatsoliannoksen korjattu suhteellinen riski oli 1,29 (95 %:n luottamusväli 1,05–1,58) ja yli 450 mg:n flukonatsoliannosten korjattu suhteellinen riski oli 1,98 (95 %:n luottamusväli 1,23–3,17).
Saatavilla olevat epidemiologiset tutkimukset sydämen epämuodostumista flukonatsolin raskaudenaikaisen käytön yhteydessä antavat epäjohdonmukaisia tuloksia. Viiden havainnoivan tutkimuksen meta-analyysissä havaittiin kuitenkin, että sydämen epämuodostumien riski on 1,8–2-kertainen verrattuna siihen, ettei flukonatsolia ollut käytetty ja/tai kun atsoleja oli käytetty paikallisesti. Havainnoivissa tutkimuksissa tutkittiin useita tuhansia raskaana olevia naisia, jotka altistuivat flukonatsolille raskauden ensimmäisen kolmanneksen aikana.
Tapausilmoituksissa kuvataan synnynnäisiä epämuodostumia vauvoilla, joiden äidit saivat suuria annoksia (400–800 mg/vrk) flukonatsolia raskauden aikana vähintään kolmen kuukauden ajan koksidioidomykoosin hoidossa. Näillä vauvoilla havaittuja synnynnäisiä epämuodostumia ovat mm. lyhytkalloisuus, korvien kehityshäiriö, iso etuaukile, reisiluun käyristyminen sekä värttinä- ja olkaluun yhteenluutuma. Flukonatsolin käytön ja näiden synnynnäisten epämuodostumien välinen syy-seuraussuhde on epävarma.
Flukonatsolia ei pidä käyttää raskauden aikana normaaliannoksin eikä lyhytaikaisesti ellei raskaana olevan potilaan kliininen tilanne edellytä hoitoa.
Flukonatsolia ei pidä käyttää raskauden aikana suurina annoksina ja/tai pitkäaikaisesti ellei potilaalla ole henkeä uhkaava infektio.
Imetys
Flukonatsoli erittyy ihmisen rintamaitoon. Rintamaidosta mitatut flukonatsolipitoisuudet ovat samaa luokkaa kuin plasmasta mitatut pitoisuudet (ks. kohta Farmakokinetiikka). Rintaruokintaa voidaan jatkaa flukonatsolin kerta-annoksen (150 mg) jälkeen. Rintaruokintaa ei suositella jatkuvassa hoidossa eikä käytettäessä suuria flukonatsoliannoksia. Käyttöä harkittaessa on huomioitava rintaruokinnan suotuisat vaikutukset lapsen kehitykseen ja terveyteen, äidin Diflucan-hoidon tarve sekä Diflucan-valmisteen tai äidin perussairauden mahdolliset haittavaikutukset rintaruokittuun lapseen.
Hedelmällisyys
Flukonatsoli ei vaikuttanut uros- eikä naarasrottien hedelmällisyyteen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Tutkimuksia valmisteen vaikutuksesta ajokykyyn tai koneidenkäyttökykyyn ei ole tehty.
Potilaalle tulee kertoa valmisteen käyttöön mahdollisesti liittyvästä huimauksesta tai kouristuskohtauksista (ks. kohta Haittavaikutukset) ja neuvoa välttämään autolla ajoa ja koneiden käyttöä tällaisten oireiden ilmaantuessa.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Flukonatsolihoidon yhteydessä on raportoitu yleisoireista eosinofiilistä oireyhtymää (DRESS) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Yleisimpiä (≥ 1/100, < 1/10) raportoituja haittavaikutuksia ovat päänsärky, vatsakipu, ripuli, pahoinvointi, oksentelu, suurentunut alaniiniaminotransferaasi, suurentunut aspartaattiaminotransferaasi, suurentunut veren alkalinen fosfataasi ja ihottuma.
Seuraavia haittavaikutuksia on havaittu ja ilmoitettu Diflucan-hoidon aikana. Haittavaikutusten esiintymistiheydet ovat seuraavat: Hyvin yleiset (≥ 1/10); yleiset (≥ 1/100, < 1/10); melko harvinaiset (≥ 1/1 000, ≤ 1/100); harvinaiset (≥ 1/10 000, ≤1/1 000); hyvin harvinaiset (≤ 1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä arviointiin).
Elinjärjestelmä | Yleiset | Melko harvinaiset | Harvinaiset | Tuntematon |
Veri ja imukudos | Anemia | Agranulosytoosi, leukopenia, trombosytopenia, neutropenia | ||
Immuunijärjestelmä | Anafylaksia | |||
Aineenvaihdunta ja ravitsemus | Alentunut ruokahalu | Hyperkolesterolemia, hypertriglyseridemia, hypokalemia | ||
Psyykkiset häiriöt | Unettomuus, uneliaisuus | |||
Hermosto | Päänsärky | Kouristuskohtaukset, tuntohäiriöt, heitehuimaus, makuaistin häiriö | Vapina | |
Kuulo ja tasapainoelin | Kiertohuimaus | |||
Sydän | Kääntyvien kärkien takykardia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet), QT-ajan piteneminen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) | |||
Ruoansulatuselimistö | Vatsakipu, oksentelu, ripuli, pahoinvointi | Ummetus, ruoansulatushäiriöt, ilmavaivat, suun kuivuminen | ||
Maksa ja sappi | Suurentunut ALAT-arvo (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet), suurentunut ASAT-arvo (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet), suurentunut veren alkalinen fosfataasi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) | Kolestaasi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet), keltaisuus (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet), suurentunut bilirubiini (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) | Maksan vajaatoiminta (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet), maksasolukuolio (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet), maksatulehdus (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet), maksasoluvaurio (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) | |
Iho ja ihonalainen kudos | Ihottuma (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) | Lääkkeestä johtuva ihottuma* (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet), nokkosihottuma (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet), kutina, lisääntynyt hikoilu | Toksinen epidermaalinen nekrolyysi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet), Stevens-Johnsonin oireyhtymä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet), akuutti yleistynyt eksantematoottinen pustuloosi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet), hilseilevä ihotulehdus, angioedeema, kasvojen turvotus, alopesia | Yleisoireinen eosinofiilinen oireyhtymä (DRESS) |
Luusto, lihakset ja sidekudos | Lihaskipu | |||
Yleisoireet ja antopaikassa todettavat haitat | Väsymys, sairaudentunne, voimattomuus, kuume |
*mukaan lukien toistopunoittuma
Pediatriset potilaat
Kliinisissä tutkimuksissa, joissa sukupuolielinten kandidoosi -käyttöaihetta ei tutkittu, lapsilla todetut haittavaikutukset, niiden ilmaantuvuus ja laboratoriotulosten poikkeavuudet ovat vastaavia kuin aikuisilla.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Diflucan-valmisteen käytön yhteydessä on ilmoitettu yliannostustapauksia. Aistiharhoja ja vainoharhaista käyttäytymistä on ilmoitettu samanaikaisesti.
Yliannostuksen sattuessa oireenmukainen hoito (johon kuuluvat peruselintoimintoja tukevat toimenpiteet ja tarvittaessa mahahuuhtelu) voi olla riittävä.
Flukonatsoli erittyy suurelta osin virtsaan; tehostettu diureesi luultavasti nopeuttaisi eliminaatiota. Kolmen tunnin hemodialyysi pienentää flukonatsolipitoisuuksia plasmassa noin 50 %.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Systeemiset sienilääkkeet, Triatsolijohdokset, ATC-koodi: J02AC01
Vaikutusmekanismi
Flukonatsoli on triatsoliryhmän sienilääke. Sen ensisijainen vaikutustapa on sienen ergosterolibiosynteesin olennaisen vaiheen, sytokromi P450 -välitteisen 14-alfa-lanosterolidemetylaation, estäminen. 14-alfa-metyylisterolien kertyminen korreloi sienen solukalvolla sen jälkeen tapahtuvan ergosterolikadon kanssa ja se saattaa myös vastata flukonatsolin antifungaalisesta aktiivisuudesta. Flukonatsolin on osoitettu olevan selektiivisempi sienen sytokromi P450 -entsyymeihin kuin erilaisiin nisäkkäiden sytokromi P450 -entsyymijärjestelmiin nähden.
Flukonatsoli-annoksen 50 mg/vrk annettuna enintään 28 päivän ajan ei havaittu vaikuttavan testosteronipitoisuuteen miesten plasmassa eikä hedelmällisessä iässä olevien naisten steroidipitoisuuksiin. Flukonatsoli-annoksilla 200–400 mg/vrk ei ollut kliinisesti merkityksellistä vaikutusta endogeenisiin steroidipitoisuuksiin eikä terveiden miesten ACTH:n stimuloimaan vasteeseen. Antipyriinillä tehdyt yhteisvaikutustutkimukset viittaavat siihen, ettei flukonatsoli 50 mg kerta-annoksena tai toistuvina annoksina vaikuta sen metaboliaan.
Herkkyys in vitro
Flukonatsolilla on havaittavissa in vitro antifungaalinen aktiivisuus kliinisesti yleisiä Candida-lajeja vastaan (C. albicans, C. parapsilosis, C. tropicalis mukaan lukien).C. glabrata osoittautui alentuneesti herkäksi flukonatsolille, kun taas C. krusei ja C. auris ovat resistenttejä flukonatsolille. Flukonatsolin MIC-arvot ja epidemiologiset raja-arvot (ECOFF) ovat C. guilliermondii -lajilla suuremmat kuin C. albicans ‑lajilla..
Flukonatsolilla on aktiivisuutta in vitro myös Cryptococcus neoformans- ja Cryptococcus gattii -lajeja vastaan sekä endeemisiä homeita Blastomyces dermatiditis, Coccidioides immitis, Histoplasma capsulatum ja Paracoccidioides brasiliensis vastaan.
Farmakokineettiset/farmakodynaamiset suhteet
Eläinkokeissa MIC-arvot ja teho korreloivat Candida-lajeilla aiheutetuissa kokeellisissa mykooseissa. Kliinisissä tutkimuksissa todettiin lähes 1:1 lineaarinen suhde AUC-arvon ja flukonatsoliannoksen välillä. AUC-arvon tai annoksen ja suun kandidoosin onnistuneen kliinisen vasteen ja vähäisemmässä määrin kandidemian ja hoidon välillä on myös suora, mutta epätäydellinen suhde. Paraneminen on vastaavasti epätodennäköisempää, jos infektion aiheuttajana on kanta, jolla on flukonatsolin yhteydessä suuri MIC-arvo.
Resistenssimekanismi
Candida-lajit ovat kehittäneet monia resistenssimekanismeja atsolisienilääkkeitä vastaan. Sienikannoilla, jotka ovat kehittäneet yhden tai useampia tällaisia resistenssimekanismeja, tiedetään olevan flukonatsolin osalta korkeat MIC-raja-arvot (MIC, minimum inhibitory concentration, pienin estävä pitoisuus), mikä vaikuttaa haitallisesti tehoon kliinisesti ja in vivo.
Tavallisesti herkillä Candida-lajeilla yleisimmin tavatussa resistenssimekanismin kehittymisessä on mukana atsolien kohde-entsyymi, joka vastaa ergosterolin biosynteesistä. Resistenssi voi aiheutua mutaatiosta, lisääntyneestä entsyymin tuotannosta, lääkkeen effluksimekanismista tai kompensoivien reittien kehittymisestä.
Candida-lajien superinfektioita on raportoitu C. albicans -lajia lukuun ottamatta, ja ne ovat usein luontaisesti alentuneesti herkkiä (C. glabrata) tai resistenttejä flukonatsolille (esim. C. krusei, C. auris). Tällaisiin infektioihin tarvitaan muunlaista sienilääkehoitoa. Joidenkin luontaisesti resistenttien (C. krusei) tai ilmaantuvien (C. auris) Candida-lajien resistenssimekanismia ei ole täysin selvitetty.
EUCAST-raja-arvot
EUCAST‑AFST (European Committee on Antimicrobial Susceptibility Testing Subcommittee on Antifungal Susceptibility Testing) on määritellyt farmakokineettisten/farmakodynaamisten tietojen analyysin, in vitro –herkkyyden ja kliinisen vasteen perusteella flukonatsolin raja-arvot Candida-lajeille (EUCAST Fluconazole rationale document (2020) - versio 3; sienilääkkeiden raja-arvotaulukot MIC-arvojen tulkintaan European Committee on Antimicrobial Susceptibility Testing, Antifungal Agents, Breakpoint tables for interpretation of MICs, versio 10.0, voimassa 4.2.2020 alkaen). Nämä on jaettu ei-lajispesifisiin raja-arvoihin, jotka on määritelty lähinnä farmakokineettisten/farmakodynaamisten tietojen perusteella eivätkä ole riippuvaisia MIC-arvojen jakautumisesta tietyille lajeille, sekä lajispesifiset raja-arvot lajeille, jotka liittyvät ihmisillä useimmiten esiintyviin infektioihin. Nämä raja-arvot esitetään seuraavassa taulukossa:
Sienilääke | Lajispesifinen raja-arvo (S≤/R>) (mg/l) | Ei-lajispesifinen raja-arvoA S≤/R> (mg/l) | |||||
Candida albicans | Candida dubliniensis | Candida glabrata | Candida krusei | Candida parapsilosis | Candida tropicalis | ||
Flukonatsoli | 2/4 | 2/4 | 0,001*/16 | -- | 2/4 | 2/4 | 2/4 |
S = Herkkä, R = Resistentti
A = Ei-lajispesifiset raja-arvot on määritelty lähinnä farmakokineettisten/farmakodynaamisten tietojen perusteella eivätkä ne ole riippuvaisia MIC-arvojen jakautumisesta tietyille lajeille. Niitä käytetään vain sellaisten organismien yhteydessä, joilla ei ole erityisiä raja-arvoja.
-- = Herkkyystestausta ei suositella, koska lääke ei todennäköisesti sovellu hoitoon tämän lajin yhteydessä.
* = Koko C. glabrata ‑laji kuuluu luokkaan I. MIC-raja-arvot yli 16 mg/l C. glabrata ‑lajia vastaan pitää tulkita resistentiksi. Luokan herkkä (≤ 0,001 mg/l) tarkoituksena on vain välttää I‑kantojen virheellinen luokittelu S‑kannoiksi. I = herkkä, iso annostus: mikrobi luokitellaan herkäksi, iso annostus, jos hoito hyvin todennäköisesti onnistuu, koska altistus lääkeaineelle lisääntyy säätämällä lääkeaineen annostusta tai infektiokohdassa saavutettavan pitoisuuden mukaan.
Farmakokinetiikka
Flukonatsolin farmakokineettiset ominaisuudet ovat samanlaiset, annettiinpa sitä laskimonsisäisesti tai oraalisesti.
Imeytyminen
Flukonatsoli imeytyy suun kautta tapahtuneen annon jälkeen hyvin, ja sen pitoisuus plasmassa (ja systeeminen hyötyosuus) vastaa yli 90-prosenttisesti laskimonsisäisen annon jälkeen saavutettavaa pitoisuutta. Samanaikainen ruoan nauttiminen ei vaikuta suun kautta otetun lääkkeen imeytymiseen.
Paastotilassa huippupitoisuus plasmassa saavutetaan 0,5−1,5 tuntia lääkkeen otosta.
Pitoisuus plasmassa on verrannollinen annokseen. Vakaan tilan pitoisuus saavutetaan 90-prosenttisesti, kun lääkettä on otettu 4−5 päivän ajan kerran päivässä. Jos ensimmäisenä päivänä annetaan 2-kertainen päiväannos (kyllästysannos), on mahdollista saavuttaa 90-prosenttisesti vakaa kineettinen tila jo toisena päivänä.
Jakautuminen
Flukonatsolin näennäinen jakaantumistilavuus on lähes sama kuin elimistön nestemäärä. Plasman proteiineihin sitoutuminen on vähäistä (11−12 %).
Flukonatsoli penetroituu hyvin kaikkiin elimistön tutkittuihin nesteisiin. Flukonatsolipitoisuus syljessä ja ysköksessä on samanlainen kuin plasmassa. Sienimeningiittiä sairastavia potilaita hoidettaessa flukonatsolin likvorista mitattu pitoisuus on noin 80 % aineen vastaavasta pitoisuudesta plasmassa.
Ihon marraskedessä ja orvaskedessä-verinahassa sekä hiessä saavutetaan suurempi flukonatsolipitoisuus kuin seerumissa. Flukonatsoli kertyy marrasketeen (stratum corneum). Annoksella 50 mg kerran päivässä flukonatsolipitoisuus oli 12 päivän hoidon jälkeen 73 mikrog/g ja 7 päivän kuluttua hoidon keskeyttämisen jälkeen pitoisuus oli vielä 5,8 mikrog/g. Annoksella 150 mg kerran viikossa marraskeden flukonatsolipitoisuus oli 7. päivänä 23,4 mikrog/g ja 7 päivän kuluttua toisen annoksen jälkeen vielä 7,1 mikrog/g.
Annosteltaessa flukonatsolia 150 mg kerran viikossa 4 kuukauden ajan flukonatsolipitoisuus oli terveissä kynsissä 4,05 mikrog/g ja sairaissa kynsissä 1,8 mikrog/g; flukonatsolipitoisuus oli mitattavissa kynsinäytteistä vielä kuuden kuukauden kuluttua hoidon loppumisesta.
Biotransformaatio
Flukonatsoli metaboloituu vain vähäisessä määrin. Radioaktiivisesti merkitystä annoksesta vain 11 % erittyi muuttuneena lääkeaineena virtsaan. Flukonatsoli on keskivahva isotsyymien CYP2C9 ja CYP3A4 estäjä (ks. kohta Yhteisvaikutukset). Flukonatsoli on myös vahva isotsyymin CYP2C19:n estäjä.
Eliminaatio
Plasmasta mitattu eliminaation puoliintumisaika on n. 30 tuntia. Flukonatsoli erittyy pääosin munuaisten kautta, jolloin 80 % käytetystä annoksesta erittyy muuttumattomana virtsaan. Flukonatsolin puhdistuma on suoraan verrannollinen kreatiniinipuhdistumaan. Verenkierrosta ei ole löydetty flukonatsolin metaboliitteja.
Lääkkeen pitkä eliminaation puoliintumisaika plasmassa mahdollistaa kerta-annoshoidon Candidan aiheuttamissa vaginiiteissa sekä kerran päivässä ja kerran viikossa tapahtuvan annostelun kaikkien muiden indisoitujen sieni-infektioiden hoidossa.
Farmakokinetiikka munuaisten vajaatoiminnan yhteydessä
Vaikeaa munuaisten vajaatoimintaa sairastavilla potilailla (glomerulusten suodattumisnopeus < 20 ml/min) puoliintumisaika piteni 30 tunnista 98 tuntiin, joten annosta on pienennettävä. Flukonatsoli poistuu elimistöstä hemodialyysin avulla ja vähäisemmässä määrin peritoneaalidialyysin avulla. Kolmen tunnin hemodialyysihoidon jälkeen noin 50 % veressä olevasta flukonatsolista on poistunut.
Farmakokinetiikka imetyksen aikana
Farmakokineettisessä tutkimuksessa on arvioitu flukonatsolipitoisuutta plasmassa ja rintamaidossa 48 tunnin ajan 150 mg:n Diflucan-kerta-annoksen jälkeen. Tutkimukseen osallistuneet kymmenen imettävää naista olivat lopettaneet imetyksen joko tilapäisesti tai pysyvästi. Rintamaidosta mitattu keskimääräinen flukonatsolipitoisuus oli noin 98 % pitoisuudesta äidin plasmassa. Keskimääräinen huippupitoisuus rintamaidossa oli 2,61 mg/l 5,2 tunnin kuluttua annoksesta. Rintamaidon keskimääräisen huippupitoisuuden perusteella imeväisen arvioidaan saavan rintamaidosta päivittäin 0,39 mg/kg/vrk flukonatsolia (olettaen, että keskimääräinen maidonkulutus on 150 ml/kg/vrk). Tämä määrä on noin 40 % vastasyntyneen (ikä < 2 viikkoa) suositusannoksesta tai 13 % imeväisen suositusannoksesta limakalvojen kandidoosin hoidossa.
Farmakokinetiikka lapsilla
Farmakokinetiikkaa on arvioitu viidessä tutkimuksessa 113 lapsipotilaalla (2 kerta-annostutkimusta, 2 toistuvan annostelun tutkimusta ja 1 keskostutkimus). Yhden tutkimuksen tiedot eivät olleet tulkittavissa, koska lääkemuotoa vaihdettiin kesken tutkimuksen. Lisätietoja saatiin tutkimuksesta, jossa hoitoa annettiin erityisluvalla.
Kun iältään 9 kk–15-vuotiaille lapsille annettiin flukonatsolia 2–8 mg/kg, AUC-arvo oli noin 38 mikrog.h/ml 1 mg/kg-annosyksikköä kohti. Toistuvan annon jälkeen flukonatsolin eliminaation puoliintumisaika plasmassa oli keskimäärin 15–18 tuntia ja jakaantumistilavuus noin 880 ml/kg. Kerta-annon jälkeen flukonatsolin eliminaation puoliintumisaika plasmassa oli suurempi, noin 24 tuntia. Tämä on verrattavissa flukonatsolin eliminaation puoliintumisaikaan plasmassa, silloin kun 11 pv–11 kuukauden ikäisille lapsille annetaan 3 mg/kg:n kerta-annos laskimoon. Jakaantumistilavuus oli tässä ikäryhmässä noin 950 ml/kg.
Kokemus flukonatsolin annosta vastasyntyneille rajoittuu farmakokineettisiin tutkimuksiin keskosilla. Tutkitut 12 keskosta syntyivät keskimäärin 28 raskausviikon ikäisinä ja saivat ensimmäisen annoksensa keskimäärin 24 tunnin ikäisinä (vaihteluväli 9–36 tuntia). Keskosten keskimääräinen syntymäpaino oli 0,9 kg (vaihteluväli 0,75–1,10 kg). Tutkimuksessa pysyi loppuun asti seitsemän potilasta, joille annettiin enintään viisi 6 mg/kg:n flukonatsoli-infuusiota laskimoon 72 tunnin välein. Keskimääräinen puoliintumisaika oli ensimmäisenä hoitopäivänä 74 h (vaihteluväli 44–185), ja se lyheni seitsemäntenä päivänä keskimäärin 53 tuntiin (vaihteluväli 30–131) ja 13. päivänä 47 tuntiin (vaihteluväli 27−68). AUC-arvo (mikrog.h/ml) oli ensimmäisenä päivänä 271 (vaihteluväli 173−385), ja se suureni seitsemäntenä päivänä keskimäärin 490:een (vaihteluväli 292−734) ja pieneni 13. päivänä keskimäärin 360:een (vaihteluväli 167−566).
Jakaantumistilavuus (ml/kg) oli ensimmäisenä päivänä 1 183 (vaihteluväli 1 070–1 470), ja se suureni seitsemäntenä päivänä keskimäärin 1 184:ään (vaihteluväli 510–2 130) ja 13. päivänä 1 328:aan (vaihteluväli 1 040−1 680).
Farmakokinetiikka iäkkäillä
Farmakokineettinen tutkimus tehtiin 22 potilaalla, jotka olivat iältään 65-vuotiaita tai vanhempia ja saivat 50 mg:n kerta-annoksen flukonatsolia suun kautta. Kymmenen näistä potilaista sai samanaikaisesti nesteenpoistolääkitystä. Huippupitoisuus (Cmax) oli 1,54 mikrog/ml ja se oli havaittavissa 1,3 tuntia annoksen ottamisen jälkeen. Keskimääräinen AUC-arvo oli 76,4 ± 20,3 mikrog.h/ml, ja keskimääräinen terminaalinen puoliintumisaika oli 46,2 tuntia. Nämä farmakokineettiset parametrit ovat suurempia kuin terveiltä nuorilta miespuolisilta vapaaehtoisilta raportoidut vastaavat arvot. Diureettien samanaikainen käyttö ei vaikuttanut merkityksellisesti AUC-arvoon tai huippupitoisuuteen. Iäkkäiden kreatiniinipuhdistuma (74 ml/min), virtsassa muuttumattomana lääkeaineena havaitun lääkeaineen prosentuaalinen osuus (0–24 h, 22 %) ja flukonatsolin munuaispuhdistuman arvot (0,124 ml/min/kg) olivat yleisesti pienemmät kuin nuoremmilla vapaaehtoisilla. Iäkkäillä havaitut flukonatsolin ominaisuuksien muutokset vaikuttavat siten liittyvän tälle ikäryhmälle tyypilliseen heikentyneeseen munuaistoimintaan.
Prekliiniset tiedot turvallisuudesta
Haittoja on koe-eläimissä todettu vain silloin, kun on käytetty altistusta, joka ylittää ihmisille riittävän annostuksen niin suuresti, että vaikutuksella on kliiniseltä kannalta vain vähäinen merkitys.
Karsinogeenisuus
Flukonatsolin karsinogeenisuudesta ei saatu näyttöä, kun sitä annettiin hiirille ja rotille suun kautta 2,5, 5 tai 10 mg/kg/vrk (noin 2–7-kertainen annos ihmisen suositusannokseen verrattuna) 24 kuukauden ajan. Kun urosrotille annettiin flukonatsolia 5 ja 10 mg/kg/vrk, hepatosellulaaristen adenoomien ilmaantuvuus lisääntyi.
Mutageenisuus
Flukonatsoli, metabolisen aktivaation kanssa tai ilman, oli negatiivinen mutageenisuustesteissä, jotka tehtiin neljällä Salmonella typhimurium -kannalla sekä hiiren lymfooma L5178Y -järjestelmässä. Sytogeneettisissä tutkimuksissa in vivo (hiiren luuydinsoluilla flukonatsolin oraalisen annon jälkeen) ja in vitro (ihmisen lymfosyyteillä, jotka altistettiin flukonatsolipitoisuudelle 1 000 mikrog/ml) ei saatu näyttöä kromosomimutaatioista.
Lisääntymistoksisuus
Flukonatsolilla ei ollut vaikutuksia hedelmällisyyteen uros- tai naarasrotilla, joille annettiin flukonatsolia 5, 10 tai 20 mg/kg suun kautta tai 5, 25 tai 75 mg/kg parenteraalisesti.
Annoksilla 5 mg/kg ja 10 mg/kg ei esiintynyt sikiöön kohdistuvia vaikutuksia. Annoksilla 25 mg/kg ja 50 mg/kg ja näitä suuremmilla annoksilla havaittiin sikiön anatomisten muutosten (kylkiluiden ylimäärä, munuaisten laajeneminen lantio-onteloon) lisääntymistä sekä luutumisen viivästymistä. Annoksesta 80 mg/kg annokseen 320 mg/kg saakka rottien alkiokuolleisuus oli lisääntynyt, ja sikiöillä esiintyi poikkeavuuksia, kuten aaltomaisia kylkiluita, suulakihalkioita ja poikkeavuuksia kallon ja kasvojen luutumisessa.
Synnytyksen käynnistyminen myöhentyi hieman suun kautta annetulla annoksella 20 mg/kg ja muutamilla emorotilla havaittiin laskimoon annetuilla annoksilla 20 mg/kg ja 40 mg/kg synnytysvaikeuksia ja synnytyksen pitkittymistä. Synnytyshäiriöt näillä annostasoilla aiheuttivat sen, että poikasia syntyi kuolleena hieman enemmän ja neonataalinen eloonjääminen väheni. Vaikutukset rottien synnytykseen ovat yhdenmukaisia sen kanssa, että suuret flukonatsoliannokset pienentävät estrogeenipitoisuuksia lajispesifisesti. Tällaista hormonimuutosta ei ole todettu flukonatsolilla hoidetuissa naisissa (ks. kohta Farmakodynamiikka).
Farmaseuttiset tiedot
Apuaineet
Sakkaroosi
Piidioksidi, kolloidinen, vedetön
Titaanidioksidi (E 171)
Ksantaanikumi (E 415)
Natriumsitraatti
Sitruunahappo, vedetön
Natriumbentsoaatti (E 211)
Luontainen appelsiinimakuaine (sisältää appelsiiniöljyä ja maltodekstriiniä)
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
Jauhe oraalisuspensiota varten: 3 vuotta.
Käyttövalmis oraalisuspensio: 28 vuorokautta.
Käyttövalmis suspensio: Säilytä alle 30 °C, ei saa jäätyä.
Säilytys
Säilytä alle 25 °C. Pidä pullo tiiviisti suljettuna.
Käyttökuntoon saatetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
DIFLUCAN jauhe oraalisuspensiota varten
40 mg/ml (L:ei) 35 ml (114,28 €)
PF-selosteen tieto
60 ml:n muovipullo (HDPE-pullo), jossa on joko muovinen lapsiturvallinen suljin tai alumiininen kierrekorkki ja joka sisältää valkoista tai luonnonvalkoista jauhetta oraalisuspensiota varten, josta saadaan käyttövalmiiksi saattamisen jälkeen valkoista tai luonnonvalkoista appelsiininmakuista suspensiota.
60 ml:n pullo sisältää 24,4 g jauhetta oraalisuspensiota varten. Suspension tilavuus on käyttövalmiiksi saattamisen jälkeen 35 ml.
60 ml:n pullon pakkaus sisältää mitta-asteikolla varustetun 5 ml:n mittaruiskun ja pulloon kiinni painettavan sovittimen. Mittaruiskun asteikkoväli on 0,2 ml.
Valmisteen kuvaus:
Valkoinen tai luonnonvalkoinen jauhe. Käyttövalmis oraalisuspensio on valkoinen tai luonnonvalkoinen, miedosti appelsiinintuoksuinen suspensio.
Käyttö- ja käsittelyohjeet
Ohjeet käyttövalmiiksi saattamiseen:
Käyttövalmiiksi saatettu suspensio on valkoinen tai luonnonvalkoinen appelsiininmakuinen suspensio.
Diflucan 40 mg/ml jauhe oraalisuspensiota varten 60 ml:n pullo, joka sisältää 35 ml suspensiota käyttövalmiiksi saattamisen jälkeen:
1. Naputtele pulloa, jotta jauhe irtoaa sen seinämistä.
2. Saata käyttövalmiiksi lisäämällä 24 ml vettä. Lisää ensin pieni määrä puhdistettua vettä ja ravista voimakkaasti. Lisää sitten vettä pullossa olevaan merkkiin (→) saakka (vastaa lisättävää 24 ml:n kokonaisvesimäärää).
3. Ravista kunnolla 1–2 minuutin ajan, jotta suspensio sekoittuu tasajakoiseksi.
4. Käyttövalmiiksi saattamisen jälkeen pullossa on 35 ml käyttövalmista suspensiota.
5. Kirjoita käyttövalmiiksi saatetun suspension viimeinen käyttöpäivämäärä pullon etikettiin (käyttövalmiiksi saatetun suspension kestoaika on 28 vuorokautta).
Käyttöohjeet:
Ravista suljettua, käyttövalmista suspensiota sisältävää pulloa aina ennen jokaista käyttökertaa.
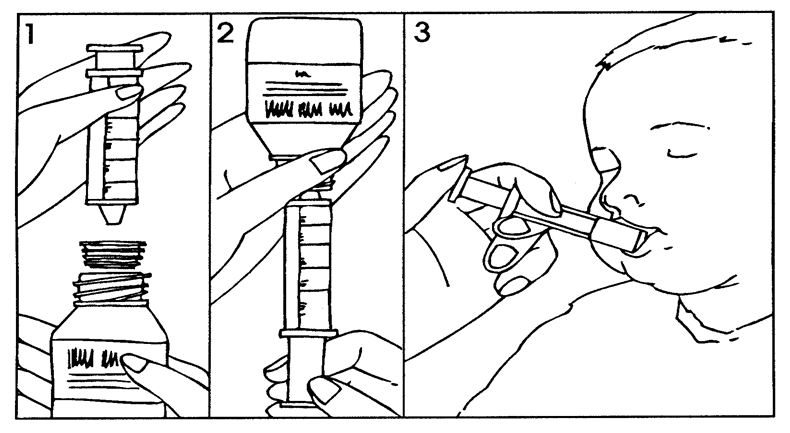
Mittaruiskun käyttöohjeet:
Ravista käyttövalmiiksi saatettu suspensio kunnolla.
- Avaa pullo (turvakorkki).
- Paina sovitin kiinni pullon suuhun ja mittaruisku kiinni sovittimeen (kuva 1).
- Käännä pullo ja mittaruisku ylösalaisin ja vedä lääkärin määräämä määrä suspensiota ruiskuun (kuva 2). Mittaruiskun mitta-asteikon merkinnät ovat millilitran (ml) välein.Pediatrisilla potilailla ei saa ylittää 400 mg:n enimmäisvuorokausiannosta (ks. kohta Annostus ja antotapa).
- Käännä pullo ja mittaruisku oikein päin, ja irrota mittaruisku pullosta.
- Lääke voidaan antaa mittaruiskun avulla suoraan suuhun. Potilaan on oltava pystyasennossa lääkkeen annon aikana. Osoita mittaruiskulla posken sisäpintaan ja paina suspensio hitaasti potilaan suuhun (kuva 3).
- Huuhtele mittaruisku.
- Sulje pullon turvakorkki, sovitin jää kiinni pullon suuhun.
Jauheesta valmistettavan oraalisuspensioannoksen muuntaminen milligrammoista millitrassa(mg/ml) millilitroiksi painokiloa kohti (ml/kg) pediatrisilla potilailla:
Lapsille Diflucan jauhe oraalisuspensiota varten tulee mitata mahdollisimman tarkkaan seuraavan kaavan avulla:

Mittaruiskun asteikkoväli on 0,2 ml. Tämän vuoksi välipainoja ja väliannostuksia varten millilitroina annettava annos on laskettava ja pyöristettävä ylös tai alas lähimpään mittaruiskun mitta-asteikon merkkiin.
Esimerkiksi 23 kg painavan lapsen, jolle on määrätty Diflucan-annos 6 mg/kg/vrk, tulee saada 138 mg/vrk, joka vastaa 3,45 ml:aa 40 mg/ml oraalisuspensiota. Annos voidaan pyöristää alas 3,4 ml:aan, mittaruiskun lähimpään mitta-asteikon merkkiin, täyden annoksen antamiseksi.
Pediatrisilla potilailla ei saa ylittää 400 mg:n vuorokausiannosta (ks. taulukko*). Diflucan 40 mg/ml jauhe oraalisuspensiota varten ‑valmistetta ei suositella alle 15 kg painaville.
Annos (vastaava annos ml/vrk) | |||
Paino kg | 3 mg/kg/vrk | 6 mg/kg/vrk | 12 mg/kg/vrk |
15 kg | 1,2 ml | 2,2 ml | 4,6 ml |
20 kg | 1,6 ml | 3,0 ml | 6,0 ml |
25 kg | 1,8 ml | 3,8 ml | 7,6 ml |
30 kg | 2,2 ml | 4,6 ml | 9,0 ml |
35 kg | 2,6 ml | 5,2 ml | 10,0 ml* |
40 kg | 3,0 ml | 6,0 ml | 10,0 ml* |
50 kg | 3,8 ml | 7,6 ml | 10,0 ml* |
Käyttämätön valmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Käyttämätön suspensio on hävitettävä 28 vuorokauden kuluttua käyttövalmiiksi saattamisesta.
Korvattavuus
DIFLUCAN jauhe oraalisuspensiota varten
40 mg/ml 35 ml
- Peruskorvaus (40 %).
ATC-koodi
J02AC01
Valmisteyhteenvedon muuttamispäivämäärä
06.02.2024
Yhteystiedot
 PFIZER OY
PFIZER OY Tietokuja 4
00330 Helsinki
09 430 040
www.pfizer.fi
etunimi.sukunimi@pfizer.com
