ENANTON DEPOT DUAL injektiokuiva-aine ja liuotin suspensiota varten, esitäytetty ruisku 30 mg
Vaikuttavat aineet ja niiden määrät
Yksi esitäytetty ruisku sisältää 30,0 mg leuproreliiniasetaattia, joka vastaa 28,58 mg leuproreliiniemästä.
Apuaine, jonka vaikutus tunnetaan
Enanton Depot Dual 30 mg sisältää polysorbaattia 1,0 mg/injektioruisku.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektiokuiva-aine ja liuotin suspensiota varten, esitäytetty ruisku.
Kliiniset tiedot
Käyttöaiheet
Pitkälle edenneen prostatasyövän hoito.
Annostus ja antotapa
Annostus
30 mg leuproreliiniasetaattia annetaan kerta-annoksena subkutaanisesti kuuden kuukauden välein.
Valmistetta tulee antaa varoen potilaille, joilla on tai joille voi kehittyä virtsatieobstruktio tai selkäydinvaurioita (ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet).
Leuproreliiniasetaatin farmakokinetiikkaa ei ole tutkittu maksan tai munuaisten vajaatoimintaa sairastavilla potilailla. Yksittäisiä havaintoja on tehty leuproreliinin seerumitasojen eroista (ks. lisätietoja kohdasta Farmakokinetiikka).
Prostatasyövän lääkehoito on yleensä pitkäkestoista.
Antotapa
Ainoastaan asiaan perehtyneiden terveydenhuollon ammattilaisten tulee valmistella, saattaa käyttövalmiiksi ja antaa Enanton Depot Dual injektio-valmiste.
Enanton Depot Dual 30 mg annetaan subkutaanisena injektiona. Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet lääkevalmisteen saattamisesta käyttökuntoon ennen lääkkeen antoa.
Huom.
Annosvälin tulee olla 168–180 päivää (24–26 viikkoa), jotta oireiden paheneminen voidaan välttää.
Laskimoon tai valtimoon annettu ruiske saattaa aiheuttaa tromboosin, joten ruiskeen ohjeenmukainen antotapa on varmistettava.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle, kohdassa Apuaineet mainituille apuaineille, synteettiselle GnRH:lle tai GnRH-johdannaisille.
Varoitukset ja käyttöön liittyvät varotoimet
Maksan toimintaa on syytä seurata leuproreliiniasetaattihoidon aikana, koska seerumin transaminaasien, AFOS:in, GT:n, LDH:n ja bilirubiinin nousu on mahdollista (ks. myös kohta Haittavaikutukset).
Voimakkaana aivolisäkkeen ja sukupuolirauhasten toimintaan vaikuttavana GnRH-johdannaisena leuproreliiniasetaatti saattaa hoidon alussa ohimenevästi lisätä seerumin testosteronipitoisuutta, joka heti ensimmäisen injektion jälkeen voi aiheuttaa luukivun pahenemista, virtsateiden tukkeutumista, verivirtsaisuutta, alaraajaheikkoutta, parestesiaa ja potilaan kliinisen tilan tilapäisen huononemisen (ns. ”flare”-ilmiö, ks. myös kohta Haittavaikutukset). Oireiden tulee yleensä laantua hoidon jatkuessa. ”Flare”-ilmiön riskin pienentämiseksi potilaalle voidaan antaa antiandrogeeniä. Ko. hoito aloitetaan kolme päivää ennen Enanton Depot Dual -hoitoa ja sitä jatketaan 2–3 viikon ajan.
Potilaita, joilla on eturauhassyövän tai metastaasin aiheuttama virtsatieobstruktio tai selkäydinvaurio, tulee tarkkailla huolellisesti ensimmäisten hoitoviikkojen aikana, koska oireet saattavat pahentua (ks. myös kohta Haittavaikutukset).
Testosteronin ja PSA:n (prostate specific antigen) pitoisuuksia seerumissa voidaan seurata Enanton Depot Dual -hoidon vasteen toteamiseksi. Testosteronitaso nousee ensimmäisen viikon aikana ja laskee sen jälkeen. Kastraatiotaso saavutetaan 2–4 viikon sisällä, ja se kestää koko hoitojakson ajan. Kuuden kuukauden hoitojakson loppuvaiheessa olisi hyvä mitata testosteronitaso niiltä potilailta, joita ei ole aikaisemmin hoidettu LHRH-analogeilla.
Pitkäaikaiseen estrogeenin tai androgeenin puutokseen (molempien kivesten poistosta tai GnRH-agonistihoidosta johtuen) on yhdistetty lisääntynyt riski luun mineraalipitoisuuden laskuun, joka saattaa aiheuttaa osteoporoosia ja lisääntynyttä luunmurtumariskiä potilailla, joilla on muita riskitekijöitä.
Potilailla, joita hoidetaan GnRH-agonisteilla, kuten leuproreliiniasetaatilla, on olemassa suurentunut riski sairastua masennukseen (joka voi olla vakava). Potilaille pitää kertoa riskistä ja heidän tulee saada asianmukaista hoitoa, jos oireita ilmenee.
Androgeenideprivaatiohoito voi pidentää QT-aikaa. Potilailla, joilla on todettu QT-ajan pidentyminen tai sen riskitekijöitä, sekä potilailla jotka saavat samanaikaisesti QT-aikaa mahdollisesti pidentäviä lääkkeitä (ks. kohta Yhteisvaikutukset), lääkärien pitäisi arvioida hyöty-haittasuhde ottaen huomioon kääntyvien kärkien takykardian mahdollisuus ennen kuin leuproreliiniasetaattihoito aloitetaan.
Endogeenisen sukupuolihormonituotannon estymiseen, androgeenihoidon aikana tai estrogeenin puutoksesta johtuen (menopausaalisilla naisilla), on yhdistetty kohonnut riski metabolisille muutoksille (kuten glukoosi- intoleranssi ja diabeteksen pahentuminen ja rasvamaksa) sekä sydän- ja verisuonisairauksille. Tutkimusnäyttö kardiovaskulaarisen kuolleisuuden lisääntymisestä on ristiriitaista. Potilaat, joilla on kohonnut riski metabolisille muutoksille tai metaboliselle oireyhtymälle, sydän- tai verisuonisairauksille, tulee arvioida huolellisesti ennen hoidon aloittamista ja heitä on asianmukaisesti seurattava GnRH-hoidon aikana.
Markkinoille tulon jälkeen on havaittu epileptisiä kohtauksia potilailla, joita on hoidettu leuproreliiniasetaatilla. Epileptisiä kohtauksia on ilmennyt lapsilla ja aikuisilla riippumatta siitä onko potilaalla ollut aiemmin epilepsiaa, kouristuksia tai näille altistavia riskitekijöitä.
Idiopaattinen kallonsisäisen paineen kohoaminen
Leuproreliinia saavilla potilailla on ilmoitettu idiopaattista kallonsisäisen paineen kohoamista (pseudotumor cerebri). Potilaita on varoitettava idiopaattisen kallonsisäisen paineen kohoamisen oireista ja löydöksistä, mukaan lukien vaikea tai toistuva päänsärky, näköhäiriöt ja tinnitus. Jos potilaalla ilmenee idiopaattista kallonsisäisen paineen kohoamista, leuproreliinihoidon lopettamista on harkittava.
Vaikeat ihoon kohdistuvat haittavaikutukset
Leuproreliinihoidon yhteydessä on raportoitu vaikeita ihoon kohdistuvia haittavaikutuksia (SCAR), mukaan lukien Stevens–Johnsonin oireyhtymä (SJS) ja toksinen epidermaalinen nekrolyysi (TEN), jotka voivat olla hengenvaarallisia tai johtaa kuolemaan. Lääkkeen määräämisen yhteydessä potilaille on kerrottava näistä oireista, ja heitä on seurattava tarkasti vaikeiden ihoreaktioiden varalta. Jos tällaisiin reaktioihin viittaavia oireita ilmenee, leuproreliini on lopetettava välittömästi ja on harkittava muuta hoitovaihtoehtoa (tarpeen mukaan).
Tämä lääkevalmiste sisältää alle 1 mmol (23 mg) natriumia per annos eli sen voidaan sanoa olevan ”natriumiton”.
Enanton Depot Dual sisältää polysorbaattia. Polysorbaatit saattavat aiheuttaa allergisia reaktioita.
Yhteisvaikutukset
Koska androgeenideprivaatiohoito voi pidentää QT-aikaa, leuproreliiniasetaatin samanaikaista käyttöä lääkkeiden kanssa, jotka pidentävät QT-aikaa tai voivat aiheuttaa kääntyvien kärkien takykardiaa, kuten luokan IA (esim. kinidiini, disopyramidi) tai luokan III (esim. amiodaroni, sotaloli, dofetilidi, ibutilidi) rytmihäiriölääkkeet, metadoni, moksifloksasiini, antipsykootit, jne., pitäisi tarkoin arvioida (katso kohta Varoitukset ja käyttöön liittyvät varotoimet).
Raskaus ja imetys
Enanton Depot Dual 30 mg on tarkoitettu vain miehille, prostatasyövän hoitoon.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Enanton Depot Dual voi vaikuttaa ajokykyyn ja koneidenkäyttökykyyn, koska leuproreliiniasetaatin on raportoitu aiheuttaneen väsymystä, näköhäiriöitä ja huimausta. Tämä on otettava huomioon autolla ajettaessa tai koneita käytettäessä.
Haittavaikutukset
”Flare”-ilmiö: Luukipu, virtsateiden tukkeutuminen ja alaraajaheikkous, parestesia (ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet) (≥ 5 %:lla potilaista).
Kuten muillakin tähän luokkaan kuuluvilla valmisteilla, aivolisäkekasvainpotilailla on raportoitu erittäin harvinaisena haittavaikutuksena aivolisäkkeen halvausta (pituitary apoplexy) ensimmäisen leuproreliiniasetaattiannoksen seurauksena.
Haittavaikutusten yleisyysluokat on määritelty seuraavasti: Yleinen (≥ 1/100 ja < 1/10), melko harvinainen (≥ 1/1 000 ja < 1/100), harvinainen (≥ 1/10 000 ja < 1/1 000), hyvin harvinainen (< 1/10 000) mukaan lukien yksittäiset raportit ja tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Elinryhmä | Yleinen | Melko harvinainen | Harvinainen | Hyvin harvinainen | Tuntematon |
Veri ja imukudos | Anemia, thrombosytopenia | ||||
Immuuni-järjestelmä | Yliherkkyys, ihottuma, kutina, urtikaria, hengityksen vinkuminen, kuume, vilunväristykset ja anafylaktinen reaktio | ||||
Aineen-vaihdunta ja ravitsemus | Painon muutokset, anoreksia, kohonneet seerumin kokonaiskole-steroli-, triglyseridi- tai glukoosipitoi-suudet, hyperkalemia, virtsahappo-pitoisuuden kohoaminen | Metabolinen oireyhtymä (hypertensio, dyslipidemia, insuliiniresistenssi, heikentynyt insuliinitoleranssi), rasvamaksa | |||
Psyykkiset häiriöt | Mielialan vaihtelut, masennus, unettomuus | ||||
Hermosto | Päänsärky, huimaus, parestesia | Aivolisäke-peräinen halvaus | Epileptinen kohtaus, idiopaattinen kallonsisäisen paineen kohoaminen (pseudotumor cerebri; ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) | ||
Silmät | Näköhäiriöt | ||||
Kuulo ja tasapainoelin | Kuurous, tinnitus | ||||
Sydän | Epänormaalit EKG-löydökset, sydän-thorax -suhteen suurentuminen | Palpitaatiot, QT-ajan pidentyminen (ks.kohdat 4.4 ja 4.5) | |||
Verisuonisto | Kuumat aallot | Kasvojen kuumotus | Tromboosi | ||
Hengityselimet, rintakehä ja välikarsina | Keuhkoembolia | Interstitiaalinen keuhkosairaus | |||
Ruuansulatus-elimistö | Pahoinvointi, oksentelu | Ripuli | |||
Maksa ja sappi | LDH-pitoisuuksien nousu, maksan toiminnan häiriö (keltaisuus) | Seerumin transaminaasien, GT-AFOS- ja bilirubiini-pitoisuuksien nousu | |||
Iho ja ihonalainen kudos | Hikoilu | Dermatiitti, hiusten kasvu päässä, ihottuma, kutina | Stevens–Johnsonin oireyhtymä/toksi-nen epidermaalinen nekrolyysi (SJS/TEN) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet), toksinen ihottuma, erythema multiforme, rakkulaihottuma, eksfoliatiivinen dermatiitti, akuutti yleistynyt eksantematoottinen pustuloosi (AGEP) | ||
Luusto, lihakset ja sidekudos | Lihasheikkous | Nivel- tai luukipu, hartiakipu, alaselkä- tai raajakipu | Myalgia | Luukato (sis. selkärangan murtuma), luun mineraalipitoi-suuden lasku | |
Munuaiset ja virtsatiet | Tiheävirtsaisuus, verivirtsaisuus, seerumin ureapitoisuuden kohoaminen | ||||
Sukupuoli-elimet ja rinnat | Libidon alentuminen, impotenssi, kivesatrofia | Gynekomastia, epämiellyttävä tunne lantiopohjan alueella | |||
Yleisoireet ja antopaikassa todettavat haitat | Injektiokoh-dan reaktio*, kuumotus | Kävelemis-vaikeudet, turvotus, paineen tunne rinnassa, jäykkyys, huonovointisuus, väsymys, kuume, injektioalueen kipu, kovettumat tai punoitus | Injektioalueen absessit |
*) Enanton Depot Dual 30 mg -valmisteen turvallisuusprofiili vastaa 11,25 mg:n valmisteen profiilia, mutta 30 mg:aa käytettäessä on raportoitu useammin injektiokohdan reaktioita.
Lisäksi GnRH-analogien käytön yhteydessä voi ilmetä metabolisia muutoksia (esim. glukoosi-intoleranssia tai diabeteksen pahentumista) tai sydän- ja verisuonitapahtumien riskin suurenemista.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Yliannostustapauksessa potilasta tulee tarkkailla huolellisesti, ja hänelle tulee antaa oireenmukaista hoitoa.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Endokrinologiset lääkeaineet, Gonadotropiinia vapauttavan hormonin kaltaiset yhdisteet, ATC-koodi: L02AE02.
Enanton Depot Dual -valmisteiden vaikuttava aine on leuproreliiniasetaatti, pitkävaikutteinen GnRH (LHRH) -analogi, joka terapeuttisia annoksia pitkäaikaisesti käytettäessä on tehokas gonadotropiinierityksen inhibiittori. Leuproreliiniasetaatti on noin 100 kertaa potentimpi kuin luonnollinen GnRH-hormoni.
Tutkimuksissa ihmisillä ja eläimillä leuproreliiniasetaatin pitkäaikaisen annon on hoidon alussa tapahtuvan stimulaation jälkeen todettu johtavan munasarjojen ja kivesten steroidogeneesin suppressioon. Munasolujen ja kivesten toiminta palautuu normaaliksi lääkehoidon lopettamisen jälkeen.
Ihmisillä leuproreliiniasetaatti aiheuttaa aluksi luteinisoivan hormonin (LH) ja follikkelia stimuloivan hormonin (FSH) pitoisuuksien lisääntymisen, mikä aiheuttaa sekä miehillä että naisilla gonadaalisteroidipitoisuuksien hetkellisen nousun. Jatkuva leuproreliinin anto kuitenkin vähentää gonadotropiini- ja sukupuolisteroidipitoisuuksia. Tämä vaikutus on todettavissa 2–4 viikon kuluessa hoidon aloittamisesta.
Farmakokinetiikka
Leuproreliiniasetaatti vapautuu maitohappopolymeeristä jatkuvasti kuuden kuukauden ajan Enanton Depot Dual 30 mg -injektion jälkeen. Kantajapolymeeri liukenee kudoksessa samalla tavalla kuin kirurgiset ompelumateriaalit.
Enanton Depot Dual 30 mg kerta-annoksen jälkeen leuproreliinitaso nousi nopeasti vähentyäkseen samalle tasolle muutaman päivän kuluessa. Kahden tunnin sisällä lääkkeen antamisesta saavutettiin leuproreliinin taso 100 ng/ml. Tasainen mitattava seerumipitoisuus todettiin aina 180 päivään asti hoitoannoksen antamisen jälkeen. Leuproreliinin jakaantumisvolyymi on 36 litraa miehillä. Totaalipuhdistuma on 139,6 ml/min Enanton Depot Dual 30 mg ‑injektion jälkeen.
Toistuvilla annoksilla pysyvä testosteronin kastraatiotaso saavutetaan ilman että testosteronitaso nousisi väliaikaisesti niin kuin ensimmäisen injektion jälkeen.
Leuproreliiniasetaatin farmakokinetiikkaa ei ole tutkittu maksan tai munuaisten vajaatoimintaa sairastavilla potilailla. Kroonisessa munuaisten vajaatoiminnassa korkeita leuproreliinitasoja on joissakin tapauksissa mitattu kun taas maksan vajaatoimintaa sairastavilla potilailla todettiin alhaisia leuproreliinipitoisuuksia. Havainnolla ei ole kuitenkaan kliinistä merkitystä.
Leuproreliinin metaboliaa, jakautumista ja erittymistä ei ole täysin ihmisillä määritelty.
Prekliiniset tiedot turvallisuudesta
Akuutti toksisuus (LD50)
Leuproreliinin depot -formulaation akuuttia toksisuutta on tutkittu uros- ja naarashiirillä ja -rotilla neljällä annostavalla (i.p., i.m., s.c. ja p.o.). Koe-eläinten kuolemia ei ole todettu leuproreliinin annoksilla 2 000 mg ja 5 000 mg.
Toistetun annoksen toksisuus
13 viikon kroonisia toksisuustutkimuksia on tehty rotilla ja koirilla käyttäen 8 mg leuproreliiniasetaattia per painokilo viikossa. 12 kuukauden toksisuustutkimuksissa käytettiin 32 mg leuproreliiniasetaatti/kg kuukaudessa.
Kaikilla annostasoilla (alin testattu annos oli 0,8 mg leuproreliiniasetaattia/kg kuukaudessa) paikallisia ihovaurioita ilmeni injektiokohdassa, lisäksi todettiin atrofisia muutoksia lisääntymiselimissä. Rakkuloita kehittyi rotalla sekä maksaan että munuaistubulusten epiteelisoluihin kaikilla annoksilla. Sukuelinten muutokset johtuvat lääkeaineen endokriinisistä vaikutuksista.
Karsinogeenisuus, mutageenisuus, vaikutukset fertiliteettiin
Karsinogeenisuus
Kahden vuoden karsinogeenisuustutkimukset on tehty rotilla ja hiirillä. Annoksesta riippuvainen nousu hypofyysiadenoomissa todettiin rotilla, kun leuproreliiniä annettiin päivittäin 0,6–4 mg, kun taas hypofyysiadenoomia ei kehittynyt hiirille, vaikka käytettiin 60 mg/kg kahden vuoden ajan.
Mutageenisuus
In vitro ja in vivo -tutkimukset leuproreliiniasetaatilla eivät osoittaneet mitään potentiaalista mutageenisuutta tutkittaessa geneettisiä ja kromosomimutaatioita.
Fertiliteetti
Kohdun ja munasarjojen paino nousi, hormonitasot nousivat ja tuore keltarauhanen todettiin sukukypsillä naarasrotilla, kun leuproreliinin antaminen lopetettiin. Tässä tutkimuksessa käytettiin kahdesti päivässä 10 µg ihon alle 14 päivän ajan tai 40 µg ihon alle 13 päivän ajan.
Koiras- ja naarasrotille kehittyi normaali sukuelimistö, kun niille annettiin leuproreliinia 3 kuukautta jatkuvasti (200 µg/kg/päivä) tai jaksottaisesti (0,8 tai 2,4 mg/kg/kuukausi). Fl-sukupolvessa ei todettu mitään poikkeavuuksia. Fl-sukupolven käyttäytymistä ei tutkittu.
Kliiniset ja farmakologiset tutkimukset ovat osoittaneet, että hedelmällisyys oli täysin palautuva vähintään 24 viikossa lääkkeen annon lopettamisen jälkeen.
Lisääntymistoksisuus
Tutkimukset rotilla ja kaneilla eivät paljastaneet teratogeenisuutta. Sikiötoksisuutta tai -kuolleisuutta on todettu kaneilla annoksella > 0,24 µg/kg.
Farmaseuttiset tiedot
Apuaineet
Injektiokuiva-aine:
Poly(maitohappo)
Mannitoli
Liuotin:
Mannitoli
Karmelloosinatrium
Polysorbaatti 80
Etikkahappo, väkevä (pH:n säätöön)
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
3 vuotta.
Käyttövalmis suspensio on käytettävä välittömästi.
Säilytys
Älä säilytä kylmässä. Ei saa jäätyä.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
ENANTON DEPOT DUAL injektiokuiva-aine ja liuotin suspensiota varten, esitäytetty ruisku
30 mg (L:ei) 30 mg (635,50 €)
PF-selosteen tieto
1 x esitäytetty kaksikammioruisku (lasi Ph. Eur. tyyppi I, kumitulpat silikonoitua klorobutyylikumia), jossa turvasuojuksella varustettu injektioneula (23 G).
Valmisteen kuvaus:
Esitäytetty ruisku on kaksikammioruisku, joka sisältää valkoista jauhetta ja kirkasta, väritöntä liuosta.
Käyttö- ja käsittelyohjeet
Injektion valmistaminen ja antotapa
Injektiokuiva-aine ja liuotin sekoitetaan ennen käyttöä. HUOM.! Älä vedä mäntää taaksepäin missään vaiheessa, koska tämän seurauksena tulpat erkaantuvat toisistaan, mikä voi johtaa vuotamiseen tulppien väleistä tai ruiskun mäntäpuolelta.
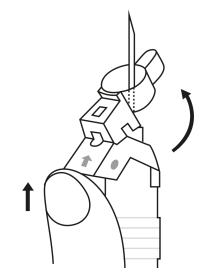
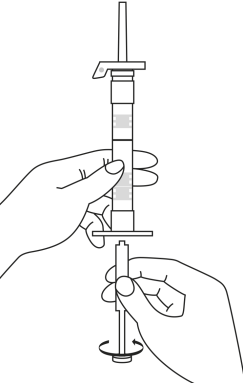 | 1. Pidä ruisku pystyasennossa (neula ylöspäin). Männän varsi kierretään kiinni ruiskun päähän kunnes taaempi kumitulppa alkaa liikkua. | 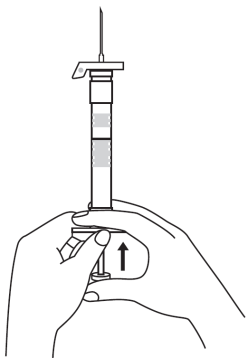 | 5. Pidä ruiskua siten, että neula osoittaa ylöspäin, jotta näet, onko ruiskun sisällä ilmakuplia. Jos ilmakuplia näkyy, paina mäntää varovasti, kunnes kaikki ilma (mutta ei yhtään nestettä) poistuu ruiskusta. |
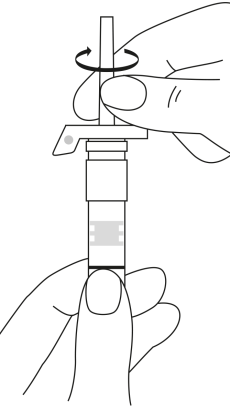 | 2. Pidä ruisku pystyasennossa (neula ylöspäin). Tarkista, että neula on kunnolla kiinnitetty ruiskuun kiertämällä neulansuojuksesta myötäpäivään. Varo kiertämästä liian tiukkaan. Naputa ruiskua varovasti sormella, jotta jauhe irtoaa kammion seinästä. |
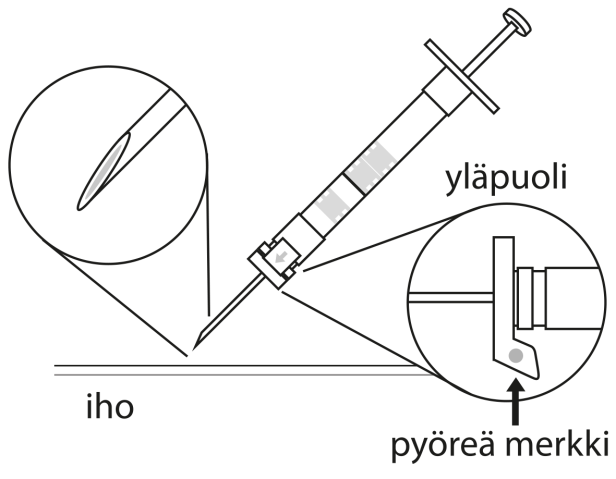
6. Puhdista ihoalue ennen pistosta antiseptisella aineella. Injektiota annettaessa turvasuojuksen pyöreän merkin tulee osoittaa ylöspäin. Varmista, että neula ei lävistä verisuonta ja injisoi ruiskun koko sisältö kerralla ihonalaisesti, kuten normaalia injektiota annettaessa. | |
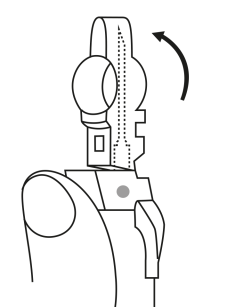
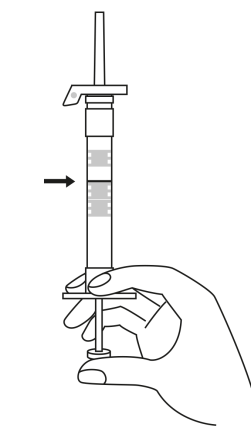 | 3. Pidä ruisku pystyasennossa (neula ylöspäin). Työnnä mäntää hitaasti (6‑8 sekuntia) kunnes keskimmäisen kumitulpan yläosa on sinisen viivan kohdalla. | ||
INJEKTION JÄLKEEN 7. Turvasuojuksen vipuun on painettuna nuoli. Heti injektion jälkeen työnnä sormella turvalaitteen vipua nuolen osoittamaan suuntaan. Tällöin suojus liukuu kohti neulan kärkeä ja lukittuu sen suojaksi. Varmista lukitus kuuntelemalla tai tunnustelemalla (lukituksesta kuuluu ”klik” tai tuntuu napsahdus). | |||
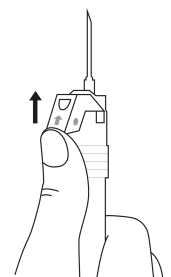
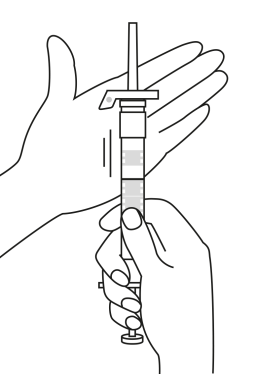 | 4. Pidä ruisku pystyasennossa (neula ylöspäin). Ravistele varovasti ruiskua, kunnes suspensio on tasa-aineinen. Valmis injektio on valkoinen maitomainen suspensio. Vedä varovasti neulan suojus irti. | ||
Yleisiä ohjeita
- Varmista, että suspensio on tasa-aineinen ennen annostelua.
- Käytä valmis suspensio välittömästi.
- Peitä injektiokohta tarvittaessa laastarilla.
- Injektiokohtaa on syytä vaihdella, jotta lääkettä ei injisoida toistamiseen samaan paikkaan.
- Koska valmiste ei sisällä säilöntäainetta, valmis suspensio on hävitettävä, mikäli sitä ei käytetä välittömästi.
- Potilasta on syytä informoida siitä, ettei injektioaluetta saa hieroa.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
ENANTON DEPOT DUAL injektiokuiva-aine ja liuotin suspensiota varten, esitäytetty ruisku
30 mg 30 mg
- Ylempi erityiskorvaus (100 %). Eturauhassyöpä (116).
- Peruskorvaus (40 %).
ATC-koodi
L02AE02
Valmisteyhteenvedon muuttamispäivämäärä
28.10.2024
Yhteystiedot
 ORION OYJ ORION PHARMA
ORION OYJ ORION PHARMA Orionintie 1, PL 65
02101 Espoo
010 4261
www.orion.fi
etunimi.sukunimi@orionpharma.com