GESTINYL tabletti, päällystetty 20/75 mikrog, 30/75 mikrog
 Lääketurva
Lääketurva
Riskienminimointimateriaalit
Terveydenhuollon ammattilainen
DAISYNELLE, GESTINYL
DAISYNELLE, GESTINYL
DAISYNELLE, GESTINYL
Vaikuttavat aineet ja niiden määrät
Vaikuttavat aineet:
Gestinyl 20 mikrog/75 mikrog: yksi tabletti sisältää 20 mikrogrammaa etinyyliestradiolia ja 75 mikrogrammaa gestodeenia
Gestinyl 30 mikrog/75 mikrog: yksi tabletti sisältää 30 mikrogrammaa etinyyliestradiolia ja 75 mikrogrammaa gestodeenia
Apuaineet, joiden vaikutus tunnetaan:
Gestinyl 20 mikrog/75 mikrog sisältää 38 mg laktoosimonohydraattia ja 20 mg sakkaroosia
Gestinyl 30 mikrog/75 mikrog sisältää 38 mg laktoosimonohydraattia ja 20 mg sakkaroosia
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Tabletti, päällystetty.
Kliiniset tiedot
Käyttöaiheet
Raskauden ehkäisy.
Gestinyl-valmisteen määräämistä koskevassa päätöksessä on otettava huomioon valmisteen käyttäjän nykyiset riskitekijät, erityisesti laskimotromboembolian (VTE) riskitekijät, ja millainen Gestinyl-valmisteen käytön VTE:n riski on verrattuna muiden hormonaalisten yhdistelmäehkäisyvalmisteiden riskeihin (ks. kohdat Vasta-aiheet ja Varoitukset ja käyttöön liittyvät varotoimet).
Annostus ja antotapa
Miten Gestinyl -tabletteja otetaan
Tabletit otetaan pakkaukseen merkityssä järjestyksessä joka päivä suunnilleen samaan aikaan. Tabletteja otetaan yksi päivässä 21 peräkkäisen päivän ajan. Ennen uuden pakkauksen aloittamista pidetään 7 päivän tablettitauko, jonka aikana tulee tyhjennysvuoto. Vuoto alkaa yleensä 2–3 päivän kuluttua viimeisen tabletin ottamisesta eikä välttämättä pääty ennen seuraavan pakkauksen aloittamista.
Miten Gestinyl -tablettien käyttö aloitetaan
Ei edeltävää hormonaalista ehkäisyä kuluneen kuukauden aikana
Tablettien käyttö aloitetaan luonnollisen kuukautiskierron ensimmäisenä päivänä (eli ensimmäisenä vuotopäivänä). Tablettien käyttö voidaan aloittaa myös kierron päivinä 2–5, mutta tällöin suositellaan lisäksi jonkin estemenetelmän käyttöä ensimmäisen kierron ensimmäisten 7 tablettipäivän ajan.
Vaihto toisesta yhdistelmäehkäisytabletista, ehkäisyrenkaasta tai ehkäisylaastarista
Gestinyl -tablettien käyttö aloitetaan mieluiten aiemman ehkäisytablettipakkauksen viimeisen vaikuttavan tabletin ottoa seuraavana päivänä, mutta viimeistään aiemman ehkäisytablettivalmisteen tavanomaisen tablettitauon tai lumetablettijakson päättymisen jälkeisenä päivänä. Käytettäessä ehkäisyrengasta tai ehkäisylaastaria Gestinyl-tablettien käyttö aloitetaan mieluiten päivää ennen suunniteltua renkaan tai laastarin poistoa, tai viimeistään silloin, kun seuraava rengas tai laastari olisi otettu käyttöön.
Vaihto pelkkää progestiinia sisältävistä valmisteista (pelkkää progestiinia sisältävät ehkäisytabletit, injektiot, implantaatit tai progestiinia vapauttava kierukka)
Pelkkää progestiinia sisältävistä tableteista voidaan milloin tahansa siirtyä Gestinyl -tabletteihin, joilla jatketaan heti seuraavana päivänä. Kun implantaatista tai kierukasta siirrytään Gestinyl -tabletteihin, tablettien käyttö aloitetaan implantaatin poistopäivänä. Kun injektioista siirrytään Gestinyl -tabletteihin, tablettien käyttö aloitetaan päivänä, jona seuraava injektio on tarkoitus antaa. Näissä kaikissa tilanteissa naisen tulisi käyttää lisäksi jotain estemenetelmää 7 ensimmäisen tablettipäivän ajan.
Ensimmäisen raskauskolmanneksen aikana tapahtuneen raskauden keskeytymisen jälkeen
Tablettien käyttö voidaan aloittaa heti. Muita ehkäisymenetelmiä ei tällöin tarvita.
Synnytyksen tai toisen raskauskolmanneksen aikana tapahtuneen raskauden keskeytymisen jälkeen
Imettävät äidit - ks. kohta Raskaus ja imetys.
Tablettien käyttö tulee aloittaa 21–28 päivää synnytyksen jälkeen (jos nainen ei imetä) tai toisen raskauskolmanneksen aikana tapahtuneen raskauden keskeytymisen jälkeen. Jos tablettien käyttö aloitetaan myöhemmin, tulee ensimmäisten 7 tablettipäivän aikana käyttää lisäksi jotain estemenetelmää. Jos nainen on jo ollut yhdynnässä, raskauden mahdollisuus on suljettava pois ennen tablettien käytön aloittamista tai naisen on odotettava seuraavien kuukautisten alkamista.
Tablettien unohtuminen
Jos unohtuneen tabletin ottaminen myöhästyy alle 12 tuntia, valmisteen ehkäisyteho ei heikenny. Unohtunut tabletti on otettava heti, kun asia muistuu mieleen. Tämän jälkeen tablettien ottamista jatketaan tavanomaiseen tapaan.
Jos unohtuneen tabletin ottaminen myöhästyy yli 12 tuntia, valmisteen ehkäisyteho voi heikentyä. Seuraavat säännöt pätevät tapauksissa, joissa tablettien ottaminen on unohtunut.
- Tablettien ottamista ei tule koskaan keskeyttää yli 7 päivän ajaksi.
- Hypotalamus-aivolisäke-munasarja-akselin riittävä suppressio edellyttää tablettien ottamista yhtäjaksoisesti 7 päivän ajan.
Yllä kuvatun perusteella voidaan siis antaa seuraavat käytännön ohjeet:
1. viikko
Viimeinen unohtunut tabletti on otettava heti, kun asia muistuu mieleen, vaikka tällöin olisikin otettava 2 tablettia samalla kertaa. Seuraavat tabletit otetaan tavanomaiseen aikaan. Lisäksi seuraavien 7 päivän ajan tulee käyttää jotain estemenetelmää, kuten kondomia. Raskauden mahdollisuus on otettava huomioon, jos nainen on ollut yhdynnässä tabletin unohtamista edeltävien 7 päivän aikana. Raskauden mahdollisuus on sitä suurempi, mitä useampia tabletteja on unohtunut ja mitä lähempänä kuukausittaista tablettitaukoa ne unohtuivat.
2. viikko
Viimeinen unohtunut tabletti on otettava heti, kun asia muistuu mieleen, vaikka tällöin olisikin otettava 2 tablettia samalla kertaa. Seuraavat tabletit otetaan tavanomaiseen aikaan. Jos tabletteja on otettu ohjeen mukaan unohtamista edeltävien 7 päivän ajan, ei lisäehkäisyä tarvita. Jos näin ei kuitenkaan ole tai jos nainen on unohtanut useampia tabletteja, hänen on käytettävä seuraavien 7 päivän ajan jotain estemenetelmää, kuten kondomia.
3. viikko
Valmisteen ehkäisyteho on uhattuna, koska tablettitauko on jo lähellä. Ehkäisytehon heikkeneminen voidaan kuitenkin estää tablettien ottamisaikataulua muuttamalla. Lisäehkäisyä ei tarvita, jos nainen noudattaa jompaakumpaa seuraavista vaihtoehdoista ja jos tabletteja on otettu ohjeen mukaan unohtamista edeltävien 7 päivän ajan. Jos näin ei kuitenkaan ole, on naista kehotettava noudattamaan ensimmäistä vaihtoehtoa ja käyttämään seuraavien 7 päivän ajan jotain estemenetelmää, kuten kondomia.
- Viimeinen unohtunut tabletti on otettava heti, kun asia muistuu mieleen, vaikka tällöin olisikin otettava 2 tablettia samalla kertaa. Seuraavat tabletit otetaan tavanomaiseen aikaan. Seuraava pakkaus aloitetaan välittömästi edellisen loputtua, eikä pakkausten välissä siis pidetä taukoa. Tyhjennysvuoto tulee todennäköisesti vasta toisen pakkauksen loputtua, mutta tablettien ottamisen aikana voi esiintyä tiputtelu- tai läpäisyvuotoa.
- Nainen voi myös lopettaa tablettien ottamisen käytössä olevasta pakkauksesta. Tällöin pidetään enintään 7 päivän tablettitauko (unohtamispäivät mukaan lukien), jonka jälkeen jatketaan tablettien ottamista uudesta pakkauksesta.
Raskauden mahdollisuus on otettava huomioon, jos nainen unohtaa ottaa tabletteja, eikä ensimmäisen normaalin tablettitauon aikana tule tyhjennysvuotoa.
Ohjeet oksentelun/ripulin varalle
Jos nainen oksentaa 3–4 tunnin kuluessa tabletin ottamisesta, imeytyminen saattaa olla epätäydellistä. Tällöin noudatetaan tablettien unohtumista koskevia ohjeita (ks. yllä). Vain äärimmäisen vaikea ripuli vaikuttaa yhdistelmäehkäisytablettien imeytymiseen, joten lisäehkäisyä ei yleensä tarvita. Jos vaikea ripuli jatkuu yli 2 päivän ajan, noudatetaan tablettien unohtamista koskevia ohjeita. Jos nainen ei halua muuttaa tavanomaista tablettien ottamisaikatauluaan, hänen on otettava tarvittavat ylimääräiset tabletit toisesta läpipainopakkauksesta.
Kuukautisten siirtäminen
Kuukautisia voidaan siirtää myöhemmäksi aloittamalla uusi Gestinyl -pakkaus heti edellisen jälkeen ilman tablettitaukoa. Kuukautisia voidaan siirtää niin pitkälle kuin halutaan, mutta kuitenkin enintään toisen pakkauksen loppumiseen saakka. Tänä aikana voi esiintyä läpäisy- tai tiputteluvuotoa. Gestinyl -tablettien säännöllinen käyttö aloitetaan uudelleen tavanomaisen 7 päivän tablettitauon jälkeen.
Jos nainen haluaa muuttaa kuukautisten alkamispäivää nykyisestä joksikin toiseksi viikonpäiväksi, häntä voidaan kehottaa lyhentämään seuraavaa tablettitaukoa niin monella päivällä kuin hän haluaa. Mitä lyhyemmäksi tablettitauko jää, sitä todennäköisemmin tyhjennysvuoto jää tulematta, ja seuraavan pakkauksen käytön aikana voi esiintyä läpäisy- tai tiputteluvuotoa (kuten kuukautisia siirrettäessä).
Erityispotilasryhmät
Pediatriset potilaat
Gestinyl on tarkoitettu käytettäväksi vasta kuukautisten alkamisen jälkeen.
Iäkkäät
Gestinyl on vasta-aiheinen vaihdevuosien jälkeen.
Potilaat, joilla on maksan vajaatoiminta
Gestinyl on vasta-aiheinen naisilla, joilla on vaikea maksan vajaatoiminta (ks. kohta Vasta-aiheet).
Potilaat, joilla on munuaisten vajaatoiminta
Gestinyl-valmistetta ei ole tutkittu erityisesti potilailla, joilla on munuaisten vajaatoiminta. Tietoja ei ole saatavilla.
Vasta-aiheet
Hormonaalisia yhdistelmäehkäisytabletteja ei pidä käyttää seuraavien tilojen yhteydessä. Jos jokin näistä tiloista ilmenee ensimmäistä kertaa yhdistelmäehkäisytablettien käytön aikana, on tablettien käyttö lopetettava välittömästi.
- Yliherkkyys vaikuttaville aineille tai kohdassa Apuaineet mainituille apuaineille
-
Laskimotromboembolia (VTE) tai sen riski
- laskimotromboembolia – tällä hetkellä esiintyvä VTE (potilas antikoagulanttilääkityksellä) tai anamneesissa VTE (esim. syvä laskimotromboosi [SLT] tai keuhkoembolia).
- tiedossa oleva perinnöllinen tai hankittu laskimotromboembolia-alttius, kuten APC- resistenssi, (mukaan lukien Faktori V Leiden), antitrombiini III:n puutos, C-proteiinin puutos, S-proteiinin puutos
- suuri leikkaus ja siihen liittyvä pitkittynyt immobilisaatio (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
- useiden riskitekijöiden aiheuttama suuri laskimotromboembolian riski (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
-
Valtimotromboembolia tai sen riski
- valtimotromboembolia – tällä hetkellä esiintyvä tai aiemmin esiintynyt valtimotromboembolia (esim.sydäninfarkti) tai sitä ennakoiva tila (esim. angina pectoris)
- aivoverisuonisairaus - tällä hetkellä esiintyvä tai aiemmin esiintynyt aivohalvaus tai sitä ennakoiva tila (esim. ohimenevä aivoverenkiertohäiriö, TIA)
- tiedossa oleva perinnöllinen tai hankittu valtimotromboembolia-alttius, kuten hyperhomokysteinemia ja fosfolipidivasta-aineet (kardiolipiinivasta-aineet, lupusantikoagulantti
- anamneesissa migreeni, johon liittyy fokaalisia neurologisia oireita.
- monista riskitekijöistä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) tai yhden vakavan riskitekijän esiintymisestä johtuva suurentunut valtimotromboemboliariski. Näitä riskitekijöitä voivat olla:
- diabetes, jossa esiintyy verisuonioireita
- vaikea hypertensio
- vaikea dyslipoproteinemia.
- Tiedossa oleva tai epäilty pahanlaatuinen kasvain (esim. sukuelimissä tai rinnoissa), johon sukupuolihormonit vaikuttavat
- Tämänhetkinen tai aiempi vaikea maksan toimintahäiriö, mikäli maksan toimintakokeiden tulokset eivät ole normalisoituneet
- Tämänhetkinen tai aiempi hyvän- tai pahanlaatuinen maksakasvain
- Selittämätön verenvuoto emättimestä
Ombitasviirin, paritapreviirin ja ritonaviirin yhdistelmää ja dasabuviiria, glekapreviirin ja pibrentasviirin yhdistelmää tai sofosbuviirin, velpatasviirin ja voksilapreviirin yhdistelmää sisältävien lääkevalmisteiden samanaikainen käyttö Gestinyl-valmisteen kanssa on vasta-aiheista (ks. kohta Yhteisvaikutukset).
Varoitukset ja käyttöön liittyvät varotoimet
Gestinyl-valmisteen soveltuvuudesta on keskusteltava naisen kanssa, jos hänellä esiintyy mikä tahansa alla mainituista tiloista tai riskitekijöistä
Jos jokin näistä tiloista tai riskitekijöistä pahenee tai ilmenee ensimmäisen kerran, käyttäjää on kehotettava ottamaan yhteys lääkäriin, joka päättää, pitääkö Gestinyl-valmisteen käyttö keskeyttää.
Laskimotromboembolian (VTE) riski
Minkä tahansa hormonaalisen yhdistelmäehkäisyvalmisteen käyttö lisää laskimotromboembolian (VTE) riskiä verrattuna siihen, että tällaista valmistetta ei käytetä lainkaan. Levonorgestreelia, norgestimaattia tai noretisteronia sisältäviin valmisteisiin liittyy pienin VTE:n riski. Tämä riski voi olla jopa kaksinkertainen muilla valmisteilla, kuten esimerkiksi Gestinyl-valmisteella. Päätöksen muun kuin VTE:n riskiltään pienimmän valmisteen käyttämisestä saa tehdä vain sen jälkeen, kun ehkäisyä harkitsevan naisen kanssa on keskusteltu. Keskustelussa on varmistettava, että hän ymmärtää Gestinyl-valmisteen käyttöön liittyvän VTE:n riskin, miten hänen nykyiset riskitekijänsä vaikuttavat tähän riskiin ja että hänen VTE:n riskinsä on suurimmillaan ensimmäisen vuoden aikana, jona hän käyttää yhdistelmäehkäisyvalmistetta ensimmäistä kertaa elämässään. On myös jonkin verran näyttöä siitä, että riski suurenee, kun yhdistelmäehkäisyvalmisteen käyttö aloitetaan uudelleen vähintään 4 viikon tauon jälkeen.
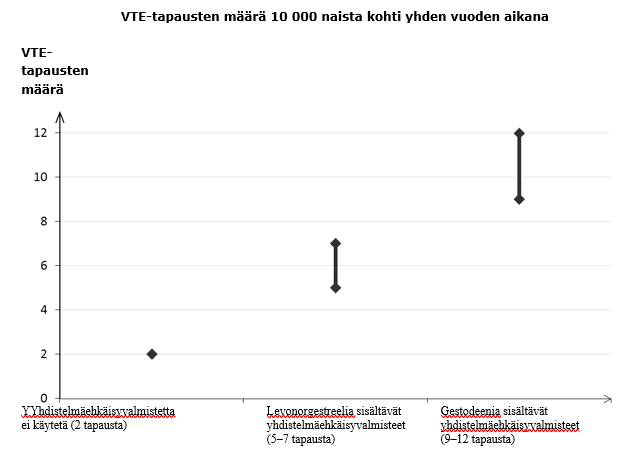
Noin kahdelle naiselle 10 000:sta, jotka eivät käytä yhdistelmäehkäisyvalmistetta eivätkä ole raskaana, kehittyy VTE yhden vuoden aikana. Yksittäisellä naisella tämä riski voi kuitenkin olla suurempi riippuen hänen omista, taustalla vaikuttavista riskitekijöistä (ks. jäljempänä).
Arviolta noin 9–12 naiselle[footnoteRef:1]10 000:sta, jotka käyttävät gestodeenia sisältävää yhdistelmäehkäisyvalmistetta, kehittyy VTE yhden vuoden aikana. Levonorgestreelia sisältävää yhdistelmäehkäisyvalmistetta käyttävillä naisilla vastaava luku on 6[footnoteRef:2]. [1: Ilmaantuvuus arvioitiin kaikista epidemiologisista tutkimustuloksista vertaamalla eri valmisteiden suhteellisia riskejä levonorgestreelia sisältäviin yhdistelmäehkäisyvalmisteisiin.] [2: Vaihteluvälin 5–7 keskipiste 10 000 naisvuotta kohden, mikä perustuu levonorgestreelia sisältävien yhdistelmäehkäisyvalmisteiden käytön suhteelliseen riskiin verrattuna käyttämättömyyteen, jolloin riski on noin 2,3–3,6.]
Molemmissa tapauksissa VTE-tapausten määrä vuotta kohti on pienempi kuin määrä, joka on odotettavissa raskauden aikana tai synnytyksen jälkeisenä aikana.
VTE saattaa aiheuttaa kuoleman 1–2 %:ssa tapauksista.
Yhdistelmäehkäisyvalmisteiden käyttäjillä tromboosia on erittäin harvoin raportoitu esiintyneen muissa verisuonissa (esim. maksan, suoliliepeen, munuaisten tai verkkokalvon laskimoissa ja valtimoissa).
Laskimotromboembolian riskitekijät
Yhdistelmäehkäisyvalmisteiden käyttäjillä esiintyvien laskimotromboembolisten komplikaatioiden riski voi suurentua huomattavasti, jos naisella on muita riskitekijöitä, erityisesti jos riskitekijöitä on useita (ks. taulukko).
Gestinyl-valmiste on vasta-aiheinen naisella, jolla on useita riskitekijöitä, jotka aiheuttavat suuren VTE:n riskin (ks. kohta Vasta-aiheet). Jos naisella on useampia kuin yksi riskitekijä, nämä yhdessä voivat muodostaa yksittäisten tekijöiden summaa suuremman riskin – tässä tapauksessa VTE:n kokonaisriski on otettava huomioon. Jos hyöty-riski-suhteen katsotaan olevan negatiivinen, yhdistelmäehkäisyvalmistetta ei pidä määrätä (ks. kohta Vasta-aiheet).
Taulukko: Laskimotromboembolian (VTE) riskitekijät
Riskitekijä | Kommentti |
Ylipaino (painoindeksi yli 30 kg/m2) | Riski suurenee huomattavasti painoindeksin |
noustessa. Huomioitava erityisesti silloin, jos muita riskitekijöitä on myös olemassa. | |
Pitkittynyt immobilisaatio, suuri leikkaus, kaikki jalkojen tai lantion alueen leikkaukset, neurokirurgia tai merkittävä trauma Huomioitavaa: väliaikainen immobilisaatio, mukaan lukien > 4 tunnin lentomatka, voi myös olla VTE:n riskitekijä, erityisesti naisilla, joilla on myös muita riskitekijöitä | Näissä tilanteissa on suositeltavaa lopettaa tabletin käyttö (elektiivisen leikkauksen kohdalla vähintään neljä viikkoa etukäteen), eikä sitä pidä jatkaa ennen kuin käyttäjä on ollut kaksi viikkoa täysin liikuntakykyinen. Jotain muuta raskaudenehkäisymenetelmää on käytettävä ei-toivotun raskauden ehkäisemiseksi. Antitromboottista hoitoa on harkittava, ellei Gestinyl-valmisteen käyttöä ole lopetettu etukäteen. |
Positiivinen sukuanamneesi (tämänhetkinen tai aikaisempi VTE sisaruksella tai vanhemmalla, etenkin suhteellisen nuorella iällä, esim. alle 50-vuotiaana) | Jos perinnöllistä alttiutta epäillään, potilas on syytä ohjata erikoislääkärin tutkimuksiin ennen kuin minkään yhdistelmäehkäisyvalmisteen käytöstä päätetään. |
Muut laskimotromboemboliaan liitetyt sairaudet | Syöpä, systeeminen lupus erythematosus, hemolyyttis-ureeminen oireyhtymä, krooninen tulehduksellinen suolistosairaus (Crohnin tauti tai haavainen koliitti) ja sirppisoluanemia |
Ikääntyminen | Erityisesti yli 35 vuoden ikä |
Suonikohjujen ja pinnallisen laskimontukkotulehduksen mahdollisesta yhteydestä laskimotromboosin alkamiseen tai etenemiseen ei ole yksimielisyyttä.
Laskimotromboembolian suurempi riski raskauden ja erityisesti synnytyksen jälkeisten noin 6 viikon aikana on otettava huomioon (ks. lisätiedot kohdasta Raskaus ja imetys "Raskaus ja imetys”).
Laskimotromboembolian oireet (syvä laskimotromboosi ja keuhkoembolia)
Jos oireita ilmaantuu, naisia on neuvottava hakeutumaan välittömästi lääkärin hoitoon ja kertomaan, että he käyttävät yhdistelmäehkäisyvalmistetta.
Syvän laskimotromboosin (SLT) oireita voivat olla:
- toisen jalan ja/tai jalkaterän turvotus tai turvotus jalan laskimon kohdalla
- jalan kipu tai arkuus, joka saattaa tuntua vain seistessä tai kävellessä
- jalan lisääntynyt lämmöntunne, jalan ihon värin muutos tai punoitus.
Keuhkoembolian oireita voivat olla:
- äkillisesti alkanut, selittämätön hengenahdistus tai nopeutunut hengitys
- äkillinen yskä, johon saattaa liittyä veriysköksiä
- pistävä rintakipu
- vaikea pyörrytys tai huimaus
- nopea tai epäsäännöllinen sydämen syke.
Jotkut näistä oireista (esim. hengenahdistus, yskä) ovat epäspesifisiä, ja ne voidaan tulkita virheellisesti yleisluontoisemmiksi tai vähemmän vaikeiksi tapahtumiksi (esim. hengitystieinfektioksi).
Muita verisuonitukoksen merkkejä voivat olla mm.: äkillinen kipu, turvotus ja sinertävä värimuutos raajassa.
Jos tukos tulee silmään, oireena voi olla esim. kivuton näön hämärtyminen, joka voi edetä näön menetykseen. Joskus näön menetys voi tapahtua lähes välittömästi.
Valtimotromboembolian (ATE) riski
Epidemiologisissa tutkimuksissa on osoitettu, että yhdistelmäehkäisyvalmisteiden käyttöön liittyy suurentunut valtimotromboembolian (sydäninfarkti) tai aivoverisuonitapahtuman (esim. aivojen ohimenevä verenkiertohäiriö (TIA), aivohalvaus) riski. Valtimotromboemboliset tapahtumat voivat johtaa kuolemaan.
Valtimotromboembolian (ATE) riskitekijät
Valtimotromboembolisten komplikaatioiden tai aivoverisuonitapahtuman riski yhdistelmäehkäisyvalmisteen käyttäjillä on korkeampi niillä naisilla, joilla on riskitekijöitä (ks. taulukko). Gestinyl-valmiste on vasta-aiheinen, jos naisella on joko yksi vakava tai useampia ATE:n riskitekijöitä, mikä aiheuttaa suuren valtimotromboemboliariskin (ks. kohta Vasta-aiheet). Jos naisella on useampi kuin yksi riskitekijä, nämä yhdessä voivat muodostaa yksittäisten tekijöiden summaa suuremman riskin – tässä tapauksessa kokonaisriski on otettava huomioon. Jos hyöty-riski-suhteen katsotaan olevan negatiivinen, yhdistelmäehkäisyvalmistetta ei pidä määrätä (ks. kohta Vasta-aiheet)
Taulukko: Valtimotromboembolian (ATE) riskitekijät
Riskitekijä | Kommentti |
Ikääntyminen | Erityisesti yli 35 vuoden ikä |
Tupakointi | Yhdistelmäehkäisyvalmistetta käyttäviä naisia on neuvottava olemaan tupakoimatta. Yli 35-vuotiaita, tupakoimista jatkavia naisia on vakavasti kehotettava käyttämään jotakin muuta ehkäisymenetelmää. |
Korkea verenpaine | |
Ylipaino (painoindeksi yli 30 kg/m2) | Riski kasvaa huomattavasti painoindeksin noustessa. Erityisen tärkeää naisilla, joilla on muitakin riskitekijöitä. |
Positiivinen sukuanamneesi (tämänhetkinen tai aikaisempi valtimotromboembolia sisaruksella tai vanhemmalla, etenkin suhteellisen nuorella iällä, alle 50-vuotiaana). | Jos perinnöllistä alttiutta epäillään, potilas on syytä ohjata erikoislääkärin tutkimuksiin ennen kuin minkään yhdistelmäehkäisyvalmisteen käytöstä päätetään. |
Migreeni | Migreenin esiintymistiheyden kasvu tai vaikeusasteen lisääntyminen (mikä saattaa olla aivoverisuonitapahtumaa ennakoiva oire) yhdistelmäehkäisyvalmisteen käytön aikana voi olla syy yhdistelmäehkäisyvalmisteen käytön välittömään keskeyttämiseen. |
Muut verisuoniston haittatapahtumiin liitetyt sairaudet | Diabetes, hyperhomokysteinemia, sydämen läppävika ja eteisvärinä, dyslipoproteinemia ja systeeminen lupus erythematosus (SLE). |
Valtimotromboembolian (ATE) oireet
Jos oireita ilmaantuu, naisia on neuvottava hakeutumaan välittömästi lääkärin hoitoon ja kertomaan, että he käyttävät yhdistelmäehkäisyvalmistetta.
Aivoverisuonitapahtuman oireita voivat olla:
- kasvojen, käsivarren tai jalan äkillinen tunnottomuus tai heikkous (varsinkin vain yhdellä puolella vartaloa esiintyvä)
- äkillinen kävelyn vaikeutuminen, huimaus, tasapainon tai koordinaation menetys
- äkillinen sekavuus, puhe- tai ymmärtämisvaikeudet
- äkillinen näön heikentyminen yhdessä tai molemmissa silmissä
- äkillinen, voimakas tai pitkittynyt päänsärky, jonka syytä ei tiedetä
- tajunnan menetys tai pyörtyminen, johon saattaa liittyä kouristuskohtaus.
Ohimenevät oireet viittaavat siihen, että tapahtuma on ohimenevä aivoverenkiertohäiriö (TIA).
Sydäninfarktin oireita voivat olla:
- kipu, epämiellyttävä tunne, paineen tunne, painon tunne, puristuksen tai täysinäisyyden tunne rinnassa, käsivarressa tai rintalastan takana
- selkään, leukaan, kurkkuun, käsivarteen ja/tai vatsaan säteilevä epämiellyttävä tunne
- täyteläisyyden, ruoansulatushäiriöiden tai tukehtumisen tunne
- hikoilu, pahoinvointi, oksentelu tai huimaus
- erittäin voimakas heikkouden tunne, ahdistuneisuus tai hengenahdistus
- nopea tai epäsäännöllinen sydämen syke.
Kasvaimet:
Kohdunkaulan syöpä
Joissakin epidemiologisissa tutkimuksissa yhdistelmäehkäisytablettien pitkäaikaiskäytön on ilmoitettu suurentavan kohdunkaulan syövän riskiä, mutta toistaiseksi ei tiedetä, missä määrin sukupuolikäyttäytyminen ja muut tekijät, kuten ihmisen papilloomavirus (HPV), vaikuttavat tähän löydökseen.
Rintasyöpä
Meta-analyysi 54 epidemiologisesta tutkimuksesta osoitti, että yhdistelmäehkäisytablettien käyttäjien suhteellinen rintasyöpäriski on hieman normaalia suurempi (RR = 1,24). Riski palaa normaalitasolle 10 vuoden kuluessa yhdistelmäehkäisytablettien käytön lopettamisesta. Rintasyöpää esiintyy alle 40-vuotiailla naisilla vain harvoin, joten yhdistelmäehkäisytabletteja käyttävillä tai niitä hiljattain käyttäneillä naisilla havaittu rintasyöpädiagnoosien ylimäärä on pieni verrattuna rintasyövän kokonaisriskiin.
Näistä tutkimuksista ei saatu näyttöä syy-seuraussuhteista. Havaittu riskin suureneminen voi johtua rintasyövän varhaisemmasta diagnoosista yhdistelmäehkäisytablettien käyttäjillä, yhdistelmäehkäisytablettien biologisista vaikutuksista tai molemmista. Lisäksi käyttäjillä todetut rintasyöpätapaukset ovat yleensä kliinisesti varhaisemmassa vaiheessa kuin ehkäisytabletteja käyttämättömillä todetut rintasyöpätapaukset.
Maksakasvaimet
Yhdistelmäehkäisytablettien käyttäjillä on ilmoitettu sekä hyvän- että pahanlaatuisia maksakasvaimia. Yksittäistapauksissa nämä kasvaimet ovat aiheuttaneet hengenvaarallisia vatsaontelon sisäisiä verenvuotoja. Erotusdiagnostisesti maksakasvaimen mahdollisuutta tulisi harkita, kun yhdistelmäehkäisytablettien käyttäjällä on voimakasta ylävatsakipua, suurentunut maksa tai merkkejä vatsaontelon sisäisestä verenvuodosta.
Muut tilat
Yhdistelmäehkäisytablettien käyttö voi suurentaa haimatulehduksen riskiä, jos naisella tai hänen lähisukulaisillaan on ollut hypertriglyseridemiaa.
Jos naisella esiintyy akuuttia tai kroonista maksan vajaatoimintaa, Gestinyl -tablettien käyttö on keskeytettävä, kunnes maksan toimintakoearvot normalisoituvat (ks. kohta Vasta-aiheet). Steroidihormonit saattavat metaboloitua heikosti, jos potilaan maksan toiminta on heikentynyt.
Monilla yhdistelmäehkäisytabletteja käyttävillä naisilla on ilmoitettu lievää verenpaineen nousua, mutta kliinisesti merkitsevä verenpaineen nousu on harvinaista. Jos yhdistelmäehkäisytablettien käytön aikana esiintyy sitkeää kliinistä verenpaineen nousua, on tablettien ottaminen keskeytettävä ja korkea verenpaine hoidettava. Yhdistelmäehkäisytablettien käytön saa tarvittaessa aloittaa uudelleen, kun verenpaine on saatu laskemaan normaaliarvoihin verenpainelääkityksellä.
Seuraavia tiloja tai niiden pahenemista on ilmoitettu sekä raskauden että yhdistelmäehkäisytablettien käytön aikana, mutta niiden yhteydestä yhdistelmäehkäisytablettien käyttöön ei ole saatu täyttä varmuutta: kolestaasiin liittyvä keltaisuus ja/tai kutina, sappikivet, porfyria, systeeminen lupus erythematosus, hemolyyttis-ureeminen oireyhtymä, Sydenhamin korea, herpes gestationis ja otoskleroosiin liittyvä kuulonalenema.
Yhdistelmäehkäisytabletit voivat vaikuttaa perifeeriseen insuliiniresistenssiin ja glukoosinsietoon. Yhdistelmäehkäisytabletteja käyttäviä diabeetikkoja tulee siis seurata huolellisesti.
Endogeenisen masennuksen, epilepsian (ks. kohta Yhteisvaikutukset ”Yhteisvaikutukset”), Crohnin taudin ja haavaisen paksusuolitulehduksen pahenemista on ilmoitettu yhdistelmäehkäisytablettien käytön aikana.
Masentunut mieliala ja masennus ovat tunnettuja hormonaalisten ehkäisyvalmisteiden käyttöön liittyviä haittavaikutuksia (ks. kohta Haittavaikutukset). Masennus voi olla vakavaa, ja se on itsetuhoisen käyttäytymisen ja itsemurhan tunnettu riskitekijä. Naisia on kehotettava ottamaan yhteyttä lääkäriinsä, jos heillä esiintyy mielialan muutoksia ja masennuksen oireita, myös pian hoidon aloittamisen jälkeen.
Maksaläiskiä voi esiintyä etenkin naisilla, joilla on ollut niitä raskausaikana. Jos naisella on taipumus saada maksaläiskiä, hänen tulisi välttää altistumista auringonvalolle ja UV-säteilylle yhdistelmäehkäisytablettien käytön aikana.
Mäkikuismaa (Hypericum perforatum) sisältäviä rohdosvalmisteita ei tule käyttää samanaikaisesti Gestinyl -tablettien kanssa, sillä Gestinyl -valmisteen pitoisuus plasmassa saattaa pienentyä ja valmisteen kliininen teho heikentyä (ks. kohta Yhteisvaikutukset).
Immuunijärjestelmän häiriöt
Angioedeema
Eksogeeniset estrogeenit voivat indusoida tai pahentaa perinnöllisen ja hankinnaisen angioedeeman oireita.
Tehon heikentyminen
Tablettien unohtaminen, vaikea ripuli tai oksentelu (ks. kohta Annostus ja antotapa) tai muiden lääkevalmisteiden samanaikainen käyttö (ks. kohta Yhteisvaikutukset) voivat heikentää ehkäisytablettien tehoa.
Syklikontrollin heikentyminen
Kaikki yhdistelmäehkäisytabletit voivat aiheuttaa epäsäännöllistä vuotoa (tiputtelu- tai läpäisyvuotoa) etenkin ensimmäisten käyttökuukausien aikana. Siksi epäsäännöllistä vuotoa kannattaa alkaa tutkia vasta noin 3 kiertoa kestävän sopeutumisvaiheen jälkeen.
Jos vuotohäiriöt jatkuvat, naisen siirtämistä suuremman hormonipitoisuuden yhdistelmäehkäisytabletteihin tulee harkita. Jos vuotohäiriöitä ilmaantuu kiertojen oltua aiemmin säännölliset, ei-hormonaaliset syyt on hyvä ottaa huomioon. Asianmukaiset diagnostiset toimenpiteet ovat perusteltuja maligniteetin tai raskauden poissulkemiseksi.
Joskus tablettitauon aikana ei tule tyhjennysvuotoa. Jos tabletteja on käytetty kohdassa Annostus ja antotapa annettujen ohjeiden mukaan, nainen ei todennäköisesti ole raskaana. Jos tabletteja ei kuitenkaan ole käytetty ohjeiden mukaan ennen tyhjennysvuodon poisjääntiä tai jos jo kaksi tyhjennysvuotoa on jäänyt tulematta, raskauden mahdollisuus on suljettava pois ennen yhdistelmäehkäisytablettien käytön jatkamista.
Lääkärintarkastus
Ennen Gestinyl-valmisteen käytön aloittamista tai uudelleen aloittamista potilaan sairaushistoria on selvitettävä täydellisesti (mukaan lukien sukuanamneesi), ja raskaus on suljettava pois. Naisen verenpaine on mitattava, ja hänelle on tehtävä lääkärintarkastus ottaen huomioon vasta-aiheet (ks. kohta Vasta-aiheet) ja varoitukset (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). On tärkeää kiinnittää naisen huomiota laskimo- ja valtimoveritulppia koskeviin tietoihin, kuten Gestinyl-valmisteen käyttöön liittyvään riskiin verrattuna muihin yhdistelmäehkäisyvalmisteisiin, laskimo- ja valtimoveritulppien oireisiin, tiedossa oleviin riskitekijöihin sekä siihen, mitä tehdä, jos epäilee veritulppaa.
Naista on myös neuvottava lukemaan pakkausseloste huolellisesti ja noudattamaan siinä annettuja ohjeita. Tarkastuskäyntien tiheyden ja luonteen pitää perustua vakiintuneisiin hoitosuosituksiin, ja ne on toteutettava kunkin naisen kliinisten tarpeiden mukaisesti.
Naisia on varoitettava siitä, että hormonaaliset ehkäisyvalmisteet eivät suojaa HIV-infektiolta (AIDS)
tai muilta sukupuoliteitse tarttuvilta taudeilta.
Apuaineet
Gestinyl -tabletit sisältävät laktoosia ja sakkaroosia. Potilaiden, joilla on harvinainen perinnöllinen galaktoosi-intoleranssi, täydellinen laktaasinpuutos tai glukoosi-galaktoosi-imeytymishäiriö, fruktoosi-intoleranssi tai sakkaroosi-isomaltaasin puutos, ei pidä käyttää tätä lääkevalmistetta.
Yhteisvaikutukset
Muiden lääkkeiden vaikutukset Gestinyl-valmisteeseen
Ehkäisytablettien ja muiden lääkkeiden väliset yhteisvaikutukset voivat lisätä sukupuolihormonien puhdistumaa.Entsyymi-induktio voidaan havaita jo muutaman hoitopäivän jälkeen. Maksimaalinen entsyymi-induktio ilmenee yleensä muutaman viikon kuluessa. Lääkehoidon lopettamisen jälkeen entsyymi-induktion vaikutus voi säilyä noin neljän viikon ajan.
Kirjallisuudessa on raportoitu seuraavassa kuvattuja yhteisvaikutuksia.
- Lääkkeet, jotka saattavat heikentää yhdistelmäehkäisytablettien tehoa
Etinyyliestradiolipitoisuuden pieneneminen saattaa lisätä läpäisyvuotoja ja kuukautisten epäsäännöllisyyttä sekä heikentää ehkäisytablettien tehoa.
Metabolian induktion välityksellä (sytokromi P450 3A4 -isoentsyymi)
- epilepsialääkkeet: hydantoiinit (fenytoiini), barbituraatit (fenobarbitaali), primidoni, karbamatsepiini, okskarbatsepiini, topiramaatti, felbamaatti
- tuberkuloosilääkkeet: rifampisiini, rifabutiini
- muut: griseofulviini, modafiniili, mäkikuisma (Hypericum perforatum). Mäkikuisman aiheuttama induktiovaikutus saattaa jatkua vähintään 2 viikkoa mäkikuisman käytön päättymisen jälkeen.
Lääkkeet, joilla on vaihtelevia vaikutuksia yhdistelmäehkäisytablettien puhdistumaan
Samanaikaisesti yhdistelmäehkäisytablettien kanssa käytettyinä monet HI-viruksen ja C-hepatiittiviruksen proteaasin estäjät (esim. ritonaviiri, nelfinaviiri) ja ei-nukleosidirakenteiset käänteiskopioijaentsyymin estäjät (esim. nevirapiini) voivat suurentaa tai pienentää estrogeenien tai progestiinien pitoisuuksia plasmassa. Nämä muutokset voivat joissakin tapauksissa olla kliinisesti merkittäviä.
Tällaisten lääkkeiden käytön aikana on käytettävä Gestinyl-valmisteen lisäksi tilapäisesti jotakin estemenetelmää. Jos tällaisia lääkkeitä käytetään pitkäaikaisesti, on valittava jokin muu ehkäisykeino. Estemenetelmää on käytettävä niin kauan kuin samanaikainen lääkitys on käytössä ja vielä 28 päivän ajan lääkityksen lopettamisen jälkeen.
Jos estemenetelmän käytön ajanjakso kestää pidempään kuin Gestinyl-läpipainopakkauksessa riittää tabletteja, seuraava Gestinyl-läpipainopakkaus aloitetaan ilman tavanomaista tablettitaukoa.
Maksaentsyymejä indusoivien lääkkeiden pitkäaikaiskäytön aikana on syytä käyttää muita ehkäisymenetelmiä.
- Lääkkeet, jotka voivat lisätä yhdistelmäehkäisytablettien pitoisuutta seerumissa
Entsyymi-inhibiittorit (yhdistelmäehkäisytablettien puhdistuman pieneneminen)
Voimakkaat tai keskivahvat CYP3A4:n estäjät, kuten atsolisienilääkkeet (esim. itrakonatsoli, vorikonatsoli, flukonatsoli), verapamiili, makrolidit (esim. klaritromysiini, erytromysiini), diltiatseemi ja greippimehu voivat suurentaa estrogeenin tai progestiinin tai molempien pitoisuuksia plasmassa.
Etorikoksibin 60–120 mg:n vuorokausiannosten on havaittu suurentavan etinyyliestradiolin pitoisuuksia plasmassa 1,4–1,6-kertaisiksi, kun etorikoksibia otetaan samanaikaisesti 0,035 mg etinyyliestradiolia sisältävän yhdistelmäehkäisyvalmisteen kanssa.
Gestinyl-valmisteen vaikutukset muihin lääkkeisiin
Etinyyliestradioli voi vaikuttaa muiden lääkeaineiden metaboliaan estämällä maksan mikrosomaalisia entsyymejä tai indusoimalla lääkeaineiden konjugoitumista maksassa, erityisesti glukuronidaatiota. Pitoisuus plasmassa ja kudoksessa voi
- suurentua
siklosporiini: samanaikainen anto yhdistelmäehkäisytablettien kanssa suurentaa maksatoksisuuden riskiä
- teofylliini
- kortikosteroidit: prednisoloni. Yhdistelmäehkäisytabletit suurentavat kortikosteroidien kuljettajaproteiinien pitoisuuksia, lisäävät niihin sitoutuvien kortikosteroidien osuutta, hidastavat kortikosteroidien eliminaatiota ja pidentävät niiden puoliintumisaikaa, mikä voi lisätä niiden toksisia vaikutuksia.
pienentyä
- kipulääkkeet: etinyyliestradioli voi vähentää parasetamolin analgeettisen vaikutuksen voimakkuutta ja kestoa
- lamotrigiini.
In vitro etinyyliestradioli on CYP2C19-, CYP1A1- ja CYP1A2-entsyymien palautuva estäjä sekä CYP3A4/5-, CYP2C8- ja CYP2J2-entsyymien mekanismiin perustuva estäjä. Kliinisissä tutkimuksissa etinyyliestradiolia sisältävien hormonaalisten ehkäisyvalmisteiden käyttö ei suurentanut tai suurensi vain vähän CYP3A4:n substraattien (esim. midatsolaami) pitoisuuksia plasmassa. CYP1A2:n substraattien pitoisuudet plasmassa sen sijaan voivat suurentua hieman (esim. teofylliini) tai kohtalaisesti (esim. melatoniini tai titsanidiini).
Laboratoriokokeet
Steroidiehkäisyn käyttö voi vaikuttaa eräiden laboratoriokokeiden tuloksiin, kuten maksan, kilpirauhasen, lisämunuaisten ja munuaisten toimintakokeiden biokemiallisiin parametreihin, (kantaja)proteiinien (esim. kortikosteroideja sitova globuliini ja lipidi/lipoproteiinifraktiot) pitoisuuksiin plasmassa, hiilihydraattiaineenvaihdunnan parametreihin ja veren hyytymis- ja fibrinolyysiparametreihin. Muutokset pysyvät yleensä normaaliarvojen rajoissa.
Farmakodynaamiset yhteisvaikutukset
Kun kliinisissä tutkimuksissa hoidettiin hepatiitti C -virusinfektiota (HCV) ombitasviirin, paritapreviirin ja ritonaviirin yhdistelmällä ja dasabuviirilla ribaviriinin kanssa tai ilman, transaminaasiarvon (ALAT) kohoamista yli 5 x ULN (viitealueen yläraja) esiintyi merkitsevästi useammin naisilla, jotka käyttivät etinyyliestradiolia sisältävää valmistetta, kuten yhdistelmäehkäisyvalmistetta. Myös glekapreviirin ja pibrentasviirin yhdistelmää tai sofosbuviirin, velpatasviirin ja voksilapreviirin yhdistelmää käyttävillä potilailla ALAT-arvojen kohoamista havaittiin etinyyliestradiolia sisältävää valmistetta (kuten yhdistelmäehkäisyvalmistetta) käyttävillä naisilla (ks. kohta Vasta-aiheet).
Tästä syystä Gestinyl-valmistetta käyttävien on vaihdettava toiseen ehkäisymenetelmään (esim. pelkkää progestiinia sisältävään tai hormonittomaan ehkäisymenetelmään) ennen kyseisten yhdistelmähoitojen aloittamista. Gestinyl-valmisteen käyttö voidaan aloittaa uudelleen 2 viikon kuluttua näiden yhdistelmähoitojen päättymisestä.
Raskaus ja imetys
Gestinyl-tabletteja ei saa käyttää raskauden aikana. Jos nainen tulee raskaaksi Gestinyl-tablettien käytön aikana, valmisteen käyttö tulee lopettaa heti.
Laajojen epidemiologisten tutkimusten mukaan synnynnäisten kehityshäiriöiden riski ei ole suurentunut ennen raskautta yhdistelmäehkäisytabletteja käyttäneiden naisten lapsilla, kuten ei myöskään teratogeenisten vaikutusten riski silloin, kun yhdistelmäehkäisytabletteja on käytetty tahattomasti raskauden aikana.
Steroidiehkäisy voi vaikuttaa imetykseen, sillä se voi vähentää rintamaidon määrää ja muuttaa sen koostumusta. Pieniä määriä näitä steroideja ja/tai niiden metaboliitteja voi erittyä rintamaitoon. Siksi steroidiehkäisyä ei yleensä tulisi suositella imettävälle äidille ennen kuin lapsi on vieroitettu rintaruokinnasta.
Kun Gestinyl-valmisteen käyttö aloitetaan uudelleen, on huomioitava, että laskimotromboembolian riski on suurentunut synnytyksen jälkeisenä aikana (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet)
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Gestinyl -tableteilla ei ole haitallista vaikutusta ajokykyyn ja koneiden käyttökykyyn.
Haittavaikutukset
Yleisimpiä haittavaikutuksia ovat epäsäännöllinen vuoto, pahoinvointi, vatsakipu, painonnousu, päänsärky, masennus, mielialan vaihtelut, rintakipu ja rintojen arkuus. Näitä vaikutuksia esiintyy ≥ 1 %:lla käyttäjistä.
Vakaviin haittavaikutuksiin sisältyvät valtimo- ja laskimotromboembolia.
Elinjärjestelmä (MedDRA) | Hyvin yleiset (≥ 1/10) | Yleiset (≥ 1/100 ja < 1/10) | Melko harvinaiset (≥ 1 / 1 000 ja < 1/100) | Harvinaiset (≥ 1 / 10 000 ja < 1/1 000) | Hyvin harvinaiset (< 1 / 10 000) | Tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin) |
Infektiot | Vaginiitti, mukaan lukien kandidiaasi | |||||
Hyvän- ja pahanlaatuiset kasvaimet (mukaan lukien kystat ja polyypit) | maksan adenooma, maksasolukarsinooma | |||||
Immuunijärjestelmä | lupus erythematosus, anafylaktiset/anafylaktoidiset reaktiot, mukaan lukien hyvin harvinaiset urtikariatapaukset, angioedeema ja vaikeat reaktiot, joihin liittyy hengitys- ja verenkierto-oireita | perinnöllisen ja hankinnaisen angioedeeman oireiden paheneminen | ||||
Aineenvaihdunta ja ravitsemus | nesteretentio | hyperlipidemia | glukoosi-intoleranssi | glukoosinsiedon muutokset tai vaikutus perifeeriseen insuliiniresistenssiin, porfyrian oireiden paheneminen | ||
Psyykkiset häiriöt | mielialan vaihtelut, mukaan lukien masennus, libidon muutokset | |||||
Hermosto | päänsärky, hermostuneisuus | migreeni, huimaus | korea | |||
Silmät | näköhäiriöt | huono piilolinssien sieto | optinen neuriitti*, verkkokalvon verisuonitukos | |||
Kuulo- ja tasapainohäiriöt | otoskleroosi | |||||
Verisuonisto | hypertensio | laskimotromboembolia, valtimotromboembolia | ||||
Ruoansulatuselimistö | pahoinvointi, vatsakipu | oksentelu | haimatulehdus | |||
Maksa ja sappi | sappikivitauti, kolestaattinen ikterus | |||||
Iho ja ihonalainen kudos | akne | ihottuma, hirsutismi, alopesia | maksaläiskät, erythema nodosum | erythema multiforme | ||
Munuaiset ja virtsatiet | hemolyyttis-ureeminen oireyhtymä | |||||
Sukupuolielimet ja rinnat | tiputteluvuoto, läpäisyvuoto | epäsäännöllinen vuoto, amenorrea, hypomenorrea, rintojen arkuus | emätineritteen muutokset | |||
Tutkimukset | painonnousu | seerumin lipiditasojen muutokset, mukaan lukien hypertriglyseridemia | pienentyneet seerumin folaattipitoisuudet** |
(*) Optinen neuriitti voi johtaa täydelliseen tai osittaiseen näön menetykseen.
(**) Ehkäisytablettien käyttö saattaa pienentää seerumin folaattipitoisuutta. Tällä saattaa olla kliinistä merkitystä naisille, jotka tulevat raskaaksi pian lääkehoidon lopettamisen jälkeen.
Tiettyjen haittavaikutusten kuvaus
Yhdistelmäehkäisyvalmisteita käyttävillä naisilla on havaittu valtimoiden ja laskimoiden tromboottisten ja tromboembolisten tapahtumien lisääntynyt riski. Näitä tapahtumia ovat mm. sydäninfarkti, aivohalvaus, ohimenevät aivoverenkiertohäiriöt (TIA), laskimoveritulppa ja keuhkoembolia. Tapahtumia kuvataan tarkemmin kohdassa Varoitukset ja käyttöön liittyvät varotoimet.
Haittavaikutukset, joiden esiintymistiheys on hyvin pieni tai joiden oireiden alku on viivästynyt ja joiden voidaan katsoa liittyvän yhdistelmäehkäisytablettien ryhmään, on lueteltu seuraavassa (ks. myös kohdat Vasta-aiheet ja Varoitukset ja käyttöön liittyvät varotoimet):
Kasvaimet
- yhdistelmäehkäisytablettien käyttäjillä rintasyöpädiagnoosien esiintyvyys on hieman normaalia suurempi. Rintasyöpää esiintyy alle 40-vuotiailla naisilla vain harvoin, joten tämä rintasyöpädiagnoosien ylimäärä on pieni verrattuna rintasyövän kokonaisriskiin. Syy-yhteyttä yhdistelmäehkäisytablettien käyttöön ei tunneta.
- maksakasvaimet (hyvän- ja pahanlaatuiset).
Muut poikkeavuudet
- naiset, joilla on hypertriglyseridemia (yhdistelmäehkäisytablettien käyttöön liittyy suurentunut haimatulehduksen riski)
- hypertensio
- seuraavia sairaustiloja tai niiden pahenemista on raportoitu, mutta niiden yhteydestä yhdistelmäehkäisytablettien käyttöön ei ole saatu täyttä varmuutta: kolestaasiin liittyvä ikterus ja/tai kutina, sappikivien muodostuminen, porfyria, systeeminen lupus erythematosus, hemolyyttis-ureeminen oireyhtymä, Sydenhamin korea, raskauspemfigoidi, otoskleroosiin liittyvä kuulonalenema
- eksogeeniset estrogeenit saattavat aiheuttaa tai pahentaa angioedeeman oireita, jos naisella on perinnöllinen angioedeema
- maksan toimintahäiriöt
- glukoosinsiedon muutokset tai vaikutus perifeeriseen insuliiniresistenssiin
- Crohnin tauti, haavainen paksusuolitulehdus
- maksaläiskät.
Yhteisvaikutukset
Ehkäisytablettien ja muiden lääkkeiden (entsyymi-induktorien) väliset yhteisvaikutukset saattavat aiheuttaa läpäisyvuotoja ja/tai ehkäisytehon pettämisen (ks. kohta Yhteisvaikutukset).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteenhyöty-haitta –tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Yliannostuksen ei ole ilmoitettu aiheuttaneen mitään vakavia haittavaikutuksia. Mahdollisia yliannostuksen oireita ovat: pahoinvointi, oksentelu ja verenvuoto emättimestä. Vastalääkettä ei ole, ja hoidon tulee olla oireenmukaista.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: systeemisesti käytettävät hormonaaliset ehkäisyvalmisteet
ATC-koodi: G03AA10
Kun yhdistelmäehkäisytabletteja käytetään oikein, niiden ehkäisytehon pettämisen todennäköisyys on noin 0,3 % vuodessa. Ehkäisytehon pettäminen saattaa olla todennäköisempää silloin, kun tabletteja jää ottamatta tai niitä ei oteta oikein.
Ehkäisytablettien ehkäisyteho perustuu monen eri tekijän yhteisvaikutukseen. Näistä tärkeimpiä ovat ovulaation estyminen ja kohdun limakalvon muutokset. Yhdistelmäehkäisytabletit estävät raskauden alkamisen, mutta niillä on myös muita positiivisia ja negatiivisia (ks. kohta Haittavaikutukset ”Varoitukset”, ”Haittavaikutukset”) ominaisuuksia, joiden perusteella voidaan päättää sopivimmasta ehkäisymenetelmästä. Kuukautiskierto pysyy säännöllisempänä, kuukautiskivut yleensä helpottuvat ja vuoto on niukempaa. Vuodon niukkuus saattaa myös vähentää raudanpuuteanemian esiintyvyyttä.
Farmakokinetiikka
Gestodeeni
Imeytyminen
Suun kautta otettu gestodeeni imeytyy nopeasti ja täydellisesti. Kerta-annoksen ottamisen jälkeen huippupitoisuus seerumissa (4 ng/ml) saavutetaan noin tunnissa. Biologinen hyötyosuus on noin 99 %.
Jakautuminen
Gestodeeni sitoutuu seerumin albumiiniin ja sukupuolihormoneja sitovaan globuliiniin (SHBG). Vain 1–2 % gestodeenin kokonaispitoisuudesta seerumissa on vapaan steroidin muodossa, 50–70 % sitoutuu spesifisesti SHBG:hen. Etinyyliestradiolin aiheuttama SHBG-pitoisuuden nousu vaikuttaa gestodeenin sitoutumiseen seerumin proteiineihin siten, että SHBG:hen sitoutuva fraktio suurenee ja albumiiniin sitoutuva fraktio pienenee. Gestodeenin näennäinen jakautumistilavuus on 0,7 l/kg.
Metabolia
Gestodeeni metaboloituu täydellisesti steroidiaineenvaihdunnan tunnettujen reittien kautta. Metabolinen puhdistuma seerumista on 0,8 ml/min/kg. Gestodeenin ja etinyyliestradiolin samanaikainen käyttö ei johda yhteisvaikutuksiin.
Eliminaatio
Gestodeenin pitoisuus seerumissa vähenee kahdessa vaiheessa. Jälkimmäiselle vaiheelle on tyypillistä 12–15 tunnin puoliintumisaika.
Gestodeeni ei eliminoidu muuttumattomassa muodossa. Sen metaboliitit erittyvät virtsaan ja sappeen suhteessa 6:4.
Metaboliittierityksen puoliintumisaika on noin 1 vrk.
Vakaa tila
Gestodeenin farmakokinetiikkaan vaikuttaa seerumin SHBG-pitoisuus, joka kolminkertaistuu kun samanaikaisesti käytetään etinyyliestradiolia. Päivittäisessä annostelussa seerumin gestodeenipitoisuus noin nelinkertaistuu verrattuna kerta-annoksella saavutettaviin arvoihin, ja vakaa tila saavutetaan hoitosyklin jälkimmäisen puoliskon aikana.
Etinyyliestradioli
Imeytyminen
Suun kautta otettu etinyyliestradioli imeytyy nopeasti ja täydellisesti. Huippupitoisuus seerumissa on noin 80 pg/ml, ja se saavutetaan 1–2 tunnissa. Presysteemisestä konjugaatiosta ja ensikierron metaboliasta johtuen absoluuttinen biologinen hyötyosuus on noin 60 %.
Jakautuminen
Imetyksen aikana 0,02 % äidin vuorokausiannoksesta erittyy rintamaitoon.
Etinyyliestradioli sitoutuu ei-spesifisesti pääasiassa albumiiniin (noin 98,5) ja suurentaa seerumin SHBG-pitoisuutta. Näennäinen jakautumistilavuus on noin 5 l/kg.
Metabolia
Etinyyliestradioli konjugoituu presysteemisesti sekä ohutsuolen limakalvolla että maksassa. Etinyyliestradioli metaboloituu pääasiassa aromaattisen hydroksylaation kautta, mutta tällöin muodostuu erilaisia hydroksyloituneita ja metyloituneita metaboliitteja, ja nämä esiintyvät vapaina metaboliitteina ja glukuronidi- ja sulfaattikonjugaatteina. Metabolinen puhdistuma on noin 5 ml/min/kg.
Eliminaatio
Etinyyliestradiolin pitoisuus seerumissa vähenee kahdessa vaiheessa, ja jälkimmäisessä vaiheessa puoliintumisaika on 24 tuntia. Etinyyliestradioli ei eliminoidu muuttumattomassa muodossa, mutta sen metaboliitit erittyvät virtsaan ja sappeen suhteessa 4:6. Metaboliittierityksen puoliintumisaika on noin 1 vrk.
Vakaa tila
Vakaa tila saavutetaan 3–4 päivässä, ja etinyyliestradiolin pitoisuudet seerumissa ovat 30–40 % suuremmat kuin kerta-annoksen jälkeen.
Prekliiniset tiedot turvallisuudesta
Etinyyliestradioli ja gestodeeni eivät ole genotoksisia. Pelkällä etinyyliestradiolilla tai etinyyliestradiolin ja eri progestiinien yhdistelmillä tehdyt karsinogeenisuustutkimukset eivät ole paljastaneet mitään erityistä karsinogeenisuusriskiä, kunhan valmisetta käytetään ohjeiden mukaisesti raskauden ehkäisyyn. On kuitenkin syytä muistaa, että sukupuolihormonit saattavat edistää tiettyjen hormoniriippuvaisten kudosten ja kasvainten kasvua.
Hedelmällisyyttä, sikiönkehitystä ja lisääntymiskykyä koskevat, pelkällä etinyyliestradiolilla tai etinyyliestradiolin ja eri progestiinien yhdistelmillä tehdyt reproduktiotoksisuustutkimukset eivät ole paljastaneet ihmisiin kohdistuvia haittavaikutuksia, kunhan valmistetta käytetään ohjeiden mukaisesti.
Farmaseuttiset tiedot
Apuaineet
Tabletin ydin:
Magnesiumstearaatti
Povidoni K-25
Maissitärkkelys
Laktoosimonohydraatti
Tabletin päällyste:
Povidoni K-90
Makrogoli 6000
Talkki
Kalsiumkarbonaatti
Sakkaroosi
Montaaniglykolivaha
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta
Säilytys
Säilytä alle 30 °C.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
GESTINYL tabletti, päällystetty
20/75 mikrog (L:kyllä) 3 x 21 fol (18,34 €)
30/75 mikrog (L:kyllä) 3 x 21 fol (19,33 €)
PF-selosteen tieto
Läpipainopakkaus: PVC/alumiini.
Pakkauskoot: 1 x 21 tablettia; 3 x 21 tablettia, 6 x 21 tablettia
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Valkoinen, pyöreä, kaksoiskupera, sokeripäällysteinen tabletti, jossa ei ole merkintöjä kummallakaan puolella.
Käyttö- ja käsittelyohjeet
Ei erityisvaatimuksia.
Korvattavuus
GESTINYL tabletti, päällystetty
20/75 mikrog 3 x 21 fol
30/75 mikrog 3 x 21 fol
- Ei korvausta.
ATC-koodi
G03AA10
Valmisteyhteenvedon muuttamispäivämäärä
07.11.2024
Yhteystiedot
Regus Graniittitalo, Jaakonkatu 3B, 7krs.
00100 Helsinki
Suomi
+358 45 159 2554
info@stragen.fi
