COVERSYL NOVUM tabletti, kalvopäällysteinen 5 mg, 10 mg
Vaikuttavat aineet ja niiden määrät
Perindopriiliarginiini
Yksi kalvopäällysteinen 5 mg tabletti sisältää perindopriilia 3,395 mg, joka vastaa perindopriiliarginiinia 5 mg.
Apuaine, jonka vaikutus tunnetaan: laktoosimonohydraatti 72,58 mg
Yksi kalvopäällysteinen 10 mg tabletti sisältää perindopriilia 6,790 mg, joka vastaa perindopriiliarginiinia 10 mg.
Apuaine, jonka vaikutus tunnetaan: laktoosimonohydraatti 145,16 mg
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Tabletti, kalvopäällysteinen.
Kliiniset tiedot
Käyttöaiheet
Coversyl Novum 5 mg tabletit:
Hypertensio
Hypertension hoito.
Sydämen vajaatoiminta
Oireisen sydämen vajaatoiminnan hoito.
Stabiili sepelvaltimotauti
Sydämen toimintahäiriöiden riskin vähentäminen, kun potilaalla on aiemmin ollut sydäninfarkti ja/tai hänelle on tehty revaskularisaatio.
Coversyl Novum 10 mg tabletit:
Hypertensio
Hypertension hoito.
Stabiili sepelvaltimotauti
Sydämen toimintahäiriöiden riskin vähentäminen, kun potilaalla on aiemmin ollut sydäninfarkti ja/tai hänelle on tehty revaskularisaatio.
Annostus ja antotapa
Annostus
Annos määritellään jokaiselle potilaalle yksilöllisesti ottaen huomioon hoidon vaikutus verenpaineeseen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Hypertensio
Coversyl Novum -valmistetta voidaan käyttää joko yksinään tai yhdistettynä johonkin toiseen verenpainetta alentavaan valmisteeseen (ks. kohdat Vasta-aiheet, Varoitukset, Yhteisvaikutukset ja Farmakodynamiikka).
Suositeltu aloitusannos on 5 mg kerran vuorokaudessa aamulla.
Verenpaine voi laskea voimakkaasti ensimmäisen annoksen jälkeen henkilöillä, joilla reniini-angiotensiini-aldosteronijärjestelmä on erityisen aktiivinen (renovaskulaarinen hypertensio, suola- tai nestevajaus, sydämen vajaatoiminta tai vaikea hypertensio). Näiden henkilöiden hoito tulee aloittaa lääkärin seurannassa, ja suositeltu aloitusannos on 2,5 mg.
Annos voidaan nostaa kuukauden hoidon jälkeen 10 mg:aan kerran vuorokaudessa.
Verenpaineen laskua voi esiintyä Coversyl Novum -hoidon alussa, erityisesti potilailla, jotka saavat samanaikaisesti diureettilääkitystä. Tällaisissa tapauksissa suositellaan erityistä huolellisuutta, koska näillä potilailla voi olla suola- tai nestevajausta.
Diureettilääkitys pitäisi lopettaa 2-3 päivää ennen Coversyl Novum -hoidon aloittamista, mikäli mahdollista (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Hoidettaessa hypertensiopotilaita, joiden diureettilääkitystä ei voida keskeyttää, Coversyl Novum -hoito tulee aloittaa 2,5 mg annoksella ja munuaisten toimintaa ja seerumin kaliumtasoa tulee seurata. Seuraava Coversyl Novum -annos tulee määritellä yksilöllisesti hoidon vasteen mukaan. Tarvittaessa diureettilääkitystä voidaan jatkaa.
Iäkkäämmille potilaille aloitusannos on 2,5 mg. Annosta voidaan nostaa asteittain vastetta ja munuaisfunktiota seuraten kuukauden kuluttua 5 mg:aan ja tarvittaessa 10 mg:aan (katso alla oleva taulukko) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Oireinen sydämen vajaatoiminta (5 mg)
Suositellaan, että Coversyl Novum -hoito aloitetaan lääkärin seurannassa, yleensä yhdistelmähoitona kaliumia säästämättömän diureetin ja/tai digoksiinin ja/tai beetasalpaajan kanssa. Suositeltu aloitusannos on 2,5 mg vuorokaudessa aamuisin. Annosta nostetaan 2 viikon kuluttua 5 mg:aan kerran vuorokaudessa, jos siedettävyys on hyvä. Annoksen nostamisen pitää perustua potilaan yksilölliseen hoitovasteeseen.
Coversyl Novum -hoito tulee aloittaa huolellisessa seurannassa potilailla, joilla on sydämen vajaatoiminta tai jotka kuuluvat riskiryhmään (potilaat, joilla on munuaisten vajaatoiminta ja taipumus elektrolyyttitasapainon häiriöihin tai potilaat, jotka saavat samanaikaisesti diureettilääkitystä ja/tai verisuonia laajentavaa lääkitystä) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Jos potilaalla on alttius oireiseen matalaan verenpaineeseen, esim. jos hänellä on suolavajaus, johon voi liittyä hyponatremia, hypovolemia tai voimakas diureettilääkitys, tulisi nämä hoitaa ennen Coversyl Novum -hoidon aloittamista. Verenpainetta, munuaisten toimintaa ja seerumin kaliumia on seurattava huolellisesti ennen hoitoa ja sen aikana (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Stabiili sepelvaltimotauti
Coversyl Novum -hoito tulisi aloittaa annoksella 5 mg kerran vuorokaudessa kahden viikon ajan. Tämän jälkeen annosta voidaan suurentaa 10 mg:aan kerran vuorokaudessa riippuen munuaisten toiminnasta ja edellyttäen, että 5 mg:n annos on hyvin siedetty.
Iäkkäille potilaille hoito tulisi aloittaa annoksella 2,5 mg kerran vuorokaudessa viikon ajan, jonka jälkeen 5 mg kerran vuorokaudessa seuraavan viikon ajan ennen kuin annos suurennetaan 10 mg:aan kerran vuorokaudessa riippuen munuaisten toiminnasta (katso taulukko 1: Annoksen sovittaminen munuaisten vajaatoiminnassa). Annosta tulisi suurentaa vain, jos aiempi pienempi annos on hyvin siedetty.
Erityisryhmät
Munuaisten vajaatoiminta
Munuaisten vajaatoimintapotilaiden annos tulee säätää kreatiniinipuhdistuman mukaan, kuten alla olevassa taulukossa 1 on määritelty.
Taulukko 1: Annoksen sovittaminen munuaisten vajaatoiminnassa
| Kreatiniinipuhdistuma (ml/min) | Suositeltu annos |
| ClCR≥ 60 | 5 mg vuorokaudessa |
| 30 < ClCR < 60 | 2,5 mg vuorokaudessa |
| 15 < ClCR < 30 | 2,5 mg joka toinen päivä |
| Hemodialyysipotilaat* ClCR < 15 | 2,5 mg dialyysipäivänä |
* Perindoprilaatin dialyysipuhdistuma on 70 ml/min.
Hemodialyysipotilaiden tulee ottaa Coversyl Novum -annos dialyysin jälkeen.
Maksan vajaatoiminta
Annoksen säätäminen ei ole tarpeen maksan vajaatoiminnassa (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Pediatriset potilaat
Perindopriilin turvallisuutta ja tehoa alle 18 vuoden ikäisten lasten ja nuorten hoidossa ei ole varmistettu. Saatavilla olevan tiedon perusteella, joka on kuvattu kohdassa Farmakodynamiikka, ei voida antaa suosituksia annostuksesta.
Tämän vuoksi käyttöä lapsille ja nuorille ei suositella.
Antotapa
Suun kautta.
Coversyl Novum suositellaan otettavaksi kerran päivässä aamuisin ennen aamupalaa.
Vasta-aiheet
- Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille tai muille ACE:n estäjille
- Aikaisempaan ACE:n estäjähoitoon liittynyt angioedeema (turvotus) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
- Perinnöllinen tai idiopaattinen angioedeema
- Raskauden toinen ja kolmas kolmannes (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Raskaus ja imetys)
- Coversyl Novum-valmisteen käyttö samanaikaisesti aliskireeniä sisältävien valmisteiden kanssa, jos potilaalla on diabetes mellitus tai munuaisten vajaatoiminta (glomerulusten suodatusnopeus <60 ml/min/1,73 m2) (ks. kohdat Yhteisvaikutukset ja Farmakodynamiikka)
- Sakubitriilia ja valsartaania sisältävän yhdistelmävalmisteen samanaikainen käyttö. Coversyl Novum -valmisteen käytön saa aloittaa vasta 36 tunnin kuluttua sakubitriilia ja valsartaania sisältävän yhdistelmävalmisteen viimeisen annoksen jälkeen (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset)
- Kehonulkoiset hoidot, jotka johtavat veren kosketukseen negatiivisesti varautuneiden pintojen kanssa (ks. kohta Yhteisvaikutukset)
- Merkittävä ahtauma munuaisvaltimoissa bilateraalisesti tai ainoan toimivan munuaisen valtimoahtauma (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Varoitukset ja käyttöön liittyvät varotoimet
Stabiili sepelvaltimotauti
Jos ensimmäisen kuukauden aikana perindopriililääkityksen aloittamisesta ilmenee epästabiili angina pectoris -kohtaus (vakava tai lievä), hoidon hyödyistä/riskeistä tulisi tehdä huolellinen arvio ennen lääkityksen jatkamista.
Hypotensio
ACE:n estäjät voivat aiheuttaa verenpaineen laskua. Potilailla, joilla on komplisoimaton hypertensio, havaitaan oireista verenpaineen laskua harvoin. Tämä on todennäköisempää potilailla, joilla on diureettilääkityksestä, suolarajoituksesta, dialyysistä, ripulista tai oksentelusta johtuva nestevajaus tai joilla on vakava reniiniriippuvainen hypertensio (ks. kohdat Yhteisvaikutukset ja Haittavaikutukset). Oireista verenpaineen laskua on havaittu potilailla, joilla on sydämen vajaatoiminta ja mahdollisesti siihen liittyvä munuaisten vajaatoiminta. Oireisen verenpaineen laskun esiintyminen on todennäköisempää potilailla, joilla on vakava sydämen vajaatoiminta ja jotka käyttävät suuria annoksia ns. loop-diureetteja ja joilla on hyponatremia tai toiminnallinen munuaisten vajaatoiminta. Coversyl Novum -hoidon aloittamista tulee seurata tarkoin ja annos tulee säätää huolellisesti, jos potilaalla on alttius oireiseen matalaan verenpaineeseen (ks. kohdat Annostus ja antotapa ja Haittavaikutukset). Annos tulee säätää huolellisesti ja hoidon aloittamista tulee seurata tarkoin myös, jos potilaalla on iskeeminen sydän- tai aivoverenkiertosairaus, sillä voimakas verenpaineen lasku voi aiheuttaa sydäninfarktin tai aivoverenkiertohäiriön.
Jos verenpaine laskee liian alas, potilas pitää asettaa selälleen makaamaan. Tarvittaessa tulee antaa natriumkloridi 9 mg/ml (0,9 %) -liuosta laskimoon. Tilapäinen verenpaineen aleneminen ei ole hoidon jatkamisen este, sillä hoitoa voidaan yleensä jatkaa normaalisti, kun verenpaine on noussut nestetilavuuden lisäännyttyä.
Joillakin potilailla, joilla on kongestiivinen sydämen vajaatoiminta ja normaali tai matala verenpaine, Coversyl Novum voi laskea verenpainetta entisestään. Tämä on ennakoitavissa oleva vaikutus, eikä hoidon keskeyttämiseen ole yleensä aihetta. Jos matala verenpaine muuttuu oireiseksi, Coversyl Novum -annosta tulee alentaa tai hoito keskeyttää.
Aortta- ja mitraaliläpän ahtauma / hypertrofinen kardiomyopatia
Coversyl Novum -valmistetta, kuten muitakin ACE:n estäjiä, tulee antaa varoen potilaille, joilla on mitraaliläpän ahtauma ja heikentynyt vasemman kammion ulosvirtaus, esim. aortan ahtauma tai hypertrofinen kardiomyopatia.
Munuaisten vajaatoiminta
Munuaisten vajaatoiminnassa (kreatiniinipuhdistuma < 60 ml/min) perindopriiliannos tulee säätää potilaan kreatiniinipuhdistuman ja saavutetun hoitovasteen mukaan (ks. kohta Annostus ja antotapa). Kaliumtason ja kreatiniinin seuraaminen ovat osa munuaisten vajaatoiminnasta kärsivien potilaiden hoitoa (ks. kohta Haittavaikutukset).
Potilailla, joilla on oireinen sydämen vajaatoiminta, ACE:n estäjähoidon aloittamisesta johtuva matala verenpaine saattaa vielä edelleen huonontaa munuaisten toimintaa. Tällaisissa tapauksissa on raportoitu äkillistä munuaisten vajaatoimintaa, joka on yleensä ollut ohimenevää.
ACE:n estäjähoitoa saaneilla potilailla, joilla on ahtauma molemmissa munuaisvaltimoissa tai joilla on vain toinen munuainen jäljellä ja ahtauma sen munuaisvaltimossa, veren ureapitoisuus ja seerumin kreatiniinitaso voivat nousta. Tilanne palautuu yleensä normaaliksi hoidon lopettamisen jälkeen. Tämä on erittäin todennäköistä potilailla, joilla on munuaisten vajaatoiminta. Jos potilaalla on lisäksi renovaskulaarinen hypertensio, on olemassa vakavan munuaisten vajaatoiminnan riski ja vaara, että verenpaine laskee voimakkaasti. Näissä tapauksissa Coversyl Novum -hoito tulee aloittaa tarkan seurannan alaisena pienillä annoksilla, annoksen säätöön tulee kiinnittää erityistä huomiota. Koska diureettilääkitys voi näissä tapauksissa pahentaa tilannetta, tulee se keskeyttää ja munuaisten toimintaa seurata ensimmäisten viikkojen ajan Coversyl Novum -hoidon aloittamisen jälkeen.
Coversyl Novum -hoito voi lievästi nostaa korkeasta verenpaineesta kärsivien potilaiden veren ureapitoisuutta ja seerumin kreatiniinitasoa, vaikka potilailla ei ole aiempaa munuaisvaltimotautia, varsinkin jos potilaalla on lisäksi diureettilääkitys. Tämä on kuitenkin todennäköisempää, jos potilaalla on aiemmin ollut munuaisten vajaatoimintaa. Näissä tilanteissa Coversyl Novum -annosta tai diureettilääkeannosta tulee alentaa tai hoito keskeyttää, jolloin kohonneet pitoisuudet korjaantuvat.
Hemodialyysipotilaat
Anafylaktoidisia reaktioita on raportoitu ilmenneen ACE:n estäjähoitoa saaneille potilaille, joita on dialysoitu nopeavirtauskalvoilla. Näissä tapauksissa on suositeltavaa käyttää toisenlaista dialyysikalvoa tai toisentyyppistä verenpainelääkettä.
Munuaisensiirto
Coversyl Novum -valmisteen käytöstä potilaille, joille on lähiaikoina tehty munuaisensiirto, ei ole kokemusta.
Renovaskulaarinen hypertensio:
Hypotension ja munuaisten vajaatoiminnan riski on suurentunut, jos ACE:n estäjillä hoidetaan potilaita, joilla on ahtauma munuaisvaltimoissa bilateraalisesti tai ainoan toimivan munuaisen valtimoahtauma (ks. kohta Vasta-aiheet). Diureettilääkitys voi pahentaa tilannetta. Munuaisten vajaatoimintaa, jossa on vain lieviä muutoksia seerumin kreatiniinissa, saattaa ilmetä myös potilailla, joilla on yksipuolinen munuaisvaltimon ahtauma.
Yliherkkyys/angioedeema
ACE:n estäjähoitoa (mukaan lukien Coversyl Novum) saaneilla potilailla on raportoitu harvoin kasvojen, raajojen, huulten, limakalvojen, kielen, äänihuulten ja/tai kurkunpään angioedeemaa (ks. kohta Haittavaikutukset). Tämä voi ilmetä missä vaiheessa hoitoa tahansa. Näissä tapauksissa Coversyl Novum -hoito pitää keskeyttää välittömästi ja potilasta tulee seurata, kunnes oireet ovat kokonaan hävinneet. Niissä tapauksissa, joissa turvotusta on esiintynyt ainoastaan kasvoissa ja huulissa, tilanne on yleensä palautunut normaaliksi ilman hoitoa. Näissäkin tapauksissa antihistamiini kuitenkin helpottaa oireita.
Angioedeema, johon liittyy kurkunpään turpoaminen, voi johtaa kuolemaan. Mikäli kieli, äänihuulet tai kurkunpää turpoavat, ensiaputoimenpiteisiin on ryhdyttävä välittömästi, sillä hengitystiet voivat tukkeutua. Adrenaliinin anto voi olla tarpeen. Hengitystiet on pidettävä avoimina. Potilasta tulee seurata, kunnes oireet ovat hävinneet kokonaan.
Potilailla, jotka ovat aikaisemmin saaneet angioedeemaa jostain muusta syystä kuin ACE:n estäjähoidosta, on suurentunut riski saada sitä myös ACE:n estäjistä (ks. kohta Vasta-aiheet).
Suoliston angioedeemaa on raportoitu esiintyneen harvoin potilailla, joita on hoidettu ACE:n estäjillä. Näillä potilailla esiintyi vatsakipua (pahoinvoinnin tai oksentelun kanssa tai niitä ilman); joissakin tapauksissa tilaa ei edeltänyt kasvojen angioedeema, ja C-1 esteraasipitoisuudet olivat normaaleja. Angioedeema todettiin tutkimusmenetelmillä, kuten vatsa-alueen TT-kuvaus tai ultraäänitutkimus, tai kirurgiassa, ja oireet hävisivät, kun hoito ACE:n estäjällä lopetettiin. Suoliston angioedeema tulisi sisällyttää ACE:n estäjällä hoidetun potilaan vatsakivun erotusdiagnoosiin.
Perindopriilin käyttö yhdistelmänä sakubitriilia ja valsartaania sisältävän yhdistelmävalmisteen kanssa on vasta-aiheista suurentuneen angioedeeman riskin vuoksi (ks. kohta Vasta-aiheet). Hoidon sakubitriilia ja valsartaania sisältävällä yhdistelmävalmisteella saa aloittaa vasta 36 tunnin kuluttua perindopriilihoidon viimeisen annoksen jälkeen. Jos hoito sakubitriilia ja valsartaania sisältävällä yhdistelmävalmisteella lopetetaan, perindopriilihoidon saa aloittaa vasta 36 tunnin kuluttua sakubitriilia ja valsartaania sisältävän yhdistelmävalmisteen viimeisen annoksen jälkeen (ks. kohdat Vasta-aiheet ja Yhteisvaikutukset). ACE:n estäjien samanaikainen käyttö NEP:n estäjien (esim. rasekadotriili), mTOR-kinaasin estäjien (esim. sirolimuusi, everolimuusi, temsirolimuusi) ja gliptiinien (esim. linagliptiini, saksagliptiini, sitagliptiini, vildagliptiini) kanssa voi johtaa tavanomaista suurempaan angioedeeman riskiin (esim. hengitysteiden tai kielen turpoaminen, johon saattaa liittyä hengityksen heikentymistä) (ks. kohta Yhteisvaikutukset). Jos potilas käyttää jo ennestään jotakin ACE:n estäjää, rasekadotriilin, mTOR-kinaasin estäjien (esim. sirolimuusin, everolimuusin, temsirolimuusin) ja gliptiinien (esim. linagliptiinin, saksagliptiinin, sitagliptiinin, vildagliptiinin) käytön aloittamisessa pitää olla varovainen.
Anafylaktoidiset reaktiot LDL-afereesin yhteydessä
Henkeä uhkaavia anafylaktoidisia reaktioita on raportoitu ilmenneen harvoin ACE:n estäjähoitoa saaneille potilaille dekstraanisulfaatin kanssa tehdyn LDL-afereesin aikana. Nämä reaktiot on voitu välttää keskeyttämällä ACE:n estäjähoito ennen jokaista afereesia.
Yliherkkyysreaktiot siedätyshoidon aikana
ACE:n estäjähoitoa saaneilla potilailla on raportoitu ilmenneen yliherkkyysreaktioita siedätyshoidon aikana (esim. pistiäisen myrkky). Yliherkkyysreaktiolta vältyttiin, kun ACE:n estäjähoito keskeytettiin. Reaktiot ilmaantuivat uudelleen tapauksissa, joissa ACE:n estäjähoito aloitettiin vahingossa uudelleen.
Maksan vajaatoiminta
ACE:n estäjät on liitetty harvoin oireyhtymään, joka alkaa kolestaattisella keltaisuudella ja etenee äkilliseen jopa kuolemaan johtavaan maksanekroosiin. Tämän oireyhtymän syytä ei tunneta. Jos ACE:n estäjähoidossa olevalla potilaalla ilmenee keltaisuutta tai maksaentsyymien merkittävää nousua, pitää ACE:n estäjähoito lopettaa ja potilaan tilaa seurata (ks. kohta Haittavaikutukset).
Neutropenia, agranulosytoosi, trombosytopenia, anemia
ACE:n estäjähoitoa saaneilla potilailla on raportoitu ilmenneen neutropeniaa, agranulosytoosia, trombosytopeniaa ja anemiaa. Neutropeniaa esiintyy kuitenkin harvoin potilailla, joilla on normaali munuaisten toiminta eikä muita riskitekijöitä ole. Perindopriilia tulee käyttää varoen, jos potilaalla on yksi tai useampi seuraavista riskitekijöistä varsinkin, jos potilaalla on aikaisemmin ollut munuaisten vajaatoimintaa: kollageeninen verisuonisairaus, immuunivastetta heikentävä hoito tai allopurinoli- tai prokaiiniamidihoito. Joillekin näistä potilaista voi kehittyä vakava infektio, johon voimakaskaan antibioottihoito ei tehoa. Jos perindopriilia käytetään näille potilaille, tulee veren valkosolujen määrää seurata säännöllisesti ja potilaita tulee neuvoa ottamaan yhteyttä lääkäriin, jos merkkejä tulehduksesta (esim. kurkkukipu, kuume) ilmenee.
Rotu
ACE:n estäjät aiheuttavat angioedeemaa muita yleisemmin mustaihoisille potilaille.
Kuten muidenkin ACE:n estäjien, perindopriilin verenpainetta alentava vaikutus voi olla heikompi mustaihoisilla potilailla kuin muihin. Tämä saattaa johtua alhaisen reniinitason yleisyydestä mustaihoisilla hypertensiopotilailla.
Yskä
ACE:n estäjien käytön yhteydessä on raportoitu esiintyneen yskää. Yskä on tyypillisesti kuivaa ja jatkuvaa, ja se häviää hoidon lopettamisen jälkeen. ACE:n estäjien aiheuttaman yskän mahdollisuus on syytä huomioida, mikäli potilaalla esiintyy yskää.
Leikkaus/anestesia
Suurten leikkausten yhteydessä tai verenpainetta alentavan nukutusaineen annon jälkeen Coversyl Novum voi estää kompensoivan reniinin vapautumisen aiheuttamaa angiotensiini II muodostumista. Coversyl Novum -hoito tulee keskeyttää vuorokautta ennen leikkausta. Jos matalaa verenpainetta esiintyy ja sen epäillään johtuvan tästä mekanismista, voidaan tila korjata volyymilisäyksellä.
Hyperkalemia
Joillekin potilaille on tullut seerumin kaliumpitoisuuden nousua ACE:n estäjähoidon aikana, mukaan lukien perindopriilihoito. ACE:n estäjät voivat aiheuttaa hyperkalemiaa, sillä ne estävät aldosteronin vapautumista. Potilailla, joiden munuaisten toiminta on normaali, tällainen vaikutus ei tavallisesti ole merkittävä. Hyperkalemian kehittymisen riskitekijöitä ovat munuaisten vajaatoiminta, heikentyvä munuaisten toiminta, korkea ikä (> 70 vuotta), diabetes mellitus, samanaikaiset tapahtumat, kuten erityisesti nestevajaus, akuutti sydämen dekompensaatio, metabolinen asidoosi, samanaikainen kaliumia säästävien diureettien (esim. spironolaktoni, eplerenoni, triamtereeni tai amiloridi), kaliumlisien tai kaliumia sisältävien suolan korvikkeiden käyttö, tai seerumin kaliumpitoisuuden kohoamiseen liittyvien lääkeaineiden käyttö (esim. hepariini, kotrimoksatsoli, joka tunnetaan myös nimellä trimetopriimi/sulfametoksatsoli) ja etenkin aldosteronin estäjien tai angiotensiinireseptorien salpaajien käyttö. Kaliumlisien, kaliumia säästävien diureettien tai kaliumia sisältävien suolan korvikkeiden käyttö voi johtaa huomattavaan seerumin kaliumpitoisuuden kohoamiseen, erityisesti munuaisten vajaatoimintapotilailla. Hyperkalemia voi aiheuttaa vakavia, joskus jopa kuolemaan johtavia rytmihäiriöitä. Kaliumia säästävien diureettien ja angiotensiinireseptorien salpaajien käytössä ACE:n estäjiä saaville potilaille pitää olla varovainen, ja kaliumin pitoisuutta seerumissa ja munuaisten toimintaa pitää seurata. Mikäli Coversyl Novum-valmisteen ja edellä mainittujen valmisteiden samanaikainen käyttö katsotaan välttämättömäksi, niiden käytössä on oltava varovainen ja seerumin kaliumpitoisuutta pitää seurata tihein väliajoin (ks. kohta Yhteisvaikutukset).
Diabetespotilaat
Oraalisia diabeteslääkkeitä tai insuliinia saavien potilaiden verensokeritasoa tulee seurata tarkoin kuukauden ajan ACE:n estäjähoidon aloittamisen jälkeen (ks. kohta Yhteisvaikutukset).
Litium
Perindopriilin ja litiumin samanaikaista käyttöä ei suositella (ks. kohta Yhteisvaikutukset).
Kaliumia säästävät lääkkeet, kaliumlisät, kaliumia sisältävät suolan korvikkeet
Perindopriilin ja kaliumia säästävien lääkeaineiden, kaliumlisien ja kaliumia sisältävien suolan korvikkeiden samanaikaista käyttöä ei yleisesti ottaen suositella (ks. kohta Yhteisvaikutukset).
Reniini-angiotensiini-aldosteronijärjestelmän (RAA-järjestelmä) kaksoisesto: On olemassa näyttöä siitä, että ACE:n estäjien, angiotensiini II -reseptorin salpaajien tai aliskireenin samanaikainen käyttö lisää hypotension, hyperkalemian ja munuaisten toiminnan heikkenemisen (mukaan lukien akuutin munuaisten vajaatoiminnan) riskiä. Sen vuoksi RAA-järjestelmän kaksoisestoa ACE:n estäjien, angiotensiini II -reseptorin salpaajien tai aliskireenin samanaikaisen käytön avulla ei suositella (ks. kohdat Yhteisvaikutukset ja Farmakodynamiikka).
Jos kaksoisestohoitoa pidetään täysin välttämättömänä, sitä on annettava vain erikoislääkärin valvonnassa ja munuaisten toimintaa, elektrolyyttejä ja verenpainetta on tarkkailtava tiheästi ja huolellisesti.
ACE:n estäjiä ja angiotensiini II-reseptorin salpaajia ei pidä käyttää samanaikaisesti potilaille, joilla on diabeettinen nefropatia.
Primaari aldosteronismi:
Potilaat, joilla on primaari hyperaldosteronismi, eivät yleensä hyödy reniini-angiotensiinialdosteronijärjestelmän kautta vaikuttavasta verenpainelääkityksestä. Tämän vuoksi tämän lääkkeen käyttöä ei suositella.
Raskaus
ACE:n estäjien käyttöä ei pidä aloittaa raskauden aikana. Jos ACE:n estäjiä käyttävä nainen aikoo tulla raskaaksi, hänelle tulee vaihtaa muu, raskauden aikanakin turvallinen verenpainelääkitys, ellei ACE:n estäjien käyttöä pidetä välttämättömänä. Kun raskaus todetaan, ACE:n estäjien käyttö tulee lopettaa heti ja tarvittaessa tulee aloittaa muu lääkitys (ks. kohdat Vasta-aiheet ja Raskaus ja imetys).
Apuaineet
Potilaiden, joilla on harvinainen perinnöllinen galaktoosi-intoleranssi, täydellinen laktaasinpuutos tai glukoosi-galaktoosi-imeytymishäiriö, ei tule käyttää tätä lääkettä.
Natriummäärä
Coversyl Novum sisältää alle 1 mmol natriumia (23 mg) per tabletti eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Kliinisissä tutkimuksissa on havaittu, että reniini-angiotensiini-aldosteronijärjestelmän (RAA-järjestelmä) kaksoisestoon ACE:n estäjien, angiotensiini II -reseptorin salpaajien tai aliskireenin samanaikaisen käytön avulla liittyy haittavaikutusten, esimerkiksi hypotension, hyperkalemian ja munuaisten toiminnan heikkenemisen (mukaan lukien akuutin munuaisten vajaatoiminnan) suurentunut esiintyvyys vain yhden RAA-järjestelmään vaikuttavan aineen käyttöön verrattuna (ks. kohdat Vasta-aiheet, Varoitukset ja Farmakodynamiikka).
Angioedeeman riskiä lisäävät lääkkeet
ACE:n estäjien samanaikainen käyttö sakubitriilia ja valsartaania sisältävän yhdistelmävalmisteen kanssa on vasta-aiheista, koska se lisää angioedeeman riskiä (ks. kohta Vasta-aiheet ja Varoitukset ja käyttöön liittyvät varotoimet). Hoidon sakubitriilia ja valsartaania sisältävällä yhdistelmävalmisteella saa aloittaa vasta 36 tunnin kuluttua perindopriilihoidon viimeisen annoksen jälkeen. Perindopriilihoidon saa aloittaa vasta 36 tunnin kuluttua sakubitriilia ja valsartaania sisältävän yhdistelmävalmisteen viimeisen annoksen jälkeen (ks. kohdat Vasta-aiheet ja Varoitukset ja käyttöön liittyvät varotoimet)
ACE:n estäjien samanaikainen käyttö rasekadotriilin, mTOR-kinaasin estäjien (esim. sirolimuusin, everolimuusin, temsirolimuusin) ja gliptiinien (esim. linagliptiini, saksagliptiini, sitagliptiini, vildagliptiini) kanssa voi aiheuttaa lisääntyneen angioedeeman riskin (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Hyperkalemiaa aiheuttavat lääkkeet
Kaliumpitoisuus seerumissa pysyy tavallisesti normaaliarvoissa, mutta joillakin potilailla voi esiintyä hyperkalemiaa Coversyl Novum-hoidon aikana. Eräät lääkeaineet tai terapeuttiset luokat voivat lisätä hyperkalemian ilmaantumista: aliskireeni, kaliumsuolat, kaliumia säästävät diureetit (esim. spironolaktoni, triamtereeni tai amiloridi), ACE:n estäjät, angiotensiini II -reseptorin salpaajat, ei-steroidaaliset tulehduskipulääkkeet, hepariinit, immunosuppressiiviset lääkkeet, kuten siklosporiini tai takrolimuusi, trimetopriimi ja kotrimoksatsoli (trimetopriimin ja sulfametoksatsolin yhdistelmä), sillä trimetopriimin tiedetään vaikuttavan amiloridin tavoin kaliumia säästävänä diureettina. Näiden lääkkeiden samanaikainen käyttö lisää hyperkalemian vaaraa. Näin ollen Coversyl Novum -valmisteen käyttöä yhdistelmänä edellä mainittujen lääkkeiden kanssa ei suositella. Jos samanaikainen käyttö on aiheellista, näiden käytössä pitää olla varovainen, ja seerumin kaliumpitoisuutta pitää seurata tihein väliajoin.
Samanaikainen käyttö on vasta-aiheista (ks. kohta Vasta-aiheet)
Aliskireeni
Potilailla, joilla on diabetes mellitus tai munuaisten vajaatoiminta, on hyperkalemian, munuaistoiminnan heikkenemisen sekä kardiovaskulaarisen sairastuvuuden ja kuolleisuuden riski lisääntynyt.
Kehonulkoiset hoidot
Kehonulkoiset hoidot, jotka johtavat veren kosketukseen negatiivisesti varautuneiden pintojen kanssa, kuten dialyysi tai hemofiltraatio tiettyjen high-flux -kalvojen kanssa (esim. polyakrylonitriilikalvot) ja LDL-afereesi dekstraanisulfaatin kanssa, koska vaikeiden anafylaktisten reaktioiden riski on lisääntynyt (ks. kohta Vasta-aiheet). Jos tällaisia hoitoja tarvitaan, on harkittava toisentyyppisten dialyysikalvojen käyttöä tai eri lääkeryhmään kuuluvaa verenpainelääkettä.
Samanaikaista käyttöä ei suositella (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
Aliskireeni
Muilla kuin potilailla, joilla on diabetes mellitus tai munuaisten vajaatoiminta, on hyperkalemian, munuaistoiminnan heikkenemisen sekä kardiovaskulaarisen sairastuvuuden ja kuolleisuuden riski lisääntynyt.
Samanaikainen ACE:n estäjän ja angiotensiinireseptorin salpaajan käyttö
Kirjallisuusraporttien mukaan potilailla joilla on todettu ateroskleroottinen sairaus, sydämen vajaatoiminta tai diabetes, johon liittyy pääte-elinten vaurioita, ACE:n estäjän ja angiotensiinireseptorin salpaajan samanaikaiseen käyttöön liittyy suurempi liian matalan verenpaineen, pyörtymisen, hyperkalemian ja munuaistoiminnan heikkenemisen (akuutti munuaisten vajaatoiminta mukaan lukien) riski yhden reniini-angiotensiini-aldosteronijärjestelmään vaikuttavan lääkkeen käyttöön verrattuna. Kaksoissalpaus (esimerkiksi yhdistämällä ACE:n estäjä ja angiotensiini II -reseptorin salpaaja) on rajattava yksilöllisesti määritettyihin tapauksiin, ja munuaistoimintaa, kaliumpitoisuuksia ja verenpainetta on seurattava tarkkaan.
Estramustiini
Lisääntyneiden haittavaikutusten, kuten angioneuroottisen edeeman, riski.
Kaliumia säästävät diureetit (esim. triamtereeni, amiloridi), kalium (kaliumsuolat)
Hyperkalemia (mahdollisesti kuolemaan johtava), erityisesti munuaisten vajaatoiminnan yhteydessä (additiiviset hyperkaleemiset vaikutukset).
Näiden käyttöä samanaikaisesti perindopriilin kanssa ei suositella (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Jos näitä kuitenkin käytetään samanaikaisesti, tulee varovaisuutta noudattaa ja seerumin kaliumpitoisuutta seurata säännöllisesti. Spironolaktonin käyttö sydämen vajaatoiminnassa, ks. alla.
Litium
ACE:n estäjien ja litiumin samanaikaisen käytön seurauksena on raportoitu reversiibeliä seerumin litiumtason nousua ja litiummyrkytystä. Perindopriilin ja litiumin samanaikaista käyttöä ei suositella, mutta mikäli yhdistelmä katsotaan välttämättömäksi, tulee seerumin litiumtasoa seurata huolellisesti (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Erityistä varovaisuutta edellyttävä samanaikainen käyttö
Diabeteslääkkeet (insuliinit, suun kautta otettavat diabeteslääkkeet)
Epidemiologisten tutkimusten tulokset viittaavat siihen, että ACE:n estäjän ja diabeteslääkkeiden (insuliinin, suun kautta otettavien diabeteslääkkeiden) samanaikainen käyttö voi lisätä verensokeria alentavaa vaikutusta, johon liittyy hypoglykemian riski. Tämä ilmiö vaikuttaa olevan todennäköisempi yhdistelmähoidon ensimmäisten viikkojen aikana sekä munuaisten vajaatoimintaa sairastavilla potilailla.
Baklofeeni
Verenpainetta alentavan vaikutuksen lisääntyminen. Verenpainetta on tarkkailtava ja verenpainelääkkeen annostusta muutettava tarvittaessa.
Kaliumia säästämättömät diureetit
Diureettilääkitystä saavien potilaiden verenpaine voi laskea liikaa ACE:n estäjähoidon aloituksen jälkeen, erityisesti jos potilaalla on neste- ja/tai suolavajaus. Matalan verenpaineen todennäköisyyttä voidaan vähentää keskeyttämällä diureettilääkitys ja lisäämällä nesteen tai suolan saantia ennen perindopriilihoidon aloittamista pienillä ja hitaasti suurenevilla annoksilla.
Arteriaalisessa hypertensiossa, jossa aiempi diureettihoito on saattanut aiheuttaa neste- ja/tai suolavajausta, diureettihoito on lopetettava ennen ACE:n estäjän aloitusta, minkä jälkeen kaliumia säästämättömän diureetin käyttö voidaan aloittaa uudelleen. Vaihtoehtoisesti ACE:n estäjähoito on aloitettava pienillä ja hitaasti suurenevilla annoksilla.
Kongestiivisessa sydämen vajaatoiminnassa, jota hoidetaan diureeteilla, ACE:n estäjä on aloitettava erittäin pienellä annoksella, mahdollisesti kaliumia säästämättömän diureetin annostuksen pienentämisen jälkeen.
Munuaistoimintaa (kreatiniinitasoja) on aina seurattava ACE:n estäjähoidon ensimmäisten viikkojen aikana.
Kaliumia säästävät diureetit (eplerenoni, spironolaktoni)
Kun eplerenonin tai spironolaktonin vuorokausiannos on 12,5–50 mg ja samanaikaisesti käytetään pieniannoksista ACE:n estäjää: NYHA II–IV -luokan sydämen vajaatoimintaa sairastavilla potilailla, joiden ejektiofraktio on < 40 %, ja jotka ovat aiemmin saaneet ACE:n estäjiä ja loop-diureetteja, on mahdollisesti kuolemaan johtavan hyperkalemian riski lisääntynyt, erityisesti poikettaessa näiden lääkkeiden yhteiskäyttöä koskevista suosituksista.
Ennen yhdistelmähoidon aloittamista on varmistettava, ettei potilaalla ole hyperkalemiaa tai munuaisten vajaatoimintaa.
Veren kalium- ja kreatiniinipitoisuutta on seurattava tarkkaan hoidon alkuvaiheissa. Hoidon ensimmäisen kuukauden aikana suositellaan seurantaa viikoittain ja sen jälkeen kuukausittain.
Tulehduskipulääkkeet (NSAID), mukaan lukien asetyylisalisyylihappoa ≥ 3 g/vrk
ACE:n estäjien ja tulehduskipulääkkeiden (esim. asetyylisalisyylihappo tulehdusta hillitsevinä annoksina, COX-2:n estäjät ja epäselektiiviset tulehduskipulääkkeet) samanaikainen käyttö voi heikentää ACE:n estäjien verenpainetta alentavaa vaikutusta. ACE:n estäjien ja tulehduskipulääkkeiden yhteiskäyttö voi suurentaa munuaisten vajaatoiminnan ja jopa äkillisen munuaisten vajaatoiminnan riskiä ja lisätä seerumin kaliumpitoisuutta, erityisesti jos potilaalla on munuaisten vajaatoimintaa. Tätä lääkeaineyhdistelmää tulee käyttää varoen erityisesti iäkkäille potilaille. Potilaiden nesteytyksestä tulee huolehtia ja munuaisten toimintaa tulee seurata harkinnan mukaan yhteiskäytön alussa ja jaksoittain jatkossakin.
Varovaisuutta edellyttävä samanaikainen käyttö
Verenpainetta laskevat ja verisuonia laajentavat lääkkeet
Näiden lääkkeiden samanaikainen käyttö perindopriilin kanssa voi lisätä perindopriilin verenpainetta alentavaa vaikutusta. Samanaikainen nitroglyseriinin, muiden nitraattien tai muiden verisuonia laajentavien valmisteiden käyttö voi alentaa verenpainetta edelleen.
Trisykliset antidepressantit, antipsykoottiset aineet, anestesia-aineet
Tiettyjen anestesia-aineiden, trisyklisten antidepressanttien ja antipsykoottisten aineiden samanaikainen käyttö ACE:n estäjien kanssa voi alentaa verenpainetta edelleen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Sympatomimeetit
Sympatomimeetit voivat heikentää ACE:n estäjien verenpainetta alentavaa vaikutusta.
Kulta
Nitritoidisia reaktioita (oireita ovat kasvojen punoitus, pahoinvointi, oksentelu ja matala verenpaine) on raportoitu esiintyneen harvoin potilailla, jotka saavat hoitoa kultainjektioilla (natriumaurotiomalaatti) ja samanaikaisesti ACE:n estäjähoitoa, mukaan lukien perindopriilia.
Raskaus ja imetys
Raskaus
ACE:n estäjien käyttöä ensimmäisen raskauskolmanneksen aikana ei suositella (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). ACE:n estäjien käyttö toisen ja kolmannen raskauskolmanneksen aikana on vasta-aiheista (ks. kohdat Vasta-aiheet ja Varoitukset ja käyttöön liittyvät varotoimet). |
Epidemiologisten tutkimusten tulokset viittaavat siihen, että altistuminen ACE:n estäjille ensimmäisen raskauskolmanneksen aikana lisää sikiön epämuodostumisen riskiä. Tulokset eivät kuitenkaan ole vakuuttavia, mutta pientä riskin suurenemista ei voida sulkea pois. Jos ACE:n estäjiä käyttävä nainen aikoo tulla raskaaksi, hänelle tulee vaihtaa muu, raskauden aikana turvallinen verenpainelääkitys, ellei ACE:n estäjien käyttöä pidetä välttämättömänä. Kun raskaus todetaan, ACE:n estäjien käyttö tulee lopettaa heti, ja tarvittaessa tulee aloittaa muu lääkitys.
Tiedetään, että altistus ACE:n estäjille toisen ja kolmannen raskauskolmanneksen aikana on haitallista sikiön kehitykselle (munuaisten toiminta heikkenee, lapsiveden määrä pienenee, kallon luutuminen hidastuu) ja vastasyntyneen kehitykselle (munuaisten toiminta voi pettää ja voi ilmetä matalaa verenpainetta ja hyperkalemiaa) (ks. kohta Prekliiniset tiedot turvallisuudesta).
Jos sikiö on raskauden toisen ja kolmannen kolmanneksen aikana altistunut ACE:n estäjille, suositellaan sikiölle tehtäväksi munuaisten toiminnan ja kallon ultraäänitutkimus.
Imeväisikäisiä, joiden äiti on käyttänyt ACE:n estäjiä, tulisi seurata huolellisesti matalan verenpaineen varalta (ks. kohdat Vasta-aiheet ja Varoitukset ja käyttöön liittyvät varotoimet).
Imetys
Koska tietoa Coversyl Novum –valmisteen käytöstä imetyksen aikana ei ole, sen käyttöä ei suositella ja vaihtoehtoista imetyksenkin aikana turvallista verenpainelääkitystä tulee suosia etenkin jos imetetään vastasyntynyttä tai keskosta.
Hedelmällisyys
Vaikutusta lisääntymiseen tai hedelmällisyyteen ei ollut.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Coversyl Novum -valmiste ei heikennä ajokykyä tai kykyä käyttää koneita. Joillakin potilailla voi kuitenkin esiintyä yksittäisiä matalaan verenpaineeseen liittyviä oireita, erityisesti hoidon alussa tai jos samanaikaisesti käytetään toista verenpainetta alentavaa lääkettä.
Tämän seurauksena ajokyky tai kyky käyttää koneita voi olla heikentynyt.
Haittavaikutukset
a. Turvallisuusprofiilin yhteenveto
Perindopriilin turvallisuusprofiili on yhdenmukainen ACE:n estäjien turvallisuusprofiilin kanssa:
Yleisimmät kliinisissä tutkimuksissa raportoidut ja perindopriilin käytön yhteydessä havaitut haittavaikutukset ovat heitehuimaus, päänsärky, tuntoharha, kiertohuimaus, näköhäiriöt, korvien soiminen, liian matala verenpaine, yskä, hengenahdistus, vatsakipu, ummetus, ripuli, makuhäiriö, ruoansulatushäiriö, pahoinvointi, oksentelu, kutina, ihottuma, lihaskouristukset ja voimattomuus.
b. Taulukkomuotoinen luettelo haittavaikutuksista
Seuraavanlaisia haittavaikutuksia on havaittu perindopriililla tehdyissä kliinisissä tutkimuksissa ja/tai markkinoille tulon jälkeisessä käytössä. Haittavaikutukset on luokiteltu esiintymistiheyden mukaisesti seuraavasti:
Hyvin yleinen (≥ 1/10); yleinen (≥ 1/100, < 1/10); melko harvinainen (≥ 1/1000, < 1/100); harvinainen (≥ 1/10000, < 1/1000); hyvin harvinainen (< 1/10000); tuntematon (koska saatavissa oleva tieto ei riitä arviointiin).
| MedDRA-elinjärjestelmä | Haittavaikutus | Yleisyys | ||
| Veri ja imukudos | Eosinofilia | Melko harvinainen* | ||
| Agranulosytoosi tai pansytopenia | Hyvin harvinainen | |||
| Hemoglobiinipitoisuuden ja hematokriitin pieneneminen | Hyvin harvinainen | |||
| Leukopenia/neutropenia | Hyvin harvinainen | |||
| Hemolyyttinen anemia potilailla, joilla on synnynnäinen G-6PDH-puutos (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) | Hyvin harvinainen | |||
| Trombosytopenia | Hyvin harvinainen | |||
| Umpieritys | Antidiureettisen hormonin epäasianmukaisen erityksen oireyhtymä (SIADH) | Harvinainen | ||
| Aineenvaihdunta ja ravitsemus | Hypoglykemia (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset) | Melko harvinainen* | ||
| Hyperkalemia, joka korjaantuu, kun lääke lopetetaan (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) | Melko harvinainen* | |||
| Hyponatremia | Melko harvinainen* | |||
| Psyykkiset häiriöt | Masennus | Melko harvinainen* | ||
| Mielialahäiriöt | Melko harvinainen | |||
| Unihäiriöt | Melko harvinainen | |||
| Hermosto | Heitehuimaus | Yleinen | ||
| Päänsärky | Yleinen | |||
| Tuntoharha | Yleinen | |||
| Kiertohuimaus | Yleinen | |||
| Uneliaisuus | Melko harvinainen* | |||
| Pyörtyminen | Melko harvinainen* | |||
| Sekavuus | Hyvin harvinainen | |||
| Silmät | Näköhäiriö | Yleinen | ||
| Kuulo ja tasapainoelin | Korvien soiminen (Tinnitus) | Yleinen | ||
| Sydän | Sydämentykytys | Melko harvinainen* | ||
| Takykardia | Melko harvinainen* | |||
| Angina pectoris (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) | Hyvin harvinainen | |||
| Rytmihäiriö | Hyvin harvinainen | |||
| Sydäninfarkti riskiryhmään kuuluvilla potilailla, mahdollisesti erittäin matalan verenpaineen vuoksi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) | Hyvin harvinainen | |||
| Verisuonisto | Liian matala verenpaine (ja siihen liittyvät vaikutukset) | Yleinen | ||
| Vaskuliitti | Melko harvinainen* | |||
| Punastuminen | Harvinainen* | |||
| Aivohalvaus riskiryhmään kuuluvilla potilailla mahdollisesti erittäin matalan verenpaineen vuoksi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) | Hyvin harvinainen | |||
| Raynaud´n oireyhtymä | Tuntematon | |||
| Hengityselimet, rintakehä ja välikarsina | Yskä | Yleinen | ||
| Hengenahdistus | Yleinen | |||
| Bronkospasmi | Melko harvinainen | |||
| Eosinofiilinen keuhkokuume | Hyvin harvinainen | |||
| Nuha | Hyvin harvinainen | |||
| Ruoansulatuselimistö | Vatsakipu | Yleinen | ||
| Ummetus | Yleinen | |||
| Ripuli | Yleinen | |||
| Makuhäiriö | Yleinen | |||
| Ruoansulatushäiriö | Yleinen | |||
| Pahoinvointi | Yleinen | |||
| Oksentelu | Yleinen | |||
| Suun kuivuminen | Melko harvinainen | |||
| Haimatulehdus | Hyvin harvinainen | |||
| Maksa ja sappi | Sytolyyttinen tai kolestaattinen maksatulehdus (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) | Hyvin harvinainen | ||
Iho ja ihonalainen kudos
| Kutina | Yleinen | ||
| Ihottuma | Yleinen | |||
| Nokkosihottuma (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) | Melko harvinainen | |||
| Kasvojen, raajojen, huulien, limakalvojen, kielen, äänielimen ja/tai kurkunpään turpoaminen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) | Melko harvinainen | |||
| Valoyliherkkyysreaktiot | Melko harvinainen* | |||
| Pemfigoidi | Melko harvinainen* | |||
| Liikahikoilu | Melko harvinainen | |||
| Psoriaasin paheneminen | Harvinainen* | |||
| Erythema multiforme | Hyvin harvinainen | |||
| Luusto, lihakset ja sidekudos | Lihaskouristukset | Yleinen | ||
| Nivelkipu | Melko harvinainen* | |||
| Lihaskipu | Melko harvinainen* | |||
| Munuaiset ja virtsatiet | Munuaisten vajaatoiminta | Melko harvinainen | ||
| Akuutti munuaisten vajaatoiminta | Harvinainen | |||
| Anuria/oliguria | Harvinainen* | |||
| Sukupuolielimet ja rinnat | Erektiohäiriö | Melko harvinainen | ||
| Yleisoireet ja antopaikassa todettavat haitat | Voimattomuus | Yleinen | ||
| Rintakipu | Melko harvinainen* | |||
| Huonovointisuus | Melko harvinainen* | |||
| Perifeerinen turvotus | Melko harvinainen* | |||
| Kuume | Melko harvinainen* | |||
| Tutkimukset | Veren ureapitoisuuden nousu | Melko harvinainen* | ||
| Veren kreatiniinipitoisuuden nousu | Melko harvinainen* | |||
| Veren bilirubiinipitoisuuden nousu | Harvinainen | |||
| Maksaentsyymipitoisuuksien nousu | Harvinainen | |||
| Vammat ja myrkytykset | Kaatuminen | Melko harvinainen* | ||
*Yleisyys on laskettu kliinisissä tutkimuksissa havaittujen spontaanisti raportoitujen haittavaikutusten perusteella
Kliiniset tutkimukset:
EUROPA-tutkimuksen satunnaistetun jakson aikana kerättiin tiedot vain vakavista haittavaikutuksista. Vakavia haittavaikutuksia ilmeni potilailla harvoin: 16 (0,3 %) potilaalla 6122 perindopriilihoitoa saaneesta potilaasta ja 12 (0,2 %) potilaalla 6107 lumelääkettä saaneesta potilaasta. Perindopriililla hoidetuista potilaista kuudella havaittiin liiallista verenpaineen laskua, kolmella angioedeemaa ja yhdellä äkillinen sydämenpysähdys. Tutkimuksen keskeytti yskän, liiallisen verenpaineen laskun tai muun perindopriiliyliherkkyyden takia suurempi osa perindopriilihoitoon satunnaistetuista potilaista (6,0 %, n = 366) verrattuna lumehoitoon satunnaistettuihin potilaisiin (2,1 %, n = 129).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haitta –tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Yliannostuksesta ihmisille on vain niukasti tietoa. ACE:n estäjien yliannostukseen liittyviä oireita voivat olla matala verenpaine, verenkiertosokki, elektrolyyttitasapainon häiriöt, munuaisten vajaatoiminta, hyperventilaatio, sydämen tiheälyöntisyys, palpitaatio, sydämen harvalyöntisyys, huimaus, levottomuus ja yskä.
Yliannostuksen hoidoksi suositellaan natriumkloridi 9 mg/ml (0,9 %) -liuoksen antoa laskimoon. Mikäli potilaan verenpaine laskee, tulee hänet asettaa sokkiasentoon. Angiotensiini II-infuusiota ja/tai katekoliamiinien antoa laskimoon voidaan myös harkita, jos niitä on saatavilla. Perindopriili voidaan poistaa verenkierrosta hemodialyysillä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Sydämentahdistusta voidaan käyttää hoitoon reagoimattoman sydämen harvalyöntisyyden hoitoon. Elintoimintoja ja seerumin elektrolyytti- ja kreatiniinitasoa tulee seurata jatkuvasti.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: ACE:n estäjät, ATC-koodi: C09AA04.
Vaikutusmekanismi
Perindopriili on angiotensiiniä konvertoivan entsyymin (ACE) estäjä, joka muuttaa angiotensiini I:tä verisuonia supistavaksi aineeksi, angiotensiini II:ksi. Konvertaasientsyymi eli kinaasi on eksopeptidaasi, joka mahdollistaa angiotensiini I:n muuntumisen verisuonia supistavaksi angiotensiini II:ksi sekä verisuonia laajentavan bradykiniinin hajoamisen inaktiiviseksi heptapeptidiksi. ACE:n eston vaikutuksesta plasman angiotensiini II-pitoisuus laskee, mistä seuraa plasman lisääntynyt reniiniaktiivisuus (negatiivinen vaikutus reniinin vapautumiseen estyy) ja aldosteronin erityksen väheneminen. Koska ACE inaktivoi bradykiniiniä, ACE:n esto johtaa myös verenkierrossa olevan ja paikallisen kallikreiini-kiniinijärjestelmän aktiivisuuden lisääntymiseen (ja siten myös prostaglandiinijärjestelmän aktivoitumiseen). On mahdollista, että ACE:n estäjien vaikutus perustuu osaksi tähän mekanismiin ja siitä johtuu myös osittain ACE:n estäjien tietyt haittavaikutukset (esim. yskä).
Perindopriilin vaikutukset perustuvat sen aktiiviseen metaboliittiin, perindoprilaattiin. Muilla metaboliiteilla ei ole ACE:n estovaikutusta in vitro.
Kliininen teho ja turvallisuus
Hypertensio
Perindopriili on tehokas kaikenasteisen korkean verenpaineen hoitoon: lievän, kohtalaisen ja vaikean hypertension hoitoon. Sekä systolinen että diastolinen verenpaineen aleneminen on havaittavissa sekä makuuasennossa että seisoma-asennossa.
Perindopriili vähentää ääreisverenkierron vastusta ja alentaa näin verenpainetta. Perifeerinen veren virtaus lisääntyy vaikuttamatta sydämen syketaajuuteen.
Munuaisten verenkierto tavallisesti lisääntyy, kun taas glomerulusfiltraatio (GFR) pysyy yleensä muuttumattomana.
Verenpainetta alentava vaikutus on voimakkaimmillaan 4-6 tuntia yksittäisen annoksen jälkeen ja kestää vähintään 24 tuntia. Jäännösvaikutus ennen seuraavaa vuorokausiannosta on noin 87-100 % maksimivaikutuksesta.
Verenpaine alenee nopeasti. Hoitoon reagoiville potilaille normaali verenpaine saadaan kuukaudessa hoidon aloittamisesta eikä lääkkeen teho heikkene jatkuvassa käytössä.
Lääkehoidon keskeyttäminen ei johda kimmovaste- eli rebound-ilmiöön.
Perindopriili vähentää sydämen vasemman kammion liikakasvua.
Perindopriililla on todettu verisuonia laajentava vaikutus ihmiseen. Se lisää isojen valtimoiden elastisuutta ja alentaa media:lumen -suhdetta pienissä valtimoissa.
Tiatsididiureetin liittämisellä ACE:n estäjähoitoon on synergistinen vaikutus. Tämä yhdistelmä vähentää myös diureettilääkityksen aiheuttamaa hypokalemian riskiä.
Sydämen vajaatoiminta (5mg)
Perindopriili vähentää sydämen työmäärää pienentämällä esi- ja jälkikuormitusta.
Tutkimukset sydämen vajaatoiminnasta kärsivillä potilailla ovat osoittaneet, että
- vasemman ja oikean kammion täyttöpaine pienenee
- ääreisverenkierron vastus alenee
- sydämen minuuttitilavuus ja sydänindeksi lisääntyvät.
Vertailevissa tutkimuksissa on havaittu, että 2,5 mg:n perindopriiliarginiiniannos ei alentanut verenpainetta sen enempää kuin lumelääke, kun potilaalla oli lievä tai kohtalainen verenpaine.
Stabiilia sepelvaltimotautia sairastavat potilaat
EUROPA-tutkimus oli neljän vuoden mittainen, kansainvälinen, satunnaistettu, kaksoissokkoutettu, lumelääkekontrolloitu, kliininen monikeskustutkimus.
Kaksitoistatuhattakaksisataakahdeksantoista (12218) iältään yli 18-vuotiasta potilasta satunnaistettiin siten, että he saivat joko 8 mg perindopriili-tert-butyyliamiinia (joka vastaa 10 mg perindopriiliarginiinia) (n = 6110) tai lumelääkettä (n = 6108).
Tutkimukseen osallistuneilla potilailla oli näyttöä sepelvaltimotaudista, mutta ei kuitenkaan näyttöä sydämen vajaatoiminnan kliinisistä merkeistä. Potilaista kaikkiaan 90 %:lla oli aiemmin ollut sydäninfarkti ja/tai esiintynyt sepelvaltimon revaskularisaatiota. Suurin osa potilaista sai tutkimuslääkkeen lisäksi tavanomaista hoitoa kuten trombosyyttejä estävää lääkitystä, lipidejä alentavia lääkeaineita ja beetasalpaajia.
Tehoa osoittava pääkriteeri oli seuraavien tekijöiden yhteenlaskettu esiintyvyys: kuolleisuus sydän- ja verisuonitauteihin, ei-fataali sydäninfarkti ja/tai sydämenpysähdys, jonka jälkeen potilas pystyttiin elvyttämään. Hoito annoksella 8 mg perindopriili-tert-butyyliamiinia (joka vastaa 10 mg perindopriiliarginiinia) kerran vuorokaudessa sai aikaan primaarivasteen absoluuttisen pienenemisen 1,9 %:lla (suhteellisen riskin pieneneminen 20 %:lla, luotettavuusväli 95 % [9,4; 28,6] - p < 0,001).
Potilailla, joilla oli aiemmin ollut sydäninfarkti ja/tai joille on tehty revaskularisaatio, ensisijaisen päätetapahtuman absoluuttinen riski pieneni 2,2 %:lla, joka vastaa suhteellisen riskin pienenemistä 22,4 %:lla (luotettavuusväli 95 % [12,0; 31,6] - p < 0,001) verrattuna lumelääkeryhmään.
Pediatriset potilaat
Perindopriilin turvallisuutta ja tehoa alle 18 vuoden ikäisten lasten ja nuorten hoidossa ei ole varmistettu.
Avoimessa ei-vertailevassa kliinisessä tutkimuksessa, joka tehtiin 62:lle iältään 2–15-vuotiaalle lapselle, joilla oli korkea verenpaine ja joiden glomerulusfiltraatio oli > 30 ml/min/1,73 m2, potilaille annettu keskimääräinen perindopriiliannos oli 0,07 mg/kg. Annos sovitettiin yksilöllisesti potilastietojen ja verenpainevasteen mukaan siten, että enimmäisannos oli 0,135 mg/kg/vrk.
59 potilasta oli mukana tutkimuksessa kolmen kuukauden mittaisen tutkimusjakson loppuun saakka, ja 36 potilasta oli mukana tutkimuksen jatko-osan loppuun saakka eli heitä seurattiin vähintään 24 kuukauden ajan (keskimääräinen tutkimuksen kesto: 44 kuukautta).
Systolinen ja diastolinen verenpaine pysyivät vakaina tutkimukseen ottamisesta aina viimeiseen mittaukseen asti potilailla, jotka olivat aiemmin saaneet muuta verenpainelääkitystä, ja alenivat aiemmin hoitamattomilla potilailla.
Yli 75 %:lla lapsista systolinen ja diastolinen verenpaine olivat 95. prosenttipisteen alapuolella viimeisellä mittauskerralla.
Turvallisuus oli perindopriilin tunnetun turvallisuusprofiilin mukainen.
Reniini-angiotensiini-aldosteronijärjestelmän (RAA-järjestelmä) kaksoisestoa koskevat kliinisistä tutkimuksista saadut tiedot:
Kahdessa suuressa satunnaistetussa, kontrolloidussa tutkimuksessa (ONTARGET [ONgoing Telmisartan Alone and in combination with Ramipril Global Endpoint Trial] ja VA NEPHRON-D [The Veterans Affairs Nephropathy in Diabetes]) tutkittiin ACE:n estäjän ja angiotensiini II -reseptorin salpaajan samanaikaista käyttöä.
ONTARGET-tutkimuksessa potilailla oli aiemmin ollut kardiovaskulaarisia tai serebrovaskulaarisia sairauksia tai tyypin 2 diabetes sekä esiintyi merkkejä kohde-elinvauriosta. VA NEPHRON-D -tutkimuksessa potilailla oli tyypin 2 diabetes ja diabeettinen nefropatia.
Nämä tutkimukset eivät osoittaneet merkittävää suotuisaa vaikutusta renaalisiin tai kardiovaskulaarisiin lopputapahtumiin ja kuolleisuuteen, mutta hyperkalemian, akuutin munuaisvaurion ja/tai hypotension riskin havaittiin kasvavan verrattuna monoterapiaan.
Nämä tulokset soveltuvat myös muihin ACE:n estäjiin ja angiotensiini II -reseptorin salpaajiin, ottaen huomioon niiden samankaltaiset farmakodynaamiset ominaisuudet.
Sen vuoksi potilaiden, joilla on diabeettinen nefropatia, ei pidä käyttää ACE:n estäjiä ja angiotensiini II -reseptorin salpaajia samanaikaisesti.
ALTITUDE (Aliskiren Trial in Type 2 Diabetes Using Cardiovascular and Renal Disease Endpoints,) -tutkimuksessa testattiin saavutettavaa hyötyä aliskireenin lisäämisestä vakiohoitoon, jossa käytetään ACE:n estäjää tai angiotensiini II -reseptorin salpaajaa potilaille, joilla on sekä tyypin 2 diabetes että krooninen munuaissairaus, kardiovaskulaarinen sairaus, tai molemmat. Tutkimus päätettiin aikaisin haittavaikutusten lisääntyneen riskin vuoksi. Kardiovaskulaariset kuolemat ja aivohalvaukset olivat lukumääräisesti yleisempiä aliskireeniryhmässä kuin lumelääkeryhmässä ja haittavaikutuksia sekä vakavia haittavaikutuksia (hyperkalemia, hypotensio ja munuaisten vajaatoiminta) raportoitiin useammin aliskireeniryhmässä kuin lumelääkeryhmässä.
Farmakokinetiikka
Imeytyminen
Nielty perindopriili imeytyy nopeasti ja maksimipitoisuus plasmassa saavutetaan tunnin kuluttua lääkkeen ottamisesta. Perindopriilin puoliintumisaika plasmassa on 1 tunti.
Perindopriili on aihiolääke. Noin 27 % imeytyneestä perindopriiliannoksesta siirtyy verenkiertoon muuntuneena aktiiviseksi metaboliitiksi, perindoprilaatiksi. Perindoprilaatin lisäksi perindopriililla on 5 inaktiivista metaboliittia. Perindoprilaatin maksimipitoisuus plasmassa saavutetaan 3-4 tunnin kuluessa.
Koska ruoka vähentää perindoprilaatin muodostumista ja siten biologista hyväksikäytettävyyttä, perindopriiliarginiinitabletit tulisi ottaa kerran vuorokaudessa aamulla ennen aamupalaa.
Perindopriiliannoksen ja plasmassa saavutettavan pitoisuuden välillä on havaittu olevan lineaarinen suhde.
Jakautuminen
Vapaan perindoprilaatin jakaantumistilavuus on noin 0,2 l/kg. Perindopriilista sitoutuu 20 % plasman proteiineihin, pääasiassa angiotensiinikonvertaasientsyymiin. Sitoutuminen riippuu pitoisuudesta.
Eliminaatio
Perindoprilaatti poistuu elimistöstä virtsan mukana ja sitoutumattoman osan puoliintumisaika on noin 17 tuntia. Steady-state –tila saavutetaan 4 vuorokauden kuluessa.
Erityisryhmät
Perindoprilaatin eliminaatio on tavallista hitaampaa, jos lääkettä käyttää vanhus tai henkilö, jolla on sydämen tai munuaisten vajaatoiminta. Munuaisten vajaatoimintaa sairastavien potilaiden annos tulee säätää vajaatoiminnan asteen mukaan (kreatiniinipuhdistuma).
Perindoprilaatin dialyysipuhdistuma on 70 ml/min.
Maksakirroosi vaikuttaa perindopriilin kinetiikkaan: perindopriilin maksapuhdistuma on vähentynyt puoleen. Perindoprilaatin muodostuminen ei kuitenkaan vähene ja sen vuoksi annosta ei tarvitse muuttaa (ks. kohta Annostus ja antotapa ja kohta Varoitukset ja käyttöön liittyvät varotoimet).
Prekliiniset tiedot turvallisuudesta
Toistuvan altistuksen (suun kautta) toksisuutta koskevissa tutkimuksissa (rotta ja apina) haitat kohdistuivat munuaisiin, mutta vauriot olivat korjaantuvia.
Mutageenisia ominaisuuksia ei ole havaittu in vitro tai in vivo -tutkimuksissa.
Reproduktiotoksisuustutkimuksissa (rotat, hiiret, kanit ja apinat) ei havaittu merkkejä alkiotoksisuudesta tai teratogeenisuudesta. Angiotensiiniä konvertoivan entsyymin estäjillä on kuitenkin havaittu olevan haitallisia vaikutuksia sikiön kehitykseen raskauden loppuvaiheessa. Vaikutukset johtavat sikiökuolemaan ja synnynnäisiin vikoihin jyrsijöillä ja kaneilla: munuaisvaurioita ja syntymänaikaista ja -jälkeistä kuolleisuutta on havaittu. Uros- ja naarasrottien hedelmällisyys ei heikentynyt.
Karsinogeenisuutta ei ole havaittu pitkäaikaisissa tutkimuksissa rotilla ja hiirillä.
Farmaseuttiset tiedot
Apuaineet
Ydin
Laktoosimonohydraatti,
Magnesiumstearaatti,
Maltodekstriini,
Piidioksidi, kolloidinen, hydrofobinen,
Natriumtärkkelysglykolaatti (tyyppi A).
Kalvopäällyste
Glyseroli,
Hypromelloosi,
Kupariklorofylliini,
Makrogoli 6000,
Magnesiumstearaatti,
Titaanidioksidi.
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta.
Säilytys
Pidä pakkaus tiiviisti suljettuna. Herkkä kosteudelle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
COVERSYL NOVUM tabletti, kalvopäällysteinen
5 mg (J) (L:kyllä) 30 kpl (11,59 €), 90 kpl (27,52 €)
10 mg (L:kyllä) 30 kpl (15,70 €), 90 kpl (40,53 €)
PF-selosteen tieto
Valkoinen polypropyleenipurkki, jossa polyetyleenistä valmistettu annostelua helpottava välikansi ja kuivausainegeelin sisältävä valkoinen läpinäkymätön kansi.
Laatikko sisältäen 5, 10, 14, 20, 28, 30, 50, 60 (60 tai 2 purkkia, joissa 30 tablettia), 84 (84 tai 3 purkkia, joissa 28 tablettia), 90 (90 tai 3 purkkia, joissa 30 tablettia), 100 (100 tai 2 purkkia, joissa 50 tablettia), 120 (120 tai 4 purkkia, joissa 30 tablettia) tai 500 (500 tai 10 purkkia, joissa 50 tablettia) tablettia.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
5 mg: Vaaleanvihreä, pitkänomainen, kalvopäällysteinen tabletti, jossa kaiverrus
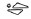
toisella puolella ja jakoura molemmilla puolilla. Tabletti voidaan jakaa yhtä suuriksi annoksiksi.
10 mg: Vihreä, pyöreä, kaksoiskupera, kalvopäällysteinen tabletti, jossa kaivertus

toisella puolella ja
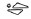
toisella puolella.
Käyttö- ja käsittelyohjeet
Ei erityisvaatimuksia.
Korvattavuus
COVERSYL NOVUM tabletti, kalvopäällysteinen
5 mg 30 kpl, 90 kpl
- Alempi erityiskorvaus (65 %). Krooninen sydämen vajaatoiminta (201), Krooninen verenpainetauti (205).
- Peruskorvaus (40 %).
COVERSYL NOVUM tabletti, kalvopäällysteinen
10 mg 30 kpl, 90 kpl
- Alempi erityiskorvaus (65 %). Krooninen verenpainetauti (205).
- Peruskorvaus (40 %).
ATC-koodi
C09AA04
Valmisteyhteenvedon muuttamispäivämäärä
15.11.2021
Yhteystiedot
Äyritie 22
01510 Vantaa
09 279 8080
www.servierfinland.fi
info.finland@servier.com
