BUCCOLAM liuos suuonteloon 2,5 mg, 5 mg, 7,5 mg, 10 mg
Vaikuttavat aineet ja niiden määrät
BUCCOLAM 2,5 mg liuos suuonteloon
Yksi esitäytetty mittaruisku sisältää 2,5 mg midatsolaamia (hydrokloridina) 0,5 ml:ssa liuosta.
BUCCOLAM 5 mg liuos suuonteloon
Yksi esitäytetty mittaruisku sisältää 5 mg midatsolaamia (hydrokloridina) 1 ml:ssa liuosta.
BUCCOLAM 7,5 mg liuos suuonteloon
Yksi esitäytetty mittaruisku sisältää 7,5 mg midatsolaamia (hydrokloridina) 1,5 ml:ssa liuosta.
BUCCOLAM 10 mg liuos suuonteloon
Yksi esitäytetty mittaruisku sisältää 10 mg midatsolaamia (hydrokloridina) 2 ml:ssa liuosta.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Liuos suuonteloon
Kliiniset tiedot
Käyttöaiheet
Pitkittyneiden, akuuttien kouristuskohtausten hoito 3 kuukauden ikäisistä lapsista aikuisiin.
Buccolamia saavat antaa vain vanhemmat/huoltajat kun potilaan epilepsia on diagnosoitu.
Hoito 3–6 kuukauden ikäisille imeväisikäisille tulee antaa sairaalaoloissa, joissa tarkkailu on mahdollista ja elvytysvälineistö saatavilla. Ks. kohta Annostus ja antotapa.
Ehto
BUCCOLAM liuos suuonteloon
2,5 mg 4 x 0,5 ml
- Hoito 3-6 kuukauden ikäisille imeväisikäisille tulee antaa sairaalaoloissa, joissa tarkkailu on mahdollista ja elvytysvälineistö saatavilla.
Annostus ja antotapa
Annostus
Suositusannokset näkyvät alla olevassa taulukossa:
| Ikäryhmä | Annos | Etiketin väri |
| 3 – 6 kk sairaalaoloissa | 2,5 mg | Keltainen |
| > 6 kk - < 1 vuotta | 2,5 mg | Keltainen |
| 1 - < 5 vuotta | 5 mg | Sininen |
| 5 - < 10 vuotta | 7,5 mg | Purppuranpunainen |
| 10 - vuotiaista aikuisiin | 10 mg | Oranssi |
Potilaan huoltaja saa antaa vain yhden kerta-annoksen midatsolaamia. Jos kohtaus ei pääty 10 minuutin kuluessa midatsolaamin antamisesta, potilaan on saatava ensiapuhoitoa ja tyhjä ruisku on annettava sitä antavalle terveydenhoidon ammattilaiselle, jotta tämä saa tietoa potilaan saamasta annoksesta.
Ensivasteen jälkeen, mikäli kohtaus uusiutuu, ei saa antaa uutta annosta eikä annosta saa toistaa ennen lääkärin määräystä (ks. kohta Farmakokinetiikka).
Potilaille, joilla on suurentunut bentsodiatsepiinien aiheuttaman hengityslaman riski, on harkittava Buccolamin antamista terveydenhuollon ammattilaisen valvonnassa ennen Buccolam-hoidon aloittamista. Tämä annos voidaan antaa ilman kohtausta.
Erityisväestöt
Munuaisten vajaatoiminta
Annosta ei tarvitse muuttaa, mutta Buccolamia tulee käyttää varoen kroonista munuaisten vajaatoimintaa sairastaville potilaille, sillä midatsolaamin eliminoituminen saattaa olla viivästynyt ja vaikutukset pitkittyneet (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Maksan vajaatoiminta
Maksan vajaatoiminta vähentää midatsolaamin puhdistumaa, mistä on seurauksena lopullisen puoliintumisajan pidentyminen. Kliiniset vaikutukset saattavat siksi olla voimakkaampia ja pidentyneitä, joten kliinisten vaikutusten ja elintoimintojen seurantaa suositellaan, kun midatsolaamia annetaan maksan vajaatoimintaa sairastaville potilaille (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Buccolam on vasta-aiheinen vaikeaa maksan vajaatoimintaa sairastavilla potilailla (ks. kohta Vasta-aiheet).
Pediatriset potilaat
Midatsolaamin turvallisuutta ja tehoa 0–3 kuukauden ikäisten lasten hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
Iäkkäät potilaat
Iäkkäät ovat herkempiä bentsodiatsepiinien vaikutuksille. Buccolamia on käytettävä varoen yli 60-vuotiaille ja iäkkäille potilaille.
Antotapa
Buccolam annetaan suuonteloon. Koko liuosmäärä tulee ruiskuttaa hitaasti ikenien ja posken väliseen tilaan. Kurkunpään/henkitorven alueelle antamista on vältettävä, jotta estetään liuoksen vahingossa aspiroiminen. Tarvittaessa (suuri liuosmäärä ja/tai pieni potilas) noin puolet annoksesta tulee antaa hitaasti toiselle puolelle suuta, minkä jälkeen loput annoksesta annetaan hitaasti toiselle puolelle suuta.
Ks. kohdasta Käyttö- ja käsittelyohjeet tarkat ohjeet lääkevalmisteen antamisesta.
Ennen lääkkeen käsittelyä tai antoa huomioon otettavat varotoimet
Mittaruiskuun ei saa liittää neulaa, laskimonsisäistä letkustoa eikä mitään muuta parenteraaliseen antamiseen tarkoitettua välinettä.
Buccolamia ei saa antaa laskimoon.
Mittaruiskun korkki on poistettava ennen käyttöä tukehtumisvaaran välttämiseksi.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle, bentsodiatsepiineille tai kohdassa Apuaineet mainituille apuaineille.
Myasthenia gravis
Vaikea hengitysvajaus
Uniapneaoireyhtymä
Vaikea maksan vajaatoiminta
Varoitukset ja käyttöön liittyvät varotoimet
Erityistä varovaisuutta on noudatettava, kun midatsolaamia annetaan korkean riskin potilaille:
• yli 60-vuotiaat aikuiset
• kroonisesti sairaat tai heikentyneet potilaat, esim.
• potilaat, joilla on krooninen hengitysvajaus
• potilaat, joilla on krooninen munuaisten vajaatoiminta, heikentynyt maksan toiminta tai heikentynyt sydämen toiminta
• pediatriset potilaat, joilla on kardiovaskulaarinen epävakaus
Nämä korkean riskin potilaat saattavat tarvita pienempiä annoksia.
Hengitysvajaus
Midatsolaamia tulee käyttää varoen potilaille, joilla on krooninen hengitysvajaus, sillä midatsolaami voi pahentaa vajausta.
3−6 kuukauden ikäiset pediatriset potilaat
Koska metaboliitin ja kantalääkkeen välinen suhde on suurempi pikkulapsilla, suuren aktiivisen metaboliittipitoisuuden aiheuttamaa viivästynyttä hengityslamaa ei 3–6 kuukauden ikäisten ryhmässä voida poissulkea. Siksi Buccolamin käyttöä 3–6 kuukauden ikäryhmään kuuluville tulee rajoittaa suoritettavaksi vain terveydenhoidon ammattilaisen valvonnassa, ja kun elvytysvälineistö on saatavissa, hengitystoimintaa voidaan tarkkailla ja välineet hengityksen avustamiseen ovat tarvittaessa käytettävissä.
Midatsolaamin muuttunut eliminoituminen
Midatsolaamia tulee käyttää varoen potilaille, joilla on krooninen munuaisten vajaatoiminta, heikentynyt maksan tai sydämen toiminta. Midatsolaami voi akkumuloitua kroonista munuaisten vajaatoimintaa tai maksan vajaatoimintaa sairastavilla potilailla, kun taas sydämen vajaatoimintaa sairastavilla se saattaa pienentää midatsolaamin puhdistumaa.
Samanaikainen käyttö muiden bentsodiatsepiinien kanssa
Heikkokuntoiset potilaat ovat muita alttiimpia bentsodiatsepiinien keskushermostoon kohdistuville vaikutuksille, ja siksi annosten pienentäminen saattaa olla tarpeen.
Alkoholin väärinkäyttö tai huumeiden käyttö anamneesissa
Midatsolaamin käyttöä tulee välttää potilaille, joiden anamneesissa on alkoholin väärinkäyttöä tai huumeiden käyttöä.
Amnesia
Midatsolaami voi aiheuttaa anterogradista amnesiaa.
Apuaineet
Natrium
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per mittaruisku eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Midatsolaami metaboloituu CYP3A4:n vaikutuksesta. CYP3A4:n estäjät ja induktorit saattavat suurentaa ja pienentää midatsolaamin pitoisuutta plasmassa ja siten vahvistaa ja heikentää midatsolaamin vaikutuksia, jolloin annoksen säätäminen on tarpeen. Farmakokineettiset yhteisvaikutukset CYP3A4:n estäjien tai induktorien kanssa ovat voimakkaampia, kun midatsolaamia annetaan suun kautta nieltynä kuin jos sitä annetaan suuonteloon tai parenteraalisesti, sillä CYP3A4-entsyymejä on myös ruoansulatuskanavan yläosassa. Suuonteloon annon jälkeen vaikutukset kohdistuvat vain systeemiseen puhdistumaan. Suuonteloon annettavan midatsolaami-kerta-annoksen jälkeen CYP3A4:n eston vaikutus midatsolaamin kliinisen vaikutuksen voimakkuuteen on vähäinen, mutta vaikutuksen kesto voi pidentyä. Sen vuoksi kliinisten vaikutusten ja elintoimintojen huolellista seurantaa suositellaan midatsolaamin ja CYP3A4:n estäjän yhteiskäytön aikana, myös kerta-annoksen jälkeen.
Anesteetit ja narkoottiset analgeetit
Fentanyyli saattaa pienentää midatsolaamin puhdistumaa.
Epilepsialääkkeet
Yhteiskäyttö midatsolaamin kanssa saattaa vahvistaa sedaatiota tai johtaa hengityslamaan tai kardiovaskulaariseen lamaan. Midatsolaami saattaa voimistaa muiden maksassa metaboloituvien lääkevalmisteiden, esim. fenytoiinin, vaikutusta.
Kalsiuminestäjät
Diltiatseemin ja verapamiilin on osoitettu pienentävän midatsolaamin ja muiden bentsodiatsepiinien puhdistumaa, mikä voi voimistaa niiden vaikutusta.
Ulkuslääkevalmisteet
Simetidiinin, ranitidiinin ja omepratsolin on osoitettu pienentävän midatsolaamin ja muiden bentsodiatsepiinien puhdistumaa, mikä voi vahvistaa niiden vaikutusta.
Ksantiinit
Ksantiinit nopeuttavat midatsolaamin ja muiden bentsodiatsepiinien metaboloitumista.
Dopaminergiset lääkevalmisteet
Midatsolaami saattaa estää levodopaa.
Lihasrelaksantit
Midatsolaami saattaa voimistaa lihasrelaksanttien, kuten baklofeenin, keskushermostoa lamaavia vaikutuksia.
Nabiloni
Yhteiskäyttö midatsolaamin kanssa saattaa vahvistaa sedaatiota tai johtaa hengityslamaan ja kardiovaskulaariseen lamaan.
CYP3A4:ää estävät lääkevalmisteet
Midatsolaamin suuonteloon annon jälkeen esiintyvät lääkevalmisteiden yhteisvaikutukset muistuttavat todennäköisesti enemmän midatsolaamin laskimoon annon jälkeen todettuja kuin suun kautta annon jälkeen todettuja yhteisvaikutuksia.
Ruoka
Greippimehu pienentää midatsolaamin puhdistumaa ja vahvistaa aineen vaikutusta.
Atsolisienilääkkeet
Ketokonatsoli 5-kertaisti laskimoon annetun midatsolaamin pitoisuuden plasmassa ja noin 3-kertaisti sen terminaalisen puoliintumisajan.
Vorikonatsoli 3-kertaisti laskimoon annetulle midatsolaamille altistuksen ja noin 3-kertaisti sen eliminaation puoliintumisajan.
Sekä flukonatsoli että itrakonatsoli 2–3-kertaistivat laskimoon annetun midatsolaamin pitoisuuden plasmassa. Terminaalinen puoliintumisaika 2,4-kertaistui itrakonatsolin ja 1,5-kertaistui flukonatsolin vaikutuksesta.
Posakonatsoli noin 2-kertaisti laskimoon annetun midatsolaamin pitoisuuden plasmassa.
Makrolidiantibiootit
Erytromysiini noin 1,6–2-kertaisti laskimoon annetun midatsolaamin pitoisuuden plasmassa ja 1,5–1,8-kertaisti sen terminaalisen puoliintumisajan.
Klaritromysiini jopa 2,5-kertaisti laskimoon annetun midatsolaamin pitoisuuden plasmassa ja 1,5–2-kertaisti sen terminaalisen puoliintumisajan.
HIV-proteaasin estäjät
Yhteiskäyttö proteaasin estäjien (esim. sakinaviirin ja muiden HIV-proteaasin estäjien) kanssa voi suurentaa midatsolaamin pitoisuutta voimakkaasti. Yhteiskäyttö ritonaviirilla vahvistetun lopinaviirin kanssa 5,4-kertaisti laskimoon annetun midatsolaamin pitoisuuden plasmassa ja johti samansuuruiseen terminaalisen puoliintumisajan pidentymiseen.
Kalsiuminestäjät
Kerta-annos diltiatseemia suurensi laskimoon annetun midatsolaamin pitoisuutta plasmassa noin 25 %:lla ja pidensi terminaalista puoliintumisaikaa 43 %:lla.
Muut lääkevalmisteet
Atorvastatiini 1,4-kertaisti laskimoon annetun midatsolaamin pitoisuuden plasmassa verrokkiryhmään nähden.
CYP3A4:ää indusoivat lääkevalmisteet
Rifampisiini
600 mg kerran päivässä 7 päivän ajan pienensi laskimoon annetun midatsolaamin pitoisuutta plasmassa noin 60 %:lla ja terminaalista puoliintumisaikaa noin 50–60 %:lla.
Yrtit
Mäkikuisma vähensi midatsolaamin pitoisuutta plasmassa noin 20–40 %, ja siihen liittyi lopullisen puoliintumisajan noin 15–17 %:n lasku. CYP3A4:n indusoiva vaikutus saattaa vaihdella mäkikuismauutevalmisteesta riippuen.
Lääkkeiden väliset farmakodynaamiset yhteisvaikutukset (DDI)
Midatsolaamin käyttö yhdessä muiden sedatiivisten/hypnoottisten lääkevalmisteiden ja keskushermostoa lamaavien aineiden, mukaan lukien alkoholin, kanssa voimistaa todennäköisesti sedaatiota ja hengityslamaa.
Tällaisia aineita ovat esimerkiksi opiaattijohdannaiset (analgeetteina, antitussiiveina tai korvaushoitona käytetyt), psykoosilääkkeet, anksiolyytteina tai hypnootteina käytettävät muut bentsodiatsepiinit, barbituraatit, propofoli, ketamiini, etomidaatti, sedatiiviset masennuslääkkeet, vanhemman sukupolven H1-antihistamiinit ja keskushermoston kautta vaikuttavat verenpainelääkevalmisteet.
Alkoholi (myös alkoholia sisältävät lääkevalmisteet) saattaa voimistaa midatsolaamin sedatiivista vaikutusta merkittävästi. Alkoholia tulee ehdottomasti välttää midatsolaamin antamisen yhteydessä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Midatsolaami pienentää inhalaatioanesteettien MAC-arvoa (minimum alveolar concentration).
CYP3A4:n estäjien vaikutus saattaa olla suurempi pikkulapsilla, sillä osa suuonteloon otettavasta annoksesta todennäköisesti tulee niellyksi, jolloin myös osa imeytyy ruoansulatuskanavan kautta.
Raskaus ja imetys
Raskaus
Ei ole olemassa tietoja tai on vain vähän tietoja midatsolaamin käytöstä raskaana oleville naisille. Eläinkokeissa ei ole havaittu teratogeenista lisääntymistoksista vaikutusta, mutta kuten muillakin bentsodiatsepiineilla toksisuutta sikiölle on havaittu ihmisissä. Tietoa kahta ensimmäistä kolmannesta koskevasta raskauden aikaisesta altistuksesta ei ole saatavilla.
Viimeisen raskauskolmanneksen tai synnytyksen aikana annettujen suurten midatsolaamiannosten on raportoitu aiheuttavan haittavaikutuksia emoilla tai sikiöillä/vastasyntyneillä (nesteiden ja mahasisällön aspiraatioriskiä emoilla synnytyksen aikana, sikiön sydämen sykkeen epäsäännöllisyyttä, hypotoniaa, imemisrefleksin heikentymistä, hypotermiaa ja hengityslamaa vastasyntyneillä).
Midatsolaamia voidaan käyttää raskauden aikana, jos käyttö on selvästi tarpeen. Riski vastasyntyneelle on otettava huomioon, jos midatsolaamia annetaan viimeisen raskauskolmanneksen aikana.
Imetys
Midatsolaamia erittyy ihmisen rintamaitoon vähäisinä määrinä (0,6 %). Imetyksen lopettaminen ei siksi välttämättä ole tarpeen yhden midatsolaamiannoksen jälkeen.
Hedelmällisyys
Eläintutkimukset eivät osoittaneet fertiliteetin heikentymistä (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Midatsolaamilla on huomattava vaikutus ajokykyyn ja koneiden käyttökykyyn.
Sedaatio, amnesia, heikentynyt huomiokyky ja heikentynyt lihasten toiminta saattavat heikentää ajokykyä, pyöräilykykyä tai koneiden käyttökykyä. Potilasta tulee kehottaa olemaan ajamatta tai käyttämättä koneita midatsolaamin saamisen jälkeen, kunnes hän on toipunut täysin.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Julkaistuista kliinisistä tutkimuksista käy ilmi, että midatsolaamia annettiin suuonteloon noin 443:lle lapselle ja 224:lle aikuiselle, joilla oli kohtauksia. Hengityslaman esiintymisprosentti on korkeintaan 5 %:n luokkaa, vaikka tämä on kouristuskohtauksiin tunnetusti liittyvä komplikaatio ja liittyy myös midatsolaamin käyttöön. Yksi pruritus-tapahtuma oli mahdollisesti poskeen annetun midatsolaamin aiheuttama.
Taulukkomuotoinen luettelo haittavaikutuksista
Alla olevassa taulukossa on esitetty haittavaikutukset, joita on ilmoitettu esiintyneen kun midatsolaamia annettiin suuonteloon kliinisissä tutkimuksissa ja markkinoille tulon jälkeen.
Haittavaikutusten esiintymistiheys on luokiteltu seuraavasti:
Yleinen: ≥ 1/100, < 1/10
Melko harvinainen: ≥ 1/1 000, < 1/100
Hyvin harvinainen: < 1/10 000
Tuntematon: koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin
Haittavaikutukset on esitetty kussakin esiintymistiheydessä haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä:
| Elinjärjestelmäluokka | Esiintymistiheys: Haittavaikutus |
| Psyykkiset häiriöt | Hyvin harvinainen: Aggressiivisuus**, agitaatio**, kiukku**, sekavuustila**, euforinen tila**, hallusinaatiot**, vihamielisyys**, liikehäiriöt**, väkivaltaisuus** |
| Hermosto | Yleinen: Sedaatio, uneliaisuus, tajunnan tason lasku Hengityslama Hyvin harvinainen: Anterogradinen amnesia**, ataksia**, heitehuimaus**, päänsärky**, kouristuskohtaus**, paradoksaaliset reaktiot** |
| Sydän | Hyvin harvinainen: Bradykardia**, sydänpysähdys**, hypotensio**, vasodilataatio** |
| Hengityselimet, rintakehä ja välikarsina | Hyvin harvinainen: Apnea**, dyspnea**, laryngospasmi**, hengityksen pysähtyminen** |
| Ruoansulatuselimistö | Yleinen: Pahoinvointi ja oksentelu Hyvin harvinainen: Ummetus**, suun kuivuminen** |
| Iho ja ihonalainen kudos | Melko harvinainen: Kutina, ihottuma ja nokkosihottuma Tuntematon: Angioedeema* |
| Yleisoireet ja antopaikassa todettavat haitat | Hyvin harvinainen: Uupumus**, hikka** |
**Näitä haittavaikutuksia on raportoitu esiintyneen lapsilla ja/tai aikuisilla midatsolaamin injisoimisen yhteydessä, minkä vuoksi niitä saattaa mahdollisesti esiintyä myös suuonteloon annettaessa.
*Markkinoille tulon jälkeen tunnistettu haittavaikutus.
Muut haittavaikutukset
Iäkkäiden bentsodiatsepiinien käyttäjien riski kaatumisiin ja murtumiin on lisääntynyt.
Hengenvaarallisten tapahtumien esiintyminen on todennäköisempää niillä, joilla jo entuudestaan on hengitysvajaus tai sydämen vajaatoiminta ja varsinkin suuria annoksia käytettäessä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Oireet
Midatsolaamin yliannostus voi aiheuttaa hengenvaaran, jos potilaalla on jo entuudestaan hengitysvajaus tai sydämen vajaatoiminta, tai jos midatsolaamia annetaan yhdessä muiden keskushermostoa lamaavien lääkeaineiden (tai alkoholin) kanssa.
Bentsodiatsepiinien yliannostus ilmenee tavallisesti eriasteisena keskushermostolamana vaihdellen uneliaisuudesta koomaan. Lievissä tapauksissa oireita ovat uneliaisuus, sekavuus ja letargia, vaikeammissa tapauksissa oireita voivat olla ataksia, hypotonia, hypotensio, hengityslama, harvoin kooma ja hyvin harvoin kuolema.
Hoito
Minkä tahansa lääkevalmisteen yliannostuksen hoidossa on otettava huomioon se, että potilas on saattanut ottaa monia eri lääkevalmisteita.
Suun kautta annetun midatsolaamin yliannostuksen jälkeen tulee joko aikaansaada oksentaminen (tunnin kuluessa), jos potilas on tajuissaan, tai suorittaa mahahuuhtelu suojaten hengitystiet, jos potilas on tajuton. Jos mahan tyhjentämisestä ei ole mitään hyötyä, annetaan aktiivihiiltä imeytymisen vähentämiseksi. Hengitys- ja kardiovaskulaarisen toiminnan seuranta toteutetaan tehohoidossa.
Vasta-aineena voidaan käyttää flumatseniilia.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Psykoosi- ja neuroosilääkkeet sekä unilääkkeet, bentsodiatsepiinijohdokset, ATC-koodi: N05CD08.
Vaikutusmekanismi
Midatsolaami on imidatsobentsodiatsepiinien ryhmän johdannainen. Sen vapaa emäs on lipofiilinen aine, jolla on alhainen vesiliukoisuus. Imidatsobentsodiatsepiinirenkaan asemassa 2 olevan emäksisen typen ansiosta midatsolaami voi yhdessä happojen kanssa muodostaa hydrokloridisuolan. Nämä aikaansaavat vakaan liuoksen, joka soveltuu suuonteloon antoa varten.
Farmakodynaamiset vaikutukset
Midatsolaamin farmakologiselle vaikutukselle on tunnusomaista nopeasta metaboliasta johtuva lyhyt kesto. Midatsolaamilla on kouristuksia estävä vaikutus. Sillä on myös voimakas sedatiivinen ja hypnoottinen vaikutus sekä anksiolyyttinen ja lihaksia relaksoiva vaikutus.
Kliininen teho ja turvallisuus
Neljässä rektaalisella diatsepaamilla kontrolloidussa ja yhdessä laskimonsisäiseen diatsepaamiin vertailevassa tutkimuksessa, joihin osallistui yhteensä 688 lasta, kouristuskohtausten näkyvät oireet hävisivät 10 minuutin sisällä 65–78 %:lla midatsolaamia suuonteloon saaneista lapsista. Lisäksi kahdessa näistä tutkimuksista 10 minuutin sisällä hävinneet kouristuskohtausten näkyvät oireet eivät palanneet yhden tunnin sisällä midatsolaamin annosta 56–70 %:lla lapsista. Suuonteloon annettavasta midatsolaamista raportoitujen haittavaikutusten esiintymistiheys ja vakavuusaste olivat julkaistuissa kliinisissä tutkimuksissa samankaltaisia kuin rektaalista diatsepaamia käyttävässä vertailuryhmässä raportoidut haittavaikutukset.
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset Buccolamin käytöstä alle 3 kk:n ikäisten pediatristen potilaiden ryhmässä sillä perusteella, että kyseessä olevasta erityisestä lääkevalmisteesta ei ole merkitsevää terapeuttista hyötyä verrattuna olemassa oleviin hoitoihin näillä potilailla.
Farmakokinetiikka
Farmakokineettiseen väestötutkimukseen perustuvat, suositetun annostuksen simuloidut farmakokineettiset parametrit 3 kk:n – alle 18 vuoden ikäisillä lapsilla sekä farmakokineettiset parametrit aikuisille suositellulla annostuksella, jotka perustuvat terveillä aikuisilla koehenkilöillä tehtyyn biologista hyötyosuutta koskevaan tutkimukseen, on esitetty alla olevassa taulukossa.
| Annos | Ikä | Parametri | Keskim. | Vakiopoikkeama (SD) |
| 2,5 mg | 3 kk < 1 vuosi | AUC0-inf (ng.h/ml) | 168 | 98 |
| Cmax (ng/ml) | 104 | 46 | ||
| 5 mg | 1 - < 5 vuotta | AUC0-inf (ng.h/ml) | 242 | 116 |
| Cmax (ng/ml) | 148 | 62 | ||
| 7,5 mg | 5 - <10 vuotta | AUC0-inf (ng.h/ml) | 254 | 136 |
| Cmax (ng/ml) | 140 | 60 | ||
| 10 mg | 10 - < 18 vuotta | AUC0-inf (ng.h/ml) | 189 | 96 |
| Cmax (ng/ml) | 87 | 44 | ||
| 10 mg | > 18 vuotta | AUC0-inf (ng.h/ml) (n=22) | 259 | 62 |
| Cmax (ng/ml) (n=22) | 71 | 29 |
Farmakokineettiseen tutkimukseen perustuvat simuloidut farmakokineettiset parametrit suositellulle aikuisten annostukselle (poislukien iäkkäät ja ylipainoiset) viittaavat siihen, että 10 mg:n annos johtaa kaikilla aikuisilla samankaltaiseen altistumiseen kuin vastaavat terapeuttiset annokset kaikissa pediatrisissa ikäryhmissä.
Imeytyminen
Midatsolaami imeytyy nopeasti suuonteloon annon jälkeen. Huippupitoisuus plasmassa saavutetaan 30 minuutissa. Suuonteloon annetun midatsolaamin absoluuttinen biologinen hyötyosuus on aikuisilla noin 75 %. Suuonteloon annettavan midatsolaamin biologisen hyötyosuuden arvioidaan olevan 87 % lapsilla, joilla on vaikea malaria ja kouristuksia.
Jakautuminen
Midatsolaami on erittäin lipofiilinen ja jakautuu laajalti. Vakaan tilan jakautumistilavuuden suuonteloon annon jälkeen arvioidaan olevan 5,3 l/kg.
Noin 96–98 % midatsolaamista sitoutuu plasman proteiineihin. Suurin osa plasman proteiineihin sitoutuvasta midatsolaamista sitoutuu albumiiniin. Midatsolaamia kulkeutuu hitaasti ja vähäisessä määrin aivo-selkäydinnesteeseen. Midatsolaamin on osoitettu hitaasti läpäisevän ihmisen istukan ja kulkeutuvan sikiön verenkiertoon. Pieniä määriä midatsolaamia erittyy myös äidinmaitoon.
Biotransformaatio
Midatsolaami eliminoituu lähes täysin biotransformaation kautta. Maksan kautta poistuu annoksesta arviolta 30–60 %. Midatsolaami hydroksyloituu sytokromi P450:n isoentsyymi 3A4:n vaikutuksesta. Päämetaboliitti virtsassa ja plasmassa on alfa-hydroksimidatsolaami. Suuonteloon annon jälkeen alfa-hydroksimidatsolaamin ja midatsolaamin AUC-arvojen suhde on lapsilla 0,46 ja aikuisilla 0,28.
Farmakokineettisessa väestötutkimuksessa metaboliittitasojen on osoitettu nuoremmilla pediatrisilla potilailla olevan korkeammat kuin vanhemmilla pediatrisilla potilailla ja siten niiden merkitys on lapsilla suurempi kuin aikuisilla.
Eliminaatio
Midatsolaamin suuonteloon annon jälkeinen plasmapuhdistuma lapsilla on 30 ml/kg/min. Ensimmäisen ja viimeisen vaiheen eliminaation puoliintumisajat ovat 27 ja 204 minuuttia. Midatsolaami erittyy pääasiassa munuaisten kautta (60–80 % injisoidusta annoksesta) glukurokonjugoituna alfa-hydroksimidatsolaamina. Alle 1 % annoksesta erittyy muuttumattomana virtsaan.
Farmakokinetiikka erityispopulaatioissa
Iäkkäät potilaat
Suuonteloon tapahtuneen annostelun jälkeen altistuminen midatsolaamille on 60–70-vuotiailla aikuisilla samankaltaista kuin nuorilla aikuisilla. Altistumisesta tätä iäkkäämmillä potilailla suuonteloon tapahtuneen annostelun jälkeen ei ole tietoa, mutta se voi lisääntyä, koska laskimonsisäisen annostelun jälkeen eliminaation puoliintumisaika voi pidentyä jopa nelinkertaiseksi.
Ylipainoiset potilaat
Midatsolaamin keskimääräinen puoliintumisaika suuonteloon tapahtuneen annostelun jälkeen aikuisilla, joiden painoindeksi on 30–34, on samankaltainen kuin aikuisilla, joiden painoindeksi on 25–30 (8,4 vs. 5,5 tuntia). Puoliintumisajasta aikuisilla, joiden BMI on yli 34, ei ole tietoa, mutta se saattaa pidentyä, koska laskimonsisäisen annostelun jälkeen keskimääräinen puoliintumisaika on ylipainoisilla pidempi (5,9 tuntia) kuin normaalipainoisilla potilailla (2,3 tuntia). Tämä johtuu jakautumistilavuuden suurenemisesta noin 50 prosentilla kehonpainoon nähden. Puhdistumassa ei ole merkittävää eroa yli- ja normaalipainoisten potilaiden välillä.
Maksan vajaatoiminta
Kirroosipotilailla eliminaation puoliintumisaika saattaa olla pidempi ja puhdistuma pienempi kuin terveillä vapaaehtoisilla (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet liittyvät varotoimet).
Munuaisten vajaatoiminta
Kroonista munuaisten vajaatoimintaa sairastavilla potilailla eliminaation puoliintumisaika on samankaltainen kuin terveillä vapaaehtoisilla.
Midatsolaamin eliminaation puoliintumisaika on jopa kuusi kertaa pidempi kriittisesti sairailla potilailla.
Sydämen vajaatoiminta
Sydämen vajaatoimintaa sairastavilla potilailla eliminaation puoliintumisaika on pidempi kuin terveillä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Altistus saman kohtauksen aikana annetun toisen annoksen jälkeen
Simuloitu altistus osoittaa kokonais-AUC-arvon noin kaksinkertaistuvan, kun 10, 30 tai 60 minuuttia ensimmäisen annoksen jälkeen annetaan toinen annos. Toinen annos 10 minuutin jälkeen suurentaa keskimääräistä Cmax-arvoa merkittävästi, 1,7–1,9-kertaiseksi. 30 minuutin ja 60 minuutin jälkeen merkittävä osa midatsolaamista on jo eliminoitunut, ja siten keskimääräisen Cmax-arvon suurentuminen on vähäisempää: 1,3–1,6-kertainen ja 1,2–1,5-kertainen (ks. kohta Annostus ja antotapa).
Rotu
Kliinisiin tutkimuksiin on osallistunut potilaita japanilaisista ja muista kuin japanilaisista ryhmistä, eikä BUCCOLAM-altistuksen yhteydessä ole havaittu eroja farmakokineettisessa profiilissa.
Annoksen muuttaminen ei ole perusteltua.
Prekliiniset tiedot turvallisuudesta
Rotilla tehdyissä fertiliteettitutkimuksissa, joissa rotille annettiin kliinistä annosta 10 kertaa suurempia annoksia, ei havaittu fertiliteettiin kohdistuvia haittavaikutuksia.
Muita kuin tämän valmisteyhteenvedon muissa kohdissa jo mainittuja lääkkeen määräämisen kannalta tärkeitä prekliinisiä turvallisuustietoja ei ole.
Farmaseuttiset tiedot
Apuaineet
Natriumkloridi
Injektionesteisiin käytettävä vesi
Suolahappo (pH:n säätöä ja midatsolaamin hydrokloridisuolaksi muuntamista varten)
Natriumhydroksidi (pH:n säätöä varten)
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
Buccolam 2,5 mg liuos suuonteloon
18 kuukautta
Buccolam 5 mg, 7,5 mg, 10 mg liuos suuonteloon
2 vuotta.
Säilytys
Pidä mittaruisku muovisessa suojaputkessaan. Älä säilytä kylmässä. Ei saa jäätyä.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
BUCCOLAM liuos suuonteloon
2,5 mg (L:ei) 4 x 0,5 ml (112,73 €)
5 mg (L:ei) 4 x 1 ml (112,73 €)
7,5 mg (L:ei) 4 x 1,5 ml (112,73 €)
10 mg (L:ei) 4 x 2 ml (112,73 €)
PF-selosteen tieto
Kullanruskea, esitäytetty neulaton mittaruisku (polypropyleenia), jossa on mäntä (polypropyleenia) ja korkki (HDPE:tä). Ruisku on pakattu korkilla varustettuun muoviseen suojaputkeen.
| Vahvuus | Liuoksen määrä | Ruiskun tilavuus | Ikäryhmä | Etiketin väri |
| 2,5 mg | 0,5 ml | 1 ml | 3 kk - < 1 vuotta | Keltainen |
| 5 mg | 1 ml | 3 ml | 1 - < 5 vuotta | Sininen |
| 7,5 mg | 1,5 ml | 3 ml | 5 - < 10 vuotta | Purppuranpunainen |
| 10 mg | 2 ml | 3 ml | 10 - vuotiaista aikuisiin | Oranssi |
BUCCOLAMia on saatavana kahtena eri pakkauskokona:
- rasioissa, jotka sisältävät 2 esitäytettyä ruiskua.
- rasioissa, jotka sisältävät 4 esitäytettyä ruiskua.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Kirkas, väritön tai hieman kellertävä liuos.
pH 2,9–3,7.
Käyttö- ja käsittelyohjeet
Buccolamin antaminen
Buccolamia ei saa antaa laskimoon.
Vaihe 1: Pidä kiinni muovisesta putkesta ja vedä korkki irti. Poista ruisku suojaputkesta.
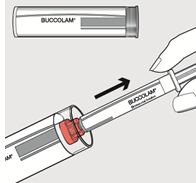
Vaihe 2: Vedä punainen korkki irti ruiskun päästä ja hävitä korkki turvallisesti.
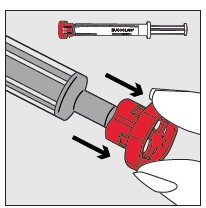
Vaihe 3: Nipistä ja vedä potilaan poskea varovasti ulospäin käyttämällä etusormea ja peukaloa. Aseta ruiskun pää posken sisäsivun ja alaikenen väliin jäävään tilaan.
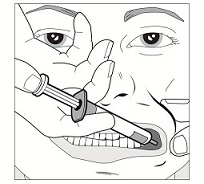
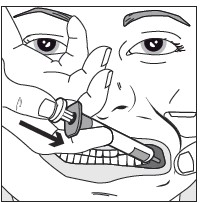
Vaihe 4: Paina ruiskun mäntää hitaasti, kunnes mäntä pysähtyy.
Koko liuosmäärä annetaan hitaasti ikenen ja posken väliseen tilaan.
Tarvittaessa (suuri liuosmäärä ja/tai pieni potilas) noin puolet annoksesta tulee antaa hitaasti toiselle puolelle suuta, minkä jälkeen loput annoksesta annetaan hitaasti toiselle puolelle suuta.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
BUCCOLAM liuos suuonteloon
2,5 mg 4 x 0,5 ml
5 mg 4 x 1 ml
7,5 mg 4 x 1,5 ml
10 mg 4 x 2 ml
- Ei korvausta.
ATC-koodi
N05CD08
Valmisteyhteenvedon muuttamispäivämäärä
21.10.2024
Yhteystiedot
Box 98
182 11 Danderyd
Sweden
www.neuraxpharm.com/se
medinfo-nordics@neuraxpharm.com
