TRESIBA injektioneste, liuos, esitäytetty kynä 100 U/ml, 200 U/ml, injektioneste, liuos, sylinteriampulli 100 U/ml
Vaikuttavat aineet ja niiden määrät
Tresiba 100 yksikköä/ml FlexTouch injektioneste, liuos, esitäytetty kynä
Yksi esitäytetty kynä sisältää 300 yksikköä degludekinsuliinia 3 ml:ssa liuosta.
1 ml liuosta sisältää 100 yksikköä degludekinsuliinia* (vastaten 3,66 mg degludekinsuliinia).
Tresiba 200 yksikköä/ml FlexTouch injektioneste, liuos, esitäytetty kynä
Yksi esitäytetty kynä sisältää 600 yksikköä degludekinsuliinia 3 ml:ssa liuosta.
1 ml liuosta sisältää 200 yksikköä degludekinsuliinia* (vastaten 7,32 mg degludekinsuliinia).
Tresiba 100 yksikköä/ml Penfill injektioneste, liuos, sylinteriampulli
Yksi sylinteriampulli sisältää 300 yksikköä degludekinsuliinia 3 ml:ssa liuosta.
1 ml liuosta sisältää 100 yksikköä degludekinsuliinia* (vastaten 3,66 mg degludekinsuliinia).
*Tuotettu yhdistelmä-DNA-tekniikalla Saccharomyces cerevisiae -hiivassa.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Tresiba 100 yksikköä/ml FlexTouch injektioneste, liuos, esitäytetty kynä
Injektioneste, liuos
Tresiba 200 yksikköä/ml FlexTouch injektioneste, liuos, esitäytetty kynä
Injektioneste, liuos
Tresiba 100 yksikköä/ml Penfill injektioneste, liuos, sylinteriampulli
Injektioneste, liuos
Kliiniset tiedot
Käyttöaiheet
Aikuisten, nuorten ja 1-vuotiaiden ja sitä vanhempien lasten diabetes mellituksen hoito.
Annostus ja antotapa
Annostus
Tämä lääkevalmiste on perusinsuliini, joka annetaan ihon alle kerran vuorokaudessa mihin tahansa kellonaikaan, mieluiten samaan aikaan joka päivä.
Insuliinianalogien, joihin degludekinsuliini kuuluu, vahvuus ilmaistaan yksiköissä. Yksi (1) yksikkö degludekinsuliinia vastaa yhtä kansainvälistä yksikköä ihmisinsuliinia, yhtä yksikköä glargininsuliinia (100 yksikköä/ml) tai yhtä yksikköä detemirinsuliinia.
Tyypin 2 diabetes mellitusta sairastavilla potilailla tätä lääkevalmistetta voidaan antaa yksinään tai minä tahansa yhdistelmähoitona oraalisten diabeteslääkkeiden, GLP-1-reseptoriagonistien ja ateriainsuliinin kanssa (ks. kohta Farmakodynamiikka).
Tyypin 1 diabetes mellitusta sairastavilla potilailla Tresiba-annoksen lisäksi on käytettävä lyhyt- tai pikavaikutteista insuliinia kattamaan aterian aikainen insuliinitarve.
Tresiba-insuliini annostellaan potilaan yksilöllisten tarpeiden mukaisesti. On suositeltavaa optimoida verenglukoositasapaino säätämällä annosta paastoplasman glukoosipitoisuuden perusteella.
Annoksen tarkistus voi olla tarpeen, jos potilaan fyysinen rasitus lisääntyy, tavanomainen ruokavalio muuttuu tai hänellä on muu samanaikainen sairaus.
Tresiba 100 yksikköä/ml ja Tresiba 200 yksikköä/ml FlexTouch injektioneste, liuos, esitäytetty kynä
Tresiba-insuliinia on saatavilla kahta eri vahvuutta. Molemmissa tarvittava annos valitaan yksikköinä. Esitäytetyn kynän annosväli on kuitenkin erilainen näissä tämän lääkevalmisteen kahdessa vahvuudessa.
- Tresiba 100 yksikköä/ml -valmisteella voidaan antaa 1–80 yksikön annos/injektio, ja annosta voidaan säätää yhden yksikön välein.
- Tresiba 200 yksikköä/ml -valmisteella voidaan antaa 2–160 yksikön annos/injektio, ja annosta voidaan säätää kahden yksikön välein. Annoksen tilavuus on puolet perusinsuliinivalmisteen (100 yksikköä/ml) tilavuudesta.
Annoslaskurissa näkyy yksikkömäärä riippumatta siitä, kumpi vahvuus on kyseessä, eikä annosta pidä muuntaa, kun potilas siirtyy käyttämään eri vahvuuden valmistetta.
Annostusajan joustavuus
Tilanteissa, joissa insuliinia ei ole mahdollista ottaa samaan aikaan joka päivä, Tresiba mahdollistaa joustavan annostusajan (ks. kohta Farmakodynamiikka). Pistosten välisen ajan on kuitenkin oltava aina vähintään 8 tuntia. Tresiba-valmisteen annostusajan joustavuudesta lapsilla ja nuorilla ei ole kliinistä kokemusta.
Jos potilas unohtaa annoksen, häntä neuvotaan ottamaan se heti kun hän muistaa asian ja jatkamaan sen jälkeen normaalin annostusaikataulun mukaista kerran päivässä annostusta.
Aloitus
Tyypin 2 diabetes mellitusta sairastavat potilaat
Suositeltu aloitusannos 10 yksikköä/vuorokausi, jonka jälkeen annostusta säädetään yksilöllisesti.
Tyypin 1 diabetes mellitusta sairastavat potilaat
Tresiba-insuliinia käytetään kerran vuorokaudessa yhdessä ateriainsuliinin kanssa ja sen annostusta on aloituksen jälkeen säädettävä yksilöllisesti.
Siirtyminen muista insuliinivalmisteista
Verenglukoosin tarkka seuranta on suositeltavaa siirtymisvaiheen aikana ja sitä seuraavina viikkoina. Lisäksi käytettävän pika- tai lyhytvaikutteisen insuliinivalmisteen annosta ja annoksen ajoitusta tai muuta samanaikaisesti annettavaa diabeteksen lääkehoitoa voidaan joutua säätämään.
Tyypin 2 diabetes mellitusta sairastavat potilaat
Niille tyypin 2 diabetesta sairastaville potilaille, joita hoidetaan kerran päivässä otettavalla perusinsuliinilla, perus- ja ateriainsuliinilla, sekoiteinsuliinilla tai itse sekoitetulla insuliinilla, perusinsuliini voidaan vaihtaa Tresiba-insuliiniin käyttäen samaa perusinsuliinin yksikkömäärää kuin aiemmin. Tämän jälkeen annostusta säädetään yksilöllisesti.
Annoksen pienentämistä 20 % aiemmasta perusinsuliiniannoksesta ja annostuksen yksilöllistä säätämistä tämän jälkeen pitää harkita, kun
- Tresiba-valmisteeseen siirrytään kaksi kertaa päivässä annosteltavasta perusinsuliinista
- Tresiba-valmisteeseen siirrytään glargininsuliinista (300 yksikköä/ml)
Tyypin 1 diabetes mellitusta sairastavat potilaat
Tyypin 1 diabetesta sairastaville potilaille annoksen pienentämistä 20 % aiemmasta perusinsuliiniannoksesta tai jatkuvan ihonalaisen insuliini-infuusion perusinsuliinikomponentista pitää harkita ja annostusta säätää myöhemmin yksilöllisesti verenglukoosivasteen perusteella.
Tresiba-insuliinin käyttö yhdessä GLP-1-reseptoriagonistien kanssa tyypin 2 diabetes mellitusta sairastavilla potilailla
Kun Tresiba-insuliini lisätään GLP-1-reseptoriagonisti-hoitoon, suositeltu aloitusannos on 10 yksikköä/vuorokausi, jonka jälkeen annostusta säädetään yksilöllisesti.
Kun GLP-1-reseptoriagonisti lisätään Tresiba-insuliinihoitoon, on suositeltavaa pienentää Tresiba-annosta 20 % hypoglykemiariskin minimoimiseksi. Myöhemmin annostusta säädetään yksilöllisesti.
Erityiset potilasryhmät
Iäkkäät (≥ 65-vuotiaat)
Tresiba-insuliinia voidaan käyttää iäkkäiden hoitoon. Verenglukoosin seurantaa on tehostettava ja insuliinin annosta on säädettävä yksilöllisesti (ks. kohta Farmakokinetiikka).
Munuaisten ja maksan vajaatoiminta
Tresiba-insuliinia voidaan käyttää munuaisten ja maksan vajaatoimintaa sairastavien potilaiden hoitoon. Verenglukoosin seurantaa on tehostettava ja insuliinin annosta on säädettävä yksilöllisesti (ks. kohta Farmakokinetiikka).
Pediatriset potilaat
Tämän lääkevalmisteen käytöstä alle 1-vuotiaille potilaille ei ole kliinistä kokemusta. Tätä lääkevalmistetta voidaan käyttää nuorille ja 1-vuotiaille ja sitä vanhemmille lapsille (ks. kohta Farmakodynamiikka). Kun perusinsuliini vaihdetaan Tresiba-insuliiniksi, perus- ja ateriainsuliinien annosten pienentämistä tulee harkita yksilöllisesti hypoglykemiariskin minimoimiseksi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Antotapa
Vain ihonalaisena pistoksena.
Tresiba-insuliinia ei saa antaa laskimoon, koska seurauksena voi olla vakava hypoglykemia.
Tätä lääkevalmistetta ei saa antaa lihakseen, koska se voi muuttaa imeytymistä.
Tätä lääkevalmistetta ei saa käyttää insuliini-infuusiopumpuissa.
Tresiba-liuosta ei saa vetää esitäytetyn kynän sylinteriampullista ruiskuun (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Tresiba pistetään ihon alle reiteen, olkavarteen tai vatsanpeitteisiin. Pistoskohtia on vaihdeltava sovitun pistosalueen sisällä lipodystrofian ja ihoamyloidoosin vaaran pienentämiseksi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset).
Potilaita pitää ohjeistaa käyttämään aina uutta neulaa. Insuliinikynän neulojen uudelleenkäyttö lisää tukkeutuneiden neulojen riskiä, mikä voi aiheuttaa yli- tai aliannostelua. Jos neula on tukossa, potilaan pitää seurata pakkausselosteen mukana tulevissa käyttöohjeissa kuvattuja ohjeita (ks. kohta Käyttö- ja käsittelyohjeet).
Tresiba 100 yksikköä/ml ja Tresiba 200 yksikköä/ml FlexTouch injektioneste, liuos, esitäytetty kynä
Tresiba on esitäytetyssä kynässä, joka on suunniteltu käytettäväksi NovoFine- tai NovoTwist-injektioneulojen kanssa.
- Esitäytetyllä 100 yksikköä/ml -kynällä voi pistää 1–80 yksikköä yhden yksikön välein.
- Esitäytetyllä 200 yksikköä/ml -kynällä voi pistää 2–160 yksikköä kahden yksikön välein.
Tresiba 100 yksikköä/ml Penfill injektioneste, liuos, sylinteriampulli
Tresiba on sylinteriampullissa, joka on suunniteltu käytettäväksi Novo Nordiskin insuliinien antolaitteiden ja NovoFine- tai NovoTwist-injektioneulojen kanssa.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Hypoglykemia
Aterian laiminlyöminen tai suunnittelematon, voimakas fyysinen rasitus voi johtaa hypoglykemiaan.
Hypoglykemiaa saattaa esiintyä, jos insuliiniannos on liian suuri suhteessa insuliinin tarpeeseen (ks. kohdat Yhteisvaikutukset, Haittavaikutukset ja Yliannostus).
Lapsilla on hypoglykemiariskin minimoimiseksi huolehdittava insuliiniannosten (erityisesti perusinsuliini-ateriainsuliinihoidossa) sovittamisesta ruokailuun ja liikuntaan.
Potilaat, joiden verenglukoositasapaino paranee huomattavasti (esim. tehostetun insuliinihoidon ansiosta), saattavat kokea muutoksen tavanomaisissa hypoglykemiasta varoittavissa oireissaan. Potilaille tulee kertoa asiasta ja antaa asianmukaista ohjausta. Tavanomaiset varoittavat oireet saattavat hävitä diabetesta pitkään sairastaneilta potilailta.
Muut sairaudet, varsinkin tulehdukset ja kuume, yleensä lisäävät potilaan insuliinin tarvetta. Samanaikainen munuais- tai maksasairaus tai lisämunuaisen, aivolisäkkeen tai kilpirauhasen toimintahäiriöt saattavat vaatia muutoksia insuliiniannokseen.
Kuten muiden perusinsuliinivalmisteidenkin kohdalla, Tresiba-insuliinin pitkittynyt vaikutus voi viivästyttää hypoglykemiasta toipumista.
Hyperglykemia
Pikavaikutteisen insuliinin antoa suositellaan vakavissa hyperglykemiatilanteissa.
Insuliinia tarvitsevien potilaiden riittämätön annostus ja/tai hoidon keskeytyminen saattavat johtaa hyperglykemiaan ja mahdollisesti diabeettiseen ketoasidoosiin. Lisäksi muut samanaikaiset sairaudet, varsinkin tulehdukset, voivat johtaa hyperglykemiaan ja lisätä siten potilaan insuliinin tarvetta.
Hyperglykemian ensimmäiset oireet ilmaantuvat yleensä vähitellen tuntien tai päivien kuluessa. Oireisiin sisältyvät jano, tihentynyt virtsaaminen, pahoinvointi, oksentelu, uneliaisuus, ihon punoitus ja kuivuminen, suun kuivuminen, ruokahaluttomuus sekä asetonin haju hengityksessä. Tyypin 1 diabetes mellituksessa hoitamattomat hyperglykemiatapahtumat johtavat lopulta diabeettiseen ketoasidoosiin, joka saattaa johtaa kuolemaan.
Siirtyminen muista insuliinivalmisteista
Kun potilas siirtyy käyttämään toisentyyppistä, toisenmerkkistä tai toisen valmistajan insuliinia, on siirtyminen toteutettava lääkärin valvonnassa ja annostuksen muutos saattaa olla tarpeen.
Iho ja ihonalainen kudos
Potilaita on ohjeistettava vuorottelemaan pistoskohtaa jatkuvasti lipodystrofian ja ihoamyloidoosin kehittymisen vaaran vähentämiseksi. Jos insuliinin pistämistä jatketaan niihin kohtiin, joilla esiintyy näitä muutoksia, on olemassa mahdollinen vaara, että insuliinin imeytyminen hidastuu ja verensokerin hallinta heikentyy. Injektiokohdan äkillisestä vaihtamisesta terveelle alueelle on ilmoitettu aiheutuvan hypoglykemiaa. Verensokerin seurantaa suositellaan pistoskohdan vaihtamisen jälkeen alueelta, jolla esiintyy muutoksia, terveelle alueelle, ja diabeteslääkkeiden annoksen muuttamista voidaan harkita.
Pioglitatsonin ja insuliinivalmisteiden yhteiskäyttö
Sydämen vajaatoimintatapauksia on raportoitu esiintyneen, kun pioglitatsonia oli käytetty yhdessä insuliinin kanssa, erityisesti potilailla, joilla on riskitekijöitä sydämen vajaatoiminnan kehittymiselle. Tämä tulee pitää mielessä, jos harkitaan pioglitatsonin ja Tresiba-valmisteen yhteiskäyttöä. Jos valmisteita käytetään yhdessä, potilailta tulee seurata sydämen vajaatoiminnan, painonnousun ja turvotuksen merkkejä ja oireita. Pioglitatsonihoito tulee lopettaa, jos sydänoireet pahenevat.
Silmäsairaudet
Insuliinihoidon tehostamisella aikaansaatuun äkilliseen glukoositasapainon paranemiseen saattaa liittyä diabeettisen retinopatian tilapäinen vaikeutuminen, mutta pitkäaikainen glukoositasapainon paraneminen vähentää diabeettisen retinopatian etenemisriskiä.
Lääkitysvirheiden välttäminen
Potilaita on neuvottava tarkistamaan insuliinin etiketti aina ennen pistämistä, jotta Tresiba-valmisteen kaksi eri vahvuutta sekä muut insuliinivalmisteet eivät menisi vahingossa sekaisin.
Potilaiden on tarkistettava valitut yksiköt kynän annoslaskurista. Jotta potilas voi pistää itse annoksen, hänen on kyettävä lukemaan kynän annoslaskurin lukema. Jos potilas on sokea tai hänellä on heikko näkö, häntä on kehotettava pyytämään aina apua sellaiselta henkilöltä, jolla on hyvä näkö ja joka on saanut opastuksen insuliinin annosteluvälineen käyttöön.
Annostusvirheiden ja mahdollisen liian suuren annoksen välttämiseksi potilaiden ja terveydenhuollon ammattilaisten ei pidä koskaan käyttää ruiskua vetääkseen lääkettä esitäytetyn kynän sylinteriampullista.
Jos neula on tukossa, potilaan pitää seurata pakkausselosteen mukana tulevissa käyttöohjeissa kuvattuja ohjeita (ks. kohta Käyttö- ja käsittelyohjeet).
Insuliinin vasta-aineet
Insuliinin annostelu saattaa aiheuttaa vasta-ainemuodostusta. Tällaisten insuliinin vasta-aineiden olemassaolo saattaa harvoissa tapauksissa edellyttää insuliiniannoksen säätämistä korjaamaan hyper- tai hypoglykemiataipumusta.
Natrium
Tämä lääkevalmiste sisältää natriumia alle 1 mmol (23 mg) per annos, eli sen voidaan sanoa olevan "natriumiton".
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Yhteisvaikutukset
Useiden lääkkeiden tiedetään vaikuttavan glukoosiaineenvaihduntaan.
Seuraavat aineet saattavat vähentää insuliinin tarvetta
Suun kautta otettavat diabeteslääkkeet, GLP-1-reseptorin agonistit, monoamiinioksidaasin (MAO:n) estäjät, beetasalpaajat, angiotensiinikonvertaasin (ACE:n) estäjät, salisylaatit, anaboliset steroidit ja sulfonamidit.
Seuraavat aineet saattavat lisätä insuliinin tarvetta
Suun kautta otettavat ehkäisyvalmisteet, tiatsidit, glukokortikoidit, kilpirauhashormonit, sympatomimeetit, kasvuhormoni ja danatsoli.
Beetasalpaajat saattavat peittää hypoglykemian oireet.
Oktreotidi ja lanreotidi voivat joko lisätä tai vähentää insuliinin tarvetta.
Alkoholi saattaa tehostaa tai vähentää insuliinin verenglukoosia alentavaa vaikutusta.
Raskaus ja imetys
Raskaus
Tresiba-valmisteen käyttöä raskaana olevilla diabetesta sairastavilla naisilla on tutkittu interventiotutkimuksessa (ks. kohta Farmakodynamiikka). Kliinisistä tutkimuksista ja markkinoille tulon jälkeen saatu kohtalainen määrä tietoa raskaana olevista naisista (yli 400 raskautta) ei viittaa epämuodostumiin eikä fetaaliseen tai neonataaliseen toksisuuteen. Sikiövaurioita ja teratogeenisuutta koskevissa eläinten lisääntymistutkimuksissa ei ole havaittu eroa degludekinsuliinin ja ihmisinsuliinin välillä.
Tresiba-valmisteen käyttöä raskauden aikana voi harkita, jos hoito on tarpeen.
Raskaana olevien diabeetikkonaisten tehostettua verenglukoosikontrollia ja hoidon seurantaa suositellaan yleisesti raskautta suunniteltaessa ja koko raskauden ajan. Insuliinin tarve yleensä vähenee raskauden ensimmäisen kolmanneksen aikana ja lisääntyy myöhemmin toisen ja kolmannen kolmanneksen aikana. Synnytyksen jälkeen insuliinin tarve tavallisesti palaa nopeasti ennen raskautta olleisiin arvoihin. Glukoosikontrollin huolellista seurantaa suositellaan ja insuliiniannosta on muutettava yksilöllisesti.
Imetys
Kliinistä kokemusta Tresiba-insuliinin käytöstä imetyksen aikana ei ole. Rotilla degludekinsuliini erittyi maitoon. Sen pitoisuus maidossa oli pienempi kuin plasmassa.
Ei tiedetä, erittyykö degludekinsuliini ihmisen rintamaitoon. Metabolisia vaikutuksia rintaruokituille vastasyntyneille/imeväisille ei ole odotettavissa.
Hedelmällisyys
Eläinten lisääntymistutkimuksissa degludekinsuliinilla ei ole havaittu olevan haittavaikutuksia hedelmällisyyteen.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Tällä lääkevalmisteella ei ole haitallista vaikutusta tai on vähäinen vaikutus ajokykyyn ja koneidenkäyttökykyyn. Potilaan keskittymis- ja reaktiokyky saattavat kuitenkin heikentyä hypoglykemian seurauksena. Tämä voi aiheuttaa vaaratilanteita silloin, kun keskittymis- ja reaktiokykyä erityisesti tarvitaan (esim. autolla ajo tai koneiden käyttö).
Potilaita on neuvottava ryhtymään varotoimiin hypoglykemian välttämiseksi ajon aikana. Tämä on erityisen tärkeää niille diabeetikoille, joiden tuntemukset hypoglykemiasta varoittavista oireista ovat vähentyneet tai puuttuvat tai joilla on usein ollut hypoglykemia. Tällaisissa tapauksissa autolla ajamisen tarkoituksenmukaisuutta on syytä harkita tarkkaan.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Hoidon aikana yleisimmin raportoitu haittavaikutus on hypoglykemia (ks. alla oleva kohta "Valikoitujen haittavaikutusten kuvaus").
Taulukoitu haittavaikutusluettelo
Alla olevassa luettelossa esitetyt haittavaikutukset perustuvat kliinisistä tutkimuksista saatuihin tietoihin ja ne on luokiteltu MedDRA:n elinjärjestelmäluettelon mukaan. Esiintymistiheydet on määritelty seuraavasti: hyvin yleinen (≥ 1/10); yleinen (≥ 1/100, < 1/10); melko harvinainen (≥ 1/1 000, < 1/100); harvinainen (≥ 1/10 000, < 1/1 000); hyvin harvinainen (< 1/10 000) ja tuntematon (koska saatavissa oleva tieto ei riitä arviointiin).
Elinjärjestelmäluokka | Esiintymistiheys | Haittavaikutus |
Immuunijärjestelmä | Harvinainen | Yliherkkyys Nokkosihottuma |
Aineenvaihdunta ja ravitsemus | Hyvin yleinen | Hypoglykemia |
Iho ja ihonalainen kudos | Melko harvinainen | Lipodystrofia |
Tuntematon | Ihoamyloidoosi† | |
Yleisoireet ja antopaikassa todettavat haitat | Yleinen | Pistoskohdan reaktiot |
Melko harvinainen | Perifeerinen turvotus |
† Myyntiintulon jälkeen ilmennyt lääkkeen aiheuttama haittavaikutus.
Tiettyjen haittavaikutusten kuvaus
Immuunijärjestelmä
Allergisia reaktioita voi esiintyä insuliinivalmisteita käytettäessä. Välitön allerginen reaktio joko insuliinille tai jollekin valmisteen apuaineelle saattaa olla hengenvaarallinen.
Tresiba-insuliinin käytön yhteydessä yliherkkyys (oireina kielen ja huulten turpoaminen, ripuli, pahoinvointi, väsymys ja kutina) ja nokkosihottuma olivat harvinaisia.
Hypoglykemia
Hypoglykemiaa saattaa esiintyä, jos insuliiniannos on liian suuri suhteessa insuliinin tarpeeseen. Vakava hypoglykemia saattaa johtaa tajuttomuuteen ja/tai aiheuttaa kouristuksia, tilapäisen tai pysyvän aivojen toimintahäiriön tai jopa kuoleman. Hypoglykemian oireet ilmaantuvat yleensä yllättäen. Oireisiin saattaa sisältyä kylmänhikisyys, kalpea ja viileä iho, uupumus, hermostuneisuus tai vapina, ahdistus, epätavallinen väsymys tai heikkous, sekavuus, keskittymisvaikeudet, uneliaisuus, kova nälkä, näköhäiriöt, päänsärky, pahoinvointi ja sydämentykytys.
Iho ja ihonalainen kudos
Lipodystrofiaa (mukaan lukien lipohypertrofiaa ja lipoatrofiaa) ja ihoamyloidoosia voi ilmaantua pistoskohtaan. Ne viivästyttävät insuliinin paikallista imeytymistä. Pistoskohdan jatkuva vuorottelu sovitulla pistosalueella saattaa vähentää tai ehkäistä näitä muutoksia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Pistoskohdan reaktiot
Tresiba-insuliinilla hoidetuilla potilailla esiintyi pistoskohdan reaktioita (mukaan lukien pistoskohdan hematooma, kipu, verenvuoto, eryteema, kyhmyt, turvotus, värinmuutos, kutina, lämpö ja pistoskohdan patti). Nämä oireet ovat yleensä lieviä ja ohimeneviä, ja ne tavallisesti häviävät hoitoa jatkettaessa.
Pediatriset potilaat
Tresiba-insuliinia on annettu enintään 18 vuoden ikäisille lapsille ja nuorille farmakokineettisten ominaisuuksien tutkimiseksi (ks. kohta Farmakokinetiikka). Teho ja turvallisuus on osoitettu pitkäaikaistutkimuksessa 1–alle 18-vuotiailla lapsilla. Haittavaikutusten esiintymistiheys, tyyppi ja vaikeusaste pediatrisilla potilailla ei viittaa eroavuuksiin verrattuna diabetesväestöön yleensä (ks. kohta Farmakodynamiikka).
Muut erityiset potilasryhmät
Kliinisissä tutkimuksissa iäkkäillä ja munuaisten tai maksan vajaatoimintaa sairastavilla potilailla havaittujen haittavaikutusten esiintymistiheys, tyyppi ja vaikeusaste ei ole eronnut väestössä yleensä havaituista haittavaikutuksista.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Insuliinin yliannostukselle ei ole olemassa erityistä määritelmää. Hypoglykemia saattaa kuitenkin kehittyä vaiheittain, jos potilas saa enemmän insuliinia kuin hän tarvitsee:
-
Lievä hypoglykemia voidaan hoitaa antamalla suun kautta rypälesokeria tai sokeria sisältäviä tuotteita. Siksi on suositeltavaa, että potilas pitää aina mukanaan rypälesokeria sisältäviä tuotteita.
- Vakava hypoglykemia, jolloin potilas ei pysty itse hoitamaan itseään, voidaan hoitaa antamalla glukagonia tai antamalla glukoosia laskimoon. Laskimonsisäisen glukoosin antaa terveydenhuollon ammattilainen. Glukoosia on annettava laskimoon, jos glukagonin antoon ei tule vastetta 10–15 minuutin kuluessa. On suositeltavaa, että tajunnan palattua potilaalle annetaan suun kautta hiilihydraatteja hypoglykemian uusiutumisen estämiseksi.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Diabeteslääkkeet. Insuliinit ja insuliinijohdokset, ylipitkävaikutteiset: ATC-koodi: A10AE06.
Vaikutusmekanismi
Degludekinsuliini sitoutuu ihmisinsuliinireseptoriin, joten farmakologiset vaikutukset ovat samat kuin ihmisinsuliinilla.
Insuliinin verenglukoosipitoisuutta alentava vaikutus perustuu glukoosin soluunoton helpottumiseen, kun insuliini sitoutuu lihas- ja rasvasolujen insuliinireseptoreihin, ja samanaikaiseen maksan glukoosin tuotannon estymiseen.
Farmakodynaamiset vaikutukset
Tresiba on perusinsuliini, joka ihonalaisena injektiona annettuna muodostaa liukenevia moniheksameereja. Tuloksena on varasto, josta degludekinsuliini imeytyy hitaasti ja tasaisesti verenkiertoon, jolloin Tresiba-insuliinin verenglukoosipitoisuutta alentava vaikutus on tasainen ja vakaa (katso kuva 1). Toisin kuin glargininsuliini kerran vuorokaudessa annettavan Tresiba-insuliinin verenglukoosipitoisuutta alentava vaikutus jakautui 24 tunnin ajanjakson aikana tasaisesti ensimmäisen ja toisen 12 tunnin ajalle (AUCGIR,0-12h,SS/AUCGIR,total,SS = 0,5).
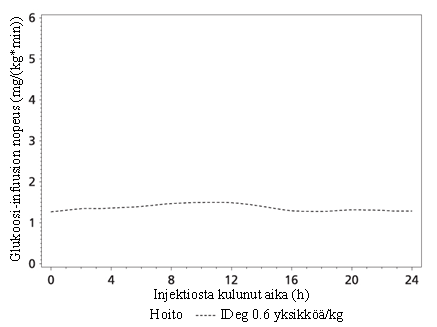
Kuva 1 Tasoitettu glukoosin infuusionopeusprofiili, vakaa tila – Keskimääräinen profiili 0–24 tuntia – IDeg 100 yksikköä/ml 0,6 yksikköä/kg – Tutkimus 1987
Tresiba-insuliinin vaikutus kestää yli 42 tuntia terapeuttisella annosalueella.
Vakaa tila saavutetaan 2–3 antopäivän jälkeen.
Vakaassa tilassa degludekinsuliinin verenglukoosipitoisuutta alentava vaikutus vaihtelee päivästä toiseen variaatiokertoimina ilmaistuna 20 % yhden 0–24 tunnin pituisen annosvälin aikana (AUCGIR,τ,SS), mikä on merkitsevästi vähemmän kuin glargininsuliinin (100 yksikköä/ml) kohdalla.
Tresiba-insuliinin verenglukoosipitoisuutta alentava kokonaisvaikutus lisääntyy lineaarisesti annosten kasvaessa.
Tresiba 100 yksikköä/ml- ja 200 yksikköä/ml -valmisteiden verenglukoosipitoisuutta alentavat kokonaisvaikutukset ovat keskenään verrannollisia saman annosmäärän annon jälkeen.
Tämän lääkevalmisteen farmakodynaamisessa vaikutuksessa ei havaittu kliinisesti merkitsevää eroa iäkkäiden ja nuorempien aikuispotilaiden välillä.
Kliininen teho ja turvallisuus
Suoritetut 11 monikansallista, 26 tai 52 viikon pituista kliinistä tutkimusta olivat kontrolloituja, avoimia, satunnaistettuja, rinnakkaisia hoitotavoitteeseen tähtääviä tutkimuksia, joissa Tresiba-valmistetta annettiin 4 275:lle potilaalle (1 102 henkilöllä oli tyypin 1 diabetes mellitus ja 3 173 henkilöllä tyypin 2 diabetes mellitus).
Avoimissa tutkimuksissa Tresiba-insuliinin vaikutus testattiin tyypin 1 diabetes mellitusta sairastavilla potilailla (Taulukko 2), potilailla joilla ei ole ollut aiempaa insuliinihoitoa (insuliinin aloitus, tyypin 2 diabetes mellitus, Taulukko 3) ja aiemmin insuliinia käyttäneillä potilailla (insuliinin tehostus, tyypin 2 diabetes mellitus, Taulukko 4) sekä kiinteää että joustavaa annostusajankohtaa käyttäen (Taulukko 5), ja HbA1c:n pieneneminen lähtötasosta tutkimuksen päättymisen tasoon oli vähintään samanarvoinen. Tämä vahvistettiin kaikissa tutkimuksissa kaikkia vertailuvalmisteita vastaan (detemirinsuliini ja glargininsuliini (100 yksikköä/ml)). Kun HbA1c:n paraneminen oli vähintään samanarvoinen muihin insuliinivalmisteisiin verrattuna, niin sitagliptiiniin verrattuna Tresiba pienensi tilastollisesti merkitsevästi enemmän HbA1c-arvoa (Taulukko 4).
Seitsemän avoimen, hoitotavoitteeseen tähtäävän varmistustutkimuksen etukäteen suunnitellussa meta-analyysissä tyypin 1 ja tyypin 2 diabetes mellitusta sairastavilla potilailla Tresiba-hoidon aikana esiintyi vähemmän vahvistettuja hypoglykemiatapahtumia (ennen kaikkea tyypin 2 diabetes mellitus -potilaat, katso taulukko 1) ja yöllisiä vahvistettuja hypoglykemiatapahtumia glargininsuliiniin (100 yksikköä/ml) verrattuna (annostus valmisteyhteenvedon mukaisesti). Glargininsuliinihoitoon verrattuna Tresiba-hoidolla hypoglykemiatapahtumat vähenivät alemmalla keskimääräisellä paastoplasman glukoositasolla (FPG).
Taulukko 1 Hypoglykemiaa käsittelevän meta-analyysin tulokset
| Vahvistettu hypoglykemiaa | ||
| Arvioitu riskisuhde (degludekinsuliini/glargininsuliini) | Yhteensä | Yölliset |
| Tyypin 1 + tyypin 2 diabetes mellitus (yhdistetty) | 0,91* | 0,74* |
| Ylläpitovaihe b | 0,84* | 0,68* |
| Iäkkäät potilaat ≥65 vuotta | 0,82 | 0,65* |
| Tyypin 1 diabetes mellitus | 1,10 | 0,83 |
| Ylläpitovaihe b | 1,02 | 0,75* |
| Tyypin 2 diabetes mellitus | 0,83* | 0,68* |
| Ylläpitovaihe b | 0,75* | 0,62* |
| Vain perusinsuliinihoito potilailla, joilla ei aiempaa insuliinihoitoa | 0,83* | 0,64* |
*Tilastollisesti merkitsevä a Vahvistetun hypoglykemiatapahtuman määritelmä oli se, että vahvistettu plasman glukoosipitoisuus oli < 3,1 mmol/l tai että potilas tarvitsi ulkopuolista apua. Yöllinen vahvistettu hypoglykemia määritelty tapahtumaksi, joka ilmeni keskiyön ja klo 6.00 välillä. b Tapahtumat viikosta 16 eteenpäin
Pitkäaikaisen Tresiba-hoidon jälkeen ei ole havaittu kliinisesti merkittävää insuliinin vasta-aineiden muodostusta.
Taulukko 2 Avointen kliinisten tutkimusten tulokset tyypin 1 diabetes mellitusta sairastavilla
| 52 hoitoviikkoa | 26 hoitoviikkoa | |||
| Tresiba1 | Glargininsuliini (100 yksikköä/ml)1 | Tresiba1 | Detemirinsuliini1 | |
| N | 472 | 157 | 302 | 153 |
| HbA1c(%) | ||||
| Tutkimuksen päättyessä | 7,3 | 7,3 | 7,3 | 7,3 |
| Keskimääräinen muutos | -0,40 | -0,39 | -0,73 | -0,65 |
| Ero: -0,01 [-0,14; 0,11] | Ero: -0,09[-0,23; 0,05] | |||
| FPG (mmol/l) | ||||
| Tutkimuksen päättyessä | 7,8 | 8,3 | 7,3 | 8,9 |
| Keskimääräinen muutos | -1,27 | -1,39 | -2,60 | -0,62 |
| Ero: -0,33 [-1,03; 0,36] | Ero: -1,66 [-2,37; -0,95] | |||
| Hypoglykemian esiintyvyys (potilasaltistusvuotta kohti) | ||||
| Vakava | 0,21 | 0,16 | 0,31 | 0,39 |
| Vahvistettu2 | 42,54 | 40,18 | 45,83 | 45,69 |
| Suhde: 1,07 [0,89; 1,28] | Suhde: 0,98 [0,80; 1,20] | |||
| Yöllinen vahvistettu2 | 4,41 | 5,86 | 4,14 | 5,93 |
| Suhde: 0,75 [0,59; 0,96] | Suhde: 0,66 [0,49; 0,88] | |||
1 Annostus kerran vuorokaudessa + aspartinsuliini kattamaan aterianaikaisen insuliinitarpeen.
2 Vahvistetun hypoglykemiatapahtuman määritelmä oli se, että vahvistettu plasman glukoosipitoisuus oli < 3,1 mmol/l tai että potilas tarvitsi ulkopuolista apua. Yöllinen vahvistettu hypoglykemia määritelty tapahtumaksi, joka ilmeni keskiyön ja klo 6.00 välillä.
Taulukko 3 Avointen kliinisten tutkimusten tulokset tyypin 2 diabetes mellitusta sairastavilla potilailla, joilla ei aiempaa insuliinihoitoa (insuliinin aloitus)
| 52 hoitoviikkoa | 26 hoitoviikkoa | |||
| Tresiba1 | Glargininsuliini (100 yksikköä/ml)1 | Tresiba1 | Glargininsuliini (100 yksikköä/ml)1 | |
| N | 773 | 257 | 228 | 229 |
| HbA1c (%) | ||||
| Tutkimuksen päättyessä | 7,1 | 7,0 | 7,0 | 6,9 |
| Keskimääräinen muutos | -1,06 | -1,19 | -1,30 | -1,32 |
| Ero: 0,09 [-0,04; 0,22] | Ero: 0,04 [-0,11; 0,19] | |||
| FPG (mmol/l) | ||||
| Tutkimuksen päättyessä | 5,9 | 6,4 | 5,9 | 6,3 |
| Keskimääräinen muutos | -3,76 | -3,30 | -3,70 | -3,38 |
| Ero: -0,43 [-0,74; -0,13] | Ero: -0,42 [-0,78; -0,06] | |||
| Hypoglykemian esiintyvyys (potilasaltistusvuotta kohti) | ||||
| Vakava | 0 | 0,02 | 0 | 0 |
| Vahvistettu2 | 1,52 | 1,85 | 1,22 | 1,42 |
| Suhde: 0,82 [0,64; 1,04] | Suhde: 0,86 [0,58; 1,28] | |||
| Yöllinen vahvistettu2 | 0,25 | 0,39 | 0,18 | 0,28 |
| Suhde: 0,64 [0,42; 0,98] | Suhde: 0,64 [0,30; 1,37] | |||
1 Annostus kerran vuorokaudessa + metformiini ± DPP-4-estäjä.
2 Vahvistetun hypoglykemiatapahtuman määritelmä oli se, että vahvistettu plasman glukoosipitoisuus oli < 3,1 mmol/l tai että potilas tarvitsi ulkopuolista apua. Yöllinen vahvistettu hypoglykemia määritelty tapahtumaksi, joka ilmeni keskiyön ja klo 6.00 välillä.
Taulukko 4 Avointen kliinisten tutkimusten tulokset tyypin 2 diabetes mellitusta sairastavilla: vasemmalla – perusinsuliinia aiemmin käyttäneet, oikealla – potilaat, joilla ei aiempaa insuliinihoitoa
| 52 hoitoviikkoa | 26 hoitoviikkoa | |||
| Tresiba1 | Glargininsuliini (100 yksikköä/ml)1 | Tresiba2 | Sitagliptiini2 | |
| N | 744 | 248 | 225 | 222 |
| HbA1c(%) | ||||
| Tutkimuksen päättyessä | 7,1 | 7,1 | 7,2 | 7,7 |
| Keskimääräinen muutos | -1,17 | -1,29 | -1,56 | -1,22 |
| Ero: 0,08 [-0,05; 0,21] | Ero: -0,43 [-0,61; -0,24] | |||
| FPG (mmol/l) | ||||
| Tutkimuksen päättyessä | 6,8 | 7,1 | 6,2 | 8,5 |
| Keskimääräinen muutos | -2,44 | -2,14 | -3,22 | -1,39 |
| Ero: -0,29 [-0,65; 0,06] | Ero: -2,17 [-2,59; -1,74] | |||
| Hypoglykemian esiintyvyys (potilasaltistusvuotta kohti) | ||||
| Vakava hypoglykemia | 0,06 | 0,05 | 0,01 | 0 |
| Vahvistettu3 | 11,09 | 13,63 | 3,07 | 1,26 |
| Suhde: 0,82 [0,69; 0,99] | Suhde: 3,81 [2,40; 6,05] | |||
| Yöllinen vahvistettu3 | 1,39 | 1,84 | 0,52 | 0,30 |
| Suhde: 0,75 [0,58; 0,99] | Suhde: 1,93 [0,90; 4,10] | |||
1 Annostus kerran vuorokaudessa + aspartinsuliini kattamaan aterianaikaisen insuliinitarpeen ± metformiini ± pioglitatsoni
2 Annostus kerran vuorokaudessa ± metformiini sulfonyyliurea/glinidi ± pioglitatsoni
3 Vahvistetun hypoglykemiatapahtuman määritelmä oli se, että vahvistettu plasman glukoosipitoisuus oli < 3,1 mmol/l tai että potilas tarvitsi ulkopuolista apua. Yöllinen vahvistettu hypoglykemia määritelty tapahtumaksi, joka ilmeni keskiyön ja klo 6.00 välillä.
Taulukko 5 Avointen kliinisen tutkimuksen tulokset Tresiba-insuliinia joustavasti annosteltaessa tyypin 2 diabetes mellitusta sairastavilla
| 26 hoitoviikkoa | ||||
| Tresiba1 | Tresiba Flex2 | Glargininsuliini (100 yksikköä/ml)3 | ||
| N | 228 | 229 | 230 | |
| HbA1c (%) | ||||
| Tutkimuksen päättyessä | 7,3 | 7,2 | 7,1 | |
| Keskimääräinen muutos | -1,07 | -1,28 | -1,26 | |
| Ero: -0,13 [-0,29; 0,03]5 | Ero: 0,04 [-0,12; 0,20] | |||
| FPG (mmol/l) | ||||
| Tutkimuksen päättyessä | 5,8 | 5,8 | 6,2 | |
| Keskimääräinen muutos lähtötasosta | -2,91 | -3,15 | -2,78 | |
| Ero: -0,05 [-0,45; 0,35]5 | Ero: -0,42 [-0,82; -0,02] | |||
| Hypoglykemian esiintyvyys (potilasaltistusvuotta kohden) | ||||
| Vakava | 0,02 | 0,02 | 0,02 | |
| Vahvistettu4 | 3,63 | 3,64 | 3,48 | |
| Suhde: 1,10 [0,79; 1,52]6 | Suhde: 1,03 [0,75; 1,40] | |||
| Yöllinen vahvistettu4 | 0,56 | 0,63 | 0,75 | |
| Suhde: 1,18 [0,66; 2,12]6 | Suhde: 0,77 [0,44; 1,35] | |||
1 Annostus kerran vuorokaudessa (iltapääaterian yhteydessä) + yksi tai kaksi seuraavista oraalisista diabeteslääkkeistä: SU, metformiini tai DPP-4-estäjä.
2 Annostus joustavasti kerran vuorokaudessa (annosväli noin 8–40 tuntia) + yksi tai kaksi seuraavista oraalisista diabeteslääkkeistä: SU, metformiini tai DPP-4-estäjä.
3 Annostus kerran vuorokaudessa + yksi tai kaksi seuraavista oraalisista diabeteslääkkeistä: SU, metformiini tai DPP-4-estäjä.
4 Vahvistetun hypoglykemiatapahtuman määritelmä oli se, että vahvistettu plasman glukoosipitoisuus oli < 3,1 mmol/l tai että potilas tarvitsi ulkopuolista apua. Yöllinen vahvistettu hypoglykemia määritelty tapahtumaksi, joka ilmeni keskiyön ja klo 6.00 välillä.
5 Hoitoryhmien ero: Tresiba Flex - Tresiba
6 Hoitoryhmien suhde: Tresiba Flex/Tresiba
104 viikkoa kestäneessä kliinisessä tutkimuksessa tyypin 2 diabetes potilaat hoidettiin Tresiba -insuliinilla (degludekinsuliini) yhdessä metformiinin kanssa. Tänä aikana 57 % potilaista saavutti tavoitteena olleen HbA1c -arvon < 7,0 %. Jäljelle jääneet potilaat jatkoivat 26 viikkoa kestäneessä avoimessa tutkimuksessa, jossa potilaat satunnaistettiin lisäämään hoitoon liraglutidi tai yksi aspartinsuliiniannos (suurimmalla aterialla). Degludekinsuliini + liraglutidi -haarassa insuliiniannosta pienennettiin 20 % hypoglykemiariskin minimoimiseksi. Liraglutidin lisääminen hoitoon pienensi tilastollisesti merkitsevästi enemmän HbA1c -arvoa (-0,73 % liraglutidilla vs -0,40 % vertailuvalmisteella, arvioidut keskiarvot) ja painoa (-3,03 vs 0,72 kg, arvioidut keskiarvot). Hypoglykemiatapahtumien määrä (potilasaltistusvuotta kohden) oli tilastollisesti merkitsevästi vähäisempi lisättäessä hoitoon liraglutidi kuin lisättäessä hoitoon yksi aspartinsuliiniannos (1,0 vs 8,15; suhde: 0,13; 95 % CI: 0,08–0,21).
Lisäksi tehtiin kaksi 64 viikon kontrolloitua, kaksoissokkoutettua, satunnaistettua, vaihtovuoroista, hoitotavoitteeseen tähtäävää tutkimusta potilailla, joilla oli vähintään yksi hypoglykemian riskitekijä. Potilailla oli tyypin 1 diabetes mellitus (501 potilasta) tai tyypin 2 diabetes mellitus (721 potilasta). Heidät satunnaistettiin saamaan joko Tresiba-valmistetta tai glargininsuliinia (100 yksikköä/ml) vaihtovuoroisesti. Tutkimuksissa arvioitiin hypoglykemioiden määrää Tresiba-hoidossa verrattuna glargininsuliinihoitoon (100 yksikköä/ml) (ks. taulukko 6).
Taulukko 6 Tulokset kaksoissokkoutetuista, vaihtovuoroisista kliinisistä tutkimuksista tyypin 1 ja tyypin 2 diabetes mellitusta sairastavilla potilailla
| Tyypin 1 diabetes mellitus | Tyypin 2 diabetes mellitus | |||
| Tresiba1 | Glargininsuliini (100 yksikköä/ml)1 | Tresiba2 | Glargininsuliini (100 yksikköä/ml)2 | |
| N | 501 | 721 | ||
| HbA1c(%) | ||||
| Lähtötilanne | 7,6 | 7,6 | ||
| Tutkimuksen päättyessä | 6,9 | 6,9 | 7,1 | 7,0 |
| FPG (mmol/l) | ||||
| Lähtötilanne | 9,4 | 7,6 | ||
| Tutkimuksen päättyessä | 7,5 | 8,4 | 6,0 | 6,1 |
| Vakavien hypoglykemioiden määrä3 | ||||
| Ylläpitojakso4 | 0,69 | 0,92 | 0,05 | 0,09 |
| Suhde: 0,65 [0,48; 0,89] | Suhde: 0,54 [0,21; 1,42] | |||
| Vakavien tai verenglukoosista vahvistettujen,oireisten hypoglykemioiden määrä3,5 | ||||
| Ylläpitojakso4 | 22,01 | 24,63 | 1,86 | 2,65 |
| Suhde: 0,89 [0,85; 0,94] | Suhde: 0,70 [0,61; 0,80] | |||
| Vakavien tai verenglukoosista vahvistettujen, oireisten yöllisten hypoglykemioiden määrä3.5 | ||||
| Ylläpitojakso4 | 2,77 | 4,29 | 0,55 | 0,94 |
| Suhde: 0,64 [0,56; 0,73] | Suhde: 0,58 [0,46; 0,74] | |||
1 Annostus kerran päivässä + aspartinsuliini kattamaan aterianaikaisen insuliinin tarpeen
2 Annostus kerran päivässä ± OAD:t (mikä tahansa yhdistelmä metformiinia, dipeptidyylipeptidaasi 4:n estäjää, alfaglukosidaasin estäjää, tiatsolidiinidioneja ja natriumin- ja glukoosinkuljettajaproteiini 2:n estäjää)
3 Potilasaltistusvuotta kohti
4 Tapahtumat viikolta 16 alkaen jokaisessa hoitojaksossa
5 Verenglukoosista vahvistettu, oireinen hypoglykemia oli määritelty tapahtumaksi, jossa plasman glukoosiarvon on vahvistettu olleen alle 3,1 mmol/l ja jossa oireet olivat yhteneväisiä hypoglykemian kanssa. Yöllinen vahvistettu hypoglykemia oli määritelty tapahtumaksi, joka ilmeni keskiyön ja klo 6.00 välillä
Sydän- ja verisuonivaikutusten arviointi
DEVOTE oli satunnaistettu, kaksoissokkoutettu ja tapahtumaperusteinen (event-driven) kliininen tutkimus, jonka mediaanikestoaika oli 2 vuotta ja jossa verrattiin Tresiba-valmisteen sydän- ja verisuoniturvallisuutta glargininsuliiniin (100 yksikköä/ml) 7 637 potilaalla, joilla oli tyypin 2 diabetes mellitus ja korkea riski sydän- ja verisuonitapahtumille.
Ensisijainen päätetapahtuma oli aika satunnaistamisesta ensimmäiseen kolmekohtaiseen vakavaan sydän- ja verisuonihaittatapahtumaan (major adverse cardiovascular event, MACE): sydän- ja verisuonikuolema, ei-fataali sydäninfarkti tai ei-fataali aivohaveri. Tutkimus oli suunniteltu vertailukelpoisuustutkimukseksi (non-inferiority trial), jossa suljettiin pois etukäteen määritetty 1,3:n riskimarginaali MACE:n riskisuhteelle (hazard ratio, HR), verraten Tresiba-valmistetta glargininsuliiniin. Tresiba-valmisteen sydän- ja verisuoniturvallisuus verrattuna glargininsuliiniin (HR 0,91 [0,78; 1,06]) vahvistettiin (kuva 2).
Alaryhmistä (esim. sukupuoli, diabeteksen kesto, sydän- ja verisuonitautien riskiryhmä ja aiempi insuliinityyppi) saadut tulokset olivat linjassa ensisijaisten päätetapahtumien kanssa.
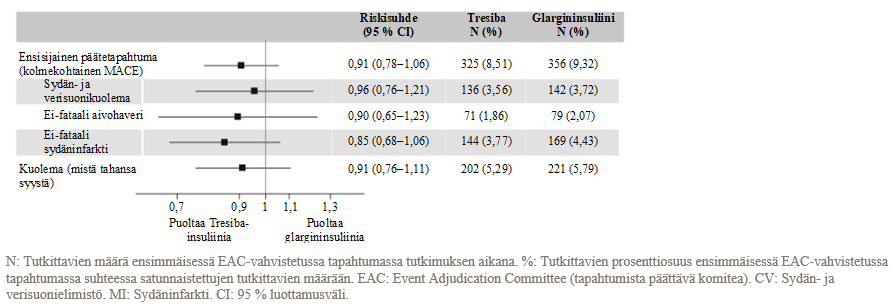
Kuva 2 DEVOTE-tutkimuksen yhdistetyn kolmekohtaisen MACE-tapahtuman ja yksilöllisten sydän- ja verisuonipäätetapahtumien Forest plot -analyysi
Lähtötilanteessa HbA1c oli molemmissa hoitoryhmissä 8,4 % ja 2 vuoden kuluttua HbA1c oli molemmissa, Tresiba- ja glargininsuliini-ryhmissä, 7,5 %.
Tresiba oli glargininsuliinia parempi mitä tulee vakavien hypoglykemioiden vähäiseen määrään ja pienempään osuuteen tutkittavista, jotka kokivat vakavia hypoglykemioita. Yöllisten, vakavien hypoglykemioiden määrä oli merkitsevästi pienempi Tresiba-valmisteella kuin glargininsuliinilla (taulukko 7).
Taulukko 7 DEVOTE-tutkimuksen tulokset
| Tresiba1 | Glargininsuliini (100 yksikköä/ml)1 | |
| N | 3,818 | 3,819 |
| Hypoglykemian aste (100 potilasseurantavuotta kohden) | ||
| Vakava | 3,70 | 6,25 |
| Ilmaantuvuussuhde: 0,60 [0,48; 0,76] | ||
| Yöllinen vakava2 | 0,65 | 1,40 |
| Ilmaantuvuussuhde: 0,47 [0,31; 0,73] | ||
| Osuus potilaista, joilla oli hypoglykemia (prosenttia potilaista) | ||
| Vakava | 4,9 | 6,6 |
| Kerroinsuhde: 0,73 [0,60; 0,89] | ||
1 Diabeteksen ja sydän- ja verisuonitautien standardihoidon lisänä
2 Yöllinen vakava hypoglykemia oli määritelty tapahtumaksi, joka ilmeni keskiyön ja klo 6.00 välillä.
Raskaus
Tresiba-valmistetta on tutkittu avoimessa, satunnaistetussa, aktiivikontrolloidussa kliinisessä tutkimuksessa, jossa tyypin I diabetes mellitusta sairastavia raskaana olevia naisia hoidettiin perus-bolus-hoito-ohjelmalla siten, että Tresiba-valmistetta (92 naista) tai detemirinsuliinia (96 naista) käytettiin perusinsuliinina, molempia yhdistelmähoitona aspartinsuliinin kanssa ateriainsuliinina (EXPECT-tutkimus).
Tresiba oli vähintään samanveroinen (non-inferior) detemirinsuliinin kanssa HbA1c -arvon perusteella mitattuna viimeisellä suunnitellulla HbA1c -arvon mittauskäynnillä ennen synnytystä gestaatioviikon 16 jälkeen. Hoitoryhmien välillä ei myöskään havaittu eroja glykeemisen kontrollin osalta (muutos HbA1c -arvossa, FPG- ja PPG-arvossa) raskauden aikana.
Tresiba-valmisteen ja detemirinsuliinin välillä ei havaittu kliinisesti merkittäviä eroja äidin turvallisuuspäätetapahtumien osalta: hypoglykemia, ennenaikainen synnytys ja raskauden aikaiset haittatapahtumat. Pre-eklampsiaa raportoitiin 12 Tresiba-hoitoa saaneella tutkittavalla (13,2 %) ja 7 detemirinsuliinihoitoa saaneella tutkittavalla (7,4 %). Ei-suunniteltua keisarinleikkausta raportoitiin 23 Tresiba-hoitoa saaneella tutkittavalla (25,3 %) ja 15 detemirinsuliinihoitoa saaneella tutkittavalla (16,0 %). Suurin osa molemmissa ryhmissä raportoiduista haittatapahtumista oli ei-vakavia ja vaikeusasteeltaan lieviä. Ne eivät todennäköisesti liittyneet tutkimusvalmisteeseen ja niiden lopputuloksena oli ”toipunut/hälvennyt”. Tutkimukseen satunnaistetuilla tutkittavilla ei raportoitu kuolemia.
Perinataalisia tai neonataalisia kuolemia ei raportoitu. Tresiba-valmisteen ja determirinsuliinin välillä ei havaittu kliinisesti merkittäviä eroja raskauden päätetapahtumien osalta (varhainen sikiökuolema, merkittävien poikkeavuuksien esiintyminen, vastasyntyneen hypoglykemia, perinataalinen kuolleisuus, neonataalinen kuolleisuus, sikiön makrosomia, suuri koko gestaatioikään nähden ja lapsella ilmenevät haittatapahtumat synnytyksen jälkeisten 30 vuorokauden aikana).
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset Tresiba-valmisteen käytöstä seuraavien potilasryhmien hoidossa:
- Vastasyntyneet ja alle 12 kuukauden ikäiset tyypin 1 diabetes mellitusta sairastavat pikkulapset ja alle 10 vuoden ikäiset tyypin 2 diabetes mellitusta sairastavat lapset, sillä perusteella että sairaus tai tila, johon kyseinen lääkevalmiste on tarkoitettu, ei esiinny kyseisessä pediatrisessa ryhmässä (ks. kohta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Tresiba-valmisteen tehoa ja turvallisuutta on tutkittu tyypin 1 diabetes mellitusta sairastavilla lapsilla ja nuorilla 1:1 satunnaistetussa, kontrolloidussa kliinisessä tutkimuksessa, joka kesti 26 viikkoa (n=350) ja jota seurasi 26 viikon lisäjakso (n=280). Tresiba-ryhmässä potilaina oli 43 iältään 1–5-vuotiasta lasta, 70 iältään 6–11-vuotiasta lasta ja 61 iältään 12–17-vuotiasta nuorta. Kerran päivässä annetulla Tresiba-valmisteella oli samanlainen HbA1c-arvon lasku viikolla 52 ja suurempi paastoplasma-arvon lasku lähtöarvosta kuin vertailuvalmiste detemirinsuliinilla, jota annettiin kerran tai kaksi kertaa päivässä. Nämä tulokset saatiin detemirinsuliiniin verrattuna 30 % pienemmillä päivittäisillä Tresiba-annoksilla. Vakavien hypoglykemioiden (ISPAD määritelmä: 0,51 vs. 0,33), vahvistettujen hypoglykemioiden (57,71 vs. 54,05) ja yöllisten vahvistettujen hypoglykemioiden (6,03 vs. 7,60) määrät (tapahtumaa per potilasaltistusvuosi) Tresiba-insuliinilla olivat vertailukelpoisia detemirinsuliiniin nähden. Molemmissa hoitoryhmissä 6–11-vuotiailla lapsilla oli lukumääräisesti suurempi vahvistettujen hypoglykemioiden määrä kuin muissa ikäryhmissä. 6–11-vuotiailla lapsilla havaittiin Tresiba-hoitoryhmässä lukumääräisesti suurempi määrä vakavia hypoglykemioita. Sellaisten hyperglykemioiden määrä, joissa esiintyi ketoosia, oli merkitsevästi pienempi Tresiba-valmisteella (0,68) kuin detemirinsuliinilla (1,09). Tresiba-insuliinilla ei todettu haittavaikutuksiin eikä tavallisiin turvallisuusparametreihin liittyviä turvallisuusongelmia. Vasta-aineiden kehittyminen oli harvinaista eikä sillä ollut kliinistä merkitystä. Tyypin 2 diabetes mellitusta sairastavia nuoria potilaita koskevat tiedot turvallisuudesta ja tehosta on ekstrapoloitu tyypin 1 diabetes mellitusta sairastavien nuorten ja aikuisten potilaiden ja tyypin 2 diabetes mellitusta sairastavien aikuispotilaiden tiedoista. Tulokset tukevat Tresiba-insuliinin käyttöä tyypin 2 diabetes mellitusta sairastaville nuorille potilaille.
Farmakokinetiikka
Imeytyminen
Ihonalaisen injektion jälkeen muodostuu liukenevia ja vakaita moniheksameereja, jotka muodostavat insuliinivaraston ihonalaiseen kudokseen. Degludekinsuliinin monomeerit irtoavat vähitellen moniheksameereista, jolloin degludekinsuliini imeytyy hitaasti ja tasaisesti verenkiertoon.
Vakaan tilan pitoisuus seerumissa saavutetaan, kun Tresiba-insuliinia on annettu päivittäin 2–3 päivän ajan.
Kerran vuorokaudessa annettavan degludekinsuliinin altistus jakautui 24 tunnin ajanjakson aikana tasaisesti ensimmäisen ja toisen 12 tunnin ajalle. AUCIDeg,0-12h,SS:n ja AUCIDeg,τ,SS:n välinen suhde oli 0,5.
Jakautuminen
Degludekinsuliinin sitoutuminen seerumin albumiiniin vastaa yli 99 %:ista sitoutumista plasman proteiineihin ihmisen plasmassa.
Biotransformaatio
Degludekinsuliini hajoaa samalla tavoin kuin ihmisinsuliini. Kaikki muodostuvat metaboliitit ovat inaktiivisia.
Eliminaatio
Tresiba-insuliinin puoliintumisaika ihon alle annetun pistoksen jälkeen määräytyy sen mukaan, miten nopeasti insuliini imeytyy ihonalaiskudoksesta. Tresiba-insuliinin puoliintumisaika on noin 25 tuntia annoksesta riippumatta.
Lineaarisuus
Kokonaisaltistus on suhteessa ihon alle annettuun annokseen terapeuttisella annosalueella. Suorassa vertailussa biologisen samanarvoisuuden vaatimukset täyttyivät Tresiba 100 yksikköä/ml:n ja Tresiba 200 yksikköä/ml:n kohdalla (perustuen AUCIDeg,τ,SS- ja Cmax, IDeg,SS-arvoihin).
Sukupuoli
Tämän lääkevalmisteen farmakokineettisissä ominaisuuksissa ei ole eroja sukupuolten välillä.
Iäkkäät, rotu, munuaisten ja maksan vajaatoiminta
Degludekinsuliinin farmakokinetiikassa ei havaittu eroa iäkkäiden ja nuorempien aikuispotilaiden välillä, eri rotujen välillä tai terveiden henkilöiden ja munuaisten tai maksan vajaatoimintaa sairastavien potilaiden välillä.
Pediatriset potilaat
Degludekinsuliinin farmakokineettiset ominaisuudet 1–11-vuotiaiden lasten ja 12–18-vuotiaiden nuorten elimistöissä olivat vakaan tilan vaiheessa verrannollisia tyypin 1 diabetes mellitusta sairastavissa aikuisissa havaittuihin farmakokineettisiin ominaisuuksiin. Kokonaisaltistus yhden annoksen jälkeen oli kuitenkin korkeampi lapsilla ja nuorilla kuin aikuisilla tyypin 1 diabetes mellituksessa.
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta, karsinogeenisuutta ja lisääntymistoksisuutta koskevien tutkimusten tulosten perusteella ei ole huolta turvallisuudesta ihmisillä.
Degludekinsuliinin mitogeenisen ja metabolisen vaikutuksen suhde on verrattavissa ihmisinsuliiniin.
Farmaseuttiset tiedot
Apuaineet
Glyseroli
Metakresoli
Fenoli
Sinkkiasetaatti
Kloorivetyhappo (pH:n säätöön)
Natriumhydroksidi (pH:n säätöön)
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Tresiba-valmisteeseen lisätyt aineet saattavat aiheuttaa degludekinsuliinin hajoamista.
Tresiba-insuliinia ei saa lisätä infuusionesteisiin.
Kestoaika
30 kuukautta.
Tresiba 100 yksikköä/ml FlexTouch injektioneste, liuos, esitäytetty kynä
Ensimmäisen avaamisen jälkeen tai mukana kuljetettava varakynä: lääkevalmistetta voi säilyttää enintään 8 viikon ajan. Säilytä alle 30°C. Voidaan säilyttää jääkaapissa (2°C - 8°C). Pidä kynän suojus paikoillaan. Herkkä valolle.
Tresiba 200 yksikköä/ml FlexTouch injektioneste, liuos, esitäytetty kynä
Ensimmäisen avaamisen jälkeen tai mukana kuljetettava varakynä: lääkevalmistetta voi säilyttää enintään 8 viikon ajan. Säilytä alle 30°C. Voidaan säilyttää jääkaapissa (2°C - 8°C). Pidä kynän suojus paikoillaan. Herkkä valolle.
Tresiba 100 yksikköä/ml Penfill injektioneste, liuos, sylinteriampulli
Ensimmäisen avaamisen jälkeen tai mukana kuljetettava varasylinteriampulli: lääkevalmistetta voi säilyttää enintään 8 viikon ajan. Säilytä alle 30°C. Ei saa säilyttää jääkaapissa. Pidä sylinteriampullit ulkopakkauksessa. Herkkä valolle.
Säilytys
Tresiba 100 yksikköä/ml FlexTouch injektioneste, liuos, esitäytetty kynä
Ennen ensimmäistä käyttöä:
Säilytä jääkaapissa (2°C - 8°C). Ei saa jäätyä.
Älä säilytä lähellä jääkaapin pakastelokeroa tai takaseinän jäähdytyselementtiä.
Pidä kynän suojus paikoillaan. Herkkä valolle.
Tresiba 200 yksikköä/ml FlexTouch injektioneste, liuos, esitäytetty kynä
Ennen ensimmäistä käyttöä:
Säilytä jääkaapissa (2°C - 8°C). Ei saa jäätyä.
Älä säilytä lähellä jääkaapin pakastelokeroa tai takaseinän jäähdytyselementtiä.
Pidä kynän suojus paikoillaan. Herkkä valolle.
Tresiba 100 yksikköä/ml Penfill injektioneste, liuos, sylinteriampulli
Ennen ensimmäistä käyttöä:
Säilytä jääkaapissa (2°C - 8°C). Ei saa jäätyä.
Älä säilytä lähellä jääkaapin pakastelokeroa tai takaseinän jäähdytyselementtiä.
Pidä sylinteriampullit ulkopakkauksessa. Herkkä valolle.
Avatun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
TRESIBA injektioneste, liuos, esitäytetty kynä
100 U/ml (L:ei) 5 x 3 ml (FlexTouch) (65,33 €)
200 U/ml (L:ei) 3 x 3 ml (FlexTouch) (77,09 €)
TRESIBA injektioneste, liuos, sylinteriampulli
100 U/ml (L:ei) 5 x 3 ml (Penfill) (65,33 €)
PF-selosteen tieto
Tresiba 100 yksikköä/ml FlexTouch injektioneste, liuos, esitäytetty kynä
3 ml liuosta sylinteriampullissa (tyypin 1 lasia), joka sisältää halobutyylistä valmistetun kumimännän ja halobutyylistä/polyisopreenista valmistetun laminoidun kumisulkimen. Sylinteriampulli on esitäytetyssä, kertakäyttöisessä, polypropeenista valmistetussa moniannoskynässä.
Pakkauskoot: 1 (neulojen kanssa tai ilman), 5 (ilman neuloja) ja monipakkaus, joka sisältää 10 (2 pakkausta, joissa 5 kynää) (ilman neuloja) esitäytettyä kynää.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Tresiba 200 yksikköä/ml FlexTouch injektioneste, liuos, esitäytetty kynä
3 ml liuosta sylinteriampullissa (tyypin 1 lasia), joka sisältää halobutyylistä valmistetun kumimännän ja halobutyylistä/polyisopreenista valmistetun laminoidun kumisulkimen. Sylinteriampulli on esitäytetyssä, kertakäyttöisessä, polypropeenista valmistetussa moniannoskynässä.
Pakkauskoot: 1 (neulojen kanssa tai ilman), 2 (ilman neuloja), 3 (ilman neuloja), 5 (ilman neuloja) ja monipakkaus, joka sisältää 6 (2 pakkausta, joissa 3 kynää) (ilman neuloja) esitäytettyä kynää.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Tresiba 100 yksikköä/ml Penfill injektioneste, liuos, sylinteriampulli
Kotelossa on 3 ml liuosta sisältävä sylinteriampulli (tyypin 1 lasia), joka sisältää halobutyylistä valmistetun kumimännän ja halobutyylistä/polyisopreenista valmistetun laminoidun kumisulkimen.
Pakkauskoot: 5 ja 10 sylinteriampullia.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Kirkas, väritön, neutraali liuos.
Käyttö- ja käsittelyohjeet
Tämä lääkevalmiste on tarkoitettu vain henkilökohtaiseen käyttöön. Sitä ei saa täyttää uudelleen.
Tresiba-insuliinia ei saa käyttää, jos liuos ei ole kirkasta ja väritöntä.
Jäätynyttä Tresiba-insuliinia ei saa käyttää.
Aina ennen jokaista käyttöä on kiinnitettävä uusi neula. Neuloja ei saa käyttää uudelleen. Potilaan on hävitettävä neula jokaisen pistoksen jälkeen.
Jos neula on tukossa, potilaan pitää seurata pakkausselosteen mukana tulevissa käyttöohjeissa kuvattuja ohjeita.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Katso yksityiskohtaiset käyttöohjeet pakkausselosteesta.
Tresiba-esitäytettyjä kyniä on kahta vahvuutta. Kynän etikettiin ja pakkaukseen on selvästi merkitty ”Tresiba 100 yksikköä/ml” tai ”Tresiba 200 yksikköä/ml”.
Tresiba 100 yksikköä/ml FlexTouch injektioneste, liuos, esitäytetty kynä
Tresiba 100 yksikköä/ml pakkaus ja etiketti ovat vaaleanvihreitä.
Esitäytetty kynä on suunniteltu käytettäväksi enintään 8 mm:n pituisten NovoFine/NovoTwist-injektioneulojen kanssa. Sillä voi valita 1–80 yksikön annoksia yhden yksikön välein. Esitäytetyn kynän mukana tulevia yksityiskohtaisia käyttöohjeita on noudatettava.
Tresiba 200 yksikköä/ml FlexTouch injektioneste, liuos, esitäytetty kynä
Tresiba 200 yksikköä/ml pakkaus ja etiketti ovat tummanvihreitä ja niissä on raitoja ja punainen laatikko korostamassa valmisteen vahvuutta.
Esitäytetty kynä on suunniteltu käytettäväksi enintään 8 mm:n pituisten NovoFine/NovoTwist-injektioneulojen kanssa. Sillä voi valita 2–160 yksikön annoksia kahden yksikön välein. Esitäytetyn kynän mukana tulevia yksityiskohtaisia käyttöohjeita on noudatettava.
Tresiba 100 yksikköä/ml Penfill injektioneste, liuos, sylinteriampulli
Sylinteriampulli on suunniteltu käytettäväksi Novo Nordiskin antolaitteiden (kestokäyttöiset laitteet toistuvaan käyttöön, eivät sisälly pakkaukseen) ja enintään 8 mm:n pituisten NovoFine/NovoTwist-injektioneulojen kanssa. Antolaitteen mukana tulevia yksityiskohtaisia käyttöohjeita on noudatettava.
Korvattavuus
TRESIBA injektioneste, liuos, esitäytetty kynä
100 U/ml 5 x 3 ml
200 U/ml 3 x 3 ml
TRESIBA injektioneste, liuos, sylinteriampulli
100 U/ml 5 x 3 ml
- Ylempi erityiskorvaus (100 %). Diabetes, insuliinihoito (103).
- Peruskorvaus (40 %).
ATC-koodi
A10AE06
Valmisteyhteenvedon muuttamispäivämäärä
26.06.2025
Yhteystiedot
 NOVO NORDISK FARMA OY
NOVO NORDISK FARMA OY Linnoitustie 6
02600 Espoo
020 762 5300
www.novonordisk.fi
