VAGIPREV depotlääkevalmiste, emättimeen 0,120/0,015 mg/24 h
 Lääketurva
Lääketurva
Riskienminimointimateriaalit
Lääkäri
Tarkistuslista lääkkeen määrääjille
Potilas
Potilasopas: kysymyksiä ja vastauksia
Vaikuttavat aineet ja niiden määrät
Vagiprev sisältää 8,25 mg etonogestreelia ja 2,60 mg etinyyliestradiolia. Emätinrenkaasta vapautuu keskimäärin 0,120 mg etonogestreelia ja 0,015 mg etinyyliestradiolia vuorokaudessa 3 viikon ajan.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Depotlääkevalmiste, emättimeen
Kliiniset tiedot
Käyttöaiheet
Raskauden ehkäisy.
Vagiprev on tarkoitettu fertiili-ikäisille naisille. Teho ja turvallisuus on tutkittu 18–40‑vuotiailla naisilla.
Vagiprev‑valmisteen määräämistä koskevassa päätöksessä on otettava huomioon valmisteen käyttäjän nykyiset riskitekijät, erityisesti laskimotromboembolian (VTE) riskitekijät, ja millainen Vagiprev‑käytön VTE:n riski on verrattuna muiden yhdistelmäehkäisyvalmisteiden (CHC) riskeihin (ks. kohdat Vasta-aiheet ja Varoitukset ja käyttöön liittyvät varotoimet).
Annostus ja antotapa
Annostus
Jotta ehkäisyteho saavutetaan, Vagiprev‑valmistetta on käytettävä ohjeiden mukaan (ks. ”Miten Vagiprev‑valmistetta käytetään” ja ”Käytön aloittaminen”).
Pediatriset potilaat
Vagiprev‑valmisteen turvallisuutta ja tehoa alle 18‑vuotiailla nuorilla ei ole tutkittu.
Antotapa
MITEN VAGIPREV‑VALMISTETTA KÄYTETÄÄN
Nainen voi itse asettaa Vagiprev‑renkaan emättimeen. Lääkärin tulee neuvoa potilaalle Vagiprev‑renkaan asetus ja poisto. Rengas asetetaan mukavimmalta tuntuvassa asennossa, esim. seisten toinen jalka kohotettuna, kyykyssä tai selinmakuulla. Vagiprev puristetaan kokoon ja viedään emättimeen niin syvälle, että se ei tunnu. Vagiprev‑renkaan tarkalla sijainnilla emättimessä ei ole merkitystä ehkäisytehon kannalta (ks. kuvat 1–4).
Kun Vagiprev on asetettu paikalleen (ks. ”Käytön aloittaminen”), se jätetään emättimeen yhtäjaksoisesti kolmeksi viikoksi. Naisia on neuvottava tarkistamaan säännöllisesti Vagiprev‑valmisteen paikallaan olo emättimessä (esim. ennen yhdyntää ja sen jälkeen). Jos Vagiprev epähuomiossa poistuu emättimestä, naisen pitää seurata kohdassa Annostus ja antotapa ”Jos rengas on väliaikaisesti poissa emättimestä” annettuja ohjeita (lisätietoa myös kohdassa Varoitukset ja käyttöön liittyvät varotoimet ”Ekspulsio”). Vagiprev on poistettava 3 viikon käytön jälkeen samana viikonpäivänä kuin se asetettiin. Viikon tauon jälkeen asetetaan uusi rengas (esim. jos Vagiprev on asetettu paikalleen keskiviikkona noin klo 22.00, se poistetaan 3 viikon kuluttua keskiviikkona noin klo 22.00. Uusi rengas asetetaan seuraavana keskiviikkona). Vagiprev poistetaan koukistamalla etusormi renkaan reunan alle tai tarttumalla reunaan etu- ja keskisormella ja vetämällä rengas ulos (ks. kuva 5). Käytetty rengas pannaan pussiinsa (ei saa jättää lasten eikä kotieläinten ulottuville) ja hävitetään kohdassa Käyttö- ja käsittelyohjeet kuvatulla tavalla. Tyhjennysvuoto alkaa yleensä 2–3 päivän kuluttua Vagiprev‑renkaan poistamisesta ja saattaa jatkua vielä, kun on aika asettaa uusi rengas.
Käyttö muiden emättimeen asetettavien ehkäisyvalmisteiden kanssa
Vagiprev voi vaikeuttaa tiettyjen muiden emättimeen asetettavien ehkäisyvalmisteiden oikeaa paikoilleenasettamista, esim. emättimeen tai kohdunkaulaan asetettavat ehkäisykupit tai naisten kondomi. Näitä ehkäisyvälineitä ei tulisi käyttää Vagiprev-valmisteen lisäksi.
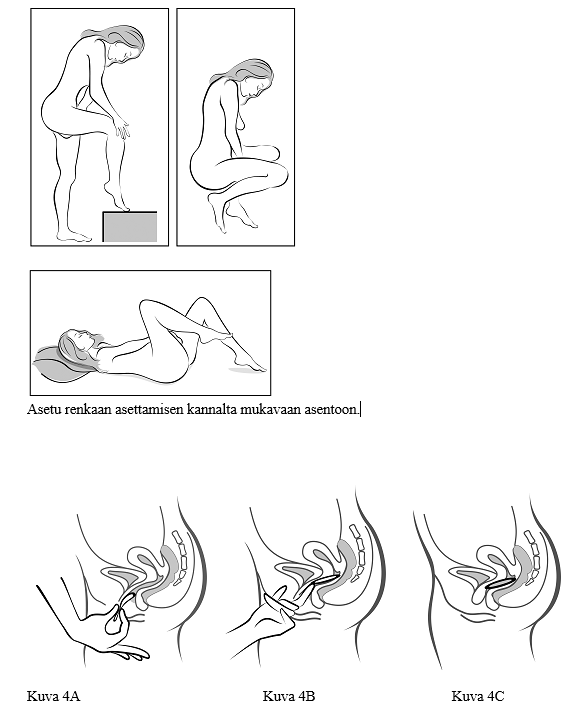
Vie rengas toisella kädellä emättimeen (kuva 4A). Tarvittaessa voit levittää häpyhuulia toisella kädellä. Työnnä rengas emättimeen niin syvälle, ettei se tunnu (kuva 4B). Jätä rengas emättimeen 3 viikoksi (kuva 4C).
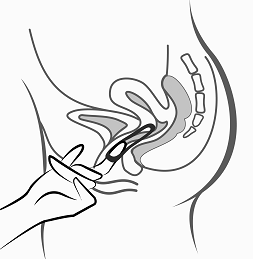
Kuva 5: Poista Vagiprev koukistamalla etusormi renkaan reunan alle tai tarttumalla reunaan etu- ja keskisormella ja vetämällä rengas ulos.
KÄYTÖN ALOITTAMINEN
Ei edeltävää hormonaalista ehkäisyä edellisen kierron aikana:
Vagiprev pitää asettaa paikalleen naisen luonnollisen kuukautiskierron 1. päivänä (eli ensimmäisenä vuotopäivänä). Vagiprev‑valmisteen voi asettaa kierron 2.–5. päivänä, mutta tällöin ensimmäisen kierron 7 ensimmäisen käyttöpäivän ajaksi suositellaan lisäksi jonkin estemenetelmän käyttöä.
Vaihto hormonaalisesta yhdistelmäehkäisyvalmisteesta Vagiprev‑valmisteeseen:
Vagiprev pitää asettaa viimeistään aiemman hormonaalisen yhdistelmäehkäisyvalmisteen tavanomaisen tablettitauon, laastaritauon tai lumetablettijakson päättymistä seuraavana päivänä.
Mikäli aiempaa menetelmää on käytetty johdonmukaisesti ja oikein ja on kohtuullisen varmaa, että nainen ei ole raskaana, voi aiemmasta hormonaalisesta yhdistelmäehkäisyvalmisteesta siirtyä Vagiprev‑valmisteeseen myös syklin minä tahansa muuna päivänä.
Aiemman menetelmän hormoniton ajanjakso ei saa koskaan ylittää sen suositeltua pituutta.
Vaihto pelkkää progestiinia sisältävästä ehkäisyvalmisteesta (minipilleristä, implantaatista tai injektiosta) tai progestiinia vapauttavasta kohdunsisäisestä ehkäisimestä (IUS, intrauterine system) Vagiprev‑valmisteeseen:
Minipilleristä voidaan siirtyä käyttämään Vagiprev‑valmistetta koska tahansa (implantaatista tai kohdunsisäisestä ehkäisimestä niiden poistopäivänä ja injektiosta seuraavana suunniteltuna injektiopäivänä), mutta kaikissa em. tapauksissa naisen pitäisi Vagiprev‑valmisteeseen siirryttyään lisäksi käyttää jotain estemenetelmää renkaan 7 ensimmäisen käyttöpäivän ajan.
Ensimmäisellä raskauskolmanneksella tapahtuneen raskauden keskeytymisen jälkeen:
Käyttö voidaan aloittaa heti. Muita ehkäisymenetelmiä ei tällöin tarvita. Jos käytön aloittaminen heti ei ole suotavaa, noudatetaan kohdassa ”Ei edeltävää hormonaalista ehkäisyä edellisen kierron aikana” annettuja ohjeita. Siihen asti naista pitää kehottaa käyttämään jotain muuta ehkäisymenetelmää.
Synnytyksen tai toisella raskauskolmanneksella tapahtuneen raskauden keskeytymisen jälkeen:
Käyttö imetyksen aikana, katso kohta Raskaus ja imetys.
Renkaan käyttö aloitetaan neljännellä viikolla synnytyksen tai toisella raskauskolmanneksella tapahtuneen raskauden keskeytymisen jälkeen. Jos käyttö aloitetaan myöhemmin, tulee Vagiprev‑renkaan 7 ensimmäisen käyttöpäivän aikana käyttää lisäksi jotain estemenetelmää. Jos nainen on jo ollut yhdynnässä, on raskaus suljettava pois tai odotettava seuraavien kuukautisten alkamista ennen Vagiprev‑valmisteen käytön aloittamista.
KÄYTTÖOHJEISTA POIKKEAMINEN
Valmisteen ehkäisyteho ja syklikontrolli voivat heikentyä, jos käyttöohjeita ei noudateta. Jos ohjeista on poikettu, on ehkäisytehon säilymisen varmistamiseksi noudatettava seuraavia ohjeita:
• Jos tauko renkaan vaihdon yhteydessä on ollut liian pitkä
Uusi rengas pitää asettaa heti muistettaessa. Lisäksi seuraavien 7 päivän ajan pitää käyttää jotain estemenetelmää, esim. kondomia. Jos nainen on ollut yhdynnässä tauon aikana, raskauden mahdollisuus on otettava huomioon. Raskauden mahdollisuus on sitä suurempi, mitä pitempi tauko renkaan käytössä on ollut.
• Jos rengas on väliaikaisesti poissa emättimestä
Vagiprev‑valmisteen annetaan olla paikallaan emättimessä yhtäjaksoisesti kolmen viikon ajan. Jos rengas epähuomiossa poistuu emättimestä, pitää se viileällä tai haalealla (ei kuumalla) vedellä huuhtelun jälkeen asettaa välittömästi uudelleen paikalleen.
Jos Vagiprev on poissa emättimestä alle 3 tuntia, sen ehkäisyteho ei heikkene. Rengas pitää asettaa takaisin mahdollisimman pian, viimeistään 3 tunnin sisällä.
Jos Vagiprev on ollut tai sen epäillään olleen poissa emättimestä yli 3 tuntia ensimmäisen tai toisen käyttöviikon aikana, ehkäisyteho on voinut heikentyä. Rengas pitää asettaa takaisin heti muistettaessa ja jotain estemenetelmää, esim. kondomia, on käytettävä kunnes Vagiprev‑valmistetta on käytetty yhtäjaksoisesti 7 päivää. Mitä kauemmin Vagiprev on ollut poissa emättimestä ja mitä lähempänä on Vagiprev‑valmisteen käytössä pidettävä tauko, sitä suurempi on raskauden mahdollisuus.
• Jos Vagiprev on ollut tai sen epäillään olleen poissa emättimestä yli 3 tuntia kolmannen käyttöviikon aikana, ehkäisyteho on voinut heikentyä. Naisen on otettava ehkäisyrengas pois emättimestä ja valittava toinen seuraavista kahdesta vaihtoehdosta:
-
Aseta uusi rengas välittömästi.
Huomaa: Uuden renkaan asettaminen aloittaa seuraavan kolmen viikon käyttöjakson. Edellisen kierron tyhjennysvuoto voi jäädä tulematta. Kuitenkin läpäisyvuotoa tai tiputteluvuotoa voi esiintyä. -
Odota tyhjennysvuotoa ja aseta uusi rengas viimeistään 7 päivän (7 x 24 tuntia) kuluttua edellisen renkaan poistamisesta tai siitä, kun rengas tuli epähuomiossa ulos emättimestä.
Huomaa: Tämä tulee valita ainoastaan, jos rengasta on käytetty yhtäjaksoisesti edellisten 7 päivän ajan.
Jos Vagiprev on ollut poissa emättimestä tuntemattoman ajan, on raskauden mahdollisuus otettava huomioon. Ennen uuden renkaan asettamista on tehtävä raskaustesti.
• Jos renkaan käyttö on kestänyt liian pitkään
Vaikka ei ole suositeltavaa pidentää käyttöä yli kolmen viikon, ehkäisyteho on yhä riittävä, jos Vagiprev‑valmistetta on käytetty enintään 4 viikkoa. Käyttäjä voi pitää viikon tauon ja asettaa sen jälkeen uuden renkaan. Jos Vagiprev on ollut emättimessä yli 4 viikkoa, ehkäisyteho voi olla heikentynyt, ja raskaus on suljettava pois ennen uuden Vagiprev‑renkaan asettamista.
Jos käyttäjä ei ole noudattanut käyttöohjeita eikä seuraavan käyttötauon aikana tule tyhjennysvuotoa, raskaus on suljettava pois ennen uuden Vagiprev‑renkaan asettamista emättimeen.
KUINKA MUUTTAA KUUKAUTISTEN ALKAMISPÄIVÄÄ TAI SIIRTÄÄ KUUKAUTISIA
Jos poikkeuksellisesti naisen on siirrettävä kuukautisiaan, hänen pitää aloittaa uuden renkaan käyttö ilman taukoa. Seuraavaa rengasta voidaan käyttää taas enintään 3 viikkoa. Tällöin voi esiintyä läpäisy- tai tiputteluvuotoa. Vagiprev‑valmisteen säännöllinen käyttö aloitetaan uudestaan tavanomaisen viikon tauon jälkeen.
Jos käyttäjä haluaa muuttaa kuukautisten alkamispäivää nykyisestä joksikin toiseksi viikonpäiväksi, häntä voidaan neuvoa lyhentämään seuraavaa käyttötaukoa niin monella päivällä kuin hän haluaa. Mitä lyhempi tauko sitä suurempi riski, että tyhjennysvuotoa ei tule ja että seuraavan renkaan käytön aikana esiintyy läpäisy- ja tiputteluvuotoa.
Vasta-aiheet
Yhdistelmäehkäisyvalmisteita ei pidä käyttää seuraavien tilojen yhteydessä. Jos jokin näistä tiloista ilmenee ensimmäistä kertaa Vagiprev‑valmisteen käytön aikana, rengas on poistettava heti.
-
Laskimotromboembolia (VTE) tai sen riski
- laskimotromboembolia – tällä hetkellä esiintyvä VTE (potilas antikoagulanttilääkityksellä) tai anamneesissa VTE (esim. syvä laskimotromboosi [SLT] tai keuhkoembolia)
- tiedossa oleva perinnöllinen tai hankittu laskimotromboembolia‑alttius, kuten APC‑resistenssi, (mukaan lukien faktori V Leiden), antitrombiini III:n puutos, C‑proteiinin puutos, S‑proteiinin puutos
- suuri leikkaus ja siihen liittyvä pitkittynyt immobilisaatio (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
- useiden riskitekijöiden aiheuttama suuri laskimotromboembolian riski (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
-
Valtimotromboembolia (ATE) tai sen riski
- valtimotromboembolia – tällä hetkellä esiintyvä tai aiemmin esiintynyt valtimotromboembolia (esim. sydäninfarkti) tai sitä ennakoiva tila (esim. angina pectoris)
- aivoverisuonisairaus – tällä hetkellä esiintyvä tai aiemmin esiintynyt aivohalvaus tai sitä ennakoiva tila (esim. ohimenevä aivoverenkiertohäiriö, TIA)
- tiedossa oleva perinnöllinen tai hankittu valtimotromboembolia-alttius, kuten hyperhomokysteinemia ja fosfolipidivasta-aineet (kardiolipiinivasta-aineet, lupusantikoagulantti)
- anamneesissa migreeni, johon liittyy fokaalisia neurologisia oireita
- monista riskitekijöistä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) tai yhden vakavan riskitekijän esiintymisestä johtuva suuri valtimotromboemboliariski. Näitä riskitekijöitä voivat olla:
- diabetes, jossa esiintyy verisuonioireita
- vaikea hypertensio
- vaikea dyslipoproteinemia
- Haimatulehdus tai aikaisempi haimatulehdus, jos siihen liittyi vakava hypertriglyseridemia
- Vaikea maksasairaus, nykyinen tai aiemmin ilmennyt, niin kauan kuin maksa-arvot eivät ole palautuneet normaaleiksi
- Nykyinen tai aiemmin ilmennyt hyvän- tai pahanlaatuinen maksakasvain
- Todetut tai oletetut sukupuolielinten tai rintojen maligniteetit, joihin sukupuolihormonit vaikuttavat
- Vaginaverenvuoto, jonka syytä ei ole selvitetty
- Yliherkkyys vaikuttaville aineille tai jollekin kohdassa Apuaineet mainitulle Vagiprev‑valmisteen apuaineelle.
Vagiprev‑valmistetta ei saa käyttää samanaikaisesti ombitasviirin, paritapreviirin ja ritonaviirin yhdistelmää ja dasabuviiria, glekapreviirin ja pibrentasviirin yhdistelmää tai sofosbuviirin, velpatasviirin ja voksilapreviirin yhdistelmää sisältävien lääkevalmisteiden kanssa (ks. kohta Yhteisvaikutukset).
Varoitukset ja käyttöön liittyvät varotoimet
VAROITUKSET
Vagiprev‑valmisteen soveltuvuudesta on keskusteltava käyttäjän kanssa, jos hänellä esiintyy mikä tahansa alla mainituista tiloista tai riskitekijöistä.
Jos jokin näistä tiloista tai riskitekijöistä pahenee tai ilmenee ensimmäisen kerran, käyttäjää on kehotettava ottamaan yhteys lääkäriin, joka päättää, pitääkö Vagiprev‑valmisteen käyttö keskeyttää.
1. Verenkiertohäiriöt
Laskimotromboembolian (VTE) riski
• Minkä tahansa yhdistelmäehkäisyvalmisteen käyttö lisää laskimotromboembolian (VTE) riskiä verrattuna siihen, että tällaista valmistetta ei käytetä lainkaan. Levonorgestreelia, norgestimaattia tai noretisteronia sisältäviin valmisteisiin liittyy pienin VTE:n riski. Tämä riski voi olla jopa kaksinkertainen muilla valmisteilla, kuten esimerkiksi Vagiprev‑valmisteella. Päätöksen muun kuin VTE:n riskiltään pienimmän valmisteen käyttämisestä saa tehdä vain sen jälkeen, kun ehkäisyä harkitsevan naisen kanssa on keskusteltu. Keskustelussa on varmistettava, että hän ymmärtää Vagiprev‑valmisteen käyttöön liittyvän VTE:n riskin, miten hänen nykyiset riskitekijänsä vaikuttavat tähän riskiin ja että hänen VTE:n riskinsä on suurimmillaan ensimmäisen vuoden aikana, jona hän käyttää yhdistelmäehkäisyvalmistetta ensimmäistä kertaa elämässään. On myös jonkin verran näyttöä siitä, että riski suurenee, kun yhdistelmäehkäisyvalmisteen käyttö aloitetaan uudelleen vähintään 4 viikon tauon jälkeen.
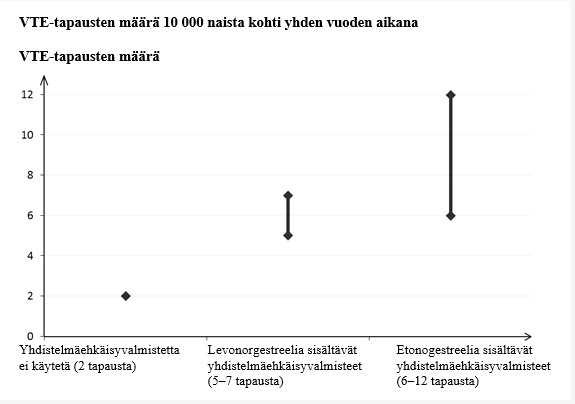
• Noin kahdelle naiselle 10 000:sta, jotka eivät käytä yhdistelmäehkäisyvalmistetta eivätkä ole raskaana, kehittyy VTE yhden vuoden aikana. Yksittäisellä naisella tämä riski voi kuitenkin olla suurempi riippuen hänen omista, taustalla vaikuttavista riskitekijöistä (ks. jäljempänä).
• Arviolta noin kuudelle1 naiselle 10 000:sta, jotka käyttävät levonorgestreelia sisältävää pieniannoksista yhdistelmäehkäisyvalmistetta, kehittyy VTE vuoden aikana. Etonogestreelia/etinyyliestradiolia sisältävän renkaan käyttöön liittyvästä VTE:n riskistä on saatu ristiriitaisia tuloksia verrattuna levonorgestreelia sisältävien yhdistelmäehkäisyvalmisteiden käyttöön (suhteellisen riskin arviot vaihtelevat siitä, ettei kasvua ole (RR = 0,96) lähes 2-kertaiseen kasvuun (RR = 1,90)). Tämä vastaa noin 6–12 VTE-tapausta vuodessa jokaista 10 000 etonogestreelia/etinyyliestradiolia sisältävää rengasta käyttävää naista kohden.
• Molemmissa tapauksissa VTE‑tapausten määrä vuotta kohti on pienempi kuin määrä, joka on odotettavissa naisilla raskauden aikana tai synnytyksen jälkeisenä aikana.
• VTE saattaa aiheuttaa kuoleman 1–2 %:ssa tapauksista.
1Vaihteluvälin 5–7 keskipiste 10 000 naisvuotta kohden, mikä perustuu levonorgestreelia sisältävien yhdistelmäehkäisyvalmisteiden käytön suhteelliseen riskiin verrattuna käyttämättömyyteen, jolloin riski on noin 2,3–3,6.
• Yhdistelmäehkäisyvalmisteiden käyttäjillä tromboosia on erittäin harvoin raportoitu esiintyneen muissa verisuonissa (esim. maksan, suoliliepeen, munuaisten tai verkkokalvon laskimoissa ja valtimoissa).
Laskimotromboembolian riskitekijät
Yhdistelmäehkäisyvalmisteiden käyttäjillä esiintyvien laskimotromboembolisten komplikaatioiden riski voi suurentua huomattavasti, jos naisella on muita riskitekijöitä, erityisesti jos riskitekijöitä on useita (ks. taulukko).
Vagiprev‑valmiste on vasta-aiheinen naisella, jolla on useita riskitekijöitä, jotka aiheuttavat suuren VTE:n riskin (ks. kohta Vasta-aiheet). Jos naisella on useampi kuin yksi riskitekijä, nämä yhdessä voivat muodostaa yksittäisten tekijöiden summaa suuremman riskin – tässä tapauksessa VTE:n kokonaisriski on otettava huomioon. Jos hyöty–riski-suhteen katsotaan olevan negatiivinen, yhdistelmäehkäisyvalmistetta ei pidä määrätä (ks. kohta Vasta-aiheet).
Taulukko: Laskimotromboembolian riskitekijät
Riskitekijä | Kommentti |
Ylipaino (painoindeksi yli 30 kg/m2) | Riski suurenee huomattavasti painoindeksin noustessa. Huomioitava erityisesti silloin, jos muita riskitekijöitä on myös olemassa. |
Pitkittynyt immobilisaatio, suuri leikkaus, kaikki jalkojen tai lantion alueen leikkaukset, neurokirurgia tai merkittävä trauma Huomioitavaa: väliaikainen immobilisaatio, mukaan lukien > 4 tunnin lentomatka, voi myös olla VTE:n riskitekijä, erityisesti naisilla, joilla on myös muita riskitekijöitä. | Näissä tilanteissa on suositeltavaa lopettaa laastarin/tabletin/renkaan käyttö (elektiivisen leikkauksen kohdalla vähintään neljä viikkoa etukäteen), eikä sitä pidä jatkaa ennen kuin käyttäjä on ollut kaksi viikkoa täysin liikuntakykyinen. Jotain muuta raskaudenehkäisymenetelmää on käytettävä ei‑toivotun raskauden ehkäisemiseksi. Antitromboottista hoitoa on harkittava, ellei Vagiprev‑valmisteen käyttöä ole lopetettu etukäteen. |
Positiivinen sukuanamneesi (tämänhetkinen tai aikaisempi VTE sisaruksella tai vanhemmalla, etenkin suhteellisen nuorella iällä, esim. alle 50‑vuotiaana) | Jos perinnöllistä alttiutta epäillään, potilas on syytä ohjata erikoislääkärin tutkimuksiin ennen kuin minkään yhdistelmäehkäisyvalmisteen käytöstä päätetään. |
Muut laskimotromboemboliaan liitetyt sairaudet | Syöpä, systeeminen lupus erythematosus, hemolyyttisureeminen oireyhtymä, krooninen tulehduksellinen suolistosairaus (Crohnin tauti tai haavainen koliitti) ja sirppisoluanemia. |
Ikääntyminen | Erityisesti yli 35 vuoden ikä. |
- Suonikohjujen ja pinnallisen laskimontukkotulehduksen mahdollisesta yhteydestä laskimotromboosin alkamiseen tai etenemiseen ei ole yksimielisyyttä.
- Laskimotromboembolian suurempi riski raskauden ja erityisesti synnytyksen jälkeisten noin 6 viikon aikana on otettava huomioon (ks. lisätiedot raskaudesta ja imetyksestä kohdasta Raskaus ja imetys).
Laskimotromboembolian oireet (syvä laskimotromboosi ja keuhkoembolia)
Jos oireita ilmaantuu, naisia on neuvottava hakeutumaan välittömästi lääkärin hoitoon ja kertomaan, että he käyttävät yhdistelmäehkäisyvalmistetta.
Syvän laskimotromboosin (SLT) oireita voivat olla:
- toisen jalan ja/tai jalkaterän turvotus tai turvotus jalan laskimon kohdalla
- jalan kipu tai arkuus, joka saattaa tuntua vain seistessä tai kävellessä
- jalan lisääntynyt lämmöntunne, jalan ihon värin muutos tai punoitus.
Keuhkoembolian oireita voivat olla:
- äkillisesti alkanut, selittämätön hengenahdistus tai nopeutunut hengitys
- äkillinen yskä, johon saattaa liittyä veriysköksiä
- pistävä rintakipu
- vaikea pyörrytys tai huimaus
- nopea tai epäsäännöllinen sydämen syke.
Jotkut näistä oireista (esim. hengenahdistus, yskä) ovat epäspesifisiä, ja ne voidaan tulkita virheellisesti yleisluontoisemmiksi tai vähemmän vaikeiksi tapahtumiksi (esim. hengitystieinfektioksi).
Muita verisuonitukoksen merkkejä voivat olla mm.: äkillinen kipu, turvotus ja sinertävä värimuutos raajassa.
Jos tukos tulee silmään, oireena voi olla esim. kivuton näön hämärtyminen, joka voi edetä näön menetykseen. Joskus näön menetys voi tapahtua lähes välittömästi.
Valtimotromboembolian (ATE) riski
Epidemiologisissa tutkimuksissa on osoitettu, että yhdistelmäehkäisyvalmisteiden käyttöön liittyy suurentunut valtimotromboembolian (sydäninfarkti) tai aivoverisuonitapahtuman (esim. aivojen ohimenevä verenkiertohäiriö (TIA), aivohalvaus) riski. Valtimotromboemboliset tapahtumat voivat johtaa kuolemaan.
Valtimotromboembolian (ATE) riskitekijät
Valtimotromboembolisten komplikaatioiden tai aivoverisuonitapahtuman riski yhdistelmäehkäisyvalmisteen käyttäjillä on korkeampi niillä naisilla, joilla on riskitekijöitä (ks. taulukko).
Vagiprev‑valmiste on vasta-aiheinen, jos naisella on joko yksi vakava tai useampia ATE:n riskitekijöitä, mikä aiheuttaa suuren valtimotromboemboliariskin (ks. kohta Vasta-aiheet). Jos naisella on useampi kuin yksi riskitekijä, nämä yhdessä voivat muodostaa yksittäisten tekijöiden summaa suuremman riskin – tässä tapauksessa kokonaisriski on otettava huomioon. Jos hyöty–riski-suhteen katsotaan olevan negatiivinen, yhdistelmäehkäisyvalmistetta ei pidä määrätä (ks. kohta Vasta-aiheet).
Taulukko: Valtimotromboembolian (ATE) riskitekijät
Riskitekijä | Kommentti |
Ikääntyminen | Erityisesti yli 35 vuoden ikä. |
Tupakointi | Yhdistelmäehkäisyvalmistetta käyttäviä naisia on neuvottava olemaan tupakoimatta. Yli 35‑vuotiaita, tupakoimista jatkavia naisia on vakavasti kehotettava käyttämään jotakin muuta ehkäisymenetelmää. |
Korkea verenpaine | |
Ylipaino (painoindeksi yli 30 kg/m2) | Riski suurenee huomattavasti painoindeksin noustessa. Erityisen tärkeää naisilla, joilla on muitakin riskitekijöitä. |
Positiivinen sukuanamneesi (tämänhetkinen tai aikaisempi valtimotromboembolia sisaruksella tai vanhemmalla, etenkin suhteellisen nuorella iällä, esim. alle 50‑vuotiaana). | Jos perinnöllistä alttiutta epäillään, potilas on syytä ohjata erikoislääkärin tutkimuksiin, ennen kuin minkään yhdistelmäehkäisyvalmisteen käytöstä päätetään. |
Migreeni | Migreenin esiintymistiheyden kasvu tai vaikeusasteen lisääntyminen (mikä saattaa olla aivoverisuonitapahtumaa ennakoiva oire) yhdistelmäehkäisyvalmisteen käytön aikana voi olla syy yhdistelmäehkäisyvalmisteen käytön välittömään keskeyttämiseen. |
Muut verisuoniston haittatapahtumiin liitetyt sairaudet | Diabetes, hyperhomokysteinemia, sydämen läppävika ja eteisvärinä, dyslipoproteinemia ja systeeminen lupus erythematosus (SLE). |
Valtimotromboembolian (ATE) oireet
Jos oireita ilmaantuu, naisia on neuvottava hakeutumaan välittömästi lääkärin hoitoon ja kertomaan, että he käyttävät yhdistelmäehkäisyvalmistetta.
Aivoverisuonitapahtuman oireita voivat olla:
- kasvojen, käsivarren tai jalan äkillinen tunnottomuus tai heikkous (varsinkin vain yhdellä puolella vartaloa esiintyvä)
- äkillinen kävelyn vaikeutuminen, huimaus, tasapainon tai koordinaation menetys
- äkillinen sekavuus, puhe- tai ymmärtämisvaikeudet
- äkillinen näön heikentyminen yhdessä tai molemmissa silmissä
- äkillinen, voimakas tai pitkittynyt päänsärky, jonka syytä ei tiedetä
- tajunnan menetys tai pyörtyminen, johon saattaa liittyä kouristuskohtaus.
Ohimenevät oireet viittaavat siihen, että tapahtuma on ohimenevä aivoverenkiertohäiriö (TIA).
Sydäninfarktin oireita voivat olla:
- kipu, epämiellyttävä tunne, paineen tunne, painon tunne, puristuksen tai täysinäisyyden tunne rinnassa, käsivarressa tai rintalastan takana
- selkään, leukaan, kurkkuun, käsivarteen ja/tai vatsaan säteilevä epämiellyttävä tunne
- täyteläisyyden, ruoansulatushäiriöiden tai tukehtumisen tunne
- hikoilu, pahoinvointi, oksentelu tai huimaus
- erittäin voimakas heikkouden tunne, ahdistuneisuus tai hengenahdistus
- nopea tai epäsäännöllinen sydämen syke.
- Epäiltäessä laskimo- tai valtimotromboemboliaa tai diagnoosin varmistuttua yhdistelmäehkäisyvalmisteiden käyttö on lopetettava. Antikoagulanttihoidon (kumariinit) teratogeenisyyden vuoksi on tällöin aloitettava asianmukaisen ehkäisymenetelmän käyttö.
2. Kasvaimet
• Epidemiologiset tutkimukset osoittavat, että pitkäaikainen oraalisten ehkäisyvalmisteiden käyttö on riskitekijä kohdunkaulasyövän kehittymiselle naisilla, joilla on ihmisen papilloomavirus (HPV). On kuitenkin epävarmaa, missä määrin tähän havaintoon vaikuttavat sekoittavat tekijät (esim. eroavuudet sukupuolikumppanien lukumäärässä ja estemenetelmien käytössä). Kohdunkaulasyövän riskistä Vagiprev‑valmisteen käytön yhteydessä ei ole epidemiologisia tutkimuksia (ks. kohta ”Lääkärintarkastus”).
• Meta-analyysi 54 epidemiologisesta tutkimuksesta osoitti, että yhdistelmäehkäisytablettien tämänhetkisten käyttäjien suhteellinen rintasyöpäriski on hieman suurentunut (suhteellinen riskikerroin 1,24) ja että tämä riski häviää vähitellen 10 vuoden kuluessa yhdistelmäehkäisytablettien käytön loputtua. Koska rintasyöpä on harvinainen alle 40‑vuotiailla naisilla, parhaillaan yhdistelmäehkäisytabletteja käyttävillä tai hiljattain niitä käyttäneillä havaittu rintasyöpädiagnoosien ylimäärä on pieni verrattuna yleiseen rintasyöpäriskiin. Ehkäisytablettien käyttäjillä diagnosoidut rintasyöpätapaukset ovat yleensä kliinisesti varhaisemmassa vaiheessa kuin ehkäisytabletteja käyttämättömillä diagnosoidut rintasyöpätapaukset. Havaittu riskin suureneminen voi johtua rintasyövän varhaisemmasta diagnoosista yhdistelmäehkäisytablettien käyttäjillä, yhdistelmäehkäisytablettien biologisista vaikutuksista tai molemmista.
• Joskus harvoin yhdistelmäehkäisytablettien käyttäjillä on raportoitu hyvänlaatuisia ja vielä harvemmin pahanlaatuisia maksakasvaimia. Yksittäistapauksissa nämä kasvaimet ovat aiheuttaneet hengenvaarallisia vatsaontelon sisäisiä verenvuotoja. Erotusdiagnostisesti maksakasvaimen mahdollisuus pitää ottaa huomioon, jos Vagiprev‑valmisteen käyttäjällä on voimakasta ylävatsakipua, suurentunut maksa tai merkkejä vatsaontelonsisäisestä verenvuodosta.
3. Muut tilat
• Hypertriglyseridemia tai sen esiintyminen suvussa voi suurentaa haimatulehduksen riskiä hormonaalisten ehkäisyvalmisteiden käyttäjillä.
• Vaikka vähäistä verenpaineen kohoamista on raportoitu monilla hormonaalisten ehkäisyvalmisteiden käyttäjillä, kliinisesti merkittävä verenpaineen kohoaminen on harvinaista. Hormonaalisten ehkäisyvalmisteiden käytön ja kliinisen hypertension välistä yhteyttä ei ole vahvistettu. Jos verenpaine kuitenkin kohoaa kliinisesti merkitsevästi Vagiprev‑valmisteen käytön aikana, lääkärin tulisi kehottaa lopettamaan valmisteen käyttö ja hoitaa hypertensiota. Vagiprev‑valmisteen käytön jatkamista voi harkita, jos verenpainelääkityksellä saadaan aikaan normotensio.
• Seuraavia sairaustiloja tai niiden pahenemista on raportoitu sekä raskauden että hormonaalisten ehkäisyvalmisteiden käytön yhteydessä, mutta niiden yhteydestä näiden valmisteiden käyttöön ei ole pitävää näyttöä: kolestaasiin liittyvä keltaisuus ja/tai kutina, sappikivimuodostus, porfyria, systeeminen lupus erythematosus, hemolyyttis-ureeminen oireyhtymä, Sydenhamin korea, herpes gestationis, otoskleroosiin liittyvä kuulon heikkeneminen.
• Eksogeeniset estrogeenit voivat indusoida tai pahentaa perinnöllisen ja hankinnaisen angioedeeman oireita.
• Vagiprev‑valmisteen käytön keskeyttäminen saattaa olla tarpeen akuuteissa tai kroonisissa maksan toimintahäiriöissä, kunnes maksafunktioarvot ovat normalisoituneet. Renkaan käyttö on lopetettava, jos raskausaikana ensi kertaa ilmennyt tai aiempaan sukupuolihormonien käyttöön liittynyt kolestaattinen keltaisuus ja/tai kutina uusiutuu.
• Vaikka estrogeenit ja progestiinit voivat vaikuttaa perifeeriseen insuliiniresistenssiin tai glukoosinsietoon, hormonaalisia ehkäisyvalmisteita käyttävien naisten diabeteshoidon muuttamistarpeesta ei ole näyttöä. Vagiprev‑valmistetta käyttäviä diabeetikkoja pitää kuitenkin seurata huolellisesti varsinkin ensimmäisten käyttökuukausien aikana.
• Crohnin taudin ja haavaisen paksusuolen tulehduksen ilmaantumista tai vaikeutumista on raportoitu tapahtuneen hormonaalisten ehkäisyvalmisteiden käytön yhteydessä, mutta näyttöä näiden yhteydestä toisiinsa ei ole osoitettu sitovasti.
• Maksaläiskiä voi joskus esiintyä, erityisesti jos niitä on esiintynyt raskausaikana. Maksaläiskiin taipuvaisten naisten pitäisi välttää aurinkoa ja ultraviolettisäteilyaltistusta Vagiprev‑valmisteen käytön aikana.
• Jos naisella on jokin seuraavista tiloista, Vagiprev‑renkaan asettaminen oikein emättimeen ei ehkä onnistu tai rengas saattaa pudota: kohdunkaulan prolapsi, kystoseele tai rektoseele, vaikea tai jatkuva ummetus.
Hyvin harvoin on raportoitu että Vagiprev on tahattomasti asetettu virtsaputkeen ja mahdollisesti päätynyt virtsarakkoon. Sen vuoksi väärän sijainnin mahdollisuus tulee ottaa huomioon kystiitin oireiden erotusdiagnosoinnissa.
• Naisella saattaa Vagiprev‑valmisteen käytön aikana esiintyä emätintulehdusta. Ei ole osoitettu että emätintulehduksen hoito vaikuttaisi Vagiprev‑valmisteen tehoon. Myöskään ei ole osoitettu, että Vagiprev‑valmisteella olisi vaikutusta emätintulehduksen hoitoon (ks. kohta Yhteisvaikutukset).
• Hyvin harvoin on raportoitu emätinrenkaan kiinnittymistä emätinkudokseen, jonka vuoksi terveydenhuollon ammattilainen joutuu poistamaan emätinrenkaan. Joissain tapauksissa, kun renkaan päälle on kasvanut kudosta, rengas on voitu poistaa katkaisemalla se; tällöin emätinkudosta ei ole tarvinnut leikata.
• Masentunut mieliala ja masennus ovat tunnettuja hormonaalisten ehkäisyvalmisteiden käyttöön liittyviä haittavaikutuksia (ks. kohta Haittavaikutukset). Masennus voi olla vakavaa, ja se on itsetuhoisen käyttäytymisen ja itsemurhan tunnettu riskitekijä. Naisia on kehotettava ottamaan yhteyttä lääkäriinsä, jos heillä esiintyy mielialan muutoksia ja masennuksen oireita, myös pian hoidon aloittamisen jälkeen.
LÄÄKÄRINTARKASTUS
Ennen Vagiprev‑valmisteen käytön aloittamista tai uudelleen aloittamista potilaan sairaushistoria on selvitettävä täydellisesti (mukaan lukien sukuanamneesi), ja raskaus on suljettava pois. Naisen verenpaine on mitattava, ja hänelle on tehtävä lääkärintarkastus ottaen huomioon vasta-aiheet (ks. kohta Vasta-aiheet) ja varoitukset (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). On tärkeää kiinnittää naisen huomiota laskimo- ja valtimoveritulppia koskeviin tietoihin, kuten Vagiprev‑valmisteen käyttöön liittyvään riskiin verrattuna muihin yhdistelmäehkäisyvalmisteisiin, laskimo- ja valtimoveritulppien oireisiin, tiedossa oleviin riskitekijöihin sekä siihen, mitä tehdä, jos epäilee veritulppaa.
Naista on myös neuvottava lukemaan pakkausseloste huolellisesti ja noudattamaan siinä annettuja ohjeita. Tarkastuskäyntien tiheyden ja luonteen pitää perustua vakiintuneisiin hoitosuosituksiin, ja ne on toteutettava kunkin naisen kliinisten tarpeiden mukaisesti.
Naisia on varoitettava siitä, että hormonaaliset ehkäisyvalmisteet eivät suojaa HIV-infektiolta (AIDS) tai muilta sukupuoliteitse tarttuvilta taudeilta.
TEHON HEIKKENEMINEN
Käyttöohjeiden noudattamatta jättäminen (kohta Annostus ja antotapa) tai sellaisen lääkityksen, joka vähentää etonogestreelin ja/tai etinyyliestradiolin pitoisuutta plasmassa, samanaikainen käyttö (kohta Yhteisvaikutukset) voivat heikentää Vagiprev‑valmisteen ehkäisytehoa.
SYKLIKONTROLLIN HEIKENTYMINEN
Vagiprev‑valmistetta käytettäessä saattaa esiintyä epäsäännöllisiä vuotoja (tiputtelu- tai läpäisyvuoto). Jos vuotohäiriöitä ilmaantuu kiertojen oltua aiemmin säännölliset ja jos Vagiprev‑valmistetta on käytetty ohjeiden mukaisesti, ei-hormonaaliset syyt on syytä ottaa huomioon. Asianmukaiset diagnostiset toimenpiteet (mahdollisesti kohdun kaavinta) ovat indisoituja maligniteetin tai raskauden poissulkemiseksi.
Joskus käyttötauon aikana ei tule tyhjennysvuotoa. Jos Vagiprev‑valmistetta on käytetty kohdassa Annostus ja antotapa annettujen ohjeiden mukaan, nainen ei todennäköisesti ole raskaana. Jos Vagiprev‑valmistetta ei kuitenkaan ole käytetty ohjeiden mukaan ennen tyhjennysvuodon ensimmäistä poisjääntiä, tai jos jo kaksi tyhjennysvuotoa on jäänyt tulematta, raskauden mahdollisuus on suljettava pois ennen käytön jatkamista.
MIEHEN ALTISTUMINEN ETINYYLIESTRADIOLILLE JA ETONOGESTREELILLE
Miespuolisen seksikumppanin etinyyliestradiolille ja etonogestreelille altistumista ja mahdollisia farmakologisia vaikutuksia peniksen kautta tapahtuvasta absorptiosta johtuen ei ole tutkittu.
RIKKOUTUNEET RENKAAT
Vagiprev‑valmisteen on raportoitu auenneen liitoskohdasta käytön aikana (ks. kohta Yhteisvaikutukset). Renkaan rikkoutumiseen liittyviä emättimen vaurioita on raportoitu. Naista neuvotaan poistamaan rikkoutunut rengas ja asettamaan uusi rengas niin pian kuin mahdollista ja käyttämään lisäksi estemenetelmää, kuten miesten kondomia, seuraavien 7 päivän ajan. Raskauden mahdollisuus on huomioitava, ja naisen otettava yhteyttä lääkäriin.
EKSPULSIO
Hyvin harvinaisissa tapauksissa Vagiprev‑valmisteen on raportoitu tulleen pois emättimestä esimerkiksi jos rengasta ei ole asetettu oikein, tamponin poiston yhteydessä, yhdynnän aikana tai vaikean tai kroonisen ummetuksen takia. Jos valmiste on ollut pidempään poissa paikaltaan saattaa ehkäisyteho heikentyä ja ilmetä läpäisyvuotoja. Tämän vuoksi ehkäisytehon varmistamiseksi naisen on hyvä säännöllisesti tarkistaa Vagiprev‑valmisteen paikallaan olo (esim. ennen yhdyntää ja sen jälkeen).
Mikäli Vagiprev on vahingossa tullut ulos emättimestä ja ollut poissa paikaltaan alle kolme tuntia, ehkäisyteho ei ole heikentynyt. Rengas pitää huuhdella kylmällä tai haalealla (ei kuumalla) vedellä ja asettaa takaisin mahdollisimman pian, mutta viimeistään kolmen tunnin sisällä.
Jos Vagiprev on ollut tai sen epäillään olleen poissa emättimestä yli kolme tuntia, ehkäisyteho on voinut heikentyä. Tässä tapauksessa pitää seurata kohdassa Annostus ja antotapa ”Jos rengas on väliaikaisesti poissa emättimestä” annettuja ohjeita.
Yhteisvaikutukset
YHTEISVAIKUTUKSET MUIDEN LÄÄKEVALMISTEIDEN KANSSA
Huom. Mahdollisten yhteisvaikutusten selvittämiseksi on tutustuttava samanaikaisesti käytettävien lääkevalmisteiden valmisteyhteenvetoihin.
Muiden lääkkeiden vaikutukset Vagiprev‑valmisteeseen
Yhteisvaikutuksia saattaa ilmetä maksan mikrosomaalisia entsyymejä indusoivien lääkkeiden tai kasvirohdosvalmisteiden kanssa, jotka voivat lisätä sukupuolihormonien puhdistumaa, mikä voi johtaa läpäisyvuotoihin ja/tai ehkäisytehon pettämiseen.
Hoito
Entsyymi-induktio voidaan havaita jo muutaman hoitopäivän jälkeen. Maksimaalinen entsyymi-induktio ilmenee yleensä muutaman viikon kuluessa. Lääkehoidon lopettamisen jälkeen entsyymi-induktion vaikutus voi kestää noin neljän viikon ajan.
Lyhytaikainen hoito
Käytettäessä entsyymejä indusoivia lääkkeitä tai kasvirohdosvalmisteita naisen pitää väliaikaisesti käyttää Vagiprev‑valmisteen lisäksi jotakin estemenetelmää tai valita jokin muu ehkäisykeino. Huom. Vagiprev‑valmistetta ei pidä käyttää emättimeen tai kohdunkaulaan asetettavien ehkäisykuppien eikä naisten kondomin kanssa. Estemenetelmää on käytettävä samanaikaisesti käytettävän lääkityksen ajan sekä lisäksi 28 päivää lääkityksen lopettamisen jälkeen. Jos samanaikainen lääkitys kestää kauemmin kuin Vagiprev‑valmisteen 3 viikon käyttösykli, seuraavan renkaan käyttö on aloitettava heti ilman tavanomaista taukoa.
Pitkäaikainen hoito
Käytettäessä pitkäkestoisesti maksan entsyymejä indusoivaa lääkitystä, suositellaan muun luotettavan ei-hormonaalisen ehkäisymenetelmän käyttöä.
Kirjallisuudessa on raportoitu seuraavia yhteisvaikutuksia.
Hormonaalisten yhdistelmäehkäisyvalmisteiden puhdistumaa lisäävät aineet
Yhteisvaikutuksia saattaa ilmetä maksan mikrosomaalisia entsyymejä indusoivien lääkkeiden tai kasvirohdosvalmisteiden, erityisesti sytokromi P450 (CYP) ‑entsyymien kanssa, jotka saattavat lisätä sukupuolihormonien puhdistumaa ja vähentää niiden pitoisuutta plasmassa ja heikentää hormonaalisten yhdistelmäehkäisyvalmisteiden, mukaan lukien Vagiprev‑valmisteen, tehoa. Näitä valmisteita ovat fenytoiini, fenobarbitaali, primidoni, bosentaani, karbamatsepiini, rifampisiini sekä mahdollisesti myös okskarbatsepiini, topiramaatti, felbamaatti, griseofulviini, jotkut HIV-proteaasin estäjät (esim. ritonaviiri) ja ei-nukleosidirakenteiset käänteiskopioijaentsyymin estäjät (esim. efavirentsi) ja mäkikuismarohdosta sisältävät valmisteet.
Aineet, joilla on vaihtelevia vaikutuksia hormonaalisten yhdistelmäehkäisyvalmisteiden puhdistumaan
Yhtäaikaisesti hormonaalisten yhdistelmäehkäisyvalmisteiden kanssa käytettynä monet HIV‑proteaasin estäjiä (esim. nelfinaviiria) ja ei-nukleosidirakenteisia käänteiskopioijaentsyymin estäjiä (esim. nevirapiinia) sisältävät lääkeyhdistelmät ja/tai HCV:n hoitoon tarkoitetut yhdistelmät (esim. bosepreviiri, telapreviiri) voivat suurentaa tai pienentää progestiinien, mukaan lukien etonogestreelin, tai estrogeenin pitoisuutta plasmassa. Näiden muutosten kokonaisvaikutus voi joissakin tapauksissa olla kliinisesti merkittävä.
Aineet, jotka vähentävät hormonaalisten yhdistelmäehkäisyvalmisteiden puhdistumaa
Entsyymi-inhibiittoreihin liittyvien mahdollisten interaktioiden kliininen merkitys on tuntematon. Voimakkaiden CYP 3A4 ‑entsyymi-inhibiittoreiden (esim. ketokonatsoli, itrakonatsoli, klaritromysiini) tai kohtalaisten CYP 3A4 ‑entsyymi-inhibiittoreiden (esim. flukonatsoli, diltiatseemi, erytromysiini) yhtäaikainen käyttö voi nostaa estrogeenien tai progestiinien, mukaan lukien etonogestreelin, pitoisuutta plasmassa.
Renkaan rikkoutumista on raportoitu käytettäessä samanaikaisesti emättimeen annosteltavia valmisteita, kuten sienilääkkeitä, antibiootteja ja liukastusaineita (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet ”Rikkoutuneet renkaat”). Farmakokineettisten tietojen perusteella emättimeen annosteltavat sienilääkkeet ja siittiöitä tuhoavat aineet eivät todennäköisesti vaikuta Vagiprev‑valmisteen ehkäisytehoon eivätkä turvallisuuteen.
Hormonaaliset ehkäisyvalmisteet saattavat vaikuttaa muiden lääkkeiden metaboliaan. Siten lääkeainepitoisuudet plasmassa ja kudoksissa saattavat joko nousta (esim. siklosporiini) tai laskea (esim. lamotrigiini).
Farmakodynaamiset yhteisvaikutukset
Kun kliinisissä tutkimuksissa hoidettiin hepatiitti C -virusinfektiota (HCV) ombitasviirin, paritapreviirin ja ritonaviirin yhdistelmällä ja dasabuviirilla ribaviriinin kanssa tai ilman, transaminaasiarvon (ALAT) kohoamista yli 5 x ULN (viitealueen yläraja) esiintyi merkitsevästi useammin naisilla, jotka käyttivät etinyyliestradiolia sisältävää valmistetta, kuten yhdistelmäehkäisyvalmistetta. Myös glekapreviirin ja pibrentasviirin yhdistelmää tai sofosbuviirin, velpatasviirin ja voksilapreviirin yhdistelmää käyttävillä potilailla ALAT-arvojen kohoamista havaittiin etinyyliestradiolia sisältävää valmistetta (kuten yhdistelmäehkäisyvalmistetta) käyttävillä naisilla (ks. kohta Vasta-aiheet).
Tästä syystä Vagiprev‑käyttäjien on vaihdettava muuhun ehkäisymenetelmään (esim. pelkkää progestiinia sisältävään ehkäisyyn tai ei-hormonaalisiin menetelmiin) ennen kyseisten yhdistelmähoitojen aloittamista. Vagiprev‑valmisteen käyttö voidaan aloittaa uudelleen 2 viikon kuluttua näiden yhdistelmähoitojen päättymisestä.
LABORATORIOKOKEET
Steroidiehkäisyn käyttö voi vaikuttaa eräisiin laboratorioarvoihin, kuten maksan, kilpirauhasen, lisämunuaisen ja munuaisten toimintakokeiden biokemiallisiin parametreihin, kantajaproteiinien (esim. kortikosteroideja sitovan globuliinin ja sukupuolihormoneja sitovan globuliinin) ja lipidi/lipoproteiinifraktioiden pitoisuuksiin plasmassa, hiilihydraattiaineenvaihdunnan parametreihin ja veren hyytymis- ja fibrinolyysiparametreihin. Muutokset pysyvät yleensä normaalialueella.
YHTEISVAIKUTUKSET TAMPONIEN KANSSA
Farmakokineettisten tutkimustietojen mukaan tamponien samanaikaisella käytöllä ei ole vaikutusta Vagiprev‑valmisteesta vapautuneiden hormonien systeemiseen imeytymiseen Harvinaisissa tapauksissa Vagiprev on saattanut tulla tamponin vaihdon yhteydessä pois emättimestä (katso ohje ”Jos rengas on väliaikaisesti poissa emättimestä”).
Raskaus ja imetys
Raskaus
Vagiprev ei ole tarkoitettu käytettäväksi raskauden aikana. Jos raskaus havaitaan Vagiprev‑valmisteen käytön aikana, pitää rengas poistaa. Laajojen epidemiologisten tutkimusten mukaan synnynnäisten kehityshäiriöiden riski ei ole suurentunut ennen raskautta yhdistelmäehkäisytabletteja käyttäneiden naisten lapsilla, kuten ei myöskään teratogeenisten vaikutusten riski silloin, kun yhdistelmäehkäisytabletteja on käytetty tahattomasti raskauden varhaisvaiheessa.
Pienellä naisjoukolla tehdyssä kliinisessä tutkimuksessa todettiin, että intravaginaalisesta annostelusta huolimatta ehkäisysteroidien kohdunsisäiset pitoisuudet olivat etonogestreelia/etinyyliestradiolia sisältävää rengasta käytettäessä vastaavat kuin yhdistelmäehkäisytabletteja käyttävillä naisilla (ks. kohta Farmakokinetiikka). Etonogestreelia/etinyyliestradiolia sisältävän renkaan raskauden aikaisesta käytöstä ei ole raportoitua kliinistä tietoa.
Kun Vagiprev‑valmisteen käyttö aloitetaan uudelleen, on huomioitava, että laskimotromboembolian riski on suurentunut synnytyksen jälkeisenä aikana (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Imetys
Estrogeenit voivat vaikuttaa imetykseen, sillä ne voivat vähentää rintamaidon määrää ja muuttaa sen koostumusta. Siksi Vagiprev‑valmisteta pitäisi yleisen suosituksen mukaisesti käyttää vasta, kun lapsi on vieroitettu rintamaidosta. Pieniä määriä kontraseptiivisiä steroideja ja/tai niiden metaboliitteja voi erittyä rintamaitoon, mutta tämän haitallisuudesta lapsen terveydelle ei ole näyttöä.
Hedelmällisyys
Vagiprev on tarkoitettu raskauden ehkäisyyn. Jos nainen haluaa lopettaa Vagiprev‑valmisteen käytön tullakseen raskaaksi, on häntä neuvottava odottamaan ensimmäisten luonnollisten kuukautisten tuloa ennen kuin yrittää tulla raskaaksi. Tämä helpottaa synnytyksen ajankohdan määrittämistä.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Farmakodynaamisten ominaisuuksiensa perusteella Vagiprev‑valmisteella ei ole haitallista vaikutusta ajokykyyn tai koneiden käyttökykyyn, tai vaikutuksen oletetaan olevan merkityksetön.
Haittavaikutukset
Kliinisissä tutkimuksissa useimmin ilmoitetut etonogestreeliin ja etinyyliestradioliin liitetyt haittavaikutukset olivat päänsärky, emätintulehdukset ja valkovuoto, joita kutakin raportoi 5–6 % naisista.
Tiettyjen haittavaikutusten kuvaus
Yhdistelmäehkäisyvalmisteita käyttävillä naisilla on havaittu valtimoiden ja laskimoiden tromboottisten ja tromboembolisten tapahtumien lisääntynyt riski. Näitä tapahtumia ovat mm. sydäninfarkti, aivohalvaus, ohimenevät aivoverenkiertohäiriöt (TIA), laskimoveritulppa ja keuhkoembolia. Tapahtumia kuvataan tarkemmin kohdassa Varoitukset ja käyttöön liittyvät varotoimet.
Yhdistelmäehkäisyvalmisteita käyttävillä naisilla on raportoitu myös muita haittavaikutuksia. Ne kuvataan tarkemmin kohdassa Varoitukset ja käyttöön liittyvät varotoimet.
Haittavaikutukset, joita on raportoitu etonogestreelia/etinyyliestradiolia sisältävällä renkaalla tehtyjen kliinisten tutkimusten tai havainnoivien tutkimusten yhteydessä tai markkinoille tulon jälkeen, on lueteltu alla olevassa taulukossa. Taulukkoon on listattu sopivin MedDRA-termi kuvaamaan tiettyä haittavaikutusta.
Haittavaikutukset on lueteltu elinjärjestelmän ja esiintymistiheyden mukaan luokiteltuina:
yleiset (≥ 1/100, < 1/10), melko harvinaiset (≥ 1/1 000, < 1/100), harvinaiset (≥ 1/10 000, < 1/1 000), tuntematon (ei voida arvioida olemassa olevan tietojen perusteella).
Elinjärjestelmäluokka | Yleinen | Melko harvinainen | Harvinainen | Tuntematon1 |
Infektiot | emätintulehdus | kohdunkaulan tulehdus, kystiitti, virtsatietulehdus | ||
Immuuni-järjestelmä | yliherkkyys- reaktiot, mukaan lukien angioedeema ja anafylaksia, perinnöllisen ja hankinnaisen angioedeeman oireiden paheneminen | |||
Aineenvaihdunta ja ravitsemus | lisääntynyt ruokahalu | |||
Psyykkiset häiriöt | masennus, libidon heikkeneminen | affektilabiliteetti, mielialan vaihtelut, mielialan ailahtelut | ||
Hermosto | päänsärky, migreeni | huimaus, hypoestesia | ||
Silmät | näköhäiriöt | |||
Verisuonisto | kuumat aallot | laskimo-tromboembolia, valtimo-tromboembolia | ||
Ruuansulatus-elimistö | vatsakipu, pahoinvointi | vatsan alueen laajeneminen, ripuli, oksentelu, ummetus | ||
Iho ja ihonalainen kudos | akne | alopesia, ekseema, kutina, ihottuma, nokkosihottuma | maksaläiskät | |
Luusto, lihakset ja sidekudokset | selkäkipu, lihasspasmit, kipu raajoissa | |||
Munuaiset ja virtsatiet | dysuria, virtsaamispakko, tiheävirtsaisuus | |||
Sukupuolielimet ja rinnat | rintojen arkuus, sukupuolielinten kutina naisella, kuukautiskivut, lantion kipu, valkovuoto | kuukautisten poisjääminen, epämukava tunne rinnoissa, rintojen koon suureneminen, rintojen tiheys, kohdunkaulan polyyppi, yhdynnän aikainen verenvuoto, yhdyntäkipu, kohdunsuun ektopia, fibrokystinen rintarauhasen sairaus, runsaat kuukautiset, epäsäännölliset kuukautiset, lantion epämukavuus, premenstruaali-oireet, kohdun spasmit, kirvelevä tunne emättimessä, haju emättimessä, kipu emättimessä, hävyn ja emättimen epämukavuus, hävyn ja emättimen kuivuus | galaktorrea | peniksen häiriöt |
Yleisoireet ja antopaikassa todettavat haitat | uupumus, ärtyneisyys, huonovointisuus, edeema, vierasesine-tuntemus | emätinkudoksen kasvaminen renkaan päälle | ||
Tutkimukset | painon nousu | verenpaineen kohoaminen | ||
Vammat, myrkytykset ja käyttöön liittyvät komplikaatiot | emätinrenkaan aiheuttama epämukavuus, emätinrenkaan ekspulsio | emätinrenkaan aiheuttama komplikaatio | renkaan rikkoutumiseen liittyvä emättimen vaurio |
1) Haittavaikutukset on luetteloitu spontaanien raporttien mukaan.
Yhdistelmäehkäisyvalmisteiden käytön yhteydessä on raportoitu hormoniriippuvaisia kasvaimia (esim. maksakasvaimet, rintasyöpä). Näitä käsitellään tarkemmin kohdassa Varoitukset ja käyttöön liittyvät varotoimet.
Vagiprev-emätinrenkaan on raportoitu auenneen liitoskohdasta käytön aikana (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset).
Yhteisvaikutukset
Läpäisyvuoto ja/tai ehkäisyn pettäminen saattavat johtua muiden lääkkeiden (entsyymi-indusorit) yhteisvaikutuksista hormonaalisten ehkäisyvalmisteiden kanssa (ks. kohta Yhteisvaikutukset).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi Lääkealan turvallisuus- ja kehittämiskeskus Fimea Lääkkeiden haittavaikutusrekisteri PL 55 00034 FIMEA
Yliannostus
Hormonaalisten ehkäisyvalmisteiden yliannostuksen ei ole raportoitu aiheuttavan vakavia haittavaikutuksia. Mahdollisia yliannostusoireita ovat pahoinvointi, oksentelu ja nuorilla tytöillä vähäinen verenvuoto emättimestä. Antidoottia ei ole, ja jatkohoito on oireenmukaista.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Muut gynekologiset valmisteet, emättimensisäiset ehkäisyvalmisteet, progestogeeniä ja estrogeeniä sisältävät emätinrenkaat, ATC-koodi: G02BB01
Vaikutusmekanismi
Vagiprev sisältää etonogestreelia ja etinyyliestradiolia. Etonogestreeli on 19‑nortestosteronista johdettu progestiini, jolla on voimakas affiniteetti kohde-elinten progestiinireseptoreihin. Etinyyliestradioli on ehkäisyvalmisteissa yleisesti käytetty estrogeeni. Etonogestreelia/etinyyliestradiolia sisältävän renkaan ehkäisyteho perustuu useisiin mekanismeihin, joista tärkein on ovulaation estyminen.
Kliininen teho ja turvallisuus
Maailmanlaajuisissa (USA, EU ja Brasilia) kliinisissä tutkimuksissa tutkittiin 18–40‑vuotiaita naisia. Ehkäisyteho osoittautui vähintään yhtä hyväksi kuin oraalisten ehkäisyvalmisteiden teho. Alla olevassa taulukossa esitetään etonogestreelia/etinyyliestradiolia sisältävällä renkaalla tehdyissä kliinisissä tutkimuksissa todetut Pearlin indeksit (raskauksien määrä 100 naisvuotta kohden).
Analyysimenetelmä | Pearlin indeksi | 95 %:n luottamusväli | Syklien määrä |
ITT (käyttäjä- ja menetelmävirheet) | 0,96 | 0,64–1,39 | 37 977 |
PP (menetelmävirheet) | 0,64 | 0,35–1,07 | 28 723 |
Suurempiannoksisten yhdistelmäehkäisytablettien (0,05 mg etinyyliestradiolia) käytön yhteydessä endometriumin ja munasarjojen syövän riski vähenee. Tarvitaan vielä lisänäyttöä selventämään, koskeeko sama myös pienempiannoksisia ehkäisyvalmisteita kuten etonogestreelia/etinyyliestradiolia sisältävää rengasta.
VUOTOPROFIILI
Laajassa vertailevassa tutkimuksessa 150 mikrogrammaa levonorgestreelia ja 30 mikrogrammaa etinyyliestradiolia sisältävän yhdistelmäehkäisytabletin kanssa (n = 512 vs n = 518), jossa tutkittiin emätinvuotojen esiintyvyyttä 13 syklin ajan, todettiin etonogestreelia/etinyyliestradiolia sisältävällä renkaalla vain vähän läpäisyvuotoja tai tiputtelua (2,0–6,4 %). Lisäksi suurimmalla osalla naisista (58,8–72,8 %:lla) vuodot rajoittuivat pelkästään rengastauolle.
VAIKUTUKSET LUUNTIHEYTEEN
Etonogestreelia/etinyyliestradiolia sisältävän renkaan (n = 76) vaikutuksia luuntiheyteen verrattiin kahden vuoden tutkimuksessa ei‑hormonaaliseen kierukkaan (n = 31). Tutkimuksessa ei todettu epäedullisia vaikutuksia luumassaan.
Pediatriset potilaat
Etonogestreelia/etinyyliestradiolia sisältävän renkaan turvallisuutta ja tehoa alle 18‑vuotiailla nuorilla ei ole tutkittu.
Farmakokinetiikka
Etonogestreeli
Imeytyminen
Etonogestreelia/etinyyliestradiolia sisältävästä renkaasta vapautuva etonogestreeli imeytyy nopeasti emättimen limakalvolta. Etonogestreelin huippupitoisuus seerumissa, noin 1700 pg/ml, saavutetaan noin viikon kuluttua käytön aloittamisesta. Pitoisuus seerumissa vaihtelee hiukan ja pienenee hitaasti. Yhden viikon käytön jälkeen pitoisuus on noin 1 600 pg/ml, kahden viikon jälkeen noin 1 500 pg/ml ja kolmen viikon jälkeen noin 1 400 pg/ml. Absoluuttinen biologinen hyötyosuus on noin 100 %, mikä on suurempi kuin oraalisessa annostelussa. Pieneltä joukolta naisia, jotka käyttivät joko etonogestreelia/etinyyliestradiolia sisältävää rengasta tai oraalista ehkäisyä, joka sisälsi 0,150 mg desogestreeliä ja 0,020 mg etinyyliestradiolia, mitattiin kohdunkaulan ja kohdunsisäiset etonogestreelipitoisuudet. Havaitut pitoisuudet olivat verrannolliset toisiinsa nähden.
Jakautuminen
Etonogestreeli sitoutuu seerumin albumiiniin ja sukupuolihormoneja sitovaan globuliiniin (SHBG). Etonogestreelin näennäinen jakautumistilavuus on 2,3 l/kg.
Biotransformaatio
Etonogestreeli metaboloituu steroidien tunnettujen metaboliareittien kautta. Näennäinen seerumin puhdistuma on noin 3,5 l/h. Suoraa interaktiota samanaikaisesti annetun etinyyliestradiolin kanssa ei ole havaittu.
Eliminaatio
Etonogestreelin pitoisuus seerumissa pienenee kaksivaiheisesti. Loppuvaiheen puoliintumisaika on noin 29 h. Etonogestreeli ja sen metaboliitit erittyvät virtsaan ja sappeen suhteessa 1,7:1. Metaboliittien erittymisen puoliintumisaika on noin 6 vrk.
Etinyyliestradioli
Imeytyminen
Etonogestreelia/etinyyliestradiolia sisältävästä renkaasta vapautuva etinyyliestradioli imeytyy nopeasti emättimen limakalvolta. Etinyyliestradiolin huippupitoisuus seerumissa, noin 35 pg/ml, saavutetaan 3 päivän kuluttua käytön aloittamisesta. Pitoisuus pienenee yhden viikon käytön jälkeen tasolle 19 pg/ml, kahden viikon jälkeen tasolle 18 pg/ml ja kolmen viikon jälkeen tasolle 18 pg/ml. Kuukausittainen systeeminen etinyyliestradiolialtistus (AUC 0-∞) on etonogestreelia/etinyyliestradiolia sisältävää rengasta käytettäessä 10,9 ng.h/ml.
Absoluuttinen biologinen hyötyosuus on noin 56 %, mikä on verrannollinen suun kautta annettavaan etinyyliestradioliin. Pieneltä joukolta naisia, jotka käyttivät joko etonogestreelia/etinyyliestradiolia sisältävää rengasta tai oraalista ehkäisyä, joka sisälsi 0,150 mg desogestreeliä ja 0,020 mg etinyyliestradiolia, mitattiin kohdunkaulan ja kohdunsisäiset etinyyliestradiolipitoisuudet. Havaitut pitoisuudet olivat verrannolliset toisiinsa nähden.
Jakautuminen
Etinyyliestradioli sitoutuu laajasti mutta epäspesifisesti seerumin albumiiniin. Näennäinen jakautumistilavuus on noin 15 l/kg.
Biotransformaatio
Etinyyliestradioli metaboloituu pääasiassa aromaattisella hydroksylaatiolla, mutta aineenvaihduntatuotteina syntyy suuri määrä hydroksyloituja ja metyloituja metaboliitteja. Nämä ovat verenkierrossa vapaina tai konjugoituneena glukuronidiin tai sulfaattiin. Näennäinen puhdistuma on noin 35 l/h.
Eliminaatio
Etinyyliestradiolin pitoisuus seerumissa pienenee kaksivaiheisesti. Loppuvaiheen eliminaatiolle on tyypillistä suuret yksilöiden väliset erot puoliintumisajassa, joka keskimäärin on noin 34 tuntia. Muuttumaton etinyyliestradioli ei erity, metaboliitit erittyvät virtsaan ja sappeen suhteessa 1,3:1. Metaboliittien erittymisen puoliintumisaika on noin 1,5 vrk.
Erityisryhmät
Pediatriset potilaat
Etonogestreelia/etinyyliestradiolia sisältävän renkaan farmakokinetiikkaa ei ole tutkittu terveillä alle 18‑vuotiailla naisilla, joilla on ollut ensimmäiset kuukautiset.
Vaikutuksen munuaisten vajaatoimintaan
Ei ole tehty tutkimuksia, joissa arvioidaan etonogestreelia/etinyyliestradiolia sisältävän renkaan farmakokinetiikkaa munuaissairauksissa.
Vaikutukset maksan vajaatoimintaan
Ei ole tehty tutkimuksia, joissa arvioidaan etonogestreelia/etinyyliestradiolia sisältävän renkaan farmakokinetiikkaa maksasairauksissa. Steroidihormonit voivat kuitenkin metaboloitua heikosti naisilla, joilla on maksan vajaatoimintaa.
Etniset ryhmät
Ei ole tehty muodollisia tutkimuksia, joissa arvioidaan etnisten ryhmien farmakokinetiikkaa.
Prekliiniset tiedot turvallisuudesta
Etinyyliestradiolia ja etonogestreelia koskeva prekliininen aineisto (perinteiset farmakologiset turvallisuus-, toistoannoksen toksisuus-, genotoksisuus-, karsinogeenisyys- ja lisääntymistoksikologiset tutkimukset) ei anna aihetta epäilyille aiemmin tuntemattomista vaaroista ihmisille.
Ympäristöön kohdistuvien riskien arviointi
Tutkimukset ympäristöön kohdistuvien riskien arvioinnista ovat osoittaneet, että 17α-
etinyyliestradiolista ja etonogestreelistä saattaa olla vaaraa pintavesien eliöille (ks. kohta Käyttö- ja käsittelyohjeet).
Farmaseuttiset tiedot
Apuaineet
Etyleenivinyyliasetaattikopolymeeri, 28 % vinyyliasetaattia
Polyuretaani
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
2 vuotta.
Säilytys
Tämä lääkevalmiste ei vaadi lämpötilan suhteen erityisiä säilytysolosuhteita. Säilytä alkuperäispakkauksessa. Herkkä valolle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
VAGIPREV depotlääkevalmiste, emättimeen
0,120/0,015 mg/24 h (L:ei) 1 kpl (11,92 €), 3 kpl (34,56 €)
PF-selosteen tieto
Pussi sisältää yhden Vagiprev‑renkaan. Pussin materiaali on PET/alumiini/LDPE. Pussi suojaa valolta ja kosteudelta. Pussi on pakattu painettuun pahvikoteloon yhdessä pakkausselosteen kanssa. Kotelossa on myös tarroja, jotka nainen voi kiinnittää kalenteriin muistuttamaan, koska rengas pitää asettaa paikalleen ja ottaa pois.
Yksittäinen pahvikotelo sisältää 1, 3 tai 6 rengasta.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Vagiprev on joustava, läpinäkyvä, väritön tai lähes väritön rengas, jonka ulkohalkaisija on 54 mm ja poikittaisläpimitta 4 mm.
Käyttö- ja käsittelyohjeet
Ks. kohta Annostus ja antotapa.
Vagiprev pitää asettaa paikalleen viimeistään kuukautta ennen kotelossa mainittua viimeistä käyttöpäivämäärää (EXP). Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Tämä lääkevalmiste voi olla haitallinen ympäristölle (ks. kohta Prekliiniset tiedot turvallisuudesta). Käytetty Vagiprev‑rengas pitää laittaa takaisin annospussiin ja sulkea pussi. Suljettu pussi on hävitettävä tavallisten kotitalousjätteiden mukana tai viemällä se apteekkiin hävitettäväksi paikallisten vaatimusten mukaisesti.
Käyttämätön (tai vanhentunut) Vagiprev‑valmiste on hävitettävä paikallisten vaatimusten mukaisesti. Vagiprev‑valmistetta ei saa huuhtoa alas WC:stä eikä hävittää jätevesijärjestelmien kautta.
Korvattavuus
VAGIPREV depotlääkevalmiste, emättimeen
0,120/0,015 mg/24 h 1 kpl, 3 kpl
- Ei korvausta.
ATC-koodi
G02BB01
Valmisteyhteenvedon muuttamispäivämäärä
09.01.2025
Yhteystiedot
 ORION OYJ ORION PHARMA
ORION OYJ ORION PHARMA Orionintie 1, PL 65
02101 Espoo
010 4261
www.orion.fi
etunimi.sukunimi@orionpharma.com
