DUAKLIR GENUAIR inhalaatiojauhe 340/12 mikrog
Vaikuttavat aineet ja niiden määrät
Yksi potilaan saama annos (suukappaleen kautta saatava annos) sisältää 396 mikrogrammaa aklidiniumbromidia (joka vastaa 340 mikrogrammaa aklidiniumia) ja 11,8 mikrogrammaa formoterolifumaraattidihydraattia. Tämä vastaa mitattuna annoksena 400 mikrogrammaa aklidiniumbromidia (joka vastaa 343 mikrogrammaa aklidiniumia) ja mitattuna annoksena 12 mikrogrammaa formoterolifumaraattidihydraattia.
Apuaineet, joiden vaikutus tunnetaan
Yksi potilaan saama annos sisältää noin 11 mg laktoosia (monohydraattina).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Inhalaatiojauhe.
Kliiniset tiedot
Käyttöaiheet
Duaklir Genuair -valmiste on tarkoitettu aikuispotilaiden keuhkoahtaumataudin (COPD) bronkodilatoivaksi ylläpitohoidoksi oireiden lievittämiseen.
Annostus ja antotapa
Annostus
Suositusannos on yksi inhalaatio kaksi kertaa vuorokaudessa.
Jos annoksen ottaminen unohtuu, annos tulee ottaa mahdollisimman pian ja seuraava annos tulee ottaa tavalliseen annoksen ottamisaikaan. Kaksinkertaista annosta ei pidä ottaa korvaamaan unohtunut kerta-annos.
Iäkkäät
Annoksen muuttaminen iäkkäitä potilaita hoidettaessa ei ole tarpeen (ks. kohta Farmakokinetiikka).
Munuaisten vajaatoiminta
Annoksen muuttaminen ei ole tarpeen hoidettaessa potilaita, joilla on munuaisten vajaatoimintaa (ks. kohta Farmakokinetiikka).
Maksan vajaatoiminta
Annoksen muuttaminen ei ole tarpeen hoidettaessa potilaita, joilla on maksan vajaatoimintaa (ks. kohta Farmakokinetiikka).
Pediatriset potilaat
Ei ole asianmukaista käyttää Duaklir Genuair -valmistetta lasten ja nuorten (alle 18-vuotiaiden) keuhkoahtaumataudin hoidossa.
Antotapa
Inhaloitava.
Potilaat tulee ohjeistaa käyttämään valmistetta oikein, koska Genuar-inhalaattori saattaa toimia eri lailla kuin aikaisemmin potilaalla käytössä olleet inhalaattorit. On tärkeää ohjeistaa potilasta lukemaan pakkausselosteessa olevat käyttöohjeet huolellisesti.
Ennen ensimmäistä käyttökertaa sinetöity suojapussi revitään auki ja inhalaattori otetaan suojapussista. Suojapussi ja kuivausainetta sisältävä pussi hävitetään.
Käyttöohjeet, ks. kohta Käyttö- ja käsittelyohjeet.
Vasta-aiheet
Yliherkkyys vaikuttaville aineille tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Astma
Duaklir Genuair -valmistetta ei pidä käyttää astman hoitoon; kliinisiä tutkimuksia Duaklir Genuair -valmisteen käytöstä astman hoidossa ei ole tehty.
Paradoksaalinen bronkospasmi
Suositeltuja Duaklir Genuair -annoksia käyttävissä kliinisissä tutkimuksissa ei havaittu paradoksaalista bronkospasmia. Paradoksaalista bronkospasmia on kuitenkin havaittu muiden inhalaatiohoitojen yhteydessä. Jos näin tapahtuu, lääkehoito on lopetettava ja harkittava muita hoitoja.
Ei akuutin tilan hoitoon
Duaklir Genuair -valmistetta ei ole tarkoitettu akuuttien bronkospasmiepisodien hoitoon.
Kardiovaskulaariset vaikutukset
β2-adrenergiset agonistit saattavat kohottaa sykettä ja verenpainetta sekä aiheuttaa osalle potilaista muutoksia sydänsähkökäyrässä (EKG), kuten T-aallon madaltumista, ST-välin laskua ja QTc-ajan pidentymistä. Jos tämänkaltaisia vaikutuksia esiintyy, hoito on ehkä keskeytettävä. Pitkävaikutteisten β2-adrenergisten agonistien käytössä on noudatettava varovaisuutta potilaille, joilla tiedetään olleen QTc-ajan pidentymistä tai joita on hoidettu lääkevalmisteilla, jotka vaikuttavat QTc-aikaan (ks. kohta Yhteisvaikutukset).
Sydämen rytmihäiriöitä (mukaan lukien eteisvärinää ja paroksysmaalista takykardiaa) havaittiin Duaklir Genuair ‑valmisteen annon jälkeen (ks. kohta Haittavaikutukset). Siksi Duaklir Genuair ‑valmistetta on käytettävä varoen potilaille, joilla on tai on aiemmin ollut sydämen rytmihäiriöitä tai joilla on sydämen rytmihäiriöiden riskitekijöitä.
Systeemiset vaikutukset
Duaklir Genuair -valmisteen käytössä on noudatettava varovaisuutta potilailla, joilla on vaikea sydän- ja verisuonitauti, kouristuksia aiheuttava sairaus, tyreotoksikoosi ja feokromosytooma (lisämunuaisydinkasvain).
Suurilla β2-adrenergisten agonistien annoksilla saattaa ilmetä hyperglykeemisiä ja hypokaleemisia aineenvaihdunnan muutoksia. Vaiheen III kliinisissä tutkimuksissa havaittujen Duaklir Genuair -valmisteen aiheuttamien huomattavien veren glukoosipitoisuuksien nousujen esiintyminen oli vähäistä (0,1 %) ja lumelääkettä vastaava. Hypokalemia on tavallisesti ohimenevä eikä vaadi korvaushoitoa. Vaikeaa keuhkoahtaumatautia sairastavilla potilailla hypokalemia saattaa pahentua hypoksian ja samanaikaisen hoidon vuoksi (ks. kohta Yhteisvaikutukset). Hypokalemia suurentaa alttiutta sydämen rytmihäiriöille.
Antikolinergisen vaikutuksensa vuoksi Duaklir Genuair -valmistetta on käytettävä varoen potilaille, joilla on oireista eturauhasen liikakasvua, virtsaumpi tai ahdaskulmaglaukooma (vaikka valmisteen suora kosketus silmiin on hyvin epätodennäköistä). Suun kuivuminen, jota on havaittu antikolinergisen hoidon yhteydessä, saattaa pitkään jatkuessaan aiheuttaa kariesta.
Sisältää laktoosia
Potilaiden, joilla on harvinainen perinnöllinen galaktoosi-intoleranssi, täydellinen laktaasinpuutos tai glukoosi-galaktoosi-imeytymishäiriö, ei pidä käyttää tätä lääkettä.
Yhteisvaikutukset
Keuhkoahtaumataudin hoitoon käytetyt lääkkeet
Duaklir Genuair -valmisteen samanaikaista käyttöä muiden antikolinergisten lääkkeiden ja/tai pitkävaikutteista β2-adrenergista agonistia sisältävien lääkkeiden kanssa ei ole tutkittu eikä niiden samanaikaista käyttöä siksi suositella.
Vaikka virallisia in vivo -yhteisvaikutustutkimuksia ei ole tehty Duaklir Genuair -valmisteella, sitä on käytetty samanaikaisesti muiden keuhkoahtaumataudin hoitoon käytettävien lääkkeiden kanssa, mm. lyhytvaikutteiset β2-adrenergiset bronkodilaattorit, metyyliksantiinit ja oraaliset ja inhaloitavat steroidit, ilman kliinistä näyttöä yhteisvaikutuksista.
Hypokalemian hoito
Samanaikainen hoito metyyliksantiinin johdannaisilla, steroideilla tai kaliumia säästämättömillä diureeteilla saattaa pahentaa β2-adrenergisten agonistien aiheuttamaa mahdollista hypokalemiaa, minkä vuoksi näiden valmisteiden samanaikaisessa käytössä on noudatettava varovaisuutta (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Beetasalpaajat
Beetasalpaajat saattavat heikentää β2-adrenergisten agonistien vaikutusta tai toimia näiden vastavaikuttajina. Jos beetasalpaajien (mukaan lukien silmätipat) käyttö on tarpeen, suositellaan kardioselektiivisiä beetasalpaajia, joiden käytössä on silti noudatettava varovaisuutta.
Muut farmakodynaamiset yhteisvaikutukset
Duaklir Genuair -valmisteen käytössä on noudatettava varovaisuutta potilailla, joita hoidetaan lääkkeillä, joiden tiedetään pidentävän QTc-aikaa, kuten monoamiinioksidaasin estäjillä, trisyklisillä masennuslääkkeillä, antihistamiineilla tai makrolideilla, jotka saattavat tehostaa formoterolin (Duaklir Genuairin ainesosa) vaikutusta kardiovaskulaarijärjestelmään. Lääkkeet, joiden tiedetään pidentävän QTc-aikaa, lisäävät kammioperäisten rytmihäiriöiden riskiä.
Metaboliset yhteisvaikutukset
In vitro ‑tutkimusten perusteella aklidiniumin tai sen metaboliittien ei odoteta terapeuttisella annoksella aiheuttavan yhteisvaikutuksia P‑glykoproteiinin (P‑gp) substraattien tai sytokromi P450:n (CYP450) entsyymien ja esteraasien kautta metaboloituvien lääkkeiden kanssa. Formoteroli ei estä CYP450‑entsyymejä terapeuttisesti merkityksellisillä pitoisuuksilla (ks. kohta Farmakokinetiikka).
Raskaus ja imetys
Raskaus
Ei ole olemassa tietoja Duaklir Genuair -valmisteen käytöstä raskaana oleville naisille.
Eläinkokeissa on havaittu sikiötoksisuutta vain annostasoilla, jotka ovat ihmisen aklidiniumin enimmäisannoksia paljon suurempia ja haittavaikutuksia lisääntymistutkimuksissa, joissa formoterolia käytettiin erittäin suurilla systeemisillä annostasoilla (ks. kohta Prekliiniset tiedot turvallisuudesta).
Raskauden aikana Duaklir Genuair -valmistetta tulee käyttää vain, jos odotettavan hyödyn arvioidaan ylittävän mahdolliset riskit.
Imetys
Ei tiedetä, erittyykö aklidinium (ja/tai sen metaboliitit) tai formoteroli ihmisen rintamaitoon. Koska rotilla tehdyissä eläinkokeissa maitoon on erittynyt pieniä määriä aklidiniumia (ja/tai sen metaboliitteja) ja formoterolia, tulee Duaklir Genuair -valmisteen käyttöä imettäville naisille harkita vain, jos odotettu hyöty äidille on suurempi kuin mahdollisesti lapseen kohdistuva riski.
Hedelmällisyys
Eläinkokeissa rotilla on havaittu pientä hedelmällisyyden heikkenemistä vain annostasoilla, jotka ovat ihmisen aklidiniumin ja formoterolin enimmäisannoksia paljon suurempia (ks. kohta Prekliiniset tiedot turvallisuudesta). On kuitenkin epätodennäköistä, että Duaklir Genuair vaikuttaa ihmisen hedelmällisyyteen suositeltuina annoksina.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Duaklir Genuair -valmisteella ei ole haitallista vaikutusta tai on vähäinen vaikutus ajokykyyn ja koneiden käyttökykyyn. Näön hämärtymisen tai huimauksen esiintyminen saattaa vaikuttaa ajokykyyn tai koneiden käyttökykyyn.
Haittavaikutukset
Turvallisuusprofiili perustuu Duaklir Genuair -valmisteesta ja sen yksittäisistä ainesosista saatuihin kokemuksiin.
Turvallisuusprofiilin yhteenveto
Turvallisuustieto käsittää Duaklir Genuair -valmisteen käytön kliinisissä tutkimuksissa suositellulla terapeuttisella annoksella 12 kuukauteen saakka ja myyntiluvan myöntämisen jälkeiset havainnot.
Duaklir Genuair -valmisteeseen liittyvät haittavaikutukset olivat samankaltaisia kuin yksittäisten lääkeaineiden aiheuttamat haittavaikutukset. Koska Duaklir Genuair sisältää aklidiniumia ja formoterolia, kumpaankin lääkeaineeseen liittyvien haittavaikutusten tyyppi ja vaikeusaste on odotettavissa myös Duaklir Genuair -valmistetta käytettäessä.
Yleisimmin ilmoitettuja Duaklir Genuair -hoidon yhteydessä ilmenneitä haittavaikutuksia ovat nenänielun tulehdus (7,9 %) ja päänsärky (6,8 %).
Taulukoitu yhteenveto haittavaikutuksista
Duaklir Genuair -valmisteen kliininen kehitysohjelma suoritettiin potilailla, joilla oli keskivaikea tai vaikea keuhkoahtaumatauti. Yhteensä 1 222 potilasta hoidettiin Duaklir Genuair 340 mikrogrammaa/12 mikrogrammaa -valmisteella. Lääkkeen haittavaikutusten esiintyvyys perustuu vakioimattomiin haittavaikutusten ilmaantuvuuksiin, jotka havaittiin Duaklir Genuair 340 mikrogrammaa/12 mikrogrammaa -valmisteella vähintään kuusi kuukautta kestäneiden, satunnaistettujen, lumelääkekontrolloitujen vaiheen III kliinisten tutkimusten yhdistetyssä analyysissä tai valmisteen yksittäisistä vaikuttavista aineista saatuihin kokemuksiin tai markkinoille tulon jälkeisten tutkimusten tuloksiin.
Haittavaikutusten esiintyvyys on määritelty seuraavasti: hyvin yleinen (≥ 1/10); yleinen (≥ 1/100 < 1/10); melko harvinainen (≥ 1/1 000 < 1/100); harvinainen (≥ 1/10 000 < 1/1 000); hyvin harvinainen (< 1/10 000) ja tuntematon (koska saatavissa oleva tieto ei riitä arviointiin).
| Elinjärjestelmäluokka | Suositeltu termi | Yleisyys |
| Infektiot | Nenänielun tulehdus Virtsatietulehdus Sinuiitti Hampaan märkäpesäke | Yleinen |
| Immuunijärjestelmä | Yliherkkyys | Harvinainen |
| Angioedeema Anafylaktinen reaktio | Tuntematon | |
| Aineenvaihdunta ja ravitsemus | Hypokalemia | Melko harvinainen |
| Hyperglykemia | Melko harvinainen | |
| Psyykkiset häiriöt | Unettomuus Ahdistuneisuus | Yleinen |
| Kiihtyneisyys | Melko harvinainen | |
| Hermosto | Päänsärky Huimaus Vapina | Yleinen |
| Makuhäiriö | Melko harvinainen | |
| Silmät | Hämärtynyt näkö | Melko harvinainen |
| Sydän | Sydämen rytmihäiriöt, mukaan lukien eteisvärinä ja paroksysmaalinen takykardia Takykardia | Melko harvinainen |
| Hengityselimet, rintakehä ja välikarsina | Yskä | Yleinen |
| Dysfonia Kurkun ärtyminen | Melko harvinainen | |
| Bronkospasmi mukaan lukien paradoksaalinen bronkospasmi | Harvinainen | |
| Ruoansulatuselimistö | Ripuli Pahoinvointi Suun kuivuminen | Yleinen |
| Stomatiitti | Melko harvinainen | |
| Iho ja ihonalainen kudos | Ihottuma Kutina | Melko harvinainen |
| Luusto, lihakset ja sidekudos | Lihassärky Lihasspasmit | Yleinen |
| Munuaiset ja virtsatiet | Virtsaumpi | Melko harvinainen |
| Tutkimukset | Kohonnut veren kreatiinikinaasi | Yleinen |
| Kohonnut verenpaine | Melko harvinainen |
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Duaklir Genuair -valmisteen yliannostuksen hallinnasta on vain niukasti näyttöä. Suuret Duaklir Genuair -annokset saattavat aiheuttaa voimistuneita antikolinergisia ja/tai β2-adrenergisia löydöksiä ja oireita, joista yleisimpiin kuuluvat näön hämärtyminen, suun kuivuminen, pahoinvointi, lihasspasmit, vapina, päänsärky, sydämentykytys ja kohonnut verenpaine.
Duaklir Genuair -valmisteen käyttö tulee keskeyttää yliannostustapauksessa. Tuki- tai oireenmukainen hoito on tarpeen.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Obstruktiivisten hengitystiesairauksien lääkkeet, adrenergiset lääkeaineet yhdistelmävalmisteina antikolinergien kanssa, ATC-koodi: R03AL05.
Vaikutusmekanismi
Duaklir Genuair sisältää kahta keuhkoputkia avaavaa lääkeainetta; aklidinium on pitkävaikutteinen muskariiniantagonisti (tunnetaan myös nimellä antikolinergi), ja formoteroli on pitkävaikutteinen β2-adrenerginen agonisti. Näiden eri vaikutusmekanismilla toimivien aineiden yhdistelmän tuloksena saadaan suurempi teho verrattuna jompaankumpaan lääkeaineeseen yksinään. Keuhkojen keskeisten ja ääreisilmateiden muskariinireseptori- ja β2-adrenoreseptoritiheyden eron vuoksi muskariiniantagonistit ovat tehokkaampia rentouttamaan keskeisiä ilmateitä, kun taas β2-adrenergiset agonistit rentouttavat ääreisilmateitä tehokkaammin; sekä keskeisten että ääreisilmateiden rentouttaminen yhdistelmälääkityksellä voi selittää suotuisan vaikutuksen keuhkojen toimintaan. Lisätietoja näistä kahdesta lääkeaineesta kerrotaan alla.
Aklidinium on kompetitiivinen, selektiivinen muskariinireseptoriantagonisti, jonka viipymä M3-reseptoreissa on pidempi kuin M2-reseptoreissa. M3-reseptorit välittävät hengitysteiden sileän lihaksen supistumista. Inhaloitu aklidiniumbromidi vaikuttaa keuhkoissa paikallisesti estäen hengitysteiden sileän lihaksen M3-reseptoreita ja saaden aikaan bronkodilataation. Aklidiniumin on myös osoitettu tuottavan keuhkoahtaumatautia sairastaville potilaille hyötyä oireiden vähenemisenä, parantuneena tautikohtaisena terveystilana, pahenemisvaiheiden vähentymisenä ja parantuneena liikuntakestävyytenä. Aklidiniumbromidi hajoaa plasmassa nopeasti, ja sen vuoksi systeemiset antikolinergiset haittavaikutukset ovat vähäisiä.
Formoteroli on voimakas, selektiivinen β2-adrenergisen reseptorin agonisti. Keuhkoputkia laajentava vaikutus aiheutuu suorasta hengitysteiden sileän lihaksen relaksaatiovaikutuksesta, joka puolestaan johtuu syklisen AMP:n lisääntymisestä adenylattisyklaasin aktivaation kautta. Keuhkotoimintaa parantavan vaikutuksensa lisäksi formoterolin on osoitettu lievittävän keuhkoahtaumataudin oireita ja kohentavan sitä sairastavien potilaiden elämänlaatua.
Farmakodynaamiset vaikutukset
Tutkimukset valmisteen kliinisestä tehosta osoittivat, että Duaklir Genuair paransi kliinisesti merkitsevästi keuhkojen toimintaa (mitattuna uloshengityksen sekuntikapasiteettina, FEV1) 12 tunnin ajan lääkkeen ottamisesta.
Duaklir Genuairin vaikutus alkoi nopeasti 5 minuutissa ensimmäisestä inhaloidusta annoksesta verrattuna lumelääkkeeseen (p < 0,0001). Duaklir Genuairin vaikutuksen alkaminen oli verrattavissa 12 mikrogrammaan nopeavaikutteista β2-agonistia formoterolia. Keuhkoputkia avaava enimmäisvaikutus (FEV1:n huippuarvo) verrattuna lähtötasoon oli nähtävissä päivästä yksi alkaen (304 ml) ja säilyi kuusi kuukautta kestäneen hoitojakson ajan (326 ml).
Sydämen elektrofysiologia
Noin 4 000 keuhkoahtaumatautipotilaalla suoritetuissa, 6-12 kuukautta kestäneissä Duaklir Genuair -hoitoa arvioivissa vaiheen III tutkimuksissa ei havaittu kliinisesti merkitseviä vaikutuksia EKG-parametreihin (mukaan lukien QT-aika) verrattuna aklidiniumiin, formoteroliin ja lumelääkkeeseen. Duaklir Genuair -hoidolla ei havaittu olevan kliinisesti merkitsevää vaikutusta sydämen rytmiin 551 potilaalla (joista 114 sai Duaklir Genuair -valmistetta kaksi kertaa vuorokaudessa) 24 tunnin Holter-seurannassa.
Kliininen teho ja turvallisuus
Vaiheen III kliiniseen kehitysohjelmaan kuului noin 4 000 kliinisen keuhkoahtaumatautidiagnoosin saanutta potilasta, ja ohjelma koostui kahdesta kuusi kuukautta kestäneestä satunnaistetusta, lumelääke- ja aktiivikontrolloidusta tutkimuksesta (ACLIFORM-COPD ja AUGMENT), AUGMENT-tutkimuksen kuusi kuukautta kestäneestä jatkotutkimuksesta ja näiden lisäksi yhdestä 12 kuukautta kestäneestä satunnaistetusta kontrolloidusta tutkimuksesta. Näiden tutkimusten aikana potilaat saivat jatkaa vakiintunutta hoitoaan inhaloitavilla kortikosteroideilla, pieniannoksisilla suun kautta otettavilla kortikosteroideilla, happihoidoilla (jos alle 15 h/vrk) tai metyyliksantiineilla ja saivat käyttää salbutamolia kohtauslääkkeenä.
Tehoa arvioitiin mittaamalla keuhkojen toimintaa sekä oireenmukaisten hoitotulosten, tautikohtaisen terveydentilan, kohtauslääkityksen ja pahenemisvaiheiden ilmaantumisen perusteella. Pitkän aikavälin turvallisuustutkimuksissa Duaklir Genuair teho säilyi ilman merkkejä takyfylaksista, kun hoito on kestänyt yli vuoden.
Vaikutus keuhkojen toimintaan
Kaksi kertaa vuorokaudessa otettuna Duaklir Genuair 340/12 mikrogrammaa paransi kliinisesti merkitsevästi keuhkotoimintaa (FEV1-arvolla, nopealla vitaalikapasiteetilla ja sisäänhengityskapasiteetilla arvioituna) verrattuna lumelääkkeeseen. Vaiheen III tutkimuksissa nähtiin kliinisesti merkitsevä bronkodilatoiva vaikutus 5 minuutissa ensimmäisestä annoksesta ja vaikutus säilyi annosjaksojen välillä. Vaikutus säilyi kuusi kuukautta ja yhden vuoden kestäneiden vaiheen III tutkimusten ajan.
FEV1 yksi tunti annoksen jälkeen ja FEV1-jäännösarvo (verrattuna 400 mikrogrammaan aklidiniumia ja 12 mikrogrammaan formoterolia, vastaavasti) määriteltiin ensisijaisiksi päätetapahtumiksi molemmissa kuusi kuukautta kestäneissä vaiheen III pivotaalitutkimuksissa, joilla osoitettiin Duaklir Genuair -valmisteen formoterolin ja aklidiniumin keuhkoputkia avaava vaikutus.
ACLIFORM-COPD-tutkimuksessa Duaklir Genuair paransi FEV1-arvoa yksi tunti annoksen jälkeen verrattuna lumelääkkeeseen (299 ml) ja aklidiniumiin (125 ml) (kumpikin p < 0,0001) sekä paransi FEV1-jäännösarvoa verrattuna lumelääkkeeseen (143 ml) ja formoteroliin (85 ml) (kumpikin p < 0,0001). AUGMENT-tutkimuksessa Duaklir Genuair paransi FEV1-arvoa yksi tunti annoksen jälkeen verrattuna lumelääkkeeseen (284 ml) ja aklidiniumiin (108 ml) (kumpikin p < 0,0001) sekä paransi FEV1-jäännösarvoa verrattuna lumelääkkeeseen (130 ml) ja formoteroliin (45 ml) (p < 0,01).
Oireiden lievitys ja tautikohtainen terveydentila
Hengenahdistus ja muut symptomaattiset muutokset:
Duaklir Genuair lievensi potilaiden hengenahdistusta kliinisesti merkitsevästi (Transition Dyspnoea -indeksin [TDI] perusteella arvioituna). 6 kuukauden kohdalla todettiin TDI-pisteytyksen parantuminen 1,29 yksiköllä lumelääkkeeseen verrattuna ACLIFORM-COPD-tutkimuksessa (p < 0,0001) ja 1,44 yksiköllä AUGMENT-tutkimuksessa (p < 0,0001). Kliinisesti merkitsevän TDI-pisteytyksen paranemisen (määritelmänä nousu vähintään yhdellä yksiköllä) lähtötasoon nähden saavuttaneiden potilaiden prosenttiosuus oli suurempi Duaklir Genuair -valmistetta käyttäneillä kuin lumelääkettä käyttäneillä ACLIFORM-COPD -tutkimuksessa (64,8 % verrattuna 45,5 %:iin, p < 0,001) ja AUGMENT-tutkimuksessa (58,1 % verrattuna 36,6 %:iin, p < 0,0001).
Näiden kahden tutkimuksen yhdistetyn analyysin perusteella Duaklir Genuair -valmisteen käytön todettiin liittyvän tilastollisesti merkitsevästi enemmän parantuneeseen TDI-yhteispisteytykseen verrattuna aklidiniumiin (0,4 yksikköä, p = 0,016) tai formoteroliin (0,5 yksikköä, p = 0,009). Tämän lisäksi suuremmalla osalla Duaklir Genuair -valmistetta saaneista potilaista ilmeni kliinisesti merkitsevä paraneminen TDI-yhteispisteytyssä verrattuna joko aklidiniumiin (61,9 % verrattuna arvoon 55,7 %; p = 0,056) tai formoteroliin (61,9 % verrattuna arvoon 57,0 %; p = 0,100).
Duaklir Genuair lievensi keuhkoahtaumataudin päiväsaikaan ilmeneviä oireita, kuten ’hengenahdistus’, ’rinnassa tuntuvat oireet’ ja ’yskä ja yskös’, (arvioituna hoitotehoa mittaavalla E-RS-kyselyllä) sekä yöaikaisia ja varhaisen aamun oireita ja varhaisen aamun toimia rajoittavia oireita verrattuna lumelääkkeeseen, aklidiniumiin ja formoteroliin, mutta oireiden lievittyminen ei aina ollut tilastollisesti merkitsevä. Aklidiniumi/formoteroli ei vähentänyt tilastollisesti merkitsevästi keuhkoahtaumataudista johtuvia yöaikaisia heräämisiä verrattuna lumelääkkeeseen tai formoteroliin.
Terveyteen liittyvä elämänlaatu:
Duaklir Genuair paransi tautikohtaista terveydentilaa (St. George’s Respiratory -kyselylomakkeella [SGRQ] arvioituna) AUGMENT-tutkimuksessa, jossa SGRQ-pistetys parani -4,34 yksiköllä verrattuna lumelääkkeeseen (p < 0,0001). Kliinisesti merkitsevän kohentumisen SGRQ-pisteytyksessä lähtötasoon nähden (määritelmänä nousu vähintään 4 yksiköllä) saavuttaneiden potilaiden prosenttiosuus AUGMENT-tutkimuksessa oli suurempi Duaklir Genuair –valmistetta käyttäneillä (58,2 %) verrattuna lumelääkkeeseen (38,7 %, p < 0,001). ACLIFORM-COPD -tutkimuksessa havaittiin vain pieni lasku verrattuna lumelääkkeeseen ennakoitua suuremman lumelääkevasteen vuoksi (p = 0,598). Kliinisesti merkitsevän kohennuksen lähtötasoon nähden saavuttaneiden potilaiden prosenttiosuus oli 55,3 % Duaklir Genuair –valmistetta käyttäneillä ja 53,2 % lumelääkettä käyttäneillä (p = 0,669).
Näiden kahden tutkimuksen yhdistetyssä analyysissä Duaklir Genuair paransi SGRQ-kokonaispisteytystä enemmän verrattuna formoteroliin (-1,7 yksikköä; p = 0,018) tai aklidiniumiin (-0,79 yksikköä, p = 0,273). Tämän lisäksi suuremmalla osalla Duaklir Genuairia saaneista potilaista saatiin kliinisesti merkitsevä paraneminen SGRQ-yhteispisteytyksessä verrattuna joko aklidiniumiin (56,6 % verrattuna arvoon 53,9 %; p = 0,603), tai formoteroliin (56,6 % verrattuna arvoon 52,2 %; p = 0,270).
Keuhkoahtaumataudin pahenemisvaiheiden väheneminen
Kahden kuusi kuukautta kestäneen vaiheen III tutkimuksen yhdistetyt analyysit osoittivat tilastollisesti merkitsevän, 29 % suuruisen, keskivaikeiden tai vaikeiden pahenemisvaiheiden (vaativat antibiootti- tai kortikosteroidihoitoa tai johtivat sairaalahoitoon) vähenemisen Duaklir Genuair -valmistetta käytettäessä verrattuna lumelääkkeeseen (arvot potilasta ja vuotta kohti: 0,29 Duaklir Genuair -ryhmässä ja 0,42 lumelääkeryhmässä, p = 0,036).
Tämän lisäksi aika ensimmäiseen keskivaikeaan tai vaikeaan pahenemisvaiheeseen piteni tilastollisesti merkitsevästi Duaklir Genuairia käytettäessä verrattuna lumelääkkeeseen (riskisuhde = 0,70; p = 0,027).
Kohtauslääkkeen käyttö
Duaklir Genuair vähensi kohtauslääkkeen käyttötarvetta kuuden kuukauden aikana verrattuna lumelääkkeeseen (0,9 henkäyksellä/vrk [p < 0,0001]), aklidiniumiin (0,4 henkäyksellä/vrk [p < 0,001]) ja formoteroliin (0,2 henkäyksellä/vrk [p = 0,062]).
Keuhkotilavuudet, liikuntakestävyys ja fyysinen aktiivisuus
Duaklir Genuair ‑valmisteen vaikutusta keuhkotilavuuksiin, liikuntakestävyyteen ja fyysiseen aktiivisuuteen tutkittiin 8 viikon mittaisessa rinnakkaisryhmillä toteutetussa, satunnaistetussa, lumekontrolloidussa kliinisessä tutkimuksessa keuhkoahtaumatautia sairastavilla potilailla, joilla ilmenee hyperinflaatiota (toiminnallinen jäännöstilavuus [FRC] > 120 %).
4 viikon hoidon jälkeen todettiin viitteitä siitä, että Duaklir Genuair paransi lumelääkkeeseen verrattuna aamulla ennen lääkeannoksen ottamista mitattua toiminnallista jäännöstilavuutta (trough) lähtötilanteesta (ensisijainen päätemuuttuja), mutta ero ei ollut tilastollisesti merkitsevä (‑0,125 l; 95 %:n luottamusväli = (‑0,259, 0,010); p = 0,069*).
Duaklir Genuair paransi 2–3 tunnin kuluttua annoksen saamisesta mitattuja keuhkotilavuuksia lumelääkkeeseen verrattuna (toiminnallinen jäännöstilavuus = ‑0,366 l [95 %:n luottamusväli = ‑0,515, ‑0,216; p < 0,0001]; jäännöstilavuus = ‑0,465 l [95 %:n luottamusväli = ‑0,648, ‑0,281; p < 0,0001] ja sisäänhengityskapasiteetti = 0,293 l [95 %:n luottamusväli = 0,208, 0,378; p < 0,0001]).
8 viikon hoidon jälkeen Duaklir Genuair oli parantanut myös liikuntakestävyysaikaa lumelääkkeeseen nähden (55 sekuntia [95 %:n luottamusväli = 5,6, 104,8; p = 0,0292]; lähtötilanne: 456 sekuntia).
4 viikon hoidon jälkeen Duaklir Genuair oli parantanut päivittäistä askelmäärää lumelääkkeeseen verrattuna (731 askelta/vrk; 95 %:n luottamusväli = 279, 1 181; p = 0,0016) ja vähentänyt passiivisten potilaiden (< 6 000 askelta vuorokaudessa) prosentuaalista osuutta (40,8 % verrattuna 54,5 %:iin; p < 0,0001). Duaklir Genuair -hoitoa saaneilla potilailla PROactive-kokonaispistemäärissä havaittiin parannuksia lumelääkkeeseen verrattuna (p = 0,0002).
Molempien hoitoryhmien potilaat noudattivat lisäksi 4 viikon ajan liikuntakäyttäytymistä muuttavaa ohjelmaa. Päivittäisten askelten määrä säilyi Duaklir Genuair -hoitoryhmässä ennallaan aikaansaaden hoitovaikutuksen lumelääkeryhmään verrattuna (510 askelta/vrk (p = 0,1588)). Lisäksi passiivisten potilaiden (< 6 000 askelta vuorokaudessa) prosentuaalinen osuus pieneni (41,5 % verrattuna 50,4 %:iin; p = 0,1134).
*Ensisijaisen päätemuuttujan suhteen ei saavutettu tilastollista merkitsevyyttä, joten kaikki toissijaisten päätemuuttujien p-arvot testataan nimellisellä merkitsevyystasolla 0,05, eikä varsinaista tilastollista päättelyä voida tehdä.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset Duaklir Genuair -valmisteen käytöstä kaikkien pediatristen potilasalaryhmien keuhkoahtaumatautien hoidossa (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Kun aklidinium ja formoteroli annettiin yhdessä inhalaationa, kummankaan lääkeaineen farmakokinetiikassa ei esiintynyt relevantteja eroja verrattuna siihen, mitä havaittiin kummankin lääkeaineen annossa erikseen.
Imeytyminen
Yhden Duaklir Genuair 340/12 mikrogrammaa -inhalaatioannoksen jälkeen aklidinium ja formoteroli imeytyivät nopeasti plasmaan ja huippupitoisuudet plasmassa saavutettiin terveiden tutkimushenkilöiden elimistössä 5 minuutin kuluessa inhalaatiosta ja keuhkoahtaumapotilaiden elimistössä 24 minuutissa. Aklidiniumin ja formoterolin vakaan tilan huippupitoisuudet plasmassa saavutettiin inhalaation jälkeen 5 minuutissa (Duaklir Genuair -valmistetta kahdesti vuorokaudessa 5 päivän ajan) keuhkoahtaumapotilailla. Huippupitoisuudet olivat 128 pg/ml (aklidinium) ja 17 pg/ml (formoteroli).
Jakautuminen
Genuair-inhalaattorin kautta inhaloidun aklidiniumin kokonaiskulkeutuma keuhkoihin on keskimäärin 30 % mitatusta annoksesta. Aklidiniumia sitoutuminen plasman proteiineihin määritettynä in vitro tuotti tuloksen, joka todennäköisesti ilmaisi metaboliittien sitoutumista, sillä aklidiniumbromidi hydrolysoituu nopeasti plasmassa; karboksyylihappometaboliitti sitoutuu plasman proteiineihin 87-prosenttisesti ja alkoholimetaboliitti 15-prosenttisesti. Pääasiallinen aklidiniumia sitova plasman proteiini on albumiini.
61–64 % formoterolista sitoutuu plasman proteiineihin (34 % sitoutuu pääasiallisesti albumiiniin). Terapeuttisten annosten pitoisuusalueilla ei saavuteta sitoutumispaikkojen kyllästymistä.
Biotransformaatio
Aklidinium hydrolysoituu nopeasti ja kattavasti sen farmakologisesti inaktiivisiksi alkoholi- ja karboksyylihappojohdannaisiksi. Happometaboliitin tasot plasmassa ovat noin 100-kertaisia alkoholimetaboliittien tasoihin sekä inhalaatiosta saatavaan muuttumattomaan vaikuttavaan aineeseen verrattuna. Hydrolysoituminen tapahtuu sekä kemiallisesti (ei-entsymaattisesti) että entsymaattisesti esteraasien kautta. Butyryylikoliiniesteraasi on pääasiallinen esteraasi hydrolysoitumisessa. Inhaloidun aklidiniumin pieni absoluuttinen hyötyosuus (< 5 %) johtuu siitä, että keuhkoihin kertynyt tai nielty aklidinium hydrolysoituu perusteellisesti systeemisesti ja presysteemisesti. CYP450-entsyymien kautta tapahtuvalla biotransformaatiolla on vähäinen osuus aklidiniumin metabolisessa kokonaispuhdistumassa. In vitro -tutkimukset ovat osoittaneet, että terapeuttisina annoksina aklidinium tai sen metaboliitit eivät inhiboi tai indusoi mitään sytokromi P450:n (CYP450) entsyymejä eivätkä inhiboi esteraaseja (karboksyyliesteraasi, asetyylikoliiniesteraasi ja butyryylikoliiniesteraasi). In vitro -tutkimukset ovat osoittaneet, että aklidinium ja sen metaboliitit eivät ole P-glykoproteiinin substraatteja tai estäjiä.
Formoteroli poistuu pääasiallisesti aineenvaihdunnan kautta. Päämetaboliareitti on suora glukuronisaatio, ja lisämetaboliareitti on O-demetylaatio, jota seuraa glukuronidin konjugaatio. Sytokromi P450:n isoentsyymit CYP2D6, CYP2C19, CYP2C9 ja CYP2A6 osallistuvat formoterolin O-demetylaatioon. Formoteroli ei estä CYP450-entsyymejä terapeuttisesti oleellisilla pitoisuuksilla.
Eliminaatio
Duaklir Genuair 340/12 mikrogrammaa ‑inhalaatioannoksen antamisen jälkeen, kun plasmanäytteitä otettiin 24 tunnin ajan annoksen antamisesta, aklidiniumbromidin terminaalisen eliminaation puoliintumisaika oli 11–33 tuntia ja formoterolin 12–18 tuntia.
Sekä aklidiniumilla että formoterolilla havaitut keskimääräiset efektiiviset puoliintumisajat* (akkumulaatiosuhteen perusteella) ovat noin 10 tuntia.
*Puoliintumisaika, joka vastaa valmisteen akkumulaatiota ja perustuu tiedossa olevaa annosta käyttämällä toteutettuun hoitoon.
Radioaktiivisesti merkitystä, terveille tutkimushenkilöille laskimoon annetusta 400 mikrogrammasta aklidiniumia erittyi muuttumattomana aklidiniumbromidina virtsaan noin 1 %. Enintään 65 % annoksesta eliminoitui metaboliitteina virtsaan ja enintään 33 % metaboliitteina ulosteeseen. Terveiden tutkimushenkilöiden ja keuhkoahtaumatautipotilaiden inhaloitua 200 mikrogrammaa tai 400 mikrogrammaa aklidiniumia oli virtsaan erittyneen muuttumattoman aklidiniumin määrä hyvin vähäinen, noin 0,1 % annetusta annoksesta. Tämä viittaa siihen, että munuaispuhdistumalla on vähäinen osuus aklidiniumin plasman kokonaispuhdistumassa.
Suurin osa formoteroliannoksesta metaboloituu maksassa ja eliminoituu munuaisten kautta. Inhaloinnin jälkeen 6-9 % formoteroliannoksesta erittyy muuttumattomana tai suorina formoterolin konjugaatteina virtsaan.
Erityisryhmät
Iäkkäät potilaat
Farmakokineettisia tutkimuksia aklidiniumin ja formoterolin yhdistelmällä ei ole suoritettu iäkkäillä potilailla. Koska aklidiniumin tai formoterolin annosta ei tarvitse muuttaa iäkkäille potilaille, aklidiniumin ja formoterolin yhdistelmän annoksen muuttaminen potilaille ei myöskään ole tarpeen.
Maksan ja munuaisten vajaatoiminta
Ei ole tietoja aklidiniuminin ja formoterolin yhdistelmän erityisestä käytöstä maksan tai munuaisten vajaatoimintaa sairastaville potilaille. Koska aklidiniumin tai formoterolin annoksen muuttaminen ei ole tarpeen potilaille, joilla on maksan tai munuaisten vajaatoimintaa, aklidiniumin ja formoterolin yhdistelmän annoksen muuttaminen ei myöskään ole tarpeen.
Rotu
Toistuvien Duaklir Genuair 340/12 mikrogrammaa ‑inhalaatioiden jälkeen AUC-arvoilla mitatut systeemiset aklidinium- ja formoterolialtistukset olivat japanilaisilla ja valkoihoisilla potilailla yhtä suuret.
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta, geenitoksisuutta sekä karsinogeenisuutta koskevien konventionaalisten, aklidiniumilla ja formoterolilla tehtyjen tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Prekliinisissä tutkimuksissa aklidiniumin havaittiin lisääntymistoksisuutta (sikiötoksiset vaikutukset) ja vaikutusta hedelmällisyyteen (lievä lasku hedelmöittymisluvuissa ja keltarauhasten määrässä sekä munasolun kiinnittymistä edeltäviä ja sen jälkeisiä keskenmenoja) vain ihmisen enimmäisannoksia huomattavasti suuremmilla annoksilla. Kliinisen käytön kannalta niiden merkitys on siten vähäinen.
Suuret systeemiset formoteroliannokset heikensivät hedelmällisyyttä (kiinnittyneen munasolun keskenmeno) rotilla, heikensivät aikaista syntymänjälkeistä eloonjääntiä ja pienensivät syntymäpainoa. Kohdun leiomyoomien esiintymistiheydessä havaittiin pieni kasvu rotilla ja hiirillä; tämä katsotaan luokkavaikutukseksi jyrsijöillä, joita on altistettu pitkään suurille β2-adrenoreseptoriantagonistiannoksille.
Prekliinisissä aklidiniumin/formoterolin vaikutuksia kardiovaskulaarisiin parametreihin arvioivissa tutkimuksissa havaittiin nopeutunutta sydämensykettä ja rytmihäiriöitä vain ihmisen enimmäisannoksia huomattavasti suuremmilla annoksilla. Kliinisen käytön kannalta niiden merkitys on siten vähäinen. Nämä vaikutukset ovat tunnettuja, voimistuneita β2-agonistien farmakologisia vasteita.
Farmaseuttiset tiedot
Apuaineet
Laktoosimonohydraatti.
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta.
Käytettävä 60 päivän aikana suojapussin avaamisesta.
Säilytys
Tämä lääkevalmiste ei vaadi lämpötilan suhteen erityisiä säilytysolosuhteita. Pidä Genuair -inhalaattori suljetussa suojapussissa, kunnes aloitat lääkkeen käytön.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
DUAKLIR GENUAIR inhalaatiojauhe
340/12 mikrog (L:kyllä) 60 annosta (Genuair-inhalaattori) (58,06 €), 3 x 60 annosta (Genuair-inhalaattori) (162,10 €)
PF-selosteen tieto
Genuair-inhalaattori on useista osista koostuva laite, joka on valmistettu muovista (polykarbonaatista, akryylinitriilibutadieenistyreenistä, polyasetaalista, polybuteenitereftalaatista, polypropeenista, polystyreenistä) ja ruostumattomasta teräksestä. Se on väriltään valkoinen ja siinä on kiinteä annoslaskuri ja oranssi annostelupainike. Suukappale on peitetty irrotettavalla oranssinvärisellä suojakorkilla. Inhalaattori toimitetaan sinetöidyssä, alumiinifoliosta valmistetussa suojapussissa, jossa on silikageelikuivausainetta sisältävä pussi.
Pakkaus, jossa on yksi 30 annosta sisältävä inhalaattori.
Pakkaus, jossa on yksi 60 annosta sisältävä inhalaattori.
Pakkaus, jossa on kolme 60 annosta sisältävää inhalaattoria.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Valkoinen tai liki valkoinen jauhe valkoisessa inhalaattorissa, jossa on kiinteä annoslaskuri ja oranssi annostelupainike.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Käyttöohjeet
Aluksi:
Lue nämä käyttöohjeet ennen kuin käytät lääkevalmistetta.
Tutustu Genuair-inhalaattorin osiin.
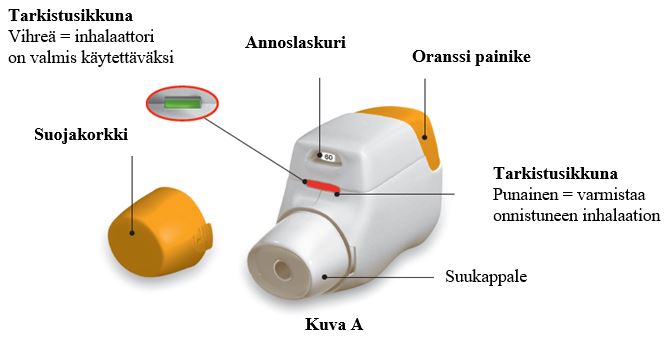
Ennen käyttöä:
a. Repäise suljettu pussi auki ennen ensimmäistä käyttökertaa ja ota inhalaattori pussista. Voit heittää pussin ja kuivausainetta sisältävän pussin roskiin.
b. Älä paina oranssia painiketta ennen kuin olet valmis ottamaan annoksen.
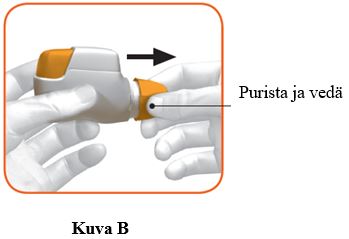
c. Poista suojakorkki puristamalla kevyesti sen kummallakin puolella näkyviä nuolia (kuva B).
VAIHE 1: Valmistele annos
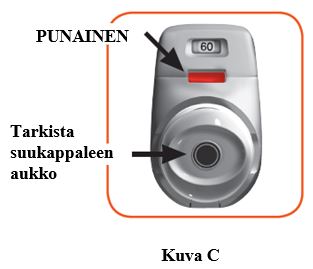
1.1 Tarkista suukappaleen aukko ja varmista, ettei mikään tuki suukappaletta (kuva C).
1.2 Tarkista tarkistusikkuna (sen pitäisi olla punainen, kuva C).
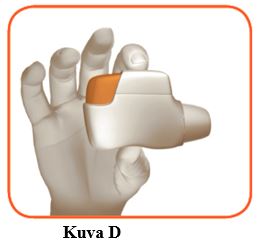
1.3 Pidä inhalaattori vaakatasossa siten, että suukappale on itseesi päin ja oranssi painike on ylhäällä (kuva D).
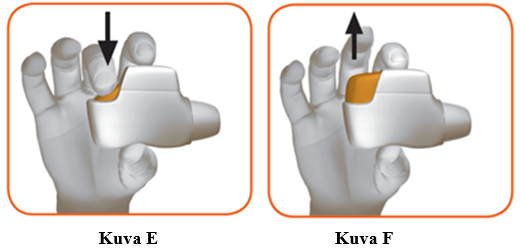
1.4 Paina oranssi painike kokonaan alas ladataksesi annoksen (kuva E).
Kun painat painikkeen kokonaan alas, tarkistusikkunan väri muuttuu punaisesta vihreäksi.
Varmista, että oranssi painike on ylhäällä. Äläkallista. |
1.5 Vapauta oranssi painike (kuva F).
Varmista, että vapautat painikkeen, jotta inhalaattori toimii oikein. |
Pysähdy ja tarkista:
1.6 Varmista, että tarkistusikkunan väri on nyt vihreä (kuva G).
Lääkevalmiste on valmiina inhalaatiota varten.
Siirry vaiheeseen 2: Lääkevalmisteen inhalointi.

Mitä tehdä, jos tarkistusikkunan väri on yhä punainen painikkeen painamisen jälkeen (kuva H).
Annos ei ole valmis. Palaa vaiheeseen 1 Valmistele annos ja toista vaiheet 1.1–1.6. |
VAIHE 2: lääkevalmisteen inhalointi
Lue vaiheet 2.1–2.7 ennen käyttöä. Älä kallista. |
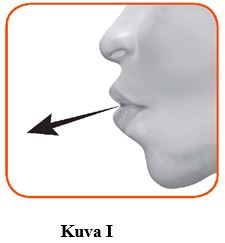
2.1 Pidä inhalaattori kaukana suusta ja hengitä keuhkot tyhjiksi. Älä koskaan uloshengitä inhalaattoriin (kuva I).
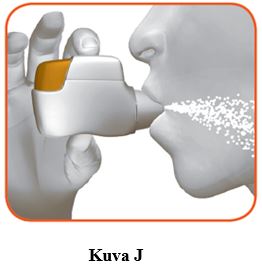
2.2 Pidä pää suorassa, aseta suukappale huulten väliin ja sulje huulet tiukasti suukappaleen ympärille (kuva J).
Älä pidä oranssia painiketta alas painettuna sisäänhengityksen aikana. |
2.3 Sisäänhengitä voimakkaasti ja syvään suun kautta. Jatka sisäänhengitystä niin kauan kuin mahdollista.
Naksahdus kertoo, että inhaloit oikein. Jatka sisäänhengitystä myös naksahduksen kuulemisen jälkeen niin kauan kuin mahdollista. Kaikki potilaat eivät kuule naksahdusta. Varmista tarkistusikkunasta, että olet inhaloinut oikein. |
2.4 Ota inhalaattori pois suusta.
2.5 Pidätä hengitystä niin kauan kuin mahdollista.
2.6 Hengitä hitaasti ulos poispäin inhalaattorista.
Jotkut potilaat saattavat tuntea hiukkasmaisen tunteen suussaan tai hiukan makean tai kitkerän maun. Älä ota uutta annosta, vaikka et huomaisi mitään makua tai tuntisi hiukkasia sisäänhengityksen jälkeen. |
Pysähdy ja tarkista:
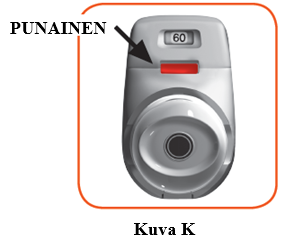
2.7 Varmista, että tarkistusikkunan väri on nyt punainen (kuva K). Tämä tarkoittaa, että olet inhaloinut lääkevalmisteen oikein.
Mitä tehdä, jos tarkistusikkunan väri on yhä vihreä inhalaation jälkeen (kuva L).
Tämä tarkoittaa, että et ole inhaloinut lääkevalmistetta oikein. Palaa vaiheeseen 2 Lääkevalmisteen inhalointi ja toista kohdat 2.1–2.7. Jos tarkistusikkuna ei vieläkään muutu punaiseksi, olet ehkä unohtanut vapauttaa oranssin painikkeen ennen inhalointia tai et ole hengittänyt sisään tarpeeksi voimakkaasti. Jos näin käy, yritä uudelleen. Varmista, että olet vapauttanut oranssin painikkeen, ja hengitä keuhkot tyhjiksi. Hengitä sitten sisään voimakkaasti ja syvään suukappaleen läpi. Ota yhteyttä lääkäriin, jos tarkistusikkunan väri on yhä vihreä usean yrityksen jälkeen. |
Laita suojakorkki takaisin suukappaleeseen jokaisen käyttökerran jälkeen (kuva M) estääksesi inhalaattorin altistumisen pölylle tai muille materiaaleille. Sinun on hävitettävä inhalaattori, jos hukkaat suojakorkin.
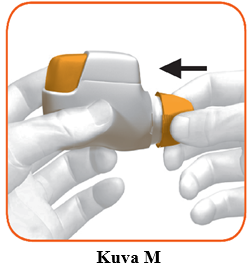
Lisätietoa:
Mitä sinun on tehtävä, jos vahingossa valmistelet annoksen?
Säilytä inhalaattori niin, että suojakorkki on paikallaan, kunnes on aika ottaa seuraava lääkeannos. Poista sitten suojakorkki ja aloita kohdasta 1.6.
Kuinka annoslaskuri toimii?
- Annoslaskuri näyttää, kuinka monta annosta inhalaattorissa on jäljellä (kuva N).
- Ensimmäisellä käyttökerralla yksi inhalaattori sisältää vähintään 60 annosta tai vähintään 30 annosta pakkauskoon mukaan.
- Aina kun lataat annoksen painamalla oranssia painiketta, annoslaskuri siirtyy hieman seuraavaa numeroa kohti (50, 40, 30, 20, 10 tai 0).
Milloin tarvitset uuden inhalaattorin?
Ota uusi inhalaattori käyttöön:
- jos inhalaattori vaikuttaa vaurioituneelta tai jos hukkaat suojakorkin tai
- kun annoslaskuriin ilmestyy punainen nauha; tämä tarkoittaa, että lähestyt viimeistä annosta (kuva N), tai
- jos inhalaattori on tyhjä (kuva O).

Kuinka tiedät, että inhalaattori on tyhjä?
Kun oranssi painike ei enää palaa kokonaan yläasentoon ja se lukittuu keskiasentoon, olet ottanut viimeisen annoksen (kuva O). Vaikka oranssi painike on lukittu, voit kuitenkin ottaa viimeisen annoksen. Sen jälkeen inhalaattoria ei voi enää käyttää ja sinun on otettava käyttöön uusi inhalaattori.

Kuinka puhdistat inhalaattorin?
Älä KOSKAAN käytä vettä inhalaattorin puhdistamiseen, sillä se voi vahingoittaa lääkevalmistetta.
Jos haluat puhdistaa inhalaattorin, voit pyyhkiä suukappaleen ulkopuolelta kuivalla liinalla tai paperipyyhkeellä.
Korvattavuus
DUAKLIR GENUAIR inhalaatiojauhe
340/12 mikrog 60 annosta, 3 x 60 annosta
- Alempi erityiskorvaus (65 %). Krooninen keuhkoastma ja sitä läheisesti muistuttavat krooniset obstruktiiviset keuhkosairaudet (203).
- Peruskorvaus (40 %).
ATC-koodi
R03AL05
Valmisteyhteenvedon muuttamispäivämäärä
20.02.2025
Yhteystiedot
Fuglevangsvej 11
1962 Frederiksberg
Denmark
(+45) 7070 1313
www.zentiva.com


