VITAROS emulsiovoide 3 mg/g
Vaikuttavat aineet ja niiden määrät
Yksi kerta-annospakkaus sisältää 200 mikrogrammaa alprostadiilia 100 mg:ssa emulsiovoidetta (2 mg/g).
Yksi kerta-annospakkaus sisältää 300 mikrogrammaa alprostadiilia 100 mg:ssa emulsiovoidetta (3 mg/g).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Emulsiovoide
Kliiniset tiedot
Käyttöaiheet
Vähintään 18-vuotiaiden miesten erektiohäiriön hoito. Erektiohäiriöllä tarkoitetaan kyvyttömyyttä saavuttaa tai ylläpitää sukupuoliseen kanssa käymiseen riittävää erektiota.
Annostus ja antotapa
Vitaros annostellaan siittimen kärkeen.
Annostus
Vitaros-valmistetta on saatavilla kahtena annosvahvuutena, 200 ja 300 mikrog alprostadiilia 100 mg:ssa emulsiovoidetta. Vitaros-valmistetta on käytettävä tarpeen mukaan erektion saavuttamiseen. Jokainen Vitaros-valmisteen asetin on kertakäyttöinen, ja se on käytön jälkeen hävitettävä asianmukaisesti. Vaikutus alkaa 5–30 minuutin kuluttua lääkkeen annostelusta. Vaikutus kestää noin 1–2 tuntia. Todellinen kesto voi kuitenkin vaihdella potilaskohtaisesti. Terveydenhoidon ammattilaisen on opastettava potilaalle, miten Vitaros-valmistetta käytetään, ennen kuin potilas siirtyy annostelemaan valmistetta itse. Suurin sallittu käyttömäärä on enintään 2–3 kertaa viikossa ja vain yksi annos 24 tunnin kuluessa.
Lääkärin on suositeltava aloitusannos. 300 mikrog:n aloitusannosta voidaan harkita etenkin potilaille, joilla on vaikea erektiohäiriö, komorbiditeetti tai jos PDE-5-estäjillä ei ole saavutettu vastetta. Potilaat, jotka eivät siedä 300 mikrog:n annosta paikallisten haittavaikutusten vuoksi, voivat siirtyä käyttämään pienempää 200 mikrog:n annosta.
Potilaita on opetettava käyttämään valmistetta oikein.
Antotapa
Virtsaamista suositellaan ennen valmisteen annostelemista. Kun korkki on poistettu, annostele Vitaros-valmisteen sisältö siittimen kärjen aukkoon seuraavien ohjeiden mukaisesti 5–30 minuuttia ennen aiottua yhdyntää:
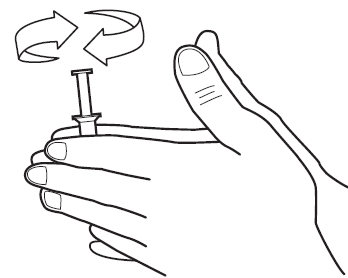
1) Pese kädet huolellisesti ennen Vitaros-valmisteen käyttöä. Ota kertakäyttöasetin foliopussista repimällä pussi kokonaan auki yläreunan keskeltä alkaen. Ota asetin pussista (katso kuva 1). Säilytä pussi kertakäyttöasettimen myöhempää hävittämistä varten.
2) Lämmitä kertakäyttöasetin huoneenlämpöiseksi pyörittämällä sitä käsiesi välissä (katso kuva 2). Tämä vaihe voidaan jättää välistä, jos foliopussi on otettu aiemmin ulos jääkaapista (kohdassa Säilytys , mainittujen aikarajojen puitteissa) ja sisältö on jo saavuttanut huoneenlämmön.
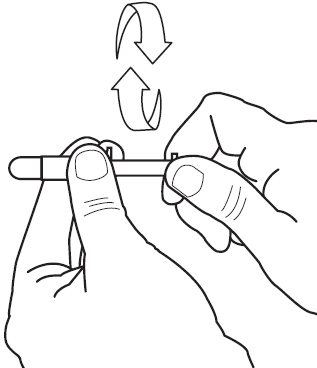
3) Pyöritä mäntää edestakaisin varmistuaksesi että se liukuu helposti (katso kuva 3). Poista sitten kertakäyttöasettimen korkki.
|
|
|
Kuva 1 | Kuva 2 | Kuva 3 |
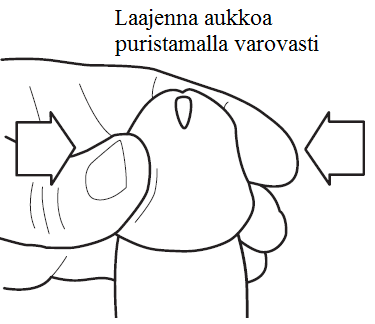
4) Tartu kädellä siittimen päästä ja laajenna siittimen kärjen aukkoa puristamalla varovasti samalla pitäen siitintä pystysuorassa (Katso kuva 4). (Huomaa, jos sinua ei ole ympärileikattu, vedä esinahka taakse ja pidä sitä taaksevedettynä ennen virtsaputken aukon laajentamista.)
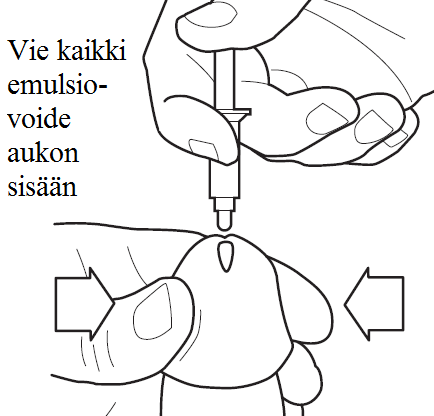
5) Pitele asettimen säiliötä sormien välissä ja aseta sen kärki niin lähelle siittimen kärjen aukkoa kuin mahdollista, jotta emulsiovoide menee virtsaputkeen sisään, laittamatta kuitenkaan asettimen kärkeä siittimen sisään (katso kuva 5). Paina mäntää hitaasti mutta vakaasti alas peukalolla tai sormella, kunnes kaikki emulsiovoide on mennyt siittimen kärjestä sisään virtsaputkeen.
Huomaa: Vaikka on tärkeää, että kaikki emulsiovoide menee alas virtsaputkeen, huolehdi että et laita asettimen kärkeä sisään siittimen kärjen aukkoon.
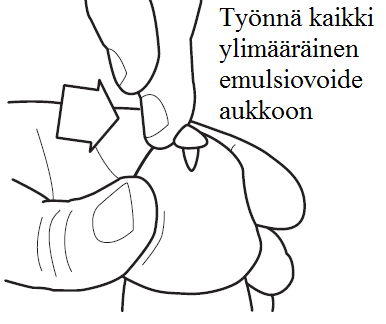
6) Pidä siitintä pystyasennossa noin 30 sekuntia, jotta emulsiovoide pääsee imeytymään. Kaikki emulsiovoide ei todennäköisesti aluksi mahdu siittimen kärjen aukkoon. Siittimen kärjen aukon päälle jäänyt ylimääräinen emulsiovoide tulee työntää sormenpäällä aukkoon. Älä käytä toista kertakäyttöasetinta korvataksesi emulsiovoiteen, joka ei ole mahtunut siittimen kärjen aukkoon (katso kuva 6). Älä käy virtsaamassa heti annostelun jälkeen, koska tällöin on riski että lääkevalmiste tulee ulos ennenkuin se ehtii vaikuttaa.
7) Muista, että jokainen Vitaros-annos on tarkoitettu kertakäyttöön. Laita kertakäyttöasettimen korkki takaisin paikalleen ja pakkaus avattuun pussiin. Taita pussi ja hävitä tavallisen kotitalousjätteen mukana.
8) Vitaros saattaa ärsyttää silmiä. Pese kädet huolellisesti Vitaros-valmisteen käytön jälkeen.
|
|
|
Kuva 4 Kuva 5 Kuva 6
Vasta-aiheet
Vitaros-valmistetta ei tulisi käyttää potilailla, joita koskee jokin seuraavista:
- Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
- Ortostaattisen hypotension, sydäninfarktin ja pyörtymisen kaltaiset perussairaudet.
- Sairaudet, jotka voivat altistaa priapismille (erektio, joka kestää vähintään 4 tuntia), kuten sirppisoluanemia tai sirppisoluanemian kantajuus, trombosytopenia, polysytemia, multippeli myelooma tai leukemia.
- Siittimen poikkeava anatomia, kuten vaikea hypospadia, siittimen anatominen deformaatio, kuten kaarevuus, virtsaputkentulehdus ja balaniitti (terskatulehdus).
- Alttius laskimotromboosin tai hyperviskositeettisyndrooma ja sen vuoksi suurentunut priapismin riski
- Potilaat, joiden kohdalla seksuaalinen kanssakäyminen ei ole suositeltavaa, kuten potilaat, joilla on epävakaa sydän- ja verisuonisairaus tai epävakaa aivoverisuonisairaus.
- Vitaros-valmistetta ei tulisi käyttää yhdynnässä hedelmällisessä iässä olevan naisen kanssa, ellei kondomia käytetä.
Varoitukset ja käyttöön liittyvät varotoimet
Paikalliset vaikutukset
Vitaros-valmisteen käytön yhteydessä on esiintynyt harvoin pitkäkestoisia, > 4 tuntia kestäviä erektioita (priapismi) (katso kohta Haittavaikutukset ). Jos priapismia esiintyy, potilaan tulisi hakeutua välittömästi lääkärin hoitoon. Jos priapismia ei hoideta välittömästi, siittimen kudos voi vaurioitua ja seksuaalinen kyvykkyys voi kärsiä pysyvästi.
Oireellista hypotensiota (huimausta) ja pyörtymistä annostelun yhteydessä esiintyi pienellä määrällä potilaista vaiheen 3 tutkimuksissa. Potilaita on varoitettava ajamasta autolla tai tekemästä vaarallisia tehtäviä, joissa Vitaroksen annostelun jälkeen esiintyvä hypotensio tai pyörtyminen voisi aiheuttaa onnettomuuden.
Erektiohäiriön hoidettavissa olevat syyt on suljettava pois asianmukaisin diagnostisin menetelmin ennen Vitaros-hoidon aloittamista.
Lisäksi potilaiden, joilla on ortostaattisen hypotension, sydäninfarktin ja pyörtymisen kaltaisia perussairauksia, ei tulisi käyttää Vitaros-valmistetta (ks. kohta Vasta-aiheet Vasta-aiheet).
Kliinisiä tutkimuksia ei ole tehty potilailla, joilla on aiempi neurologinen sairaus tai selkäydinvamma.
Vitaros-valmisteen turvallisuutta ja tehoa ei ole muodollisesti tutkittu maksan ja/tai munuaisten vajaatoimintaa sairastavilla potilailla. Annosta voi olla tarpeen pienentää näissä ryhmissä heikentyneen metabolian vuoksi.
Yleiset varotoimet
Vitaros-valmistetta on käytettävä edellä annettujen ohjeiden mukaisesti. Valmisteen joutuminen tahattomasti virtsaputken sisälle voi aiheuttaa siittimeen polttelevan tai kihelmöivän tunteen sekä kipua. Virtsaputken sisäisen toistuvan, pitkäaikaisen Vitaros-valmisteelle altistumisen vaikutuksia ei tunneta.
Potilalle on kerrottava, ettei Vitaros-valmiste suojaa sukupuolitaudeilta. Vitaros-valmistetta käyttäville potilaille ja heidän kumppaneilleen on annettava ohjeita suojatoimista, joiden avulla he voivat suojautua sukupuolitautien, HI-virus (HIV) mukaan lukien, leviämiseltä.
Terveydenhoidon ammattilaisten olisi kannustettava potilaita kertomaan seksikumppaneilleen, että he käyttävät Vitaros-valmistetta. Vitaros-valmisteen käyttäjien kumppaneilla voi esiintyä haittavaikutuksia, joista yleisin on emättimen ärtyminen. Kondomin käyttö on sen vuoksi suositeltavaa.
Vitaros-valmisteen vaikutuksia suun ja peräsuolen limakalvoon ei ole tutkittu. Suu- tai anaaliseksin aikana olisi sen vuoksi käytettävä kondomia.
Vitaros-valmisteella ei ole raskautta ehkäisevää vaikutusta. Vitaros-valmistetta käyttävien pariskuntien on suositeltavaa huolehtia riittävästä ehkäisystä, jos naispuolinen kumppani on hedelmällisessä iässä.
Alprostadiilin vaikutuksista raskauden varhaisvaiheeseen niillä määrillä, joita naispuolinen kumppani saa, ei ole tietoa. Yhdynnässä hedelmällisessä iässä olevien, raskaana olevien tai imettävien naisten kanssa tulisi käyttää kondomia.
Valmisteen käytön yhteydessä on tutkittu vain lateksipohjaisia kondomeja. Muiden materiaalien osalta ei voida sulkea pois kondomin mahdollisen vaurioitumisen riskiä.
Yhteisvaikutukset
Vitaros-valmisteella ei ole tehty farmakokineettisiä tai farmakodynaamisia yhteisvaikutustutkimuksia. Valmisteen metabolisten ominaisuuksien perusteella (ks. kohta Farmakokinetiikka ) lääkeaineiden väliset yhteisvaikutukset ovat epätodennäköisiä.
Interaktioiden vaikutus
Vitaros-valmisteen turvallisuutta ja tehoa yhdessä muiden erektiohäiriön hoitoon käytettävien lääkkeiden kanssa, etenkin fosfodiesteraasi-5-estäjien (PDE5) kuten sildenafiilin, tadalafiilin ja vardenafiilin kanssa, ei ole tutkittu. Vitaros-valmistetta ei sen vuoksi tulisi käyttää yhdessä PDE5-estäjien kanssa. Koska sekä Vitaros että PDE5-estäjät vaikuttavat sydän- ja verenkiertoelimistöön, kardiovaskulaaririskien lisääntymistä ei voida sulkea pois.
Vitaros-valmisteella ei ole tehty yhteisvaikutustutkimuksia siitinimplanttien tai sileälihasrelaksanttien, kuten papaveriinin, tai erektion aikaansaamiseen käytettävien lääkkeiden, kuten alfasalpaajien (esim. intrakavernosaalinen fentolamiini, tymoksamiini) kanssa. Yhteiskäyttöön liittyy priapismin riski (kivulias, pitkittynyt, epänormaali erektio).
Vitaros-valmisteella ei ole tehty yhteisvaikutustutkimuksia sympatomimeettien, turvotusta vähentävien ja ruokahalua hillitsevien lääkeaineiden kanssa. Yhteiskäyttö voi vähentää alprostadiilin vaikutusta (yhteisvaikutuksen aiheuttama inhibitio).
Vitaros-valmisteelle ei ole tehty yhteisvaikutustutkimuksia antikoagulanttien ja verihiutaleiden aggregaation estäjien kanssa. Yhteiskäyttöön voi liittyä virtsaputken verenvuodon tai verivirtsaisuuden riski.
Potilailla, jotka käyttävät samanaikaisesti verenpainelääkkeitä ja vasoaktiivisia lääkkeitä, voi olla suurentunut hypotension riski. Tämä koskee etenkin iäkkäitä potilaita.
Raskaus ja imetys
Raskaus
Vitaros-valmisteen käytöstä raskaana oleville naisille ei ole tietoa. Naisiin kohdistuva välillinen altistus alprostadiilille on todennäköisesti pieni.
Eläimillä tehdyt tutkimukset suuremmilla alprostadiiliannoksilla ovat osoittaneet lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta).
Raskaana olevien naisten ei tule altistua Vitaros-valmisteelle.
Imetys
Ei ole tietoa, johtaako välillinen altistuminen alprostadiilille Vitaros-valmisteen kautta merkittävään erittymiseen rintamaitoon. Vitaros-valmisteen käyttö imetyksen aikana ei ole suositeltavaa.
Hedelmällisyys
Uroskaniineilla todettiin toistuvan annostuksen jälkeen kivesten siementiehyeiden atrofiaa. Ei ole tiedossa, vaikuttaako Vitaros-valmiste miesten hedelmällisyyteen.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Tutkimuksia valmisteen vaikutuksesta ajokykyyn tai koneiden käyttökykyyn ei ole tehty. Koska Vitaros-valmisteella tehdyissä kliinisissä tutkimuksissa on raportoitu harvoin huimausta ja pyörtymistä, potilaiden tulee välttää autolla ajoa tai muita tehtäviä, joissa 1–2 tunnin sisällä lääkkeen ottamisesta esiintyvä mahdollinen huimaus tai pyörtyminen voisi aiheuttaa onnettomuuden.
Haittavaikutukset
Yleisin lääkeaineeseen liittyvä kliinisten tutkimusten aikana ilmoitettu haittavaikutus oli ohimenevä paikallinen reaktio annostelukohdassa tai sen läheisyydessä, kuten polttelu, kipu, kutina, kihelmöinti ja peniksen eryteema. Oireet olivat voimakkuudeltaan lieviä tai keskivaikeita ja menivät ohi 1-2 tunnin kuluessa. Nämä paikalliset haittavaikutukset olivat hyvin siedettyjä useimmilla potilailla ja verrattavissa alprostadiilin annokseen.
Epätavallisia mutta mahdollisesti vakavia haittavaikutuksia vaiheen 3 kliinisissä tutkimuksissa olivat huimaus, pyörtyminen ja hypotensio (2/459 (0,4 %), 6/1591 (0,4 %), ja 6/1280 (0,5 %) 100, 200 ja 300 mikrogramman alprostadiiliannoksilla. Priapismia havaittiin kahdessa 3 kuukautta kestäneessä tutkimuksessa vain 1 potilaalla (0,06 %) ja > 6 kuukautta kestäneessä tutkimuksessa vain 5 potilaalla (0,4 %), joista 4 (0,3 %) oli 200 mikrogramman ja 1 (0,1 %) 300 mikrogramman ryhmässä.
Yleisin naispuolisten kumppaneiden ilmoittama lääkeaineeseen liittyvä haittavaikutus plasebokontrolloidussa, kaksoissokkoutetussa moniannostutkimuksessa (kesto 3 kuukautta ja > 6 kuukautta) oli ohimenevä lievä tai keskivaikea polttelu emättimessä tai kutina. Oireet lievittyvät 1-2 tunnin kuluessa. Ei tiedetä liittyvätkö oireet Vitaros lääkitykseen vai yhdyntöihin, joita oli tiheämmin lääkitystä käyttävillä.
Haittavaikutukset taulukkomuodossa
Seuraavassa taulukossa on esitetty yleisimmin raportoidut Vitaros-valmisteen käyttöön liittyvät haittavaikutukset. (Hyvin yleinen ≥ 1/10, yleinen ≥ 1/100, < 1/10, melko harvinainen ≥ 1/1 000, < 1/100, harvinainen ≥ 1/10 000, < 1/1 000, hyvin harvinainen < 1/10 000)
Priapismi (yli 4 tuntia kestävä erektio) on vakava tila, joka vaatii pikaista lääkärinhoitoa.
Taulukko 1 Haittavaikutukset
Elinjärjestelmä | Yleisyys | Haittavaikutus |
Hermosto | Melko harvinainen | Herkkätuntoisuus |
Verisuonisto* | Melko harvinainen | Huimaus Pyörtyminen Hypotensio |
Iho ja ihonalainen kudos | Yleinen | Ihottuma |
Luusto, lihakset ja sidekudos | Melko harvinainen | Raajakipu |
Munuaiset ja virtsatiet | Yleinen | Virtsaputken kipu |
Melko harvinainen | Virtsaputken ahtauma Virtsatietulehdus | |
Sukuelimet ja rinnat | Yleinen | Poltteleva tunne siittimessä Siittimen kipu Siittimen punoitus Sukuelinten kipu Epämukavuuden tunne sukuelimissä Sukuelinten punoitus Lisääntynyt erektio Sukuelinten kutina Siittimen edeema Terskatulehdus Kihelmöivä tunne siittimessä Sykkivä tunne siittimessä Siittimen tunnottomuus Naispuolisilla kumppaneilla: Poltteleva tunne ulkosynnyttimissä ja emättimessä Emätintulehdus |
Melko harvinainen | Siittimen kutina Sukuelinten ihottuma Kivespussikipu Sukuelinten täysinäisyyden tunne Liiallinen jäykkyys Siittimen tunnottomuus Pidentynyt erektio/priapismi Naispuolisilla kumppaneilla: Ulkosynnyttimien ja emättimen kutina | |
Yleisoireet ja antopaikassa todettavat haitat | Melko harvinainen | Annostelukohdan kipu |
Erityisryhmät
* Ei ole selkeää näyttöä siitä, että alprostadiili lisäisi sydän- ja verisuonitapahtumien riskiä verisuonia laajentavaa vaikutusta lukuun ottamatta. Ei kuitenkaan voida sulkea pois mahdollisuutta, että potilailla, joilla on perussairaus tai riskitekijöitä, olisi suurentunut riski, kun lisäksi otetaan huomioon alprostadiilin käyttöön liittyvä lisääntynyt seksuaalinen/fyysinen aktiivisuus (ks. Vasta-aiheet ja Varoitukset ja käyttöön liittyvät varotoimet)
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haitta–tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 Fimea
Yliannostus
Vitaros-valmisteen yhteydessä ei ole raportoitu hoitoa vaativaa yliannostusta. Vitaros-valmisteen yliannostus voi aiheuttaa hypotensiota, pyörtymistä, huimausta, siitinkipua ja mahdollisesti priapismin (erektio, joka kestää > 4 tuntia). Priapismi voi heikentää erektiokykyä pysyvästi. Mahdollisesti yliannoksen saaneita potilaita, joilla on näitä oireita, on tarkkailtava lääkärin valvonnassa, kunnes systeemiset tai paikalliset oireet ovat hävinneet.
Jos potilaalla on pitkittynyt, yli 4 tuntia kestävä erektio, potilasta on neuvottava hakeutumaan lääkäriin. Seuraavat toimenpiteet ovat mahdollisia:
- Potilaan tulisi maata selällään tai kyljellään. Jääpussi laitetaan vuorotellen kummankin reiden sisäpinnalle pariksi minuutiksi (tämä saatta laukaista laskimon läpän aukeamaan). Jos vastetta ei saavuteta 10 minuutin kuluessa, tulee hoito keskeyttää.
- Jos tämä hoito on tehotonta ja erektio on kestänyt yli 6 tuntia, on tehtävä siittimen aspiraatio. Aseptista tekniikkaa käyttäen viedään perhosneula (koko 19–21) paisuvaiseen ja vedetään 20–50 ml verta ruiskuun. Tämä saattaa vähentää turvotusta siittimessä. Toimenpide voidaan tarvittaessa toistaa siittimen toisella puolella.
- Jos hoito ei edelleenkään auta, suositellaan intrakavernaalista injektiota α-adrenergisella lääkkeellä. Vaikka vasokonstriktorin tavallinen vasta-aihe, siittimensisäinen anto, ei koskekaan priapismin hoitoa, on varovaisuutta silti noudatettava, jos tähän vaihtoehtoon turvaudutaan. Verenpainetta ja pulssia on seurattava jatkuvasti toimenpiteen aikana. Äärimmäinen varovaisuus on tarpeen hoidettaessa potilaita, joilla on sepelvaltimotauti, hallitsematon hypertensio tai aivoiskemia, sekä potilailla, jotka käyttävät monoamiinioksidaasin estäjiä. Jälkimmäisessä tapauksessa täytyy olla käytettävissä keinot hypertensiivisen kriisin hoitamiseen.
- Valmistetaan 200 mikrog/ml fenyyliefriiniliuos, jota annetaan injektiona 0,5–1,0 ml 5–10 minuutin välein. Vaihtoehtoisesti voidaan käyttää 20 mikrog/ml adrenaliiniliuosta. Tarvittaessa tämän jälkeen voidaan toistaa veren aspiraatio saman perhosneulan kautta. Fenyyliefriinin enimmäisannoksen tulisi olla 1 mg tai adrenaliinin 100 mikrog (5 ml liuosta).
- Vaihtoehtoisesti voidaan käyttää metaraminolia, mutta on syytä huomata, että sen käytön yhteydessä on raportoitu kuolemaan johtavia hypertensiivisiä kriisejä. Jos priapismi jatkuu edelleen, potilas on siirrettävä välittömästi kirurgiseen hoitoon.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Erektiohäiriöiden hoitoon tarkoitetut lääkkeet
ATC-koodi: G04BE01
Vaikutusmekanismi
Alprostadiili on kemiallisesti identtinen prostaglandiini E1:n kanssa, jonka vaikutuksiin kuuluvat muun muassa siittimen paisuvaisen erektion aiheuttavien kudosten verisuonten vasodilaatio ja paisuvaisen valtimoverenkierron lisääntyminen, jolloin seurauksena on siittimen jäykkyys.
Erektiovaikutus alkaa 5–30 minuutin kuluttua Vitaros-valmisteen annosta. Alprostadiilin puoliintumisaika ihmisillä on lyhyt, ja erektion paraneminen voi kestää 1–2 tuntia valmisteen ottamisesta.
Kliininen teho ja turvallisuus
Kahdessa vaiheen 3 pivotaalitutkimuksessa arvioitiin Vitaros-valmisteen (100, 200 ja 300 mikrog) tehoa erektiohäiriöstä kärsivillä potilailla 12 viikon ajan (n=1651). Tutkimuksessa havaittiin ensisijaisten päätetapahtumien keskimääräisessä muutoksessa tilastollisesti merkitseviä (p < 0,001) eroja lumelääkkeeseen nähden. Päätetapahtumia olivat IIEF:n erektiotoimintaa koskeva pistemäärä (IIEF-EF), emätinpenetraation onnistumisen keskimääräinen prosenttiosuus (SEP-3) ja ejakulaation onnistumisen keskimääräinen prosenttiosuus (SEP-4). IIEF-EF-pistemäärän keskimääräiset muutokset olivat 1,6 (100 mikrog annos), 2,5 (200 mikrog annos) ja 2,4 (300 mikrog annos). Paranemista havaittiin myös muissa ensisijaisissa päätetapahtumissa, sillä emätinpenetraation onnistuminen lisääntyi (100 mikrog [2,9 %], 200 mikrog [5,1 %], 300 mikrog [7,2 %]), samoin ejakulaation onnistuminen (100 mikrog [7,0 %], 200 mikrog [13,8 %], 300 mikrog [9,1 %]). Samankaltaisia tuloksia saavutettiin niiden miesten potilasjoukoissa, jotka olivat aiemmin saaneet fosfodiesteraasi-V-estäjähoitoa, joilla oli diabetes, sydämen toimintahäiriöitä tai kohonnut verenpaine tai joilta oli poistettu eturauhanen. Tulokset olivat samankaltaisia ≤ 65 ja > 65 vuoden ikäisillä miehillä. Post-hoc -vastaaja-analyysin mukaan niiden miesten osuudet, jotka ilmoittivat tilastollisesti merkitsevästä (p < 0,001) IIEF-EF-pistemäärän paranemisesta (≥ 4), olivat 35 % (100 mikrog annos), 39 % (200 mikrog) ja 38 % (300 mikrog), kun lumelääkkeellä vastaava tulos oli 21 %. Pidempikestoisessa avoimessa kliinisessä tutkimuksessa todettiin, että 300 mikrog annos paransi tuloksia edelleen. IIEF-EF-pistemäärän keskimääräinen muutos lähtötilanteesta oli 6,67.
Farmakokinetiikka
Imeytyminen
Absoluuttista biologista hyötyosuutta topikaalisesti annettuna ei ole määritetty. Farmakokinetiikkatutkimuksessa hoidettiin erektiohäiriöstä kärsiviä potilaita 100 mg:lla Vitaros-emulsiovoidetta, jolloin potilaat saivat 100, 200 tai 300 mikrogramman annoksen alprostadiilia. PGE1:n ja sen metaboliitin, PGE0:n, pitoisuudet plasmassa olivat useimmilla potilailla alhaiset tai niitä ei voitu havaita useimmissa antamisen jälkeen otetuissa verikokeissa, eikä farmakokineettisiä parametreja voitu arvioida. 15-keto-PGE0:n Cmax-arvot ja AUC-arvot olivat alhaisia ja kasvoivat vähemmän kuin suhteessa annokseen 100–300 mikrogramman annosalueella. 15-keto-PGE0:n enimmäispitoisuudet plasmassa saavutettiin tunnin kuluessa valmisteen annosta.
Taulukko 2
15-keto-PGE0:n keskimääräiset (SD) farmakokineettiset parametrit
Parametri | Lumelääke (N = 5) | Vitaros 100 mikrog (N = 5) | Vitaros 200 mikrog (N = 5) | Vitaros 300 mikrog (N = 5) |
AUCa (pg*h/ml) | 388 (256) | 439 (107) | 504 (247) | 960 (544) |
Cmax (pg/ml) | 23 (19) | 202 (229) | 120 (103) | 332 (224) |
Tmax (h) | 6 (8) | 0,6 (0,4) | 1 (0,7) | 0,7 (0,3) |
T1/2 (h) | 4 (--)b | 5 (3) | 3 (1)c | 6 (6) |
a AUC on plasmapitoisuuskäyrän alapuolinen pinta-ala nollahetkestä tuntiin 24 asti b Tiedot riittivät puoliintumisajan arviointiin vain 1 tutkittavan kohdalla. c Tiedot riittivät puoliintumisajan arviointiin vain 3 tutkittavan kohdalla. SD = keskihajonta | ||||
Jakautuminen
Kun alprostadiili annetaan siittimen päähän ja terskaan, se imeytyy rinnakkaissuonten kautta nopeasti virtsaputken ja siittimen paisuvaisen kudoksiin. Loppu lääke kulkeutuu lantion laskimoverenkiertoon virtsaputken paisuvaista tyhjentävien laskimoiden kautta.
Biotransformaatio
PGE1 metaboloituu paikallisen annon jälkeen nopeasti paikallisesti 15-hydroksyyliryhmän hapettuessa entsymaattisesti 15-keto-PGE1:ksi. 15-keto-PGE1:n biologinen aktiivisuus on vain 1–2 % PGE1:n aktiivisuudesta, ja se pelkistyy nopeasti vallitsevaksi epäaktiiviseksi metaboliitikseen, 13, 14-dihydro, 15-keto-PGE:ksi, joka poistuu elimistöstä pääasiassa munuaisten ja maksan kautta.
Eliminaatio
Sen jälkeen, kun tritiumilla merkittyä alprostadiilia annetaan miehelle laskimonsisäisesti, merkitty lääke häviää verenkierrosta nopeasti ensimmäisten 10 minuutin kuluessa, ja 1 tunnin kuluttua veressä on jäljellä enää vain vähäinen määrä radioaktiivisuutta. Alprostadiilin metaboliitit erittyvät pääasiassa munuaisten kautta. Noin 90 % laskimoon annetusta annoksesta erittyi virtsaan 24 tunnin kuluessa lääkkeen antamisesta. Loppu lääke erittyy ulosteeseen. Näyttöä laskimonsisäisesti annetun alprostadiilin tai sen metaboliittien kudosretentiosta ei ole.
Farmakokinetiikka erityisryhmissä
Keuhkosairaudet
Keuhkosairauksia sairastavien potilaiden kyky poistaa lääkettä elimistöstä saattaa olla heikentynyt. Potilailla, jotka sairastivat aikuisen hengitysvaikeusoireyhtymää, laskimoon annetun PGE1:n erittyminen keuhkojen kautta väheni noin 15 % verrokkiryhmään nähden, joka koostui potilaista, joiden hengitys toimi normaalisti.
Sukupuoli
Sukupuolen vaikutusta Vitaros-valmisteen farmakokinetiikkaan ei ole tutkittu, eikä farmakokinetiikkatutkimuksia ole tehty naispuolisilla kumppaneilla.
Iäkkäät potilaat, pediatriset potilaat
Iän vaikutusta topikaalisesti annetun alprostadiilin farmakokinetiikkaan ei ole tutkittu. Vitaros-valmistetta ei ole tarkoitettu käytettäväksi lapsille ja alle 18-vuotiaille nuorille.
Prekliiniset tiedot turvallisuudesta
Alprostadiililla, DDAIP:lla ja Vitaros-valmisteella (joka sisältää DDAIP:ta) ei ole havaittu genotoksisia vaikutuksia.
Alprostadiililla tai Vitaros-valmisteella ei ole tehty karsinogeenisuustutkimuksia. DDAIP-apuaineen karsinogeenisuusarvioinneissa ei havaittu kasvainten muodostumista, kun ainetta annettiin paikallisesti hiirille ja subkutaanisesti rotille. Tg.AC-transgeenisessä hiirimallissa DDAIP:n antaminen aiheutti papilloomia 1,0 %:lle naarashiiristä ja 2,5 %:lle uroshiiristä. Tämä vaikutus ei todennäköisesti ole olennainen ihmisille, koska se johtuu todennäköisesti ärsytyksestä.
Alprostadiili ei vaikuta siittiöiden määrään tai morfologiaan. Apuaine DDAIP kuitenkin aiheutti kivesten siementiehyeiden atrofiaa kaniineilla, joille ainetta annettiin paikallisesti 5 %:n pitoisuutena. DDAIP:n suoraa toksisuutta siemennesteelle ei voitu testata, minkä vuoksi havainnon merkitystä miehen mahdollisen hedelmällisyyden laskemisen kannalta ei tunneta. DDAIP ei vaikuttanut hedelmällisyyteen annettuna subkutaanisesti rotille.
Alprostadiilin on todettu aiheuttavan embryotoksisuutta (sikiön tavanomaista alhaisempi paino), kun sitä annetaan matalalla annoksella subkutaanisena boluksena kantavana oleville rotille. Suuremmat annokset lisäsivät resorptiota, vähensivät eloon jääneiden sikiöiden määrää, lisäsivät sisäelinten ja luuston muutoksia ja epämuodostumia sekä toksisuutta emolle. PGE1:n intravaginaalinen anto kantavana oleville kaniineille ei aiheuttanut vahinkoa sikiölle.
DDAIP:lla tehtiin lisääntymistoksisuustutkimuksia, kun ainetta oli annettu rotille ja kaniineille subkutaanisesti. Vaikutuksia ei havaittu rotilla, mutta kaniineilla todettiin suurilla annoksilla sikiötoksisuutta, muun muassa epämuodostumien lisääntymistä. Syynä oli luultavasti emoon kohdistunut toksisuus. Rotilla ei havaittu ilmeisiä vaikutuksia syntymän jälkeiseen kehitykseen.
Farmaseuttiset tiedot
Apuaineet
Puhdistettu vesi
Etanoli, vedetön
Etyylilauraatti
Hydroksipropyyliguarkumi
Dodekyyli-2-N,N-dimetyyliaminopropionaattihydrokloridi
Kaliumdivetyfosfaatti
Natriumhydroksidi, pH:n säätöön
Fosforihappo, pH:n säätöön
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
Vitaros 2 mg/g emulsiovoide: 9 kuukautta
Vitaros 3 mg/g emulsiovoide: 12 kuukautta
Käytettävä heti avaamisen jälkeen. Hävitä käyttämättä jäänyt lääke.
Säilytys
Säilytä jääkaapissa (2 °C – 8 °C).
Ei saa jäätyä.
Avaamatonta foliopussia voi säilyttää huoneenlämmössä alle 25 °C ennen käyttöä korkeintaan 3 päivää. Tämän jälkeen käyttämätön valmiste on hävitettävä.
Säilytettävä alkuperäispussissa valolta suojattuna.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
VITAROS emulsiovoide
3 mg/g (L:ei) 4 x 1 annos (58,74 €)
PF-selosteen tieto
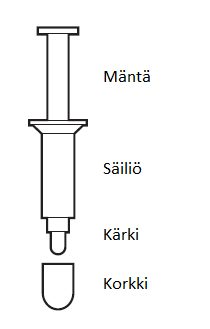
Vitaros -valmiste toimitetaan yksittäispakattuna pusseihin, jotka sisältävät kukin yhden (1) kerta-annospakkauksen. Kerta–annospakkaus koostuu männästä, säiliöstä ja suojakorkista pakattuna suojaavaan pussiin. Kukin kerta-annospakkaus sisältää 100 mg emulsiovoidetta. Vitaros on pakattu pahvisiin laatikoihin, jotka sisältävät neljä (4) kerta-annospakkausta. Pussit ovat alumiinikalvoa/laminaattia. Kerta-annospakkauksen osat on valmistettu polypropeenista ja polyeteenistä.
Valmisteen kuvaus:
Vitaros on valkoinen tai luonnonvalkoinen emulsiovoide.
Käyttö- ja käsittelyohjeet
Kerta-annospakkaukset ovat kertakäyttöisiä.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
VITAROS emulsiovoide
3 mg/g 4 x 1 annos
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Alprostadiili, aviptadiilin ja fentolamiinin yhdistelmävalmiste ja sildenafiili: Vaikeasta perustaudista johtuva vaikea erektiöhäiriö erityisin edellytyksin (308).
- Korvataan enintään 6 hoitoannosta kuukaudessa.
ATC-koodi
G04BE01
Valmisteyhteenvedon muuttamispäivämäärä
25.03.2021
Yhteystiedot
Ground Floor, 71 Lower Baggot Street
D02 P593 Dublin
Ireland
regulatory@simplepharma.company