APIDRA injektioneste, liuos 100 U/ml, injektioneste, liuos, sylinteriampulli 100 U/ml, APIDRA SOLOSTAR injektioneste, liuos, esitäytetty kynä 100 U/ml
Vaikuttavat aineet ja niiden määrät
Yksi ml sisältää 100 yksikköä glulisinsuliinia (vastaten 3,49 mg).
Apidra 100 yksikköä/ml injektioneste, liuos injektiopullossa
Yksi injektiopullo sisältää 10 ml injektionestettä, joka vastaa 1000 yksikköä.
Apidra 100 yksikköä/ml injektioneste, liuos sylinteriampullissa
Yksi sylinteriampulli sisältää 3 ml injektionestettä, joka vastaa 300 yksikköä.
Apidra SoloStar 100 yksikköä/ml injektioneste, liuos esitäytetyssä kynässä
Yksi kynä sisältää 3 ml injektionestettä, joka vastaa 300 yksikköä.
Glulisinsuliini on tuotettu yhdistelmä-DNA-tekniikalla Escherichia colia käyttäen.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Apidra 100 yksikköä/ml injektioneste, liuos injektiopullossa
Injektioneste, liuos injektiopullossa.
Apidra 100 yksikköä/ml injektioneste, liuos sylinteriampullissa
Injektioneste, liuos sylinteriampullissa.
Apidra SoloStar 100 yksikköä/ml injektioneste, liuos esitäytetyssä kynässä
Injektioneste, liuos esitäytetyssä kynässä.
Kliiniset tiedot
Käyttöaiheet
Aikuisten, nuorten sekä 6 vuotta täyttäneiden lasten insuliinihoitoa vaativan diabetes mellituksen hoito.
Annostus ja antotapa
Annostus
Tämän valmisteen teho ilmoitetaan yksikköinä. Nämä yksiköt koskevat yksinomaan Apidra‑insuliinia eivätkä vastaa kansainvälisiä yksikköjä (IU) tai muita insuliinianalogien tehoa ilmaisevia yksikköjä (katso kohta Farmakodynamiikka).
Apidra‑insuliinia voidaan käyttää diabeteksen hoidossa yhdessä pitkävaikutteisen, ylipitkävaikutteisen insuliinin tai perus insuliinianalogin kanssa ja se voidaan liittää oraaliseen diabeteslääkehoitoon.
Apidra‑insuliinin annos tulee sovittaa yksilöllisesti.
Erityispotilasryhmät
Munuaisten vajaatoiminta
Glulisinsuliinin farmakokineettiset ominaisuudet eivät yleensä muutu munuaisten vajaatoimintapotilailla. Insuliinintarve voi kuitenkin vähentyä munuaisten vajaatoimintapotilailla (ks. kohta Farmakokinetiikka).
Maksan vajaatoiminta
Glulisinsuliinin farmakokineettisiä ominaisuuksia ei ole tutkittu maksan vajaatoimintapotilailla. Maksan vajaatoimintaa sairastavien potilaiden insuliinintarve voi vähentyä johtuen glukoneogeneesin ja insuliinin metabolian vähenemisestä.
Iäkkäät potilaat
Glulisinsuliinin farmakokinetiikasta diabetesta sairastavilla iäkkäillä potilailla on vain vähän tietoa. Heikkenevä munuaisten toiminta voi johtaa insuliinintarpeen vähenemiseen.
Lapset
Apidra-insuliinin käytöstä alle 6-vuotiaille lapsille ei ole riittävästi kliinistä tietoa.
Antotapa
Apidra 100 yksikköä/ml injektioneste, liuos injektiopullossa
Suonensisäinen käyttö
Apidra-insuliini voidaan annostella suonensisäisesti, jolloin hoitohenkilökuntaan kuuluvan henkilön on suoritettava annostelu.
Apidra-insuliinia ei saa sekoittaa glukoosiliuoksen tai Ringerin liuoksen tai muun insuliinin kanssa.
Jatkuva ihonalainen insuliini-infuusio
Apidra‑insuliinia voidaan käyttää jatkuvaan ihonalaiseen insuliini‑infuusioon sopivissa pumpuissa sopivien katetrien ja säiliöiden kanssa. Näitä pumppuja käyttävät potilaat on perehdytettävä tarkasti pumpun käyttöön.
Apidra-insuliinin kanssa käytettävä infuusiokatetri neuloineen sekä insuliinisäiliö on vaihdettava aseptisesti 2 vuorokauden välein. Nämä ohjeet voivat erota yleisistä insuliinipumpun käyttöohjeista. Apidra-insuliinia käytettäessä potilaan on tärkeää noudattaa Apidra-insuliinin käyttöön tarkoitettuja erityisiä ohjeita. Jos Apidra-insuliinin käyttöön tarkoitettuja erityisiä ohjeita ei noudateta, seurauksena voi olla vakavia haittavaikutuksia.
Käytettäessä Apidra-insuliinia insuliinipumpussa sitä ei saa laimentaa eikä sekoittaa mihinkään muuhun insuliiniin.
Potilailla, jotka annostelevat Apidra‑insuliinia insuliinipumpulla, on oltava saatavilla vaihtoehtoiset insuliinin annosteluvälineet pumpun toimintahäiriöiden varalta (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset).
Apidra 100 yksikköä/ml injektioneste, liuos injektiopullossa
Käsittelyä koskevat tarkemmat ohjeet, ks. kohta Käyttö- ja käsittelyohjeet.
Apidra 100 yksikköä/ml injektioneste, liuos sylinteriampullissa
Apidra 100 yksikköä/ml sylinteriampulleissa sopii vain insuliinikynällä ihon alle annettaviin pistoksiin. Jos anto ruiskulla, pistoksena laskimoon tai infuusiopumpulla on tarpeen, silloin on käytettävä injektiopulloa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Käsittelyä koskevat tarkemmat ohjeet, ks. kohta Käyttö- ja käsittelyohjeet.
Apidra SoloStar 100 yksikköä/ml injektioneste, liuos esitäytetyssä kynässä
Apidra SoloStar 100 yksikköä/ml esitäytetyssä kynässä sopii vain ihon alle annettaviin pistoksiin. Jos anto ruiskulla, pistoksena laskimoon tai infuusiopumpulla on tarpeen, silloin on käytettävä injektiopulloa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Ihonalainen käyttö
Apidra-insuliini annostellaan injektiona ihon alle juuri ennen ateriaa (0–15 minuuttia) tai pian sen jälkeen tai jatkuvana ihonalaisena infuusiona insuliinipumpulla.
Apidra-insuliini pistetään ihon alle vatsan, reiden tai olkavarren alueelle tai jatkuvana infuusiona vatsan alueelle. Pistos- ja infuusiokohtia tulee vaihdella sovitun pistosalueen (vatsa, reisi, olkavarsi) sisällä kerrasta toiseen lipodystrofian ja ihoamyloidoosin vaaran pienentämiseksi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset).
Imeytyminen ja siten vaikutuksen alkaminen sekä vaikutusaika voivat vaihdella johtuen eri pistosalueesta, liikunnasta tai muista tekijöistä. Vatsan alueelle pistäminen varmistaa hiukan nopeamman imeytymisen kuin muille pistosalueille pistäminen (ks. kohta Farmakokinetiikka).
On varmistuttava huolellisesti siitä, ettei insuliinipistosta anneta suoneen. Injektion jälkeen pistoskohtaa ei saa hieroa. Potilaalle tulee neuvoa oikea pistostekniikka.
Sekoittaminen muihin insuliineihin
Käytettäessä Apidra-insuliinia ihonalaisena injektiona sitä ei saa sekoittaa muihin lääkevalmisteisiin kuin NPH-ihmisinsuliiniin.
Käsittelyä koskevat tarkemmat ohjeet, ks. kohta Käyttö- ja käsittelyohjeet.
Pakkausselosteessa olevat käyttöohjeet tulee lukea huolellisesti ennen SoloStar‑kynän käyttöä (ks. kohta Käyttö- ja käsittelyohjeet).
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Hypoglykemia.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Siirtyminen toiseen insuliinityyppiin tai valmisteeseen on toteutettava tarkassa lääkärin valvonnassa. Muutokset vahvuudessa, valmisteessa (valmistaja), tyypissä (lyhytvaikutteinen insuliini, neutraali-protamiini-Hagedorn [NPH-insuliini], eläininsuliini, ylipitkävaikutteinen insuliini jne.), alkuperässä (eläinperäinen, ihmisperäinen, ihmisinsuliinianalogi) ja/tai valmistusmenetelmässä voivat vaatia annoksen muuttamista. Samanaikaisen oraalisen diabeteslääkkeen annosta voidaan joutua muuttamaan.
Potilaita on ohjeistettava vuorottelemaan pistoskohtaa jatkuvasti lipodystrofian ja ihoamyloidoosin kehittymisen vaaran vähentämiseksi. Jos insuliinin pistämistä jatketaan niihin kohtiin, joilla esiintyy näitä muutoksia, on olemassa mahdollinen vaara, että insuliinin imeytyminen hidastuu ja verensokerin hallinta heikentyy. Injektiokohdan äkillisestä vaihtamisesta terveelle alueelle on ilmoitettu aiheutuvan hypoglykemiaa. Verensokerin seurantaa suositellaan pistoskohdan vaihtamisen jälkeen, ja diabeteslääkkeiden annoksen muuttamista voidaan harkita.
Hyperglykemia
Sopimaton annos tai hoidon keskeyttäminen etenkin tyypin 1 diabeetikoilla voi johtaa hyperglykemiaan ja diabeettiseen ketoasidoosiin; tiloihin, jotka voivat mahdollisesti johtaa kuolemaan.
Hypoglykemia
Hypoglykemian ilmaantumisen ajankohta riippuu käytettyjen insuliinien vaikutusprofiilista ja voi niin ollen muuttua hoito-ohjelmaa muutettaessa.
Hypoglykemian varoitusoireet voivat muuttua tai olla vähemmän selkeitä seuraavissa tapauksissa: pitkään jatkunut diabetes, tehostettu insuliinihoito, diabeettinen neuropatia, lääkevalmiste kuten beetasalpaaja, siirtyminen eläininsuliinista ihmisinsuliiniin.
Annoksen muuttaminen voi olla tarpeen myös, jos potilas lisää fyysistä rasitustaan tai muuttaa ruokailutottumuksiaan. Fyysinen rasitus heti aterian jälkeen lisää hypoglykemian riskiä.
Hypoglykemia saattaa ilmaantua aikaisemmin nopeavaikutteisen insuliinianalogin kuin liukoisen ihmisinsuliinin pistämisen jälkeen.
Hoitamaton hypoglykemia tai hyperglykemia voi johtaa tajunnan menetykseen, koomaan tai kuolemaan.
Insuliinintarve voi muuttua muun sairauden tai tunne-elämän häiriön aikana.
Apidra 100 yksikköä/ml injektioneste, liuos sylinteriampullissa
Kynät, joita voidaan käyttää Apidra 100 yksikköä/ml injektioneste, liuos -sylinteriampullien kanssa
Apidra 100 yksikköä/ml sylinteriampulleissa sopii vain insuliinikynällä ihon alle annettaviin pistoksiin. Jos anto ruiskulla, pistoksena laskimoon tai infuusiopumpulla on tarpeen, silloin on käytettävä injektiopulloa.
Apidra-sylinteriampulleja voi käyttää ainoastaan seuraavien kynien kanssa:
- JuniorSTAR, jolla voidaan annostella Apidra-insuliinia 0,5 yksikön tarkkuudella
- ClikSTAR, Tactipen, Autopen 24, AllStar tai AllStar PRO, joilla voidaan annostella Apidra-insuliinia 1 yksikön tarkkuudella.
Näitä sylinteriampulleja ei saa käyttää minkään muun uudelleenkäytettävän kynän kanssa, koska annostarkkuus on varmistettu vain mainituille kynille (ks. kohdat Annostus ja antotapa ja Käyttö- ja käsittelyohjeet).
Kaikkia kyniä ei välttämättä ole kaupan.
Lääkehoitoon liittyvät virheet
On raportoitu lääkehoitoon liittyviä virhetilanteita, joissa muita insuliineja, erityisesti pitkävaikutteisia insuliineja, on vahingossa pistetty glulisinsuliinin sijaan. Insuliinin etiketti on tarkistettava aina ennen pistämistä, jotta lääkitysvirheet glulisinsuliinin ja muiden insuliinien välillä vältetään.
Apidra 100 yksikköä/ml injektioneste, liuos injektiopullossa
Jatkuva ihonalainen insuliini-infuusio
Insuliinipumpun tai infuusiolaitteiston toimintahäiriöt tai käsittelyvirheet voivat nopeasti johtaa hyperglykemiaan, ketoosiin ja diabeettiseen ketoasidoosiin. Nopea hyperglykemian, ketoosin tai diabeettisen ketoasidoosin tunnistaminen ja tilan korjaaminen ovat tarpeen.
Diabeettista ketoasidoosia on ilmoitettu esiintyneen, kun Apidra-insuliinia on annettu jatkuvana ihonalaisena insuliini-infuusiona insuliinipumpulla. Useimmat tapauksista liittyivät käsittelyvirheisiin tai pumpun toimintahäiriöihin.
Väliaikaiset ihonalaiset Apidra-injektiot voivat olla tarpeen. Potilaat, jotka annostelevat insuliinia jatkuvana ihonalaisena insuliini-infuusiona insuliinipumpulla, on opetettava antamaan insuliini injektiona ja heillä on oltava saatavilla vaihtoehtoiset insuliinin annosteluvälineet pumpun toimintahäiriöiden varalta (ks. kohdat Annostus ja Antotapa ja Haittavaikutukset).
Apuaineet
Tämä lääkevalmiste sisältää vähemmän kuin 1 mmol (23 mg) natriumia annosta kohti eli se on natriumiton.
Apidra-insuliini sisältää metakresolia, joka voi aiheuttaa allergisia reaktioita.
Apidra yhdistelmähoidossa pioglitatsonin kanssa
Sydämen vajaatoimintatapauksia on raportoitu esiintyneen, kun pioglitatsonia käytettiin yhdistelmähoitona insuliinin kanssa, erityisesti potilailla, joilla on riskitekijöitä sydämen vajaatoiminnan kehittymiseen. Tämä on muistettava, jos harkitaan pioglitatsonin ja Apidra-insuliinin yhdistelmähoitoa. Jos tätä yhdistelmää käytetään, on potilailta seurattava sydämen vajaatoiminnan, painon nousun ja turvotuksen merkkejä ja oireita. Pioglitatsonin käyttö on lopetettava, jos ilmaantuu sydämen vajaatoiminnan oireita.
Apidra SoloStar 100 yksikköä/ml injektioneste, liuos esitäytetyssä kynässä
Esitäytetyn SoloStar-kynän käsittely
Apidra SoloStar 100 yksikköä/ml esitäytetyssä kynässä sopii vain ihon alle annettaviin pistoksiin. Jos anto ruiskulla, pistoksena laskimoon tai infuusiopumpulla on tarpeen, silloin on käytettävä injektiopulloa. Pakkausselosteessa olevat käyttöohjeet tulee lukea huolellisesti ennen SoloStar-kynän käyttöä. SoloStar-kynää tulee käyttää näiden käyttöohjeiden mukaisesti (ks. kohta Käyttö- ja käsittelyohjeet).
Yhteisvaikutukset
Farmakokineettisiä yhteisvaikutuksia ei ole tutkittu. Perustuen kokemuksiin muista vastaavista lääkevalmisteista kliinisesti merkittäviä yhteisvaikutuksia ei ole odotettavissa.
Monet aineet vaikuttavat sokeriaineenvaihduntaan ja voivat vaatia glulisinsuliinin annoksen säätöä ja erityisen tarkkaa seuraamista.
Verensokeria alentavaa vaikutusta voivat voimistaa ja hypoglykemiariskiä lisätä mm. oraaliset diabeteslääkkeet, angiotensiinikonvertaasin (ACE:n) estäjät, disopyramidi, fibraatit, fluoksetiini, monoamiinioksidaasin (MAO:n) estäjät, pentoksifylliini, propoksifeeni, salisylaatit ja sulfonamidiantibiootit.
Aineita, jotka voivat heikentää verensokeria alentavaa vaikutusta ovat kortikosteroidit, danatsoli, diatsoksidi, diureetit, glukagoni, isoniatsidi, fentiatsiinin johdokset, somatropiini, sympatomimeetit (esim. epinefriini [adrenaliini], salbutamoli, terbutaliini), kilpirauhashormonit, estrogeenit, progestiinit (esim. ehkäisytableteissa), proteaasi-inhibiittorit ja epätyypilliset psykoosilääkkeet (esim. olantsapiini ja klotsapiini).
Beetasalpaajat, klonidiini, litiumsuolat tai alkoholi voivat joko voimistaa tai heikentää insuliinin verensokeria alentavaa vaikutusta. Pentamidiini voi aiheuttaa hypoglykemiaa, jota voi joskus seurata hyperglykemia.
Lisäksi sympatolyyttisten lääkkeiden kuten beetasalpaajien, klonidiinin, guanetidiinin ja reserpiinin käytön aikana adrenergisen vasteen aiheuttamat oireet voivat heiketä tai puuttua.
Raskaus ja imetys
Raskaus
Ei ole olemassa tietoja tai on vain vähän tietoja (alle 300 raskaudesta) glulisinsuliinin käytöstä raskaana oleville naisille.
Eläinten lisääntymistutkimukset eivät ole osoittaneet mitään eroa glulisinsuliinin ja ihmisinsuliinin välillä vaikutuksessa raskauteen, alkion/sikiön kehitykseen, synnytykseen tai postnataaliseen kehitykseen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Varovaisuutta on noudatettava määrättäessä valmistetta raskaana oleville naisille. Huolellinen verensokerin seuranta on tärkeää.
Potilailla, joilla on diabetes tai raskausdiabetes, hyvän hoitotasapainon säilyttäminen on tärkeää koko raskausajan. Insuliinin tarve voi vähentyä ensimmäisen raskauskolmanneksen aikana ja se lisääntyy yleensä toisen ja kolmannen raskauskolmanneksen aikana. Heti synnytyksen jälkeen insuliinintarve vähenee nopeasti.
Imetys
Ei tiedetä erittyykö glulisinsuliini äidinmaitoon, mutta yleensä insuliini ei kulkeudu äidinmaitoon eikä imeydy suun kautta otettuna.
Insuliiniannosta ja ruokavaliota voi olla tarpeen muuttaa imetyksen aikana.
Hedelmällisyys
Eläinten lisääntymistutkimukset eivät ole osoittaneet glulisinsuliinilla olevan mitään haittavaikutuksia hedelmällisyyteen.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Potilaan kyky keskittyä ja reagoida saattaa olla huonontunut hypoglykemian tai hyperglykemian seurauksena tai esim. niistä johtuvan näön heikkenemisen seurauksena. Tämä voi aiheuttaa vaaraa tilanteissa, joissa näillä taidoilla on suuri merkitys (esim. autolla ajo tai koneiden käyttö).
Potilaita tulee neuvoa varautumaan hypoglykemian välttämiseen autoa ajaessaan. Tämä on erityisen tärkeää niille potilaille, joiden kyky tunnistaa hypoglykemian varoitusoireita on huonontunut tai puuttuu tai joilla on toistuvia hypoglykemioita. Näissä tapauksissa tulee harkita, onko suositeltavaa ajaa autolla.
Haittavaikutukset
Yhteenveto turvallisuusprofiilista
Hypoglykemia, insuliinihoidon yleisin haittavaikutus voi kehittyä, jos insuliiniannos ylittää insuliinintarpeen.
Taulukoitu lista haittavaikutuksista
Seuraavat kliinisissä tutkimuksissa esiintyneet haittavaikutukset on luokiteltu alla elinryhmien ja yleisyyden perusteella (hyvin yleinen: ≥ 1/10; yleinen: ≥ 1/100 − < 1/10; melko harvinainen: ≥ 1/1 000 − < 1/100; harvinainen: ≥ 1/10 000 − < 1/1 000; hyvin harvinainen: < 1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä arviointiin).
Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
| MedDRA-elinjärjestelmä-luokka | Hyvin yleinen | Yleinen | Melko harvinainen | Harvinainen | Tuntematon |
| Aineenvaihdunta ja ravitsemus | Hypoglykemia | Hyperglykemia (joka voi aiheuttaa diabeettisen ketoasidoosin (1)) | |||
| Iho ja ihonalainen kudos | Pistoskohdan reaktiot Paikalliset yliherkkyysreaktiot | Lipodystrofia | Ihoamyloidoosi | ||
| Yleisoireet ja antopaikassa todettavat haitat | Systeemiset yliherkkyysreaktiot | ||||
| (1) Apidra 100 yksikköä/ml injektioneste, liuos injektiopullossa: Useimmat tapauksista liittyivät käsittelyvirheisiin tai pumpun toimintahäiriöihin käytettäessä Apidra-insuliinia jatkuvana ihonalaisena insuliini-infuusiona insuliinipumpussa. | |||||
Kuvaus tietyistä haittavaikutuksista
- Aineenvaihdunta ja ravitsemus
Hypoglykemian oireet ilmaantuvat yleensä äkillisesti. Niihin saattaa liittyä kylmä hiki, viileä ja kalpea iho, uupumus, hermostuneisuus tai vapina, levottomuus, epätavallinen väsymys tai heikotus, sekavuus, keskittymiskyvyn heikkeneminen, uneliaisuus, voimakas nälkä, näköhäiriöt, päänsärky, pahoinvointi ja palpitaatio. Hypoglykemia voi pahentua ja voi johtaa tajuttomuuteen ja/tai kouristuksiin sekä tilapäiseen tai jatkuvaan aivojen toimintahäiriöön ja jopa kuolemaan.
Apidra 100 yksikköä/ml injektioneste, liuos injektiopullossa
Diabeettiseen ketoasidoosiin johtaneita hyperglykemiatapauksia on ilmoitettu esiintyneen käytettäessä Apidra-insuliinia jatkuvana ihonalaisena insuliini-infuusiona insuliinipumpussa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Useimmat tapauksista liittyivät käsittelyvirheisiin tai pumpun toimintahäiriöihin. Potilaan on aina noudatettava Apidra-insuliinin käyttöön tarkoitettuja erityisiä ohjeita ja hänellä on aina oltava saatavilla vaihtoehtoiset insuliinin annosteluvälineet pumpun toimintahäiriöiden varalta.
- Iho ja ihonalainen kudos
Paikallisia yliherkkyysreaktioita (pistoskohdan punoitus, turvotus ja kutina) voi esiintyä insuliinihoidon aikana. Nämä reaktiot ovat yleensä ohimeneviä ja tavallisesti ne häviävät hoidon jatkuessa.
Lipodystrofiaa ja ihoamyloidoosia saattaa esiintyä pistoskohdassa. Ne viivästyttävät insuliinin paikallista imeytymistä. Pistoskohdan jatkuva vuorottelu sovitulla pistosalueella saattaa vähentää tai ehkäistä näitä muutoksia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
- Yleisoireet ja antopaikassa todettavat haitat
Systeemisiä yliherkkyysreaktioita voivat olla urtikaria, puristava tunne rintakehällä, hengenahdistus, allerginen ihottuma ja kutina. Vaikeat yleistyneet allergiset reaktiot, mukaan lukien anafylaktinen reaktio, voivat olla henkeä uhkaavia.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Oireet
Hypoglykemia saattaa aiheutua, jos insuliinin teho on liiallinen suhteessa nautittuun ruokamäärään ja energian kulutukseen.
Glulisinsuliinin yliannostuksesta ei ole erityistä tietoa. Kuitenkin hypoglykemia voi kehittyä asteittain.
Hoito
Lieviä hypoglykemiakohtauksia voidaan hoitaa suun kautta otettavalla glukoosilla tai sokeripitoisilla tuotteilla. Tämän vuoksi on suositeltavaa, että diabeetikolla on aina mukanaan muutama sokeripala, makeisia, keksejä tai sokeroitua hedelmämehua.
Vaikeat hypoglykemiakohtaukset, joissa potilas on tajuton, voidaan hoitaa antamalla glukagonia (0,5 mg–1 mg) lihakseen tai ihon alle (sopivan koulutuksen saaneen henkilön toimesta) tai glukoosia laskimoon (terveydenhoitohenkilön toimesta). Glukoosia tulee antaa laskimoon myös silloin, kun potilas ei reagoi glukagoniin 10–15 minuutissa.
Tajunnan palautuessa suositellaan hiilihydraattien antamista suun kautta kohtauksen uusiutumisen estämiseksi.
Glukagonipistoksen jälkeen potilasta tulee seurata sairaalassa vakavan hypoglykemian syyn selvittämiseksi ja vastaavien kohtausten estämiseksi.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Diabeteslääkkeet, insuliinit ja insuliinijohdokset, lyhytvaikutteiset
ATC-koodi: A10AB06
Vaikutusmekanismi
Glulisinsuliini on yhdistelmä-DNA-tekniikalla valmistettu ihmisinsuliinianalogi, joka vastaa lyhytvaikutteista ihmisinsuliinia. Glulisinsuliinin vaikutus alkaa nopeammin ja on kestoltaan lyhyempi kuin lyhytvaikutteisen ihmisinsuliinin.
Insuliinien ja insuliinianalogien, mukaan lukien glulisinsuliinin, ensisijainen vaikutus on glukoosiaineenvaihdunnan säätely. Insuliinit laskevat veren glukoosipitoisuutta stimuloimalla perifeeristä glukoosin siirtymistä soluihin, etenkin luurankolihaksiin ja rasvakudokseen, ja estämällä glukoosin tuotantoa maksassa. Insuliini estää lipolyysiä rasvasoluissa, estää proteolyysiä sekä edistää proteiinisynteesiä.
Tutkimukset terveille vapaaehtoisille ja diabetespotilaille osoittivat, että ihon alle annettuna glulisinsuliinin vaikutus alkaa nopeammin ja on kestoltaan lyhyempi kuin lyhytvaikutteisen ihmisinsuliinin. Ihon alle pistetyn glulisinsuliinin glukoosipitoisuutta alentava vaikutus alkaa 10–20 minuutin sisällä. Suonensisäisen annostelun jälkeen havaittiin vaikutuksen alkavan nopeammin, olevan kestoltaan lyhyempi ja lisäksi saatiin suurempi huippuvaste verrattaessa ihonalaiseen annosteluun. Laskimoon annettuna glulisinsuliinin glukoosipitoisuutta alentava vaikutus on vastaava kuin lyhytvaikutteisella ihmisinsuliinilla. Yhdellä yksiköllä glulisinsuliinia on sama glukoosipitoisuutta alentava vaikutus kuin yhdellä yksiköllä lyhytvaikutteista ihmisinsuliinia.
Annosriippuvuus
Tutkimuksessa, johon osallistui 18 iältään 21–50-vuotiasta tyypin 1 diabetesta sairastavaa miestä, glulisinsuliinilla osoitettiin annoksesta riippuva glukoosipitoisuutta alentava vaikutus terapeuttisesti merkityksellisellä annosvälillä 0,075–0,15 yksikköä/kg, ja suhteessa pienempi glukoosia alentava vaikutus annoksella 0,3 yksikköä/kg tai tätä suuremmalla annoksella, kuten ihmisinsuliinilla.
Glulisinsuliinin vaikutus alkaa noin kaksi kertaa nopeammin kuin lyhytvaikutteisen ihmisinsuliinin ja glukoosipitoisuutta alentava vaikutus loppuu noin 2 tuntia aiemmin kuin lyhytvaikutteisen ihmisinsuliinin.
Tyypin 1 diabeetikoille tehdyssä faasin I tutkimuksessa arvioitiin glulisinsuliinin ja lyhytvaikutteisen ihmisinsuliinin glukoosipitoisuutta alentavaa profiilia, kun molempia insuliineja annosteltiin ihon alle 0,15 yksikköä/kg eri aikoina suhteessa 15 minuutin normaaliin ateriaan. Tulokset osoittivat, että 2 minuuttia ennen ateriaa pistetty glulisinsuliini sääteli aterianjälkeistä sokeritasapainoa samalla tavalla kuin 30 minuuttia ennen ateriaa pistetty lyhytvaikutteinen ihmisinsuliini. Pistettäessä glulisinsuliinia 2 minuuttia ennen ateriaa aterianjälkeinen sokeritasapaino oli parempi kuin 2 minuuttia ennen ateriaa pistetyllä lyhytvaikutteisella ihmisinsuliinilla. 15 minuuttia aterian aloittamisen jälkeen pistetty glulisinsuliini säätelee sokeritasapainoa samalla tavalla kuin 2 minuuttia ennen ateriaa pistetty lyhytvaikutteinen ihmisinsuliini (ks. Kuva 1).
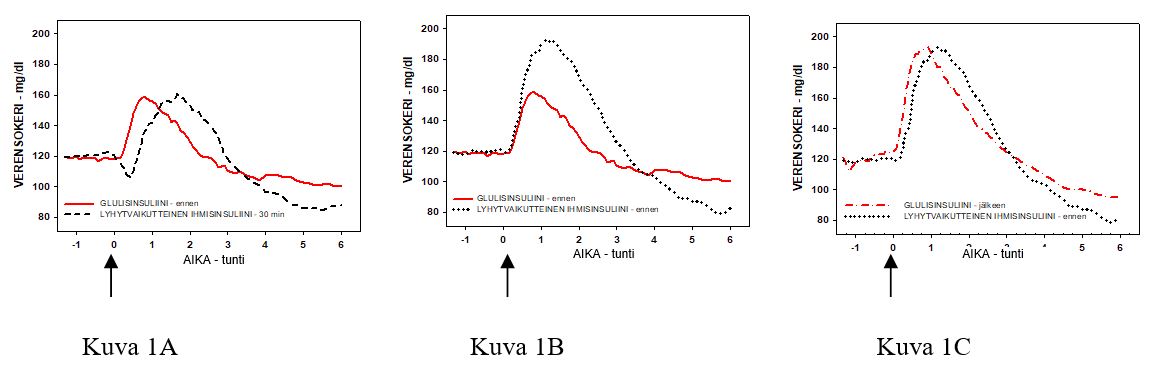
Kuva 1: Keskimääräinen glukoosipitoisuutta alentava vaikutus 6 tunnin aikana 20:llä tyypin 1 diabetespotilaalla. Glulisinsuliini pistettynä 2 minuuttia ennen aterian aloittamista (GLULISINSULIINI-ennen) verrattuna 30 minuuttia ennen aterian aloittamista pistettyyn lyhytvaikutteiseen ihmisinsuliiniin (LYHYTVAIKUTTEINEN IHMISINSULIINI-30 min) (kuva 1A) ja verrattuna 2 minuuttia ennen ateriaa pistettyyn lyhytvaikutteiseen ihmisinsuliiniin (LYHYTVAIKUTTEINEN IHMISINSULIINI-ennen) (kuva 1B). Glulisinsuliini pistettynä 15 minuuttia aterian aloittamisen jälkeen (GLULISINSULIINI-jälkeen) verrattuna 2 minuuttia ennen aterian aloittamista pistettyyn lyhytvaikutteiseen ihmisinsuliiniin (LYHYTVAIKUTTEINEN IHMISINSULIINI-ennen) (kuva 1C).
X‑akselilla kohta 0 (nuoli) on 15 minuuttia kestävän aterian aloitusaika.
Lihavuus
Faasin I tutkimus, joka tehtiin glulisinsuliinilla, lisproinsuliinilla ja lyhytvaikutteisella ihmisinsuliinilla ylipainoisille, osoitti, että glulisinsuliini säilytti nopeavaikutteiset ominaisuutensa. Tässä tutkimuksessa aika, jolloin AUC:n kokonaisarvosta oli saavutettu 20 %, ja AUC-arvo (0-2 h), joka kuvaa alkuvaiheen glukoosia alentavaa vaikutusta, olivat glulisinsuliinilla 114 min ja 427 mg/kg, lisproinsuliinilla 121 min ja 354 mg/kgja lyhytvaikutteisella ihmisinsuliinilla 150 min ja 197 mg/kg (ks. Kuva 2).
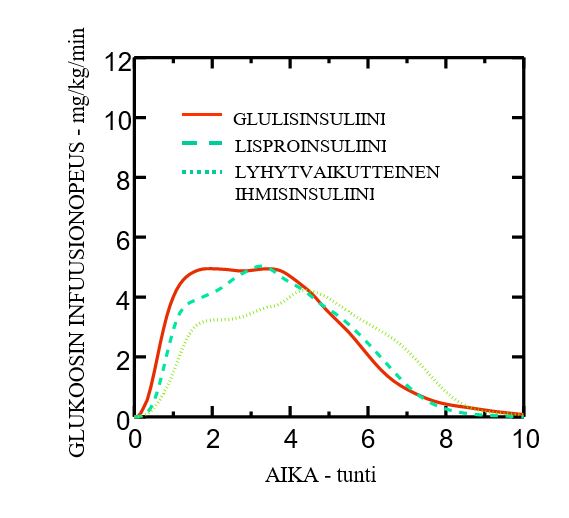
Kuva 2: Glukoosin infuusionopeus (GIR) ihonalaisen 0,3 yksikköä/kg injektion jälkeen ylipainoisille glulisinsuliinilla (GLULISINSULIINI), lisproinsuliinilla (LISPROINSULIINI) tai lyhytvaikutteisella ihmisinsuliinilla (LYHYTVAIKUTTEINEN IHMISINSULIINI).
Toinen faasin I tutkimus, joka tehtiin glulisinsuliinilla ja lisproinsuliinilla 80:lle ei-diabeetikolle, joiden painoindeksit vaihtelivat laajasti (18−46 kg/m2), osoitti, että vaikutuksen nopeus yleensä säilyy laajalla painoindeksialueella (BMI), kun taas kokonaisglukoosipitoisuutta alentava vaikutus vähenee ylipainon lisääntyessä.
Keskimääräinen glukoosin infuusionopeuden (GIR) kokonais-AUC (0-1 h) oli 102 ± 75 mg/kg ja 158 ± 100 mg/kg glulisinsuliinin annoksilla 0,2 ja 0,4 yksikköä/kg sekä 83,1 ± 72,8 mg/kg ja 112,3 ± 70,8 mg/kg lisproinsuliinin annoksilla 0,2 ja 0,4 yksikköä/kg.
Faasin I tutkimus, johon osallistui 18 ylipainoista tyypin 2 diabeetikkoa (BMI 35−40 kg/m2), glulisinsuliinilla ja lisproinsuliinilla [90 % CI: 0,81, 0,95 (p = < 0,01)] osoitti, että glulisinsuliini pitää tehokkaasti päivänaikaisen aterianjälkeisen veren glukoosipitoisuuden suurenemisen kurissa.
Kliininen teho ja turvallisuus
Tyypin 1 diabetes–Aikuiset
26 viikkoa kestäneessä faasin III tutkimuksessa verrattiin glulisinsuliinia lisproinsuliiniin tyypin 1 diabeetikoilla, jotka käyttivät perusinsuliinina glargininsuliinia. Glulisinsuliinia ja lisproinsuliinia pistettiin ihonalaisesti vähän (0-15 minuuttia) ennen ateriaa. Sokeritasapainon säätely glulisinsuliinilla ja lisproinsuliinilla oli vastaava mitattuna glykolysoituneen hemoglobiinin (ilmaistuna HbA1c ekvivalenttina) määrän muutoksena lähtötilanteesta päätepisteeseen. Potilaiden omaseurannassa mittaamat veren glukoosiarvot olivat samanlaiset. Perusinsuliinin annosta ei glulisinsuliinia käytettäessä tarvinnut nostaa toisin kuin lisproinsuliinilla.
12 viikkoa kestänyt faasin III tutkimus tyypin 1 diabeetikoille, jotka saivat perusinsuliinina glargininsuliinia, osoitti, että välittömästi aterian jälkeen pistetty glulisinsuliini on yhtä tehokas kuin vähän (0-15 minuuttia) ennen ateriaa pistetty glulisinsuliini tai ennen ateriaa (30-45 minuuttia) pistetty lyhytvaikutteinen ihmisinsuliini.
Tämän tutkimuksen potilailla glulisinsuliinia ennen ateriaa saaneessa ryhmässä glykohemoglobiinin vähenemä oli merkittävästi suurempi kuin lyhytvaikutteista ihmisinsuliinia saaneessa ryhmässä.
Tyypin 1 diabetes–Lapset
26 viikkoa kestäneessä faasin III tutkimuksessa verrattiin glulisinsuliinia ja lisproinsuliinia ihon alle annosteltuna juuri ennen ateriaa (0-15 minuuttia) tyypin 1 diabetesta sairastavilla lapsilla (4–5-vuotiaita: n = 9; 6–7-vuotiaita: n = 32 ja 8–11-vuotiaita: n = 149) ja nuorilla (12–17-vuotiaita: n = 382), jotka käyttivät perusinsuliinina glargininsuliinia tai NPH-insuliinia. Sokeritasapainon säätely glulis- ja lisproinsuliinilla oli vastaava mitattuna glykolysoituneen hemoglobiinin (GHb ilmaistuna HbA1c ekvivalenttina) määrän muutoksena lähtötilanteesta päätetapahtumaan tutkimuksen aikana. Potilaiden omaseurannassa mittaamat veren glukoosiarvot olivat samanlaiset.
Apidra-insuliinin käytöstä alle 6-vuotiaille lapsille ei ole riittävästi kliinistä tietoa.
Tyypin 2 diabetes–Aikuiset
26 viikkoa kestäneessä faasin III tutkimuksessa, jota seurasi 26 viikkoa kestänyt turvallisuuden seurantatutkimus, verrattiin glulisinsuliinia (0–15 minuuttia ennen ateriaa) lyhytvaikutteiseen ihmisinsuliiniin (30–45 minuuttia ennen ateriaa) ihon alle annosteltuna tyypin 2 diabeetikoille, joilla perusinsuliinina oli NPH‑insuliini. Potilaiden keskimääräinen painoindeksi (BMI) oli 34,55 kg/m2. Glulisinsuliini osoittautui tilastollisesti samanarvoiseksi kuin lyhytvaikutteinen ihmisinsuliini HbA1c‑arvon muutoksessa lähtöarvosta 6 kuukauden päätearvoon (‑0,46 % glulisinsuliinilla ja ‑0,30 % lyhytvaikutteisella ihmisinsuliinilla, p = 0,0029) ja lähtöarvosta 12 kuukauden päätearvoon (‑0,23 % glulisinsuliinilla ja ‑0.13 % lyhytvaikutteisella ihmisinsuliinilla, ero ei merkitsevä). Tässä tutkimuksessa suurin osa potilaista (79 %) sekoitti lyhytvaikutteisen insuliinin NPH‑insuliinin kanssa välittömästi ennen pistämistä ja 58 %:lla oli oraalinen diabeteslääke randomoinnin yhteydessä, ja heitä oli neuvottu jatkamaan sen käyttöä entisellä annoksella.
Rotu ja sukupuoli
Aikuisille suoritetuissa kontrolloiduissa kliinisissä tutkimuksissa glulisinsuliini ei eronnut turvallisuudessa eikä tehossa rotuun tai sukupuoleen perustuvissa alaryhmäanalyyseissa.
Farmakokinetiikka
Glulisinsuliinissa ihmisinsuliinin asparagiini-aminohapon korvaaminen lysiinillä asemassa B3 ja lysiinin korvaaminen glutamiinihapolla asemassa B29 saavat aikaan nopean imeytymisen.
Tutkimuksessa, johon osallistui 18 iältään 21–50-vuotiasta tyypin 1 diabetesta sairastavaa miestä, glulisinsuliinin alku-, maksimi- ja kokonaisaltistus oli annoksesta riippuvaa annoksilla 0,075–0,4 yksikköä/kg.
Imeytyminen ja hyötyosuus
Farmakokineettiset profiilit terveillä vapaaehtoisilla ja diabetespotilailla (tyypin 1 tai 2) osoittivat, että glulisinsuliinin imeytyminen oli noin kaksi kertaa nopeampaa ja huippupitoisuus noin kaksi kertaa suurempi kuin lyhytvaikutteisella ihmisinsuliinilla.
Tyypin 1 diabetespotilaille tehdyssä tutkimuksessa, jossa insuliinia annosteltiin ihon alle 0,15 yksikköä/kg, glulisinsuliinin Tmax oli 55 minuuttia ja Cmax 82 ± 1,3 µyksikköä/ml ja lyhytvaikutteisen ihmisinsuliinin Tmax oli 82 minuuttia ja Cmax oli 46 ± 1,3 µyksikköä/ml. MRT (Mean Residence Time) oli glulisinsuliinilla lyhyempi (98 min) kuin lyhytvaikutteisella ihmisinsuliinilla (161 min) (ks. Kuva 3).
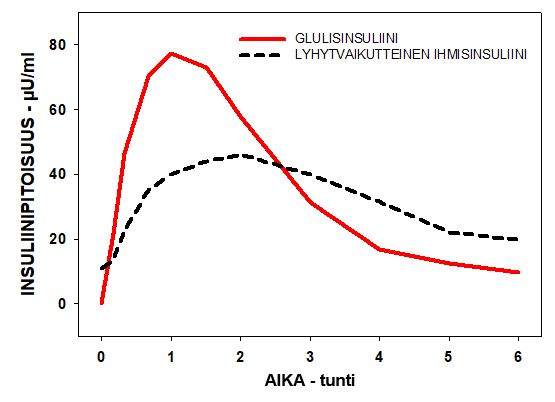
Kuva 3: Glulisinsuliinin ja lyhytvaikutteisen ihmisinsuliinin farmakokineettiset profiilit tyypin 1 diabetespotilailla 0,15 yksikköä/kg annoksen jälkeen.
Tutkimuksessa tyypin 2 diabeetikoille 0,2 yksikköä/kg ihonalaisen insuliiniannoksen jälkeen glulisinsuliinin Cmax oli 91 µyksikköä/ml ja kvartiiliväli 78–104 µyksikköä/ml.
Pistettäessä ihonalaisesti vatsan alueelle, olkavarteen ja reiteen glulisinsuliinin pitoisuus‑aika ‑profiilit olivat samanlaiset, vatsaan pistettynä imeytyminen oli vähän nopeampaa kuin reiteen pistettynä. Imeytyminen olkavarren alueelta oli näiden väliltä (ks. kohta Annostus ja antotapa). Glulisinsuliinin absoluuttinen hyötyosuus (70 %) oli samanlainen kaikilla pistoalueilla ja yksilöiden välinen vaihtelu oli pientä (11 % CV). Glulisinsuliinin suonensisäinen bolusinjektio aiheutti suuremman systeemisen altistuksen Cmax:n ollessa noin 40 kertaa suurempi kuin ihonalaisen injektion jälkeen.
Liikalihavuus
Toinen faasin I tutkimus, joka tehtiin glulisinsuliinilla ja lisproinsuliinilla 80:lle ei-diabeetikolle, joiden painoindeksit vaihtelivat laajasti (18–46 kg/m2), osoitti, että nopea imeytyminen ja kokonaisaltistus yleensä säilyvät laajalla painoindeksialueella.
Glulisinsuliinilla saavutettiin 10 % insuliinin kokonaisaltistuksesta nopeammin, noin 5–6 minuutissa.
Jakautuminen ja eliminaatio
Glulisinsuliinin ja lyhytvaikutteisen ihmisinsuliinin jakautuminen ja eliminaatio laskimonsisäisen annostelun jälkeen ovat samanlaiset, jakautumistilavuudet ovat 13 l ja 22 l ja puoliintumisajat 13 ja 18 minuuttia, vastaavasti.
Ihonalaisen pistoksen jälkeen glulisinsuliini eliminoituu nopeammin kuin lyhytvaikutteinen ihmisinsuliini puoliintumisaikojen ollessa 42 ja 86 minuuttia. Glulisinsuliinitutkimuksessa, joka tehtiin terveille vapaaehtoisille sekä tyypin 1 tai 2 diabetespotilaille, puoliintumisaika vaihteli 37 ja 75 minuutin välillä (kvartiiliväli).
Glulisinsuliinin sitoutuminen plasman proteiineihin on vähäistä, kuten ihmisinsuliinilla.
Erityispotilasryhmät
Munuaisten vajaatoiminta
Kliinisessä tutkimuksessa, johon osallistuneilla ei ollut diabetesta ja joiden munuaisten toiminta vaihteli (kreatiniinipuhdistuma > 80 ml/min, 30–50 ml/min tai < 30 ml/min), glulisinsuliinin nopeavaikutteisuus säilyi yleisesti. Munuaisten vajaatoimintapotilailla insuliinintarve voi kuitenkin vähentyä.
Maksan vajaatoiminta
Farmakokineettisiä ominaisuuksia ei ole tutkittu maksan vajaatoimintapotilailla.
Iäkkäät potilaat
Iäkkäiden diabetespotilaiden farmakokinetiikasta on vain rajoitetusti tietoa.
Lapset ja nuoret
Glulisinsuliinin farmakokineettisiä ja farmakodynaamisia ominaisuuksia tutkittiin tyypin 1 diabetesta sairastavilla lapsilla (7–11 v.) ja nuorilla (12–16 v.). Glulisinsuliini imeytyi nopeasti molemmissa ikäryhmissä ja Tmax sekä Cmax olivat samanlaiset kuin aikuisilla (ks. kohta Annostus ja antotapa). Välittömästi ennen testiateriaa pistetty glulisinsuliini sääteli samoin kuin aikuisilla aterianjälkeistä sokeritasapainoa paremmin kuin lyhytvaikutteinen ihmisinsuliini (ks. kohta Farmakodynamiikka). Glukoosin AUC0-6 h oli glulisinsuliinilla 641 mg.h.dl-1 ja lyhytvaikutteisella ihmisinsuliinilla 801 mg.h.dl-1.
Prekliiniset tiedot turvallisuudesta
Prekliinisissä tiedoissa ei ollut muita toksisia havaintoja kuin verensokeria alentava farmakodynaaminen vaikutus (hypoglykemia), joka ei poikennut lyhytvaikutteisella ihmisinsuliinilla havaitusta, eikä sillä ollut kliinistä merkitystä ihmisille.
Farmaseuttiset tiedot
Apuaineet
Metakresoli
Natriumkloridi
Trometamoli
Polysorbaatti 20
Kloorivetyhappo, väkevä
Natriumhydroksidi
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Apidra 100 yksikköä/ml injektioneste, liuos injektiopullossa
Ihonalainen käyttö
Koska yhteensopimattomuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kuin NPH‑ihmisinsuliinin kanssa.
Insuliinipumpussa käytettäessä Apidra-insuliinia ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Suonensisäinen käyttö
Apidra-insuliinin on todettu olevan yhteensopimaton 5-prosenttisen glukoosiliuoksen ja Ringerin liuoksen kanssa eikä sitä saa käyttää näiden liuosten kanssa. Muiden liuosten käyttöä ei ole tutkittu.
Kestoaika
2 vuotta.
Apidra 100 yksikköä/ml injektioneste, liuos injektiopullossa
Säilyvyys injektiopullon käyttöönoton jälkeen
Valmiste voidaan säilyttää alle 25 °C suoralta kuumuudelta ja valolta suojassa enimmillään 4 viikon ajan. Pidä injektiopullo ulkopakkauksessa. Herkkä valolle.
Injektiopullon ensimmäisen käyttökerran päivämäärä on hyvä merkitä etikettiin.
Säilyvyys suonensisäisessä käytössä
Suonensisäiseen käyttöön tarkoitettu glulisinsuliini, jonka pitoisuus on 1 yksikkö/ml, on stabiili 15–25 °C:ssa 48 tunnin ajan (ks. kohta Käyttö- ja käsittelyohjeet).
Apidra 100 yksikköä/ml injektioneste, liuos sylinteriampullissa
Säilyvyys sylinteriampullin käyttöönoton jälkeen
Valmiste voidaan säilyttää alle 25 °C suoralta kuumuudelta ja valolta suojassa enimmillään 4 viikon ajan.
Sylinteriampullin sisältävää kynää ei saa säilyttää jääkaapissa.
Kynänsuojus on asetettava takaisin paikalleen jokaisen pistoksen jälkeen suojaamaan valolta.
Apidra SoloStar 100 yksikköä/ml injektioneste, liuos esitäytetyssä kynässä
Säilyvyys kynän käyttöönoton jälkeen
Valmiste voidaan säilyttää alle 25 °C suoralta kuumuudelta ja valolta suojassa enimmillään 4 viikon ajan. Käyttöönotettuja kyniä ei saa säilyttää jääkaapissa.
Kynänsuojus on asetettava takaisin paikalleen jokaisen pistoksen jälkeen suojaamaan valolta.
Säilytys
Apidra 100 yksikköä/ml injektioneste, liuos injektiopullossa
Avaamattomat injektiopullot
Säilytä jääkaapissa (2 °C–8 °C).
Ei saa jäätyä.
Huolehdi siitä, että Apidra‑insuliini ei ole lähellä jääkaapin pakastuslokeroa tai kylmäelementtiä.
Pidä injektiopullo ulkopakkauksessa. Herkkä valolle.
Avatut injektiopullot
Avatun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Apidra 100 yksikköä/ml injektioneste, liuos sylinteriampullissa
Avaamattomat sylinteriampullit
Säilytä jääkaapissa (2 °C–8 °C).
Ei saa jäätyä.
Huolehdi siitä, että Apidra‑insuliini ei ole lähellä jääkaapin pakastuslokeroa tai kylmäelementtiä.
Pidä sylinteriampulli ulkopakkauksessa. Herkkä valolle.
Käyttöönotetut sylinteriampullit
Avatun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Apidra SoloStar 100 yksikköä/ml injektioneste, liuos esitäytetyssä kynässä
Käyttämättömät kynät
Säilytä jääkaapissa (2 °C–8 °C).
Ei saa jäätyä.
Huolehdi siitä, että Apidra‑insuliini ei ole lähellä jääkaapin pakastuslokeroa tai kylmäelementtiä.
Pidä esitäytetty kynä ulkopakkauksessa. Herkkä valolle.
Käyttöönotetut kynät
Avatun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
APIDRA injektioneste, liuos
100 U/ml (L:ei) 10 ml (18,04 €)
APIDRA injektioneste, liuos, sylinteriampulli
100 U/ml (L:ei) 5 x 3 ml (30,32 €)
APIDRA SOLOSTAR injektioneste, liuos, esitäytetty kynä
100 U/ml (L:ei) 5 x 3 ml (33,48 €)
PF-selosteen tieto
Apidra 100 yksikköä/ml injektioneste, liuos injektiopullossa
10 ml liuosta injektiopullossa (tyypin I väritön lasi), jossa suljin (alumiinirengas, synteettinen klorobutyylitulppa) ja polypropyleenirepäisysuojus. Pakkauksissa on 1, 2, 4 tai 5 injektiopulloa.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Apidra 100 yksikköä/ml injektioneste, liuos sylinteriampullissa
3 ml liuosta sylinteriampullissa (tyypin I väritön lasi), jossa mäntä (synteettinen bromobutyylikumi), suljin (alumiinirengas) ja tulppa (synteettinen bromobutyylikumi). Pakkauksissa on 1, 3, 4, 5, 6, 8, 9 ja 10 sylinteriampullia.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Apidra SoloStar 100 yksikköä/ml injektioneste, liuos esitäytetyssä kynässä
3 ml liuosta sylinteriampullissa (väritön lasi), jossa mäntä (synteettinen bromobutyylikumi), suljin (alumiinirengas) ja tulppa (synteettinen bromobutyylikumi). Sylinteriampulli on suljettu kertakäyttöiseen esitäytettyyn kynään. Pakkauksissa on 1, 3, 4, 5, 6, 8, 9 ja 10 kynää.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Kirkas, väritön vesiliuos.
Käyttö- ja käsittelyohjeet
Apidra 100 yksikköä/ml injektioneste, liuos injektiopullossa
Ihonalainen käyttö
Injektiopulloissa olevaa Apidra-insuliinia käytetään insuliiniruiskujen kanssa, joissa on sopiva asteikko, tai insuliinipumpuissa (ks. kohta Annostus ja antotapa).
Tarkista injektiopullo ennen käyttöä. Sitä saa käyttää vain, jos liuos on kirkas, väritön eikä siinä näy kiinteitä hiukkasia. Koska Apidra on kirkas insuliiniliuos, se ei vaadi sekoittamista ennen käyttöä.
Insuliinin etiketti on tarkistettava aina ennen pistämistä, jotta lääkitysvirheet glulisinsuliinin ja muiden insuliinien välillä vältetään (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Sekoittaminen muiden insuliinien kanssa
Sekoitettaessa NPH‑ihmisinsuliinin kanssa tulee Apidra‑insuliini vetää ruiskuun ensimmäiseksi. Pistos tulee antaa välittömästi sekoittamisen jälkeen, koska ennalta sekoitettujen insuliinien säilyvyydestä ei ole tietoa.
Jatkuva ihonalainen infuusiopumppu
Ks. ohjeet kohdista Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet.
Suonensisäinen käyttö
Infuusiolaitteistossa käytettävän Apidra-insuliinin pitoisuuden on oltava 1 yksikkö/ml glulisinsuliinia 9 mg/ml (0,9 %) natriumkloridiliuoksessa, jossa on tai ei ole 40 mmol kaliumkloridia. Infuusioon on käytettävä muovista koekstrudoitua polyolefiini/polyamidi-infuusiopussia, jossa on erillinen infuusiolinja. Suonensisäiseen käyttöön tarkoitettu glulisinsuliini, jonka pitoisuus on 1 yksikkö/ml, on stabiili 15–25 °C:ssa 48 tunnin ajan.
Liuos on tarkastettava laimentamisen jälkeen silmämääräisesti hiukkasten varalta ennen suonensisäistä annostelua. Liuosta saa käyttää vain, jos se on kirkasta ja väritöntä eikä se ole sameaa eikä siinä ole silminhavaittavia hiukkasia.
Apidra-insuliinin on todettu olevan yhteensopimaton 5-prosenttisen glukoosiliuoksen ja Ringerin liuoksen kanssa eikä sitä saa käyttää näiden liuosten kanssa. Muiden liuosten käyttöä ei ole tutkittu.
Apidra 100 yksikköä/ml injektioneste, liuos sylinteriampullissa
Apidra 100 yksikköä/ml sylinteriampullissa sopii vain insuliinikynällä ihon alle annettaviin pistoksiin. Jos anto ruiskulla, pistoksena laskimoon tai infuusiopumpulla on tarpeen, silloin on käytettävä injektiopulloa. Apidra-sylinteriampullit on tarkoitettu käytettäväksi vain seuraavien kynien kanssa: ClikSTAR, Autopen 24, Tactipen, AllStar, AllStar PRO tai JuniorSTAR (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet). Kaikkia kyniä ei välttämättä ole kaupan.
Kynää pitää käyttää valmistajan antamien ohjeiden mukaisesti.
On noudatettava huolellisesti kynän valmistajan ohjeita sylinteriampullin ja neulan asettamisesta sekä insuliinipistoksen ottamisesta. Tarkista sylinteriampulli ennen käyttöä. Sitä saa käyttää vain, jos liuos on kirkas, väritön eikä siinä näy kiinteitä hiukkasia. Sylinteriampulli on pidettävä huoneenlämmössä 1–2 tuntia ennen kynään asettamista. Ilmakuplat on poistettava sylinteriampullista ennen pistämistä (ks. kynän käyttöohje). Älä täytä tyhjää sylinteriampullia uudelleen.
Jos insuliinikynä on vaurioitunut tai se ei toimi kunnolla (mekaanisista vioista johtuen), se tulee hävittää ja ottaa käyttöön uusi insuliinikynä.
Kontaminaation ehkäisemiseksi insuliinikynä on tarkoitettu vain potilaan henkilökohtaiseen käyttöön.
Insuliinin etiketti on tarkistettava aina ennen pistämistä, jotta lääkitysvirheet glulisinsuliinin ja muiden insuliinien välillä vältetään (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Apidra SoloStar 100 yksikköä/ml injektioneste, liuos esitäytetyssä kynässä
Apidra SoloStar 100 yksikköä/ml esitäytetyssä kynässä sopii vain ihon alle annettaviin pistoksiin. Jos anto ruiskulla, pistoksena laskimoon tai infuusiopumpulla on tarpeen, silloin on käytettävä injektiopulloa. Ennen ensimmäistä käyttökertaa kynää on säilytettävä huoneenlämmössä 1–2 tunnin ajan.
Tarkista sylinteriampulli ennen käyttöä. Sitä saa käyttää vain, jos liuos on kirkas, väritön, siinä ei näy kiinteitä hiukkasia ja se muistuttaa vettä. Koska Apidra on kirkas insuliiniliuos, se ei vaadi sekoittamista ennen käyttöä.
Tyhjiä kyniä ei saa käyttää uudelleen, vaan ne on hävitettävä asianmukaisesti.
Mahdollisten sairauksien leviämisen ehkäisemiseksi jokainen kynä on tarkoitettu vain yhden potilaan käyttöön.
Insuliinin etiketti on tarkistettava aina ennen pistämistä, jotta lääkitysvirheet glulisinsuliinin ja muiden insuliinien välillä vältetään (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Kynän käsittely
Potilasta tulee neuvoa lukemaan pakkausselosteessa oleva käyttöohje huolellisesti ennen SoloStar-kynän käyttöä.
Tärkeää tietoa SoloStar-kynän käytöstä:
- Ennen jokaista käyttöä on aina kiinnitettävä uusi neula huolellisesti ja tehtävä käyttövalmiuden tarkistus. Annosta ei saa valita ja/tai annostelunappulaa painaa ilman paikalleen asetettua neulaa. Vain SoloStar-kynän kanssa yhteensopivia neuloja on käytettävä.
- Erityistä varovaisuutta on noudatettava neulojen käsittelyssä vammojen ja infektioiden välttämiseksi.
- SoloStar-kynää ei saa koskaan käyttää, jos se on vaurioitunut tai potilas on epävarma toimiiko se oikein.
- Potilaan on pidettävä aina toinen SoloStar-kynä mukana siltä varalta, että SoloStar-kynä katoaa tai vaurioituu.
Säilytysohjeet
Katso SoloStar-kynän säilytysohjeet tämän valmisteyhteenvedon kohdasta Säilytys.
Jos SoloStar-kynä on kylmäsäilytyksessä, se on otettava lämpenemään 1–2 tuntia ennen pistämistä. Kylmän insuliinin pistäminen on kivuliaampaa.
Käytetty SoloStar-kynä on hävitettävä paikallisten ohjeiden mukaisesti.
Huolto
SoloStar-kynä on suojattava pölyltä ja lialta.
SoloStar-kynä voidaan puhdistaa pyyhkimällä ulkopuolelta kostealla kankaalla.
Kynää ei saa kastella, pestä tai voidella, jotta se ei vahingoittuisi.
SoloStar-kynä on suunniteltu toimimaan tarkasti ja turvallisesti. Sitä on käsiteltävä varoen. Potilaan on vältettävä tilanteita, joissa SoloStar-kynä voi vaurioitua. Jos potilas epäilee, että SoloStar-kynä on vaurioitunut, hänen pitää ottaa käyttöön uusi kynä.
Vaihe 1. Insuliinin tarkistaminen
Kynässä olevasta etiketistä on tarkistettava, että kynä sisältää oikeaa insuliinia. Apidra SoloStar-kynä on sininen. Annostelunappula on tummansininen ja sen päällä on koholla oleva rengas. Kynänsuojuksen poistamisen jälkeen on myös tarkistettava insuliinin ulkonäkö: liuoksen on oltava kirkas, väritön, siinä ei näy kiinteitä hiukkasia ja sen on muistutettava vettä.
Vaihe 2. Neulan asettaminen
Vain SoloStar-kynän kanssa yhteensopivia neuloja saa käyttää, jotta varmistetaan että kynä ja neula toimivat oikein ja ilmakuplat poistuvat.
Jokaiseen pistokseen käytetään aina uutta steriiliä neulaa. Kynänsuojuksen poistamisen jälkeen neula on asetettava huolellisesti kohtisuorassa kynään.
Vaihe 3. Käyttövalmiuden tarkistus
Käyttövalmius on tarkistettava ennen jokaista pistosta, jotta varmistutaan siitä, että kynä ja neula toimivat oikein sekä ilmakuplien poistamiseksi.
Valitaan 2 yksikön annos.
Poistetaan ulompi ja sisempi neulansuojus.
Kynää pidetään neula ylöspäin ja naputetaan kevyesti sormella insuliinisäiliön kylkeen niin, että ilmakuplat nousevat neulaa kohti.
Sen jälkeen annostelunappula painetaan kokonaan pohjaan.
Jos neulan kärkeen ilmestyy insuliinia, kynä ja neula toimivat oikein.
Jos insuliinia ei tule neulan kärkeen, vaihe 3 on toistettava, kunnes insuliinia ilmestyy neulan kärkeen.
Vaihe 4. Insuliiniannoksen valitseminen
Annos voidaan asettaa 1 yksikön tarkkuudella. Pienin annos on 1 yksikkö ja suurin annos 80 yksikköä. Yli 80 yksikön annos on otettava kahtena tai useampana pistoksena.
Käyttövalmiuden tarkistamisen jälkeen annosikkunassa pitää näkyä ”0”. Sen jälkeen voidaan valita annos.
Vaihe 5. Insuliiniannoksen pistäminen
Terveydenhuoltohenkilön on neuvottava potilaalle oikea pistostekniikka.
Neula pistetään ihon alle.
Annostelunappula on painettava kokonaan pohjaan. Annostelunappula on pidettävä alas painettuna 10 sekuntia ennen kuin neula vedetään ihosta. Tämä varmistaa sen, että koko insuliiniannos on pistetty.
Vaihe 6. Neulan poistaminen ja hävittäminen
Neula on aina poistettava ja hävitettävä jokaisen pistoksen jälkeen. Tämä auttaa estämään kontaminaatiota ja/tai infektioita, ilman pääsyä sylinteriampulliin ja insuliinin vuotamista. Neuloja ei saa käyttää uudelleen.
Erityistä varovaisuutta on noudatettava neulan poistamisessa ja hävittämisessä. Suositeltuja varotoimia on noudatettava neulojen poistamisessa ja hävittämisessä (esim. neulansuojuksen paikalleen asettaminen yhdellä kädellä), jotta neulojen aiheuttamien vammojen ja tarttuvien tautien leviämisen vaara pienenee.
Kynänsuojus on asetettava paikalleen.
Korvattavuus
APIDRA injektioneste, liuos
100 U/ml 10 ml
APIDRA injektioneste, liuos, sylinteriampulli
100 U/ml 5 x 3 ml
APIDRA SOLOSTAR injektioneste, liuos, esitäytetty kynä
100 U/ml 5 x 3 ml
- Ylempi erityiskorvaus (100 %). Diabetes, insuliinihoito (103).
- Peruskorvaus (40 %).
ATC-koodi
A10AB06
Valmisteyhteenvedon muuttamispäivämäärä
04.02.2025
Yhteystiedot
 SANOFI OY
SANOFI OY Revontulenkuja 1
02100 Espoo
0201 200 300
www.sanofi.fi
