PROLASTINA infuusiokuiva-aine ja liuotin, liuosta varten 1000 mg
Vaikuttavat aineet ja niiden määrät
Yksi injektiopullo sisältää noin 1000 mg funktionaalista ihmisen alfa1-proteinaasin estäjää*.
Kun liuos on saatettu käyttövalmiiksi lisäämällä 40 ml liuotinta, liuos sisältää noin 25 mg/ml ihmisen alfa1-proteinaasin estäjää.
* Tuotettu ihmisluovuttajien plasmasta.
Apuaineet, joiden vaikutus tunnetaan:
Prolastina sisältää 2,76 mg natriumia per ml käyttövalmista liuosta (120 mmol/l).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Infuusiokuiva-aine ja liuotin, liuosta varten
Kliiniset tiedot
Käyttöaiheet
Pitkäkestoinen korvaushoito potilailla, joilla on dokumentoitu vaikea alfa1-proteinaasinestäjän puutos (esim. genotyypit PiZZ, PiZ(null), Pi(null,null) ja PiSZ). Potilaiden lääkkeellisen ja ei-lääkkeellisen hoidon pitää olla optimaalinen, ja on oltava näyttöä etenevästä keuhkosairaudesta (esim. odotettua matalampi uloshengityksen sekuntitilavuus (FEV1), heikentynyt kävelykyky tai lisääntynyt pahenemisvaiheiden määrä), jonka on arvioinut terveydenhuollon ammattilainen, jolla on kokemusta alfa1-proteinaasinestäjän puutoksen hoidosta.
Ehto
Ensimmäiset infuusiot on annettava sellaisen terveydenhuollon ammattilaisen ohjauksessa, jolla on kokemusta alfa1-proteinaasinestäjän puutoksen hoidosta.
Annostus ja antotapa
Lääkärin, jolla on kokemusta kroonisista obstruktiivisista keuhkosairauksista, on aloitettava hoito ja valvottava ensimmäisiä infuusiokertoja. Myöhemmät infuusiot voi antaa terveydenhuollon ammattilainen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Hoidon kestosta päättää hoitava lääkäri. Hoidon kestoa koskevia spesifisiä rajoituksia ei ole.
Annostus
Aikuiset, myös iäkkäät potilaat
Yleensä riittää 60 mg vaikuttavaa ainetta painokiloa kohti (vastaa 75 kg painavalla potilaalla 180 ml:aa käyttövalmista infuusionestettä, joka sisältää 25 mg/ml ihmisen alfa1-proteinaasin estäjää) kerran viikossa lyhytkestoisena infuusiona, jotta seerumin alfa1‑proteinaasin estäjäpitoisuus pysyy jatkuvasti tasolla > 80 mg/dl, joka vastaa keuhkoissa pitoisuutta 1,3 mikroM. Tämän katsotaan olevan pienin keuhkoemfyseeman pahenemista estävä seerumin alfa1‑proteinaasin estäjäpitoisuus.
Pediatriset potilaat
Prolastina-valmisteen antamisesta alle 18-vuotiaille lapsille ja nuorille ei ole kokemusta.
Antotapa
Prolastina-valmisteen saa antaa ainoastaan infuusiona laskimoon käyttövalmiiksi saattamisen jälkeen.
Kuiva-aine liuotetaan pakkauksessa mukana olevaan liuottimeen (injektionesteisiin käytettävä vesi) kohdassa Käyttö- ja käsittelyohjeet annettujen ohjeiden mukaisesti ja annetaan sopivalla nesteensiirtolaitteella (ei mukana pakkauksessa).
Liuos on käytettävä 3 tunnin sisällä käyttövalmiiksi saattamisesta.
Infuusionopeus ei saa olla yli 0,08 ml/painokilo/min (vastaa 75 kg painavalla potilaalla infuusionopeutta 6 ml/min). Tätä infuusionopeutta voidaan säätää potilaan sietokyvyn mukaisesti.
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet lääkevalmisteen saattamisesta käyttökuntoon ennen lääkkeen antoa.
Vasta-aiheet
Prolastina-valmistetta ei saa käyttää, jos potilaalla on
- selektiivinen IgA-puutos ja IgA-vasta-aineita, koska tällöin voi kehittyä allergisia reaktioita ja jopa anafylaktinen sokki
- tiedossa oleva yliherkkyys alfa1-proteinaasin estäjille tai kohdassa Apuaineet mainituille apuaineille (ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet).
Varoitukset ja käyttöön liittyvät varotoimet
Kohdassa Annostus ja antotapa annettua suositeltua infuusionopeutta on noudatettava. Jos ilmenee mikään reaktio, joka saattaisi liittyä Prolastina-valmisteen antoon, infuusionopeutta on pienennettävä tai anto on keskeytettävä, potilaan voinnin mukaisesti.
Prolastina voi aiheuttaa ohimenevän verivolyymin nousun, joten erityistä varovaisuutta tulee noudattaa, mikäli potilaalla on vaikea sydämen vajaatoiminta tai verenkiertoelimistön ylikuormituksen riski.
Yliherkkyys
Yliherkkyysreaktioita voi harvoin ilmetä myös niillä potilailla, jotka ovat sietäneet aikaisempaa hoitoa ihmisen alfa1-proteinaasinestäjällä. Jos potilaalle kehittyy vaikea yliherkkyysreaktio (verenpaineen lasku tasolle < 90 mmHg, hengenahdistus tai jopa anafylaktinen sokki), Prolastina-hoito on keskeytettävä välittömästi, ja asianmukainen hoito (tarvittaessa myös sokin hoito) on aloitettava.
Kotihoito
On vain vähän tietoja Prolastina-valmisteen käytöstä kotihoidossa.
Mahdolliset kotihoitoon liittyvät riskit liittyvät lääkevalmisteen käsittelyyn ja antoon sekä haittavaikutusten hoitoon. Potilaille on kerrottava yliherkkyysreaktioiden oireista.
Päätöksen siitä, sopiiko potilas kotihoitoon, tekee hoitava lääkäri, jonka on varmistettava asianmukainen koulutus (esim. koskien käyttövalmiiksi saattamista, siirtolaitteen käyttöä, i.v.-letkujen kokoamista, infuusiotekniikoita, hoitopäiväkirjan pitämistä, haittavaikutusten tunnistamista ja tällaisissa tapauksissa suoritettavista toimenpiteistä) ja että valmisteen käyttöä arvioidaan säännöllisin väliajoin.
Tartunnanaiheuttajat
Ihmisen veri- tai plasmaperäisten lääkevalmisteiden aiheuttamat infektiot pyritään torjumaan tavanomaisin keinoin, joita ovat luovuttajien valinta, luovutettujen veriyksiköiden ja plasmapoolien testaus spesifisten infektiomarkkerien suhteen, sekä tehokkaiden virusten inaktivointi/poistomenetelmien käyttö valmistusprosessin aikana. Taudinaiheuttajien siirtymismahdollisuutta ei kuitenkaan pystytä täysin sulkemaan pois käytettäessä ihmisen veri- tai plasmaperäisiä lääkevalmisteita. Tämä koskee myös toistaiseksi tuntemattomia ja uusia viruksia ja taudinaiheuttajia.
Käytössä olevien toimenpiteiden katsotaan tehoavan vaipallisiin viruksiin, kuten ihmisen immuunikatovirus (HIV), hepatiitti B ‑virus (HBV) ja hepatiitti C ‑virus (HCV). Virusten inaktivointi/poistomenetelmien teho vaipattomiin viruksiin, kuten hepatiitti A ‑virus (HAV) ja parvovirus B19, saattaa olla rajallinen.
Parvovirus B19 ‑infektio voi olla vakava raskausaikana (sikiö voi saada infektion) ja jos potilaalla on immuunivajavuustila tai kiihtynyt erytropoieesi (esim. hemolyyttinen anemia).
Potilaat, jotka saavat ihmisen plasmasta valmistettuja proteinaasin estäjiä säännöllisesti tai toistuvasti, tulee rokottaa näitä taudinaiheuttajia vastaan (A- ja B-hepatiitti).
Jäljitettävyys
Potilaan nimi ja valmisteen eränumero tulee aina dokumentoida selkeästi Prolastina-valmisteen annon yhteydessä, jotta voidaan tarvittaessa selvittää, mitä valmiste-erää potilas on saanut.
Tupakointi
Prolastina-hoitoa ei voida kieltää tupakoitsijoilta. Koska kuitenkin tupakan savu keuhkoissa huonontaa Prolastinan tehoa, tupakoinnin lopettamista suositellaan.
Natriumpitoisuus
Tämä lääkevalmiste sisältää noin 110,4 mg (4,8 mmol) natriumia per 1000 mg:n injektiopullo. Potilaalla, joka painaa 75 kg, suositusannoksen natriummäärä vastaa 24,84 % WHO:n suosittelemasta natriumin 2 g:n päivittäisestä enimmäissaannista aikuisille. Tämä on otettava huomioon potilailla, joilla on ruokavalion natriumrajoitus.
Yhteisvaikutukset
Prolastina-valmisteella ei tiedetä olevan yhteisvaikutuksia muiden lääkevalmisteiden kanssa.
Raskaus ja imetys
Raskaus
Valmisteen käytöstä raskauden aikana ei ole tehty kliinisiä tutkimuksia eikä eläinkokeita. Siksi Prolastina-valmisteen antoa raskaana oleville naisille tulee harkita huolellisesti.
Imetys
Ei tiedetä, erittyykö alfa1-proteinaasin estäjä rintamaitoon. Alfa1-proteinaasin estäjän eritystä rintamaitoon ei ole tutkittu eläimillä. Imetyksen hyöty lapselle ja Prolastina-lääkityksen hyöty äidille tulisi ottaa huomioon, kun tehdään päätöstä imetyksen tai Prolastina-lääkityksen jatkamisesta tai keskeyttämisestä.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Prolastina-valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Prolastina-hoito saattaa aiheuttaa tunnettuja reaktioita, kuten kuumetta, flunssankaltaisia oireita, hengenahdistusta, nokkosihottumaa, pahoinvointia, ym.
Kuitenkin melko harvinaisia tai harvinaisia immunologisia reaktioita saattaa ilmetä, kuten muidenkin proteiinihoitojen kanssa, silloinkin kun potilaalla ei ole ilmennyt yliherkkyyttä tai allergisia reaktioita aikaisempien antojen suhteen. Tämä käsittää allergiset reaktiot, kuten nokkosihottuma tai hengenahdistus, hyvin harvoin anafylaksia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Oireet, jotka ovat mahdollisesti immunologista alkuperää, tulisi arvioida ennen kuin potilaat uudelleen altistuvat hoidolle.
Haittavaikutustaulukko
Haittavaikutukset esitetään alla olevassa taulukossa MedDRA-elinjärjestelmäluokituksen mukaisesti (elinjärjestelmäluokitus ja suositeltu termi).
Esiintymistiheydet on arvioitu seuraavan käytännön mukaisesti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000) ja hyvin harvinainen (< 1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä arviointiin).
Seuraavia haittavaikutuksia on havaittu Prolastina-hoidon aikana:
| Elinjärjestelmä | Melko harvinaiset > 0,1 % – < 1 % | Harvinaiset > 0,01 % – < 0,1 % | Hyvin harvinaiset < 0,01 % |
| Immuunijärjestelmä | Nokkosihottuma | Yliherkkyysreaktiot | Anafylaktinen sokki |
| Hermosto | Huimaus/pyörrytys, päänsärky | ||
| Sydän | Takykardia | ||
| Verisuonisto | Hypotensio Hypertensio | ||
| Hengityselimet, rintakehä ja välikarsina | Hengenahdistus | ||
| Iho ja ihonalainen kudos | Ihottuma | ||
| Ruoansulatuselimistö | Pahoinvointi | ||
| Luusto, lihakset ja sidekudos | Nivelkipu/nivelsärky | Selkäkipu | |
| Yleisoireet ja antopaikassa todettavat haitat | Vilunväreet, kuume, flunssankaltaiset oireet, rintakipu |
Tietoa virusturvallisuudesta, ks. kohta Varoitukset ja käyttöön liittyvät varotoimet.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Yliannostuksen seurauksia ei tunneta.
Yliannostustapauksissa potilasta on seurattava tarkasti haittavaikutusten varalta, ja tukihoitoa tulee antaa tarvittaessa.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Proteinaasin estäjät, ATC-koodi: B02AB02
Alfa1-proteinaasin estäjä on ihmisen veren normaali aineosa, joka estää useiden entsyymien, mm. neutrofiilielastaasin, toimintaa. Alfa1-proteinaasin estäjän molekyylipaino on 51 kDa, ja se kuuluu seriiniproteaasin estäjien ryhmään.
Tällä hetkellä oletetaan, että emfyseeman patogeneesi alfa1-proteinaasin estäjän puutostilassa johtuu kroonisesta biokemiallisesta epätasapainosta elastaasin ja alfa1-proteinaasin estäjän välillä. Elastaasia muodostuu alahengitysteiden proinflammatorisissa soluissa, ja se pystyy hajottamaan kimmokudosta. Alfa1-proteinaasin estäjä on yksi tärkeimmistä elastaasin estäjistä, mutta perinnöllisessä alfa1-proteinaasin estäjän puutoksessa sitä ei ole. Tällöin keuhkorakkulat ovat suojattomia alahengitysteiden neutrofiileistä vapautuvaa elastaasia vastaan ja altistuvat sille kroonisesti.
Tämä johtaa kimmokudoksen etenevään hajoamiseen ja jos seerumin alfa1-antitrypsiinin pitoisuus laskee alle 80 mg/dl, liittyy tilaan suurentunut emfyseeman kehittymisen riski.
Kahden kontrolloidun tutkimuksen mukaan uloshengityksen sekuntikapasiteetin (FEV1) aleneminen hidastui merkittävimmin potilailla, joiden FEV1-arvo on ollut 35–60 % normaaliarvosta.
Farmakokinetiikka
Laskimoon annon jälkeen käytännöllisesti katsoen 100 % verenkierrossa olevasta alfa1-proteinaasin estäjäannoksesta on heti käytössä. Keskimääräinen saanti in vivo on 4,2 mg/dl painokiloa kohti.
Puoliintumisaika in vivo on noin 4,5 vuorokautta.
Prekliiniset tiedot turvallisuudesta
Prolastina-valmisteen vaikuttava aine alfa1-proteinaasin estäjä on peräisin ihmisen plasmasta ja käyttäytyy endogeenisten plasman aineosien tavoin. Merkkejä toksisista vaikutuksista ei todettu, kun useille koe-eläinlajeille annettiin kerta-annos Prolastina-valmistetta. Merkkejä toksisista vaikutuksista ei havaittu myöskään, kun Prolastinaa annettiin kaneille kerta-annos viitenä päivänä peräkkäin. Muita prekliinisiä tutkimuksia, joissa lääkevalmistetta annetaan toistuvasti (krooninen toksisuus, karsinogeenisuus, lisääntymistoksisuus) ei tehty. Näitä tutkimuksia ei voida tehdä tavanomaisilla eläinmalleilla, koska vasta-aineiden oletetaan muodostuvan ihmisen heterologisten proteiinien annon seurauksena.
Farmaseuttiset tiedot
Apuaineet
Kuiva-aine:
Natriumkloridi
Natriumdivetyfosfaatti
Liuotin:
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, Prolastina-valmistetta ei saa sekoittaa muiden lääkevalmisteiden eikä muiden infuusionesteiden kanssa.
Kestoaika
3 vuotta.
Käyttövalmis liuos tulee aina käyttää 3 tunnin sisällä käyttövalmiiksi saattamisesta.
Käyttövalmista infuusioliuosta ei saa säilyttää jääkaapissa. Käyttämätön liuos on hävitettävä paikallisten vaatimusten mukaisesti.
Säilytys
Säilytä alle 25 °C.
Ei saa jäätyä.
Käyttökuntoon saatetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
PROLASTINA infuusiokuiva-aine ja liuotin, liuosta varten
1000 mg (L:ei) 1 kpl (1000 mg+40 ml) (464,92 €)
PF-selosteen tieto
Kuiva-aine:
Injektiopullo (tyypin I lasia), jossa on klooributyylikumitulppa ja alumiinikorkki.
Liuotin:
Injektiopullo (tyypin I lasia), jossa on klooributyylikumitulppa ja alumiinikorkki.
Pakkauskoot:
Kertapakkaus:
Prolastina 1000 mg infuusiokuiva-ainetta ja liuotinta, liuosta varten, sisältää:
- yhden kuiva-ainetta sisältävän injektiopullon (1000 mg funktionaalista ihmisen alfa1-proteinaasin estäjää)
- yhden liuotinta sisältävän injektiopullon (40 ml injektionesteisiin käytettävää vettä)
- yhden siirtolaitteen käyttökuntoon saattamista varten.
Kerrannaispakkaus sisältää:
- neljä kertapakkausta Prolastina 1000 mg infuusiokuiva-ainetta ja liuotinta, liuosta varten.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Kuiva-aine tai mureneva massa: valkoinen tai vaaleankeltainen tai vaaleanruskea kuiva-aine
Liuotin: kirkas väritön liuos
Käyttövalmis liuos on kirkas tai hieman opalisoiva, väritön, vaaleanvihreä, vaaleankeltainen tai vaaleanruskea liuos.
Käyttö- ja käsittelyohjeet
Kuiva-aine liuotetaan pakkauksessa mukana olevaan injektiopullon sisältämään injektionesteisiin käytettävään veteen seuraavien ohjeiden mukaisesti. Käyttövalmis liuos on kirkas tai hieman opalisoiva, väritön, vaaleanvihreä, vaaleankeltainen tai vaaleanruskea liuos. Liuoksen pitäisi sekoittua käyttövalmiiksi 5 minuutin kuluessa.
Infuusionesteen käyttövalmiiksi saattaminen
- Noudata aseptista tekniikkaa (puhdas ja sanitoitu), jotta tuote pysyy steriilinä. Käytä käyttökuntoon saattamisessa tasaista työskentelyalustaa.
- Varmista, että Prolastina-injektiopullot (kuiva-aine) ja liuotin (steriili injektionesteisiin käytettävä vesi) ovat huoneenlämpöisiä (20–25 °C).
- Poista Prolastina-injektiopullosta ja liuotinta sisältävästä injektiopullosta suojakorkki, ja puhdista injektiopullon kaulan reunukset ja tulpat desinfiointipyyhkeellä. Anna kumitulppien kuivua.
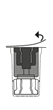
4. Avaa steriili siirtolaitepakkaus vetämällä kansi pois.
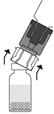
| 5. Aseta liuottimen sisältävä injektiopullo pystyyn tasaiselle alustalle ja ota injektiopullosta tukeva ote. Älä poista siirtolaitetta ulkopakkauksesta. Paina siirtolaitteen sinistä päätä suoraan alaspäin, kunnes piikki lävistää tulpan ja napsahtaa. Vältä kiertämistä.
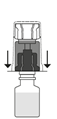
| 6. Poista siirtolaitteesta kirkas ulkopakkaus ja hävitä se.
|
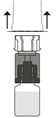
7. Aseta Prolastina-injektiopullo pystyyn alustalle. Käännä liuottimen sisältävä injektiopullo ja siihen kiinnitetty siirtolaite ylösalaisin 180°. Paina siirtolaitteen kirkasta/valkoista päätä suoraan alaspäin – kiertämättä – kunnes piikki lävistää tulpan ja napsahtaa.
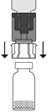
| 8. Injektiopullon tyhjiö vetää liuottimen siihen automaattisesti. Odota että kaikki liuos siirtyy injektiopulloon. Irrota siirtolaite siihen liitetystä liuottimen sisältävästä injektiopullosta noin 45° kulmassa.
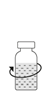
| 9. Pyörittele Prolastina-injektiopulloa kevyesti, kunnes kuiva-aihe on liuennut täysin.
|
10. Jos tarvittavaan annokseen on käytettävä useampi kuin yksi injektiopullo, noudata edellä annettuja ohjeita myös muiden pakkausten ja uuden siirtolaitteen yhteydessä. Älä käytä siirtolaitetta uudelleen.
Vain kirkasta tai hieman opalisoivaa, väritöntä, vaaleanvihreää, vaaleankeltaista tai vaaleanruskeaa liuosta, jossa ei ole näkyviä hiukkasia, saa käyttää. Liuos on käytettävä 3 tunnin sisällä käyttövalmiiksi saattamisesta. Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
PROLASTINA infuusiokuiva-aine ja liuotin, liuosta varten
1000 mg 1 kpl
- Ei korvausta.
ATC-koodi
B02AB02
Valmisteyhteenvedon muuttamispäivämäärä
15.07.2024
Yhteystiedot
Sveavägen 166
SE-113 46 Stockholm
Sverige
+46 8 441 89 50
www.grifols.com
infonordic@grifols.com