SANCUSO depotlaastari 3,1 mg/24 h
Vaikuttavat aineet ja niiden määrät
Yksi 52 cm2:n depotlaastari sisältää 34,3 mg granisetronia, josta vapautuu 3,1 mg granisetronia 24 tunnin kuluessa.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Depotlaastari.
Kliiniset tiedot
Käyttöaiheet
Sancuso-depotlaastari on tarkoitettu aikuisille kohtalaisesti tai hyvin voimakkaasti pahoinvointia aiheuttavan solunsalpaajahoidon yhteydessä esiintyvän pahoinvoinnin ja oksentelun ehkäisyyn.
Depotlaastari on suunniteltu käytettäväksi 3 – 5 perättäisen vuorokauden ajan silloin kun suun kautta annettavan oksentelua hillitsevän lääkeaineen käyttö on komplisoitunut syistä, jotka vaikeuttavat nielemistä (ks. kohta Farmakodynamiikka).
Annostus ja antotapa
Annostus
Aikuiset
Kiinnitä yksi depotlaastari 24 - 48 tuntia ennen solunsalpaajahoitoa tarvittaessa.
Granisetronin plasmatasojen vähittäisen nousun vuoksi depotlaastarin kiinnityksen jälkeen solunsalpaajahoidon alussa voidaan havaita tehon alkavan hitaammin kuin suun kautta otettavan 2 mg:n annoksen. Depotlaastari tulee kiinnittää 24−48 tuntia ennen solunsalpaajahoitoa.
Depotlaastari tulee poistaa aikaisintaan 24 tunnin kuluttua solunsalpaajahoidon päättymisestä. Depotlaastaria voidaan käyttää korkeintaan 7 vuorokauden ajan solunsalpaajahoito-ohjelman kestosta riippuen.
Tavanomaisen hematologisen tarkkailun jälkeen depotlaastarin saa kiinnittää vain sellaisiin potilaisiin, joiden solunsalpaajahoito ei todennäköisesti viivästy, näin vähennetään tarpeetonta granisetronille altistumista.
Kortikosteroidien samanaikainen käyttö
Multinational Association of Supportive Care in Cancer (MASCC) suosittaa ohjeissaan deksametasonin annostelua 5HT3-antagonistin kanssa ennen solunsalpaajahoitoa. Tärkeässä Sancuso-tutkimuksessa kortikosteroidien, esim. deksametasonin, samanaikainen käyttö sallittiin edellyttäen, että se oli osana solunsalpaajahoitoa. Kortikosteroidien käytön lisääminen tutkimuksen aikana ilmoitettiin apuhoitona.
Erityisryhmät
Iäkkäät
Annostelu kuten aikuisille (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet sekä Farmakokinetiikka).
Munuaisten tai maksan vajaatoiminta
Annoksen muuttaminen ei ole tarpeen. Annostus kuten aikuisille (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet sekä Farmakokinetiikka). Vaikka haittavaikutusten lisääntymistä ei ole todettavissa munuaisten tai maksan vajaatoimintaa sairastavilla potilailla, jotka saivat granisetronia suun kautta ja laskimoon, on varovaisuutta noudatettava tälle väestölle granisetronin farmakokinetiikan vuoksi.
Pediatriset potilaat
Sancuson turvallisuutta ja tehoa 0-18 vuoden ikäisten lasten hoidossa ei ole vielä varmistettu.
Tietoja ei ole saatavilla.
Antotapa
Depotlaastari tulee kiinnittää puhtaalle, kuivalle ja ehjälle iholle olkavarren ulkopintaan. Jos depotlaastarin kiinnitys olkavarteen ei ole mahdollista, se voidaan kiinnittää vatsan iholle. Depotlaastaria ei tule kiinnittää punoittavalle, ärtyneelle tai vaurioituneelle iholle.
Jokainen depotlaastari on pakattu pussiin, ja laastari tulee kiinnittää välittömästi pussin avaamisen jälkeen. Tarran suojakalvo poistetaan ennen laastarin kiinnittämistä.
Depotlaastaria ei saa leikata osiin.
Mikäli depotlaastari irtoaa kokonaan tai osittain, alkuperäinen depotlaastari tulee kiinnittää uudelleen samaan kohtaan käyttämällä lääketeippiä (jos tarpeen). Jos uudelleenkiinnitys ei ole mahdollista tai depotlaastari on vaurioitunut, tulee uusi depotlaastari kiinnittää samaan paikkaan kuin alkuperäinen depotlaastari. Jos se ei ole mahdollista, uusi depotlaastari kiinnitetään vastakkaiseen olkavarteen.
Uudelleen kiinnitetty depotlaastari tulee poistaa yllä annetun suositellun aikataulun mukaisesti.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle, muille 5-HT3–reseptoriantagonisteille tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Kiinnityskohdassa todettavat reaktiot
Sancusoon liittyvissä kliinisissä tutkimuksissa ilmoitettiin kiinnityskohdassa esiintyvistä reaktioista, jotka olivat yleensä voimakkuudeltaan lieviä eivätkä johtaneet käytön lopettamiseen. Vakavien reaktioiden tai yleistyneen ihoreaktion (esim. allerginen ihottuma, mukaan lukien erytematoottinen, makulaarinen ja papulaarinen ihottuma tai kutina) ilmetessä tulee depotlaastari poistaa.
Ruoansulatuselimistö
Granisetroni saattaa vaikeuttaa taustalla olevan sairauden aiheuttaman progressiivisen ileuksen ja/tai vatsan turvotuksen havaitsemista. Koska granisetroni saattaa hidastaa suolen motiliteettia, tulee sen annostelun jälkeen seurata potilaita, joilla on subakuutin suolitukoksen merkkejä.
Sydän
5-HT3-reseptoriantagonistien, kuten granisetronin, käyttöön saattaa liittyä rytmihäiriöitä tai EKG- poikkeavuuksia. Tällä saattaa olla kliinistä merkitystä potilaille, joilla on entuudestaan rytmihäiriöitä tai sydämen johtumishäiriöitä ja/tai jotka saavat hoitoa rytmihäiriölääkkeillä tai beetasalpaajilla. Kliinisesti merkitseviä vaikutuksia ei ole havaittu SANCUSOon liittyvissä kliinisissä tutkimuksissa.
Altistuminen valolle
Suora luonnon- tai keinovalo saattaa vaikuttaa granisetroniin, ks. lisätietoja kohdasta Prekliiniset tiedot turvallisuudesta. Potilaiden on peitettävä depotlaastarin kiinnityspaikka esim. vaatetuksella, jos on olemassa auringonvalolle altistumisen riski käytön aikana ja 10 vuorokauden ajan laastarin poistamisen jälkeen.
Suihkussa käynti tai peseytyminen
Suihkussa käyntiä tai peseytymistä normaaliin tapaan voidaan jatkaa Sancusoa käytettäessä. Uinnin, rasittavan liikunnan ja saunomisen kaltaisia toimintoja tulee välttää.
Ulkopuolinen kuumuus
Ulkoista lämpöä (esim. kuumavesipulloja tai lämpöpakkauksia) tulee välttää depotlaastarin kiinnitysalueella.
Erityisväestöt
Annosta ei tarvitse muuttaa iäkkäille tai munuaisten tai maksan vajaatoimintaa sairastaville potilaille. Vaikka ei ole näyttöä siitä, että haittavaikutusten määrä olisi suurempi munuaisten tai maksan vajaatoimintaa sairastavilla potilailla, jotka saivat granisetronia suun kautta ja laskimoon, on varovaisuutta noudatettava tällä väestöllä granisetronin farmakokinetiikan vuoksi.
Serotoniinioireyhtymä
On esiintynyt raportteja serotoniinioireyhtymästä 5-HT3-antagonistien käytön yhteydessä joko yksinään tai useimmiten yhdistettynä muihin serotonergisiin lääkevalmisteisiin (mukaan lukien selektiiviset serotoniinin takaisinoton estäjät (SSRI-lääkkeet) ja serotoniinin ja noradrenaliinin takaisinoton estäjät (SNRI-lääkkeet)). On myös esiintynyt raportteja serotoniinioireyhtymästä, joka on mahdollisesti johtunut buprenorfiinin/opioidien ja serotonergisten lääkevalmisteiden välisisistä lääkeyhteisvaikutuksista. Potilaiden asianmukainen tarkkailu serotoniinioireyhtymän kaltaisten oireiden varalta on aiheellista.
Ihoreaktiot
Granisetroni-depotlaastarilla tehdyissä kliinisissä tutkimuksissa raportoitiin kiinnityskohdan reaktioita, jotka olivat yleensä lieviä ja jotka eivät johtaneet käytön lopettamiseen. Vaikeiden reaktioiden tai yleistyneen ihoreaktion (esim. allerginen ihottuma, mukaan lukien erytematoottinen, makulaarinen ja papulaarinen ihottuma tai kutina) tapauksessa depotlaastari on poistettava.
Väärinkäytön ja riippuvuuden mahdollisuus
Granisetronilla ei tiedetä olevan väärinkäyttö- tai riippuvuuspotentiaalia.
Yhteisvaikutukset
Serotonergisistä lääkevalmisteista (esim. SSRI- ja SNRI-lääkkeet, buprenorfiini, opioidit tai muut serotonergiset lääkevalmisteet) on saatu ilmoituksia serotoniinioireyhtymästä samanaikaisen 5-HT3-antagonistien ja muiden serotonergisten lääkevalmisteiden (SSRI- ja SNRI-lääkkeet mukaan lukien) käytön seurauksena.
Laskimoon annettavien 5-HT3–reseptoriantagonistien ja suun kautta otettavan parasetamolin samanaikaisen annostelun ihmisellä on ilmoitettu estävän analgeettista vaikutusta farmakodynaamisen mekanismin kautta.
Koska maksan sytokromi P450 -vaikuttavia aineita metaboloivat entsyymit CYP1A1 ja CYP3A4 metaboloivat granisetronia, näiden entsyymien indusoijat tai estäjät saattavat muuttaa granisetronin puhdistumaa ja siten sen puoliintumisaikaa.
Ihmisellä maksaentsyymien indusointi fenobarbitaalilla on aiheuttanut plasman kokonaispuhdistuman suurenemista (noin 25 %) kun granisetronia on annettu laskimoon.
In vitro –tutkimuksissa on todettu, että ketokonatsoli saattaa estää granisetronin metaboloitumista sytokromin P450 3A -isoentsyymiryhmän kautta. Tämän löydöksen kliininen merkitys on toistaiseksi selvittämättä.
In vitro -tutkimuksissa, joissa käytettiin ihmisen mikrosomeja, todettiin, että granisetroni ei stimuloi eikä estä sytokromi P450 -entsyymijärjestelmää.
Terveillä vapaaehtoisilla tehdyissä tutkimuksissa ei todettu yhteisvaikutuksia granisetronin ja bentsodiatsepiinien (loratsepaamin), neuroleptien (haloperidolin) tai ulkustaudin hoitoon käytettävien valmisteiden (simetidiinin) välillä.
Sancuson ja pahoinvointia aiheuttavien solunsalpaajahoitojen välillä ei ole todettu kliinisesti merkitseviä yhteisvaikutuksia. Mitään yhteisvaikutuksia ei myöskään ole havaittu granisetronin ja pahoinvointia aiheuttavien syöpähoitojen välillä. Näiden tietojen kanssa yhdenmukaisesti ei myöskään Sancusoon liittyvissä kliinisissä tutkimuksissa ole saatu ilmoituksia kliinisesti merkitsevistä lääkkeiden yhteisvaikutuksista. Kliinisissä yhteisvaikutustutkimuksissa aprepitantilla ei ollut kliinisesti merkitseviä vaikutuksia granisetronin farmakokinetiikkaan.
Pediatriset potilaat
Yhteisvaikutuksia on tutkittu vain aikuisille tehdyissä tutkimuksissa.
Raskaus ja imetys
Raskaus
On vain vähän tietoja (alle 300 raskaudesta) granisetronin käytöstä raskaana oleville naisille. Eläintutkimuksissa ei ole havaittu suoria tai epäsuoria lisääntymistoksisia vaikutuksia (ks. kohta Prekliiniset tiedot turvallisuudesta) Varmuuden vuoksi suositellaan välttämään Sancuson käyttöä raskauden aikana.
Imetys
Granisetronin tai sen metaboliittien erittymisestä ihmisen rintamaitoon ei ole tietoa. Rintaruokinta on keskeytettävä Sancuso-hoidon ajaksi.
Hedelmällisyys
Granisetronin vaikutuksesta ihmisen hedelmällisyyteen ei ole tietoa.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Sancuson vaikutusta ajokykyyn tai koneidenkäyttökykyyn ei ole tutkittu
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Sancuson turvallisuusprofiili on saatu kliinisistä tutkimuksista ja markkinoille tulon jälkeisestä kokemuksesta. Kliinisissä tutkimuksissa yleisimmin raportoitu haittavaikutus oli ummetus, jota esiintyi noin 8,7 prosentilla potilaista. Suurin osa haittavaikutuksista oli vaikeusasteeltaan lieviä tai kohtalaisia.
Haittavaikutusluettelo
Kliinisissä tutkimuksissa todetut ja Sancuson käytöstä oma-aloitteisesti ilmoitetut haittavaikutukset on esitetty elinjärjestelmäluokan mukaan alla olevassa taulukossa.
Elinjärjestelmäluokassa haittavaikutukset on lueteltu esiintyvyystiheyden mukaisesti seuraavan tavan mukaisesti: hyvin yleinen (≥1/10); yleinen (≥1/100, <1/10); melko harvinainen (≥1/1000, <1/100); harvinainen (≥1/10 000, <1/1000); hyvin harvinainen (<1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä arviointiin).
Haittavaikutukset on lueteltu vähenevän vakavuusasteen mukaan kussakin yleisyysluokassa.
Taulukko 1: Sancuson käytössä ilmoitetut haittavaikutukset
Elinjärjestelmäluokka | Haittavaikutus | Esiintyvyys |
Immuunijärjestelmä | Yliherkkyysreaktiot | Tuntematon |
Aineenvaihdunta ja ravitsemus | Ruokahalun väheneminen | Melko harvinainen |
Hermosto | Päänsärky | Melko harvinainen |
Dystonia | Harvinainen | |
Dyskinesia | Harvinainen | |
Serotoniinioireyhtymä | Tuntematon | |
Kuulo ja tasapainoelin | Vertigo | Melko harvinainen |
Verisuonisto | Punastuminen | Melko harvinainen |
Ruoansulatuselimistö | Ummetus | Yleinen |
| Suun kuivuminen, pahoinvointi, yökkäily | Melko harvinainen |
Maksa ja sappi | Alaniiniaminotransferaasin nousu, aspartaattiaminotransferaasin nousu, gamma-glutamyylitransferaasin nousu | Melko harvinainen |
Luusto, lihakset ja sidekudos | Nivelkipu | Melko harvinainen |
Yleisoireet ja antopaikassa todettavat haitat | Yleistynyt turvotus Kiinnityskohdan ärsytys* Kiinnityskohdan reaktiot** | Melko harvinainen Melko harvinainen Tuntematon |
*Kiinnityskohdan ärsytys sisältää seuraavat: kiinnityskohdan kutina ja ihoärsytys (oma-aloitteiset ilmoitukset)
**Kiinnityskohdan reaktiot sisältää seuraavat: kiinnityskohdan eryteema, kiinnityskohdan ihottuma, kiinnityskohdan kipu, kiinnityskohdan yliherkkyys, kiinnityskohdan rakkulat, kiinnityskohdan kirvely, kiinnityskohdan urtikaria ja kiinnityskohdan värjäytyminen.
Valittujen haittavaikutusten kuvaus
Kohtalaisesti tai hyvin voimakkaasti pahoinvointia aiheuttavaa solunsalpaajahoitoa saavilla potilailla voi esiintyä oksentelua vaikka he saavatkin oksentelua hillitsevää hoitoa, Sancuso mukaan lukien.
Serotoniinioireyhtymä
On esiintynyt raportteja serotoniinioireyhtymästä 5-HT3-antagonistien käytön yhteydessä joko yksinään tai useimmiten yhdistettynä muihin serotonergisiin lääkevalmisteisiin (mukaan lukien selektiiviset serotoniinin takaisinoton estäjät (SSRI-lääkkeet) ja serotoniinin ja noradrenaliinin takaisinoton estäjät (SNRI-lääkkeet)). On myös esiintynyt raportteja serotoniinioireyhtymästä, joka on mahdollisesti johtunut buprenorfiinin/opioidien ja serotonergisten lääkevalmisteiden välisisistä lääkeyhteisvaikutuksista (ks. kohta Yhteisvaikutukset). Potilaiden asianmukainen tarkkailu serotoniinioireyhtymän kaltaisten oireiden varalta on aiheellista.
Luokkavaikutukset
Granisetronin muiden (suun kautta tai laskimoon annosteltavien) lääkemuotojen käytön yhteydessä havaittuja luokkavaikutuksia ovat
- yliherkkyysreaktiot, esim. anafylaksia, urtikaria
- unettomuus
- päänsärky
- ekstrapyramidaalireaktiot
- raukeus
- huimaus
- QT-ajan piteneminen
- ummetus
- ripuli
- maksan transaminaasiarvojen suureneminen
- ihottuma
- astenia
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Granisetronille ei ole olemassa mitään erityistä vasta-ainetta. Yliannostustapauksessa on depotlaastari poistettava. Oireenmukaista hoitoa on annettava.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Antiemeetit ja pahoinvointilääkkeet, serotoniinin (5HT3) antagonistit.
ATC-koodi: A04AA02
Granisetroni on voimakas antiemeetti ja erittäin selektiivinen 5-hydroksitryptamiinin (5-HT3–reseptorien) antagonisti. Farmakologiset tutkimukset ovat osoittaneet, että granisetroni on tehokas pahoinvoinnin ja oksentelun hoidossa solunsalpaajahoidon jälkeen.
Radioligandisitoutumistutkimuksen mukaan granisetronilla on erittäin heikko affiniteetti muihin reseptorityyppeihin, 5-HT1-, 5-HT2-, 5-HT4- ja dopamiini D2-reseptorien sitoutumispaikat mukaan lukien.
Keskeisessä satunnaistetussa, kaksoissokkoutetussa, kaksoisplasebotekniikalla toteutetussa monikansallisessa Faasin III tutkimuksessa vertailtiin Sancuson tehoa, siedettävyyttä ja turvallisuutta kerran vuorokaudessa annettavaan, pahoinvoinnin ja oksentelun ehkäisyyn suun kautta otettavaan 2 mg:n granisetroniannokseen kaikkiaan 641 potilaalla, jotka saivat solunsalpaajahoitoa usean päivän ajan. Tutkimuksen tavoitteena oli osoittaa Sancuso vähintään samanveroiseksi (non-inferiority) suun kautta otettavan granisetronin kanssa.
Tutkimukseen satunnaistetusta väestöstä miehiä oli 48 % ja naisia 52 %, iältään 16-86 vuotta, ja he saivat kohtalaisesti pahoinvointia aiheuttavaa (ME) tai voimakkaasti pahoinvointia aiheuttavaa (HE) solunsalpaajahoitoa usean päivän ajan. 78 % potilaista oli valkoihoisia, 12 % aasialaisia sekä 10 % espanjalaisia/latinalaisamerikkalaisia.
Granisetronia sisältävä depotlaastari kiinnitettiin 24 - 48 tuntia ennen ensimmäistä solunsalpaaja-annosta, ja se pidettiin paikallaan 7 vuorokauden ajan. Suun kautta annosteltavaa granisetronia annettiin päivittäin solunsalpaajahoidon ajan, yksi tunti ennen kutakin solunsalpaaja-annosta. Oksentelua ehkäisevää vaikutusta arvioitiin ensimmäisestä annostelusta siihen saakka, kun viimeisen päivän kohtalaisesti pahoinvointia aiheuttavan (ME) tai voimakkaasti pahoinvointia aiheuttavan (HE) solunsalpaajan annostelun aloittamisesta oli kulunut 24 tuntia.
Sancuso ja suun kautta annettava granisetroni vahvistettiin samanveroisiksi. Täysi hallinta (complete control) saavutettiin 60,2 %:lla potilaista Sancuso-hoitoryhmässä ja 64,8 %:lla potilaista suun kautta granisetronia saaneessa ryhmässä ‘per protocol’ -joukossa (ero -4,89 %; 95 % luottamusväli –12,91 % - +3,13 %; n=284 depotlaastari, n=298 suun kautta). Täysi hallinta määritettiin saavutetuksi, jos potilaalla ei esiintynyt lainkaan oksentelua ja/tai yökkäilyä, jos pahoinvointi oli enintään lievää, ja jos mitään apulääkitystä ei tarvittu useana päivänä annetun solunsalpaajahoidon ensimmäisestä annoksesta viimeistä annosta seuraavaan 24 tuntiin.
Granisetronin pitoisuus plasmassa suurenee hitaasti depotlaastarin kiinnityksen jälkeen solunsalpaajahoidon alussa, minkä vuoksi lääkkeen teho voi alkaa hitaammin kuin suun kautta otettavan 2 mg:n annoksen. Sancuso on siksi tarkoitettu käytettäväksi potilaille, joiden kohdalla suun kautta annettavan oksentelua hillitsevän lääkeaineen käyttö on komplisoitunut syistä, jotka vaikeuttavat nielemistä.
Täydellinen hallinta kunakin päivänä on esitetty alla.
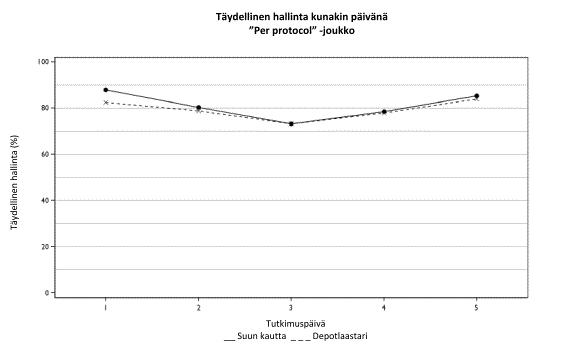
Sancuson kliinisten tutkimusten aikana ei esiintynyt hoitoon liittyviä sydämen sykkeeseen eikä verenpaineeseen kohdistuvia vaikutuksia. EKG-sarjojen arvioinnissa potilailla ei esiintynyt QT-ajan pidentymistä eikä EKG:n morfologian muutoksia. Sancuson vaikutusta QTc-intervalliin arvioitiin erityisesti sokkoutetussa, satunnaistetussa, rinnakkaisessa lumelääke- ja aktiivilääke- (moksifloksasiini) kontrolloidussa, QTc:tä perusteellisesti selvittäneessä tutkimuksessa 240 aikuisella mies- ja naispotilaalla. Sancuson ei havaittu merkitsevästi pidentävän QTc-intervallia.
Depotlaastarin kiinnittymistä arvioineessa tutkimuksessa 621 potilasta oli saanut joko vaikuttavaa lääkettä tai lumelääkettä sisältäviä depotlaastareita. Tutkimus osoitti alle 1 % depotlaastareista irtoavan 7 vuorokauden kuluessa laastarin kiinnityksestä.
Kliinistä tutkimuskokemusta Sancuson käytöstä seuraaville potilasryhmille ei ole: solunsalpaajahoitoa vähemmän kuin 3 perättäistä päivää saaneet potilaat, useita solunsalpaajahoitojaksoja saaneet potilaat, tai suuria solunsalpaaja-annoksia ennen kantasolusiirtoa saaneet potilaat.
Farmakokinetiikka
Imeytyminen
Granisetroni läpäisee ehjän ihon ja kulkeutuu systeemiseen verenkiertoon passiivisen diffuusioprosessin kautta. Sancuson kiinnittämisen jälkeen granisetronin imeytyminen on hidasta, ja suurimmat pitoisuudet saavutetaan 24 - 48 tunnin kuluessa.
Depotlaastariin sen poistamisen jälkeen jääneen sisällön määrän perusteella noin 65 % granisetronista tulee annostelluksi, mikä tarkoittaa keskimäärin 3,1 mg:n vuorokausiannosta.
Terveille tutkimushenkilöille annettiin boluksena laskimoon 0,01 mg/kg (korkeintaan 1 mg) kerta-annos granisetronia samanaikaisesti kun Sancuson depotlaastari kiinnitettiin. Granisetronin ensimmäinen huippupitoisuus plasmassa oli 10 minuutin kuluttua annostelusta, ja se aiheutui laskimoon annetusta granisetronista. Depotlaastarin tunnettu farmakokineettinen profiili käytön (7 vuorokauden) aikana ei muuttunut.
Kun terveille tutkimushenkilöille kiinnitettiin kaksi Sancuso-depotlaastaria peräjälkeen, kumpikin seitsemäksi päiväksi, granisetronitasot pysyivät ennallaan koko tutkimusjakson ajan ja kertymisen todettiin olevan vähäistä.
Tutkimuksessa, jossa tavoitteena oli arvioida terveillä tutkimushenkilöillä lämmön vaikutusta granisetronin Sancusosta ihon läpi kulkeutumiseen, kiinnitettiin lämpöä keskimäärin 42°C tuottava lämpöpakkaus depotlaastarin päälle 4 tunnin ajaksi jokaisena viitenä käyttöpäivänä. Vaikka vaikuttavan aineen kulkeutuminen depotlaastarista lisääntyi hieman ja ohimenevästi lämpöpakkauksen kiinnitysajankohtana, kokonaisaltistus granisetronille ei ollut suurempi kuin vertailuryhmässä.
Terveillä tutkimushenkilöillä tehdyssä farmakokineettisessä tutkimuksessa, jossa Sancuso kiinnitettiin 7 vuorokauden ajaksi, keskimääräinen kokonaisaltistuminen (AUC0-inf) oli 416 ng•h/ml (vaihteluväli 55 – 1192 ng•h/ml), henkilöiden välinen vaihtelu 89 %. Keskimääräinen Cmax oli 3,9 ng/ml (vaihteluväli 0,7 – 9,5 ng/ml), henkilöiden välinen vaihtelu 77 %. Tämä vaihtelu on samanlainen kuin tiedetään olevan suun kautta tai laskimoon annettavalla granisetronilla.
Jakaantuminen
Granisetronin keskimääräinen jakaantumistilavuus on noin 3 l/kg.
Plasman proteiiniin sitoutuu noin 65 %. Granisetroni jakaantuu vapaasti plasman ja punasolujen välillä.
Biotransformaatio
Suun kautta ja depotlaastarina annettavan granisetronin metabolisten profiilien välillä ei havaittu eroja.
Granisetroni tärkeimmät metaboliitit ovat 7-hydroksigranisetroni ja 9’N-desmetyyligranisetroni. In vitro –tutkimukset, joissa käytettiin ihmisen maksamikrosomeja, osoittavat CYP1A1-entsyymin olevan pääasiallisesti vastuussa granisetronin 7-hydroksilaatiosta, kun taas CYP3A4 myötävaikuttaa 9’-desmetylaatioon.
Eliminaatio
Granisetroni poistuu pääasiallisesti maksametabolian kautta. Laskimoon annostelun jälkeen plasman keskimääräinen puhdistuma oli 33,4 - 75,7 l/h terveillä tutkimushenkilöillä ja 14,7 - 33,6 l/h potilailla, potilaiden välinen vaihtelu oli suuri. Keskimääräinen puoliintumisaika plasmassa terveillä tutkimushenkilöillä on 4-6 tuntia, ja potilailla 9-12 tuntia. Depotlaastarin kiinnityksen jälkeen granisetronin näennäinen puoliintumisaika plasmassa piteni noin 36 tuntiin granisetronin ihon läpi imeytymisen hitauden vuoksi.
Sancusolla tehtyjen kliinisten tutkimusten perusteella puhdistuma syöpäpotilailla näytti olevan noin puolet terveiden tutkimushenkilöiden puhdistumasta.
Laskimoon injisoinnin jälkeen noin 12 % annoksesta erittyy terveillä tutkimushenkilöillä muuttumattomana virtsaan 48 tunnin kuluessa. Loput annoksesta erittyy metaboliitteina, 49 % virtsaan ja 34 % ulosteisiin.
Farmakokinetiikka erityisväestöllä
Sukupuolen vaikutusta Sancuson farmakokinetiikkaan ei ole erityisesti tutkittu. Mitään johdonmukaisia sukupuoleen liittyviä vaikutuksia farmakokinetiikkaan ei havaittu Sancusoon liittyvissä kliinisissä tutkimuksissa, joissa molemmilla sukupuolilla raportoitiin suurta yksilöiden välistä vaihtelua. Populaatiokineettisen mallintamisen perusteella sukupuoli ei vaikuta Sancuson farmakokinetiikkaan.
Iäkkäät
Kliinisessä tutkimuksessa ei todettu eroavuuksia Sancuson farmakokinetiikassa iäkkäiden miesten ja naisten (≥ 65 vuotta) ja nuorten tutkimushenkilöiden (iältään 18-45 vuotta) välillä.
Munuaisten tai maksan vajaatoiminta
Mitään erityisiä kliinisiä tutkimuksia ei ole tehty Sancuson farmakokinetiikan tutkimiseksi munuaisten tai maksan vajaatoimintaa sairastavilla potilailla. Mitään selvää munuaisten toiminnan (kreatiniinin puhdistumana mitattuna) ja granisetronin puhdistuman välistä suhdetta ei havaittu populaatiokineettisessä mallintamisessa. Munuaisten tai maksan vajaatoimintaa sairastavilla potilailla granisetronin farmakokinetiikka määritettiin granisetronihydrokloridin laskimoon annetun 40 μg/kg:n kerta-annoksen jälkeen.
Maksan vajaatoiminta
Maksakasvaimista johtuvaa maksan vajaatoimintaa sairastavilla potilailla plasman kokonaispuhdistuma oli noin puoliintunut verrattuna potilaisiin, joilla ei ollut maksan vajaatoimintaa. Granisetronin farmakokineettisten parametrien laajan vaihtelun ja pitkälti yli suositellun annoksen ulottuvan hyvän siedettävyyden vuoksi annosta ei tarvitse muuttaa toiminnallista maksan vajaatoimintaa sairastaville potilaille.
Munuaisten vajaatoiminta
Syöpäpotilailla ei havaittu korrelaatiota kreatiniinin puhdistuman ja kokonaispuhdistuman välillä. Tämä viittaa siihen, että munuaisten vajaatoiminta ei vaikuta granisetronin farmakokinetiikkaan.
Painoindeksi (Body Mass Index, BMI)
Kliinisessä tutkimuksessa, jossa tavoitteena oli arvioida Sancuson aiheuttamaa granisetronialtistumista tutkimushenkilöillä, joiden kehon rasvamäärä vaihteli, käytettiin painoindeksiä kehon rasvamäärää korvaavana muuttujana. Tutkimuksessa ei todettu eroja Sancuson farmakokinetiikassa miespuolisilla ja naispuolisilla tutkimushenkilöillä, joiden painoindeksi oli alhainen [<19,5 kg/m2 (miehet), <18,5 kg/m2 (naiset)] ja joiden painoindeksi oli korkea (30,0 – 39,9 kg/m2 ) verrokkiryhmään (BMI 20,0 – 24,9 kg/m2) verrattuna.
Pediatriset potilaat
Alle 18‑vuotiaista potilaista on vain vähän tietoja saatavilla. Tutkimuksia ei ole tehty SANCUSOn farmakokinetiikan arvioimiseksi alle 13‑vuotiailla pediatrisilla potilailla.
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta, geenitoksisuutta, karsinogeenisuutta sekä lisääntymistoksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille. Karsinogeenisuutta koskevat tutkimukset eivät osoittaneet erityistä vaaraa ihmiselle suositeltuja annoksia käytettäessä. Jos siis käytetään suurempia annoksia ja käyttö pitkittyy, karsinogeenisuusriskiä ei voida sulkea pois, mutta ihon läpi kulkeutumista varten suositeltua lyhyttä käyttöaikaa noudattaen karsinogeeninen riski ihmiselle ei ole odotettavissa.
Eläinkokeissa ei ole havaittu suoria tai epäsuoria lisääntymistoksisia vaikutuksia. Näissä tutkimuksissa granisetronin ei havaittu aiheuttavan hedelmällisyyden heikentymistä tai sikiöön kohdistuvia haittoja.
Granisetronihoito ei vaikuttanut rottien hedelmällisyyteen.
Sancuso-depotlaastarit eivät osoittaneet valoärsytyksen tai valoherkkyyden riskiä kun sitä testattiin in vivo marsuilla. Granisetroni ei ollut fototoksinen, kun sitä testattiin in vitro hiiren fibroblastisolulinjassa. Kun granisetronia testattiin mahdollisen fotogenotoksisuuden varalta in vitro kiinalaisen hamsterin munasarjan (CHO) solulinjassa, granisetroni lisäsi kromosomivaurioituneiden solujen prosentuaalista määrää valosäteilyttämisen jälkeen. Vaikka tämän löydöksen kliininen merkitys ei ole täysin selvä, potilaita tulee neuvoa peittämään depotlaastarin kiinnitysalue, jos on olemassa auringonvalolle altistumisen riski käytön ajan sekä 10 päivän ajan laastarin poistamisen jälkeen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Kun ihon herkistymismahdollisuutta testattiin marsuilla, Sancuso osoitti pientä ärsytysmahdollisuutta.
Ihmisen kloonatuilla ionikanavilla tehty tutkimus on osoittanut, että granisetroni voi vaikuttaa sydämen repolarisaatioon salpaamalla hERG-kaliumkanavia. Granisetronin on osoitettu salpaavan sekä natrium- että kaliumkanavia, mikä voi vaikuttaa sekä depolarisaatioon että repolarisaatioon, ja siten PR-, QRS- ja QT-aikaan. Nämä tutkimustiedot auttavat selvittämään molekyylitason mekanismeja, jotka aiheuttavat osan tähän lääkeryhmään kuuluvien aineiden käyttöön liittyvistä EKG-muutoksista (etenkin QT- ja QRS-ajan pidentyminen). Mitään kliinisesti merkityksellisiä EKG-muutoksia ei kuitenkaan ole havaittu Sancusoon liittyvissä kliinisissä tutkimuksissa, mukaan lukien 240 terveellä tutkimushenkilöllä tehty perusteellinen QT-tutkimus (kohta Farmakodynamiikka).
Farmaseuttiset tiedot
Apuaineet
Taustakerros
Polyesteri
Matriksikerros
Akrylaattivinyyliasetaatti-kopolymeeri
Kiinnityspuolen suojakalvo
Silikonisoitu polyesteri
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta
Säilytys
Säilytä alkuperäisessä pakkauksessa. Herkkä valolle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
SANCUSO depotlaastari
3,1 mg/24 h (L:ei) 1 kpl (96,38 €)
PF-selosteen tieto
Jokainen depotlaastari on pakattu lämpösuljettuun pussiin, joka on valmistettu polyesteripäällysteisestä paperi/alumiini/LLDPE:stä.
Jokainen rasia sisältää 1 depotlaastarin.
Valmisteen kuvaus:
Ohut, läpikuultava, matriksityyppinen, suorakaiteen muotoinen depotlaastari, jossa on pyöristetyt kulmat.
Käyttö- ja käsittelyohjeet
Depotlaastari sisältää vaikuttavaa ainetta vielä käytön jälkeen. Poistamisen jälkeen käytetty depotlaastari tulee taittaa tiukasti keskeltä siten, että kiinnityspuoli jää väliin sisäpuolelle, ja hävittää sitten niin, että se on poissa lasten ulottuvilta.
Korvattavuus
SANCUSO depotlaastari
3,1 mg/24 h 1 kpl
- Rajoitettu peruskorvaus reseptimerkinnällä (40 %). Merkintä lääkemääräyksen 'Perustelut'-kohdassa: Nielemisvaikeudet (E011).
ATC-koodi
A04AA02
Valmisteyhteenvedon muuttamispäivämäärä
09.02.2023
Yhteystiedot
Arne Jacobsens Allé 7
2300 København S
Denmark
