APOGO PEN injektioneste, liuos 10 mg/ml
Vaikuttavat aineet ja niiden määrät
Yksi millilitra sisältää 10 mg apomorfiinihydrokloridia
Yksi 3 ml:n PEN-sylinteriampulli sisältää 30 mg apomorfiinihydrokloridia.
Apuaine, jonka vaikutus tunnetaan
natriumbisulfiitti 0,93 mg/ml
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, liuos.
Kliiniset tiedot
Käyttöaiheet
Parkinsonin tautia sairastavien potilaiden motoristen tilanvaihteluiden (’on-off’ -ilmiön) hoitoon, joita ei saada riittävästi hallintaan suun kautta otettavien parkinsonlääkkeiden avulla.
Ehto
Hoito tulee aloittaa ja sitä tulee seurata Parkinsonin tautiin perehtyneen erikoislääkärin valvonnassa.
Annostus ja antotapa
Apogo-pistoksiin soveltuvien potilaiden valinta:
Apogo-hoitoon valittavien potilaiden tulisi pystyä tunnistamaan ’off’-vaiheen alkamiseen liittyvät oireet ja antamaan itselleen pistoksia tai heillä tulisi olla hoidosta vastuun kantava hoitaja, joka pystyy tarvittaessa pistämään lääkkeen potilaan puolesta.
Apomorfiinilla hoidettavien potilaiden on yleensä aloitettava domperidonin käyttö vähintään kaksi päivää ennen hoidon alkua. Domperidoniannos on titrattava pienimpään vaikuttavaan annokseen ja anto on lopetettava mahdollisimman pian. Ennen kuin domperidoni- ja apomorfiinihoidon aloittamisesta päätetään, QT-ajan pitenemisen riskitekijät yksittäiselle potilaalle on arvioitava tarkoin, jotta varmistetaan, että hyöty on haittaa suurempi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Apomorfiinihoito on aloitettava erikoissairaanhoidon valvotuissa olosuhteissa. Parkinsonin taudin hoitoon erikoistuneen lääkärin, esim. neurologin, pitää seurata potilasta. Ennen Apogo-hoidon aloittamista potilaan levodopahoito, joko dopamiiniagonistien kanssa tai ilman niitä, on optimoitava.
Annostus
Kynnysannoksen määrittäminen
Sopiva annos määritetään yksilöllisesti lisäämällä annosta vähitellen. Ehdotus menettelytavaksi:
1 mg apomorfiinihydrokloridia (0,1 ml), noin 15–20 mikrog/kg, voidaan pistää ihon alle hypokinesia- tai ’off’- jakson aikana, minkä jälkeen potilaan motorista vastetta seurataan 30 minuutin ajan.
Jos vastetta ei havaita tai se on riittämätön, pistetään 2 mg apomorfiinihydrokloridia (0,2 ml) ihon alle, ja potilaan vastetta seurataan vielä 30 minuuttia.
Annosta voidaan lisätä antamalla lisäpistoksia siten, että niiden välille jää vähintään 40 minuuttia, kunnes saadaan tyydyttävä motorinen vaste.
Hoidon vakiinnuttaminen
Sen jälkeen kun sopiva annos on määritetty, ’off’-vaiheen ensimerkkien ilmaantuessa voidaan antaa yksi ihonalainen injektio alavatsaan tai reiden ulkosyrjään. On mahdollista, että imeytyminen vaihtelee eri pistokohdissa samalla henkilöllä. Vastaavasti potilasta tulee tarkkailla pistoksen jälkeen tunnin ajan hoitovasteen arvioimiseksi. Annosta voidaan muuttaa potilaan vasteen mukaisesti.
Apomorfiinihydrokloridin optimiannos vaihtelee yksilöllisesti, mutta hoidon vakiinnuttua se pysyy suhteellisen samana.
Hoidon jatkamiseen liittyvät varotoimet
Päivittäinen Apogo-annos vaihtelee eri potilailla, tyypillisesti se on 3 – 30 mg annettuna 1 – 10 pistoksena, joskus jopa 12 erillisenä injektiona päivässä.
Apomorfiinihydrokloridin päivittäinen kokonaisannos ei saa ylittää 100 mg eikä yksittäinen bolusinjektio 10 mg.
Kliinisissä tutkimuksissa on yleensä ollut mahdollista vähentää levodopan annosta hieman. Tämän muutoksen vaikutus vaihtelee huomattavasti eri potilailla ja vaatii kokeneen lääkärin huolellista hoitoa.
Hoidon vakiinnuttua domperidonihoitoa voidaan vähitellen vähentää joillakin potilailla, mutta vain harvoilta se jää kokonaan pois oksentelun tai hypotension lisääntymättä.
Pediatriset potilaat
Apogo PEN 10 mg/ml injektioneste -valmisteen käyttö on vasta-aiheista lapsille ja alle 18-vuotiaille nuorille (ks. kohta Vasta-aiheet).
Iäkkäät
Parkinson-potilaiden väestössä on runsaasti iäkkäitä, ja heitä on osallistunut runsaasti myös Apogo-valmisteen kliinisiin tutkimuksiin. Apogo-valmisteella hoidettujen iäkkäiden potilaiden hoito ei ole poikennut nuorempien potilaiden hoidosta. Asentohypotension riskin vuoksi hoidon alussa on kuitenkin suositeltavaa noudattaa erityistä varovaisuutta.
Munuaisten vajaatoiminta
Munuaisten vajaatoimintaa sairastaville potilaille voidaan soveltaa samaa annostusta kuin aikuisille ja iäkkäille (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet,).
Antotapa
Apogo PEN 10 mg/ml injektioneste annetaan ihon alle toistuvina bolusinjektioina.
Apomorfiinia ei saa antaa laskimoon.
Älä käytä, jos liuoksen väri on muuttunut vihreäksi. Liuos on tarkistettava silmämääräisesti ennen käyttöä. Liuosta saa käyttää vain, jos se on kirkasta ja väritöntä eikä siinä ole näkyviä hiukkasia.
Vasta-aiheet
Hengityslamaa, dementiaa, psykoottisia sairauksia tai maksan vajaatoimintaa sairastavat potilaat.
Apomorfiinihydrokloridihoitoa ei saa antaa potilaille, joilla on ’on’-vaste levodopalle, jota pahentaa vaikea dyskinesia tai dystonia.
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille. Apogo-valmistetta ei saa antaa potilaille, joilla on tunnettu yliherkkyys apomorfiinille tai valmisteen apuaineille.
Samanaikainen käyttö ondansetronin kanssa (katso kohta Yhteisvaikutukset).
Apogo on vasta-aiheinen lapsille ja alle 18-vuotiaille nuorille.
Varoitukset ja käyttöön liittyvät varotoimet
Apomorfiinihydrokloridia on annettava varoen potilaille, joilla on munuais-, keuhko- tai sydän-/verisuonisairaus ja potilaille, jotka voivat helposti pahoin ja oksentavat.
Erityistä varovaisuutta on noudatettava aloitettaessa hoitoa iäkkäille ja/tai debilitoituneille potilaille.
Apomorfiini voi aiheuttaa hypotensiota, vaikka se annettaisiin samanaikaisesti domperidoni-esilääkityksen kanssa. Siksi sen käytössä on noudatettava varovaisuutta potilailla, joilla on jokin aiempi sydänsairaus tai jotka käyttävät vasoaktiivisia lääkkeitä (kuten verenpainelääkkeitä) ja etenkin niillä, joilla on esiintynyt asentohypotensiota.
Apomorfiini voi etenkin suurempina annoksina pidentää QT-aikaa. Siksi sitä on annettava varoen potilaille, joilla on kääntyvien kärkien kammiotakykardian riski.
Kun sitä käytetään yhdessä domperidonin kanssa, yksittäisen potilaan riskitekijät on arvioitava tarkoin. Tämä on tehtävä ennen hoidon aloittamista ja hoidon aikana. Tärkeisiin riskitekijöihin kuuluvat vakavat taustalla olevat sydänsairaudet, kuten sydämen kongestiivinen vajaatoiminta, vaikea maksan vajaatoiminta tai merkittävä elektrolyyttihäiriö. Myös elektrolyyttitasapainoon, CYP3A4-välitteiseen metaboliaan tai QT-aikaan mahdollisesti vaikuttava lääkitys on arvioitava. QTc-aikaan kohdistuvan vaikutuksen seuranta on suositeltavaa. EKG on otettava:
- ennen domperidonihoitoa
- hoidon aloitusvaiheen aikana
- tämän jälkeen silloin, kun se on kliinisesti indisoitua.
Potilaita on neuvottava ilmoittamaan mahdollisista sydänoireista, kuten sydämentykytyksistä, pyörtymisestä tai presynkopeestä. Heidän tulee ilmoittaa myös kliinisistä muutoksista, jotka voivat johtaa hypokalemiaan, kuten maha-suolitulehduksesta tai diureettilääkityksen aloittamisesta.
Riskitekijät on arvioitava uudelleen jokaisella hoitokäynnillä.
Apomorfiiniin liittyy paikallisia ihonalaisia vaikutuksia. Niitä voidaan toisinaan vähentää vaihtelemalla pistoskohtaa tai mahdollisesti käyttämällä ultraääntä (mikäli käytettävissä), jotta paukamat ja kovettumat voitaisiin välttää.
Apomorfiinilla hoidetuilla potilailla on raportoitu hemolyyttistä anemiaa ja trombosytopeniaa. Verikokeita on otettava säännöllisesti kuten levodopahoidossa, kun sitä annetaan samanaikaisesti apomorfiinin kanssa.
Apomorfiinia on käytettävä varoen muiden lääkevalmisteiden kanssa, erityisesti sellaisten, joiden terapeuttinen alue on kapea (ks. kohta Yhteisvaikutukset).
Pitkälle edenneessä Parkinsonin taudissa neuropsykiatriset ongelmat ovat yleisiä. Joidenkin tutkimustietojen mukaan apomorfiini saattaa pahentaa neuropsykiatrisia häiriöitä joillakin potilailla.
Näille potilaille apomorfiinia on annettava erityistä varovaisuutta noudattaen.
Apomorfiinin käyttöön on liittynyt uneliaisuutta ja äkillistä nukahtamista, etenkin Parkinsonin tautia sairastavilla. Potilaille on kerrottava tästä ja kehotettava heitä varovaisuuteen autoa ajettaessa ja koneita käytettäessä apomorfiinihoidon aikana. Potilaat, joilla ilmenee uneliaisuutta ja/tai äkillistä nukahtelua, eivät saa ajaa autoa eivätkä käyttää koneita. Lisäksi voidaan harkita annoksen pienentämistä tai hoidon lopettamista.
Impulssikontrollin häiriöt
Potilaita pitää seurata säännöllisesti impulssikontrollin häiriöiden kehittymisen varalta. Potilaiden ja heidän hoitajiensa on hyvä tietää, että impulssikontrollin häiriöihin liittyviä käytösoireita (kuten pelihimo, lisääntynyt libido, hyperseksuaalisuus, pakonomainen tuhlaaminen tai ostelu, ahmiminen ja pakonomainen syöminen) voi esiintyä potilailla, jotka ovat käyttäneet dopamiiniagonistia, mukaan lukien apomorfiinia. Annoksen pienentämistä tai lääkityksen asteittaista lopettamista pitää harkita, jos tällaisia oireita esiintyy.
Dopamiinin säätelyhäiriö -oireyhtymä (DDS) on addiktiivinen häiriö, joka johtaa lääkkeen liialliseen käyttöön joillakin apomorfiinihoitoa saavilla potilailla. Ennen kuin hoito aloitetaan, potilaita ja heidän hoitajiaan pitää varoittaa DDS:n kehittymisen mahdollisesta riskistä.
Apogo PEN 10 mg/ml injektioneste sisältää natriumbisulfiittia, joka voi harvoissa tapauksissa aiheuttaa vakavan allergisen reaktion tai bronkospasmin.
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per 10 ml liuosta eli se on käytännössä natriumiton.
Yhteisvaikutukset
Apomorfiinihydrokloridihoitoon valitut Parkinson-potilaat käyttävät lähes varmuudella samanaikaisesti muita lääkkeitä. Apomorfiinihydrokloridihoidon alkuvaiheessa potilasta tulisi tarkkailla epätavallisten haittavaikutusten tai tehon voimistumisen merkkien varalta.
Neurolepteillä voi olla antagonistinen vaikutus yhteiskäytössä apomorfiinin kanssa. Klotsapiinin ja apomorfiinin välillä on potentiaalinen yhteisvaikutus, joskin klotsapiinia voidaan myös käyttää neuropsykiatristen komplikaatioiden vähentämiseen.
Apomorfiinin samanaikainen käyttö ondansetronin kanssa voi johtaa vakavaan hypotensioon ja tajunnan menetykseen, ja on siten vasta-aiheista (katso kohta Vasta-aiheet). Vastaavia vaikutuksia saattaa ilmetä myös muiden 5-HT3-antagonistien kanssa.
Apomorfiinin mahdollista vaikutusta muiden lääkevalmisteiden plasmapitoisuuksiin ei ole tutkittu. Apomorfiinia on käytettävä varoen muiden lääkevalmisteiden kanssa, erityisesti sellaisten, joiden terapeuttinen alue on kapea.
Verenpaineeseen ja sydämen toimintaan vaikuttavat lääkkeet
Vaikka apomorfiinia annettaisiin samanaikaisesti domperidonin kanssa, se voi voimistaa näiden lääkevalmisteiden verenpainetta laskevia vaikutuksia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Apomorfiinin samanaikaista antoa QT-aikaa pidentävien lääkkeiden kanssa on vältettävä.
Raskaus ja imetys
Raskaus
Apomorfiinin käytöstä raskaana oleville naisille ei ole tietoja.
Lisääntymistutkimukset eläimillä eivät viittaa teratogeenisiin vaikutuksiin, mutta rottaemolle myrkylliset annokset voivat aiheuttaa vastasyntyneiden poikasten kyvyttömyyttä alkaa hengittää. Mahdollista riskiä ihmiselle ei tunneta. Ks. kohta Prekliiniset tiedot turvallisuudesta.
Apogo-valmistetta ei saa käyttää raskauden aikana, ellei se ole aivan välttämätöntä.
Imetys
Ei tiedetä, erittyykö apomorfiini äidinmaitoon. Harkittaessa imetyksen jatkamista/lopettamista tai Apogo-hoidon jatkamista/lopettamista on otettava huomioon rintaruokinnasta aiheutuvat hyödyt lapselle ja Apogo-hoidosta koituvat hyödyt äidille.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Apomorfiinihydrokloridilla on vähäinen tai kohtalainen vaikutus ajokykyyn ja koneidenkäyttökykyyn.
Apomorfiinilla hoidettavia ja uneliaisuudesta ja/tai äkillisestä nukahtelusta kärsiviä potilaita on kehotettava välttämään ajamista tai muita toimia (esim. koneiden käyttöä), joissa heikentynyt reaktiokyky saattaa altistaa heidät tai toiset ihmiset vakavalle vaaralle tai jopa kuolemalle, kunnes toistuvaa nukahtelua ja uneliaisuutta ei enää esiinny (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Haittavaikutukset
Hyvin yleinen (≥ 1/10)
Yleinen (≥ 1/100, < 1/10)
Melko harvinainen (≥ 1/1 000, < 1/100)
Harvinainen (≥ 1/10 000, < 1/1 000)
Hyvin harvinainen (< 1/10 000)
Tuntematon (koska saatavilla oleva tieto ei riitä esiintyvyyden arviointiin)
Veri ja imukudos
Melko harvinainen:
Apomorfiinilla hoidetuilla potilailla on raportoitu hemolyyttistä anemiaa ja trombosytopeniaa.
Harvinainen:
Eosinofiliaa on ilmennyt harvoissa tapauksissa apomorfiinihydrokloridihoidon aikana.
Immuunijärjestelmä
Harvinainen:
Natriumbisulfiitin takia saattaa esiintyä allergisia reaktioita (myös anafylaksiaa ja bronkospasmia).
Psyykkiset häiriöt
Hyvin yleinen:
Hallusinaatiot
Yleinen:
Neuropsykiatrisia häiriöitä (kuten ohimenevää lievää sekavuutta tai näköhallusinaatioita) on esiintynyt apomorfiinihydrokloridihoidon aikana.
Tuntematon:
Impulssikontrollin häiriöt: Pelihimoa, lisääntynyttä sukupuolista halua, hyperseksuaalisuutta, pakonomaista tuhlaamista tai ostelua, ahmimista ja pakonomaista syömistä, voi esiintyä potilailla, jotka ovat käyttäneet dopamiiniagonisteja, mukaan lukien apomorfiinia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Aggressio, agitaatio
Hermosto
Yleinen:
Hoidon alussa saattaa jokaisen apomorfiinihydrokloridiannoksen yhteydessä esiintyä ohimenevää sedaatiota. Tilanne korjaantuu yleensä muutaman ensimmäisen viikon aikana.
Apomorfiinin käyttöön liittyy uneliaisuutta.
Heitehuimausta ja pyörrytystä on myös raportoitu.
Melko harvinainen:
Apomorfiini saattaa aiheuttaa dyskinesiaa ’on’-vaiheiden aikana. Se voi joissain tapauksissa olla voimakasta, ja joillakin potilailla hoito on sen takia lopetettava.
Apomorfiinin käyttöön on liittynyt äkillistä nukahtelua. (Ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Tuntematon:
Pyörtyminen
Päänsärky
Verisuonisto
Melko harvinainen:
Asentohypotensiota esiintyy harvoin ja se on yleensä ohimenevää (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Hengityselimet, rintakehä ja välikarsina
Yleinen:
Haukottelua on raportoitu apomorfiinihoidon aikana.
Melko harvinainen:
Hengitysvaikeuksia on raportoitu.
Ruoansulatuselimistö
Yleinen:
Pahoinvointi ja oksentelu, joita esiintyy erityisesti apomorfiinihoitoa aloitettaessa, johtuvat yleensä domperidonin lopettamisesta (ks. kohta Annostus ja antotapa).
Iho ja ihonalainen kudos
Melko harvinainen:
Paikallisia ja yleistyneitä ihottumia on raportoitu.
Yleisoireet ja antopaikassa todettavat haitat
Hyvin yleinen:
Useimmilla potilailla ilmenee pistoskohdan reaktioita, etenkin jatkuvassa käytössä. Näitä ovat mm. ihonalaiset paukamat, kovettumat, eryteema, arkuus ja pannikuliitti. Muitakin paikallisia reaktioita (kuten ärsytystä, kutinaa, mustelmia ja kipua) saattaa esiintyä.
Melko harvinainen:
Pistoskohdan nekroosia ja haavaumia on raportoitu.
Tuntematon:
Perifeeristä turvotusta on raportoitu.
Tutkimukset
Melko harvinainen:
Apomorfiinia saavilla potilailla on raportoitu positiivisia Coombsin testejä.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Apomorfiinin yliannostuksesta on vain vähän kliinistä tietoa tämän antoreitin osalta. Yliannostusoireita voidaan hoitaa empiirisesti alla ehdotetun mukaisesti.
- Voimakasta pahoinvointia voidaan hoitaa domperidonilla.
- Hengityslamaa voidaan hoitaa naloksonilla.
- Hypotensio: lievitys asianmukaisin keinoin, esim. kohottamalla sängyn jalkopäätä.
- Bradykardiaa voidaan hoitaa atropiinilla.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Dopamiiniagonistit, ATC-koodi: N04B C07
Apomorfiini stimuloi suoraan dopamiinireseptoreita ja koska sillä on sekä D1- että D2-reseptoriagonistin ominaisuuksia, se ei kulkeudu eikä hajoa samaa reittiä kuin levodopa.
Vaikka kajoamattomilla koe-eläimillä apomorfiinin anto vaimentaa nigrostriataalisten solujen laukaisutiheyttä ja matalina annoksina havaintojen mukaan aiheuttaa lokomotorisen aktiivisuuden heikkenemistä (johtunee endogeenisen dopamiinin vapautumisen presynaptisesta inhibitiosta), apomorfiinin vaikutus Parkinsonin tautiin liittyvään liikuntakyvyttömyyteen välittyy todennäköisesti postsynaptisissa reseptoreissa. Tätä kaksivaiheista vaikutusta on havaittu myös ihmisillä.
Farmakokinetiikka
Jakautuminen ja eliminaatio
Ihonalaisen injektion jälkeen apomorfiini jakautuu kaksitilamallin mukaisesti; sen jakautumisen puoliintumisaika on 5 ( + 1,1) minuuttia ja eliminaation puoliintumisaika 33 ( + 3,9) minuuttia. Kliininen vaste korreloi hyvin aivo-selkäydinnesteen apomorfiinipitoisuuden kanssa ja lääkeaineen jakautumista voidaan parhaiten kuvata kaksitilamallilla.
Imeytyminen
Apomorfiini absorboituu nopeasti ja täydellisesti ihonalaisesta kudoksesta, mikä korreloi kliinisten vaikutusten nopean alkamisen kanssa (4-12 minuuttia) ja lääkkeen vaikutuksen lyhyen keston kanssa (noin 1 tunti), mikä johtuu lääkeaineen nopeasta puhdistumasta. Apomorfiini hajoaa kymmenesosaan glukuronidaatiossa ja sulfonaatiossa; muita hajoamisreittejä ei ole kuvattu.
Prekliiniset tiedot turvallisuudesta
Ihonalaisten toistuvien annosten toksisuustutkimukset eivät osoita erityistä vaaraa ihmisille sen lisäksi, mitä on ilmoitettu valmisteyhteenvedon muissa kohdissa.
In vitro -genotoksisuustutkimuksissa osoitettiin mutageenisia ja klastogeenisia vaikutuksia, jotka todennäköisimmin johtuvat apomorfiinin oksidaatiotuotteista. In vivo -tutkimuksissa apomorfiini ei kuitenkaan ollut genotoksinen.
Apomorfiinin vaikutusta lisääntymiseen on tutkittu rotilla. Apomorfiini ei ollut tällä lajilla teratogeeninen, mutta huomattiin, että emolle myrkyllinen annos voi aiheuttaa poikasista huolehtimisen puutetta ja poikasten kyvyttömyyttä alkaa hengittää.
Karsinogeenisuustutkimuksia ei ole tehty.
Ympäristöön kohdistuvien riskien arviointi
Apomorfiinihydrokloridi on lääkinnälliseen käyttöön vakiintunut vaikuttava aine ja Apogo-valmisteita on ollut myynnissä 10 vuoden ajan. Päätelmämme on, ettei ympäristöön kohdistuvien riskien arviointi
ole tarpeen tämän vaikuttavan aineen kohdalla.
Farmaseuttiset tiedot
Apuaineet
Natriumbisulfiitti (E222)
Kloorivetyhappo (37 %), väkevä (pH:n säätöön)
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Koska yhteensopimattomuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
2 vuotta.
Ensimmäisen avaamiskerran jälkeen 48 tuntia.
Säilytys
Säilytä alle 25 º °C.
Pidä säiliö ulkopakkauksessa. Herkkä valolle.
Tuotetta pitää säilyttää samoissa olosuhteissa avaamisen jälkeen ja käyttökertojen välillä.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
APOGO PEN injektioneste, liuos
10 mg/ml (L:ei) 5 x 3 ml (kertakäyttöinen moniannoksinen injektiokynä) (186,61 €)
PF-selosteen tieto
Sylinteriampulli.
Apogo PEN on kertakäyttöinen moniannoksinen injektiokynä, jossa kirkas injektioneste on kirkkaassa (tyypin I) lasisäiliössä. Lasisäiliö on sinetöity toisesta päästä bromobutyylikumimännällä ja toisesta päästä bromobutyylikumi/alumiinikalvolla.
Yksi kynä sisältää 3 ml injektionestettä.
Pakkauksen sisältö: Pahvikotelo, jossa on 1, 5 tai 10 kynää à 3 ml valetulla muovialustalla.
25 kynän monipakkaus (viisi 5 kynän pakkausta).
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Liuos on kirkas ja käytännössä väritön ja hajuton eikä siinä ole näkyviä hiukkasia.
pH = 2,5 – 4,0
Käyttö- ja käsittelyohjeet
Apogo PEN
Älä käytä, jos liuos on muuttunut vihreäksi.
Hävitä jokainen kynä 48 tunnin kuluttua ensimmäisestä käyttökerrasta.
(ks. oheinen kaavio)
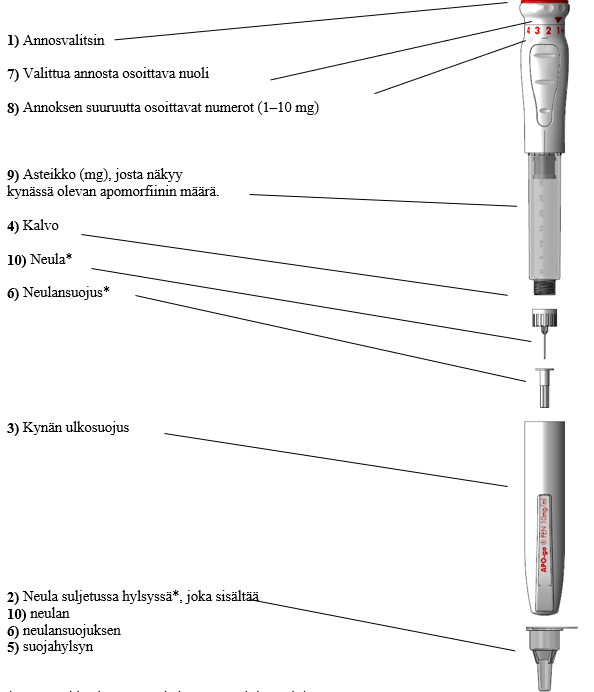
* Tässä pakkauksessa EI ole kynään sopivia neuloja.
Käytä enintään 12,7 mm:n pituisia ja vähintään 30 G paksuisia neuloja. Apogo PEN ‑kynässä voidaan käyttää myös insuliinikynään sopivia neuloja.
TÄRKEÄÄ: Älä vedä punaista annosvalitsinta (ks. 1) ennen kuin olet säätänyt annoksen (ks. kohta ”Oikean annoksen valinta”)
Neulan kiinnittäminen
(a)Ennen Apogo PEN ‑kynän käyttöä tarvitset desinfiointipyyhkeitä ja yhden neulan suojahylsyssään (ks.2).
(b) Ota kynä kotelostaan ja poista uloin suojus (ks. 3).

(c) Pyyhi kynän kalvo (ks. 4) desinfiointipyyhkeellä.
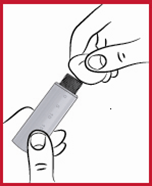
(d) Repäise paperi pois neulan suojahylsyn päältä (ks.2).
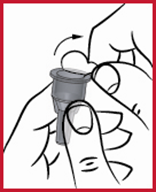
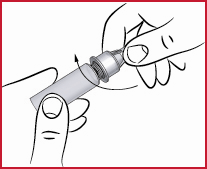
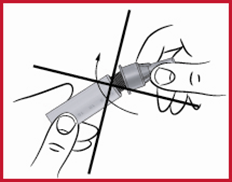
(e) Neula on kiinnitettävä kynään kohtisuoraan yllä olevan kuvan mukaisesti. Jos neula viedään paikalleen vinottain, kynä saattaa vuotaa.
(f) Kierrä hylsy (ks.2) myötäpäivään tiukasti kalvon päälle. Nyt myös neula on tiukasti kiinni.
(g) Poista suojahylsy (ks. 5), mutta älä heitä sitä pois. Älä poista neulansuojusta (ks. 6) vielä.
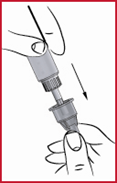
(h) Aseta kynän ulkosuojus (ks. 3) takaisin paikalleen.
Oikean annoksen valinta
(i) Paina punaista annosvalitsinta (ks. 1) ja käännä sitä samalla myötäpäivään kunnes nuoli osoittaa lääkärin sinulle määräämää annosta (ks. 7, 8) Vapauta valitsin. Annos on nyt valittu eikä sinun enää tarvitse valita sitä uudelleen seuraavilla pistokerroilla.
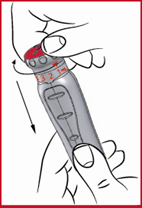
Tärkeää: jos ohitat määrätyn annoksen valitsinta kääntäessäsi, jatka painamista ja kääntämistä samaan suuntaan, kunnes nuoli osoittaa lääkärin sinulle määräämää annosta. Älä koskaan sekä vedä että käännä punaista annosvalitsinta samanaikaisesti.
Jos annos on 1 mg, aloita tyhjentämällä 1 mg:n annos talouspaperille ja heitä se pois. Tätä kutsutaan esitäytöksi ja se on tärkeä, koska näin saat varmasti täyden annoksen, kun käytät kynää ensimmäisen kerran. Säädä sitten tarvitsemasi annos pistosta varten ja pistä tavalliseen tapaan ( ks. kohta ”Pistäminen”). Jos ensimmäinen tarvittu annos on yli 1 mg, esitäyttöä ei tarvita.
Pistäminen
(j) Kun olet valinnut annoksen, vedä varovasti punainen annosvalitsin niin pitkälle kuin se menee. Tarkista männässä (ks. 9) olevapunainen asteikko ja pistä vain, jos viiva, joka on juuri näkyvissä, vastaa haluttua annosta.
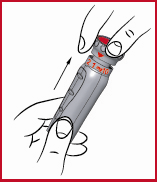

(k) Puhdista pistoskohta ja sen ympärys desinfiointipyyhkeellä.
(l) Poista kynän ulkosuojus (ks. 3).
(m) Poista neulansuojus (ks. 6).
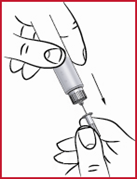
(n) Vie neula (ks. 10) ihoon lääkärin näyttämällä tavalla.
(o) Anna pistos painamalla punaista annosvalitsinta (ks. 1) niin pitkälle kuin sen menee. Käytä painamiseen mieluiten peukaloa. Kun punainen annosvalitsin on painettu täysin pohjaan, laske kolmeen ennen kuin vedät neulan pois.
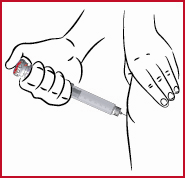
(p) Laita suojahylsy (ks. 5) takaisin käytetyn neulan päälle ja paina se kevyesti paikalleen. Kun se on tiiviisti paikallaan, kierrä neula irti vastapäivään.
Pidä neula suojahylsyssään ja hävitä se sopivaan paikkaan, esim. neulankeruuastiaan tai tyhjään kahvipurkkiin.
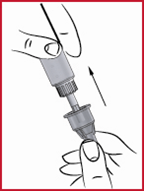
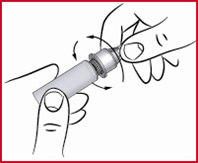
Seuraavan pistoksen valmistelutoimet
(q) Poista kynän ulkosuojus ja tarkista, onko säiliössä riittävästi apomorfiinia seuraavaa pistosta varten. Jos on, aseta uusi neula paikalleen edellä kuvatulla tavalla.
(r) Jos apomorfiinia ei ole tarpeeksi, valmistele toinen kynä käyttöä varten.
(s) Aseta lopuksi kynän ulkosuojus takaisin paikalleen.

Korvattavuus
APOGO PEN injektioneste, liuos
10 mg/ml 5 x 3 ml
- Ylempi erityiskorvaus (100 %). Parkinsonin tauti ja siihen verrattavat liikehäiriöt (110).
- Peruskorvaus (40 %).
ATC-koodi
N04BC07
Valmisteyhteenvedon muuttamispäivämäärä
26.09.2023
Yhteystiedot
PL 1310, Puolikkotie 8, 02230 Espoo (käyntiosoite)
00101 Helsinki
0207 416 888
