GAZYVARO infuusiokonsentraatti, liuosta varten 1000 mg
Vaikuttavat aineet ja niiden määrät
Yksi 40 ml:n injektiopullo konsentraattia sisältää 1 000 mg obinututsumabia, mikä vastaa ennen laimentamista pitoisuutta 25 mg/ml.
Obinututsumabi on tyypin II humanisoitu monoklonaalinen IgG1-alaryhmän anti-CD20-vasta-aine, joka valmistetaan humanisoimalla parentaalinen hiiren B-Ly1-vasta-aine ja tuotetaan yhdistelmä-DNA-tekniikalla kiinanhamsterin munasolulinjassa.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Infuusiokonsentraatti, liuosta varten.
Kliiniset tiedot
Käyttöaiheet
Krooninen lymfaattinen leukemia (KLL)
Gazyvaro on yhdistelmänä klorambusiilin kanssa tarkoitettu aikuisille aiemmin hoitamattoman kroonisen lymfaattisen leukemian hoitoon, kun potilaalla on muita samanaikaisia sairauksia, minkä vuoksi fludarabiinipohjainen hoito täysinä annoksina ei sovi potilaalle (ks. kohta Farmakodynamiikka).
Follikulaarinen lymfooma (FL)
Gazyvaro on yhdistelmänä solunsalpaajahoidon kanssa ja sen jälkeen vasteen saaneille potilaille annettavana ylläpitohoitona tarkoitettu aiemmin hoitamattoman edenneen follikulaarisen lymfooman hoitoon (ks. kohta Farmakodynamiikka).
Gazyvaro on yhdistelmänä bendamustiinin kanssa ja sen jälkeen annettava Gazyvaro-ylläpitohoito tarkoitettu follikulaarisen lymfooman hoitoon, kun potilas ei ole saanut vastetta rituksimabihoitoon tai rituksimabia sisältäneeseen yhdistelmähoitoon tai jos potilaan tauti on edennyt tällaisen hoidon aikana tai 6 kuukauden aikana tällaisen hoidon jälkeen.
Lupusnefriitti (LN)
Gazyvaro on yhdistelmänä mykofenolaattimofetiilin kanssa tarkoitettu aikuisille aktiivisen luokan III tai IV ja mahdollisen samanaikaisen luokan V lupusnefriitin hoitoon.
Ehto
Valmiste pitää antaa kokeneen lääkärin tarkassa valvonnassa hoitopaikassa, jossa kaikki elvytysvälineet ovat heti saatavissa.
Annostus ja antotapa
Gazyvaro pitää antaa kokeneen lääkärin tarkassa valvonnassa hoitopaikassa, jossa kaikki elvytysvälineet ovat heti saatavissa.
Annostus
Tuumorilyysioireyhtymän estohoito ja esilääkitys
Potilaalla katsotaan olevan tuumorilyysioireyhtymän riski, jos kasvaintaakka on suuri ja/tai verenkierrossa oleva lymfosyyttimäärä on suuri (> 25 x 109/l) ja/tai jos potilaalla on munuaisten vajaatoimintaa (CrCl < 70 ml/min). Potilaalle pitää tällöin antaa estohoitoa. Hoitokäytännön mukaisesti 12–24 tuntia ennen Gazyvaro-hoidon alkua annettavaan estohoitoon pitää kuulua riittävä nesteytys sekä virtsahapon muodostusta estävä lääkehoito (esim. allopurinoli) tai muu sopiva hoitovaihtoehto, kuten uraattioksidaasi (esim. rasburikaasi) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Potilaalle pitää antaa estohoitoa aina ennen jokaista infuusiota, jos se katsotaan tarkoituksenmukaiseksi.
Infuusioon liittyvien reaktioiden estohoito ja esilääkitys
Infuusioon liittyvien reaktioiden riskin vähentämiseksi annettava esilääkitys on kuvattu taulukossa 1 (ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet). Ensimmäisessä hoitosyklissä follikulaarista lymfoomaa sairastaville potilaille suositellaan esilääkityksenä kortikosteroideja. Kroonista lymfaattista leukemiaa sairastaville potilaille ja lupusnefriittiä sairastaville potilaille esilääkitys kortikosteroidilla on pakollinen (ks. taulukko 1). Seuraavien infuusioiden yhteydessä annettava esilääkitys sekä muut annettavat esilääkitykset esitetään alla.
Gazyvaro-infuusion laskimoon annon aikana saattaa esiintyä infuusioon liittyvien reaktioiden oireena hypotensiota. Verenpainelääkityksen keskeyttämistä tulisi harkita 12 tunniksi ennen jokaista Gazyvaro-infuusiota sekä infuusion annon ajaksi ja annon jälkeisen tunnin ajaksi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Taulukko 1Esilääkitys ennen Gazyvaro-infuusiota vähentämään infuusioon liittyvien reaktioiden riskiä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
| Käyttöaihe/hoitopäivä/hoitosykli | Esilääkitystä tarvitsevat potilaat | Esilääkitys | Antoajankohta |
Krooninen lymfaattinen leukemia ja follikulaarinen lymfooma: Hoitosykli 1: Päivä 1 | Kaikki potilaat | Kortikosteroidi laskimoon1,4 (kroonisessa lymfaattisessa leukemiassa pakollinen, follikulaarisessa lymfoomassa suositus) | Annon päätyttävä vähintään 1 tunti ennen Gazyvaro-infuusiota |
| Suun kautta otettavat analgeetit/antipyreetit2 | Vähintään 30 minuuttia ennen Gazyvaro-infuusiota | ||
| Antihistamiini3 | |||
Vain krooninen lymfaattinen leukemia: Hoitosykli 1: Päivä 2 | Kaikki potilaat | Kortikosteroidi laskimoon1 (pakollinen) | Annon päätyttävä vähintään 1 tunti ennen Gazyvaro-infuusiota |
| Suun kautta otettavat analgeetit/antipyreetit2 | Vähintään 30 minuuttia ennen Gazyvaro-infuusiota | ||
| Antihistamiini3 | |||
Krooninen lymfaattinen leukemia ja follikulaarinen lymfooma: Kaikki seuraavat infuusiot | Potilaat, joilla ei ole esiintynyt infuusioon liittynyttä reaktiota aiemman infuusion yhteydessä | Suun kautta otettavat analgeetit/antipyreetit2 | Vähintään 30 minuuttia ennen Gazyvaro-infuusiota |
| Potilaat, joilla on ollut (gradus 1 tai 2) infuusioon liittynyt reaktio aiemman infuusion yhteydessä | Suun kautta otettavat analgeetit/antipyreetit2 Antihistamiini3 | ||
| Potilaat, joilla on ollut gradus 3 infuusioon liittynyt reaktio aiemman infuusion yhteydessä TAI Potilaat, joiden lymfosyyttimäärä on > 25 x 109/l ennen seuraavaa hoitoa | Kortikosteroidi laskimoon1,4 | Annon päätyttävä vähintään 1 tunti ennen Gazyvaro-infuusiota | |
Suun kautta otettavat analgeetit/antipyreetit2 Antihistamiini3 | Vähintään 30 minuuttia ennen Gazyvaro-infuusiota | ||
| Lupusnefriitti | Kaikki potilaat | Kortikosteroidi laskimoon5 | Annon päätyttävä 30–60 minuuttia ennen Gazyvaro-infuusiota 6. annoksesta alkaen kortikosteroidi annetaan laskimoon vain potilaille, joilla on ollut infuusioon liittyvä reaktio edellisen infuusion yhteydessä |
| Suun kautta otettavat analgeetit/antipyreetit6 | |||
| Antihistamiini3 |
1100 mg prednisonia/prednisolonia tai 20 mg deksametasonia tai 80 mg metyyliprednisolonia. Hydrokortisonia ei pidä käyttää, koska se ei ole tehonnut infuusioon liittyvien reaktioiden vähentämiseen.
2 esim. 1 000 mg asetaminofeenia/parasetamolia
3 esim. 50 mg difenhydramiinia
4 Jos kortikosteroidia sisältävää solunsalpaajahoitoa annetaan Gazyvaron kanssa samana päivänä, kortikosteroidi voidaan antaa suun kautta, jos se annetaan vähintään 60 minuuttia ennen Gazyvaroa. Tässä tapauksessa laskimoon annosteltavaa kortikosteroidiesilääkitystä ei tarvita.
5 80 mg metyyliprednisolonia laskimoon
6 650–1 000 mg asetaminofeenia/parasetamolia
Annos
Krooninen lymfaattinen leukemia (KLL, yhdistelmähoito klorambusiilin kanssa1)
Kroonista lymfaattista leukemiaa sairastaville potilaille suositeltu Gazyvaro-annos yhdistelmänä klorambusiilin kanssa esitetään taulukossa 2.
Hoitosykli 1
Gazyvaron suositeltu annos yhdistelmähoidossa klorambusiilin kanssa on 1 000 mg, joka annetaan ensimmäisen 28 päivän pituisen hoitosyklin päivinä 1 ja 2 (tai antoa jatketaan päivänä 1) sekä päivinä 8 ja 15.
Päivinä 1 ja 2 annettavaa infuusiota varten pitää saattaa käyttökuntoon kaksi infuusiopussia (100 mg päiväksi 1 ja 900 mg päiväksi 2). Jos ensimmäinen pussi annetaan ilman antonopeuden muutoksia tai infuusion keskeytyksiä, toinen pussi voidaan antaa samana päivänä (antoa ei tarvitse siirtää myöhempään ajankohtaan, ei uutta esilääkitystä), jos infuusiota varten on käytettävissä tarkoituksenmukainen aika, olosuhteet ja lääkärin valvonta. Jos antonopeutta muutetaan tai infuusio keskeytetään ensimmäisen 100 mg:n annon aikana, toinen pussi on annettava seuraavana päivänä.
Hoitosyklit 2–6
Gazyvaron suositeltu annos yhdistelmähoidossa klorambusiilin kanssa on 1 000 mg, joka annetaan jokaisen hoitosyklin päivänä 1.
Taulukko 2Kroonista lymfaattista leukemiaa sairastaville potilaille kuuden 28 päivän pituisen hoitosyklin aikana annettava Gazyvaro-annos
| Hoitosykli | Hoitopäivä | Gazyvaro-annos |
| Hoitosykli 1 | Päivä 1 | 100 mg |
Päivä 2 (tai jatketaan päivänä 1) | 900 mg | |
| Päivä 8 | 1 000 mg | |
| Päivä 15 | 1 000 mg | |
| Hoitosyklit 2–6 | Päivä 1 | 1 000 mg |
1Ks. tiedot klorambusiiliannoksesta kohdasta Farmakodynamiikka
Hoidon kesto
Kuusi 28 päivän pituista hoitosykliä.
Annosten viivästyminen tai antamatta jääminen
Jos suunniteltu Gazyvaro-annos jää antamatta, se on annettava mahdollisimman pian. Älä odota seuraavaa suunniteltua antoajankohtaa. Gazyvaro-annosten välillä on pidettävä suunniteltu hoitotauko.
Follikulaarinen lymfooma
Follikulaarista lymfoomaa sairastaville potilaille suositeltu Gazyvaro-annos yhdistelmänä solunsalpaajahoidon kanssa esitetään taulukossa 3.
Aiemmin hoitamatonta follikulaarista lymfoomaa sairastavat potilaat
Induktiohoito (yhdistelmähoito solunsalpaajahoidon kanssa2)
Gazyvaro pitää antaa solunsalpaajahoidon kanssa seuraavasti:
- kuusi 28 päivän pituista hoitosykliä yhdistelmänä bendamustiinin2 kanssa tai
- kuusi 21 päivän pituista hoitosykliä yhdistelmänä syklofosfamidin, doksorubisiinin, vinkristiinin ja prednisolonin (CHOP-hoidon) kanssa, minkä jälkeen kahdessa lisähoitosyklissä annetaan pelkästään Gazyvaroa tai
- kahdeksan 21 päivän pituista hoitosykliä yhdistelmänä syklofosfamidin, vinkristiinin ja prednisonin/prednisolonin/metyyliprednisolonin (CVP-hoidon) kanssa.
Ylläpitohoito
Jos potilas saa täydellisen tai osittaisen vasteen induktiohoitoon Gazyvaron ja solunsalpaajahoidon (CHOP- tai CVP-hoito tai bendamustiini) yhdistelmällä, hoitoa jatketaan ylläpitohoitona antamalla pelkästään Gazyvaroa 1 000 mg:n annoksella kerran 2 kuukaudessa 2 vuoden ajan tai kunnes tauti etenee (sen mukaan kumpi ehdoista täyttyy ensin).
Follikulaarista lymfoomaa sairastavat potilaat, jotka eivät saaneet vastetta rituksimabihoitoon tai rituksimabia sisältäneeseen hoito-ohjelmaan tai joiden tauti eteni tällaisen hoidon aikana tai viimeistään 6 kuukauden kuluttua tällaisen hoidon jälkeen.
Induktiohoito (yhdistelmähoito bendamustiinin2 kanssa)
Gazyvaroa pitää antaa kuusi 28 päivän pituista hoitosykliä yhdistelmänä bendamustiinin2 kanssa.
Ylläpitohoito
Jos potilas saa täydellisen tai osittaisen vasteen induktiohoitoon (eli kuuden ensimmäisen hoitosyklin aikana) Gazyvaron ja bendamustiinin yhdistelmällä tai jos hänen tautinsa on stabiili, ylläpitohoitoa jatketaan antamalla pelkästään Gazyvaroa 1 000 mg:n annoksella kerran 2 kuukaudessa 2 vuoden ajan tai kunnes tauti etenee (sen mukaan kumpi ehdoista täyttyy ensin).
Taulukko 3 Follikulaarinen lymfooma: Gazyvaro-annos induktiohoidossa ja sen jälkeen ylläpitohoidossa
| Hoitosykli | Hoitopäivä | Gazyvaro-annos |
| Hoitosykli 1 | Päivä 1 | 1 000 mg |
| Päivä 8 | 1 000 mg | |
| Päivä 15 | 1 000 mg | |
| Hoitosyklit 2–6 tai 2–8 | Päivä 1 | 1 000 mg |
| Ylläpitohoito | Kerran 2 kuukaudessa 2 vuoden ajan tai kunnes tauti etenee (sen mukaan kumpi ehdoista täyttyy ensin) | 1 000 mg |
2Ks. tiedot bendamustiiniannoksesta kohdasta Farmakodynamiikka
Hoidon kesto
Induktiohoito kestää noin kuusi kuukautta (kuusi 28 päivän pituista Gazyvaro-hoitosykliä yhdistelmänä bendamustiinin kanssa tai kahdeksan 21 päivän pituista Gazyvaro-hoitosykliä yhdistelmänä CHOP- tai CVP-hoidon kanssa), jonka jälkeen ylläpitohoito kerran 2 kuukaudessa 2 vuoden ajan tai kunnes tauti etenee (sen mukaan kumpi ehdoista täyttyy ensin).
Annosten viivästyminen tai antamatta jääminen
Jos suunniteltu Gazyvaro-annos jää antamatta, se on annettava mahdollisimman pian. Sitä ei jätetä antamatta eikä seuraavaa suunniteltua antoajankohtaa odoteta.
Jos ennen ensimmäisen hoitosyklin päivää 8 tai15 esiintyy toksisuutta, jonka vuoksi antoajankohtaa on siirrettävä myöhemmäksi, annokset pitää antaa, kun toksisuus on hävinnyt. Seuraavia hoitokäyntejä ja hoitosyklin 2 aloittamista pitää tällöin siirtää hoitosyklin 1 pitkittymisen mukaisesti.
Ylläpitohoidossa seuraavat annokset pitää antaa alkuperäisen hoitoaikataulun mukaisesti.
Lupusnefriitti
Gazyvaron suositeltu annos on 1 000 mg laskimoon (ks. taulukko 4).
Gazyvaro-valmistetta on käytettävä yhdessä mykofenolaattimofetiilin kanssa.
Taulukko 4 Lupusnefriittipotilaille annettava Gazyvaro-annos
| Annoksen numero | Hoidon ajankohta | Annos |
| 1 | Ensimmäinen infuusio | 1 000 mg |
| 2 | Viikko 2 (kaksi viikkoa 1. annoksen jälkeen) | 1 000 mg |
| 3 | Viikko 24 | 1 000 mg |
| 4 | Viikko 26 (kaksi viikkoa 3. annoksen jälkeen) | 1 000 mg |
5* ja sitä seuraavat | 6 kuukauden välein | 1 000 mg |
*5. annos annetaan kuuden kuukauden kuluttua 4. annoksesta.
Potilaan tila ja vaste on arvioitava viikolla 76 ja sen jälkeen, ja hoidon jatkamisesta on tehtävä asianmukainen riski-hyötyanalyysi.
Annosten viivästyminen tai antamatta jääminen
Jos suunniteltu Gazyvaro-annos jää antamatta, se on annettava mahdollisimman pian. Älä odota seuraavaa suunniteltua antoajankohtaa. Antoaikataulua on muutettava niin, että annosten välinen aika pysyy asianmukaisena.
Annoksen muuttaminen hoidon aikana (kaikki käyttöaiheet)
Gazyvaro-annoksen pienentämistä ei suositella.
Oireisten haittavaikutusten (infuusioon liittyvät reaktiot mukaan lukien) hoito, ks. jäljempänä (Infuusioon liittyvien reaktioiden hoito tai kohta Varoitukset ja käyttöön liittyvät varotoimet).
Erityispotilasryhmät
Iäkkäät potilaat
Annostusta ei tarvitse muuttaa iäkkäitä potilaita hoidettaessa (ks. kohta Farmakokinetiikka). Gazyvaro-valmisteen turvallisuutta ja tehoa yli 65 vuoden ikäisten potilaiden lupusnefriitin hoidossa ei ole varmistettu.
Munuaisten vajaatoiminta
Annosta ei ole tarpeen muuttaa, jos potilaalla on lievä tai keskivaikea munuaisten vajaatoiminta (kreatiniinipuhdistuma [CrCl] 30–89 ml/min) (ks. kohta Farmakokinetiikka). Gazyvaron turvallisuutta ja tehoa potilaille, joilla on vaikea-asteinen munuaisten vajaatoiminta (CrCl < 30 ml/min), ei ole varmistettu (ks. kohdat Haittavaikutukset ja Farmakokinetiikka).
Maksan vajaatoiminta
Gazyvaron turvallisuutta ja tehoa potilaille, joilla on maksan vajaatoimintaa, ei ole varmistettu. Erityisiä annossuosituksia ei voida antaa.
Pediatriset potilaat
Gazyvaro-valmisteen turvallisuutta ja tehoa alle 18 vuoden ikäisten lasten hoidossa ei ole vielä varmistettu. Tietoja ei ole saatavilla.
Antotapa
Gazyvaro annetaan laskimoon. Valmiste annetaan laimentamisen jälkeen infuusiona laskimoon tähän tarkoitetun antolaitteen kautta (ks. kohta Käyttö- ja käsittelyohjeet). Gazyvaro-infuusiota ei saa antaa laskimoon paineella eikä boluksena.
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet Gazyvaron laimentamisesta ennen antoa.
Ohjeet infuusion antonopeudesta ovat taulukoissa 5–8.
Krooninen lymfaattinen leukemia (KLL)
Taulukko 5Krooninen lymfaattinen leukemia:Infuusion tavanomaiset antonopeudet, kun infuusioon liittyviä reaktioita/yliherkkyyttä ei havaita, sekä suositukset, jos aiemman infuusion yhteydessä on esiintynyt infuusioon liittyvä reaktio
| Hoitosykli | Hoitopäivä | Infuusionopeus Infuusionopeutta voidaan lisätä, jos potilas sietää sen. Infuusion aikana esiintyvien infuusioon liittyvien reaktioiden hoito, ks. kohta Infuusioon liittyvien reaktioiden hoito |
| Hoitosykli 1 | Päivä 1 (100 mg) | Anna nopeudella 25 mg/h 4 tunnin kestoisena infuusiona. Älä lisää infuusionopeutta. |
Päivä 2 (tai jatketaan päivänä 1) (900 mg) | Jos aiemman infuusion yhteydessä ei esiintynyt infuusioon liittynyttä reaktiota, anna nopeudella 50 mg/h. Infuusionopeutta voidaan lisätä 50 mg/h lisäyksin 30 minuutin välein enimmäisnopeuteen 400 mg/h saakka. Jos aiemman infuusion yhteydessä esiintyi infuusioon liittynyt reaktio, aloita anto nopeudella 25 mg/h. Infuusionopeutta voidaan lisätä enintään 50 mg/h ‑lisäyksin 30 minuutin välein enimmäisnopeuteen 400 mg/h saakka. | |
Päivä 8 (1 000 mg) | Jos aiemman lopullisella nopeudella vähintään 100 mg/h annetun infuusion yhteydessä ei esiintynyt infuusioon liittynyttä reaktiota, infuusiot voidaan aloittaa nopeudella 100 mg/h, jota voidaan lisätä 100 mg/h lisäyksin 30 minuutin välein enimmäisnopeuteen 400 mg/h saakka. Jos aiemman infuusion yhteydessä esiintyi infuusioon liittynyt reaktio, anna nopeudella 50 mg/h. Infuusionopeutta voidaan lisätä 50 mg/h ‑lisäyksin 30 minuutin välein enimmäisnopeuteen 400 mg/h saakka. | |
Päivä 15 (1 000 mg) | ||
| Hoitosyklit 2–6 | Päivä 1 (1 000 mg) |
Follikulaarinen lymfooma (FL)
Hoitosyklissä 1 Gazyvaro-valmiste pitää antaa tavanomaisella infuusionopeudella (ks. taulukko 6). Potilaille, joilla ei ilmene graduksen ≥ 3 infuusioon liittyviä reaktioita hoitosyklin 1 aikana, voidaan antaa Gazyvaro-valmiste lyhytkestoisena infuusiona (noin 90 minuuttia) hoitosyklistä 2 alkaen (ks. taulukko 7).
Taulukko 6 Follikulaarinen lymfooma: Infuusion tavanomaiset antonopeudet sekä suositukset, jos aiemman infuusion yhteydessä on esiintynyt infuusioon liittyvä reaktio
| Hoitosykli | Hoitopäivä | Infuusionopeus Infuusionopeutta voidaan lisätä, jos potilas sietää sen. Infuusion aikana esiintyvien infuusioon liittyvien reaktioiden hoito, ks. kohta Infuusioon liittyvien reaktioiden hoito. |
| Hoitosykli 1 | Päivä 1 (1 000 mg) | Anna nopeudella 50 mg/h. Infuusionopeutta voidaan lisätä 50 mg/h lisäyksin 30 minuutin välein enimmäisnopeuteen 400 mg/h saakka. |
Päivä 8 (1 000 mg) | Jos aiemman lopullisella nopeudella vähintään 100 mg/h annetun infuusion yhteydessä ei esiintynyt infuusioon liittynyttä reaktiota tai on esiintynyt gradus 1 infuusioon liittynyt reaktio, infuusiot voidaan aloittaa nopeudella 100 mg/h, jota voidaan lisätä 100 mg/h lisäyksin 30 minuutin välein enimmäisnopeuteen 400 mg/h saakka. Jos aiemman infuusion yhteydessä esiintyi infuusioon liittynyt gradus 2 tai vaikeampiasteinen reaktio, anna nopeudella 50 mg/h. Infuusionopeutta voidaan lisätä 50 mg/h ‑lisäyksin 30 minuutin välein enimmäisnopeuteen 400 mg/h saakka. | |
Päivä 15 (1 000 mg) | ||
| Hoitosyklit 2–6 tai 2–8 | Päivä 1 (1 000 mg) | |
| Ylläpitohoito | Kerran 2 kuukaudessa 2 vuoden ajan tai kunnes tauti etenee (sen mukaan kumpi ehdoista täyttyy ensin) |
Taulukko 7 Follikulaarinen lymfooma: Lyhytkestoisen infuusion antonopeudet sekäsuositukset, jos aiemman infuusion yhteydessä on esiintynyt infuusioon liittyvä reaktio
| Hoitosykli | Hoitopäivä | Infuusionopeus Katso kohdasta Infuusioon liittyvien reaktioiden hoito ohjeet infuusion aikana ilmenevien infuusioon liittyvien reaktioiden hoitoon. |
| Hoitosyklit 2‑6 tai 2–8 | Päivä 1 (1 000 mg) | Jos hoitosyklin 1 aikana ei esiintynyt graduksen ≥ 3 infuusioon liittyviä reaktioita: 100 mg/h 30 minuutin ajan, sitten 900 mg/h noin 60 minuutin ajan. Jos aiemman lyhytkestoisen infuusion aikana esiintyi graduksen 1–2 infuusioon liittynyt reaktio, jonka oireet jatkuvat edelleen, tai graduksen 3 infuusioon liittynyt reaktio, anna seuraava obinututsumabi-infuusio tavanomaisella antonopeudella (ks. taulukko 6). |
| Ylläpitohoito | Kerran 2 kuukaudessa 2 vuoden ajan tai kunnes tauti etenee (sen mukaan kumpi ehdoista täyttyy ensin) |
Lupusnefriitti
Ensimmäinen Gazyvaro-infuusio annetaan normaalilla infuusionopeudella (ks. taulukko 8).
Taulukko 8 Lupusnefriitti: Normaali infuusionopeus
| Annoksen numero | Hoidon ajankohta | Infuusionopeus |
| 1 | Ensimmäinen infuusio (1 000 mg) | Anna nopeudella 50 mg/h. Infuusionopeutta voidaan lisätä 50 mg/h lisäyksin 30 minuutin välein enimmäisnopeuteen 400 mg/h saakka. Katso kohdasta Infuusioon liittyvien reaktioiden hoito ohjeet infuusion aikana ilmenevien infuusioon liittyvien reaktioiden hoitoon. |
| 2 | Viikko 2 – kaksi viikkoa 1. annoksen jälkeen (1 000 mg) | Anna nopeudella 100 mg/h. Infuusionopeutta voidaan lisätä 100 mg/h lisäyksin 30 minuutin välein enimmäisnopeuteen 400 mg/h saakka. |
| 3 | Viikko 24 (1 000 mg) | |
| 4 | Viikko 26 – kaksi viikkoa 3. annoksen jälkeen (1 000 mg) | |
| 5* ja sitä seuraavat | 6 kuukauden välein (1 000 mg) |
*5. annos annetaan kuuden kuukauden kuluttua 4. annoksesta.
Infuusioon liittyvien reaktioiden hoito
Infuusioon liittyvien reaktioiden hoitamiseksi saattaa olla tarpeen keskeyttää infuusio tilapäisesti, hidastaa infuusion antonopeutta tai lopettaa Gazyvaro-hoito seuraavassa annettujen ohjeiden mukaisesti (ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet):
Krooninen lymfaattinen leukemia (KLL) ja follikulaarinen lymfooma (FL)
- gradus 4 (henkeä uhkaava): Infuusion anto on lopetettava ja hoito on lopetettava pysyvästi.
- gradus 3 (vaikea-asteinen): Infuusion anto on lopetettava tilapäisesti ja oireet hoidettava. Kun oireet ovat hävinneet, infuusion antoa voidaan jatkaa enintään puolella aiemmasta antonopeudesta (eli antonopeudesta, joka oli käytössä infuusioon liittyvien reaktioiden ilmaantuessa) ja jos potilaalla ei esiinny infuusioon liittyviä reaktioita, infuusionopeutta voidaan jälleen lisätä hoitoannokseen nähden tarkoituksenmukaisin lisäyksin ja väliajoin (ks. taulukot 5–7). Jos kroonista lymfaattista leukemiaa sairastavan potilaan päivän 1 (hoitosyklissä 1) annos jaetaan kahdelle päivälle, päivän 1 infuusionopeus voidaan 1 tunnin kuluttua nostaa takaisin nopeuteen 25 mg/h saakka, mutta ei tätä nopeammaksi. Infuusion anto on lopetettava ja hoito lopetettava pysyvästi, jos potilaalle ilmaantuu toisen kerran vaikeusasteen 3 infuusioon liittyvä reaktio.
- gradus 1–2 (lievä tai keskivaikea): Infuusionopeutta pitää hidastaa ja oireet hoitaa. Infuusiota voidaan jatkaa, kun oireet ovat hävinneet, ja jos potilaalle ei enää ilmaannu infuusioon liittyvän reaktion oireita, infuusionopeutta voidaan lisätä hoitoannokseen nähden tarkoituksenmukaisin lisäyksin ja väliajoin (ks. taulukot 5–7). Jos kroonista lymfaattista leukemiaa sairastavan potilaan päivän 1 (hoitosyklissä 1) annos jaetaan kahdelle päivälle, päivän 1 infuusionopeus voidaan 1 tunnin kuluttua nostaa takaisin nopeuteen 25 mg/h saakka, mutta ei tätä nopeammaksi.
Lyhytkestoisen infuusion aikana esiintyvät infuusioon liittyvät reaktiot:
- gradus 4 (henkeä uhkaava): Infuusion anto on lopetettava ja hoito on lopetettava pysyvästi.
-
gradus 3 (vaikea-asteinen): Infuusion anto on lopetettava tilapäisesti ja oireet hoidettava. Kun oireet ovat hävinneet, infuusion antoa voidaan jatkaa enintään puolella aiemmasta antonopeudesta (eli antonopeudesta, joka oli käytössä infuusioon liittyvien reaktioiden ilmaantuessa) ja korkeintaan nopeudella 400 mg/h.
Jos potilaalla ilmenee toisen kerran graduksen 3 infuusioon liittyvä reaktio infuusion uudelleen aloittamisen jälkeen, infuusion anto on lopetettava ja hoito on lopetettava pysyvästi. Jos potilas pystyy saamaan koko infuusion ilman uutta graduksen 3 infuusioon liittyvää reaktiota, seuraava infuusio on annettava nopeudella, joka ei ylitä tavanomaista antonopeutta. - gradus 1–2 (lievä tai keskivaikea): Infuusionopeutta pitää hidastaa ja oireet hoitaa. Infuusiota voidaan jatkaa, kun oireet ovat hävinneet, ja jos potilaalle ei enää ilmaannu infuusioon liittyvän reaktion oireita, infuusionopeutta voidaan lisätä hoitoannokseen nähden tarkoituksenmukaisin lisäyksin ja väliajoin (ks. taulukot 6–7).
Lupusnefriitti (LN)
- gradus 4 (henkeä uhkaava): Infuusion anto on lopetettava ja hoito on lopetettava pysyvästi.
-
gradus 3 (vaikea-asteinen): Infuusion anto on lopetettava tilapäisesti ja oireet hoidettava. Kun oireet ovat hävinneet, infuusion antoa voidaan jatkaa enintään puolella aiemmasta antonopeudesta (eli antonopeudesta, joka oli käytössä infuusioon liittyvän reaktion ilmaantuessa), ja jos potilaalla ei enää ole infuusioon liittyvän reaktion oireita, infuusionopeutta voidaan jälleen lisätä hoitoannokseen nähden tarkoituksenmukaisin lisäyksin ja väliajoin (ks. taulukko 8).
Jos potilaalla ilmenee toisen kerran graduksen 3 infuusioon liittyvä reaktio, infuusion anto on lopetettava ja hoito lopetettava pysyvästi. - gradus 1–2 (lievä tai keskivaikea): Infuusionopeus pitää hidastaa puoleen siitä nopeudesta, joka oli käytössä reaktion ilmaantuessa, ja oireet pitää hoitaa. Kun oireet ovat hävinneet, infuusiota voidaan jatkaa pienemmällä nopeudella vielä 30 minuutin ajan. Jos potilaalle ei enää ilmaannu infuusioon liittyvän reaktion oireita, infuusionopeutta voidaan lisätä hoitoannokseen nähden tarkoituksenmukaisin lisäyksin ja väliajoin (ks. taulukko 8).
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Varoitukset ja varotoimet esitetään erikseen onkologian (krooninen lymfaattinen leukemia ja follikulaarinen lymfooma) ja lupusnefriitin käyttöaiheissa.
Krooninen lymfaattinen leukemia (KLL) ja follikulaarinen lymfooma (FL)
Aiemmin hoitamatonta follikulaarista lymfoomaa sairastavista tehdyn osajoukkoanalyysin perusteella teho pienen riskin FLIPI-ryhmässä (0–1) ei ole tällä hetkellä vakuuttava (ks. kohta Farmakodynamiikka). Valittaessa hoitoa tämän potilasryhmän potilaille on huomioitava tarkoin Gazyvaro-valmisteen ja solunsalpaajahoidon yhdistelmän turvallisuusprofiili sekä potilaan yksilöllinen tilanne.
Infuusioon liittyvät reaktiot
Gazyvaro-hoitoa saavilla potilailla yleisimmin havaittuja haittavaikutuksia olivat infuusioon liittyvät reaktiot, joita esiintyi pääasiassa ensimmäisen 1 000 mg:n infuusion aikana. Infuusioon liittyvät reaktiot saattavat olla yhteydessä sytokiinioireyhtymään, jota on raportoitu myös Gazyvaro-hoitoa saaneilla potilailla. Jos kroonista lymfaattista leukemiaa sairastava potilas sai infuusioon liittyvien reaktioiden estoon kohdassa Annostus ja antotapa kuvattua yhdistelmähoitoa (riittävästi kortikosteroideja, suun kautta otettavia analgeetteja/antihistamiinia, verenpainelääke jätettiin ottamatta ensimmäisen infuusion sekä kahdelle päivälle jaettujen hoitosyklin 1 päivän 1 infuusioiden antopäivän aamuna), infuusioon liittyvien reaktioiden kaikkien vaikeusasteiden ilmaantuvuuden havaittiin vähenevän. Gradus 3‑4 infuusioon liittyvät reaktiot (jotka perustuivat suhteelliseen pieneen potilasjoukkoon) olivat samankaltaisia ennen niiden vähentämiseen tähtääviä toimenpiteitä ja tällaisten toimenpiteiden jälkeen. Infuusioon liittyvien reaktioiden vähentämiseen tähtääviä toimenpiteitä pitää noudattaa (ks. kohta Annostus ja antotapa). Infuusioon liittyvien reaktioiden ilmaantuvuus ja vaikeusaste vähenivät huomattavasti ensimmäisen 1 000 mg:n infuusion antamisen jälkeen eikä suurimmalla osalla potilaista esiinny infuusioon liittyviä reaktioita tämän jälkeen annettavien Gazyvaro‑antokertojen aikana (ks. kohta Haittavaikutukset).
Riippumatta siitä, mihin käyttöaiheeseen hoitoa annettiin, infuusioon liittyvät reaktiot olivat useimmilla potilailla lieviä tai keskivaikeita ja ne saatiin hallintaan hidastamalla ensimmäisen infuusion antonopeutta tai keskeyttämällä sen anto tilapäisesti, mutta vaikea‑asteisia ja hengenvaarallisia oireenmukaista hoitoa vaatineita infuusioon liittyneitä reaktioita on myös raportoitu. Infuusioon liittyvät reaktiot eivät välttämättä ole kliinisesti erotettavissa immunoglobuliini E (IgE) ‑välitteisistä allergisista reaktioista (esim. anafylaksiasta). Jos potilaan kasvaintaakka on suuri ja/tai kroonista lymfaattista leukemiaa sairastavan potilaan verenkierrossa oleva lymfosyyttimäärä on suuri (> 25 x 109/l), vaikea-asteisten infuusioon liittyvien reaktioiden riski saattaa olla suurempi. Jos potilaalla on munuaisten vajaatoimintaa (CrCl < 50 ml/min) tai potilaan CIRS-indeksi (Cumulative Illness Rating Scale) on > 6 ja CrCl on < 70 ml/min, infuusioon liittyvien reaktioiden, mukaan lukien vaikea-asteisten infuusioon liittyvien reaktioiden, riski saattaa olla suurempi (ks. kohta Haittavaikutukset). Infuusioon liittyvien reaktioiden hoito, ks. kohta Annostus ja antotapa.
Potilaalle ei enää saa antaa Gazyvaro-infuusioita, jos hänellä esiintyy
- akuutteja hengenvaarallisia hengitysoireita
- graduksen 4 (eli henkeä uhkaava) infuusioon liittyvä reaktio tai
- graduksen 3 (pitkittyvä/uusiutuva) infuusioon liittyvä reaktio toisen kerran (sen jälkeen, kun ensimmäistä infuusiota jatketaan tai ensimmäisen infuusion jälkeen annettavan infuusion yhteydessä).
Jos potilaalla on ennestään sydän- tai keuhkosairaus, potilasta on seurattava tarkoin infuusion koko antoajan sekä infuusion annon päättymisen jälkeen. Gazyvaro-infuusiota laskimoon annettaessa saattaa esiintyä hypotensiota. Siksi on harkittava verenpainelääkityksen keskeyttämistä 12 tunniksi ennen kutakin Gazyvaro-infuusiota sekä infuusion annon ajaksi ja annon jälkeisen tunnin ajaksi. Jos potilaalla on hypertensiivisen kriisin akuutti riski, verenpainelääkehoidon keskeyttämisen hyödyt ja riskit on arvioitava.
Yliherkkyysreaktiot
Gazyvaro-hoitoa saaneilla potilailla on raportoitu välittömiä yliherkkyysreaktioita (esim. anafylaksiaa) ja viivästyneesti ilmaantuneita yliherkkyysreaktioita (esim. seerumitautia). Yliherkkyysreaktioita saattaa olla vaikea erottaa kliinisesti infuusioon liittyvistä reaktioista. Yliherkkyysreaktioita voi ilmaantua aiemman altistumisen jälkeen, ja niitä ilmaantuu hyvin harvoin ensimmäisen infuusion yhteydessä. Jos infuusion aikana tai sen jälkeen epäillään yliherkkyysreaktiota, infuusion anto on keskeytettävä ja hoito lopetettava pysyvästi. Potilasta ei saa hoitaa obinututsumabilla, jos hänen tiedetään olevan sille yliherkkä (ks. kohta Vasta-aiheet).
Tuumorilyysioireyhtymä
Gazyvaro-hoidon yhteydessä on raportoitu tuumorilyysioireyhtymää. Jos potilaalla katsotaan olevan tuumorilyysioireyhtymän riski (esim. potilaan kasvaintaakka on suuri tai verenkierrossa oleva lymfosyyttimäärä on suuri [> 25 x 109/l] ja/tai potilaalla on munuaisten vajaatoimintaa [CrCl < 70 ml/min]), potilaalle pitää antaa estohoitoa. Hoitokäytännön mukaisesti estohoito on aloitettava 12–24 tuntia ennen Gazyvaro-infuusiota ja siihen pitää kuulua riittävä nesteytys sekä virtsahapon muodostusta estävä lääkehoito (esim. allopurinoli) tai muu sopiva hoitovaihtoehto, kuten uraattioksidaasi (esim. rasburikaasi) (ks. kohta Annostus ja antotapa). Kaikkia riskiryhmään kuuluviksi katsottuja potilaita pitää seurata tarkoin hoidon alkuvaiheessa, ja tällöin on kiinnitettävä erityistä huomiota munuaisten toimintaan, kaliumpitoisuuteen ja virtsahappopitoisuuteen. Lisäksi on noudatettava mahdollisia muita hoitokäytännön mukaisia ohjeistoja. Tuumorilyysioireyhtymän hoitona on aiheellista korjata elektrolyyttien poikkeavuudet, seurata munuaisten toimintaa ja nestetasapainoa ja antaa elintoimintoja tukevaa hoitoa, kuten dialyysihoitoa.
Neutropenia
Gazyvaro-hoidon aikana on raportoitu vaikea-asteista ja hengenvaarallista neutropeniaa, mukaan lukien kuumeista neutropeniaa. Potilaita, joille neutropeniaa kehittyy, pitää seurata tarkoin säännöllisin laboratoriokokein, kunnes tila korjaantuu. Jos hoito on tarpeen, sen pitää olla paikallisten ohjeistojen mukaista, ja granulosyyttiryhmiä stimuloivien kasvutekijöiden (G-CSF) antoa pitää harkita. Samanaikaisen infektion oireet pitää hoitaa tarkoituksenmukaisesti. Vaikea-asteisen tai hengenvaarallisen neutropenian yhteydessä pitää harkita antoajankohdan siirtämistä myöhemmäksi. Jos potilaalla on vaikea-asteinen ja yli 1 viikon kestävä neutropenia, on erittäin suositeltavaa antaa potilaalle estohoitoa mikrobilääkkeillä koko hoitojakson ajan, kunnes oireet lievenevät gradukseen 1 tai 2. Estohoitoa virus- ja sienilääkkeillä pitää myös harkita (ks. kohta Annostus ja antotapa). Viivästyneesti ilmaantuvaa neutropeniaa (ilmaantuu 28 päivää hoidon päättymisen jälkeen) tai pitkittyvää neutropeniaa (kestää pidempään kuin 28 päivää hoidon päättymisen/lopettamisen jälkeen) saattaa esiintyä. Munuaisten vajaatoimintaa (CrCl < 50 ml/min) sairastavilla potilailla on tavanomaista suurempi neutropenian riski (ks. kohta Haittavaikutukset).
Trombosytopenia
Gazyvaro-hoidon aikana on havaittu vaikea-asteista ja hengenvaarallista trombosytopeniaa, mukaan lukien akuuttia trombosytopeniaa (joka ilmaantuu 24 tunnin kuluessa infuusion jälkeen). Munuaisten vajaatoimintaa (CrCl < 50 ml/min) sairastavilla potilailla on tavanomaista suurempi trombosytopenian riski (ks. kohta Haittavaikutukset). Gazyvaro-hoitoa saaneilla potilailla on raportoitu hoitosyklin 1 aikana myös kuolemaan johtanutta verenvuotoa. Trombosytopenian ja verenvuotojen välillä ei ole varmistettu selvää yhteyttä.
Potilaita pitää tarkkailla huolellisesti trombosytopenian havaitsemiseksi, etenkin ensimmäisen hoitosyklin aikana, ja laboratoriokokeita on tehtävä säännöllisesti tilan korjautumiseen saakka. Vaikean tai hengenvaarallisen trombosytopenian yhteydessä on harkittava antoajankohdan siirtämistä myöhäisemmäksi. Hoitopaikan käytännön mukaisia verivalmistesiirtoja (esim. trombosyyttisiirto) annetaan hoitavan lääkärin harkinnan mukaan. Mahdolliset samanaikaiset hoidot, jotka voivat pahentaa trombosytopeniaan liittyviä tapahtumia, kuten trombosyyttien estäjät ja antikoagulantit, pitää myös ottaa huomioon, etenkin ensimmäisen hoitosyklin aikana.
Veren hyytymiseen liittyvät poikkeavuudet, mukaan lukien yleistynyt suonensisäinen hyytyminen (DIC)
DIC-oireyhtymää, mukaan lukien kuolemaan johtaneita tapahtumia, on ilmoitettu Gazyvaroa saaneilla potilailla kliinisissä tutkimuksissa ja myyntiluvan myöntämisen jälkeisessä seurannassa. Suurimmassa osassa tapauksista kyse oli ei-ilmeisestä DIC-oireyhtymästä, johon liittyi piileviä (oireettomia) muutoksia verihiutalemäärissä ja laboratoriokokeiden hyytymisarvoissa 1–2 vuorokauden kuluessa ensimmäisestä infuusiosta ja itsestään tapahtuva tilanteen palautuminen yleensä 1–2 viikon kuluessa ilman tarvetta keskeyttää lääkkeen käyttöä tai ryhtyä erityisiin hoitotoimenpiteisiin. Joissakin tapauksissa tapahtumat ovat olleet yhteydessä infuusioon liittyviin reaktioihin ja/tai tuumorilyysioireyhtymään. DIC-oireyhtymän osalta ei havaittu mitään erityisiä riskitekijöitä. Potilailta, joilla epäillään ei-ilmeistä DIC-oireyhtymää, on seurattava tiiviisti hyytymisarvoja, mukaan lukien verihiutaleet ja kliininen seuranta on toteutettava ilmeisen DIC-oireyhtymän merkkien tai oireiden varalta. Gazyvaro-hoito on keskeytettävä heti, kun potilaalla epäillään ilmeistä DIC-oireyhtymää, jolloin on aloitettava asianmukainen hoito.
Aiemmin kehittyneiden sydänsairauksien paheneminen
Potilailla, joilla on perussairautena sydänsairaus, on esiintynyt Gazyvaro-hoidon aikana sydämen rytmihäiriöitä (kuten eteisvärinää ja takyarytmioita), angina pectorista, akuuttia sepelvaltimo-oireyhtymää, sydäninfarkteja ja sydämen vajaatoimintaa (ks. kohta Haittavaikutukset). Tällaisia tapahtumia voi esiintyä osana infuusioon liittyvää reaktiota ja ne voivat johtaa kuolemaan. Potilaita, joilla on aiemmin ollut sydänsairaus, pitää siksi seurata tarkoin. Näiden potilaiden nesteytyksessä on oltava varovainen, jotta vältetään mahdollinen nesteylikuormitus.
Infektiot
Gazyvaro-hoitoa ei saa antaa aktiivisen infektion aikana, ja Gazyvaro-hoidon harkinnassa on oltava varovainen, jos potilaalla on aiemmin ollut toistuvia tai kroonisia infektioita. Gazyvaro-hoidon aikana ja päättymisen jälkeen voi esiintyä vakavia bakteeri- ja sieni-infektioita tai virusinfektioita voi puhjeta tai aktivoitua uudelleen. Kuolemaan johtaneita infektioita on raportoitu. Jos potilaan CIRS-pisteet ovat > 6 ja CrCl on < 70 ml/min, potilaan infektioriski, vaikea-asteiset infektiot mukaan lukien, on tavanomaista suurempi (ks. kohta Haittavaikutukset). Follikulaarista lymfoomaa koskeneissa tutkimuksissa havaittiin suuri infektioiden ilmaantuvuus tutkimusten kaikissa vaiheissa, myös seurannassa. Ilmaantuvuus oli suurin ylläpitovaiheen aikana. Gradus 3–5 infektioita havaittiin seurantavaiheen aikana useammin potilailla, jotka saivat hoidon induktiovaiheessa Gazyvaron ja bendamustiinin yhdistelmää.
B-hepatiitin aktivoituminen uudelleen
Hepatiitti B -viruksen (HBV) aktivoitumista uudelleen, mikä johtaa joissakin tapauksissa voimakasoireisen hepatiitin kehittymiseen, maksan vajaatoimintaan ja kuolemaan, voi esiintyä anti-CD20‑vasta-aineilla, Gazyvaro mukaan lukien, hoitoa saaneilla potilailla (ks. kohta Haittavaikutukset). Kaikilta potilailta pitää seuloa hepatiitti B -virus ennen Gazyvaro-hoidon aloittamista. Tähän pitää sisältyä vähintään hepatiitti B:n pinta-antigeenin (HBsAg) ja hepatiitti B:n ydinvasta-aineiden (HBcAb) tilanne. Tätä voidaan täydentää muilla tarkoituksenmukaisilla merkkiaineilla paikallisten ohjeistojen mukaisesti. Jos potilaalla on aktiivinen B-hepatiitti, häntä ei pidä hoitaa Gazyvarolla. Jos potilas on hepatiitti B -serologiapositiivinen, maksatautien erikoislääkäriä pitää konsultoida ennen hoidon aloittamista, ja potilasta pitää seurata ja hoitaa paikallisten hoito-ohjeistojen mukaisesti hepatiitin uudelleenaktivoitumisen estämiseksi.
Progressiivinen multifokaalinen leukoenkefalopatia (PML)
Gazyvaro-hoitoa saaneilla potilailla on raportoitu progressiivista multifokaalista leukoenkefalopatiaa (PML) (ks. kohta Haittavaikutukset). PML:n diagnoosia pitää harkita, jos potilaalle ilmaantuu uudentyyppisiä neurologisia oireita tai aiemmat neurologiset oireet muuttuvat. PML:n oireet ovat epäspesifisiä ja voivat vaihdella sen mukaan, mihin aivojen alueeseen sairaus vaikuttaa. Motoriset oireet, joihin liittyy kortikospinaalisen alueen löydöksiä (esim. lihasheikkoutta, halvaantumista ja tuntoaistin häiriötä), tuntoaistin poikkeavuudet, pikkuaivo-oireet ja näkökenttäpuutokset ovat yleisiä. Kortikaalisiksi katsottuja oireita ja löydöksiä (esim. afasiaa tai visuaalis-spatiaalista desorientaatiota) voi esiintyä. PML:n tutkimuksiin kuuluu neurologin konsultointi, aivojen magneettikuvaus ja lannepisto (John Cunninghamin viruksen DNA:n tutkimiseksi aivo-selkäydinnesteestä), näihin kuitenkaan rajoittumatta. Gazyvaro-hoito pitää keskeyttää mahdollisen PML:n tutkimisen ajaksi, ja jos PML varmistuu, hoito pitää lopettaa pysyvästi. Mahdollisen samanaikaisen solunsalpaajahoidon tai immunosuppressiivisen hoidon keskeyttämistä tai annoksen pienentämistä pitää myös harkita. Potilas pitää lähettää neurologin vastaanotolle PML:n tutkimista ja hoitoa varten.
Immunisaatio
Eläviä tai heikennettyjä viruksia sisältävillä rokotteilla toteutettavan immunisaation turvallisuutta Gazyvaro-hoidon jälkeen ei ole tutkittu, joten rokottamista eläviä viruksia sisältävillä rokotteilla ei suositella hoidon aikana eikä ennen kuin B-soluarvot korjautuvat.
Altistuminen obinututsumabille kohdussa ja eläviä viruksia sisältävien rokotteiden antaminen imeväisikäisille
Koska raskauden aikana Gazyvarolle altistuneille äideille syntyneillä imeväisillä saattaa olla B-solupuutos, imeväisikäisiä pitää seurata B-solupuutoksen havaitsemiseksi, ja rokottamista eläviä viruksia sisältävillä rokotteilla pitää siirtää siihen saakka, kunnes lapsen B-solumäärä on korjautunut. Rokotuksen turvallisuudesta ja ajankohdasta pitää keskustella lasta hoitavan lääkärin kanssa (ks. kohta Raskaus ja imetys).
Lupusnefriitti (LN)
Infektiot
Gazyvaro-hoitoa ei saa antaa aktiivisen infektion aikana, ja Gazyvaro-hoidon harkinnassa on oltava varovainen, jos potilaalla on aiemmin ollut toistuvia tai kroonisia infektioita. Gazyvaro-hoidon aikana ja päättymisen jälkeen voi esiintyä vakavia bakteeri- ja sieni-infektioita tai virusinfektioita voi puhjeta tai aktivoitua uudelleen. Kuolemaan johtaneita infektioita on raportoitu.
Kaikilta potilailta pitää seuloa hepatiitti B -virus ennen Gazyvaro-hoidon aloittamista. Tähän pitää sisältyä vähintään hepatiitti B:n pinta-antigeenin (HBsAg) ja hepatiitti B:n ydinvasta-aineiden (HBcAb) tilanne. Tätä voidaan täydentää muilla tarkoituksenmukaisilla merkkiaineilla paikallisten ohjeistojen mukaisesti. Jos potilaalla on aktiivinen B-hepatiitti, häntä ei pidä hoitaa Gazyvarolla. Jos potilas on hepatiitti B -serologiapositiivinen, potilasta pitää seurata ja hoitaa paikallisten hoito-ohjeistojen mukaisesti hepatiitin uudelleenaktivoitumisen estämiseksi.
Neutropenia
Gazyvaro-hoidon aikana on raportoitu vaikea-asteista ja hengenvaarallista neutropeniaa, mukaan lukien kuumeista neutropeniaa. Potilaita, joille neutropeniaa kehittyy, pitää seurata tarkoin säännöllisin laboratoriokokein, kunnes tila korjaantuu. Jos hoito on tarpeen, sen pitää olla paikallisten ohjeistojen mukaista, ja granulosyyttiryhmiä stimuloivien kasvutekijöiden (G-CSF) antoa pitää harkita. Samanaikaisen infektion oireet pitää hoitaa tarkoituksenmukaisesti.
Infuusioon liittyvät reaktiot
Lupusnefriittiä sairastavilla potilailla infuusioon liittyviä reaktioita esiintyi pääasiassa ensimmäisen 1 000 mg:n infuusion aikana. Infuusioon liittyvät reaktiot olivat yleensä lieviä (gradus 1) tai keskivaikeita (gradus 2), ja ne saatiin hallintaan hidastamalla infuusion antonopeutta tai keskeyttämällä sen anto tilapäisesti (ks. kohta Infuusioon liittyvien reaktioiden hoito). Vaikea-asteisia (gradus 3) ja hengenvaarallisia (gradus 4) oireenmukaista hoitoa vaatineita infuusioon liittyneitä reaktioita on kuitenkin myös raportoitu. Ks. tiedot estohoidosta kohdasta Annostus ja antotapa.
Potilaalle ei enää saa antaa Gazyvaro-infuusioita, jos hänellä esiintyy
- akuutteja hengenvaarallisia hengitysoireita
- graduksen 4 (eli henkeä uhkaava) infuusioon liittyvä reaktio tai
- graduksen 3 (pitkittyvä/uusiutuva) infuusioon liittyvä reaktio toisen kerran (sen jälkeen, kun ensimmäistä infuusiota jatketaan tai ensimmäisen infuusion jälkeen annettavan infuusion yhteydessä).
Jos potilaalla on ennestään sydän- tai keuhkosairaus, potilasta on seurattava tarkoin infuusion koko antoajan sekä infuusion annon päättymisen jälkeen. Gazyvaro-infuusiota laskimoon annettaessa saattaa esiintyä hypotensiota. Siksi on harkittava verenpainelääkityksen keskeyttämistä 12 tunniksi ennen kutakin Gazyvaro-infuusiota sekä infuusion annon ajaksi ja annon jälkeisen tunnin ajaksi. Jos potilaalla on hypertensiivisen kriisin akuutti riski, verenpainelääkehoidon keskeyttämisen hyödyt ja riskit on arvioitava.
Progressiivinen multifokaalinen leukoenkefalopatia (PML)
Gazyvaro-hoitoa saaneilla kroonista lymfaattista leukemiaa ja/tai follikulaarista lymfoomaa sairastavilla potilailla on raportoitu progressiivista multifokaalista leukoenkefalopatiaa (PML) (ks. kohta Haittavaikutukset). Sitä ei ole raportoitu Gazyvaro-valmisteella hoidetuilla lupusnefriittiä sairastavilla potilailla lumekontrolloitujen tutkimusten aikana kertyneissä tiedoissa. PML:n diagnoosia pitää harkita, jos potilaalle ilmaantuu uudentyyppisiä neurologisia oireita tai aiemmat neurologiset oireet muuttuvat. PML:n oireet ovat epäspesifisiä ja voivat vaihdella sen mukaan, mihin aivojen alueeseen sairaus vaikuttaa. Motoriset oireet, joihin liittyy kortikospinaalisen alueen löydöksiä (esim. lihasheikkoutta, halvaantumista ja tuntoaistin häiriötä), tuntoaistin poikkeavuudet, pikkuaivo-oireet ja näkökenttäpuutokset ovat yleisiä. Kortikaalisiksi katsottuja oireita ja löydöksiä (esim. afasiaa tai visuaalis-spatiaalista desorientaatiota) voi esiintyä. PML:n tutkimuksiin kuuluu neurologin konsultointi, aivojen magneettikuvaus ja lannepisto (John Cunninghamin viruksen DNA:n tutkimiseksi aivo-selkäydinnesteestä), näihin kuitenkaan rajoittumatta. Gazyvaro-hoito pitää keskeyttää mahdollisen PML:n tutkimisen ajaksi, ja jos PML varmistuu, hoito pitää lopettaa pysyvästi. Mahdollisen samanaikaisen solunsalpaajahoidon tai immunosuppressiivisen hoidon keskeyttämistä tai annoksen pienentämistä pitää myös harkita. Potilas pitää lähettää neurologin vastaanotolle PML:n tutkimista ja hoitoa varten.
Immunisaatio
Eläviä tai heikennettyjä viruksia sisältävillä rokotteilla toteutettavan immunisaation turvallisuutta Gazyvaro-hoidon jälkeen ei ole tutkittu, joten rokottamista eläviä viruksia sisältävillä rokotteilla ei suositella hoidon aikana eikä ennen kuin B-soluarvot korjautuvat.
Altistuminen obinututsumabille kohdussa ja eläviä viruksia sisältävien rokotteiden antaminen imeväisikäisille
Koska raskauden aikana Gazyvarolle altistuneille äideille syntyneillä imeväisillä saattaa olla B‑solupuutos, imeväisikäisiä pitää seurata B‑solupuutoksen havaitsemiseksi, ja rokottamista eläviä viruksia sisältävillä rokotteilla pitää siirtää siihen saakka, kunnes lapsen B‑solumäärä on korjautunut. Rokotuksen turvallisuudesta ja ajankohdasta pitää keskustella lasta hoitavan lääkärin kanssa (ks. kohta Raskaus ja imetys).
Iäkkäät potilaat
Gazyvaro-valmisteen turvallisuutta ja tehoa yli 65 vuoden ikäisten potilaiden lupusnefriitin hoidossa ei ole varmistettu.
Munuaisten vajaatoiminta
Gazyvaro-valmisteen turvallisuutta ja tehoa ei ole varmistettu vaikeaa munuaisten vajaatoimintaa sairastavilla potilailla (kreatiniinipuhdistuma (CrCl) < 30 ml/min).
Yhteisvaikutukset
Varsinaisia lääkkeiden yhteisvaikutustutkimuksia ei ole tehty, mutta Gazyvaro-valmisteella on tehty suppeita osatutkimuksia lääkeyhteisvaikutuksista bendamustiinin, CHOP-hoidon, fludarabiinin ja syklofosfamidin (FC-hoidon) sekä klorambusiilin kanssa.
Yhteisvaikutusten riskiä muiden samanaikaisesti käytettyjen lääkevalmisteiden kanssa ei voida sulkea pois.
Farmakokineettiset yhteisvaikutukset
Obinututsumabi ei ole sytokromi P450:n (CYP450), uridiinidifosfaattiglukuronyylitransferaasin (UGT:n) ja kuljettajaproteiinien, kuten P-glykoproteiinin, substraatti, estäjä eikä indusoija. Sen vuoksi näiden entsyymijärjestelmien kautta tunnetusti metaboloituvien lääkkeiden kanssa ei oletettavasti esiinny farmakokineettisiä yhteisvaikutuksia.
Gazyvaron samanaikainen antaminen ei vaikuttanut bendamustiinin, FC-hoidon, klorambusiilin eikä CHOP-hoidon komponenttien farmakokinetiikkaan. Lisäksi bendamustiinilla, FC-hoidolla, klorambusiililla tai CHOP-hoidolla ei ollut ilmeisiä vaikutuksia Gazyvaron farmakokinetiikkaan.
Farmakodynaamiset yhteisvaikutukset
Rokottamista eläviä viruksia sisältävillä rokotteilla ei suositella hoidon aikana eikä niin kauan, kunnes B-soluarvot ovat korjautuneet, koska obinututsumabilla on immunosuppressiivinen vaikutus (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Obinututsumabin ja klorambusiilin, bendamustiinin, CHOP- tai CVP-hoidon yhdistelmäkäyttö saattaa lisätä neutropenian riskiä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi
Naisten, jotka voivat tulla raskaaksi, täytyy käyttää tehokasta ehkäisyä Gazyvaro-hoidon aikana ja 18 kuukautta Gazyvaro-hoidon päättymisen jälkeen.
Raskaus
Cynomolgus-apinoilla tehty lisääntymistutkimus ei viitannut alkioon ja sikiöön kohdistuvaan toksisuuteen eikä teratogeenisiin vaikutuksiin, mutta aiheutti jälkeläisille täydellisen B-lymfosyyttipuutoksen. Jälkeläisten B-solumäärä palautui normaaliksi ja immunologiset toiminnot korjautuivat 6 kuukauden kuluessa syntymästä. Obinututsumabipitoisuudet jälkeläisten seerumissa olivat samankaltaiset kuin niiden emoilla 28. synnytyksen jälkeisenä päivänä. Pitoisuudet maidossa olivat samana päivänä sitä vastoin hyvin pienet, mikä viittaa siihen, että obinututsumabi läpäisee istukan (ks. kohta Prekliiniset tiedot turvallisuudesta). Ei ole olemassa tietoja obinututsumabin käytöstä raskaana oleville naisille. Gazyvaroa ei pidä käyttää raskauden aikana, elleivät hoidon mahdolliset hyödyt ole sen mahdollisia riskejä suuremmat.
Raskauden aikana valmisteelle altistuneella imeväisellä voidaan olettaa olevan B-solupuutos valmisteen farmakologisten vaikutusten seurauksena. Jos äiti on raskauden aikana altistunut Gazyvarolle, pitää harkita, siirretäänkö syntyneen lapsen rokottamista eläviä taudinaiheuttajia sisältävillä rokotteilla siihen saakka, kunnes lapsen B-solumäärä on korjautunut normaaliksi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Imetys
Eläinkokeet ovat osoittaneet, että obinututsumabi erittyy maitoon (ks. kohta Prekliiniset tiedot turvallisuudesta).
Koska ihmisen immunoglobuliini G (IgG) erittyy ihmisen rintamaitoon ja saattaa imeytyä, lapselle aiheutuvaa haittaa ei tunneta. Naista pitää neuvoa lopettamaan imetys Gazyvaro-hoidon ajaksi ja 18 kuukauden ajaksi viimeisen Gazyvaro-annoksen jälkeen.
Hedelmällisyys
Obinututsumabin hedelmällisyyteen kohdistuvien vaikutusten tutkimiseksi ei ole tehty spesifisiä eläinkokeita. Cynomolgus-apinoilla tehdyissä toistuvan altistuksen aiheuttamaa toksisuutta selvittäneissä tutkimuksissa ei havaittu haitallisia vaikutuksia uroksen ja naaraan lisääntymiselimiin (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Gazyvarolla ei ole haitallista vaikutusta ajokykyyn ja koneiden käyttökykyyn. Infuusioon liittyvät reaktiot ovat hyvin yleisiä ensimmäisen Gazyvaro-infuusion aikana, joten jos potilaalle ilmaantuu infuusioon liittyviä oireita, häntä on kehotettava olemaan ajamatta autoa tai käyttämättä koneita siihen saakka, kunnes oireet häviävät.
Haittavaikutukset
Haittavaikutukset esitetään erikseen onkologian (krooninen lymfaattinen leukemia ja follikulaarinen lymfooma) ja lupusnefriitin käyttöaiheissa.
Krooninen lymfaattinen leukemia (KLL) ja follikulaarinen lymfooma (FL)
Turvallisuusprofiilin yhteenveto
Haittavaikutuksia on tunnistettu kolmessa kliinisessä pivotaalitutkimuksessa hidaskasvuisen non-Hodgkin-lymfooman, follikulaarinen lymfooma mukaan lukien, hoidon aloituksen, ylläpitohoidon ja seurannan aikana sekä kroonisen lymfaattisen leukemian hoidon ja seurannan aikana:
- BO21004/CLL11 (N = 781): aiemmin hoitamatonta kroonista lymfaattista leukemiaa sairastavia potilaita
- BO21223/GALLIUM (N = 1390): aiemmin hoitamatonta hidaskasvuista non-Hodgkin-lymfoomaa sairastavia potilaita (86 % potilaista sairasti follikulaarista lymfoomaa)
- GAO4753g/GADOLIN (N = 409): hidaskasvuista non-Hodgkin-lymfoomaa sairastavia potilaita (81 % potilaista sairasti follikulaarista lymfoomaa), jotka eivät saaneet vastetta rituksimabihoitoon tai rituksimabia sisältävään yhdistelmähoitoon tai joiden tauti eteni tällaisen hoidon aikana tai 6 kuukauden kuluessa tällaisen hoidon jälkeen.
Näissä tutkimuksissa tutkittiin Gazyvaroa yhdistelmänä klorambusiilin kanssa kroonisen lymfaattisen leukemian hoidossa sekä bendamustiinin, CHOP- ja CVP-hoidon kanssa ja sen jälkeen ylläpitohoitona annettua Gazyvaroa hidaskasvuisen non-Hodgkin-lymfooman hoidossa. Tutkimuksiin BO21223/GALLIUM ja GAO4753g/GADOLIN otettiin mukaan hidaskasvuista non-Hodgkin-lymfoomaa (iNHL), follikulaarinen lymfooma mukaan lukien, sairastavia potilaita. Seuraavassa esitetty haittavaikutusten analyysi on tehty koko tutkimuspotilasjoukosta (eli hidaskasvuista non-Hodgkin-lymfoomaa sairastavista potilaista), jotta turvallisuutta koskevat tiedot olisivat mahdollisimman kattavat.
Taulukossa 9 on yhteenveto kaikista haittavaikutuksista, mukaan lukien pivotaalitutkimuksissa (BO21004/CLL11, BO21223/GALLIUM ja GAO4753g/GADOLIN) esiintyneistä haittavaikutuksista, joiden ilmaantuvuus oli vähintään yhdessä pivotaalitutkimuksessa suurempi (ero ≥ 2 %) kuin oleellisessa vertailuryhmässä:
- kroonista lymfaattista leukemiaa sairastavat potilaat, jotka saivat Gazyvaron ja klorambusiilin yhdistelmää, verrattuna pelkkää klorambusiilia tai rituksimabin ja klorambusiilin yhdistelmää saaneisiin potilaisiin (tutkimus BO21004/CLL11)
- aiemmin hoitamatonta hidaskasvuista non-Hodgkin-lymfoomaa sairastavat potilaat, jotka saivat Gazyvaroa yhdistelmänä solunsalpaajahoidon (bendamustiini, CHOP, CVP) kanssa, jonka jälkeen vasteen saaneet potilaat saivat ylläpitohoitoon Gazyvaroa. Tätä hoitoa verrattiin rituksimabin ja solunsalpaajahoidon yhdistelmään, jonka jälkeen vasteen saaneet potilaat saivat ylläpitohoitoon rituksimabia (tutkimus BO21223/GALLIUM)
- hidaskasvuista non-Hodgkin-lymfoomaa sairastavat potilaat, jotka eivät saaneet vastetta tai joiden tauti eteni rituksimabihoidon tai rituksimabia sisältävän hoito-ohjelman aikana tai viimeistään 6 kuukautta tällaisen hoidon jälkeen ja jotka saivat Gazyvaron ja bendamustiinin yhdistelmää (jonka jälkeen osa potilaista sai Gazyvaroa ylläpitohoitona) verrattuna bendamustiinia yksinään saaneisiin potilaisiin (tutkimus GAO4753g/GADOLIN).
Taulukossa 9 mainitut ilmaantuvuudet (kaikki gradukset ja gradus 3–5) ovat missä tahansa näissä kolmessa tutkimuksessa suurin haittavaikutuksen raportoitu ilmaantuvuus.
Esiintymistiheydet on määritelty seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000) ja tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin). Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Haittavaikutustaulukko
Taulukko 9 Yhteenveto haittavaikutuksista Gazyvaron ja solunsalpaajahoidon* yhdistelmää saaneilla potilailla#
Elinjärjestelmä Esiintyvyys | Kaikki gradukset Gazyvaro + solunsalpaajahoito* (krooninen lymfaattinen leukemia, hidaskasvuinen non-Hodgkin-lymfooma), minkä jälkeen Gazyvaro-ylläpitohoito (hidaskasvuinen non-Hodgkin-lymfooma) | Gradus 3–5† Gazyvaro + solunsalpaajahoito* (krooninen lymfaattinen leukemia, hidaskasvuinen non-Hodgkin-lymfooma), minkä jälkeen Gazyvaro-ylläpitohoito (hidaskasvuinen non-Hodgkin-lymfooma) |
| Infektiot | ||
| Hyvin yleinen | Ylähengitysteiden infektio, sinuiitti§, virtsatieinfektio, keuhkokuume§, vyöruusu§, nasofaryngiitti | |
| Yleinen | Suun herpesinfektio, riniitti, faryngiitti, keuhkoinfektio, influenssa | Virtsatieinfektio, keuhkokuume, keuhkoinfektio, ylähengitysteiden infektio, sinuiitti, vyöruusu |
| Melko harvinainen | B-hepatiitin uudelleen aktivoituminen | Nasofaryngiitti, nuha, influenssa, huuliherpes |
| Hyvän- ja pahanlaatuiset kasvaimet (mukaan lukien kystat ja polyypit) | ||
| Yleinen | Ihon okasolusyöpä, tyvisolusyöpä | Ihon okasolusyöpä, tyvisolusyöpä |
| Veri ja imukudos | ||
| Hyvin yleinen | Neutropenia§, trombosytopenia, anemia, leukopenia | Neutropenia, trombosytopenia |
| Yleinen | Kuumeinen neutropenia | Anemia, leukopenia, kuumeinen neutropenia |
| Melko harvinainen | Yleistynyt suonensisäinen hyytyminen## | |
| Aineenvaihdunta ja ravitsemus | ||
| Yleinen | Tuumorilyysioireyhtymä, hyperurikemia, hypokalemia | Tuumorilyysioireyhtymä, hypokalemia |
| Melko harvinainen | Hyperurikemia | |
| Psyykkiset häiriöt | ||
| Hyvin yleinen | Unettomuus | |
| Yleinen | Masennus, ahdistus | |
| Melko harvinainen | Unettomuus, masennus, ahdistus | |
| Hermosto | ||
| Hyvin yleinen | Päänsärky | |
| Melko harvinainen | Päänsärky | |
| Tuntematon | Progressiivinen multifokaalinen leukoenkefalopatia | |
| Sydän | ||
| Yleinen | Eteisvärinä | Eteisvärinä |
| Verisuonisto | ||
| Yleinen | Hypertensio | Hypertensio |
| Hengityselimet, rintakehä ja välikarsina | ||
| Hyvin yleinen | Yskä§ | |
| Yleinen | Nenän tukkoisuus, voimakas nuha, suunielun kipu | |
| Melko harvinainen | Yskä, suunielun kipu | |
| Ruoansulatuselimistö | ||
| Hyvin yleinen | Ripuli, ummetus§ | |
| Yleinen | Dyspepsia, peräpukamat, maha-suolikanavan perforaatio | Ripuli |
| Melko harvinainen | Ummetus, peräpukamat | |
| Iho ja ihonalainen kudos | ||
| Hyvin yleinen | Alopesia, kutina | |
| Yleinen | Ekseema | |
| Melko harvinainen | Kutina | |
| Luusto, lihakset ja sidekudos | ||
| Hyvin yleinen | Nivelsärky§, selkäkipu, raajakipu | |
| Yleinen | Rintakehän muskuloskeletaalinen kipu, luukipu | Raajakipu |
| Melko harvinainen | Nivelsärky, selkäkipu, rintakehän muskuloskeletaalinen kipu, luukipu | |
| Munuaiset ja virtsatiet | ||
| Yleinen | Dysuria, virtsankarkailu | |
| Melko harvinainen | Dysuria, virtsankarkailu | |
| Yleisoireet ja antopaikassa todettavat haitat | ||
| Hyvin yleinen | Kuume, voimattomuus, uupumus | |
| Yleinen | Rintakehän kipu | Kuume, voimattomuus, uupumus |
| Melko harvinainen | Rintakehän kipu | |
| Immuunijärjestelmä | ||
| Harvinainen | Sytokiinioireyhtymä** | |
| Tutkimukset | ||
| Yleinen | Vähentynyt veren valkosolumäärä, vähentynyt neutrofiilimäärä, painon nousu | Vähentynyt veren valkosolumäärä, vähentynyt neutrofiilimäärä |
| Melko harvinainen | Hypogammaglobulinemia | |
| Vammat, myrkytykset ja hoitokomplikaatiot | ||
| Hyvin yleinen | Infuusioon liittyvät reaktiot | Infuusioon liittyvät reaktiot |
# Vain tutkimuksissa havaittu suurin esiintyvyys on raportoitu (perustuu tutkimuksiin BO21004/aiemmin hoitamatonta kroonista lymfaattista leukemiaa sairastavat potilaat, BO21223/aiemmin hoitamatonta edennyttä hidaskasvuista non-Hodgkin-lymfoomaa sairastavat potilaat ja GAO4753g/rituksimabihoitoon reagoimattomat hidaskasvuista non-Hodgkin-lymfoomaa sairastavat potilaat) ## Gazyvaroa saaneilla potilailla on kliinisissä tutkimuksissa ja myyntiluvan myöntämisen jälkeisessä seurannassa ilmoitettu yleistyneestä suonensisäisestä hyytymisestä (DIC), myös kuolemaan johtaneista tapahtumista (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) † Sellaisia gradus 5 haittavaikutuksia ei havaittu, joiden ilmaantuvuudessa olisi ollut ≥ 2 %:n ero hoitoryhmien välillä * Solunsalpaajahoito: kroonisen lymfaattisen leukemian hoitoon klorambusiili, hidaskasvuisen non-Hodgkin-lymfooman, follikulaarinen lymfooma mukaan lukien, hoitoon bendamustiini, CHOP, CVP § havaittu myös ylläpitohoidossa, jolloin ilmaantuvuus oli Gazyvaro-ryhmässä vähintään 2 % suurempi (BO21223) ** Perustuu altistukseen follikulaarista lymfoomaa ja kroonista lymfaattista leukemiaa koskevissa kliinisissä tutkimuksissa | ||
Follikulaarista lymfoomaa sairastavien potilaiden haittavaikutusprofiili oli kummassakin tutkimuksessa yhdenmukainen koko hidaskasvuista non-Hodgkin-lymfoomaa sairastavassa potilasjoukossa.
Valikoitujen haittavaikutusten kuvaus
Seuraavissa kohdissa mainitut hidaskasvuista non-Hodgkin-lymfoomaa koskevat ilmaantuvuudet ovat kummassa tahansa pivotaalitutkimuksessa (BO21223/GALLIUM, GAO4753g/GADOLIN) raportoitu haittavaikutuksen suurin ilmaantuvuus.
Tutkimus MO40597 oli suunniteltu kuvaamaan lyhytkestoisten infuusioiden (noin 90 minuuttia) turvallisuusprofiilia hoitosyklistä 2 alkaen potilaille, joilla oli aiemmin hoitamaton follikulaarinen lymfooma (ks. kohta Farmakodynamiikka).
Infuusioon liittyvät reaktiot
Yleisimmin raportoituja (≥ 5 %) infuusioon liittyvien reaktioiden yhteydessä esiintyneitä oireita olivat pahoinvointi, oksentelu, ripuli, päänsärky, heitehuimaus, uupumus, vilunväristykset, kuume, hypotensio, punastelu, hypertensio, takykardia, hengenahdistus ja epämukavat tuntemukset rintakehässä. Myös hengityselimiin liittyviä oireita, kuten bronkospasmia, kurkunpään ja nielun ärsytystä, hengityksen vinkumista, kurkunpään turvotusta, ja sydämeen liittyviä oireita, kuten eteisvärinää, on raportoitu (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Krooninen lymfaattinen leukemia
Infuusioon liittyvien reaktioiden ilmaantuvuus oli suurempi Gazyvaron ja klorambusiilin yhdistelmää saaneessa ryhmässä verrattuna rituksimabin ja klorambusiilin yhdistelmää saaneeseen ryhmään. Infuusioon liittyvien reaktioiden ilmaantuvuus oli ensimmäisen 1000 mg:n Gazyvaro-infuusion yhteydessä 66 % (20 %:lla potilaista esiintyi graduksen 3–4 infuusioon liittynyt reaktio). Kaikkiaan 7 %:lle potilaista ilmaantui infuusioon liittynyt reaktio, joka johti Gazyvaro-hoidon lopettamiseen. Infuusioon liittyvien reaktioiden ilmaantuvuus oli toisen 1000 mg:n annoksen infuusion yhteydessä 3 % ja sen jälkeen 1 %. Graduksen 3–5 infuusioon liittyviä reaktioita ei raportoitu enää hoitosyklissä 1 annetun ensimmäisen 1000 mg:n infuusion jälkeen.
Infuusioon liittyviä reaktioita estäviä toimenpiteitä kohdassa Annostus ja antotapa annettujen suositusten mukaisesti saaneilla potilailla havaittiin infuusioon liittyvien minkä tahansa graduksen reaktioiden esiintyvyyden vähenemistä. Infuusioon liittyvien gradus 3–4 reaktioiden (joita esiintyi suhteellisen harvalla potilaalla) määrä oli samankaltainen ennen reaktioita lieventävien toimenpiteiden käyttöä ja sen jälkeen.
Hidaskasvuinen non-Hodgkin-lymfooma, mukaan lukien follikulaarinen lymfooma
Infuusioon liittyviä gradus 3–4 reaktioita esiintyi 12 %:lla potilaista. Gazyvaron ja solunsalpaajahoidon yhdistelmää saaneilla potilailla oli infuusioon liittyvien reaktioiden kokonaisilmaantuvuus hoitosyklissä 1 suurempi kuin vertailuryhmässä. Infuusioon liittyvien reaktioiden ilmaantuvuus oli Gazyvaron ja solunsalpaajahoidon yhdistelmää saaneilla potilailla suurin päivänä 1, ja ne vähenivät asteittain seuraavien infuusioiden yhteydessä. Väheneminen jatkui edelleen pelkästään Gazyvarolla annetun ylläpitohoidon aikana. Hoitosyklin 1 jälkeisten infuusioiden yhteydessä infuusioon liittyvien reaktioiden ilmaantuvuus oli verrannollinen Gazyvaro-ryhmässä ja vastaavassa vertailuryhmässä. Kaikkiaan 4 %:lle potilaista ilmaantui Gazyvaro-hoidon lopettamiseen johtanut infuusioon liittynyt reaktio.
Lyhytkestoinen infuusio follikulaarista lymfoomaa sairastaville potilaille
Lyhytkestoisen infuusion turvallisuutta selvittäneessä tutkimuksessa MO40597 ilmeni hoitosyklissä 2 minkä tahansa graduksen infuusioon liittynyt reaktio suuremmassa potilasosuudessa verrattuna siihen potilasosuuteen, jolla tutkimuksessa BO21223 ilmeni hoitosyklissä 2 infuusioon liittynyt reaktio tavanomaisella antonopeudella (lyhytkestoisessa infuusiossa 10/99 [10,1%] vs. tavanomaisessa infuusiossa 23/529 [4,3%]; tutkijan mihin tahansa tutkimushoidon osaan liittämä infuusioon liittynyt reaktio). Tutkimuksessa MO40597 yhdelläkään potilaista ei esiintynyt hoitosyklissä 2 graduksen ≥ 3 infuusioon liittyneitä reaktioita lyhytkestoisen infuusion jälkeen; tutkimuksessa BO21223 529 potilaasta kolmella (0,6 %:lla) esiintyi hoitosyklissä 2 graduksen ≥ 3 infuusioon liittynyt reaktio. Infuusioon liittyvien reaktioiden oireet ja löydökset olivat molemmissa tutkimuksissa samankaltaiset. Taulukossa 10 esitetään yhteenveto tutkimuksessa MO40597/GAZELLE havaituista infuusioon liittyneistä reaktioista.
Taulukko 10 Tutkimus MO40597/GAZELLE, lyhytkestoinen infuusio: Infuusioon liittyneet reaktiota hoitosykleittäin (tutkimuspopulaatio, josta turvallisuus voitiin arvioida)
| CTCAE gradus | C1 yhteensä (tavanomainen infuusio) | C1b hoitopäivittäin | C2C | C3 | C4 | C5 | C6 | C7 | Kaikkien induktiosyklien aikana yhteensä | |||
| Päivä 1 | Päivä 2d | Päivä 8 | Päivä 15 | |||||||||
| Kaikki gradukset | 65/113 (57,5 %) | 57/113 (50,4 %) | 4/51 (7,8 %) | 6/112 (5,4 %) | 5/111 (4,5 %) | 13/110 (11,8 %) | 9/108 (8,3 %) | 7/108 (6,5 %) | 6/107 (5,6 %) | 5/105 (4,8 %) | 2/55 (3,6 %) | 71/113 (62,8 %) |
| Gradus ≥ 3 | 6/113 (5,3 %) | 5/113 (4,4 %) | 1/51 (2,0 %) | 0 | 0 | 0 | 0 | 0 | 1/107 (0,9 %) | 0 | 0 | 7/113 (6,2 %) |
C = hoitosykli; CTCAE = Common Terminology Criteria for Adverse Events
a Infuusioon liittyvän reaktion määriteltiin olevan mikä tahansa tapahtuma, joka esiintyi tutkimushoidon annon aikana tai 24 tunnin kuluessa sen jälkeen, ja jonka tutkija oli arvioinut liittyvän mihin tahansa hoidon osaan
b Hoitosykli 1 (C1) koostui kolmesta tavanomaisella nopeudella annetusta infuusiosta, jotka annettiin viikon välein
c Potilaat saivat lyhytkestoisia infuusioita hoitosyklistä 2 (C2) lähtien. Hoitosyklin 2 ja sitä myöhempien syklien nimittäjä kuvaa niiden potilaiden määrää, jotka saivat lyhytkestoisia infuusioita kyseisen syklin aikana.
d Potilaat, joita hoidettiin bendamustiinilla hoitosyklin 1 päivänä 2.
Neutropenia ja infektiot
Krooninen lymfaattinen leukemia
Neutropenian ilmaantuvuus oli suurempi Gazyvaron ja klorambusiilin yhdistelmää saaneessa ryhmässä (41 %) verrattuna rituksimabia ja klorambusiilia yhdistelmänä saaneeseen ryhmään, ja neutropenia korjaantui itsestään tai granulosyyttiryhmiä stimuloivien tekijöiden käytön avulla. Infektioiden ilmaantuvuus oli Gazyvaron ja klorambusiilin yhdistelmää saaneessa ryhmässä 38 % ja rituksimabin ja klorambusiilin yhdistelmää saaneessa ryhmässä 37 % (graduksen 3–5 tapahtumia ilmoitettiin Gazyvaron ja klorambusiilin yhdistelmää saaneessa ryhmässä 12 %:lla potilaista ja rituksimabin ja klorambusiilin yhdistelmää saaneessa ryhmässä 14 %:lla potilaista; kuolemaan johtaneita tapahtumia raportoitiin kummassakin hoitoryhmässä < 1 %:lla potilaista). Myös pitkittynyttä neutropeniaa (2 %:lla Gazyvaron ja klorambusiilin yhdistelmää saaneessa ryhmässä ja 4 %:lla rituksimabin ja klorambusiilin yhdistelmää saaneessa ryhmässä) ja myöhään ilmaantunutta neutropeniaa (16 %:lla Gazyvaron ja klorambusiilin yhdistelmää saaneessa ryhmässä ja 12 %:lla rituksimabin ja klorambusiilin yhdistelmää saaneessa ryhmässä) raportoitiin (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Hidaskasvuinen non-Hodgkin-lymfooma, mukaan lukien follikulaarinen lymfooma
Gradus 1–4 neutropenian ilmaantuvuus oli suurempi (50 %) Gazyvaron ja solunsalpaajahoidon yhdistelmää saaneessa ryhmässä kuin vertailuryhmässä, ja riski oli tavanomaista suurempi hoidon induktiovaiheessa. Pitkäkestoisen neutropenian ilmaantuvuus oli 3 %, ja viivästyneen neutropenian ilmaantuvuus oli 8 %. Infektioiden ilmaantuvuus oli 81 % Gazyvaron ja solunsalpaajahoidon yhdistelmää saaneessa ryhmässä (gradus 3–5 tapahtumia raportoitiin 22 %:lla potilaista). Kuolemaan johtaneita tapahtumia raportoitiin 3 %:lla potilaista. Gradus 3–5 infektioiden esiintyvyys oli pienempi potilailla, jotka saivat estohoitona granulosyyttiryhmiä stimuloivia kasvutekijöitä (G-CSF) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Lyhytkestoinen infuusio follikulaarista lymfoomaa sairastaville potilaille
Lyhytkestoisen infuusion turvallisuutta selvittäneessä tutkimuksessa MO40597 ilmoitettiin haittatapahtumana neutropeniaa suuremmassa potilasosuudessa verrattuna tutkimukseen BO21223, jossa potilaat saivat kestoltaan tavanomaisia infuusioita (koko induktiovaiheen aikana 69 potilaalla 113:sta [61,1 %:lla] tutkimuksessa MO40597 vs. 247 potilaalla 595:stä [41,5 %:lla] tutkimuksessa BO21223). Neutrofiiliarvon mediaani ja vaihteluväli olivat molemmissa tutkimuksissa kaikissa aikapisteissä samankaltaiset. Kuumeista neutropeniaa ilmoitettiin samankaltaisilla potilasosuuksilla tutkimuksissa MO40597 ja BO21223 (6 potilaalla 113:sta [5,3 %:lla] tutkimuksessa MO40597 vs. 31 potilaalla 595:stä [5,2 %:lla] tutkimuksessa BO21223). Infektioita ilmoitettiin harvemmin tutkimuksessa MO40597 kuin tutkimuksessa BO21223 (45 potilaalla 113:sta [39,8 %:lla] tutkimuksessa MO40597 vs. 284 potilaalla 595:stä [47,7 %:lla] tutkimuksessa BO21223).
Trombosytopenia ja verenvuototapahtumat
Krooninen lymfaattinen leukemia
Trombosytopenian ilmaantuvuus oli varsinkin ensimmäisen hoitosyklin aikana suurempi Gazyvaron ja klorambusiilin yhdistelmää saaneessa ryhmässä (16 %) verrattuna rituksimabin ja klorambusiilin yhdistelmää saaneeseen ryhmään (7 %). Neljällä prosentilla Gazyvaron ja klorambusiilin yhdistelmää saaneista potilaista esiintyi akuuttia trombosytopeniaa (ilmaantui 24 tunnin kuluessa Gazyvaro-infuusion jälkeen) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Verenvuototapahtumien kokonaisilmaantuvuus oli samankaltainen Gazyvaro-hoitoa ja rituksimabihoitoa saaneissa ryhmissä. Kuolemaan johtaneiden verenvuototapahtumien lukumäärä oli tasapainossa hoitoryhmien välillä, mutta kaikki tapahtumat Gazyvaro-hoitoa saaneilla potilailla raportoitiin hoitosyklissä 1. Gradus 5 trombosytopeniatapauksia ei raportoitu. Trombosytopenian ja verenvuotojen välillä ei ole varmistettu selvää yhteyttä.
Hidaskasvuinen non-Hodgkin-lymfooma, mukaan lukien follikulaarinen lymfooma
Trombosytopenian ilmaantuvuus oli 15 %. Trombosytopeniaa esiintyi Gazyvaron ja solunsalpaajahoidon yhdistelmää saaneessa ryhmässä useammin hoitosyklissä 1. Infuusion aikana tai 24 tunnin kuluessa infuusion päättymisestä ilmaantunut trombosytopenia (akuutti trombosytopenia) oli yleisempää Gazyvaron ja solunsalpaajahoidon yhdistelmää saaneessa ryhmässä kuin vertailuryhmässä. Verenvuototapahtumien ilmaantuvuus oli kaikissa hoitoryhmissä samankaltainen. Verenvuototapahtumia esiintyi 12 %:lla potilaista, ja gradus 3–5 verenvuototapahtumia esiintyi 4 %:lla potilaista. Kuolemaan johtaneita verenvuotoja esiintyi alle 1 %:lla potilaista, mutta yksikään kuolemaan johtaneista haittatapahtumista ei tapahtunut hoitosyklissä 1.
Lyhytkestoinen infuusio follikulaarista lymfoomaa sairastaville potilaille
Lyhytkestoisen infuusion turvallisuutta selvittäneessä tutkimuksessa MO40597 ilmoitettiin trombosytopeniaa haittatapahtumana suuremmassa potilasosuudessa kuin tutkimuksessa BO21223, jossa potilaat saivat kestoltaan tavanomaisia infuusioita (koko induktiovaiheen aikana 21 potilaalla 113:sta [28,6 %:lla] tutkimuksessa MO40597 vs. 63 potilaalla 595:stä [10,6 %:lla] tutkimuksessa BO21223). Verihiutalearvon mediaani ja vaihteluväli olivat molemmissa tutkimuksissa samankaltaiset kaikissa aikapisteissä. Yhteenkään tutkimuksessa MO40597 ilmoitetuista trombosytopeniatapahtumista ei liittynyt verenvuotoa.
Lupusnefriitti
Turvallisuusprofiilin yhteenveto
Lumekontrolloitujen tutkimusten yhdistetyissä tiedoissa 200:lla lupusnefriittiä sairastavalla potilaalla, jotka saivat Gazyvaro-hoitoa, yleisimmin havaitut haittavaikutukset olivat ylähengitysteiden infektio (29 %), COVID-19-koronavirusinfektio (22,5 %) ja virtsatieinfektio (21 %).
Haittavaikutustaulukko
Taulukossa 11 luetellut haittavaikutukset perustuvat yhdistettyihin turvallisuustietoihin, jotka on saatu kahdesta kliinisestä tutkimuksesta. Niihin osallistuneilla potilailla oli ISN/RPS 2003 -luokituksen luokan III tai IV ja mahdollisesti samanaikainen luokan V lupusnefriitti. Tiedot ulottuvat viikkoon 76 asti.
- REGENCY (CA41705): vaiheen III tutkimus, johon osallistui 136 potilasta; potilaat saivat Gazyvaro-hoitoa yhdistelmänä tavanomaisen hoidon kanssa, joka koostui mykofenolaattimofetiilista (MMF) ja kortikosteroideista.
- NOBILITY (WA29748): vaiheen II tutkimus, johon osallistui 64 potilasta; potilaat saivat Gazyvaro-hoitoa yhdistelmänä tavanomaisen hoidon kanssa, joka koostui mykofenolaattimofetiilista/mykofenolihaposta ja kortikosteroideista.
Esiintymistiheydet on määritelty seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000) ja tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin). Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Taulukko 11 Gazyvaro-valmistetta + tavanomaista hoitoa* saaneilla lupusnefriittiä sairastavilla potilailla raportoidut haittavaikutukset
Elinjärjestelmä Esiintyvyys | Kaikki gradukset | Gradus3–5 |
| Infektiot | ||
| Hyvin yleinen | Ylähengitysteiden infektio, COVID-19-koronavirusinfektio, virtsatieinfektio, keuhkoputkitulehdus | |
| Yleinen | Keuhkokuume, herpes simplex -infektio | COVID-19-koronavirusinfektio, virtsatieinfektio, keuhkokuume |
| Vammat, myrkytykset ja hoitokomplikaatiot | ||
| Hyvin yleinen | Infuusioon liittyvä reaktio | |
| Yleinen | Infuusioon liittyvä reaktio | |
| Veri ja imukudos | ||
| Hyvin yleinen | Neutropenia | |
| Yleinen | Neutropenia | |
| Tutkimukset | ||
| Hyvin yleinen | Veren immunoglobuliini M -pitoisuuden pieneneminen** | |
* mykofenolaattimofetiili (MMF) ja kortikosteroidit
** Esiintyvyysluokka perustuu laboratorioarvoihin, jotka on mitattu kliinisten tutkimusten rutiininomaisen laboratorioseurannan yhteydessä.
Valikoitujen haittavaikutusten kuvaus
Infektiot
Infektioita raportoitiin 72,0 %:lla Gazyvaro-ryhmän potilaista ja 61,7 %:lla lumelääkeryhmän potilaista. Yleisimmin raportoituja infektioita olivat ylä- ja alahengitysteiden infektiot. Graduksen 3–5 infektiotapahtumia raportoitiin 11,5 %:lla Gazyvaro-ryhmän potilaista ja 9,8 %:lla lumelääkeryhmän potilaista. Kuolemaan johtaneita infektiotapahtumia raportoitiin 1 %:lla Gazyvaro-ryhmän potilaista ja 0,5 %:lla lumelääkeryhmän potilaista (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Neutropenia
Neutropeniaa ja siihen liittyviä tapahtumia raportoitiin 14,0 %:lla Gazyvaro-ryhmän potilaista ja 6,2 %:lla lumelääkeryhmän potilaista. Gradusten 3–4 neutropeniaa raportoitiin 7 %:lla Gazyvaro-ryhmän potilaista ja 0,5 %:lla lumelääkeryhmän potilaista. Neutropenia ja siihen liittyvät tapahtumat korjautuivat/lievittyivät useimmiten itsestään tai granulosyyttiryhmiä stimuloivien kasvutekijöiden käytön avulla (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Infuusioon liittyvät reaktiot
Infuusioon liittyviä reaktioita raportoitiin 13,5 %:lla Gazyvaro-ryhmän potilaista ja 10,4 %:lla lumelääkeryhmän potilaista. Infuusioon liittyvät reaktiot olivat molemmissa ryhmissä pääasiassa gradusten 1–2 reaktioita, ja ne ilmenivät ensimmäisen infuusion aikana tai sen jälkeen. Gradusten 3–4 infuusioon liittyviä reaktioita raportoitiin 1,5 %:lla Gazyvaro-ryhmän potilaista ja 0,5 %:lla lumelääkeryhmän potilaista. Kaikki gradusten 3–4 tapahtumat ilmenivät joko ensimmäisen tai toisen infuusion aikana tai jälkeen. Infuusioon liittyvien reaktioiden ilmaantuvuus ja vaikeusaste vähenivät seuraavien infuusioiden yhteydessä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
REGENCY-tutkimuksessa yleisimpiä infuusioon liittyvän reaktion oireita/löydöksiä olivat päänsärky, pahoinvointi ja oksentelu. NOBILITY-tutkimuksessa yleisimpiä infuusioon liittyvän reaktion oireita olivat kuume ja takykardia.
Erityispotilasryhmät
Iäkkäät potilaat
Krooninen lymfaattinen leukemia
Pivotaalitutkimuksessa BO21004/CLL11 46 % (156 potilasta 336 potilaasta) Gazyvaron ja klorambusiilin yhdistelmää kroonisen lymfaattisen leukemian hoitoon saaneista potilaista oli 75-vuotiaita tai vanhempia (iän mediaani oli 74 vuotta). Tässä potilasryhmässä esiintyi enemmän vakavia haittatapahtumia ja kuolemaan johtaneita haittatapahtumia kuin < 75-vuotiaiden potilaiden ryhmässä.
Hidaskasvuinen non-Hodgkin-lymfooma, mukaan lukien follikulaarinen lymfooma
Hidaskasvuista non-Hodgkin-lymfoomaa koskeneissa pivotaalitutkimuksissa (BO21223/GALLIUM, GAO4753g/GADOLIN) 65-vuotiailla ja vanhemmilla potilailla esiintyneet haittatapahtumat olivat vakavampia ja johtivat useammin hoidon keskeyttämiseen tai potilaan kuolemaan kuin < 65-vuotiailla.
Munuaisten vajaatoiminta
Krooninen lymfaattinen leukemia
Pivotaalitutkimuksessa BO21004/CLL11 27 %:lla (90 potilasta 336 potilaasta) Gazyvaron ja klorambusiilin yhdistelmää saaneista potilaista oli keskivaikea munuaisten vajaatoiminta (CrCl < 50 ml/min). Tässä potilasryhmässä esiintyi enemmän vakavia haittatapahtumia ja kuolemaan johtaneita haittatapahtumia kuin potilailla, joiden CrCl oli ≥ 50 ml/min (ks. kohdat Annostus ja antotapa, Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka). Potilaita, joiden CrCl oli < 30 ml/min, ei otettu mukaan tutkimukseen (ks. kohta Farmakodynamiikka).
Hidaskasvuinen non-Hodgkin-lymfooma, mukaan lukien follikulaarinen lymfooma
Hidaskasvuista non-Hodgkin-lymfoomaa koskeneissa pivotaalitutkimuksissa (BO21223/GALLIUM, GAO4753g/GADOLIN) 5 %:lla (35 potilaalla 698 potilaasta tutkimuksessa BO21223/GALLIUM) ja 7 %:lla (14 potilaalla 204 potilaasta tutkimuksessa GAO4753g/GADOLIN) Gazyvaroa saaneista potilaista oli keskivaikeaa munuaisten vajaatoimintaa (CrCl < 50 ml/min). Näillä potilailla esiintyi enemmän vakavia, gradusten 3–5 haittavaikutuksia ja hoidon keskeyttämiseen (vain BO21223-tutkimuksen potilaat) johtaneita haittavaikutuksia kuin potilailla, joiden CrCl oli ≥ 50 ml/min (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka). Potilaita, joiden CrCl oli < 40 ml/min, ei otettu mukaan tutkimuksiin (ks. kohta Farmakodynamiikka).
Lupusnefriitti
Gazyvaro-valmistetta koskeva populaatiofarmakokineettinen analyysi (n = 196) osoitti, ettei kreatiniinipuhdistuma vaikuta obinututsumabin farmakokinetiikkaan lupusnefriittiä sairastavilla potilailla. Obinututsumabin farmakokinetiikka oli lievää (kreatiniinipuhdistuma (CrCl) 60 – < 90 ml/min, n = 45) tai keskivaikeaa (kreatiniinipuhdistuma (CrCl) 30 – < 60 ml/min, n = 17) munuaisten vajaatoimintaa sairastavilla potilailla samankaltainen kuin potilailla, joiden munuaisten toiminta oli normaali. Gazyvaro-valmisteen turvallisuutta ja tehoa vaikeaa munuaisten vajaatoimintaa sairastavien potilaiden hoidossa ei ole varsinaisesti tutkittu.
Kliinisistä tutkimuksista saatuun kokemukseen perustuvat lisätiedot turvallisuudesta
Aiemmin kehittyneiden sydänsairauksien paheneminen
Kroonista lymfaattista leukemiaa ja non-Hodgkin-lymfoomaa sairastavien potilaiden Gazyvaro-hoidon aikana on esiintynyt sydämen rytmihäiriöitä (kuten eteisvärinää ja takyarytmioita), angina pectorista, akuuttia sepelvaltimo-oireyhtymää, sydäninfarkteja ja sydämen vajaatoimintaa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Tällaisia tapahtumia voi esiintyä osana infuusioon liittyvää reaktiota ja ne voivat johtaa kuolemaan.
Laboratorioarvojen poikkeavuudet
Kroonista lymfaattista leukemiaa sairastavilla potilailla on pian ensimmäisen Gazyvaro-infuusion jälkeen havaittu ohimenevästi kohonneita maksaentsyymiarvoja (aspartaattiaminotransferaasi [ASAT], alaniiniaminotransferaasi [ALAT], alkalinen fosfataasi).
Lumekontrolloiduista tutkimuksista saaduissa yhdistetyissä lupusnefriittiä koskevissa tiedoissa obinututsumabista aiheutui immunoglobuliinien kokonaismäärän pieneneminen, mikä johtui pääasiassa IgM-pitoisuuden pienenemisestä.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Ihmisellä tehdyistä kliinisistä tutkimuksista ei ole kokemusta yliannoksesta. Gazyvarolla tehdyissä kliinisissä tutkimuksissa annetut annokset ovat olleet pienimmillään 50 mg ja enimmillään 2 000 mg per infuusio. Näissä tutkimuksissa raportoitujen haittavaikutusten ilmaantuvuus ja vaikeusaste eivät vaikuttaneet olevan annosriippuvaisia.
Jos potilas saa yliannoksen, infuusion anto on heti keskeytettävä tai infuusiota hidastettava, ja potilasta on seurattava tarkoin. Verenkuvan ja lisääntyneen infektioriskin säännöllisen seurannan tarvetta potilaan B-solupuutoksen aikana on harkittava.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: solunsalpaajat, monoklonaaliset vasta-aineet,
ATC-koodi: L01FA03
Vaikutusmekanismi
Obinututsumabi on rekombinantti monoklonaalinen humanisoitu ja glykomodifioitu tyypin II IgG1-isotyypin anti-CD20‑vasta-aine. Se tunnistaa spesifisesti CD20-transmembraaniproteiinin antigeenin solunulkoisen silmukan, joka esiintyy sekä malignien että ei-malignien pre-B-lymfosyyttien ja kypsien B-lymfosyyttien pinnalla. CD20-transmembraaniproteiinin antigeeniä ei ilmennetä hematopoieettisissa kantasoluissa, pro-B-soluissa, normaaleissa plasmasoluissa, eikä muissa normaaleissa kudoksissa. Obinututsumabin FC-osan glykomodifikaatio antaa sille korkeamman affiniteetin immuuniefektorisolujen FcɣRIII- reseptoriin verrattuna glykomodifioimattomaan vasta-aineeseen. Immuuniefektorisoluja ovat mm. luonnolliset tappajasolut, makrofagit ja monosyytit.
Obinututsumabin on osoitettu indusoivan nonkliinisissä tutkimuksissa suoraa solukuolemaa sekä välittävän vasta-aineriippuvaista soluvälitteistä solutuhoa (antibody dependent cellular cytotoxicity, ADCC) ja vasta-aineriippuvaista solujen fagosytoosia (antibody dependent cellular phagocytosis, ADCP) rekrytoimalla FcɣRIII-positiivisia immuuniefektorisoluja. Obinututsumabi välittää lisäksi in vivo vähäisessä määrin komplementtivälitteistä solutuhoa (complement dependent cytotoxicity, CDC). Tyypin II vasta-aineena obinututsumabi indusoi enemmän suoraa solukuolemaa ja vähemmän komplementtivälitteistä sytotoksisuutta kuin tyypin I vasta-aineet, jos niitä verrataan samanlaisilla annoksilla toisiinsa. Glykomodifikaatio lisää obinututsumabin välittämää vasta-aineriippuvaista soluvälitteistä solutuhoa ja fagosytoosia verrattuna glykomodifioimattomiin vasta-aineisiin vastaavalla annoksella. Eläinmalleissa obinututsumabi välittää tehokasta B-solujen hajoamista ja kasvaimen kasvua ehkäisevää vaikutusta.
Kliinisessä rekisteröintitutkimuksessa, johon osallistui kroonista lymfaattista leukemiaa sairastavia potilaita (BO21004/CLL11), arvioitavissa olleista Gazyvaro-hoitoa saaneista potilaista 91 %:lla (40 potilaalla 44 potilaasta) oli merkittävästi alentuneet B-solutasot (B-solujen [CD19+] määrä < 0,07 x 109/l) hoitojakson päättyessä, ja B-solujen määrät pysyivät alhaalla seurantajakson ensimmäisten 6 kuukauden ajan. B-solujen määrän havaittiin korjaantuvan seurantajakson aikana 12–18 kuukauden kuluessa 35 %:lla potilaista (14 potilaalla 40 potilaasta) ilman taudin etenemistä ja 13 %:lla potilaista (5 potilaalla 40 potilaasta), joilla tauti eteni.
Kliinisessä rekisteröintitutkimuksessa, johon osallistui hidaskasvuista non-Hodgkin-lymfoomaa sairastavia potilaita, (GAO4753/GADOLIN), arvioitavissa olleista Gazyvaro-hoitoa saaneista potilaista 97 %:lla (171 potilaalla 176 potilaasta) oli merkittävästi alentuneet B-solutasot hoitojakson päättyessä, ja 97 %:lla (61 potilaalla 63 potilaasta) B-solujen määrät pysyivät alhaalla pitempään kuin 6 kuukautta viimeisen annoksen jälkeen. B-solujen määrän havaittiin korjaantuvan seurantajakson aikana 12–18 kuukauden kuluessa 11 %:lla tutkittavana olevista potilaista (5 potilaalla 46 potilaasta).
Kliinisessä rekisteröintitutkimuksessa, johon osallistui lupusnefriittiä sairastavia potilaita (CA41705/REGENCY), arvioitavissa olleista Gazyvaro-hoitoa saaneista potilaista 99,2 %:lla (127 potilaalla 128 potilaasta) oli merkittävästi alentuneet B-solutasot (jonka määritelmä oli B-solujen [CD19+] määrä < 10 solua/mikrol) viikolla 4 ja 95 %:lla (117 potilaalla 123 potilaasta) oli merkittävästi alentuneet B-solutasot viikolla 76. Naiivien B-solujen, muisti-B-solujen ja plasman blastien / plasmasolujen määrien havaittiin vähentyneen verenkierrossa viikolla 4, ja ne säilyivät vähäisinä viikolle 76 asti hoidon aloittamisen jälkeen.
Kliininen teho ja turvallisuus
Krooninen lymfaattinen leukemia
Kansainvälisessä, avoimessa, satunnaistetussa, vaiheen III, kahden hoitovaiheen, kolmen hoitohaaran kliinisessä monikeskustutkimuksessa (BO21004/CLL11) selvitettiin Gazyvaron ja klorambusiilin yhdistelmän (GClb) tehoa ja turvallisuutta verrattuna rituksimabin ja klorambusiilin yhdistelmään (RClb) tai yksinään käytettyyn klorambusiiliin (Clb) aiemmin hoitamattomien kroonista lymfaattista leukemiaa (KLL) sairastavilla potilailla, joilla oli liitännäissairauksia.
Potilailla tuli olla dokumentoitu CD20-positiivinen KLL ja yksi tai kumpikin seuraavista liitännäissairauksien mittareista: liitännäissairauden pisteytys (CIRS) yli 6 tai alentunut munuaisten toiminta, mitattuna CrCl < 70 ml/min. Potilaita, joilla oli riittämätön maksan toiminta (National Cancer Institute – Common Terminology Criteria -kriteerit maksan toimintakokeiden graduksen 3 haittavaikutuksille (ASAT, ALAT > 5 x viitearvojen yläraja [ULN] > 2 viikon ajan; bilirubiini > 3 x viitearvojen yläraja [ULN]) ja munuaisten toiminta (CrCl < 30 ml/min), ei otettu mukaan tutkimukseen. Potilaita, joilla yhden tai useamman elimen/elinjärjestelmän heikkenemistä osoittavat CIRS-pisteet olivat 4, lukuun ottamatta silmiä, korvia, nenää, nielua ja kurkunpäätä, ei otettu mukaan tutkimukseen.
Yhteensä 781 potilasta satunnaistettiin saamaan Gazyvaron ja klorambusiilin yhdistelmää, rituksimabin ja klorambusiilin yhdistelmää tai klorambusiilia yksinään suhteessa 2:2:1. Tutkimuksen vaiheessa 1a Gazyvaron ja klorambusiilin yhdistelmää verrattiin 356 potilaalla klorambusiiliin yksinään käytettynä, ja vaiheessa 2 Gazyvaron ja klorambusiilin yhdistelmää verrattiin 663 potilaalla rituksimabin ja klorambusiilin yhdistelmään.
Gazyvaro annettiin suurimmalle osalle potilaista 1000 mg:n aloitusannoksena laskimoon ensimmäisen hoitosyklin päivänä 1, päivänä 8 ja päivänä 15. Tätä hoito-ohjelmaa muutettiin potilailla esiintyvien infuusioon liittyvien reaktioiden vähentämiseksi, jolloin 140 potilasta sai ensimmäisen Gazyvaro-annoksen kahdelle päivälle jaettuna (päivänä 1 [100 mg] ja päivänä 2 [900 mg]) (ks. kohta Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet). Seuraavissa hoitosykleissä (hoitosyklit 2–6) potilaat saivat aina 1000 mg Gazyvaroa päivänä 1. Klorambusiili annettiin suun kautta painonmukaisena annoksena 0,5 mg/kg jokaisen hoitosyklin (1–6) päivänä 1 ja päivänä 15.
Potilaiden demografiset tiedot ja lähtötilanteen ominaisuudet olivat hyvin tasapainossa hoitohaarojen välillä. Suurin osa potilaista oli valkoihoisia (95 %) ja miehiä (61 %). Iän mediaani oli 73 vuotta, ja 44 % potilaista oli 75-vuotiaita tai vanhempia. Lähtötilanteessa potilaista 22 %:n Binet'n luokitus oli aste A, 42 %:n Binet'n luokitus oli aste B ja 36 %:n Binet'n luokitus oli aste C.
Samanaikaisten sairauksien pisteiden mediaani oli 8, ja 76 %:lla tutkimukseen mukaan otetuista potilaista samanaikaisten sairauksien pisteet olivat yli 6. Arvioidun CrCl:n mediaani oli 62 ml/min ja 66 %:lla kaikista potilaista CrCl oli < 70 ml/min. Neljälläkymmenelläkahdella prosentilla tutkimukseen mukaan otetuista potilaista CrCl oli < 70 ml/min ja samanaikaisten sairauksien pisteet olivat > 6. Kolmellakymmenelläneljällä prosentilla tutkimukseen mukaan otetuista potilaista oli ainoastaan samanaikaisen sairauden pisteitä, ja 23 %:lla tutkimukseen mukaan otetuista potilaista oli ainoastaan heikentyneen munuaisten toiminnan pisteitä.
Yleisimmin raportoituja MedDRA-elinjärjestelmäluokituksen mukaisia samanaikaisia sairauksia (raja-arvo 30 % tai enemmän) ovat: verisuoniston sairaudet (73 %), sydänsairaudet (46 %), ruoansulatuselimistön sairaudet (38 %), aineenvaihdunnan ja ravitsemuksen häiriöt (40 %), munuaisten ja virtsateiden sairaudet (38 %), luuston, lihasten ja sidekudoksen sairaudet (33 %).
Yhteenveto tehoa koskevista tuloksista aiemmin hoitamatonta kroonista lymfaattista leukemiaa sairastavilla potilailla esitetään taulukossa 12. Etenemisvapaan elinajan ja kokonaiselossaolon Kaplan-Meier-kuvaaja esitetään kuvissa 1–4.
Taulukko 12Tutkimuksen BO21004/CLL11 tehon yhteenveto
| Vaihe 1a | Vaihe 2 | |||
Klorambusiili N = 118 | Gazyvaro + klorambusiili N = 238 | Rituksimabi + klorambusiili N = 330 | Gazyvaro + klorambusiili N = 333 | |
| Havainnointiajan mediaani 22,8 kuukautta g | Havainnointiajan mediaani 18,7 kuukautta g | |||
| Ensisijainen päätetapahtuma | ||||
| Tutkijan arvioima etenemisvapaa elinaika (PFS-INV)a | ||||
| Potilaiden lukumäärä (%), joilla esiintyi tapahtuma | 96 (81,4 %) | 93 (39,1 %) | 199 (60,3 %) | 104 (31,2 %) |
| Mediaaniaika tapahtumaan (kuukautta) | 11,1 | 26,7 | 15,2 | 26,7 |
| Riskisuhde (95 %:n luottamusväli) | 0,18 [0,13, 0,24] | 0,39 [0,31, 0,49] | ||
| p-arvo (Log-rank-testi, ositettub) | < 0,0001 | < 0,0001 | ||
| Keskeiset toissijaiset päätetapahtumat | ||||
| Riippumattoman arviointitoimikunnan arvioima etenemisvapaa elinaika (PFS-IRC)a | ||||
| Potilaiden lukumäärä (%), joilla esiintyi tapahtuma | 90 (76,3 %) | 89 (37,4 %) | 183 (55,5 %) | 103 (30,9 %) |
| Mediaaniaika tapahtumaan (kuukautta) | 11,2 | 27,2 | 14,9 | 26,7 |
| Riskisuhde (95 %:n luottamusväli) | 0,19 [0,14, 0,27] | 0,42 [0,33, 0,54] | ||
| p-arvo (Log-rank-testi, ositettub) | < 0,0001 | < 0,0001 | ||
| Vasteluku hoidon päättyessä | ||||
| Analyysissa mukana olleiden potilaiden lukumäärä | 118 | 238 | 329 | 333 |
| Vasteen saaneet (%) | 37 (31,4 %) | 184 (77,3 %) | 214 (65,0 %) | 261 (78,4 %) |
| Ei vastetta saaneet (%) | 81 (68,6 %) | 54 (22,7 %) | 115 (35,0 %) | 72 (21,6 %) |
| Vasteluvun ero (95 %:n luottamusväli) | 45,95 [35,6, 56,3] | 13,33 [6,4, 20,3] | ||
| p-arvo (khii2-testi) | < 0,0001 | 0,0001 | ||
| Täydellisen vasteen saaneiden lukumääräc (%) | 0 (0,0 %) | 53 (22,3 %) | 23 (7,0 %) | 69 (20,7 %) |
| Molekulaarinen remissio hoidon päättyessäd | ||||
| Analyysissa mukana olleiden potilaiden lukumäärä | 90 | 168 | 244 | 239 |
| MRD-negatiivisete (%) | 0 (0 %) | 45 (26,8 %) | 6 (2,5 %) | 61 (25,5 %) |
| MRD-positiivisetf (%) | 90 (100 %) | 123 (73,2 %) | 238 (97,5 %) | 178 (74,5 %) |
| MRD-luvun ero (95 %:n luottamusväli) | 26,79 [19,5, 34,1] | 23,06 [17,0, 29,1] | ||
| Tapahtumavapaa elinaika | ||||
| Potilaiden lukumäärä (%), joilla esiintyi tapahtuma | 103 (87,3 %) | 104 (43,7 %) | 208 (63,0 %) | 118 (35,4 %) |
| Ajan mediaani tapahtumaan (kuukautta) | 10,8 | 26,1 | 14,3 | 26,1 |
| Riskisuhde (95 %:n luottamusväli) | 0,19 [0,14, 0,25] | 0,43 [0,34, 0,54] | ||
| p-arvo (Log-rank-testi, ositettub) | < 0,0001 | < 0,0001 | ||
| Aika uuteen leukemiahoitoon | ||||
| Potilaiden lukumäärä (%), joilla esiintyi tapahtuma | 65 (55,1 %) | 51 (21,4 %) | 86 (26,1 %) | 55 (16,5 %) |
| Mediaaniaika tapahtumaan (kuukautta) | 14,8 | NR | 30,8 | NR |
| Riskisuhde (95 %:n luottamusväli) | 0,24 [0,16, 0,35] | 0,59 [0,42, 0,82] | ||
| p-arvo (Log-rank-testi, ositettub) | < 0,0001 | < 0,0018 | ||
| Kokonaiselossaolo | ||||
| Potilaiden lukumäärä (%), joilla esiintyi tapahtuma | 57 (48,3 %) | 93 (39,1 %) | 147 (44,5 %) | 121 (36,3 %) |
| Ajan mediaani tapahtumaan (kuukautta) | 66,7 | NR | 73,1 | NR |
| Riskisuhde (95 %:n luottamusväli) | 0,68 [0,49; 0,94] | 0,76 [0,60; 0,97] | ||
| p-arvo (Log-rank-testi, ositettub) | 0,0196 | 0,0245 | ||
Riippumaton arviointitoimikunta: IRC, Independent Review Committee; Etenemisvapaa elinaika: PFS, progression-free survival; Riskisuhde: HR, Hazard Ratio; Luottamusväli: CI, Confidence Interval; MRD: vähäinen jäännöstauti (Minimal Residual Disease), NR = ei saavutettu (Not Reached)
a Määritetty ajaksi satunnaistamisesta taudin etenemiseen, taudin uusiutumiseen tai kuolemaan mistä tahansa syystä tutkijan arvion perusteella
b ositettu lähtötilanteen Binet'n luokituksen mukaan
c sisältää 11 GClb-ryhmän potilasta, jotka saivat täydellisen vasteen ja joiden luuydin ei ollut korjautunut täysin
d veri ja luuydin yhteensä
e MRD-negatiivisuudeksi on määritelty tulos alle 0,0001
f sisältää MRD-positiiviset potilaat sekä potilaat, joiden tauti eteni tai jotka kuolivat ennen hoidon päättymistä
g Kokonaiselossaolon havainnointiajan mediaania koskevat tiedot vastaavat tutkimuksen vaiheessa 1a havainnointiajan mediaania 62,5 kuukautta ja tutkimuksen vaiheessa 2 havainnointiajan mediaania 59,4 kuukautta.
Alaryhmäanalyysien tulokset
Etenemisvapaan elinajan osajoukkoanalyysin (esim. sukupuoli, ikä, Binet'n luokitus, CrCl, CIRS-pisteet, beeta2-mikroglobuliini, IGVH-status, kromosomipoikkeavuudet, lähtötilanteen lymfosyyttimäärä) tulokset olivat yhdenmukaiset koko hoitoaikeen mukaisen (Intent-to-Treat) potilasjoukon tulosten kanssa. Taudin etenemisen tai kuoleman riski oli alentunut GClb-hoitohaaran potilailla verrattuna RClb- ja Clb-hoitohaaroihin kaikissa potilaiden alaryhmissä lukuun ottamatta alaryhmää, jossa potilailla on 17p‑deleetio. Tässä pienessä alaryhmässä, jossa potilailla on 17p‑deleetio, havaittiin vain positiivinen suuntaus, kun sitä verrattiin Clb-hoitoon (HR = 0,42; p = 0,0892). R-Clb-hoitoon verrattaessa hyötyä ei havaittu. Taudin etenemisen tai kuoleman riskin alentuminen vaihteli potilasalaryhmissä 92 %:sta 58 %:iin verrattaessa GClb-hoitoa Clb-hoitoon ja 72 %:sta 29 %:iin verrattaessa GClb-hoitoa RClb-hoitoon.
Kuva 1 Kroonista lymfaattista leukemiaa sairastavien potilaiden tutkijan vaiheessa 1a arvioima etenemisvapaan elinajan Kaplan–Meier-kuvaaja (tutkimus BO21004/CLL11)
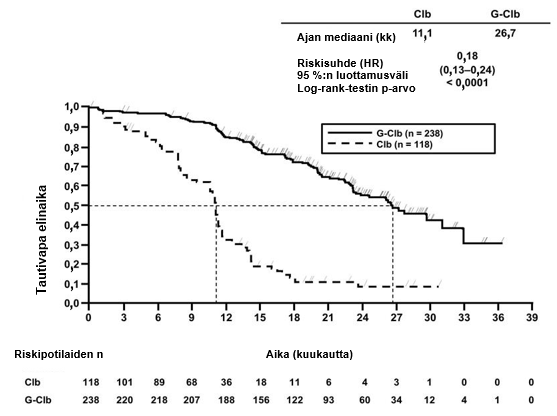
Kuva 2 Kroonista lymfaattista leukemiaa sairastavien potilaiden vaiheen 1a kokonaiselossaolon Kaplan–Meier-kuvaaja (tutkimus BO21004/CLL11)
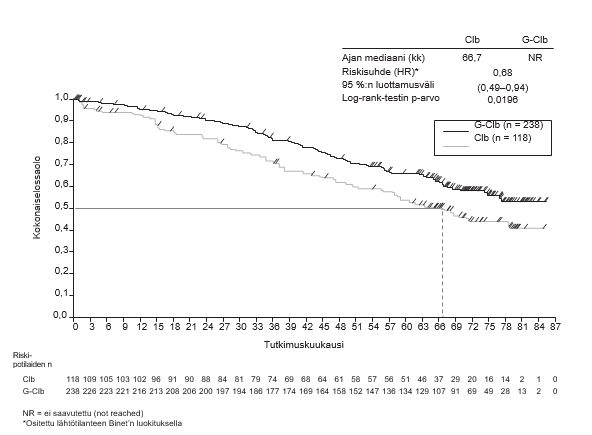
Kuva 3 Kroonista lymfaattista leukemiaa sairastavien potilaiden tutkijan vaiheessa 2 arvioiman etenemisvapaan elinajan Kaplan–Meier-kuvaaja (tutkimus BO21004/CLL11)
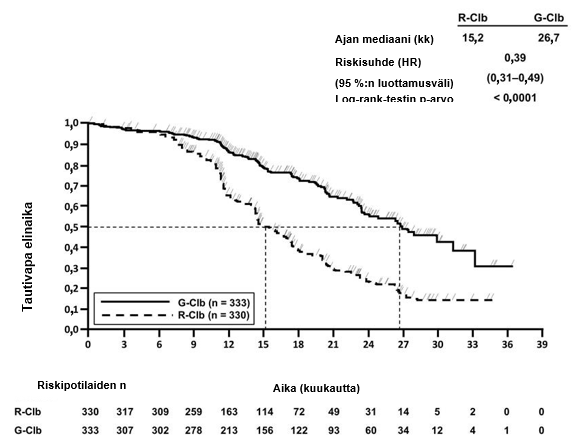
Kuva 4 Kroonista lymfaattista leukemiaa sairastavien potilaiden vaiheen 2 kokonaiselossaolon Kaplan-Meier-kuvaaja (tutkimus BO21004/CLL11)
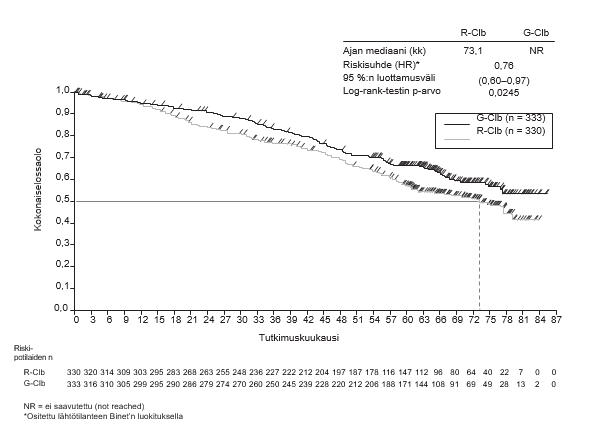
Elämänlaatu
Hoitojakson aikana tehdyissä QLQC30- ja QLQ-CLL-16-kyselyissä ei havaittu merkittäviä eroja minkään osapisteytyksen osalta. Seurantatietoja on vähän, etenkin pelkkää klorambusiilia saaneiden ryhmästä. Elämänlaadussa ei ole tähän mennessä kuitenkaan todettu merkittäviä eroja.
Uupuneisuutta koko hoitojakson aikana spesifisesti koskeneissa terveyteen liittyvissä elämänlaatuarvioissa ei havaittu tilastollisesti merkitsevää eroa, mikä viittaa siihen, ettei Gazyvaron lisääminen klorambusiilihoitoon lisää potilaan kokemaa uupuneisuutta.
Follikulaarinen lymfooma
Aiemmin hoitamaton follikulaarinen lymfooma (tutkimus BO21223/GALLIUM)
Avoimessa, satunnaistetussa, vaiheen III kliinisessä monikeskustutkimuksessa (BO21223/GALLIUM) arvioitiin 1202 aiemmin hoitamatonta graduksen 1–3a edennyttä follikulaarista lymfoomaa (levinneisyysaste II ja suuri tautimassa, levinneisyysaste III/IV) sairastanutta potilasta. Levinneisyysasteen 3b follikulaarista lymfoomaa sairastavia potilaita ei otettu tutkimukseen mukaan. Potilaat satunnaistettiin suhteessa 1:1 saamaan joko Gazyvaroa (n = 601 potilasta) tai rituksimabia (n = 601 potilasta) yhdistelmänä solunsalpaajahoidon (bendamustiini, CHOP tai CVP) kanssa, minkä jälkeen täydellisen tai osittaisen vasteen saaneet potilaat saivat ylläpitohoitona Gazyvaroa tai rituksimabia.
Gazyvaroa annettiin 1000 mg:n annoksina infuusiona laskimoon hoitosyklin 1 päivinä 1, 8 ja 15 sekä seuraavien hoitosyklien päivänä 1. Potilaat saivat yhteensä kuusi Gazyvaro-hoitosykliä (28 päivän välein) yhdistelmänä kuuden bendamustiinihoitosyklin kanssa, ja yhteensä kahdeksan Gazyvaro-hoitosykliä (21 päivän välein) annettiin yhdistelmänä kuuden CHOP-hoitosyklin kanssa tai kahdeksan CVP-hoitosyklin kanssa. Gazyvaro annettiin ennen solunsalpaajahoitoa. Kun Gazyvaron kanssa annettiin yhdistelmänä bendamustiinia, sitä annettiin kaikkien hoitosyklien (hoitosyklit 1–6) päivinä 1 ja 2 laskimoon annoksina 90 mg/m2/vrk. CHOP- ja CVP-hoitoa annettiin tavanomaisina annoksina. Hoitosyklien 6–8 jälkeen yhdistelmähoitoon solunsalpaajahoidon kanssa vasteen saaneet potilaat saivat Gazyvaro-ylläpitohoitoa 2 kuukauden välein, kunnes tauti eteni tai enintään kahden vuoden ajan.
Potilasjoukon demografiset tiedot ja ominaisuudet lähtötilanteessa olivat hyvin tasapainossa hoitohaarojen välillä; iän mediaani oli 59 vuotta, 81 % oli valkoihoisia, 53 % oli naisia, 79 %:n FLIPI-pisteet olivat ≥ 2, ja 7 %:lla oli levinneisyysasteen II (suuri tautimassa), 35 %:lla oli levinneisyysasteen III ja 57 %:lla levinneisyysasteen IV tauti, 44 %:lla oli suuri tautimassa (> 7 cm), 34 %:lla oli lähtötilanteessa vähintään yksi B-oire ja 97 %:n ECOG-suorituskykyluokka oli lähtötilanteessa 0–1. Viisikymmentäseitsemän prosenttia sai bendamustiinia, 33 % sai CHOP-hoitoa, ja 10 % sai CVP-solunsalpaajahoitoa.
Aiemmin hoitamatonta follikulaarista lymfoomaa sairastavien potilaiden hoidon tehoa koskevien tulosten yhteenveto esitetään taulukossa 13. Etenemisvapaan elinajan Kaplan–Meier-käyrät esitetään kuvassa 5.
Taulukko 13 Tutkimuksessa BO21223/ GALLIUM mukana olleilla aiemmin hoitamatonta follikulaarista lymfoomaa sairastavilla potilailla todetun tehon yhteenveto
Rituksimabi + solunsalpaajahoito, minkä jälkeen rituksimabiylläpitohoito N = 601 | Gazyvaro + solunsalpaajahoito, minkä jälkeen Gazyvaro-ylläpitohoito N = 601 | |
| Ensisijainen päätetapahtuma | ||
| Tutkijan arvioima etenemisvapaa elinaika§(PFS-INV), primaarianalyysi | ||
| Potilaiden lukumäärä (%), joilla esiintyi tapahtuma | 144 (24,0 %) | 101 (16,8 %) |
| Riskisuhde [95 %:n luottamusväli] | 0,66 [0,51, 0,85] | |
| p-arvo (Log-Rank-testi, ositettu*) | 0,0012 | |
3 vuoden etenemisvapaan elinajan estimaatti (%) [95 %:n luottamusväli] | 73,3 [68,8, 77,2] | 80,0 [75,9, 83,6] |
| Tutkijan arvioima etenemisvapaa elinaika (PFS-INV), loppuanalyysi§§ | ||
| Potilaiden lukumäärä (%), joilla esiintyi tapahtuma | 244 (40,6 %) | 206 (34,3 %) |
| Riskisuhde [95 %:n luottamusväli] | 0,77 [0,64, 0,93] | |
| p-arvo (Log-Rank-testi, ositettu*) | 0,0055 | |
3 vuoden etenemisvapaan elinajan estimaatti (%) [95 %:n luottamusväli] | 75,5 [71,8, 78,9] | 82,4 [79,0, 85,3] |
7 vuoden etenemisvapaan elinajan estimaatti (%) [95 %:n luottamusväli] | 55,7 [51,3, 59,9] | 63,4 [59,0, 67,4] |
| Keskeiset päätetapahtumat | ||
| Riippumattoman arviointitoimikunnan arvioima etenemisvapaa elinaika (PFS-IRC), primaarianalyysi | ||
| Potilaiden lukumäärä (%), joilla esiintyi tapahtuma | 125 (20,8 %) | 93 (15,5 %) |
| Riskisuhde [95 %:n luottamusväli] | 0,71 [0,54, 0,93] | |
| p-arvo (Log-Rank-testi, ositettu*) | 0,0138 | |
| Aika seuraavaan lymfoomahoitoon#, primaarianalyysi | ||
| Potilaiden lukumäärä (%), joilla esiintyi tapahtuma | 111 (18,5 %) | 80 (13,3 %) |
| Riskisuhde [95 %:n luottamusväli] | 0,68 [0,51, 0,91] | |
| p-arvo (Log-Rank-testi, ositettu*) | 0,0094 | |
| Kokonaiselossaolo#, primaarianalyysi | ||
| Potilaiden lukumäärä (%), joilla esiintyi tapahtuma | 46 (7,7 %) | 35 (5,8 %) |
| Riskisuhde [95 %:n luottamusväli] | 0,75 [0,49, 1,17] ¶ | |
| p-arvo (Log-Rank-testi, ositettu*) | 0,21¶ | |
| Kokonaiselossaolo, loppuanalyysi§§ | ||
| Potilaiden lukumäärä (%), joilla esiintyi tapahtuma | 86 (14,3 %) | 76 (12,6 %) |
| Riskisuhde [95 %:n luottamusväli] | 0,86 [0,63, 1,18] | |
| p-arvo (Log-Rank-testi, ositettu*) | 0,36 | |
| Kokonaisvasteluku** induktiohoidon jälkeen‡(tutkijan arvioima, TT) #, primaarianalyysi | ||
| Vasteen saaneet (%) (CR, PR) | 522 (86,9 %) | 532 (88,5 %) |
| Vasteluvun ero (%) [95 %:n luottamusväli] | 1,7 % [-2,1 %, 5,5 %] | |
| p-arvo (Cochran-Mantel-Haenszelin testi) | 0,33 | |
| Täydellinen vaste (Complete Response, (CR) | 143 (23,8 %) | 117 (19,5 %) |
| Osittainen vaste (Partial Response, PR) | 379 (63,1 %) | 415 (69,1 %) |
Riippumaton arviointitoimikunta: IRC, Independent Review Committee; Etenemisvapaa elinaika: PFS, progression-free survival; Riskisuhde: HR, Hazard Ratio; Luottamusväli: CI, Confidence Interval * Ositustekijät olivat solunsalpaajahoito-ohjelma, follikulaarista lymfoomaa koskeva FLIPI-riskiryhmä, maantieteellinen alue § Tämän tehoa koskevan välianalyysin/primaarianalyysin merkitsevyys: 0,012, tietojenkeruun katkaisuajankohta 31. tammikuuta 2016, havainnointiajan mediaani 34/35 kuukautta §§ Loppuanalyysi, tietojenkeruun katkaisuajankohta 30. heinäkuuta 2021, havainnointiajan mediaani 94 kuukautta ¶ Tiedot eivät ole vielä valmiit. Mediaania ei ollut saavutettu analyysiajankohtana # ei korjattu kerrannaisuuden suhteen **Arvioitu muokattujen Cheson 2007 ‑kriteerien mukaisesti ‡ Hoidon aloitusvaiheen päättyminen = induktiovaiheen päättyminen, ei sisällä monoterapiana annettua ylläpitohoitoa | ||
Kuva 5 Aiemmin hoitamatonta follikulaarista lymfoomaa sairastavien potilaiden tutkijan arvioima etenemisvapaan elinajan Kaplan–Meier-käyrä (tutkimus BO21223/GALLIUM), loppuanalyysi*
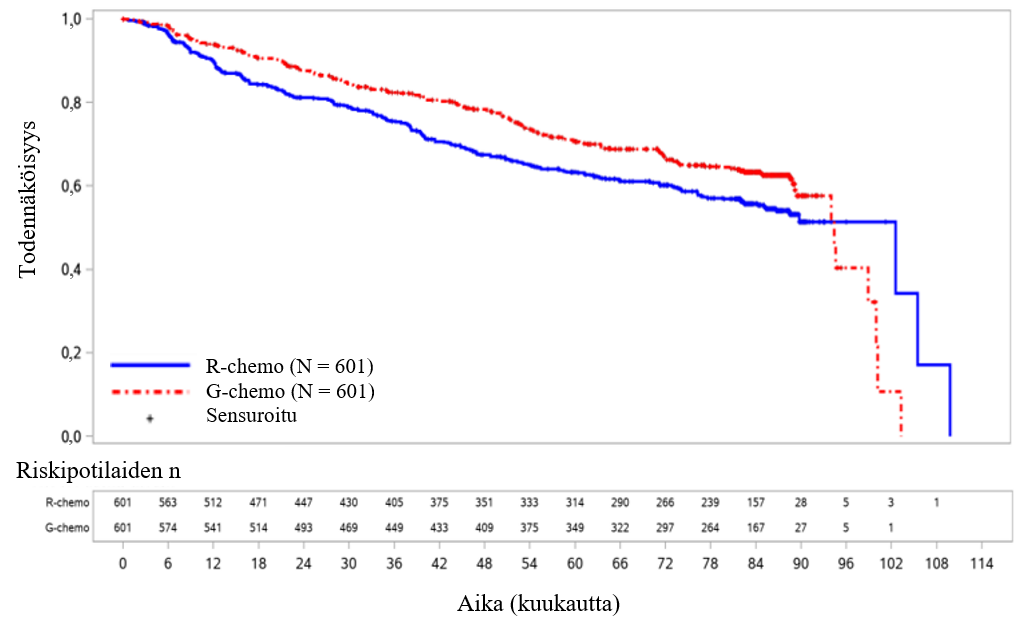
R-Chemo: rituksimabin ja solunsalpaajahoidon yhdistelmä, G-Chemo: Gazyvaron ja solunsalpaajahoidon yhdistelmä, riskisuhde: hazard ratio (HR), luottamusväli: confidence interval (CI) *Loppuanalyysi, tietojenkeruun katkaisuajankohta 30. heinäkuuta 2021, havainnointiajan mediaani 94 kuukautta
Alaryhmäanalyysien tulokset
Alaryhmäanalyysien tulokset (ei korjattu kerrannaisuuden suhteen) olivat yleensä yhdenmukaiset follikulaarista lymfoomaa sairastavan potilasjoukon tulosten kanssa, mikä tukee kokonaistulosten osoitusvoimaa (primaarianalyysi, tietojenkeruun katkaisuajankohta 31. tammikuuta 2016). Arvioituja alaryhmiä olivat IPI, FLIPI, suuri tautimassa, lähtötilanteen B-oireet, Ann Arbor ‑levinneisyysaste ja lähtötilanteen ECOG-toimintakykypisteet. Potilailla, joiden FLIPI-pisteet olivat 0–1 (pieni riski), ei havaittu eroa Gazyvaron ja solunsalpaajahoidon yhdistelmän ja rituksimabin ja solunsalpaajahoidon yhdistelmän välillä (tutkijan arvioiman etenemisvapaan elinajan riskisuhde 1,17 [95 %:n luottamusväli 0,63; 2,19], 40 etenemisvapaan elinajan tapahtumaa). Tässä osajoukossa oli 21 % (253/1202) follikulaarista lymfoomaa koskeneesta hoitoaikeen mukaisesta (ITT) potilasjoukosta, ja siinä todettiin 16,3 % (40/245) etenemisvapaan elinajan tapahtumista. Eri solunsalpaajahoidoista (bendamustiini, CHOP ja CVP) tehdyt taudin etenemisvapaan ajan eksploratiiviset alaryhmäanalyysit olivat yhdenmukaiset Gazyvaron ja solunsalpaajahoidon yhdistelmää saaneen potilasjoukon tulosten kanssa. Havaitut riskisuhteet olivat seuraavat: CHOP (n = 398): riskisuhde 0,77 (95 %:n luottamusväli: 0,50, 1,20), CVP (n = 118): riskisuhde 0,63 (95 %:n luottamusväli: 0,32, 1,21) ja bendamustiini (n = 686): riskisuhde 0,61 (95 %:n luottamusväli: 0,43, 0,86).
Potilaiden raportoimat hoitotulokset
Kummankin hoitoryhmän potilaat kokivat hoidon ja seurannan aikana kerättyjen FACT-Lym-kyselyjen perusteella, että lymfoomaan liittyvät oireet olivat lieventyneet kliinisesti merkittävästi, joksi määriteltiin lymfoomaa koskevalla ala-asteikolla mitattujen pisteiden suureneminen ≥ 3 pistettä lähtötilanteesta, FACT Lym TOI ‑pisteiden suureneminen ≥ 6 pistettä lähtötilanteesta ja FACT Lym ‑kokonaispisteiden suureneminen ≥ 7 pistettä lähtötilanteesta. EQ-5D-utiliteettipisteet olivat samankaltaiset lähtötilanteessa, hoidon aikana ja seurannassa. Terveyteen liittyvää elämänlaatua (HRQOL) ja terveydentilaa osoittavissa mittareissa ei todettu merkittäviä eroja hoitoryhmien välillä.
Koska tutkimusasetelma oli avoin, potilaiden raportoimia hoitotuloksia pitää tulkita varoen.
Follikulaarista lymfoomaa sairastavat potilaat, jotka eivät saaneet vastetta rituksimabihoitoon tai rituksimabia sisältävään hoito-ohjelmaan tai joiden tauti eteni tällaisen hoidon aikana tai viimeistään 6 kuukauden kuluessa tällaisesta hoidosta (tutkimus GAO4753g/GADOLIN).
Avoimessa, satunnaistetussa, vaiheen III kliinisessä monikeskustutkimuksessa (GAO4753g/GADOLIN) oli mukana 396 hidaskasvuista non-Hodgkin-lymfoomaa sairastavaa potilasta, jotka eivät olleet saaneet vastetta rituksimabihoidon tai rituksimabia sisältävän hoidon (mukaan lukien rituksimabimonoterapia osana induktio- tai ylläpitohoitoa) aikana tai joiden tauti oli edennyt 6 kuukauden kuluessa tällaisen hoidon viimeisestä annoksesta. Potilaat satunnaistettiin suhteessa 1:1 saamaan joko pelkästään bendamustiinia (B) (n = 202) tai Gazyvaron ja bendamustiinin yhdistelmää (G+B) (n = 194) kuuden 28 vuorokauden pituisen hoitosyklin ajan. Gazyvaron ja bendamustiinin yhdistelmää (G+B) saaneen ryhmän potilaat, joiden tauti ei edennyt (eli potilas oli saanut täydellisen tai osittaisen vasteen tai potilaan tauti oli stabiili) induktiohoidon päättyessä, jatkoivat Gazyvaro-ylläpitohoitoa kerran kahdessa kuukaudessa kahden vuoden ajan tai kunnes tauti eteni (sen mukaan kumpi ehdoista täyttyi ensin). Potilaat ositettiin alueen, hidaskasvuisen non-Hodgkin-lymfooman alatyypin (follikulaarinen versus ei-follikulaarinen), rituksimabihoitoon reagoimattomuuteen liittyvien ominaisuuksien (reagoimaton aiempaan rituksimabimonoterapiaan tai rituksimabin käyttöön yhdistelmänä solunsalpaajahoidon kanssa) ja potilaan aiemmin saamien hoitojen lukumäärän (≤ 2 versus > 2) perusteella.
Potilaiden demografiset tiedot ja lähtötilanteen ominaisuudet olivat hyvin tasapainossa hoitohaarojen välillä (iän mediaani 63 vuotta, suurin osa valkoihoisia [88 %] ja miehiä [58 %]). Useimmat potilaat sairastivat follikulaarista lymfoomaa (81 %). Mediaaniaika alkuperäisestä diagnoosista oli 3 vuotta ja aiempien hoitojen lukumäärän mediaani oli 2 (vaihteluväli 1–10); 44 % potilaista oli saanut yhtä aiempaa hoitoa ja 34 % potilaista oli saanut kahta aiempaa hoitoa.
Gazyvaro annettiin infuusiona laskimoon annoksena 1000 mg hoitosyklin 1 päivinä 1, 8 ja 15 sekä hoitosyklien 2–6 päivänä 1, ja jos potilaan tauti ei edennyt, kerran kahdessa kuukaudessa kahden vuoden ajan tai kunnes tauti eteni (sen mukaan kumpi ehdoista täyttyi ensin). Bendamustiini annettiin laskimoon kaikkien hoitosyklien (hoitosyklit 1–6) päivinä 1 ja 2 annoksena 90 mg/m2/vrk, kun se annettiin yhdistelmänä Gazyvaron kanssa, tai annoksena 120 mg/m2/vrk, kun sitä annettiin yksinään. Gazyvaron ja bendamustiinin yhdistelmällä hoitoa saaneista potilaista 79,4 % sai kaikki kuusi hoitosykliä verrattuna 66,7 %:iin bendamustiinia saaneessa potilasryhmässä.
Riippumattoman arviointitoimikunnan arvioon perustunut ensisijainen analyysi osoitti, että taudin etenemisen tai kuoleman riski väheni tilastollisesti merkitsevästi 45 % hidaskasvuista non-Hodgkin-lymfoomaa sairastavilla potilailla, jotka saivat Gazyvaron ja bendamustiinin yhdistelmää ja sen jälkeen Gazyvaroa ylläpitohoitona, verrattuna pelkkää bendamustiinia saaneisiin potilaisiin. Hidaskasvuista non-Hodgkin-lymfoomaa sairastavien ryhmässä havaittuun taudin etenemisen tai kuoleman alentuneeseen riskiin vaikuttavat follikulaarista lymfoomaa sairastavien potilaiden tulokset.
Suurin osa tutkimuksen GAO4753g potilaista sairasti follikulaarista lymfoomaa (81,1 %). Follikulaarista lymfoomaa sairastavan potilasjoukon tehon tulokset, jotka on saatu ensisijaisesta analyysista, esitetään taulukossa 14 sekä kuvissa 6 ja 8. Potilaista 11,6 %:lla oli marginaalivyöhykkeen lymfooma ja 7,1 %:lla oli pienilymfosyyttinen lymfooma. Riippumattoman arviointitoimikunnan arvioiman etenemisvapaan elinajan riskisuhde muuta kuin follikulaarista lymfoomaa sairastavassa potilasjoukossa oli 0,94 (95 %:n luottamusväli: 0,49; 1,90).
Tehosta marginaalivyöhykkeen lymfoomaa tai pienilymfosyyttistä lymfoomaa sairastavissa potilasjoukoissa ei voida tehdä varmoja päätelmiä.
Loppuanalyysissa havainnointiajan mediaani oli follikulaarista lymfoomaa sairastavien potilaiden B‑haarassa 45,9 kuukautta (vaihteluväli: 0–100,9 kuukautta) ja G+B-haarassa 57,3 kuukautta (vaihteluväli: 0,4–97,6 kuukautta), ollen B-haarassa 25,6 kk ja G+B-haarassa 35,2 kk pidempi kuin ensisijaisessa analyysissä. Loppuanalyysissa raportoitiin vain tutkijan arvioimat päätetapahtumat, sillä riippumattoman arviointitoimikunnan arviot eivät jatkuneet. Tutkijan arvioimat tehon tulokset olivat kaiken kaikkiaan yhdenmukaiset ensisijaisen analyysin havaintojen kanssa. Follikulaarista lymfoomaa sairastavien potilaiden kokonaiselossaolo pysyi stabiilina seuranta-ajan ollessa pidempi (ks. kuva 7); kuoleman riskin riskisuhde oli 0,71 (95 %:n luottamusväli: 0,51; 0,98).
Taulukko 14 Tutkimuksessa GAO4753g/GADOLIN follikulaarista lymfoomaa# sairastavilla potilailla todetun tehon ensisijaisen analyysin yhteenveto
Bendamustiini N = 166 | Gazyvaro + bendamustiini, minkä jälkeen Gazyvaro- ylläpitohoito N = 155 | |
| Havainnointiajan mediaani: 20 kuukautta | Havainnointiajan mediaani: 22 kuukautta | |
| Follikulaarista lymfoomaa sairastavan potilasjoukon ensisijainen päätetapahtuma | ||
| Riippumattoman arviointitoimikunnan arvioima etenemisvapaa elinaika (PFS-IRC) | ||
| Potilaiden lukumäärä (%), joilla esiintyi tapahtuma | 90 (54,2 %) | 54 (34,8 %) |
| Mediaaniaika tapahtumaan (kuukautta, 95 %:n luottamusväli) | 13,8 (11,4, 16,2) | NR (22,5, -) |
| Riskisuhde (95 %:n luottamusväli) | 0,48 (0,34, 0,68) | |
| p-arvo (Log-rank-testi, ositettu*) | < 0,0001 | |
| Toissijaiset päätetapahtumat | ||
| Tutkijan arvioima etenemisvapaa elinaika (PFS-INV) | ||
| Potilaiden lukumäärä (%), joilla esiintyi tapahtuma | 102 (61,4 %) | 62 (40,0 %) |
| Mediaaniaika tapahtumaan (kuukautta, 95 %:n luottamusväli) | 13,7 (11,0, 15,5) | 29,2 (17,5, -) |
| Riskisuhde (95 %:n luottamusväli) | 0,48 (0,35, 0,67) | |
| p-arvo (Log-rank-testi, ositettu*) | < 0,0001 | |
| Paras kokonaisvaste (BOR) (riippumattoman arviointitoimikunnan arvio)§ | ||
| Analyysissa mukana olleiden potilaiden lukumäärä | 161 | 153 |
| Vasteen saaneet (%) (täydellinen/osittainen vaste) | 124 (77,0 %) | 122 (79,7 %) |
| Vasteluvun ero (95 %:n luottamusväli) | 2,72 (−6,74, 12,18) | |
| p-arvo (Cochran-Mantel-Haenszelin testi) | 0,6142 | |
| Täydellisen vasteen saaneiden lukumäärä (%) | 31 (19,3 %) | 24 (15,7 %) |
| Osittaisen vasteen saaneiden lukumäärä (%) | 93 (57,8 %) | 98 (64,1 %) |
| Potilaiden lukumäärä, joiden tauti stabiili (%) | 18 (11,2 %) | 13 (8,5 %) |
| Vasteen kestoaika (DOR) (riippumattoman arviointitoimikunnan arvio) | ||
| Analyysissa mukana olleiden potilaiden lukumäärä | 127 | 122 |
| Potilaiden lukumäärä (%), joilla esiintyi tapahtuma | 74 (58,3 %) | 36 (29,5 %) |
| Vasteen kestoajan mediaani (kuukautta) (95 %:n luottamusväli) | 11,9 (8,8, 13,6) | NR (25,4, -) |
| Riskisuhde (95 %:n luottamusväli) | 0,36 (0,24, 0,54) | |
| Kokonaiselossaolo (keskeneräiset tiedot) | ||
| Potilaiden lukumäärä (%), joilla esiintyi tapahtuma | 36 (21,7 %) | 25 (16,1 %) |
| Mediaaniaika tapahtumaan (kuukautta) | NR | NR |
| Riskisuhde (95 %:n luottamusväli) | 0,71 (0,43, 1,19) | |
| p-arvo (Log-rank-testi, ositettu*) | 0,1976 | |
Riippumaton arviointitoimikunta: IRC, Independent Review Committee; Etenemisvapaa elinaika: PFS, progression-free survival
NR = ei saavutettu (Not reached)
# Follikulaarista lymfoomaa sairastavat potilaat, jotka eivät saaneet vastetta rituksimabihoitoon tai rituksimabia sisältävään hoito-ohjelmaan tai joiden tauti eteni tällaisen hoidon aikana tai viimeistään 6 kuukauden kuluessa tällaisesta hoidosta
*Analyysissa käytetyt ositteet olivat rituksimabihoitoon reagoimattomuuteen liittyvät ominaisuudet (rituksimabi monoterapiana vs. rituksimabi yhdistelmänä solunsalpaajahoidon kanssa) ja aiemmat hoidot (≤ 2 vs > 2). Tutkimuksen ositteena käytettiin myös sitä, sairastiko potilas follikulaarista vai ei-follikulaarista lymfoomaa, mutta se ei soveltunut ositteeksi follikulaarista lymfoomaa sairastavan potilasjoukon analyysiin.
§ Paras vaste 12 kuukauden kuluessa hoidon aloittamisesta
Kuva 6 Follikulaarista lymfoomaa# sairastavien potilaiden riippumattoman arviointitoimikunnan arvioiman etenemisvapaan elinajan Kaplan-Meier-kuvaaja(tutkimus GAO4753g/GADOLIN)
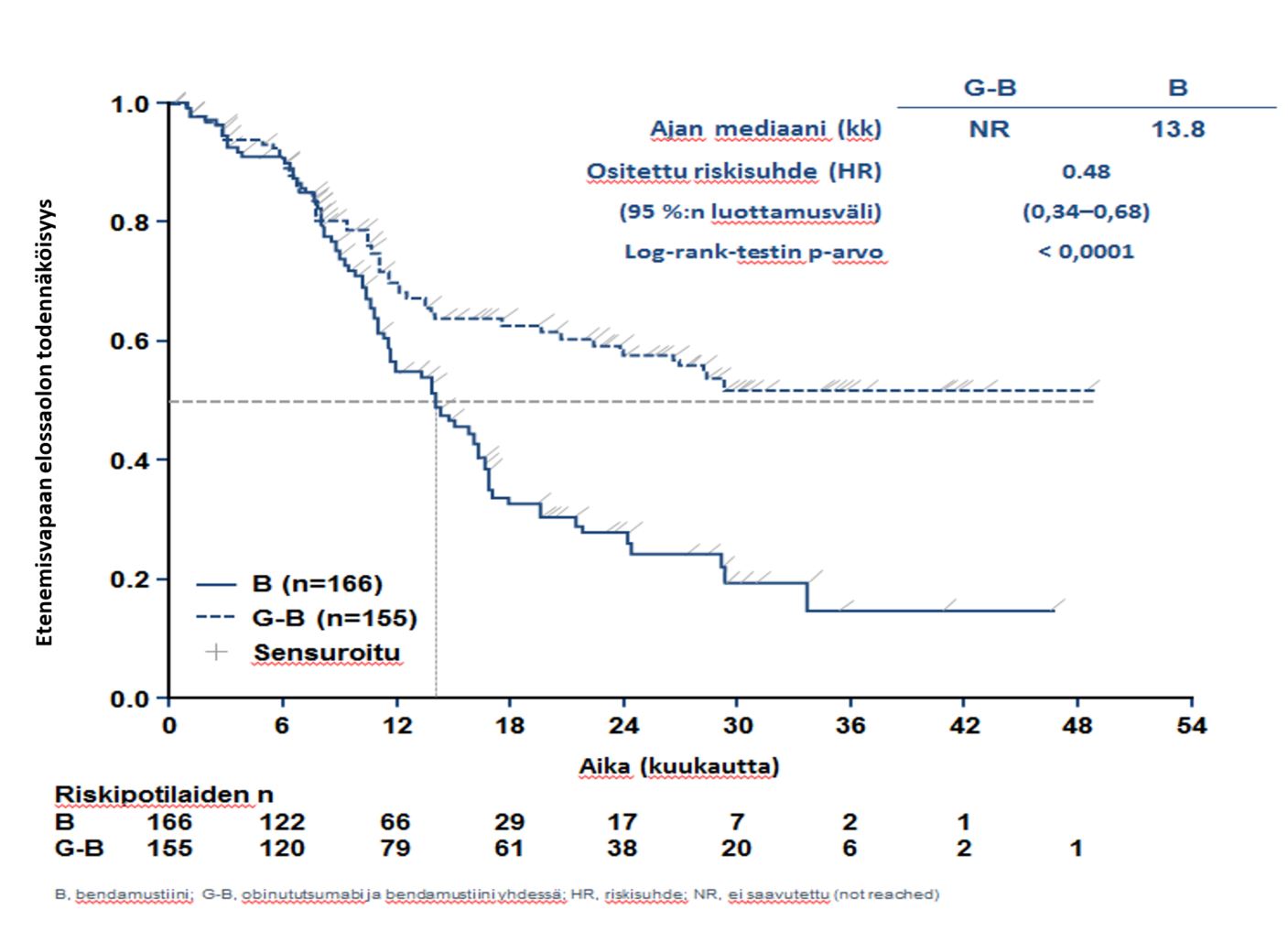
# Follikulaarista lymfoomaa sairastavat potilaat, jotka eivät saaneet vastetta rituksimabihoitoon tai rituksimabia sisältävään hoito-ohjelmaan tai joiden tauti eteni tällaisen hoidon aikana tai viimeistään 6 kuukauden kuluessa tällaisesta hoidosta
Kuva 7 Follikulaarista lymfoomaa sairastavien potilaiden kokonaiselossaolon loppuanalyysin Kaplan-Meier-kuvaaja (tutkimus GAO4753g/GADOLIN)
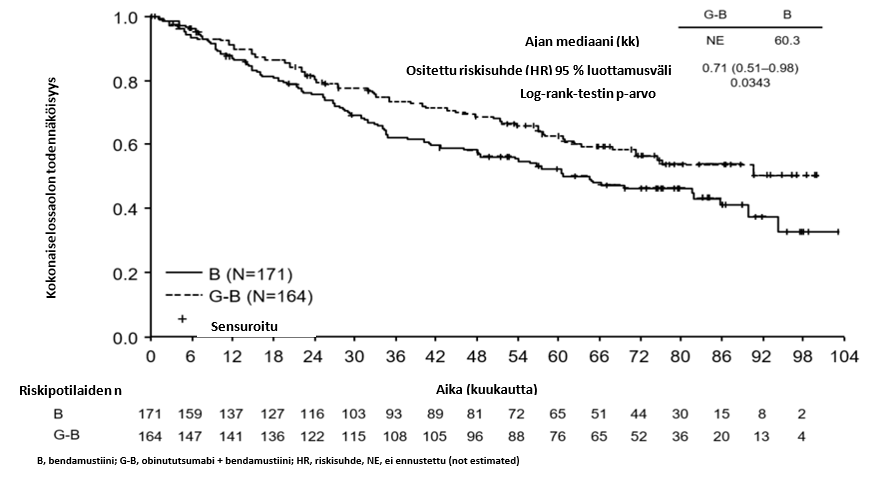
Alaryhmäanalyysien tulokset
Alaryhmäanalyysien tulokset olivat yleisesti ottaen yhdenmukaiset follikulaarista lymfoomaa sairastavan potilasjoukon tulosten kanssa, mikä tukee kokonaistulosten vakautta.
Kuva 8 Riippumattoman arviointitoimikunnan follikulaarista lymfoomaa# sairastavien potilaiden osajoukoittain arvioima etenemisvapaa elinaika* (tutkimus GAO4753g/GADOLIN)
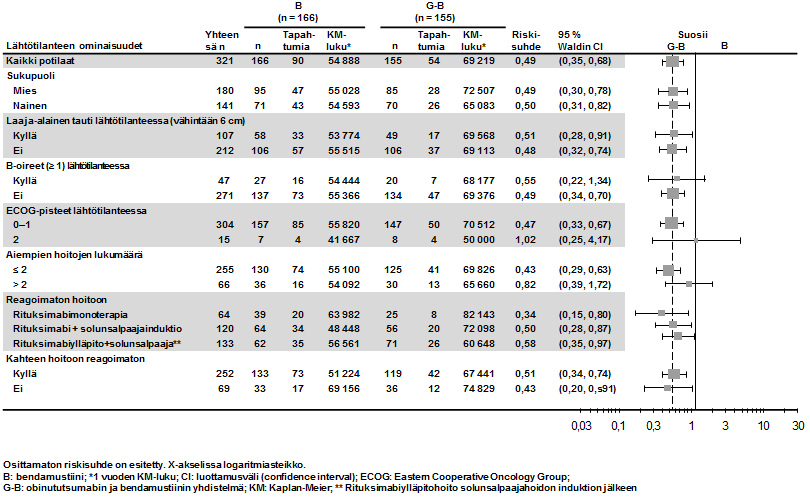
*Hoitoaikeen mukaisella (intent-to-treat, ITT) potilasjoukolla tehdyt ennalta määritellyt analyysit toistettiin follikulaarista lymfoomaa sairastavalla potilasjoukolla; kaksinkertaisesti hoitoon reagoimattomien (eli ei vastetta tai taudin eteneminen alkyloivaa lääkeainetta sisältävän hoito-ohjelman aikana tai 6 kuukauden kuluessa tällaisen hoidon viimeisestä annoksesta) potilaiden statuksen analyysi oli eksploratiivinen.
# Follikulaarista lymfoomaa sairastavat potilaat, jotka eivät saaneet vastetta rituksimabihoitoon tai rituksimabia sisältävään hoito-ohjelmaan tai joiden tauti eteni tällaisen hoidon aikana tai viimeistään 6 kuukauden kuluessa tällaisesta hoidosta
Lyhytkestoista infuusiota koskeva tutkimus MO40597 (GAZELLE)
Yhdistelmänä CHOP-, CVP- tai bendamustiinisolunsalpaajahoidon kanssa annetun lyhytkestoisen (noin 90 minuuttia) obinututsumabi-infuusion turvallisuutta arvioitiin avoimessa yksihaaraisessa monikeskustutkimuksessa 113:lla aiemmin hoitamatonta edennyttä follikulaarista lymfoomaa sairastaneella potilaalla (Tutkimus MO40597/GAZELLE).
Potilaat saivat ensimmäisen hoitosyklin obinututsumabia tavanomaisella antonopeudella hoitosyklin 1 päivinä 1, 8 ja 15. Potilaat, joilla ei esiintynyt graduksen ≥ 3 infuusioon liittyneitä reaktioita ensimmäisen syklin aikana, saivat hoitoa lyhytkestoisina infuusioina hoitosyklistä 2 alkaen.
Tutkimuksen ensisijainen päätetapahtuma oli niiden potilaiden osuus, joilla ilmeni graduksen ≥ 3 infuusioon liittynyt reaktio lyhytkestoisen infuusion yhteydessä hoitosyklissä 2, siinä potilasjoukossa, joka oli aiemmin saanut kolme antokertaa obinututsumabia tavanomaisella antonopeudella hoitosyklissä 1 ilman graduksen ≥ 3 infuusioon liittyvien reaktioiden ilmenemistä. Graduksen ≥ 3 infuusioon liittyviä reaktioita ei havaittu lyhytkestoisia infuusioita saaneilla potilailla hoitosyklin 2 aikana. Hoitosyklin 2 jälkeen vain yhdellä potilaalla ilmeni graduksen 3 infuusioon liittynyt reaktio (hypertensio hoitosyklissä 5). Ks. kohta Haittavaikutukset Haittavaikutukset.
Potilaiden raportoimat hoitotulokset
Koska tutkimusasetelma oli avoin, potilaiden raportoimia hoitotuloksia pitää tulkita varoen.
Terveyteen liittyvä elämänlaatu oli hoidon ja seurantajaksojen aikana kerättyjen FACT-Lym-kyselyn ja EQ-5D-indeksiasteikon perusteella yleensä säilynyt pivotaalitutkimuksessa ennallaan eikä hoitoryhmien välillä ollut merkittäviä eroja. Gazyvaron lisääminen follikulaarista lymfoomaa sairastavien potilaiden bendamustiinihoitoon hidasti kuitenkin FACT-Lym TOI ‑pisteillä mitattua terveyteen liittyvän elämänlaadun huononemista 2,2 kuukaudella (mediaani bendamustiinihoidossa 5,6 kuukautta versus Gazyvaron ja bendamustiinin yhdistelmähoidossa 7,8 kuukautta, riskisuhde = 0,83; 95 %:n luottamusväli: 0,60, 1,13).
Lupusnefriitti
Satunnaistettu, kaksoissokkoutettu, lumekontrolloitu, rinnakkaisryhmillä toteutettu vaiheen III monikeskustutkimus (CA41705/REGENCY) tehtiin potilailla, joilla oli ISN/RPS 2003 -luokituksen luokan III tai IV lupusnefriitti ja mahdollisesti samanaikainen luokan V lupusnefriitti ja joita hoidettiin tavanomaisella hoidolla, joka koostui mykofenolaattimofetiilista (MMF) ja kortikosteroideista.
Potilailla oli aktiivinen tai aktiivinen/krooninen ISN/RPS 2003 -luokituksen luokan III tai IV lupusnefriitti ja mahdollisesti samanaikainen luokan V proliferatiivinen lupusnefriitti, joka oli määritetty munuaisbiopsialla, nykyisellä tai aiemmalla positiivisella tumavasta-aineiden (ANA) testituloksella ja virtsan proteiinin ja kreatiniinin suhteella (UPCR) ≥ 1 g/g. Potilaat olivat saaneet vähintään yhden suuren annoksen metyyliprednisolonia laskimoon (≥ 250 mg, pulse methylprednisolone IV) tai vastaavaa hoitoa lupusnefriittiin seulontaa edeltävien 6 kuukauden aikana tai seulonnan aikana.
Tutkimuksesta suljettiin pois potilaat, joiden glomerulusten laskennallinen suodatusnopeus (eGFR) oli < 30 ml/min/1,73 m2 tai jotka tarvitsivat dialyysihoitoa tai elinsiirron, joilla oli munuaisbiopsiassa skleroosia > 50 %:ssa hiussuonikeräsistä, joilla oli nopeasti etenevä munuaiskerästulehdus, joilla oli näyttöä aktiivisesta infektiosta, jotka olivat saaneet CD20-vasta-ainehoitoa < 9 kuukautta ennen seulontaa tai seulonnan aikana, sekä potilaat, jotka olivat saaneet syklofosfamidia, takrolimuusia, siklosporiinia tai voklosporiinia seulontaa edeltävien 2 kuukauden aikana tai seulonnan aikana.
Yhteensä 271 potilasta satunnaistettiin suhteessa 1:1 saamaan 1 000 mg Gazyvaro-valmistetta tai lumelääkettä laskimoon yhdistelmänä mykofenolaattimofetiilin (2–2,5 g/vrk) ja vähitellen pienennettävän kortikosteroidiannoksen kanssa. Potilaita arvioitiin 76 viikon ajan. Gazyvaro-hoitoa saamaan satunnaistetut potilaat satunnaistettiin lisäksi suhteessa 1:1 saamaan joko 1 000 mg Gazyvaro-valmistetta laskimoon päivänä 1 sekä viikoilla 2, 24, 26, 50 ja 52 (ryhmä 1) tai 1 000 mg Gazyvaro-valmistetta laskimoon päivänä 1 sekä viikoilla 2, 24, 26 ja 52 (ryhmä 2). Taulukossa 15 on esitetty kaikki Gazyvaro-valmisteen tehoa koskevat tiedot, joissa on yhdistetty molemmat hoitoryhmät.
Kaikki potilaat saivat 0,5 mg/kg/vrk prednisonia suun kautta (enintään 60 mg/vrk), ja tämän annoksen käyttöä jatkettiin viikkoon 2 asti. Päivästä 15 alkaen prednisoniannosta pienennettiin vähitellen, jotta 5 mg:n/vrk tavoiteannos saavutettiin viikkoon 24 mennessä. Prednisonihoitoa jatkettiin pienellä annoksella (5 mg/vrk) viikosta 24 viikkoon 80.
Potilaiden iän mediaani oli 31 vuotta; 84,5 % oli naisia, 57,6 % oli latinalaisamerikkalaisia, 47,6 % oli valkoihoisia, 14,8 % oli mustaihoisia tai afroamerikkalaisia. Potilaat jakautuivat munuaisbiopsian perusteella luokkiin seuraavasti: 39,5 % oli luokassa III, 60,5 % oli luokassa IV ja 31,4 % oli samanaikaisesti luokassa V. eGFR:n keskiarvo (keskihajonta) oli lähtötilanteessa 102,3 (± 30,8) ml/min/1,73 m2. Virtsan proteiinin ja kreatiniinin suhteen (UPCR) keskiarvo (keskihajonta) oli lähtötilanteessa 3,34 (± 2,87) mg/mg, ja 42,2 %:lla potilaista virtsan ja kreatiniinin suhteen keskiarvo oli lähtötilanteessa ≥ 3 mg/mg. Lähtötilanteessa 17 %:lla potilaista oli lievä (eGFR 60 – < 90 ml/min/m2) ja 11,4 %:lla keskivaikea (eGFR 30 – < 60 ml/min/m2) munuaisten vajaatoiminta.
Ensisijainen hoitotulosmittari oli niiden potilaiden osuus, jotka saivat täydellisen munuaisvasteen (CRR) viikolla 76. Täydellisen munuaisvasteen määritelmä oli kaikkien seuraavien kriteerien täyttyminen: UPCR < 0,5 g/g; glomerulusten laskennallinen suodatusnopeus (eGFR) ≥ 85 % lähtötilanteesta vuoden 2009 Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) ‑yhtälöllä laskettuna; ei seuraavia samanaikaisia tapahtumia: salvage-hoito, hoidon epäonnistuminen, kuolema tai tutkimukseen osallistumisen ennenaikainen lopettaminen.
Keskeisiä toissijaisia hoitotulosmittareita olivat niiden potilaiden osuudet, joilla todettiin jokin seuraavista: täydellinen munuaisvaste (CRR) ja prednisoniannosta oli viikolla 76 pienennetty onnistuneesti vähitellen, proteinuriavaste viikolla 76, kuolema tai munuaisiin liittyvä tapahtuma viikkoon 76 mennessä.
Tulokset
Lupusnefriittiä sairastavista potilaista merkitsevästi suurempi osa (46,4 %) Gazyvaro-valmistetta yhdistelmänä tavanomaisen hoidon kanssa saaneista potilaista oli viikolla 76 saanut täydellisen munuaisvasteen kuin niistä potilaista, jotka saivat lumelääkettä ja tavanomaista hoitoa (33,1 %). Yhteenveto tehoa koskevista tuloksista on taulukossa 15.
Taulukko 15 Tehoa koskevat tulokset lupusnefriittiä sairastavilla aikuisilla (REGENCY/CA41705)
Lumelääke + tavanomainen hoito^ (N = 136) | Gazyvaro + tavanomainen hoito^ (N = 135) | |
| Ensisijainen päätetapahtuma | ||
| Täydellinen munuaisvaste viikolla 76 (%) | 33,1 | 46,4 |
| Hoitojen välinen ero (95 %:n luottamusväli) | 13,40 (1,95, 24,84) | |
| p-arvo | 0,0232 | |
| Täydellisen munuaisvasteen osa-alueet: | ||
| UPCR < 0,5 | 49 (36,0 %) | 64 (47,4 %) |
| eGFR ≥ 85 % lähtötilanteesta | 103 (75,7 %) | 113 (83,7 %) |
| Ei samanaikaisia tapahtumia | 102 (75,0 %) | 120 (88,9 %) |
| Keskeiset toissijaiset päätetapahtumat | ||
| Täydellinen munuaisvaste ja prednisoniannoksen onnistunut pienentäminen vähitellen viikolla 76 (%)* | 30,9 | 42,7 |
| Hoitojen välinen ero (95 %:n luottamusväli) | 11,88 (0,57, 23,18) | |
| p-arvo | 0,0421 | |
| Proteinuriavaste viikolla 76 (%)# | 41,9 | 55,5 |
| Hoitojen välinen ero (95 %:n luottamusväli) | 13,68 (2,01, 25,36) | |
| p-arvo | 0,0227 | |
UPCR: virtsan proteiinin ja kreatiniinin suhde; eGFR: glomerulusten laskennallinen suodatusnopeus ^mykofenolaattimofetiili (MMF) ja kortikosteroidit *Täydellinen munuaisvaste viikolla 76 ilman prednisoniannoksen pienentämistä vähitellen > 7,5 mg:aan/vrk tai vastaavaa viikosta 64 viikkoon 76 #UPCR < 0,8 g/g viikolla 76 eikä seuraavia samanaikaisia tapahtumia: salvage-hoito, hoidon epäonnistuminen, kuolema tai tutkimukseen osallistumisen ennenaikainen lopettaminen | ||
Immunogeenisyys
Immunogeenisyysmääritystulokset riippuvat huomattavassa määrin useista tekijöistä, kuten määrityksen herkkyydestä ja spesifisyydestä, määritysmenetelmästä, määrityksen luotettavuudesta verenkierrossa olevien Gazyvaro/vasta-ainemäärien suhteen, näytteiden käsittelystä, näytteenoton ajankohdasta, samanaikaisesti käytetyistä lääkkeistä ja perussairaudesta. Vasta-aineiden ilmaantuvuuden vertailu Gazyvaro-valmisteen ja muiden valmisteiden välillä saattaa näistä syistä olla harhaanjohtava.
Potilailta tutkittiin kroonista lymfaattista leukemiaa koskeneessa pivotaalitutkimuksessa BO21004/CLL11 useana eri ajankohtana Gazyvaron lääkevasta‑aineet (anti-therapeutic antibodies, ATA). Gazyvaro-hoitoa saaneista 140 potilaasta kahdeksan potilaan testitulos oli satunnaistamisvaiheessa positiivinen lääkevasta-aineiden suhteen, ja kuudesta potilaasta kaksi todettiin hoidon aloitusvaiheen 12 kuukauden seurannan jälkeen lääkevasta-ainepositiivisiksi. Yhdelläkään näistä potilaista ei esiintynyt anafylaktisia tai yliherkkyysreaktioita, joiden olisi katsottu liittyneen lääkevasta-aineisiin, eikä niiden katsottu vaikuttaneen kliiniseen vasteeseen.
Tutkimuksessa GAO4753g/GADOLIN hoitoa saaneilla hidaskasvuista non-Hodgkin-lymfoomaa sairastavilla potilailla ei havaittu lähtötilanteen jälkeen ihmisen antihumaanivasta-aineita (HAHA). Tutkimuksen BO21223/GALLIUM induktiohoidon päättyessä ihmisen antihumaanivasta-aineita oli kehittynyt yhdelle potilaalle 565 potilaasta (0,2 % potilaista, joita arvioitiin lähtötilanteen jälkeen). Ihmisen antihumaanivasta-aineiden kliinistä merkitystä ei tiedetä, mutta mahdollista korrelaatiota ihmisen antihumaanivasta-aineiden ja sairauden kliinisen kulun välillä ei voida sulkea pois.
Lupusnefriittiä koskeneissa tutkimuksissa Gazyvaro-hoitoa saaneista potilaista yhteensä 12 potilaalta 200:sta (6 %) oli kirjattu vähintään yksi lääkevasta-ainepositiivinen näyte milloin tahansa tutkimusten aikana. Kuudelta (3 %) tutkittavalta oli kirjattu lääkevasta-ainepositiivisia näytteitä lähtötilanteessa. Kaksi niistä 6 potilaasta, jotka olivat lääkevasta-ainepositiivisia lähtötilanteessa, pysyi lääkevasta-ainepositiivisina koko tutkimuksen ajan, 1 potilaalla oli yksi lääkevasta-ainepositiivinen näyte lähtötilanteen jälkeen ja lopuilla 3 potilaalla kaikki lähtötilanteen jälkeen otetut näytteet olivat lääkevasta-ainenegatiivisia. Kuudella potilaalla (3 %), joiden lähtötilanteen näyte oli lääkevasta-ainenegatiivinen, todettiin positiivinen lääkevasta-ainetitteri lähtötilanteen jälkeen (hoidon aiheuttamia lääkevasta-aineita).
Yhdellekään niistä 12 potilaasta, joiden lääkevasta-ainetitterit olivat positiivisia jossain vaiheessa hoitojaksoa, ei tullut tutkimuksen aikana infuusioon liittyvää reaktiota, anafylaktista reaktiota tai yliherkkyysreaktiota.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset Gazyvaro-valmisteen käytöstä kaikkien pediatristen potilasryhmien kroonisen lymfaattisen leukemian ja follikulaarisen lymfooman hoidossa (ks. kohta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Euroopan lääkevirasto on myöntänyt lykkäyksen velvoitteelle toimittaa tutkimustulokset Gazyvaro-valmisteen käytöstä systeemisen lupus erythematosuksen, mukaan lukien lupusnefriitti, hoidossa yhdessä tai useammassa pediatrisessa potilasryhmässä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Vaiheen I, vaiheen II ja vaiheen III tutkimuksissa obinututsumabia pelkästään tai yhdistelmänä solunsalpaajien kanssa saaneiden 469 hidaskasvuista non-Hodgkin-lymfoomaa, 342 kroonista lymfaattista leukemiaa ja 130 diffuusia suurisoluista B-solulymfoomaa sairastaneiden potilaiden farmakokineettisten tietojen analysoimiseksi kehitettiin populaatiofarmakokineettinen malli.
Populaatiofarmakokineettinen malli kehitettiin farmakokineettisten tietojen analysoimiseksi 196:sta lupusnefriittiä sairastavasta potilaasta, jotka saivat obinututsumabia vaiheen II ja vaiheen III tutkimuksissa.
Imeytyminen
Obinututsumabi annetaan laskimoon, joten imeytyminen ei ole oleellista. Muita antoreittejä ei ole tutkittu. Populaatiofarmakokineettisen mallin perusteella hoitosyklin 6 päivänä 1 kroonista lymfaattista leukemiaa sairastaville potilaille annetun infuusion jälkeinen Cmax-arvon arvioitu mediaani oli 465,7 μg/ml ja AUC(τ)-arvo oli 8961 μg•vrk/ml, ja hidaskasvuista non-Hodgkin-lymfoomaa sairastavien potilaiden Cmax-arvon arvioitu mediaani oli 539,3 μg/ml ja AUC(τ)-arvo oli 10956 μg•vrk/ml. Lupusnefriittiä sairastavien potilaiden populaatiofarmakokineettiseen malliin perustuva arvioitu Cmax-arvon mediaani vakaassa tilassa oli 468 mikrog/ml ja vakaan tilan AUC-arvo oli 8 740 mikrog•vrk/ml.
Jakautuminen
Jakautumistilavuus keskustilassa (kroonista lymfaattista leukemiaa sairastavilla potilailla 2,98 l, hidaskasvuista non-Hodgkin-lymfoomaa sairastavilla potilailla 2,97 l ja lupusnefriittiä sairastavilla potilailla 2,22 l) on laskimoon tapahtuneen annon jälkeen lähellä seerumin tilavuutta, mikä osoittaa, että jakautuminen rajoittuu pääasiassa plasmaan ja kudosnesteeseen.
Biotransformaatio
Obinututsumabin metaboliaa ei ole tutkittu suoraan. Vasta-aineet puhdistuvat lähinnä katabolian kautta.
Eliminaatio
Obinututsumabin puhdistuma on kroonista lymfaattista leukemiaa sairastavilla potilailla noin 0,11 l/vrk ja hidaskasvuista non-Hodgkin-lymfoomaa sairastavilla potilailla 0,08 l/vrk, ja eliminaation puoliintumisajan (t½) mediaani on kroonista lymfaattista leukemiaa sairastavilla potilailla 26,4 vuorokautta ja hidaskasvuista non-Hodgkin-lymfoomaa sairastavilla potilailla 36,8 vuorokautta. Obinututsumabin eliminaatio koostuu kahdesta rinnakkaisesta reitistä, jotka kuvaavat puhdistumaa, lineaarista puhdistumareittiä ja epälineaarista puhdistumareittiä, joka muuttuu ajan funktiona. Epälineaarinen ajan suhteen muuttuva puhdistumareitti on vallitseva hoidon alussa ja on siten pääasiallinen puhdistumareitti. Kun hoitoa jatketaan, tämän reitin merkitys vähenee ja lineaarinen puhdistumareitti muuttuu vallitsevaksi. Tämä viittaa lääkkeen kohdevälitteiseen jakautumiseen (target mediated drug disposition, TMDD), kun alkuvaiheen CD20-solurunsaus aiheuttaa nopeasti obinututsumabin poistumisen verenkierrosta. Kun suurin osa CD20-soluista on sitoutunut obinututsumabiin, lääkkeen kohdevälitteisen jakautumisen vaikutus farmakokinetiikkaan minimoituu.
Lupusnefriittiä sairastavilla potilailla obinututsumabin vakaan tilan puhdistuma oli noin 0,13 l/vrk ja eliminaation puoliintumisajan (t1/2) mediaani oli 22,4 vrk. Obinututsumabin eliminaatio käsittää kaksi rinnakkaista reittiä, jotka kuvaavat puhdistumaa: lineaarinen puhdistumareitti ja epälineaarinen puhdistumareitti, joka muuttuu ajan funktiona. Ajan suhteen vaihteleva puhdistuma vähenee ajan myötä siten, että hajoamiskerroin on eksponentiaalinen. Tämä liittyy todennäköisesti CD20-kohteen vähenemiseen ja proteinurian paranemiseen ajan myötä sekä ajasta riippumattomaan puhdistumaan, joka liittyy IgG:n endogeenisiin katabolisiin prosesseihin.
Farmakokineettinen/farmakodynaaminen suhde
Populaatiofarmakokineettisessä analyysissä havaittiin sukupuolen olevan kovariaatti, mikä selittää osan potilaiden välisestä vaihtelusta, sillä miehillä vakaan tilan puhdistuma (CLss) on 22 % ja jakautumistilavuus (V) on 19 % suurempi. Populaatioanalyysin tulokset ovat kuitenkin osoittaneet, että erot altistuksessa eivät ole merkittäviä (kun kroonista lymfaattista leukemiaa sairastavien naisten AUC:n arvioitu mediaani on 11282 µg•vrk/ml ja Cmax-arvo on 578,9 µg/ml ja miesten AUC:n arvioitu mediaani on 8451 µg•vrk/ml ja Cmax-arvo on 432,5 µg/ml hoitosyklissä 6, ja hidaskasvuista non-Hodgkin-lymfoomaa sairastavien naisten AUC on 13172 µg•vrk/ml ja Cmax-arvo on 635,7 µg/ml ja miesten AUC on 9769 µg•vrk/ml ja Cmax-arvo on 481,3 µg/ml), mikä viittaa siihen, että annosta ei tarvitse sukupuolen perusteella muuttaa.
Iäkkäät potilaat
Krooninen lymfaattinen leukemia ja follikulaarinen lymfooma
Obinututsumabin populaatiofarmakokineettinen analyysi osoitti, ettei ikä vaikuta obinututsumabin farmakokinetiikkaan. Obinututsumabin farmakokinetiikassa ei havaittu merkittäviä eroja < 65-vuotiaiden (n = 375), 65–75-vuotiaiden (n = 265) ja > 75-vuotiaiden (n = 171) potilaiden välillä.
Lupusnefriitti
Obinututsumabin farmakokinetiikkaa ei ole tutkittu ≥ 65-vuotiailla potilailla.
Pediatriset potilaat
Obinututsumabin farmakokinetiikan selvittämiseksi ei ole tehty tutkimuksia pediatrisilla potilailla.
Munuaisten vajaatoiminta
Krooninen lymfaattinen leukemia ja follikulaarinen lymfooma
Obinututsumabin populaatiofarmakokineettinen analyysi osoitti, ettei kreatiniinipuhdistuma vaikuta obinututsumabin farmakokinetiikkaan. Obinututsumabin farmakokinetiikka oli lievää (CrCl 50–89 ml/min, n = 464) tai keskivaikeaa (CrCl 30–59 ml/min, n = 106) munuaisten vajaatoimintaa sairastavilla potilailla samankaltainen kuin potilailla, joiden munuaisten toiminta oli normaali (CrCl ≥ 90 ml/min, n = 383). Vaikeaa munuaisten vajaatoimintaa (CrCl 15–29 ml/min) sairastavista potilaista on vähän (n = 8) farmakokineettisiä tietoja eikä annossuosituksia voida antaa.
Lupusnefriitti
Obinututsumabin populaatiofarmakokineettinen analyysi (n = 196) osoitti, että kreatiniinipuhdistuma ei vaikuta farmakokinetiikkaan lupusnefriittiä sairastavilla potilailla. Obinututsumabin farmakokinetiikka oli lievää (kreatiniinipuhdistuma (CrCl) 60 – < 90 ml/min, n = 45) tai keskivaikeaa (kreatiniinipuhdistuma (CrCl) 30 – < 60 ml/min, n = 17) munuaisten vajaatoimintaa sairastavilla potilailla samankaltainen kuin potilailla, joiden munuaisten toiminta oli normaali.
Maksan vajaatoiminta
Maksan vajaatoimintaa sairastavilla potilailla ei ole tehty varsinaisia farmakokineettisiä tutkimuksia.
Prekliiniset tiedot turvallisuudesta
Obinututsumabin karsinogeenisuuden selvittämiseksi ei ole tehty tutkimuksia.
Obinututsumabin hedelmällisyyteen kohdistuvien vaikutusten tutkimiseksi ei ole tehty spesifisiä eläinkokeita. Obinututsumabilla ei esiintynyt cynomolgus-apinoilla tehdyissä toistuvan annoksen toksisuutta selvittäneissä tutkimuksissa haittavaikutuksia urosten ja naaraiden lisääntymiselimiin.
Tiineillä cynomolgus-apinoilla tehty tehostettu pre- ja postnataalista kehitystä (enhanced pre and postnatal development, ePPND) koskeva toksisuustutkimus ei viitannut teratogeenisiin vaikutuksiin. Kahdennestakymmenennestä parittelun jälkeisestä päivästä synnytykseen saakka viikoittain annetut obinututsumabiannokset aiheuttivat imeväisikäisille apinoille kuitenkin täydellisen B-solupuutoksen, kun laskimoon viikoittain annetut obinututsumabiannokset olivat 25 mg/kg ja 50 mg/kg (Cmax- ja AUC-arvojen perusteella 2–5-kertainen altistus kliiniseen altistukseen verrattuna). Jälkeläisten altistus 28. syntymän jälkeisenä päivänä viittaa siihen, että obinututsumabi pystyy läpäisemään veri-istukkaesteen. Pitoisuudet jälkeläisen seerumissa 28. syntymän jälkeisenä päivänä olivat samansuuruisia kuin pitoisuudet emon seerumissa, vaikka pitoisuudet maidossa olivat samana päivänä hyvin pieniä (alle 0,5 % vastaavista pitoisuuksista emon seerumissa), mikä viittaa siihen, että jälkeläisen altistuksen on pitänyt tapahtua kohdussa. B-solumäärä palautui normaaliksi ja immunologiset toiminnot korjautuivat 6 kuukauden kuluessa syntymästä.
Cynomolgus‑apinoilla tehdyssä 26 viikkoa kestäneessä tutkimuksessa havaittiin yliherkkyysreaktioita, ja ne liittyivät cynomolgus-apinoiden elimistön tunnistamaan vieraaseen humanisoituun vasta-aineeseen (0,7–6-kertainen kliininen altistus perustuen ns. steady state Cmax- ja AUC-arvoihin viikoittaisten annosten 5, 25 ja 50 mg/kg jälkeen). Löydöksiä olivat akuutit anafylaktiset ja anafylaktoidiset reaktiot sekä immuunikompleksivälitteisiin yliherkkyysreaktioihin sopivat systeemiset tulehdukset ja infiltraatit, kuten arteriitti/periarteriitti, glomerulonefriitti ja herakalvon/ulkokalvon tulehdus. Nämä reaktiot johtivat 6/36 obinututsumabilla hoidetun eläimen ennalta suunnittelemattomaan lopettamiseen valmisteen annon ja toipumisjakson aikana. Tällaiset muutokset olivat osittain korjaantuvia. Ihmisellä ei ole havaittu munuaistoksisuutta, jolla olisi syy-yhteys obinututsumabiin.
Farmaseuttiset tiedot
Apuaineet
Histidiini
Histidiinihydrokloridimonohydraatti
Trehaloosidihydraatti
Poloksameeri 188
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa, lukuun ottamatta niitä, jotka mainitaan kohdassa Käyttö- ja käsittelyohjeet.
Kestoaika
Avaamaton injektiopullo
3 vuotta.
Laimentamisen jälkeen
Kemialliseksi ja fysikaaliseksi säilyvyydeksi 9 mg/ml (0,9 %) natriumkloridi-injektioliuokseen pitoisuuteen 0,4 mg/ml – 20 mg/ml laimentamisen jälkeen on osoitettu 72 tuntia 2 °C – 8 °C:ssa, ja tämän jälkeen 48 tuntia (infuusioaika mukaan lukien) ≤ 30 °C:ssa.
Käyttövalmis infuusioliuos tulisi mikrobiologiselta kannalta käyttää heti. Jos valmistetta ei käytetä heti, käytönaikaiset säilytysajat ja ‑olosuhteet ovat käyttäjän vastuulla eivätkä saisi tavallisesti ylittää 24 tuntia 2 °C – 8 °C:n lämpötilassa, ellei valmisteen laimentamista ole tehty valvotuissa ja validoiduissa aseptisissa olosuhteissa.
Säilytys
Säilytä jääkaapissa (2 °C – 8 ºC).
Ei saa jäätyä.
Pidä injektiopullo ulkopakkauksessa. Herkkä valolle.
Laimennetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
GAZYVARO infuusiokonsentraatti, liuosta varten
1000 mg (L:ei) 40 ml (25 mg/ml) (4529,68 €)
PF-selosteen tieto
40 ml konsentraattia 50 ml:n injektiopullossa (kirkasta tyypin I lasia), jossa tulppa (butyylikumia). Pakkauskoko 1 injektiopullo.
Valmisteen kuvaus:
Kirkas, väritön tai hieman ruskehtava liuos.
Käyttö- ja käsittelyohjeet
Laimennusohjeet
Terveydenhuollon ammattilaisen pitää saattaa Gazyvaro käyttökuntoon aseptista tekniikkaa noudattaen. Älä ravista injektiopulloa. Käytä steriiliä neulaa ja ruiskua Gazyvaron käyttökuntoon saattamista varten.
Kroonisen lymfaattisen leukemian hoitosyklit 2–6, follikulaarisen lymfooman kaikki hoitosyklit ja koko lupusnefriitin hoidon ajan
Vedä injektiopullosta 40 ml konsentraattia ja laimenna se 9 mg/ml (0,9 %) natriumkloridi-injektioliuosta sisältävään polyvinyylikloridi (PVC) -infuusiopussiin tai PVC:tä sisältämättömään polyolefiini-infuusiopussiin.
Pelkästään kroonisen lymfaattisen leukemian hoitosykli 1
Jotta hoidon alussa annettavan 1 000 mg:n annoksen antamiseen tarvittavat kaksi infuusiopussia voidaan tunnistaa, käyttöön suositellaan ottamaan erikokoiset infuusiopussit, jotta hoitosyklin 1 päivänä 1 annettava 100 mg:n annos voidaan erottaa hoitosyklin 1 päivänä 1 (jatkettu infuusio) tai päivänä 2 annettavasta 900 mg:n annoksesta. Valmista kaksi infuusiopussia vetämällä injektiopullosta 40 ml konsentraattia ja laimentamalla 4 ml 100 ml:aan 9 mg/ml (0,9 %) natriumkloridi-infuusioliuosta PVC-infuusiopussissa tai PVC:tä sisältämättömässä polyolefiinipussissa ja loput 36 ml 250 ml:aan 9 mg/ml (0,9 %) natriumkloridi-infuusioliuosta PVC-infuusiopussissa tai PVC:tä sisältämättömässä polyolefiinipussissa. Merkitse infuusiopussit selkeästi. Infuusiopussien säilytys, ks. kohta Kestoaika.
| Annettava Gazyvaro-annos | Tarvittava määrä Gazyvaro-konsentraattia | PVC-infuusiopussin tai PVC:tä sisältämättömän polyolefiini-infuusiopussin koko |
| 100 mg | 4 ml | 100 ml |
| 900 mg | 36 ml | 250 ml |
| 1 000 mg | 40 ml | 250 ml |
Älä käytä muita laimentimia, kuten glukoosia (5 %) sisältävää liuosta (ks. kohta Yhteensopimattomuudet).
Pussia on käänneltävä varovasti ylösalaisin liuoksen sekoittamiseksi, jotta vältetään liiallinen vaahdonmuodostus. Laimennettua liuosta ei saa ravistaa eikä se saa jäätyä.
Parenteraaliset lääkevalmisteet on tarkistettava ennen antoa silmämääräisesti, ettei niissä ole hiukkasia ja värimuutoksia havaittavissa.
Yhteensopimattomuutta ei ole havaittu pitoisuuksiin 0,4 mg/ml – 20,0 mg/ml laimennetun Gazyvaron ja 9 mg/ml (0,9 %) natriumkloridi-injektioliuoksen sekä
- PVC-, polyeteeni- (PE), polypropeeni- tai polyolefiini-infuusiopussien välillä
- PVC-, polyuretaani- (PUR) tai PE-infuusionantolaitteiden välillä
- valinnaisen letkunsisäisen suodattimen valmisteen kanssa kosketuksiin joutuvien polyeetterisulfoni (PES) ‑pintojen, polykarbonaatista (PC) valmistetun 3‑tiehanan ja polyeetteriuretaanista (PEU) valmistettujen katetrien välillä.
Hävittäminen
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
GAZYVARO infuusiokonsentraatti, liuosta varten
1000 mg 40 ml
- Ei korvausta.
ATC-koodi
L01FA03
Valmisteyhteenvedon muuttamispäivämäärä
04.12.2025
Yhteystiedot
 ROCHE OY
ROCHE OY Revontulenpuisto 2 C, P.O. Box 112
02101 Espoo
010 554 500
www.roche.fi
etunimi.sukunimi@roche.com
