PROSTIVAS infuusiokonsentraatti, liuosta varten 0,5 mg/ml
Vaikuttavat aineet ja niiden määrät
1 millilitra sisältää 0,5 mg alprostadiilia.
Apuaine, jonka vaikutus tunnetaan
Prostivas sisältää 790 mg vedetöntä etanolia per 1 ml:n ampulli, mikä vastaa 790 mg:aa/ml (79 % w/v).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Infuusiokonsentraatti, liuosta varten.
Kliiniset tiedot
Käyttöaiheet
Alprostadiili on tarkoitettu palliatiiviseksi, ei parantavaksi hoidoksi vastasyntyneille, joilla on synnynnäinen sydänvika ja joiden eloonjääminen riippuu valtimotiehyen avoimena pysymisestä. Alprostadiili pitää valtimotiehyen (ductus arteriosus) tilapäisesti avoimena, kunnes lapselle voidaan tehdä korjaava tai palliatiivinen toimenpide. Tällaisia synnynnäisiä sydänvikoja ovat esimerkiksi hiippaläpän atresia, keuhkovaltimoläpän atresia, keuhkovaltimoläpän ahtauma, trikuspidaaliläpän atresia, Fallot´n tetralogia, aortan kaaren kehityshäiriö, aortan ahtauma tai suurten valtasuonten virhesijainti, johon saattaa liittyä myös muita vikoja.
Ainoastaan lääketieteellisen koulutuksen saanut henkilökunta saa käyttää alprostadiili-infuusiokonsentraattia olosuhteissa, joissa lapsipotilaille voidaan antaa tehohoitoa ja lasten teho-osasto on tarvittaessa käytettävissä.
Annostus ja antotapa
Infuusio aloitetaan yleensä annoksella 0,05 - 0,1 mikrog alprostadiilia painokiloa kohti minuutissa. Kun hoitovaste on saavutettu, infuusioannos pienennetään pienimpään mahdolliseen määrään, jolla toivotut vaikutukset säilyvät. Ylläpitoinfuusion sopiva nopeus on usein 0,01 mikrog/kg/min.
Jos aloitusannos 0,1 mikrog/kg/min ei riitä, annos voidaan varovasti suurentaa enimmäismäärään 0,4 mikrog/kg/min. Annoksen suurentaminen ei kuitenkaan yleensä paranna vastetta. Prostivas-infuusiokonsentraatti on suositeltavinta antaa jatkuvana infuusiona suureen laskimoon. Se voidaan antaa myös valtimotiehyen aukkoon sijoitetun napavaltimokatetrin kautta. Valmiste lisää veren hapettumista (pO2) yhtä paljon antotavasta riippumatta.
Infuusion anto: Infuusiossa on käytettävä infuusiopumppua, jonka infuusionopeutta voidaan säätää portaattomasti toivotun vasteen saavuttamiseksi.
Laimentaminen: 1 Prostivas-ampulli (= 500 mikrog PGE1/1 ml) laimennetaan 100 ml:aan 0,9-prosenttista natriumkloridi-infuusionestettä tai 5-prosenttista steriiliä glukoosi-infuusionestettä. Koska alprostadiili on instabiili, se on säilytettävä jääkaapissa (2 – 8 °C). Tuoreet alprostadiililaimennokset on valmistettava 24 tunnin välein. Yli 24 tuntia vanhat laimennokset on hävitettävä.
| Infuusionopeus | 0,6 ml/kg/h = |
| 0,01 ml/kg/min = | |
| 0,05 mikrog/kg/min i.v. |
Taulukossa esitetyt alprostadiilipitoisuudet (mikrog/ml) saavutetaan lisäämällä 100, 250 ja 500 mikrog alprostadiilia ilmoitettuihin laimenninmääriin:
| Alprostadiililisäys (mikrog) | |||
| Kokonaistilavuus | 100 mikrog (0,2 ml)* | 250 mikrog (0,5 ml)* | 500 mikrog (1,0 ml)* |
| 250 ml | 0,4 | 1,0 | 2,0 |
| 100 ml | 1,0 | 2,5 | 5,0 |
| 50 ml | 2,0 | 5,0 | 10,0 |
| 25 ml | 4,0 | 10,0 | 20,0 |
*lisäys millilitroina
Infuusionopeuden laskeminen:
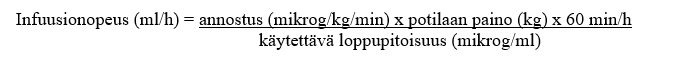
Esimerkki: 2,8-kiloiselle vastasyntyneelle annettava 0,1 mikrog/kg/min alprostadiilia, kun käytettävä loppupitoisuus on 5 mikrog/ml:
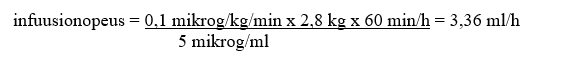
Pediatriset potilaat
On todennäköistä, että Prostivas-valmisteen sisältämä etanoli vaikuttaa lapsiin (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Alprostadiilin käyttöä on vältettävä vastasyntyneillä, joilla on respiratory distress -syndrooma (RDS eli hyaliinimembraanitauti). Se voidaan toisinaan tulkita virheellisesti syanoottiseksi sydänsairaudeksi (rajoittunut keuhkoverenvirtaus). Jos riittäviä diagnostisia keinoja ei ole heti käytettävissä, diagnoosin tulisi perustua syanoosin esiintymiseen (pO2 alle 40 torr) ja röntgenologisesti osoitettuun keuhkoverenvirtauksen vähenemiseen.
Varoitukset ja käyttöön liittyvät varotoimet
Alprostadiilia saa antaa vain hyvin koulutettu terveydenhoitohenkilöstö, ja se on tehtävä tiloissa, joista on pääsy lasten tehohoitoyksikköön.
Apneaa ilmenee noin 10 - 12 prosentilla niistä synnynnäistä sydänvikaa sairastavista vastasyntyneistä, jotka saavat alprostadiilia (prostaglandiini E1). Apneaa ilmenee useimmiten vastasyntyneillä, joiden syntymäpaino on alle 2 kg, ja se alkaa yleensä ensimmäisen tunnin kuluessa infuusion aloittamisesta.
Valmistetta on käytettävä ainoastaan olosuhteissa, joissa mahdollinen hengitysvajaus voidaan hoitaa nopeasti. Jos lapsi joudutaan lähettämään toiseen sairaalaan, hänelle on yleensä asetettava hengitysputki ennen kuljetusta.
Prostaglandiini E1:lla hoidetuilla vauvoilla valtimotiehyen ja keuhkovaltimoiden patologiset tutkimukset ovat paljastaneet histologisia muutoksia, jotka liittyvät näiden rakenteiden heikentymiseen. Näiden tulosten spesifisyyttä tai kliinistä merkitystä ei tunneta.
Pitkäaikaiset alprostadiili-infuusiot ovat aiheuttaneet vastasyntyneille pitkien luiden kortikaalista lisäkasvua. Lapsilta lisäkasvu on lakannut, kun lääkitys on lopetettu.
Valtimotiehyen seinämän ja keuhkovaltimoiden heikentymistä on raportoitu pääasiassa pitkittyneen annon aikana.
Alprostadiilin anto vastasyntyneille saattaa aiheuttaa antrumin liikakasvusta johtuvan mahalaukun tyhjenemisesteen. Tämä vaikutus liittyy ilmeisesti hoidon kestoon ja valmisteen kumulatiiviseen annokseen.
Vastasyntyneitä, jotka saavat valmistetta suositusannoksina yli 120 tuntia, on seurattava tarkoin mahdollisen antraalisen hyperplasian ja mahalaukun tyhjenemisesteen havaitsemiseksi.
Valmiste on infusoitava mahdollisimman nopeasti ja mahdollisimman pieninä annoksina, jotka vielä tuottavat toivotun vaikutuksen. Pitkäaikaiseen alprostadiili-infuusioon liittyviä riskejä on punnittava siitä kriittisesti sairaalle lapselle mahdollisia koituvia hyötyjä vasten.
Koska prostaglandiini E1 (alprostadiili) estää voimakkaasti verihiutaleiden aggregoitumista, sitä on annettava varoen sellaisille vastasyntyneille, joilla voi olla verenvuototaipumusta.
Kaikkien vastasyntyneiden valtimopaine on mitattava ajoittain napavaltimokatetrilla, auskultoimalla tai Doppler-anturilla. Jos valtimopaine laskee huomattavasti, infuusionopeutta on heti pienennettävä.
Lapsilla, joilla keuhkoverenvirtaus on vähentynyt, veren hapettumisen lisääntyminen on käänteisesti verrannollinen ennen hoitoa mitattuihin pO2-arvoihin. Näin ollen paras hoitovaste saadaan niille potilaille, joiden pO2-arvot ovat pienet (alle 40 torr), ja vähäinen vaste niille potilaille, joilla pO2-arvot ovat suuret (yli 40 torr). Lapsilta, joilla keuhkoverenvirtaus on vähentynyt, hoidon tehoa mitataan veren hapettumisen paranemisena. Lapsilta, joilla systeeminen verenvirtaus on vähentynyt, hoidon tehoa mitataan systeemisen verenpaineen paranemisena ja veren pH-arvon avulla.
Tietoa apuaineesta
Yksi 1 ml:n Prostivas-ampulli sisältää 790 mg vedetöntä etanolia (ks. kohta Vaikuttavat aineet ja niiden määrät), mikä vastaa alle 20 ml:aa olutta tai 8 ml:aa viiniä.
Esimerkki etanolialtistuksesta, joka perustuu infuusionopeuteen 0,1 mikrog/kg/min 24 tunnin aikana (ks. kohta Annostus ja antotapa):
0,576 ml:n annos tätä lääkevalmistetta annettuna 1 kuukauden ikäiselle lapselle, joka painaa 2 kg aiheuttaa etanolialtistuksen 227,52 mg/kg, joka saattaa nostaa veren alkoholipitoisuuden noin tasolle 37,9 mg/100 ml.
Vertailun vuoksi, kun aikuinen juo lasillisen viiniä tai 500 ml olutta, veren alkoholipitoisuus on todennäköisesti noin 50 mg/100 ml.
On todennäköistä, että tämän lääkevalmisteen sisältämä etanoli vaikuttaa lapsiin. Vaikutuksia voivat olla uneliaisuus ja muutokset käytöksessä.
Koska tätä lääkettä annetaan hitaasti 24 tunnin ajan, etanolin vaikutukset saattavat olla vähäisempiä (ks. kohta Annostus ja antotapa).
Samanaikainen anto esimerkiksi propyleeniglykolia tai etanolia sisältävien lääkevalmisteiden kanssa saattaa johtaa etanolin kumuloitumiseen ja aiheuttaa haittavaikutuksia, erityisesti pienille lapsille, joiden metaboliakyky on alhainen tai kehittymätön.
Tämän lääkevalmisteen etanolisisältö pitää ottaa tarkoin huomioon seuraavilla potilasryhmillä, joilla etanoliin liittyvien haittavaikutusten riski voi olla tavanomaista suurempi:
- maksasairautta sairastavat potilaat
- epilepsiapotilaat.
Tämä lääkkeen sisältämä etanolimäärä saattaa muuttaa muiden lääkkeiden vaikutusta.
Yhteisvaikutukset
Alprostadiilin ja synnynnäistä sydänvikaa sairastavien vastasyntyneiden tavanomaisen lääkehoidon välillä ei ole raportoitu yhteisvaikutuksia. Tavanomaiseen lääkehoitoon kuuluvat antibiootit (kuten penisilliini tai gentamysiini), vasopressorit (kuten dopamiini), sydänglykosidit ja diureetit (kuten furosemidi).
Raskaus ja imetys
Ei sovellettavissa.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Ei sovellettavissa.
Haittavaikutukset
Suurin osa niistä alprostadiili-infuusioiden haittavaikutuksista, joita on havaittu vastasyntyneillä, joilla on synnynnäinen sydänvika ja joiden eloonjääminen riippuu valtimotiehyen avoimena pysymisestä, liittyvät alprostadiilin tunnettuihin farmakologisiin vaikutuksiin.
Seuraavassa lueteltuja haittavaikutuksia on havaittu ja raportoitu alprostadiilihoidon aikana (434 vastasyntynyttä) esiintymistiheyksillä: Hyvin yleiset (≥1/10); yleiset (≥1/100 − <1/10); melko harvinaiset (≥1/1 000 − <1/100); harvinaiset (≥1/10 000 − <1/1 000); hyvin harvinaiset (≤1/10 000).
Elinjärjestelmä | Esiintymistiheys | Haittavaikutukset |
Aineenvaihdunta ja ravitsemus | Yleinen | Hypokalemia |
Hermosto | Yleinen | Epileptiset kohtaukset |
Sydän | Yleinen | Bradykardia, hypotensio, takykardia |
Hengityselimet, rintakehä ja välikarsina | Hyvin yleinen | Apnea |
Ruoansulatuselimistö | Yleinen | Ripuli |
Melko harvinainen | Mahalaukun tyhjenemiseste, mahan limakalvon hypertrofia | |
Luusto, lihakset ja sidekudos | Melko harvinainen | Eksostoosi |
Verisuonisto | Melko harvinainen | Verisuonten hauraus |
Yleisoireet ja antopaikassa todettavat haitat | Hyvin yleinen | Ohimenevä kuume |
Yleinen | Vasodilataatio iholla (punoitus)* |
* Tämä haittavaikutus liittyi suoraan lääkkeen annosteluun, ja sitä esiintyi useammin valtimonsisäisessä annostelussa.
Alprostadiilin ja seuraavien haittavaikutusten yhteyttä ei tunneta: sepsis (1,6 %), hajapesäkkeinen suonensisäinen koagulopatia (1,1 %), sydänpysähdys (1,1 %), edeema (1,1 %).
Pitkäaikaisen alprostadiili-infuusion on todettu aiheuttavan pitkien luiden kortikaalista lisäkasvua.
Prostaglandiini E1:llä hoidettujen lasten valtimotiehyiden ja keuhkovaltimoiden patologisissa tutkimuksissa on osoitettu histologisia muutoksia, joita tavataan näiden rakenteiden heikkenemisen yhteydessä. Näiden löydösten spesifisyyttä tai kliinistä merkitystä ei tunneta.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Valmisteen yliannostus voi aiheuttaa apneaa, bradykardiaa, kuumetta, hypotensiota ja ihon punoitusta. Jos apneaa tai bradykardiaa esiintyy, infuusio on keskeytettävä ja aloitettava asianmukainen hoito. Varovaisuutta on noudatettava, jos infuusio aloitetaan uudelleen. Jos potilaalla ilmenee kuumetta tai hypotensiota, infuusionopeutta on pienennettävä, kunnes nämä oireet häviävät. Punoitus liittyy yleensä
napavaltimokatetrin virheelliseen asettamiseen ja se lievittyy tavallisesti, kun katetrin kärkeä siirretään.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Prostaglandiinit, ATC-koodi: C01EA01
Alprostadiili (prostaglandiini E1) on luonnollinen rasvahappo, jolla on useita farmakologisia vaikutuksia. Näistä merkittävimpiä ovat vasodilaatio, verihiutaleiden aggregaation esto ja suolen ja kohdun sileälihaksen stimulaatio. Kun alprostadiilia annetaan laskimonsisäisesti 1 - 10 mikrog/kg nisäkkäille, ääreisvastus pienenee, jolloin verenpaine alenee. Lisäksi sydämen minuuttitilavuus ja syke suurenevat.
Valtimotiehyen sileälihas on erityisen herkkä alprostadiilin vaikutuksille: aine relaksoi huomattavasti karitsan valtimotiehyestä otettua näytepalaa. Alprostadiili avaa uudelleen myös vastasyntyneiden rottien, kanien ja karitsojen sulkeutumassa olevat valtimotiehyet. Näiden havaintojen pohjalta on tutkittu alprostadiilin käyttöä lapsilla, joilla on sellaisia synnynnäisiä vikoja, jotka vähentävät keuhko- tai yleistä verenvirtausta, sekä lapsilla, joilla veren riittävä hapettuminen ja vähäisemmän perfuusion turvaaminen riippuvat valtimotiehyen auki pysymisestä. Tutkimuksissa puolet niistä lapsista, joilla keuhkoverenvirtaus oli vähentynyt, reagoi alprostadiili-infuusioon: veren pO2 suureni vähintään
10 torria (keskimääräinen nousu noin 14 torria ja keskimääräinen nousu hapettumisen kyllästymisessä noin 23 %). Yleisesti ottaen hoitoon parhaiten vastanneilla potilailla oli ennen hoitoa pieni pO2-arvo, ja he olivat enintään 4 päivän ikäisiä. Lapsilla, joilla systeeminen verenvirtaus oli vähentynyt, alprostadiili suurensi usein pH-arvoa asidoosissa, nosti systeemistä verenpainetta ja pienensi keuhkovaltimo- ja aorttapaineiden välistä suhdetta.
Vaikutusmekanismi: Alprostadiilin vaikutusmekanismia ei toistaiseksi tunneta. Luonnolliset prostaglandiinit voivat kuitenkin auttaa pitämään sikiön valtimotiehyen avoimena relaksoimalla valtimotiehyen sileälihasta. Jatkuvana infuusiona valtimoon tai laskimoon annettu Prostivas-infuusiokonsentraatti laajentaa valtimotiehyttä vastasyntyneillä.
Farmakokinetiikka
Alprostadiili on luonnollinen aineosa nisäkkäiden kudoksissa, mutta sen pitoisuudet ovat normaalisti niin pienet, että niitä on vaikea mitata luotettavasti. Eläimillä ja ihmisillä laskimoon ja valtimoon annettu alprostadiili metaboloituu nopeasti ja jakautuu koko elimistöön, paitsi keskushermostoon, jonne jakautuminen on selvästi vähäisempää. Jos keuhkot toimivat normaalisti, alprostadiili metaboloituu keuhkoissa suuressa määrin: 68 - 70 % ihmisellä, 87 - 95 % koiralla ja 90 % kissalla ja kanilla. Kun ihmiselle annetaan 0,2 - 0,5 mikrog alprostadiilia kerta-annoksena laskimoon, alprostadiilin ja sen kiertävän päämetaboliitin (13, 14-dihydro-15-oksoprostaglandiini E1) arvioitu puoliintumisaika plasmassa on 5 - 10 minuuttia. Toinen metaboliitti, jolla on mitattu huomattavia pitoisuuksia sekä rotan että koiran plasmassa, on 15-oksoprostaglandiini E1. Näillä molemmilla metaboliiteilla on paljon vähäisempi biologinen aktiviteetti kuin alprostadiililla. Alprostadiilin metaboliitit eliminoituvat pääasiassa munuaisteitse. Muuttumatonta alprostadiilia ei ole mitattu virtsasta. Metaboliittien erittyminen virtsaan ja ulosteeseen on kokonaan ohi 24 tunnin kuluessa valmisteen annosta. Alprostadiilin ja sen metaboliittien kudosjäämistä ei ole näyttöä.
Prekliiniset tiedot turvallisuudesta
Pitkäaikaisia karsinogeenisuus- ja fertiliteettitutkimuksia ei ole tehty. Ames- ja alkaliinieluutioanalyyseissa ei ole osoitettu mutageneesiä.
Farmaseuttiset tiedot
Apuaineet
Etanoli, vedetön.
Yhteensopimattomuudet
Jos laimentamaton Prostivas-infuusiokonsentraatti joutuu suoraan kosketukseen muovisen infuusiopullon kanssa, pullon seinämistä saattaa liueta liuokseen muovinpehmittimiä. Liuos voi muuttua sameaksi ja muovin ulkonäkö muuttua. Tällöin liuos on hävitettävä ja otettava käyttöön uusi muovipullo. Reaktio riippuu pitoisuudesta. Samentumisen estämiseksi Prostivas-infuusiokonsentraatti tulisi lisätä suoraan infuusionesteeseen välttäen suoraa kosketusta muovipullon kanssa.
Kestoaika
Infuusiokonsentraatti: 3 vuotta.
Laimennettu infuusiokonsentraatti: Prostivas-infuusiokonsentraatin laimennokset säilyvät laimentamisen jälkeen kemiallisesti ja fysikaalisesti 8 tuntia huoneenlämmössä tai 24 tuntia jääkaapissa. Laimennettu liuos tulisi käyttää välittömästi mikrobiologisista syistä. Jos liuosta ei käytetä välittömästi, säilytysaika ja -olosuhteet ennen käyttöä ovat käyttäjän vastuulla eivätkä normaalisti saa ylittää 24 tuntia 2–8 °C:ssa, jos laimentaminen ei ole tapahtunut kontrolloiduissa ja validoiduissa aseptisissa olosuhteissa.
Säilytys
Säilytä jääkaapissa (2 °C – 8 °C).
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
PROSTIVAS infuusiokonsentraatti, liuosta varten
0,5 mg/ml (L:ei) 1 ml (852,16 €)
PF-selosteen tieto
Tyypin I lasista valmistettu ampulli: 1 ml.
Valmisteen kuvaus:
Kirkas, väritön liuos.
Käyttö- ja käsittelyohjeet
Infuusiokonsentraatti on laimennettava ennen käyttöä.
Katso kohta 4.2 Annostus ja antotapa, Laimentaminen. Laimennokset, jotka ovat yli 24 tuntia vanhoja, on hävitettävä.
Korvattavuus
PROSTIVAS infuusiokonsentraatti, liuosta varten
0,5 mg/ml 1 ml
- Ei korvausta.
ATC-koodi
C01EA01
Valmisteyhteenvedon muuttamispäivämäärä
29.08.2024
Yhteystiedot
 PFIZER OY
PFIZER OY Tietokuja 4
00330 Helsinki
09 430 040
www.pfizer.fi
etunimi.sukunimi@pfizer.com
