SYNARELA nenäsumute, liuos 200 mikrog/annos
Vaikuttavat aineet ja niiden määrät
Yksi millilitra sumuteliuosta sisältää 2 mg nafareliinia (nafareliiniasetaattina).
Yksi annos sisältää 200 mikrogrammaa nafareliinia.
Apuaine, jonka vaikutus tunnetaan
Tämä lääkevalmiste sisältää 0,01 mg bentsalkoniumkloridia per annos (= per yksi 0,1 ml:n suihke), mikä vastaa pitoisuutta 0,1 mg/ml.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Nenäsumute, liuos
Kliiniset tiedot
Käyttöaiheet
Vaikean endometrioosin hoito korkeintaan kuuden kuukauden ajan.
Koeputkihedelmöityksen esihoito (aivolisäkkeen desensitisaatio ovulaatiota indusoitaessa).
Myoomien hoito ennen leikkausta.
Suositus: Suositellaan käytettäväksi vain naistentautien ja synnytysopin erikoislääkärien valvomassa hoidossa.
Annostus ja antotapa
Suihketta annosteltaessa päätä taivutetaan hieman alaspäin ja suihkauksen jälkeen lievästi taaksepäin. Suihkeiden annon välillä tulee pitää 30 sekunnin tauko.
Endometrioosi
Suositeltu vuorokausiannos on yksi 200 mikrogramman Synarela-suihke toiseen sieraimeen aamulla ja toinen suihke toiseen sieraimeen illalla (kokonaisvuorokausiannos 400 mikrog) kuuden kuukauden ajan.
400 mikrogramman annos ei välttämättä tuota amenorreaa kaikille potilaille. Näillä potilailla vuorokausiannos voidaan suurentaa 800 mikrogrammaan, jos endometrioosioireet jatkuvat.
Hoito aloitetaan kuukautiskierron 2.–4. päivänä.
Säännöllisesti annossuosituksen mukaan käytettynä nafareliini estää ovulaation. Potilaita olisi neuvottava käyttämään ei-hormonaalista ehkäisyä. Jos annoksia jää väliin, ovulaatio ja raskaus ovat mahdollisia.
Koeputkihedelmöityksen esihoito
Hoito voidaan aloittaa joko follikulaarivaiheen 1. tai 2. päivänä tai luteaalivaiheen puolivälissä (kuukautiskierron 21. päivä). Annostus on 400–800 mikrog/24 h. Yksi suihke toiseen sieraimeen tai molempiin sieraimiin sekä aamulla että illalla.
Kliiniset kokeet ovat osoittaneet, että annostuksella 800 mikrog/24 h hoitovaste on luotettavampi.
Kun steroidituotanto on loppunut 3–4 viikon kuluttua, hoitoon pitäisi liittää gonadotropiini, kunnes saavutetaan riittävä follikkelien kypsymisaste. Tämän jälkeen ovulaatio indusoidaan.
Myoomien hoito ennen leikkausta
Yksi nafareliinisuihke (200 mikrog) toiseen sieraimeen aamulla ja yksi suihke toiseen sieraimeen illalla (kokonaisvuorokausiannos 400 mikrog) 3 kuukauden ajan.
Nenän tukkoisuutta lieventäviä valmisteita ei saa käyttää 30 minuutin sisällä Synarelan annostelusta (ei sitä ennen eikä sen jälkeen).
Aivastelu annostelun aikana voi heikentää lääkkeen imeytymistä. Jos lääkettä otettaessa tulee aivastus, suositellaan annostuksen uusimista.
Pediatriset potilaat
Säännöllinen seuranta erityisesti hoidon ensimmäisten 3–6 kuukauden aikana on tarpeen, jos potilaalla on aivoperäinen varhaiskypsyys, jotta aivolisäke-sukupuolirauhastoiminnan nopea estyminen voidaan varmistaa.
Kun nafareliiniasetaattia annetaan suositusannoksina tytöille, joilla on aivoperäinen varhaiskypsyys, voi joillakin potilailla esiintyä aluksi tyhjennysvuotoa yleensä 6 viikon kuluessa hoidon aloittamisesta. Tämän jälkeen kuukautisten pitäisi loppua.
Tärkeitä ohjeita Synarela-sumutinpullon käyttöön liittyen
- Pumpusta pitäisi tulla hienojakoista sumua; mikä aikaansaadaan vain nopealla ja napakalla painalluksella. Hienojakoisessa sumussa voi näkyä myös suurempia nestetippoja. Se on ihan normaalia. Jos Synarela-liuos kuitenkin virtaa sumutinpullosta ulos ohuena nestevanana eikä hienojakoisena sumuna, niin silloin Synarela ei ehkä tehoa kunnolla ja potilaan on keskusteltava apteekkihenkilökunnan kanssa.
- Annostelukärki on puhdistettava pullon aktivoinnin jälkeen (ensimmäisen käyttökerran yhteydessä). Sen jälkeen annostelukärki on puhdistettava aina ennen käyttöä ja käytön jälkeen. Jos se jää tekemättä, annostelukärki voi tukkeutua eikä potilas ehkä saa oikeaa, hänelle määrättyä lääkeannosta. Varmistinrengas ja suojatulppa on laitettava takaisin paikoilleen annostelukärkeen jokaisen käyttökerran jälkeen, jotta annostelukärki ei tukkeudu.
- Pumppu annostelee aina vain tietyn määrän lääkettä riippumatta siitä, kuinka kovaa pumppua painetaan.
- Älä yritä suurentaa annostelukärjen pientä aukkoa. Jos aukkoa suurennetaan, pumppu annostelee vääränsuuruisen Synarela-annoksen.
Pumpun aktivointi
Potilaan tulee aktivoida Synarela-pullon pumppu ennen ensimmäistä käyttökertaa. Aktivointi tehdään vain kerran, ennen ensimmäisen annoksen ottamista.
1. Poista suojatulppa ja varmistinrengas ja laita ne talteen. Tartu annostelukärjen hartiaosaan sen molemmilta puolilta etu- ja keskisormella, samalla kun tuet pulloa sen alta peukalolla. Pidä pullo pystyasennossa siten, että annostelukärki osoittaa sinusta poispäin.
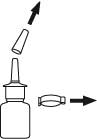
2. Aktivoi pumppu painamalla sitä useita kertoja (tavallisesti noin 5–7 kertaa) voimakkaasti, tasaisesti ja nopeasti, kunnes ilma on poistunut ja liuos purkautuu annostelukärjestä hienojakoisena, tasaisena suihkeena. Kun sumutinpullo on kerran aktivoitu, sitä ei enää tarvitse aktivoida uudelleen päivittäisessä käytössä. Lääkettä menee hukkaan, jos pumppu aktivoidaan jokaisen käyttökerran yhteydessä.
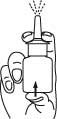
3. Puhdista annostelukärki pumpun aktivoinnin jälkeen:
Pidä pullo vaakasuorassa asennossa ja huuhtele kärkeä 15 sekunnin ajan lämpimällä vedellä, samalla kun puhdistat sitä sormella tai puhtaalla pehmeällä kankaalla.
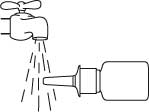
Älä puhdista annostelukärkeä terävällä esineellä, koska tällöin pullosta tuleva annos voi muuttua. Älä irrota pumppuosaa pullosta, sillä silloin pumpun aktivointipaine purkaantuu.
Kuivaa annostelukärki puhtaalla pehmeällä kankaalla tai nenäliinalla.
Käyttö
1. Niistä nenä tyhjäksi.

2. Poista suojatulppa ja varmistinrengas ja laita ne talteen. Pitele pulloa kuten aiemmin on kuvattu.
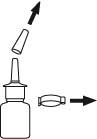
3. Puhdista pumpun kärki.
Pidä pullo vaakasuorassa asennossa ja huuhtele kärkeä 15 sekunnin ajan lämpimällä vedellä, samalla kun puhdistat sitä sormella tai pehmeällä kankaalla.
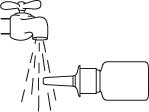
Älä puhdista annostelukärkeä terävällä esineellä, koska tällöin pullosta tuleva annos voi muuttua. Älä irrota pumppuosaa pullosta, sillä silloin pumpun aktivointipaine purkaantuu.
Kuivaa kärki puhtaalla pehmeällä kankaalla tai nenäliinalla.
4. Taivuta päätä hieman alaspäin. Paina sormella toinen sierain kiinni ja vie pullon annostelukärki toiseen sieraimeen, niin että se osoittaa kohti nenän takaosaa ja ulkoseinämää.
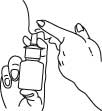
5. Paina pullon pumppua nopeasti ja voimakkaasti yhden kerran, samalla kun hengität rauhallisesti sisään sieraimen kautta.
Jos lääkäri on määrännyt sinulle 4 suihketta päivässä, annostele nyt yksi suihke myös toiseen sieraimeen.
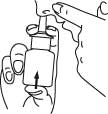
6. Poista annostelukärki sieraimesta ja taivuta pää taaksepäin muutamaksi sekunniksi niin, että liuos levittyy nenän limakalvolle.

7. Puhdista pumpun kärki.
Pidä pullo vaakasuorassa asennossa ja huuhtele kärkeä noin 15 sekunnin ajan lämpimällä vedellä, samalla kun puhdistat sitä sormella tai pehmeällä kankaalla.
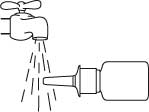
Älä puhdista annostelukärkeä terävällä esineellä, koska tällöin pullosta tuleva annos voi muuttua. Älä irrota pumppuosaa pullosta, sillä silloin pumpun aktivointipaine purkaantuu.
Kuivaa kärki puhtaalla pehmeällä kankaalla tai nenäliinalla.
Annostelukärjen puhdistaminen ennen käyttöä ja sen jälkeen on tärkeää, jotta annostelukärki ei tukkeutuisi, koska tällöin saatat saada vääränsuuruisen lääkeannoksen.
8. Aseta varmistinrengas ja suojatulppa paikoilleen. Tämä on tärkeää, koska se auttaa estämään annostelukärjen tukkeutumista.
Vasta-aiheet
Nafareliiniasetaattia ei saa antaa potilaille,
- jotka ovat yliherkkiä vaikuttavalle aineelle, GnRH-agonistien analogeille tai kohdassa Apuaineet mainituille apuaineille
- joilla on diagnosoimatonta epänormaalia emätinverenvuotoa
- jotka ovat raskaana
- jotka imettävät.
Varoitukset ja käyttöön liittyvät varotoimet
Säännöllisesti annossuosituksen mukaan käytettynä nafareliini estää aivolisäkkeen ja sukupuolirauhasten (munasarjojen ja kivesten) hormonituotantoa. Aivolisäke-sukupuolirauhastoiminta (endogeeninen hormonitoiminta) palautuu normaaliksi yleensä 4–8 viikossa hoidon lopettamisen jälkeen. Hoidon aikana ja 4–8 viikon ajan hoidon päättymisestä aivolisäkkeen ja sukupuolirauhasten diagnostisten toimintakokeiden tulokset voivat olla harhaanjohtavia.
Raskauden mahdollisuus on poissuljettava ennen hoidon aloittamista. Jos potilas unohtaa ottaa lääkettä, seurauksena voi olla läpilyöntiovulaatio ja hedelmöittymisen mahdollisuus. Tämän vuoksi potilaita on neuvottava käyttämään ei-hormonaalista ehkäisyä.
Jos potilas tulee raskaaksi hoidon aikana, hoito on keskeytettävä ja potilaalle on kerrottava sikiön kehitykselle mahdollisesti koituneista riskeistä ja/tai keskenmenon mahdollisuudesta. Koska tällä potilasryhmällä on keskenmenon riski, syy-yhteys nafareliiniasetaattiin on epävarma.
Kuten muidenkin tähän lääkeaineryhmään kuuluvien lääkkeiden käytön yhteydessä, munasarjakystia on ilmoitettu esiintyneen kahden ensimmäisen nafareliiniasetaattihoitokuukauden aikana. Monet näistä tapahtumista, mutta eivät kaikki, ilmenivät potilailla, joilla oli munasarjojen monirakkulatauti.
Suurentuneet kystat voivat hävitä itsestään noin 4–6 viikossa hoidon aloittamisesta, mutta joissakin tapauksissa ne voivat vaatia lääkehoidon keskeyttämistä ja/tai kirurgista toimenpidettä.
Jos endometrioosin ja fibroomien jatkohoitoa nafareliiniasetaatilla harkitaan hoitojakson jälkeen, tulisi luuntiheys mitata ennen uusintahoidon aloittamista ja varmistaa, että arvot ovat normaalit.
Tietoja luuntiheyden muutoksista lapsilla ei ole saatavilla. Aikuisilla 6 kuukauden nafareliiniasetaattihoito ei juurikaan vähentänyt värttinäluun distaalipään ja toisen kämmenluun mineraalipitoisuutta. Selkänikamien trabekulaarisen luun tiheys pieneni keskimäärin 8,7 % ja selkänikamien kokonaismassa 4,3 %. Luukudos palautui huomattavassa määrin hoidon päätyttyä. Hoidon päättyessä tehdyn kaksoisfotoniabsorptiometrimittauksen mukaan selkänikamien kokonaismassa pieneni keskimäärin 5,9 %. Kun mittaus toistettiin 6 kuukauden kuluttua hoidon päättymisestä, selkänikamien keskimääräinen kokonaismassa oli enää 1,4 % pienempi kuin ennen hoitoa.
Nafareliiniasetaatin käytöstä kontrolloituun munasarjojen stimulaatiohoitoon naisille, joilla on munasarjojen monirakkulatauti, ei ole kliinisiä tietoja, mutta hoito saattaa johtaa liialliseen follikkelien stimulaatioon.
Kliinisissä tutkimuksissa Synarela-valmisteen on todettu vain harvoin suurentavan maksan toimintakokeiden arvoja. S-ASAT- ja S-ALAT-arvojen seuraamista kuitenkin suositellaan.
Nafareliinin ja gonadotropiinin samanaikaiseen käyttöön on muiden GnRH-agonistien tavoin raportoitu liittyneen munasarjojen hyperstimulaatio-oireyhtymää. Potilaita, joiden munasarjoja stimuloidaan kontrolloidusti ennen koeputkihedelmöitystä, tulee seurata tarkoin. Jos munasarjojen hyperstimulaatio-oireyhtymän oireita ilmaantuu, hoito tulee lopettaa (ks. kohta Haittavaikutukset).
Potilailla, joita hoidetaan GnRH-agonisteilla, kuten nafareliiniasetaatilla, on olemassa suurentunut riski sairastua masennukseen (joka voi olla vakava). Potilaille pitää kertoa riskistä ja heidän tulee saada asianmukaista hoitoa, jos oireita ilmenee.
Synarela-valmisteen tehoa alle 18-vuotiaiden lasten hoidossa ei ole varmistettu.
Hoitojakson uusimista ei toistaiseksi suositella.
Aivastelu annostelun aikana tai heti sen jälkeen voi heikentää lääkkeen imeytymistä. Jos lääkettä otettaessa tulee aivastus, annoksen uusiminen voi olla suositeltavaa.
Jos nenän tukkoisuutta vähentävän valmisteen käyttö on tarpeen, se tulee annostella vasta 30 minuuttia nafareliiniasetaatin annon jälkeen (ks. kohta Yhteisvaikutukset).
Tietoa apuaineesta
Synarela sisältää säilytysaineena bentsalkoniumkloridia. Pitkäaikainen käyttö saattaa aiheuttaa nenän limakalvojen turvotusta. Jos epäillään nenän limakalvojen pitkittynyttä turvotusta, on valittava bentsalkoniumkloridia sisältämätön nenään annettava lääkevalmiste, jos mahdollista. Jos tällaista nenään annettavaa valmistetta ei ole saatavilla, on harkittava lääkevalmisteen muiden lääkemuotojen käyttöä.
Yhteisvaikutukset
Nafareliiniasetaatilla ei ole tehty farmakokineettisiä lääkkeiden yhteisvaikutustutkimuksia. Yhteisvaikutuksia ei odoteta esiintyvän, koska nafareliiniasetaatti on peptidi, joka hajoaa pääasiassa peptidaasin ei sytokromi P450-entsyymien vaikutuksesta ja koska noin 80 % lääkeaineesta sitoutuu plasman proteiineihin 4 °C:n lämpötilassa.
Nuha ei heikennä nafareliinin imeytymistä nenästä. Nenän tukkoisuutta vähentävän oksimetatsoliinihydrokloridin käyttö 30 minuuttia ennen nafareliinin antoa jatkuvasta nuhasta kärsiville tutkittaville vähensi nafareliinin imeytymistä merkittävästi (AUC0-8h pieneni 39 % ja Cmax 49 %) verrattuna tutkittaviin, joiden nenän limakalvot olivat terveet. Nenän tukkoisuutta vähentävien valmisteiden samanaikaista käyttöä pitäisi pyrkiä rajoittamaan nafareliinin käytön aikana (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Raskaus ja imetys
Raskaus
Nafareliiniasetaatin käytön turvallisuutta raskauden aikana ei ole varmistettu kliinisesti.
Rotilla tehdyissä lisääntymistoksisuustutkimuksissa havaittiin sikiötoksisuutta, kun annokset olivat 10-kertaiset ihmiselle käytettyyn, nenään annosteltuun annokseen nähden. Vastaavaa toksisuutta ei todettu hiirillä tai kaneilla (ks. kohta Prekliiniset tiedot turvallisuudesta).
Nafareliiniasetaatti voi aiheuttaa sikiövaurioita, jos sitä annetaan raskaana olevalle naiselle (ks. kohta Prekliiniset tiedot turvallisuudesta). Siksi nafareliiniasetaatin käyttö on vasta-aiheista raskauden aikana (ks. kohta Vasta-aiheet).
Raskauden mahdollisuus on poissuljettava ennen Synarela-hoidon aloittamista.
Imetys
Ei tiedetä, erittyykö nafareliiniasetaatti äidinmaitoon. Koska nafareliiniasetaatin vaikutuksia rintaruokittuun lapseen ei ole selvitetty, imetys on vasta-aiheista (ks. kohta Vasta-aiheet).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Ei merkityksellinen.
Haittavaikutukset
Nafareliinihoito voi aluksi ohimenevästi pahentaa endometrioosia ja pitkäaikaishoito voi aiheuttaa menopausaalisen tilan.
Esiintymistiheydet on määritelty seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10); melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Seuraavia haittavaikutuksia on havaittu ja raportoitu nafareliiniasetaatin käytön yhteydessä 282 aikuisella:
Elinjärjestelmä | Esiintymistiheys | Haittavaikutukset |
Immuunijärjestelmä | Yleinen | lääkeyliherkkyys (rintakipu, hengenahdistus, kutina, ihottuma, nokkosihottuma) |
Umpieritys | Yleinen | estrogeenivajaus |
Aineenvaihdunta ja ravitsemus | Hyvin yleinen | painon nousu |
Yleinen | painon lasku | |
Psyykkiset häiriöt | Hyvin yleinen | mielialan ailahtelu, libidon heikkeneminen |
Yleinen | masennus, unettomuus, libidon voimistuminen | |
Hermosto | Hyvin yleinen | päänsärky |
Yleinen | tuntoharhat | |
Verisuonisto | Hyvin yleinen | kuumat aallot |
Yleinen | verenpaineen kohoaminen, verenpaineen lasku | |
Hengityselimet, rintakehä ja välikarsina | Hyvin yleinen | nuha |
Iho ja ihonalainen kudos | Hyvin yleinen | akne, seborrea |
Yleinen | hirsutismi | |
Melko harvinainen | hiusten lähtö | |
Luusto, lihakset ja sidekudos | Hyvin yleinen | lihaskipu |
Melko harvinainen | nivelkipu | |
Sukupuolielimet ja rinnat | Hyvin yleinen | rintojen koon pieneneminen, ulkosynnyttimien ja emättimen kuivuus |
Yleinen | keinotekoinen menopaussi, kohtuverenvuoto | |
Melko harvinainen | rintojen koon suurentuminen, munasarjakysta | |
Tuntematon | munasarjojen hyperstimulaatio-oireyhtymä | |
Yleisoireet ja antopaikassa todettavat haitat | Hyvin yleinen | turvotus |
Tutkimukset | Yleinen | luuntiheyden pieneneminen |
Seuraavia haittavaikutuksia on havaittu ja raportoitu nafareliiniasetaatin käytön yhteydessä 155 lapsipotilaalla:
Elinjärjestelmä | Esiintymistiheys | Haittavaikutukset |
Immuunijärjestelmä | Yleinen | lääkeyliherkkyys (rintakipu, hengenahdistus, kutina, ihottuma, nokkosihottuma) |
Psyykkiset häiriöt | Yleinen | mielialan ailahtelu |
Verisuonisto | Yleinen | kuumat aallot |
Hengityselimet, rintakehä ja välikarsina | Yleinen | nuha |
Iho ja ihonalainen kudos | Yleinen | akne, hirsutismi, seborrea, ihon poikkeava haju |
Sukupuolielimet ja rinnat | Yleinen | rintojen koon suurentuminen, emätinerite, emätinverenvuoto |
Seuraavia haittavaikutuksia on havaittu ja raportoitu GnRH-agonistien (esim. busereliini, gosereliini, histereliini, leuproreliini, nafareliini, triptoreliini) käytön yhteydessä:
Elinjärjestelmä | Esiintymistiheys | Haittavaikutukset |
Hermostolliset/psyykkiset | Pitkäaikainen käyttö: Yleinen | mielialan vaihtelut, masennus |
Lyhytaikainen käyttö: Melko harvinainen* | mielialan vaihtelut, masennus |
* Esiintymistaajuus voi olla suurempi tietyillä valmisteilla perustuen valmiste- ja indikaatiokohtaisiin kliinisiin tutkimuksiin.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Eläimillä ihmisen suositusannoksiin nähden jopa 60-kertaiset ihon alle annetut annokset (mikrog/kg nafareliinia) eivät aiheuttaneet haittavaikutuksia. Suun kautta annettu nafareliini hajoaa maha-suolikanavassa entsyymitoiminnan vaikutuksesta ja on siksi inaktiivinen.
Yliannostuksen hoito on oireenmukaista ja elintoimintoja tukevaa.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Gonadotropiinia vapauttavat hormonit, ATC-koodi: H01CA02
Nafareliini on gonadoliberiinin (GnRH) potentti agonistijohdos. Kerta-annos nafareliinia stimuloi gonadotropiinien, luteinisoivan hormonin (LH) ja follikkelia stimuloivan hormonin (FSH), vapautumista aivolisäkkeestä, mikä lisää munasarjojen ja kivesten steroidituotantoa. Toistuvassa annostelussa vaste heikkenee vähitellen. Päivittäinen annostelu johtaa 3–4 viikossa aivolisäkkeen gonadotropiinierityksen vähenemiseen tai erittyvien gonadotropiinien biologisen aktiivisuuden vähenemiseen. Seurauksena on steroidituotannon vaimeneminen ja sukupuolihormoneista riippuvaisten kudosten ja toimintojen estyminen. Sekundaarinen seksuaalinen kehitys pysähtyy ja kasvu sekä luuston kehitys hidastuvat.
Farmakokinetiikka
Nenään annosteltu nafareliini imeytyy nopeasti yleiseen verenkiertoon. Huippupitoisuus plasmassa saavutetaan 400 mikrogramman annoksella 20 minuutissa. Puoliintumisaika plasmassa on aikuisilla noin 4 tuntia ja lapsilla 2,6 tuntia. Nenään annetun annoksen biologinen hyötyosuus on keskimäärin 2,8 % (vaihteluväli 1,2–5,6 %). Merkittävää kertymistä elimistöön ei havaittu, kun 18 terveelle naiselle annettiin 200 tai 400 mikrogrammaa nafareliinia kahdesti vuorokaudessa 22 päivän ajan.
Nenän tukkoisuutta lievittävien valmisteiden käyttö 30 minuuttia ennen nafareliinin antamista vähensi sen imeytymistä.
In vitro -tutkimuksissa 78–84 % nafareliinista sitoutui plasman proteiineihin, pääasiassa albumiinifraktioon.
Kolmella koehenkilöllä, joille annettiin 14C-nafareliinia ihon alle, 44–56 % annoksesta erittyi virtsaan ja 19–44 % ulosteeseen. Noin 3 % annoksesta erittyi muuttumattomana nafareliinina virtsaan. Annetusta annoksesta erittyi kaiken kaikkiaan keskimäärin 83 %. Kuusi metaboliittia on tunnistettu, mutta niiden biologista aktiivisuutta ei ole määritetty.
Prekliiniset tiedot turvallisuudesta
Muiden GnRH-agonistien tavoin nafareliinin parenteraalinen anto jyrsijöille suurina annoksina pitkään aiheuttaa endokriinisten kudosten, myös aivolisäkkeen etuosan (adenooma/karsinooma), hyperplasiaa ja neoplasiaa sekä hiirille että rotille; haimasaarekkeiden, lisämunuaisytimen, kivesten ja munasarjojen kasvaimia puolestaan esiintyi vain rotilla tehdyissä pitkäaikaistutkimuksissa. Näillä kasvaimilla ei todettu etäpesäkkeitä. Apinoille, joita hoidettiin suurilla nafareliiniannoksilla vuoden ajan, ei kehittynyt kasvaimia eikä proliferatiivisia muutoksia. GnRH-analogien kasvaimia aiheuttavasta ominaisuudesta ei ole näyttöä ihmisellä.
Nafareliinin mutageenisuudesta ei ole saatu näyttöä bakteereilla ja nisäkässoluilla tehdyissä tutkimuksissa.
Naaras- ja urosrotilla tehdyissä lisääntymistutkimuksissa, joissa lääkettä annettiin enintään 6 kuukautta yhtäjaksoisesti, on osoitettu, että hedelmällisyyttä heikentävä vaikutus korjaantuu täysin, kun lääkehoito lopetetaan.
Eräässä tutkimuksessa rotille annettiin tiineyspäivinä 6–15 lääkettä 0,4; 1,6 ja 6,4 mikrog/kg/vrk (vastaa 0,6-, 2,5- ja 10-kertaista intranasaalista annosta ihmisellä) lihakseen. Suurimman annoksen ryhmässä neljällä sikiöllä 80:sta, todettiin vakavia epämuodostumia, joita ei havaittu toistotutkimuksessa rotilla. Hiiri- ja kaniinitutkimuksissa ei myöskään saatu viitteitä sikiöepämuodostumien lisääntymisestä. Rotilla todettiin suurimmalla tutkitulla annoksella annoksesta riippuvaista sikiökuolleisuuden lisääntymistä ja sikiön painon alentumista. Nämä vaikutukset rottien sikiökuolleisuuteen ovat looginen seuraus lääkkeen tälle lajille aiheuttamasta hormonitasojen muuttumisesta.
Farmaseuttiset tiedot
Apuaineet
Sorbitoli 50 mg/ml
Bentsalkoniumkloridi
Väkevä etikkahappo
Natriumhydroksidi tai kloorivetyhappo (pH:n säätöön)
Puhdistettu vesi
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
2 vuotta.
Säilytys
Säilytä pystyasennossa, alle 25 °C. Säilytä ulkopakkauksessa. Ei saa jäätyä.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
SYNARELA nenäsumute, liuos
200 mikrog/annos (L:ei) 60 annosta (122,00 €)
PF-selosteen tieto
4 ml = 30 annosta, 8 ml = 60 annosta
PVC-päällysteinen lasinen sumutinpullo, jossa mekaaninen pumppu. Pakattu pahvikoteloon, jossa pakkausseloste.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Kirkas, väritön tai hieman kellertävä liuos.
Käyttö- ja käsittelyohjeet
Jotta voidaan varmistaa, että sumutinpullosta saadaan oikea lääkeannos, niin annostelukärki on tärkeä puhdistaa pullon aktivoinnin jälkeen (ensimmäisen käyttökerran yhteydessä). Tämän jälkeen annostelukärki on puhdistettava aina ennen käyttöä ja käytön jälkeen, jotta se ei tukkeutuisi (ks. kohta Annostus ja antotapa).
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
SYNARELA nenäsumute, liuos
200 mikrog/annos 60 annosta
- Peruskorvaus (40 %).
ATC-koodi
H01CA02
Valmisteyhteenvedon muuttamispäivämäärä
11.08.2022
Yhteystiedot
 PFIZER OY
PFIZER OY Tietokuja 4
00330 Helsinki
09 430 040
www.pfizer.fi
etunimi.sukunimi@pfizer.com
