PRO-EPANUTIN infuusiokonsentraatti, liuosta varten/injektioneste, liuos 75 mg/ml (50 mg/ml FE)
Vaikuttavat aineet ja niiden määrät
Fosfenytoiininatrium-injektio on aihiolääke, joka on tarkoitettu annettavaksi parenteraalisesti. Sen aktiivinen metaboliitti on fenytoiini. 1,5 mg fosfenytoiininatriumia vastaa 1 mg fenytoiininatriumia, mistä käytetään merkintää 1 mg fenytoiininatriumekvivalentteja (FE). Fosfenytoiinin määrä ja pitoisuus ilmaistaan aina muodossa mg FE.
Yksi millilitra Pro-Epanutinia sisältää 75 mg fosfenytoiininatriumia (vastaa 50 mg:aa fenytoiininatriumia) (ks. kohta Annostus ja antotapa).
Pro-Epanutin on saatavana 10 ml:n ja 2 ml:n injektiopulloissa.
Yksi 10 ml:n injektiopullo sisältää 500 mg FE.
Yksi 2 ml:n injektiopullo sisältää 100 mg FE.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Infuusiokonsentraatti, liuosta varten / Injektioneste, liuos.
Kliiniset tiedot
Käyttöaiheet
Pro-Epanutin on tarkoitettu aikuisille ja 5 vuotta täyttäneille lapsille:
- toonis-kloonisen (grand mal) status epilepticuksen hallintaan (ks. kohta Annostus ja antotapa).
- neurokirurgian ja/tai pään vamman yhteydessä ilmenevien kouristusten ehkäisyyn ja hoitoon.
- korvaamaan suun kautta otettava fenytoiini silloin, kun anto suun kautta ei ole mahdollista ja/tai se on vasta-aiheista.
Annostus ja antotapa
TÄRKEÄÄ: Fosfenytoiinin määrä ja pitoisuus ilmoitetaan kaikissa Pro-Epanutinin tuotetiedoissa aina fenytoiininatriumekvivalentteina (FE), jotta vältytään molekyylipainoon perustuvalta säädöltä muunneltaessa fosfenytoiininatrium- ja fenytoiininatriumannosten välillä. Pro-Epanutin pitää aina määrätä ja toimittaa fenytoiininatriumekvivalentti-yksikköinä (FE). Huomaa kuitenkin, että fosfenytoiinin annossa on tärkeitä eroavaisuuksia verrattuna parenteraalisen fenytoiininatriumin annosteluun (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Fenytoiininatriumekvivalentit (FE):
1,5 mg fosfenytoiinia vastaa 1 mg fenytoiininatriumia, joka merkitään 1 mg fenytoiininatriumekvivalentteja (FE) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet Varoitukset ja käyttöön liittyvät varotoimet).
Yksi 10 ml:n Pro-Epanutin-injektiopullo sisältää 500 mg FE:tä.
Yksi 2 ml:n Pro-Epanutin-injektiopullo sisältää 100 mg FE:tä.
Antotapa
Pro-Epanutinin voi joko infusoida laskimoon (i.v.) tai injisoida lihakseen (i.m.). Lihaksensisäistä antotapaa pitää harkita aikuispotilaille silloin, kun kiireellistä hoitovastetta ei tarvita. Jos päätavoite on nopea fenytoiinin kyllästysannoksen antaminen, Pro-Epanutinin anto laskimoon on suositeltavaa, koska laskimoon annon jälkeen saavutetaan terapeuttinen fenytoiinipitoisuus plasmassa nopeammin kuin lihaksensisäisen annon jälkeen.
Pro-Epanutinia ei saa antaa lihakseen hätätilanteissa, esim. status epilepticuksessa.
Lihaksensisäistä antoa ei suositella lapsille.
Valmistetta ei saa käyttää, jos siinä näkyy hiukkasia tai sen väri on muuttunut.
Pro-Epanutin on tarkoitettu lyhytaikaiseen parenteraaliseen antoon. Yli 5 päivää kestävää käyttöä ei ole arvioitu.
Annostus
Laskimoinfuusio (i.v.)
Laskimoinfuusiota varten Pro-Epanutin laimennetaan 5 % glukoosi-infuusioliuokseen tai 0,9 % natriumkloridi-infuusioliuokseen. Pitoisuuden pitää olla 1,5−25 mg FE/ml.
Hypotensioriskin vuoksi suositeltava laskimoinfuusionopeus on kliinisissä rutiinitilanteissa 50−100 mg FE/min. Edes hätätilanteessa antonopeus ei saa olla yli 150 mg FE/min. Infuusionopeutta kontrolloivan laitteen käyttöä suositellaan.
Taulukot 1−10 sisältävät esimerkkilaskelmia annostuksesta, laimentamisesta ja infuusioajoista.
Jatkuva EKG-valvonta, verenpaineen mittaus ja hengitystoiminnan seuranta infuusion aikana on välttämätöntä. Potilasta on seurattava myös koko sen ajan, jolloin fenytoiinin huippupitoisuus plasmassa saavutetaan. Tämä tapahtuu noin 30 minuutin kuluttua Pro-Epanutin-infuusion jälkeen.
Sydämen elvyttämiseen tarkoitettu laitteisto pitää olla käytettävissä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
| Katso taulukoista 1−10 esimerkkilaskelmia annostuksesta, laimentamisesta ja infuusioajoista | |||
| Populaatio | Käyttöaihe | Annostustaulukko | |
| Aikuiset | Status epilepticus | Kyllästysannos | Taulukko 1 |
| Status epilepticus | Ylläpitoannos | Taulukko 2 | |
| Kohtausten hoito tai ehkäisy | Kyllästysannos | Taulukko 3 | |
| Kohtausten hoito tai ehkäisy | Ylläpitoannos | Taulukko 4 | |
| Suun kautta otettavan fenytoiinin tilapäinen korvaaminen | Taulukko 5 | ||
| Lapset (5 vuotta täyttäneet) | Status epilepticus | Kyllästysannos | Taulukko 6 |
| Status epilepticus | Ylläpitoannos | Taulukko 7 | |
| Kohtausten hoito tai ehkäisy | Kyllästysannos | Taulukko 8 | |
| Kohtausten hoito tai ehkäisy | Ylläpitoannos | Taulukko 9 | |
| Suun kautta otettavan fenytoiinin tilapäinen korvaaminen | Taulukko 10 | ||
ANNOSTUS AIKUISILLE
(Annostuksen pienentäminen iäkkäille potilaille tai potilaille, joilla on munuaisten tai maksan vajaatoiminta, ks. ohjeistus tämän kappaleen loppupuolella.)
Status epilepticus
Pro-Epanutinin antoa lihakseen (i.m.) ei suositella status epilepticuksen hoidossa.
Kyllästysannos:
Kun tarvitaan nopeaa hoitovastetta potilaalle, jolla on jatkuvia kouristuksia, pitää laskimoon antaa diatsepaamia tai loratsepaamia ennen Pro-Epanutinin antoa.
Pro-Epanutinin kyllästysannos on 15 mg FE/kg, ja se infusoidaan kerta-annoksena laskimoon.
Suositeltava (aikuisten kyllästysannoksen)laskimoinfuusionopeus: 100−150 mg FE/min (ei saa edes hätätilanteessaolla yli 150 mg FE/min). Katso taulukosta 1 infuusioajat.
Jos Pro-Epanutinin anto ei lopeta kohtauksia, on harkittava jonkin vaihtoehtoisen kouristuksia ehkäisevän lääkkeen käyttöä.
Taulukossa 1. on tietoa status epilepticuksen hallintaan käytetystä kyllästysannoksesta aikuiselle.
| TAULUKKO 1. STATUS EPILEPTICUKSEN HALLINTAAN KÄYTETTY KYLLÄSTYSANNOS (AIKUISET) | |||||
| Esimerkkejä laskimonsisäisistä 15 mg FE†/kg -kyllästysannoksista ja suosituksia laimennoksista (25 mg:aan FE/ml) ja laskimoinfuusioajoista (enimmäisnopeudella 150 mg FE/min) kehon painokiloa kohti | |||||
| Paino (kg) | Annos (mg FE) | Pro-Epanutinin (50 mg FE/ml) tilavuus | Laimennusliuoksen tilavuus (ml) (5 % glukoosi tai 0,9 % natriumkloridi) lopulliseen pitoisuuteen 25 mg FE/ml | Lyhyin infuusioaika (minuuttia) suositellun enimmäis-infuusionopeuden 150 mg FE/min saavuttamiseksi | |
Avattavien 10 ml pullojen lukumäärä | Tarvittava tilavuus (ml) | ||||
| 100 | 1 500 | 3 | 30 | 30 | 10 |
| 95 | 1 425 | 3 | 28,5 | 28,5 | 9,5 |
| 90 | 1 350 | 3 | 27 | 27 | 9 |
| 85 | 1 275 | 3 | 25,5 | 25,5 | 8,5 |
| 80 | 1 200 | 3 | 24 | 24 | 8 |
| 75 | 1 125 | 3 | 22,5 | 22,5 | 7,5 |
| 70 | 1 050 | 3 | 21 | 21 | 7 |
| 65 | 975 | 2 | 19,5 | 19,5 | 6,5 |
| 60 | 900 | 2 | 18 | 18 | 6 |
| 55 | 825 | 2 | 16,5 | 16,5 | 5,5 |
| 50 | 750 | 2 | 15 | 15 | 5 |
| 45 | 675 | 2 | 13,5 | 13,5 | 4,5 |
† FE - fenytoiininatriumekvivalentteja Huomautus: Sopiva annos, annostilavuus, Pro-Epanutin-injektiopullojen määrä, laimennusliuoksen tilavuus ja infuusion vähimmäisaika on aina laskettava potilaan tarkan painon mukaan, kun se ei sisälly esimerkkeihin. | |||||
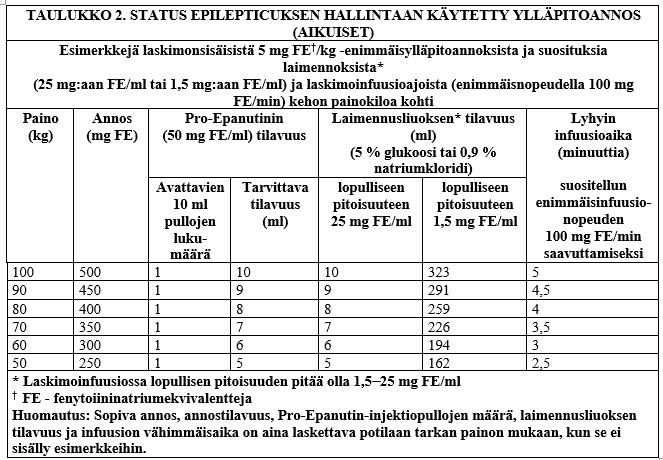
Ylläpitoannos:
Pro-Epanutinin suositeltava ensimmäinen ylläpitoannos on 4−5 mg FE/kg/vrk, ja sen voi joko infusoida laskimoon tai injisoida lihakseen yhtenä annoksena tai jaettuna kahteen annokseen. Ensimmäinen kumulatiivinen vuorokausiannos saa olla korkeintaan 4–5 mg FE/kg/vrk. Kyllästysannoksen antamisen jälkeen ylläpitoannokset on tyypillisesti aloitettava seuraavan tunnetun antovälin mukaisesti. Jos esimerkiksi annosten välin on tarkoitus olla 12 tuntia, ensimmäinen Pro-Epanutinin ylläpitoannos on annettava 12 tuntia kyllästysannoksen jälkeen.
Ylläpitoannosta on muutettava potilaan vasteen ja plasman fenytoiinipitoisuuksien mukaan (ks. Terapeuttisten lääkeainepitoisuuksien seuranta).
Suositeltava (aikuisten ylläpitoannoksen) laskimoinfuusionopeus:
50−100 mg FE/min (ei saa olla yli 100 mg FE/min). Katso taulukosta 2 infuusioajat.
Ylläpitohoitoon suun kautta annettavalla fenytoiinilla siirrytään, kun se on asianmukaista.
Taulukossa 2. on tietoa status epilepticuksen hallintaan käytetystä ylläpitoannoksesta aikuiselle.
Kohtausten hoito tai ehkäisy
Kyllästysannos:
Pro-Epanutinin kyllästysannos on 10−15 mg FE/kg kerta-annoksena, ja se joko infusoidaan laskimoon tai injisoidaan lihakseen.
Suositeltava (aikuisten kyllästysannoksen) laskimoinfuusionopeus: 50−100 mg FE/min (ei saa olla yli 100 mg FE/min). Katso taulukosta 3 infuusioajat.
Taulukossa 3. on tietoa kohtausten hoitoon tai ehkäisyyn käytetystä kyllästysannoksesta aikuiselle.
| TAULUKKO 3. KOHTAUSTEN HOITOON TAI EHKÄISYYN KÄYTETTY KYLLÄSTYSANNOS (AIKUISET) | ||||||
| Esimerkkejä laskimonsisäisistä 10 mg FE†/kg -kyllästysannoksista ja suosituksia laimennoksistaa (25 mg:aan FE/ml tai 1,5 mg:aan FE/ml) ja laskimoinfuusioajoista (enimmäisnopeudella 100 mg FE/min) kehon painokiloa kohti. | ||||||
| Paino (kg) | Annos (mg FE) | Pro-Epanutinin (50 mg FE/ml) tilavuus | Laimennusliuoksena tilavuus (ml) (5 % glukoosi tai 0,9 % natriumkloridi) | Lyhyin infuusioaika (minuuttia) suositellun enimmäis- infuusionopeuden 100 mg FE/min saavuttamiseksi | ||
| Avattavien 10 ml pullojen lukumäärä | Tarvittava tilavuus (ml) | lopulliseen pitoisuuteen 25 mg FE/ml | lopulliseen pitoisuuteen 1,5 mg FE/ml | |||
| 100 | 1 000 | 2 | 20 | 20 | 647 | 10 |
| 90 | 900 | 2 | 18 | 18 | 582 | 9 |
| 80 | 800 | 2 | 16 | 16 | 517 | 8 |
| 70 | 700 | 2 | 14 | 14 | 453 | 7 |
| 60 | 600 | 2 | 12 | 12 | 388 | 6 |
| 50 | 500 | 1 | 10 | 10 | 323 | 5 |
†FE - fenytoiininatriumekvivalentteja a Laskimoinfuusiossa lopullisen pitoisuuden pitää olla 1,5−25 mg FE/ml. Huomautus: Sopiva annos, annostilavuus, Pro-Epanutin-injektiopullojen määrä, laimennusliuoksen tilavuus ja infuusion vähimmäisaika on aina laskettava potilaan tarkan painon mukaan, kun se ei sisälly esimerkkeihin. | ||||||
Ylläpitoannos:
Pro-Epanutinin suositeltava ensimmäinen ylläpitoannos on 4−5 mg FE/kg/vrk, ja sen voi joko infusoida laskimoon tai injisoida lihakseen yhtenä annoksena tai jaettuna kahteen annokseen.
Ensimmäinen kumulatiivinen vuorokausiannos saa olla korkeintaan 4–5 mg FE/kg/vrk. Kyllästysannoksen antamisen jälkeen ylläpitoannokset on tyypillisesti aloitettava seuraavan tunnetun antovälin mukaisesti. Jos esimerkiksi annosten välin on tarkoitus olla 12 tuntia, ensimmäinen Pro-Epanutinin ylläpitoannos on annettava 12 tuntia kyllästysannoksen jälkeen.
Ylläpitoannosta on muutettava potilaan vasteen ja plasman fenytoiinipitoisuuksien mukaan (ks. Terapeuttisten lääkeainepitoisuuksien seuranta).
Suositeltava (aikuisten ylläpitoannoksen) laskimoinfuusionopeus:
50−100 mg FE/min (ei saa olla yli 100 mg FE/min). Katso taulukosta 4 infuusioajat.
Ylläpitohoitoon suun kautta annettavalla fenytoiinilla siirrytään, kun se on asianmukaista.
Taulukossa 4. on tietoa kohtausten hoitoon tai ehkäisyyn käytetystä ylläpitoannoksesta aikuiselle.
| TAULUKKO 4. KOHTAUSTEN HOITOON TAI EHKÄISYYN KÄYTETTY YLLÄPITOANNOS (AIKUISET) | ||||||
| Esimerkkejä laskimonsisäisistä 5 mg FE†/kg:n enimmäisylläpitoannoksista ja suosituksia laimennoksista* (25 mg:aan FE/ml tai 1,5 mg:aan FE/ml) ja laskimoinfuusioajoista (enimmäisinfuusionopeudella 100 mg FE/min) kehon painokiloa kohti. | ||||||
| Paino (kg) | Annos (mg FE) | Pro-Epanutinin (50 mg FE/ml) tilavuus | Laimennusliuoksen* tilavuus (ml) (5 % glukoosi tai 0,9 % natriumkloridi) | Lyhyin infuusioaika (minuuttia) suositellun enimmäis- infuusionopeuden 100 mgFE/min saavuttamiseksi | ||
| Avattavien 10 ml pullojen lukumäärä | Tarvittava tilavuus (ml) | lopulliseen pitoisuuteen 25 mg FE/ml | lopulliseen pitoisuuteen 1,5 mg FE/ml | |||
| 100 | 500 | 1 | 10 | 10 | 323 | 5 |
| 90 | 450 | 1 | 9 | 9 | 291 | 4,5 |
| 80 | 400 | 1 | 8 | 8 | 259 | 4 |
| 70 | 350 | 1 | 7 | 7 | 226 | 3,5 |
| 60 | 300 | 1 | 6 | 6 | 194 | 3 |
| 50 | 250 | 1 | 5 | 5 | 162 | 2,5 |
* Laskimoinfuusiossa lopullisen pitoisuuden pitää olla 1,5−25 mg FE/ml † FE - fenytoiininatriumekvivalentteja Huomautus: Sopiva annos, annostilavuus, Pro-Epanutin-injektiopullojen määrä, laimennusliuoksen tilavuus ja infuusion vähimmäisaika on aina laskettava potilaan tarkan painon mukaan, kun se ei sisälly esimerkkeihin. | ||||||
Suun kautta annettavan fenytoiininatriumhoidon tilapäinen korvaaminen Pro-Epanutinilla
Fenytoiininatriumekvivalenttien (FE) vuorokausikokonaisannos ja antoväli ovat samat kuin suun kautta annettavassa fenytoiininatriumhoidossa. Pro-Epanutinin voi joko infusoida laskimoon tai injisoida lihakseen.
Terapeuttisten lääkeainepitoisuuksien seuranta voi olla hyödyllistä vaihdettaessa valmistetta ja/tai antotapaa. Annosta pitää säätää potilaan vasteen ja plasman fenytoiinipitoisuuksien mukaan (ks. Terapeuttisten lääkeainepitoisuuksien seuranta).
Suositeltava laskimoinfuusionopeus (tilapäisessä annoksen korvaamisessa aikuisilla):
50−100 mg FE/min (ei saa olla yli 100 mg FE/min). Katso taulukosta 5 infuusioajat.
Taulukossa 5. on tietoa aikuisten annostuksesta, kun suun kautta annettava fenytoiininatriumhoito korvataan tilapäisesti.
| TAULUKKO 5. SUUN KAUTTA ANNETTAVAN FENYTOIININATRIUMHOIDON TILAPÄINEN KORVAAMINEN (AIKUISET) | ||||||
| Esimerkkejä ekvivalenteista annoksista ja suosituksia laimennoksista* (25 mg:aan FE†/ml tai 1,5 mg:aan FE/ml) ja laskimoinfuusioajoista (enimmäisinfuusionopeudella 100 mg FE/min) | ||||||
| Fenytoiininatriumin annos (mg) | Annos (mg FE) | Pro-Epanutinin (50 mg FE/ml) tilavuus | Laimennusliuoksen* tilavuus (ml) (5 % glukoosi tai 0,9 % natriumkloridi) | Lyhyin infuusioaika (minuuttia) suositellun enimmäisinfuusio-nopeuden 100 mg FE/min saavuttamiseksi | ||
Avattavien 10 ml pullojen lukumäärä | Tarvittava tilavuus (ml) | lopulliseen pitoisuuteen 25 mg FE/ml | lopulliseen pitoisuuteen 1,5 mg FE/ml | |||
| 500 | 500 | 1 | 10 | 10 | 323 | 5 |
| 450 | 450 | 1 | 9 | 9 | 291 | 4,5 |
| 400 | 400 | 1 | 8 | 8 | 259 | 4 |
| 350 | 350 | 1 | 7 | 7 | 226 | 3,5 |
| 300 | 300 | 1 | 6 | 6 | 194 | 3 |
| 250 | 250 | 1 | 5 | 5 | 162 | 2,5 |
* Laskimoinfuusiossa lopullisen pitoisuuden pitää olla 1,5−25 mg FE/ml † FE - fenytoiininatriumekvivalentteja Huomautus: Sopiva annos, annostilavuus, Pro-Epanutin-injektiopullojen määrä, laimennusliuoksen tilavuus ja infuusion vähimmäisaika on aina laskettava potilaan tarkan painon mukaan, kun se ei sisälly esimerkkeihin. | ||||||
ANNOSTUS LAPSILLE
Vastasyntyneet ja korkeintaan 5 vuotta täyttäneet lapset
Pro-Epanutinin turvallisuutta ja tehoa alle 5-vuotiaille lapsille ei ole vahvistettu.
5 vuotta täyttäneet lapset
Pro-Epanutinia voidaan antaa lapsille (5 vuotta täyttäneille) ainoastaan laskimoinfuusiona, samalla mg FE/kg -annoksella kuin aikuisille. Lasten Pro-Epanutin-annokset perustuvat tietoihin Pro-Epanutinin farmakokinetiikasta aikuisilla ja 5−10-vuotiailla lapsilla sekä parenteraalisen fenytoiinin farmakokinetiikasta aikuisilla ja lapsilla.
Lihaksensisäistä (i.m.) antotapaa ei suositella lapsille.
Annostuksen pienentäminen potilaille, joilla on munuaisten tai maksan vajaatoiminta, ks. ohjeistus tämän kappaleen loppupuolella.
Status epilepticus
Kyllästysannos:
Kun tarvitaan nopeaa hoitovastetta potilaalle, jolla on jatkuvia kouristuksia, pitää laskimoon antaa diatsepaamia tai loratsepaamia ennen Pro-Epanutinin antoa.
Pro-Epanutinin kyllästysannos on 15 mg FE/kg, ja se infusoidaan kerta-annoksena laskimoon.
Suositeltava (lasten kyllästysannoksen) laskimoinfuusionopeus:
2−3 mg FE/kg/min (ei saa olla yli 3 mg FE/kg/min tai yli 150 mg FE/min, kumpi tahansa on hitaampi). Katso taulukosta 6 infuusioajat.
Jos Pro-Epanutinin anto ei lopeta kohtauksia, on harkittava jonkin vaihtoehtoisen antikonvulsiivisen lääkkeen käyttöä.
Taulukossa 6. on tietoa status epilepticuksen hallintaan käytetystä kyllästysannoksesta lapselle.
| TAULUKKO 6. STATUS EPILEPTICUKSEN HALLINTAAN KÄYTETTY KYLLÄSTYSANNOS (5 VUOTTA TÄYTTÄNEET LAPSET) | |||||
| Esimerkkejä laskimonsisäisistä 15 mg FE†/kg -kyllästysannoksista ja suosituksia laimennoksista (25 mg:aan FE/ml) ja laskimoinfuusioajoista (korkeintaan 3 mg FE/kg/min) kehon painokiloa kohti | |||||
| Paino (kg) | Annos (mg FE) | Pro-Epanutinin (50 mg FE/ml) tilavuus | Laimennusliuoksen tilavuus (ml) (5 % glukoosi tai 0,9 % natriumkloridi) lopulliseen pitoisuuteen 25 mg FE/ml | Lyhyin infuusioaika (minuuttia) suositellun enimmäisinfuusio-nopeuden 3 mg FE/kg/ min saavuttamiseksi | |
| Avattavien 10 ml pullojen lukumäärä | Tarvittava tilavuus (ml) | ||||
| 47,5 | 712,5 | 2 | 14,25 | 14,25 | 5 |
| 45 | 675 | 2 | 13,5 | 13,5 | 5 |
| 42,5 | 637,5 | 2 | 12,75 | 12,75 | 5 |
| 40 | 600 | 2 | 12 | 12 | 5 |
| 37,5 | 562,5 | 2 | 11,25 | 11,25 | 5 |
| 35 | 525 | 2 | 10,5 | 10,5 | 5 |
| 32,5 | 487,5 | 1 | 9,75 | 9,75 | 5 |
| 30 | 450 | 1 | 9 | 9 | 5 |
| 27,5 | 412,5 | 1 | 8,25 | 8,25 | 5 |
| 25 | 375 | 1 | 7,5 | 7,5 | 5 |
| 22,5 | 337,5 | 1 | 6,75 | 6,75 | 5 |
| 20 | 300 | 1 | 6 | 6 | 5 |
| 17,5 | 262,5 | 1 | 5,25 | 5,25 | 5 |
† FE - fenytoiininatriumekvivalentteja Huomautus: Sopiva annos, annostilavuus, Pro-Epanutin-injektiopullojen määrä, laimennusliuoksen tilavuus ja infuusion vähimmäisaika on aina laskettava potilaan tarkan painon mukaan, kun se ei sisälly esimerkkeihin. | |||||
Ylläpitoannos:
Pro-Epanutinin suositeltava ensimmäinen ylläpitoannos on 4−5 mg FE/kg/vrk, ja sen voi infusoida laskimoon yhtenä annoksena tai jaettuna korkeintaan neljään annokseen. Ensimmäinen kumulatiivinen vuorokausiannos saa olla korkeintaan 4–5 mg FE/kg/vrk. Kyllästysannoksen antamisen jälkeen ylläpitoannokset on tyypillisesti aloitettava seuraavan tunnetun antovälin mukaisesti. Jos esimerkiksi annosten välin on tarkoitus olla 12 tuntia, ensimmäinen Pro-Epanutinin ylläpitoannos on annettava 12 tuntia kyllästysannoksen jälkeen.
Ylläpitoannosta on muutettava potilaan vasteen ja plasman fenytoiinipitoisuuksien mukaan (ks. Terapeuttisten lääkeainepitoisuuksien seuranta).
Suositeltava laskimoinfuusionopeus (lasten ylläpitoannostuksessa):
1−2 mg FE/kg/min (ei saa olla yli 2 mg FE/kg/min tai 100 mg FE/min, kumpi tahansa on hitaampi). Katso taulukosta 7 infuusioajat.
Ylläpitohoitoon suun kautta annettavalla fenytoiinilla siirrytään, kun se on asianmukaista.
Taulukossa 7. on tietoa status epilepticuksen hallintaan käytetystä ylläpitoannoksesta lapselle.
TAULUKKO 7. STATUS EPILEPTICUKSEN HALLINTAAN KÄYTETTY YLLÄPITOANNOS (5 VUOTTA TÄYTTÄNEET LAPSET) | ||||||
Esimerkkejä laskimonsisäisistä 5 mg FE†/kg -enimmäisylläpitoannoksista ja suosituksia laimennoksista* (25 mg:aan FE/ml tai 1,5 mg:aan FE/ml) ja laskimoinfuusioajoista (enimmäisnopeudella 2 mg FE/kg/min) kehon painokiloa kohti | ||||||
| Paino (kg) | Annos (mg FE) | Pro-Epanutinin (50 mg FE/ml) tilavuus | Laimennusliuoksen tilavuus (ml) (5 % glukoosi tai 0,9 % natriumkloridi) | Lyhyin infuusioaika (minuuttia) suositellun enimmäisinfuusio-nopeuden 2 mg FE/kg/min saavuttamiseksi | ||
| Avattavien 10 ml pullojen lukumäärä | Tarvittava tilavuus (ml) | lopulliseen pitoisuuteen 25 mg FE/ml | lopulliseen pitoisuuteen 1,5 mg FE/ml | |||
| 47,5 | 237,5 | 1 | 4,75 | 4,75 | 154 | 2,5 |
| 45 | 225 | 1 | 4,5 | 4,5 | 146 | 2,5 |
| 42,5 | 212,5 | 1 | 4,25 | 4,25 | 137 | 2,5 |
| 40 | 200 | 1 | 4 | 4 | 129 | 2,5 |
| 37,5 | 187,5 | 1 | 3,75 | 3,75 | 121 | 2,5 |
| 35 | 175 | 1 | 3,5 | 3,5 | 113 | 2,5 |
| 32,5 | 162,5 | 1 | 3,25 | 3,25 | 105 | 2,5 |
| 30 | 150 | 1 | 3 | 3 | 97 | 2,5 |
| 27,5 | 137,5 | 1 | 2,75 | 2,75 | 89 | 2,5 |
| 25 | 125 | 1 | 2,5 | 2,5 | 81 | 2,5 |
| 22,5 | 112,5 | 1 | 2,25 | 2,25 | 73 | 2,5 |
| 20 | 100 | 1 | 2 | 2 | 65 | 2,5 |
| 17,5 | 87,5 | 1 | 1,75 | 1,75 | 57 | 2,5 |
* Laskimoinfuusiossa lopullisen pitoisuuden pitää olla 1,5−25 mg FE/ml † FE - fenytoiininatriumekvivalentteja Huomautus: Sopiva annos, annostilavuus, Pro-Epanutin-injektiopullojen määrä, laimennusliuoksen tilavuus ja infuusion vähimmäisaika on aina laskettava potilaan tarkan painon mukaan, kun se ei sisälly esimerkkeihin. | ||||||
Kohtausten hoito tai ehkäisy
Kyllästysannos:
Pro-Epanutinin kyllästysannos on 10−15 mg FE/kg, ja se infusoidaan kerta-annoksena laskimoon.
Suositeltava (lasten kyllästysannoksen) laskimoinfuusionopeus:
1−2 mg FE/kg/min (ei saa olla yli 2 mg FE/kg/min tai yli 100 mg FE/min, kumpi tahansa on hitaampi). Katso taulukosta 8 infuusioajat.
Taulukossa 8. on tietoa kohtausten hoitoon tai ehkäisyyn käytetystä kyllästysannoksesta lapselle.
| TAULUKKO 8. KOHTAUSTEN HOITOON TAI EHKÄISYYN KÄYTETTY KYLLÄSTYSANNOS (5 VUOTTA TÄYTTÄNEET LAPSET) | ||||||
| Esimerkkejä laskimonsisäisistä 10 mg FE†/kg -kyllästysannoksista ja suosituksia laimennoksistaª (25 mg:aan FE/ml tai 1,5 mg:aan FE/ml) ja laskimoinfuusioajoista (enimmäisnopeudella 2 mg FE/kg/min) kehon painokiloa kohti. | ||||||
| Paino (kg) | Annos (mg FE) | Pro-Epanutinin (50 mg FE/ml) tilavuus | Laimennusliuoksena tilavuus (ml) (5 % glukoosi tai 0,9 % natriumkloridi) | Lyhyin infuusioaika (minuuttia) suositellun enimmäisinfuusio-nopeuden 2 mg FE/kg/min saavuttamiseksi | ||
| Avattavien 10 ml pullojen lukumäärä | Tarvittava tilavuus (ml) | lopulliseen pitoisuuteen 25 mg FE/ml | lopulliseen pitoisuuteen 1,5 mg FE/ml | |||
| 47,5 | 475 | 1 | 9,5 | 9,5 | 307 | 5 |
| 45 | 450 | 1 | 9 | 9 | 291 | 5 |
| 42,5 | 425 | 1 | 8,5 | 8,5 | 275 | 5 |
| 40 | 400 | 1 | 8 | 8 | 259 | 5 |
| 37,5 | 375 | 1 | 7,5 | 7,5 | 243 | 5 |
| 35 | 350 | 1 | 7 | 7 | 226 | 5 |
| 32,5 | 325 | 1 | 6,5 | 6,5 | 210 | 5 |
| 30 | 300 | 1 | 6 | 6 | 194 | 5 |
| 27,5 | 275 | 1 | 5,5 | 5,5 | 178 | 5 |
| 25 | 250 | 1 | 5 | 5 | 161 | 5 |
| 22,5 | 225 | 1 | 4,5 | 4,5 | 145 | 5 |
| 20 | 200 | 1 | 4 | 4 | 129 | 5 |
| 17,5 | 175 | 1 | 3,5 | 3,5 | 113 | 5 |
† FE - fenytoiininatriumekvivalentteja a Laskimoinfuusiossa lopullisen pitoisuuden pitää olla 1,5−25 mg FE/ml Huomautus: Sopiva annos, annostilavuus, Pro-Epanutin-injektiopullojen määrä, laimennusliuoksen tilavuus ja infuusion vähimmäisaika on aina laskettava potilaan tarkan painon mukaan, kun se ei sisälly esimerkkeihin. | ||||||
Ylläpitoannos:
Pro-Epanutinin suositeltava ensimmäinen ylläpitoannos on 4−5 mg FE/kg/vrk, ja sen voi infusoida laskimoon yhtenä annoksena tai jaettuna korkeintaan neljään annokseen. Ensimmäinen kumulatiivinen vuorokausiannos saa olla korkeintaan 4–5 mg FE/kg/vrk. Kyllästysannoksen antamisen jälkeen ylläpitoannokset on tyypillisesti aloitettava seuraavan tunnetun antovälin mukaisesti. Jos esimerkiksi annosten välin on tarkoitus olla 12 tuntia, ensimmäinen Pro-Epanutinin ylläpitoannos on annettava 12 tuntia kyllästysannoksen jälkeen.
Ylläpitoannosta on muutettava potilaan vasteen ja plasman fenytoiinipitoisuuksien mukaan (ks. Terapeuttisten lääkeainepitoisuuksien seuranta).
Suositeltava laskimoinfuusionopeus (lasten ylläpitoannostuksessa):
1−2 mg FE/kg/min (ei saa olla yli 2 mg FE/kg/min tai 100 mg FE/min, kumpi tahansa on hitaampi). Katso taulukosta 9 infuusioajat.
Ylläpitohoitoon suun kautta annettavalla fenytoiinilla siirrytään, kun se on asianmukaista.
Taulukossa 9. on tietoa kohtausten hoitoon tai ehkäisyyn käytetystä ylläpitoannoksesta lapselle.
| TAULUKKO 9. KOHTAUSTEN HOITOON TAI EHKÄISYYN KÄYTETTY YLLÄPITOANNOS (5 VUOTTA TÄYTTÄNEET LAPSET) | ||||||
Esimerkkejä laskimonsisäisistä 5 mg FE†/kg -enimmäisylläpitoannoksista ja suosituksia laimennoksista* (25 mg:aan FE/ml tai 1,5 mg:aan FE/ml) ja laskimoinfuusioajoista (enimmäisinfuusionopeudella 2 mg FE/kg/min) kehon painokiloa kohti. | ||||||
| Paino (kg) | Annos (mg FE) | Pro-Epanutinin (50 mg FE/ml) tilavuus | Laimennusliuoksen* tilavuus (ml) (5 % glukoosi tai 0,9 % natriumkloridi) | Lyhyin infuusioaika (minuuttia) suositellun enimmäisinfuusio-nopeuden 2 mg FE/kg/min saavuttamiseksi | ||
| Avattavien 10 ml pullojen lukumäärä | Tarvittava tilavuus (ml) | lopulliseen pitoisuuteen 25 mg FE/ml | lopulliseen pitoisuuteen 1,5 mg FE/ml | |||
| 47,5 | 237,5 | 1 | 4,75 | 4,75 | 154 | 2,5 |
| 45 | 225 | 1 | 4,50 | 4,50 | 146 | 2,5 |
| 42,5 | 212,5 | 1 | 4,25 | 4,25 | 137 | 2,5 |
| 40 | 200 | 1 | 4 | 4 | 129 | 2,5 |
| 37,5 | 187,5 | 1 | 3,75 | 3,75 | 121 | 2,5 |
| 35 | 175 | 1 | 3,5 | 3,5 | 113 | 2,5 |
| 32,5 | 162,5 | 1 | 3,25 | 3,25 | 105 | 2,5 |
| 30 | 150 | 1 | 3 | 3 | 97 | 2,5 |
| 27,5 | 137,5 | 1 | 2,75 | 2,75 | 89 | 2,5 |
| 25 | 125 | 1 | 2,5 | 2,5 | 81 | 2,5 |
| 22,5 | 112,5 | 1 | 2,25 | 2,25 | 73 | 2,5 |
| 20 | 100 | 1 | 2 | 2 | 65 | 2,5 |
| 17,5 | 87,5 | 1 | 1,75 | 1,75 | 57 | 2,5 |
* Laskimoinfuusiossa lopullisen pitoisuuden pitää olla 1,5−25 mg FE/ml † FE - fenytoiininatriumekvivalentteja Huomautus: Sopiva annos, annostilavuus, Pro-Epanutin-injektiopullojen määrä, laimennusliuoksen tilavuus ja infuusion vähimmäisaika on aina laskettava potilaan tarkan painon mukaan, kun se ei sisälly esimerkkeihin. | ||||||
Suun kautta annettavan fenytoiininatriumhoidon tilapäinen korvaaminen Pro-Epanutinilla
Fenytoiininatriumekvivalenttien (FE) kokonaisvuorokausiannos ja antoväli ovat samat kuin suun kautta annettavassa fenytoiininatriumhoidossa. Pro-Epanutin pitää infusoida laskimoon.
Terapeuttisten lääkeainepitoisuuksien seuranta voi olla hyödyllistä vaihdettaessa valmistetta ja/tai antotapaa. Annosta pitää säätää potilaan vasteen ja plasman fenytoiinipitoisuuksien mukaan (ks. Terapeuttisten lääkeainepitoisuuksien seuranta).
Suositeltava laskimoinfuusionopeus (annoksen tilapäisessä korvaamisessa lapsilla): 1−2 mg FE/kg/min (ei saa olla yli 2 mg FE/kg/min tai 100 mg FE/min, kumpi tahansa on hitaampi). Katso taulukosta 10 infuusioajat.
Taulukossa 10. on tietoa lasten annostuksesta, kun suun kautta annettava fenytoiininatriumhoito korvataan tilapäisesti.
| TAULUKKO 10. SUUN KAUTTA ANNETTAVAN FENYTOIININATRIUMHOIDON TILAPÄINEN KORVAAMINEN (5 VUOTTA TÄYTTÄNEET LAPSET) | ||||||
| Esimerkkejä ekvivalenteista annoksista ja suosituksia laimennoksista* (25 mg:aan FE†/ml tai 1,5 mg:aan FE/ml) ja laskimoinfuusioajoista (enimmäisinfuusionopeudella 2 mg FE/kg/min). | ||||||
Fenytoiininatriumin annos (mg) 5 mg/kg | Annos (mg FE) | Pro-Epanutinin (50 mg FE/ml) tilavuus | Laimennusliuoksen* tilavuus (ml) (5 % glukoosi tai 0,9 % natriumkloridi) | Lyhyin infuusioaika (minuuttia) suositellun enimmäisinfuusio-nopeuden 2 mg FE/kg/min saavuttamiseksi | ||
| Avattavien 10 ml pullojen lukumäärä | Tarvittava tilavuus (ml) | lopulliseen pitoisuuteen 25 mg FE/ml | lopulliseen pitoisuuteen 1,5 mg FE/ml | |||
| 175 | 175 | 1 | 3,5 | 3,5 | 113 | 2,5 |
| 150 | 150 | 1 | 3 | 3 | 97 | 2,5 |
| 125 | 125 | 1 | 2,5 | 2,5 | 81 | 2,5 |
| 100 | 100 | 1 | 2 | 2 | 65 | 2,5 |
| 75 | 75 | 1 | 1,5 | 1,5 | 49 | 2,5 |
| 50 | 50 | 1 | 1 | 1 | 32 | 2,5 |
* Laskimoinfuusiossa lopullisen pitoisuuden pitää olla 1,5−25 mg FE/ml † FE - fenytoiininatriumekvivalentteja | ||||||
Iäkkäät potilaat
Pro-Epanutinin kyllästysannosta ja/tai infuusionopeutta on ehkä pienennettävä, ja ylläpitoannostusta pienennettävä ja harvennettava. Fenytoiinin metabolia hidastuu hiukan vanhuksilla. Annoksen tai infuusionopeuden pienentämistä 10−25 % voidaan harkita, ja huolellinen kliininen seuranta on tarpeen.
Munuaisten tai maksan vajaatoiminta
Lukuun ottamatta status epilepticuksen hoitoa, kyllästysannosta ja/tai infuusionopeutta on ehkä pienennettävä, ja ylläpitoannostusta pienennettävä tai harvennettava, jos potilaalla on munuaisten ja/tai maksan sairaus tai hypoalbuminemia. Annoksen tai infuusionopeuden pienentämistä 10−25 % voidaan harkita, ja huolellinen kliininen seuranta on tarpeen.
Näillä potilailla laskimoon annettavan Pro-Epanutinin muuttuminen fenytoiiniksi voi nopeutua. Vaikka kokonaisfenytoiinin puhdistumisnopeus ei muutu, sitoutumattoman fenytoiinin pitoisuus plasmassa voi suurentua. Jos potilaalla on hyperbilirubinemia, fenytoiinin sitoutumaton pitoisuus saattaa suurentua (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Siksi näiltä potilailta on asianmukaisempaa mitata sitoutumattoman fenytoiinin pitoisuus plasmassa mieluummin kuin fenytoiinin kokonaispitoisuus plasmassa.
Terapeuttisten lääkeainepitoisuuksien seuranta
Jos immunoanalyyttinen testi tehdään ennen kuin fosfenytoiini on metaboloitunut täydellisesti fenytoiiniksi, testitulos voi näyttää plasman fenytoiinipitoisuuden merkittävästi todellista suuremmaksi fosfenytoiinin kanssa tapahtuvan ristireaktion vuoksi. Kromatografiamääritykset (esim. HPLC) mittaavat fenytoiinin pitoisuudet biologisissa nesteissä tarkasti fosfenytoiinin läsnäollessa. Verinäytteitä fenytoiinin pitoisuusmäärityksiä varten ei saaottaa vähintään kahteen tuntiin laskimonsisäisen Pro-Epanutin-infuusion jälkeen eikä vähintään neljään tuntiin lihaksensisäisen Pro-Epanutin-injektion jälkeen.
Optimaalinen kohtauskontrolli ilman kliinisiä toksisuuden merkkejä saavutetaan useimmiten silloin, kun fenytoiinin kokonaispitoisuus plasmassa on 10−20 mg/l (40−80 mikromol/l) tai sitoutumattoman fenytoiinin pitoisuus plasmassa on 1−2 mg/l (4−8 mikromol/l).
Jatkuvasti optimaalista vaihteluväliä suuremmat fenytoiinipitoisuudet plasmassa voivat aiheuttaa merkkejä akuutista toksisuudesta (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet ).
Suun kautta annettavien fenytoiinikapseleiden biologinen hyötyosuus on noin 90 %. Pro-Epanutinina annetun fenytoiinin biologinen hyötyosuus on 100 % sekä lihakseen että laskimoon annettuna. Siksi plasman fenytoiinipitoisuudet voivat suurentua, kun suun kautta otettava fenytoiininatrium korvataan lihakseen tai laskimoon annettavalla Pro-Epanutinilla. Aloitusannoksia ei kuitenkaan tarvitse muuttaa siirryttäessä suun kautta annettavasta fenytoiinista Pro-Epanutiniin tai päinvastoin.
Terapeuttisten lääkeainepitoisuuksien seuranta voi olla hyödyllistä vaihdettaessa valmistetta ja/tai antotapaa.
Vasta-aiheet
Yliherkkyys fosfenytoiininatriumille, fenytoiinille tai muille hydantoiineille tai kohdassa Apuaineet mainituille apuaineille.
Parenteraalinen fenytoiini vaikuttaa kammioiden automatiikkaan. Siksi Pro-Epanutin on vasta-aiheinen potilaille, joilla on sinusbradykardia, SA-katkos, toisen ja kolmannen asteen eteis-kammiokatkos tai Adams-Stokesin oireyhtymä.
Akuutti intermittoiva porfyria.
Pro-Epanutinin samanaikainen anto delavirdiinin kanssa on vasta-aiheista, koska virologinen vaste voi hävitä ja mahdollisesti kehittyä resistenssi delavirdiinille tai NNRTI (ei-nukleosidiset käänteiskopioija entsyymin estäjät) -lääkeryhmälle (ks. kohta Yhteisvaikutukset).
Varoitukset ja käyttöön liittyvät varotoimet
Fenytoiininatriumekvivalentit (FE)
Pro-Epanutin on aihiolääke, joka on tarkoitettu annettavaksi parenteraalisesti. Sen aktiivinen metaboliitti on fenytoiini. 1,5 mg fosfenytoiininatriumia vastaa 1 mg fenytoiininatriumia, mistä käytetään merkintää 1 mg fenytoiininatriumekvivalentteja (FE). Fosfenytoiinin määrä ja pitoisuus ilmaistaan aina muodossa mg FE.
Infuusionopeus laskimoon (i.v.)
Aikuiset:
Pro-Epanutinin infuusionopeus laskimoon ei saa olla yli 150 mg FE/min kardiovaskulaarisen toksisuusriskin takia (ks. kohta Annostus ja antotapa).
5 vuotta täyttäneet lapset:
Pro-Epanutinin antonopeusei saa olla yli 3 mg FE/kg/min tai 150 mg FE/min (näistä hitaampi) kardiovaskulaarisen toksisuusriskin takia (ks. kohta Annostus ja antotapa).
Huomaa, että Pro-Epanutinilla on merkittäviä eroja antamisen suhteen parenteraaliseen fenytoiininatriumiin verrattuna.
Annostusvirheet
Pro-Epanutin-valmisteeseen liittyvät annostusvirheet ovat johtaneet siihen, että potilaat ovat saaneet väärän Pro-Epanutin-annoksen. Pro-Epanutin on myynnissä 2 ml:n ja 10 ml:n injektiopulloina, joiden sisältämä pitoisuus on 50 mg FE/ml. 2 ml:n injektiopullon sisältämä kokonaismäärä on 100 mg FE ja 10 ml:n injektiopullon sisältämä kokonaismäärä on 500 mg FE. Virheitä on tapahtunut, kun injektiopullon pitoisuus (50 mg FE/ml) tulkittiin väärin tarkoittamaan, että injektiopullon kokonaismäärä oli 50 mg FE:tä. Tämä johti Pro-Epanutin-valmisteen kaksin- tai kymmenkertaisiin yliannoksiin.
On ollut myös muita syitä annosteluvirheisiin, mukaan lukien erehtyminen valmisteen nimestä, virheet valmisteen käyttöönvalmistamisessa, virheet lääkkeen infuusiossa/annossa ja väärät annoslaskelmat. Joissakin tapauksissa yliannokset johtivat kuolemaan, mukaan lukien alle 5-vuotiailla lapsilla.
Sekaannusten välttämiseksi Pro-Epanutinin määrätty annos pitää aina ilmaista milligrammoina fenytoiiniekvivalentteja (mg FE) (ks. kohta Annostus ja antotapa). On varmistettava tarkasti, että oikea määrä Pro-Epanutinia otetaan injektiopullosta, kun lääkettä valmistellaan antoa varten. Huomion kiinnittäminen näihin seikkoihin saattaa estää joitakin Pro-Epanutin-lääkehoitovirheitä tapahtumasta.
Potilaiden seuraaminen
Sydänsähkökäyrän, verenpaineen ja hengitystoimintojen seuraaminen koko infuusion ajan on oleellisen tärkeää. Potilasta on myös tarkkailtava koko sinä aikana, kun plasman fenytoiinipitoisuus on suurimmillaan. Tämä tapahtuu noin 30 minuuttia Pro-Epanutin-infuusioiden päättymisen jälkeen. Sydämen elvyttämiseen tarkoitettu laitteisto pitää olla käytettävissä.
Vaikutukset sydämeen ja verisuoniin
Pro-Epanutinia pitää käyttää varoen, jos potilaalla on hypotensio ja vaikea sydämen vajaatoiminta. Fenytoiinin ja fosfenytoiinin annon jälkeen on ilmoitettu vaikeita sydän- ja verisuonireaktioita, mukaan lukien eteis- ja kammiojohtumisen heikkeneminen, kammiovärinä, asystolia ja kuolemia. Pro-Epanutinin anto suurina annoksina laskimoon ja/tai nopeana laskimoinfuusiona voi myös aiheuttaa hypotensiota, jopa suositusannoksia ja -nopeuksia käytettäessä. Antonopeuden hidastaminen tai annon keskeyttäminen voi olla tarpeen (ks. kohta Annostus ja antotapa).
Iäkkäillä potilailla, lapsilla (erityisesti imeväisillä) tai vakavasti sairailla potilailla on ilmoitettu vaikeita sydänkomplikaatioita fosfenytoiinin annon jälkeen. Sydämeen kohdistuvia haittavaikutuksia on raportoitu myös aikuisilla ja lapsilla, joilla ei ollut perussairautena sydänsairautta tai muita samanaikaisia sairauksia, ja kun valmistetta on annettu suositeltuina annoksina ja infuusionopeuksina. Siksi fosfenytoiinin kyllästysannosten anto laskimoon edellyttää tiivistä sydänvalvontaa (ja hengityksen seurantaa).
Hypotension riski voi olla suurentunut potilailla, joilla on akuutti aivoverisuonitapahtuma. Tällaisia potilaita on seurattava erityisen tarkasti.
Poissaolokohtaukset
Fenytoiini ei tehoa poissaolokohtauksiin. Jos poissaolokohtausten kanssa ilmenee samanaikaisesti toonis-kloonisia kohtauksia, suositellaan yhdistelmälääkehoitoa.
Lääkehoidon lopettamiseen liittyvä kohtaus/status epilepticus
Epilepsialääkityksen äkillinen lopettaminen voi lisätä kohtaustiheyttä ja johtaa status epilepticukseen.
Itsetuhoiset ajatukset ja itsetuhoinen käyttäytyminen
Potilailla, joita on hoidettu epilepsialääkkeillä eri käyttöaiheissa, on ilmoitettu itsetuhoisia ajatuksia ja itsetuhoista käyttäytymistä. Meta-analyysi epilepsialääkkeiden satunnaistetuista lumekontrolloiduista tutkimuksista on myös osoittanut pientä riskin suurentumista itsetuhoisten ajatusten ja itsetuhoisen käyttäymisen osalta. Tämän riskin mekanismia ei tunneta. Saatavilla olevien tietojen perusteella ei voida poissulkea mahdollisesti suurentunutta riskiä fosfenytoiinin käyttäjillä.
Siksi potilaita olisi seurattava itsetuhoisten ajatusten tai itsetuhoisen käyttäytymisen merkkien varalta ja harkittava asianmukaista hoitoa. Potilaita (ja heidän läheisiään) on neuvottava ottamaan yhteyttä lääkäriin, jos merkkejä itsetuhoisista ajatuksista tai itsetuhoisesta käyttäytymisestä ilmenee.
Paikallinen toksisuus (mukaan lukien ”Purple Glove” -oireyhtymä)
Perifeeriseen laskimoon annetun fosfenytoiini-injektion jälkeen on raportoitu turvotusta, värjäytymistä ja kipua injektion antopaikasta distaalisesti (kuvattu ”Purple Glove” -oireyhtymänä). Tähän voi mahdollisesti liittyä ekstravasaatiota. Oireyhtymä ei välttämättä kehity useaan päivään injektion annon jälkeen. Kirurgisia toimenpiteitä (harvinaisissa tapauksissa jopa amputaatiota) vaativaa ihonekroosia ja raajojen iskemiaa on esiintynyt, vaikka oireet saattavat hävitä myös ilman hoitotoimenpiteitä
Yliherkkyysoireyhtymä/yliherkkyysreaktiot, joihin liittyy eosinofiliaa ja systeemisiä oireita (HSS/DRESS)
Yliherkkyysoireyhtymää (HSS) tai yliherkkyysreaktioita, joihin liittyy eosinofiliaa ja systeemisiä oireita (DRESS), on raportoitu epilepsialääkkeitä, myös fenytoiinia ja fosfenytoiinia, saavilla potilailla. Osa näistä tapahtumista on ollut henkeä uhkaavia tai johtanut kuolemaan.
HSS:n/DRESS:n tyypillisiä oireita, jotka eivät kuitenkaan yksinomaan rajoitu näihin, ovat kuume, ihottuma ja/tai lymfadenopatia liittyneenä muihin elinhäiriöihin (esim. hepatiitti, nefriitti, hematologiset poikkeamat, myokardiitti, myosiitti tai pneumoniitti). Alussa esiintyvät oireet voivat muistuttaa äkillistä virusinfektiota. Muita yleisiä oireita ovat nivelsäryt, keltatauti, hepatomegalia, leukosytoosi ja eosinofilia. Oireet ilmenenevät tavallisesti 2–4 viikon kuluttua ensimmäisestä lääkeainealtistuksesta, mutta osalla potilaista oireita on raportoitu vasta, kun he ovat saaneet epilepsialääkitystä 3 kuukautta tai kauemmin. Jos tällaisia merkkejä ja oireita ilmenee, potilaan tila on arvioitava välittömästi. Fosfenytoiinin anto on lopetettava, jos muuta syytä sairauden merkeille ja oireille ei voida osoittaa.
Suurempi riski HSS:n/DRESS:n kehittymiselle on mustaihoisilla ja immunosuppressoiduilla potilailla sekä potilailla, joilla on ollut oireyhtymä aikaisemmin (fenytoiinin, fosfenytoiinin tai muun epilepsialääkityksen käytön yhteydessä) tai joiden suvussa on esiintynyt tätä oireyhtymää. Oireyhtymä on vakavampi aikaisemmin herkistyneillä yksilöillä.
Vakavat ihon haittavaikutukset
Fosfenytoiini voi aiheuttaa vaikeita ihoon liittyviä haittavaikutuksia (SCAR), kuten akuuttia yleistynyttä eksantematoottista pustuloosia (AGEP), kesivää ihotulehdusta, Stevens-Johnsonin oireyhtymää (SJS), toksista epidermaalista nekrolyysia (TEN) ja DRESS:a, jotka voivat olla kuolemaan johtavia. Vaikka vakavia ihoreaktioita voi ilmetä ilman sairastumista ennakoivia varomerkkejä, potilaiden on oltava valppaina ihottuman ja muiden HSS:n/DRESS:n oireiden varalta ja hakeuduttava lääkärin hoitoon välittömästi havaitessaan oireyhtymään viittaavia oireita tai merkkejä. Lääkärin on neuvottava potilasta keskeyttämään hoito, jos ilmaantuu ihottumaa. Jos ihottuma on lievempää (tuhka- tai tulirokonkaltaista), hoitoa voidaan jatkaa sen jälkeen, kun ihottuma on hävinnyt kokonaan. Jos ihottuma uusiutuu, kun lääkkeen käyttö on aloitettu uudelleen, fosfenytoiinin tai fenytoiinin käyttö on vasta-aiheista.
Fenytoiiniin liittyvien vakavien ihoreaktioiden ja muiden yliherkkyysreaktioiden riski voi olla suurempi mustaihoisilla potilailla.
Kiinalaista syntyperää olevilla potilailla tehdyissä tutkimuksissa on havaittu voimakas yhteys Stevens-Johnsonin oireyhtymän/toksisen epidermaalisen nekrolyysin riskin ja HLA-B-geenin perityn muunnoksen (HLA-B*1502-alleelin) esiintymisen välillä potilailla, jotka käyttävät karbamatsepiinia. Vähäinen näyttö viittaa siihen, että HLA-B*1502-alleeli voi olla riskitekijä Stevens-Johnsonin oireyhtymän/toksisen epidermaalisen nekrolyysin kehittymiselle aasialaista syntyperää oleville potilaille, jotka käyttävät näihin haittavaikutuksiin liitettyjä lääkeaineita, myös fenytoiinia. Tapaus-verrokkiasetelmalla tehdyissä genominlaajuisissa yhteystutkimuksissa taiwanilaisilla, japanilaisilla, malesialaisilla ja thaimaalaisilla potilailla on tunnistettu vakavien ihon haittavaikutusten lisääntynyt riski, jos potilas on heikentyneeseen toimintaan liittyvän CYP2C9*3:n variantin kantaja.
Kirjallisuudessa esitetyt raportit viittaavat siihen, että fenytoiinin antoon yhdessä kallon säteilytyksen ja kortikosteroidien asteittaisen vähentämisen kanssa voi liittyä erythema multiforme ja/tai Stevens-Johnsonin oireyhtymä ja/tai toksinen epidermaalinen nekrolyysi.
Lääkeaineihottuma, eosinofilia ja systeemiset oireet (DRESS) muodostavat vakavan yliherkkyysreaktion, jonka oireina ovat ihottuma, kuume, imusolmukkeiden suureneminen ja sisäelinten toiminnan häiriöt. DRESS-tapauksia on ilmennyt fenytoiinia saavilla potilailla.
CYP2C9-metabolia
Fenytoiini metaboloituu CYP450 CYP2C9 -entsyymin välityksellä. Potilailla, jotka ovat heikentyneeseen toimintaan liittyvien CYP2C9*2:n tai CYP2C9*3:n varianttien kantajia (kohtalaisia tai heikkoja CYP2C9:n substraattien metaboloijia), saattaa olla suurentuneiden plasman fenytoiinipitoisuuksien ja siitä aiheutuvan toksisuuden riski. Jos potilaan tiedetään olevan heikentyneeseen toimintaan liittyvien CYP2C9*2:n tai *3:n alleelien kantaja, kliinistä vastetta kehotetaan seuraamaan ja plasman fenytoiinipitoisuuden seuranta voi olla tarpeen.
Angioedeema
Angioedeemaa on raportoitu potilailla, joita on hoidettu fenytoiinilla ja fosfenytoiinilla. Fosfenytoiinihoito tulee keskeyttää välittömästi, jos angioedeeman oireita, kuten kasvojen, suun ympäryksen tai ylempien hengitysteiden turvotusta, ilmenee.
Maksavaurio
Fenytoiinin biotransformaatio tapahtuu pääosin maksassa.
Fenytoiinin käytön yhteydessä on raportoitu toksista hepatiittia ja maksavauriota, jotka voivat harvinaisissa tapauksissa johtaa kuolemaan.
Fenytoiinin käytön yhteydessä on raportoitu akuuttia maksatoksisuutta, mukaan lukien harvinaisia tapauksia akuutista maksan vajaatoiminnasta. Nämä tapahtumat ilmenevät tavallisesti ensimmäisten 2 kuukauden aikana hoidon aloittamisesta ja ne voivat liittyä HSS:ään/DRESS:iin. Heikentyneestä maksan toiminnasta kärsivillä, iäkkäillä tai vakavasti sairailla potilailla voi ilmetä toksisuuden merkkejä varhaisemmassa vaiheessa.
Akuutin fenytoniinin aiheuttaman maksatoksisuuden taudinkulku vaihtelee nopeasta toipumisesta kuolemantapauksiin. Jos potilaalla ilmenee akuuttia maksatoksisuutta, fosfenytoiinin anto on välittömästi keskeytettävä eikä sitä saa antaa uudelleen.
Fenytoiiniin liittyvän maksatoksisuuden ja muiden yliherkkyysreaktioiden riski voi olla suurempi mustaihoisilla potilailla.
Hematopoieettinen järjestelmä
Hematopoieettisen järjestelmään liittyviä komplikaatioita, joskus kuolemaan johtavia, on raportoitu satunnaisesti fenytoiinin antoon liittyen. Näihin ovat lukeutuneet trombosytopenia, leukopenia, granulosytopenia, agranulosytoosi ja pansytopenia, joihin on voinut liittyä luuydinlama (ks. kohta Haittavaikutukset).
Fenytoiinin antoon on liitetty (paikallinen tai yleistynyt) lymfadenopatia, mukaan lukien hyvänlaatuinen imusolmukkeiden hyperplasia, pseudolymfooma, lymfooma ja Hodgkinin tauti, vaikka syy-seuraussuhdetta ei olekaan vahvistettu. Tämän vuoksi on tärkeää poissulkea muuntyyppiset imusolmukesairaudet ennen Pro-Epanutin-hoidon keskeyttämistä. Imusolmukeoireita voi esiintyä yksinään tai yhdessä edellä kuvattujen HSS:ää/DRESS:iä muistuttavien merkkien ja oireiden kanssa. Pitkäaikaisseuranta on tarpeen kaikissa lymfadenopatiatapauksissa, ja kohtauskontrolliin on pyrittävä kaikin keinoin jollakin vaihtoehtoisella epilepsialääkkeellä.
Akuutti toksisuus
Jos fenytoiinin pitoisuudet plasmassa ylittävät jatkuvasti optimaalisen vaihteluvälin ja/tai fenytoiinia käytetään pitkäaikaisesti, potilaalla voi ilmetä sekavuustiloja, joista käytetään nimitystä ’delirium’, ’psykoosi’ tai ’enkefalopatia’, tai joissakin harvinaisissa tapauksissa palautumaton pikkuaivojen toimintahäiriö ja/tai pikkuaivoatrofia. Plasman fenytoiinipitoisuus on määritettävä heti, jos merkkejä akuutista toksisuudesta ilmenee (ks. kohta Annostus ja antotapa). Jos plasman fenytoiinipitoisuudet ovat liian suuret, Pro-Epanutin-annosta on pienennettävä. Jos oireet jatkuvat, Pro-Epanutinin anto on keskeytettävä.
Munuais- tai maksasairaus
Varovaisuutta on noudatettava Pro-Epanutinin käytössä, jos potilaalla on munuais- ja/tai maksasairaus tai hypoalbuminemia.
Koska sitoutumattoman fenytoiinin fraktio on suurentunut potilailla, joilla on munuais- ja/tai maksasairaus tai hypoalbuminemia, plasman kokonaisfenytoiinipitoisuuden tulkinnassa pitää olla varovainen, sillä se ei välttämättä kuvasta farmakologisesti aktiivista sitoutumatonta pitoisuutta. Jos potilaalla on hyperbilirubinemia, fenytoiinin sitoutumaton pitoisuus saattaa olla suurentunut. Tällä potilasryhmällä sitoutumattoman fenytoiinin pitoisuudet ovat tarkoituksenmukaisemmat (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka). Annosta on ehkä muutettava, jos potilaan munuaisten tai maksan toiminta on heikentynyt tai jos potilas on iäkäs tai vakavasti sairas (ks. kohta Annostus ja antotapa). Näillä potilailla voi ilmetä jo varhain merkkejä fenytoiinitoksisuudesta tai haittavaikutusten vaikeutumisesta johtuen Pro-Epanutinin ja fenytoiinin farmakokineettisistä muutoksista.
Pro-Epanutinin aiheuttama fosfaattikuorma on 0,0037 mmol fosfaattia/mg fosfenytoiininatriumia. Varovaisuutta on noudatettava annettaessa Pro-Epanutinia potilaalle, jolla on fosfaattirajoitus, esimerkiksi vaikean munuaisten vajaatoiminnan vuoksi.
Aistihäiriöt
Aistihäiriöitä esiintyy 13 %:lla Pro-Epanutinia saavista potilaista. Pro-Epanutinin laskimoinfuusion aikana tai pian sen jälkeen voi esiintyä ohimenevää kutinaa, polttelua ja lämmöntunnetta tai pistelyä nivusalueella. Tuntemukset eivät ole yhdenmukaisia allergisen reaktion aiheuttamien merkkien kanssa, ja ne voidaan välttää tai minimoida hidastamalla infuusionopeutta tai keskeyttämällä infuusio tilapäisesti.
Diabetes
Fenytoiini voi nostaa diabeetikon verensokeritasoa.
Alkoholin käyttö
Hetkellinen alkoholin käyttö voi suurentaa plasman fenytoiinipitoisuutta, kun taas krooninen alkoholinkäyttö voi pienentää plasman fenytoiinipitoisuutta.
Naiset, jotka voivat tulla raskaaksi
Pro-Epanutinin käyttö raskauden aikana voi vahingoittaa sikiötä. Ennen syntymää tapahtuva altistus fenytoiinille voi suurentaa synnynnäisten epämuodostumien ja muiden kehityshäiriöiden riskiä (ks. kohta Raskaus ja imetys).
Natriumsisältö
Natriumin kokonaismäärää laskettaessa tulee ottaa huomioon fosfenytoiininatrium-injektion mahdollinen laimentaminen natriumkloridiliuoksella (ks. kohta Käyttö- ja käsittelyohjeet).
Fosfenytoiininatrium-injektio 75 mg/ml sisältää 8,5 mg natriumia per millilitra.
Pro-Epanutin-valmistetta on saatavana 10 ml:n ja 2 ml:n injektiopulloissa.
Jokainen 10 ml:n injektiopullo sisältää 85 mg natriumia, joka vastaa 4,25 % WHO:n suosittelemasta natriumin 2 g:n päivittäisestä enimmäissaannista aikuisille.
Jokainen 2 ml:n injektiopullo sisältää 17 mg natriumia, joka vastaa 0,85 % WHO:n suosittelemasta natriumin 2 g:n päivittäisestä enimmäissaannista aikuisille.
Yhteisvaikutukset
Pro-Epanutinin antoon mahdollisesti liittyvät lääkeyhteisvaikutukset ovat odotettavasti samat kuin lääkkeillä, joilla on tunnetusti yhteisvaikutuksia fenytoiinin kanssa. Fenytoiinin metabolia on kyllästyvä, ja muut samaa metaboliareittiä käyttävät lääkkeet voivat muuttaa plasman fenytoiinipitoisuutta. Monet lääkkeet voivat suurentaa tai pienentää plasman fenytoiinipitoisuutta. Samoin fenytoiini voi vaikuttaa monien muiden lääkkeiden metaboliaan, koska se on entsyymejä voimakkaasti indusoiva lääkeaine. Plasman fenytoiinipitoisuuden määrittäminen on erityisen hyödyllistä epäiltäessä lääkeyhteisvaikutuksia (ks. kohta Annostus ja antotapa).
Minkään lääkkeen ei tiedetä vaikuttavan fosfenytoiinin muuntumiseen fenytoiiniksi.
Fenytoiini sitoutuu laajalti plasman proteiineihin ja on altis kilpailevalle syrjäytymiselle. Albumiiniin voimakkaasti sitoutuvat lääkkeet voivat suurentaa myös fosfenytoiinin sitoutumatonta fraktiota ja siten nopeuttaa fosfenytoiinin muuntumista fenytoiiniksi.
Fenytoiini metaboloituu maksan sytokromi P450 CYP2C9 ja CYP2C19 -entsyymien välityksellä.
Fenytoiinimetabolian esto voi suurentaa plasman fenytoiinipitoisuutta merkittävästi ja lisätä fenytoiinitoksisuuden vaaraa. Fenytoiini indusoi voimakkaasti myös maksan lääkeainemetaboliaan osallistuvia entsyymejä ja voi pienentää näiden entsyymien välityksellä metaboloituvien lääkkeiden pitoisuuksia.
Seuraavat lääkeyhteisvaikutukset ovat yleisimmin fenytoiinin kanssa ilmenevät lääkeyhteisvaikutukset:
Luettelo lääkeaineista, jotka voivat lisätä seerumin fenytoiinipitoisuutta, sekä todennäköinen mekanismi:
Lääkeainea | Mekanismi |
Antineoplastiset aineet (fluorourasiili) Atsoli-sienilääkkeet (ketokonatsoli, itrakontsoli, flukonatsoli, mikonatsoli) Kapesitabiini Fluvastatiini Glibenklamidi Sulfafenatsoli | CYP2C9 esto |
Felbamaatti Okskarbatsepiini Topiramaatti | CYP2C19 esto |
Atsapropatsoni Fluvoksamiini Nifedipiini Sertraliini Tiklopidiini Tolbutamidi Vorikonatsoli | CYP2C9/2C19 esto |
Hetkellinen alkoholinkäyttö Amiodaroni Amfoterisiini B Kloramfenikoli Diltiatseemi (suuret annokset) Disulfiraami Fluoksetiini H2-salpaajat (simetidiini) Halotaani Isoniatsidi Metyylifenidaatti Estrogeenit Omepratsoli Fentiatsiinit Fenyylibutatsoni Salisylaatit Natriumvalproaatti Suksinimidit (etosuksimidi) Sulfonamidit (sulfadiatsiini, sulfametitsoli, sulfametoksatsoli-trimetopriimi) Takrolimuusi Tratsodoni Viloksatsiini | Tuntematon |
a Lista ei ole kaikenkattava. Katso yhteisvaikutukset ko. lääkevalmisteen valmisteyhteenvedosta. |
Luettelo lääkeaineista, jotka voivat pienentää plasman fenytoiinipitoisuutta, sekä todennäköinen mekanismi:
Lääkeainea | Mekanismi |
Rifampisiini | CYP 2C9/2C19 induktio |
Antineoplastiset aineet (bleomysiini, karboplatiini, sisplatiini, doksorubisiini, metotreksaatti) Krooninen alkoholin käyttö Diatsoksidi Foolihappo Fosamprenaviiri Nelfinaviirib Teofylliini Vigabatriini Ritonaviiri Mäkikuisma | Tuntematon |
a Lista ei ole kaikenkattava. Katso yhteisvaikutukset ko. lääkevalmisteen valmisteyhteenvedosta. b Nelfinaviiritablettien (1250 mg kahdesti päivässä) samanaikainen anto fenytoiinikapselien (300 mg kerran päivässä) kanssa ei muuttanut nelfinaviirin pitoisuutta plasmassa. Sen sijaan nelfinaviirin samanaikainen anto vähensi kuitenkin fenytoiinin AUC-arvoa 29 % ja vapaan fenytoiinin AUC-arvoa 28 %. Fenytoiinin pitoisuutta plasmassa pitää seurata samanaikaisen nelfinaviirihoidon aikana. |
Luettelo lääkeaineista, jotka voivat suurentaa tai pienentää fenytoiinipitoisuutta, sekä todennäköinen mekanismi:
Lääkeainea | Mekanismi |
Antineoplastiset aineet Karbamatsepiini Klooridiatsepoksidi Siprofloksasiini Diatsepaami Fenobarbitaali Fenotiatsiinit Natriumvalproaattib Valproiinihappob Eräät antasidit | Tuntematon |
a Lista ei ole kaikenkattava. Katso yhteisvaikutukset ko. lääkevalmisteen valmisteyhteenvedosta. b Natriumvalproaatti ja valproiinihappo ovat samankaltaisia lääkkeitä. Näistä lääkkeistä on käytetty termiä valproaatti. |
Luettelo lääkeaineista, joiden pitoisuuksia seerumissa ja/tai vaikutuksia fenytoiini voi muuttaa, sekä todennäköinen mekanismi:
Lääkeainea | Mekanismi |
Antineoplastiset aineet (esim. teniposidi) Atorvastatiini Karbamatsepiini Siklosporiini Disopyramidi Efavirentsi Erytromysiini Fosamprenaviiri Indinaviiri Lopinaviiri/ritonaviiri Metadoni Nelfinaviiri Hermolihasjohtumisen lamaavat aineet (pankuroni, vekuroni) Nikardipiini Nifedipiini Nisoldipiini Pratsikvanteli Ritonaviiri Sakinaviiri Simvastatiini Verapamiili | CYP3A4 induktio |
Klooripropamidi Fluvastatiini | CYP 2C9/2C19 induktio |
Teofylliini | CYP1A2 induktio |
Albendatsoli Bakteerilääkkeet (doksisykliini, rifampisiini, tetrasykliini) Veren hyytymistä estävät lääkkeet (varfariini, apiksabaani, dabigatraani, edoksabaani, rivaroksabaani) Sienilääkkeet (atsolit, posakonatsoli, vorikonatsoli) Verihiutaleiden aggregaation estäjät (tikagrelori) Sisatrakuuri Kortikosteroidit Sydän- ja verenpainelääkkeet (digoksiini, nimodipiini, kinidiini) Delavirdiini Furosemidi Glibenklamidi Hormonit (estrogeenit, suun kautta otettavat ehkäisyvalmisteet) (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Raskaus ja imetys) Lakosamidi Lamotrigiini Meksiletiini Fenobarbitaali Psykotrooppiset aineet (paroksetiini, klotsapiini, ketiapiini) Rokuroni Natriumvalproaattib Valproiinihappob D-vitamiini | Tuntematon |
Tenofoviirialafenamidi Afatinibi | P-glykoproteiinin induktio |
a Lista ei ole kaikenkattava. Katso yhteisvaikutukset ko. lääkevalmisteen valmisteyhteenvedosta. b Natriumvalproaatti ja valproiinihappo ovat samankaltaisia lääkkeitä. Näistä lääkkeistä on käytetty termiä valproaatti. |
Vaikka kyseessä ei ole todellinen farmakokineettinen yhteisvaikutus, trisykliset masennuslääkkeet ja fentiatsiinit voivat aiheuttaa kohtauksia niille alttiille potilaille, ja Pro-Epanutin-annosta voi joutua muuttamaan.
Hyperammonemia valproaatin samanaikaisen käytön yhteydessä
Fenytoiinin ja valproaatin samanaikaiseen antoon on liittynyt lisääntynyt valproaattiin liittyvän hyperammonemian riski. Potilaita, joita hoidetaan samanaikaisesti näillä kahdella lääkkeellä, on seurattava hyperammonemian merkkien ja oireiden varalta.
Farmakodynaamiset yhteisvaikutukset
Paroksetiinin ja sertraliinin samanaikainen käyttö fenytoiinin kanssa voi alentaa kohtauskynnystä.
Fenytoiini voi suurentaa seerumin glukoosiarvoja, minkä vuoksi insuliiniannosta tai suun kautta otettavien diabeteslääkkeiden (glibenklamidi, tolbutamidi) annosta voi olla tarpeen muuttaa.
Lääke-/laboratoriotestiyhteisvaikutukset
Fenytoiini voi pienentää seerumin T4-pitoisuutta. Se voi aiheuttaa myös matalat tulokset deksametasoni- tai metyraponikokeissa. Kyseessä voi olla mittausmenetelmän virhe. Fenytoiini voi suurentaa veren glukoosiarvoa tai alkalisen fosfataasin ja gammaglutamyylitranspeptidaasin (GGT) pitoisuuksia seerumissa. Fenytoiini voi vaikuttaa veren kalsium- ja sokeriaineenvaihduntamäärityksiin.
Fenytoiini voi pienentää seerumin folaattipitoisuuksia.
Raskaus ja imetys
Raskaus
Epilepsialääkkeisiin liittyvä yleinen riski
Lääkärin on mahdollisuuksien mukaan kerrottava kaikille epilepsialääkkeillä hoidetuille naisille, jotka voivat tulla raskaaksi, ja erityisesti raskautta suunnitteleville naisille ja raskaana oleville naisille, sikiölle mahdollisesti koituvista riskeistä, joita sekä kohtaukset että epilepsiahoito aiheuttavat. Epilepsiahoitoa on uudelleenarvioitava säännöllisesti ja erityisesti silloin, kun nainen suunnittelee raskautta. Epilepsiaan hoitoa saavan raskaana olevan naisen epilepsialääkitystä ei pidä lopettaa yhtäkkiä, koska tämä saattaa aiheuttaa kohtausten uudelleen alkamisen, millä voisi olla vakavia seurauksia sekä naiselle että syntymättömälle lapselle. Yleisperiaate on, että raskauden aikaisessa epilepsian hoidossa suositaan mahdollisuuksien mukaan monoterapiaa, koska useilla epilepsialääkkeillä tapahtuvaan hoitoon voi liittyä suurempi synnynnäisten epämuodostumien riski kuin monoterapiaan sen mukaan, mitä epilepsialääkkeitä käytetään.
Fenytoiiniin liittyvä riski
Fenytoiini läpäisee ihmisen istukan. Samansuuruisia fenytoiinipitoisuuksia on raportoitu napanuorassa ja äidin veressä.
Ennen syntymää tapahtuva altistus fenytoiinille voi suurentaa synnynnäisten epämuodostumien ja muiden kehityshäiriöiden riskiä. Ihmisellä raskauden aikaiseen fenytoiinialtistukseen liittyy 2–3 kertaa suurempi vaikeiden epämuodostumien esiintymistiheys kuin yleisväestössä, jossa esiintymistiheys on 2–3 %. Lapsilla, joiden epilepsiaa sairastaneet äidit ovat ottaneet raskauden aikana fenytoiinia, on todettu epämuodostumia, esimerkiksi huuli- ja suulakihalkioita, sydänvikoja, dysmorfisia kasvonpiirteitä, kynsien ja sormien hypoplasiaa ja kasvun poikkeavuutta (myös mikrokefaliaa). Samankaltaista sikiötoksisuutta, kehitystoksisuutta ja teratogeenisuutta on esiintynyt sellaisilla rotan poikasilla, joiden emot saivat fosfenytoiinia tiineysaikana, kuin mitä on raportoitu fenytoiinilla (ks. kohta Prekliiniset tiedot turvallisuudesta). Hermoston kehityshäiriöitä on raportoitu lapsilla, joiden epilepsiaa sairastaneet äidit ottivat fenytoiinia yksinään tai muiden epilepsialääkkeiden kanssa raskauden aikana. Hermoston kehityshäiriön riskiin liittyvät tutkimukset lapsista, jotka olivat altistuneet fenytoiinille sikiöaikanaan, ovat tuloksiltaan ristiriitaisia, eikä riskiä voida poissulkea. Lapsilla, joiden äiti on saanut fenytoiinia raskauden aikana, on useissa tapauksissa ilmoitettu maligniteetteja (mm. neuroblastoomaa). Niin epilepsialääkkeiden kuin muidenkin tekijöiden vaikutus riskin lisääntymiseen on kuitenkin epäselvä.
Pro-Epanutinia ei pidä käyttää naisille, jotka voivat tulla raskaaksi, raskautta suunnitteleville naisille eikä raskaana oleville naisille, paitsi kliiniseen tarpeeseen. Naiselle on mahdollisuuksien mukaan kerrottava riskeistä, joita fosfenytoiinin ottaminen raskauden aikana aiheuttaa.
Kohtaustiheys voi lisääntyä raskauden aikana fenytoiinin farmakokinetiikan muuttumisen vuoksi. Säännölliset plasman fenytoiinipitoisuuden määritykset voivat olla tarpeen raskaudenaikaisessa hoidossa, jotta annostusta osataan muuttaa asianmukaisesti (ks. kohta Annostus ja antotapa). Synnytyksen jälkeen on todennäköisesti kuitenkin palattava alkuperäiseen annostukseen.
Naiset, jotka voivat tulla raskaaksi
Pro-Epanutinia ei pidä käyttää naisille, jotka voivat tulla raskaaksi, paitsi jos muut epilepsialääkkeet eivät tehoa tai potilas ei siedä niitä. Naiselle on mahdollisuuksien mukaan kerrottava sikiölle mahdollisesti koituvan vaurion riskistä ja raskauden suunnittelun tärkeydestä.
Naisten, jotka voivat tulla raskaaksi, on käytettävä tehokasta ehkäisyä hoidon aikana. Naisille, jotka voivat tulla raskaaksi, on harkittava raskaustestiä ennen Pro-Epanutin-hoidon aloittamista.
Pro-Epanutin saattaa viedä hormonaalisten ehkäisyvalmisteiden tehon, ja siksi naisia, jotka voivat tulla raskaaksi, on neuvottava muiden tehokkaiden raskaudenehkäisymenetelmien käytössä (ks. kohta Yhteisvaikutukset).
Raskautta suunnittelevat naiset ja raskaana olevat naiset
Raskautta suunnittelevan naisen lääkitys on mahdollisuuksien mukaan kaikin keinoin pyrittävä vaihtamaan johonkin sopivaan vaihtoehtoiseen hoitoon ennen hedelmöitymistä. Pro-Epanutin-hoitoa ei saa keskeyttää ennen hoidon uudelleenarviointia. Potilaille on mahdollisuuksien mukaan kerrottava sikiölle mahdollisesti koituvasta vaarasta. Jos Pro-Epanutin-hoitoa raskauden aikana jatketaan riskien ja hyötyjen huolellisen arvioinnin perusteella, on suositeltavaa käyttää pienintä tehokasta annosta ja aloittaa erityinen sikiöaikainen seuranta edellä kuvailtujen epämuodostumien mahdollisen ilmenemisen varalta.
Vastasyntyneet
Verenvuoto-oireyhtymää on raportoitu vastasyntyneillä, joiden epilepsiaa sairastaneet äidit ovat saaneet fenytoiinia. K‑vitamiinin on osoitettu estävän tai korjaavan tämän häiriön, ja sitä on suositeltu annettavaksi äidille viimeisen raskauskuukauden aikana ja vastasyntyneelle syntymän jälkeen.
Syntymänjälkeinen seuranta / lapset
Jos sikiö altistuu fenytoiinille raskauden aikana, lasta on seurattava tarkoin hermoston kehityshäiriöiden varalta, jotta erikoissairaanhoitoa voidaan tarvittaessa tarjota mahdollisimman pian.
Imetys
Ei tiedetä, erittyykö Pro-Epanutin ihmisen rintamaitoon. Suun kautta annettu fenytoiini näyttäisi erittyvän vähäisessä määrin ihmisen rintamaitoon. Siksi imettämistä ei suositella Pro-Epanutinin annon yhteydessä.
Hedelmällisyys
Eläinkokeissa fosfenytoiinilla ei ollut vaikutusta urosrottien hedelmällisyyteen, mutta se heikensi naarasrottien hedelmällisyyttä (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Varovaisuutta on noudatettava tarkkaavaisuutta vaativissa tehtävissä (kuten autolla ajaminen ja koneiden käyttö), koska fosfenytoiinihoito saattaa aiheuttaa haitallisia keskushermostovaikutuksia, kuten heitehuimausta ja tokkuraisuutta (ks. kohta Haittavaikutukset).
Haittavaikutukset
Seuraavia haittatapahtumia on ilmoitettu kliinisissä tutkimuksissa Pro-Epanutinia saaneilla aikuisilla. Luettelossa on myös haittavaikutukset, joita on ilmoitettu spontaanin haittavaikutusilmoitusjärjestelmän kautta sekä akuutin että pitkäkestoisen fenytoiinin käytön jälkeen.
Fosfenytoiinin tai fenytoiinin laskimonsisäisen käytön aiheuttamia tärkeitä kliinisiä haittatapahtumia ovat verenkiertokollapsi ja/tai keskushermoston toiminnan lamaantuminen. Kummankin lääkkeen nopea anto laskimoon voi aiheuttaa hypotensiota.
Kliinisissä tutkimuksissa fosfenytoiinin käytön yhteydessä yleisimmin havaitut kliiniset haittatapahtumat olivat silmävärve, heitehuimaus, kutina, tuntoharhat, päänsärky, uneliaisuus ja ataksia. Kahta poikkeusta lukuun ottamatta nämä tapahtumat liittyivät yleensä fenytoiinin laskimonsisäiseen antoon. Tuntoharhoja ja kutinaa todettiin kuitenkin paljon useammin fosfenytoiinin annon jälkeen ja useammin fosfenytoiinin laskimonsisäisen kuin lihaksensisäisen annon jälkeen.
Nämä tapahtumat olivat annokseen ja antonopeuteen liittyviä.
Seuraavassa taulukossa kaikki haittavaikutukset, joita esiintyi enemmän kuin lumelääkkeellä ja useammalla kuin yhdellä potilaalla, on lueteltu elinjärjestelmittäin ja esiintymistiheyksittäin (hyvin yleiset (≥ 1/10), yleiset (≥ 1/100, < 1/10), melko harvinaiset (≥ 1/1 000, < 1/100) ja tuntemattomat (koska saatavissa oleva tieto ei riitä arviointiin). Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Myyntiluvan saamisen jälkeen ilmoitetut muut reaktiot on merkitty yleisyysluokaltaan tuntemattomiksi.
| Veri ja imukudos | |
| Tuntematon | leukopenia; granulosytopenia; agranulosytoosi; pansytopenia, johon joko liittyy tai ei liity luuydinsuppressio; trombosytopenia; aplastinen anemia; lymfadenopatia. Jotkut näistä tapauksista ovat johtaneet kuolemaan. |
| Immuunijärjestelmä | |
| Tuntematon | anafylaktinen/anafylaksiaa muistuttava reaktio, yliherkkyysoireyhtymä; periarteritis nodosa; immunoglobuliinipoikkeavuudet; angioedeema (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) |
| Aineenvaihdunta ja ravitsemus | |
| Tuntematon | hyperglykemia; häiriö ruokahalussa |
| Psyykkiset häiriöt | |
| Yleiset | euforinen mieliala |
| Melko harvinaiset | hermostuneisuus; sekavuustila; epänormaalit ajatukset |
| Hermosto | |
| Hyvin yleiset | silmävärve; heitehuimaus |
| Yleiset | tuntoharhat; ataksia; uneliaisuus; päänsärky; vapina; koordinaatiohäiriöt; makuaistin häiriö; stupor; dysartria |
| Melko harvinaiset | hypestesia; refleksien voimistuminen; refleksien heikkous |
| Tuntematon | ekstrapyramidaalinen häiriö; dyskinesia, mukaan lukien korea; dystonia ja asterixis, jotka ovat samantyyppisiä kuin fentiatsiinien ja muiden neuroleptien aiheuttamat; tokkuraisuus; nykivät liikkeet; unettomuus; tooniset kohtaukset. Pitkäaikaista fenytoiinihoitoa saaneilla potilailla on havaittu vallitsevasti sensorista perifeeristä polyneuropatiaa. Keskushermoston haittatapahtumia ja aistihäiriöitä ilmeni enemmän ja ne olivat vaikeampia suuremmilla annoksilla ja antonopeuksilla. |
| Silmät | |
| Yleiset | hämärtynyt näkö, näön heikkeneminen |
| Melko harvinaiset | kaksoiskuvat |
| Kuulo ja tasapainoelin | |
| Yleiset | korvien soiminen; kiertohuimaus |
| Melko harvinaiset | huonokuuloisuus |
| Sydän | |
| Melko harvinaiset | sydänpysähdys |
| Tuntematon | vaikeat kardiotoksiset reaktiot, joihin liittyy sydämen eteisten ja kammioiden johtumisen vaimentuminen (mukaan lukien bradykardia ja kaikenasteiset sydänkatkokset); kammiovärinä ja verenkiertosokki (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) |
| Verisuonisto | |
| Yleiset | vasodilataatio, hypotensio |
| Hengityselimet, rintakehä ja välikarsina | |
| Tuntematon | keuhkotulehdus; hengitystoiminnan muutokset, mukaan lukien hengityspysähdys. Jotkut näistä reaktioista ovat johtaneet kuolemaan (ks. kohta Annostus ja antotapa). |
| Ruoansulatuselimistö | |
| Yleiset | pahoinvointi; suun kuivuminen, oksentelu |
| Melko harvinaiset | heikentynyt tuntoaisti kielessä |
| Tuntematon | ienten liikakasvu; ummetus |
| Maksa ja sappi | |
| Tuntematon | toksinen maksatulehdus; maksasoluvaurio |
| Iho ja ihonalainen kudos | |
| Hyvin yleiset | kutina |
| Yleiset | mustelma |
| Melko harvinaiset | ihottuma. Muut vakavammat ja harvinaisemmat ihottumat kuten rakkulainen, hilseilevä tai purppurainen ihottuma, punahukka, Stevens-Johnsonin oireyhtymä ja toksinen epidermaalinen nekrolyysi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) |
| Tuntematon | hirsutismi; hypertrikoosi; kasvonpiirteiden karkeistuminen; huulten suureneminen; Peyronien tauti; Dupuytrenin kontraktuura; akuutti yleistynyt eksantematoottinen pustuloosi (AGEP) ja yliherkkyysreaktiot, joihin liittyy eosinofiliaa ja systeemisiä oireita (DRESS) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) ja urtikaria. |
| Luusto, lihakset ja sidekudos | |
| Melko harvinaiset | lihasheikkous; lihasten nyintä, lihaskouristukset |
| Tuntematon | systeeminen lupus erythematosus; polyartriitti ja ”Purple Glove”-oireyhtymä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) |
| Munuaiset ja virtsatiet | |
| Tuntematon | interstitiaalinen nefriitti |
| Yleisoireet ja antopaikassa todettavat haitat | |
| Yleiset | reaktio pistokohdassa; kipu pistokohdassa; voimattomuus; vilunväristykset |
| Tuntematon | lämmöntunne ja pistely nivusalueella |
Pitkään fenytoiinia käyttäneillä potilailla on raportoitu luun mineraalitiheyden laskua, osteopeniaa, osteoporoosia ja luunmurtumia. Mekanismia, jolla fenytoiini vaikuttaa luun aineenvaihduntaan, ei tunneta.
Pediatriset potilaat
Kontrolloiduissa kliinisissä tutkimuksissa, joissa fosfenytoiinia annettiin laskimoon pediatrisille epilepsiapotilaille tai neurokirurgisille potilaille, haittavaikutusten tyypit ja kokonaisilmaantuvuus olivat samankaltaiset fosfenytoiinihoitoa saaneilla lapsilla ja aikuisilla. Pediatrisilla tutkittavilla (vastasyntyneistä 16-vuotiaisiin) tehdyssä avoimessa fosfenytoiinin turvallisuutta, siedettävyyttä ja farmakokinetiikkaa selvittäneessä tutkimuksessa (982-028) fosfenytoiinia sai laskimoon 96 tutkittavaa, ja seuraavien haittavaikutusten esiintymistiheys oli yli 5 %: oksentelu (20,8 %), silmävärve (17,7 %), ataksia (10,4 %), kuume (8,3 %), hermostuneisuus (7,3 %), kutina (6,3 %), uneliaisuus (6,3 %), hypotensio (5,2 %), ihottuma (5,2 %).
Pro-Epanutinilla hoidetuilla potilailla ei havaittu mitään tyypillisiä laboratorioarvojen muutoksia.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Pro-Epanutinin yliannostuksen yhteydessä on ilmoitettu pahoinvointia, oksentelua, letargiaa, takykardiaa, bradykardiaa, asystoliaa, sydämenpysähdyksiä, hypotensiota, pyörtymisiä, hypokalsemiaa, metabolista asidoosia ja kuolemantapauksia.
Pro-Epanutinin toksisuuden ensioireet ovat samat kuin fenytoiinin aiheuttamassa akuutissa toksisuudessa: silmävärve, ataksia ja dysartria. Palautumatonta pikkuaivojen toimintahäiriötä ja pikkuaivoatrofiaa on raportoitu fenytoiinin käytön yhteydessä. Muita merkkejä ovat vapina, hyperrefleksia, letargia, puheen puuroutuminen, pahoinvointi, oksentelu, kooma ja hypotensio. Kuolemaan johtavan hengityksen ja verenkierron lamaantumisen riski on olemassa. Toksisuutta aiheuttava plasman fenytoiinipitoisuus, vaihtelee huomattavasti yksilöittäin. Lateraalinen silmävärve ilmenee yleensä, kun fenytoiinin pitoisuus plasmassa on 20 mg/l, ataksia pitoisuudella 30 mg/l ja dysartria ja letargia silloin, kun pitoisuus plasmassa on yli 40 mg/l. Kuitenkin jopa 50 mg/l:n fenytoiinipitoisuuksia on ilmoitettu ilman näyttöä toksisuudesta. Jopa 25-kertaisen fenytoiinihoitoannoksen ottamisen jälkeen fenytoiinipitoisuus plasmassa on ollut yli 100 mg/l, ja paraneminen on ollut täydellistä.
Spesifistä hoitoa ei ole, koska Pro-Epanutinille tai fenytoiinin yliannostukselle ei ole tunnettua vastalääkettä. Hengitys- ja verenkiertotoiminnan riittävyyttä on seurattava tarkoin ja ryhdyttävä asianmukaisiin peruselintoimintoja tukeviin hoitotoimiin. Hemodialyysiä voidaan harkita, koska fenytoiini ei sitoudu plasman proteiineihin täydellisesti. Lasten vaikeissa myrkytystapauksissa on tehty täydellinen verenvaihto. Akuutissa yliannostuksessa on otettava huomioon muiden keskushermostoa lamaavien aineiden, myös alkoholin, käytön mahdollisuus.
Fosfenytoiinin metaboliitit formaatti ja fosfaatti voivat myötävaikuttaa toksisuuden ilmenemiseen yliannostuksessa. Formaattitoksisuuden merkit ovat samankaltaiset kuin metanolitoksisuudessa ja liittyvät vaikeaan anionivajeeseen metabolisessa asidoosissa. Suuret fosfaattimäärät voivat nopeasti annettuina aiheuttaa hypokalsemiaa, johon liittyy tuntoharhoja, lihasspasmeja ja kouristuskohtauksia. Ionisoituneen vapaan kalsiumin pitoisuus voidaan mitata, ja jos pitoisuus on pieni, edetä hoidossa sen mukaisesti.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Epilepsialääkkeet. ATC-koodi: N03AB05
Pro-Epanutin on fenytoiinin aihiolääke, jonka antikonvulsiiviset vaikutukset tuottaa siis fenytoiini.
Fosfenytoiininatriumin farmakologiset ja toksikologiset vaikutukset ovat samat kuin fenytoiinilla.
Fenytoiinin antikonvulsiivisten vaikutusten katsotaan perustuvan sen seuraaviin soluvaikutuksiin: neuronien jänniteohjattujen natriumkanavien modulaatio, kalsiumin siirtymisen esto neuronien solukalvon läpi, neuronien jänniteohjattujen kalsiumkanavien modulaatio ja natrium-kalium-ATPaasi-aktiivisuuden voimistaminen neuroneissa ja gliasoluissa. Ensisijainen antikonvulsiivinen mekanismi saattaa olla natriumkanavien modulaatio, koska tämä ominaisuus on fenytoiinin lisäksi useilla muillakin antikonvulsiiveilla.
Farmakokinetiikka
Fosfenytoiini on fenytoiinin aihiolääke. Yhdestä moolista fosfenytoiinia metaboloituu nopeasti yksi mooli fenytoiinia.
Fosfenytoiinin farmakokinetiikka
Imeytyminen / biologinen hyötyosuus
Kun Pro-Epanutin infusoidaan laskimoon, fosfenytoiinin enimmäispitoisuudet plasmassa saavutetaan infuusion lopussa. Kun Pro-Epanutin injisoidaan lihakseen, fosfenytoiinin biologinen hyötyosuus on täydellinen. Huippupitoisuudet saavutetaan noin 30 minuutin kuluttua annoksesta. Plasman fosfenytoiinipitoisuudet lihakseen annon jälkeen ovat pienemmät kuin laskimoon annon jälkeen mutta pysyvät koholla pitempään, koska fosfenytoiinin imeytyminen pistokohdasta kestää pitempään.
Jakautuminen
Fosfenytoiini sitoutuu laajasti (95−99 %) ihmisen plasman proteiineihin, ensisijaisesti albumiiniin. Sitoutuminen plasman proteiineihin on kyllästyvää, siten että sitoutumattoman fraktion osuus suurenee fosfenytoiinin kokonaispitoisuuden suurentuessa. Fosfenytoiini syrjäyttää fenytoiinin proteiiniin sitoutumiskohdista. Fosfenytoiinin jakautumistilavuus suurenee fosfenytoiininatriumin annoksen ja antonopeuden myötä ja on 4,3−10,8 l.
Metabolia ja erittyminen
Fosfenytoiinin hydrolysoituminen fenytoiiniksi tuottaa kaksi metaboliittia, fosfaatin ja formaldehydin. Formaldehydi muuntuu edelleen formaatiksi, joka puolestaan metaboloituu folaatista riippuvaisen mekanismin kautta. Vaikka fosfaatilla ja formaldehydillä (formaatilla) on mahdollisesti tärkeitä biologisia vaikutuksia, ne ilmenevät tyypillisesti pitoisuuksilla, jotka ovat huomattavasti suuremmat kuin jos Pro-Epanutin annetaan annossuositusten mukaisesti.
Fosfenytoiinista fenytoiiniksi muuntumisen puoliintumisaika on noin 15 minuuttia. Fosfenytoiinin muuntumismekanismia ei ole selvitetty, mutta fosfataasit ovat siinä luultavasti tärkeitä. Yksi millimooli fosfenytoiinia metaboloituu yhdeksi millimooliksi fenytoiinia, fosfaattia ja formaattia.
Fosfenytoiini ei erity virtsaan.
Fenytoiinin farmakokinetiikka (Pro-Epanutinin annon jälkeen)
Fenytoiinin farmakokinetiikka Pro-Epanutinin laskimoon annon jälkeen on monimutkainen, ja hätätilanteessa (esim. status epilepticus) käytettynä voi fenytoiinin hyötyosuudessa olla kriittisiä eroja. Siksi tutkimuksissa onkin empiirisesti määritetty Pro-Epanutinin infuusionopeus, jolla saavutetaan suuruusluokaltaan samankaltainen fenytoiinin systeeminen hyötyosuus kuin infusoimalla fenytoiininatriumia 50 mg/min. Lihakseen annettu Pro-Epanutin imeytyy täydellisesti ja muuntuu fenytoiiniksi,joten näin saavutettavat systeemiset fenytoiinipitoisuudet ovat riittävän samanlaiset kuin suun kautta annetulla fenytoiinilla, jotta näitä antotapoja voidaan periaatteessa käyttää toistensa sijasta ja kyllästysannos lihakseen voidaan antaa luotettavasti.
Seuraavassa taulukossa on esitetty fosfenytoiinin ja fenytoiinin farmakokineettiset parametrit Pro-Epanutinin laskimon- ja lihaksensisäisen annon jälkeen.
Farmakokineettisten parametrien keskiarvot Pro-Epanutinin antoreitin mukaan
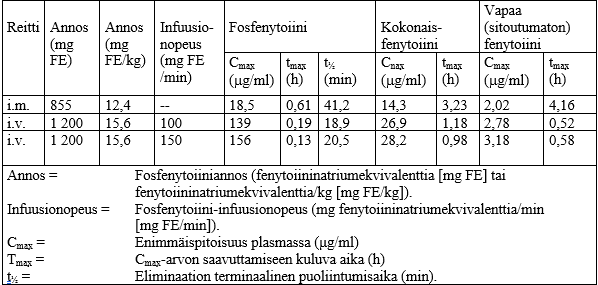
Imeytyminen / biologinen hyötyosuus
Sekä laskimoon että lihakseen annettu fosfenytoiininatrium muuntuu fenytoiiniksi nopeasti ja täydellisesti. Siksi fenytoiinin biologinen hyötyosuus Pro-Epanutinin annon jälkeen on sama kuin fenytoiinin parenteraalisen annon jälkeen.
Jakautuminen
Fenytoiini sitoutuu voimakkaasti plasman proteiineihin, ensisijaisesti albumiiniin, joskin vähäisemmässä määrin kuin fosfenytoiini. Jos fosfenytoiinia ei ole, noin 12 % plasman kokonaisfenytoiinista on sitoutumatonta kliinisesti merkittävällä pitoisuusalueella. Fosfenytoiini kuitenkin syrjäyttää fenytoiinin plasmassa proteiinien sitoutumiskohdista. Tämä suurentaa sitoutumattoman fenytoiinin fraktiota (jopa 30 % sitoutumattomana) sinä aikana, joka kuluu fosfenytoiinin muuntumiseen fenytoiiniksi (noin 0,5−1 h infuusion jälkeen).
Fenytoiinin jakautumistilavuus on 24,9–36,8 l.
Metabolia ja erittyminen
Pro-Epanutinista peräisin oleva fenytoiini metaboloituu pääosin maksassa ja erittyy virtsaan ensisijaisesti 5-(p-hydroksifenyyli)-5-fenyylihydantoiinina ja sen glukuronidina; vähäinen määrä muuttumatonta fenytoiinia (1-5 % Pro-Epanutin-annoksesta) erittyy virtsaan. Fenytoiinin maksametabolia on kyllästyvä; kun Pro-Epanutinia injisoidaan kerta-annoksena 400−1200 mg FE laskimoon, kokonaisfenytoiinin ja sitoutumattoman fenytoiinin AUC-arvojen suureneminen ei ole suhteessa annokseen. Edellä mainituilla Pro-Epanutin-annoksilla saavutettavat kokonaisfenytoiinin puoliintumisaikojen keskiarvot (12,0−28,9 h) ovat samaa luokkaa kuin ekvivalenteilla parenteraalisilla fenytoiiniannoksilla. Puoliintumisaika pitenee tyypillisesti plasman fenytoiinipitoisuuden suurentuessa.
Erityisryhmät
Potilaat, joilla on munuais- tai maksasairaus:
Fosfenytoiini muuntuu fenytoiiniksi nopeammin potilailla, joilla on munuais- tai maksasairaus, kuin muilla potilailla, koska tällaisissa sairauksissa sitoutuminen plasman proteiineihin on vähäisempää hypoalbuminemian vuoksi. Muuntumisaste fenytoiiniksi ei muutu. Sitoutumattoman fenytoiinin fraktio on suurentunut potilailla, joilla on munuais- ja/tai maksasairaus tai hypoalbuminemia. Jos potilaalla on hyperbilirubinemia, fenytoiinin sitoutumaton pitoisuus saattaa suurentua. Fenytoiinin metabolia saattaa olla vähäisempää potilailla, joilla maksan toiminta on heikentynyt, minkä seurauksena plasman fenytoiinipitoisuus suurenee (ks. kohta Annostus ja antotapa).
Iäkkäät potilaat:
Potilaan ikä ei vaikuta fosfenytoiinin farmakokinetiikkaan merkittävästi. Fenytoiinipuhdistuma pienenee yleensä iän myötä (20 % pienempi yli 70-vuotiailla potilailla kuin 20−30-vuotiailla) (ks. kohta Annostus ja antotapa).
Sukupuoli:
Sukupuoli ei vaikuta merkittävästi fosfenytoiinin eikä fenytoiinin farmakokinetiikkaan.
Pediatriset potilaat:
Rajoitetut tutkimukset (5–10-vuotiailla) Pro-Epanutinia saaneilla lapsilla ovat osoittaneet, että fosfenytoiini- ja fenytoiinipitoisuuksien aika-pitoisuus-kuvaajat ovat lapsilla samankaltaiset kuin vastaavia mg FE/kg -annoksia saavilla aikuispotilailla.
Prekliiniset tiedot turvallisuudesta
Fosfenytoiinin systeeminen toksisuus on laadullisesti ja määrällisesti samankaltaista kuin fenytoiinilla vastaavilla altistuksilla.
Fosfenytoiinista ei ole saatavilla karsinogeenisuustutkimuksia. Koska fosfenytoiini on fenytoiinin aihiolääke, fenytoiinin karsinogeenisuustutkimusten tulokset ovat ekstrapoloitavissa. Hiirillä tehdyissä karsinogeenisuustutkimuksissa on osoitettu maksasolukasvainten lisääntymistä terapeuttista aluetta vastaavilla fenytoiinin plasmapitoisuuksilla. Vastaavissa rotilla tehdyissä tutkimuksissa maksasolukasvainten lisääntyminen ei ole ollut johdonmukaista. Näiden löydösten kliininen merkitys on tuntematon.
Geneettiset toksisuustutkimukset osoittivat, ettei fosfenytoiini ole mutageeninen bakteeri- eikä nisäkässoluissa in vitro. Se on klastogeeninen in vitro, mutta ei in vivo.
Kun rotille annettiin fosfenytoiinia ennen parittelua sekä parittelun, tiineyden ja imetyksen aikana, jälkeläisillä ilmeni sikiötoksisuutta, kehitystoksisuutta ja teratogeenisuutta. Annettaessa tiineille kaneille fosfenytoiinia jälkeläisillä ei havaittu kehitykseen kohdistuvia vaikutuksia; sen sijaan annettaessa tiineille kaneille fenytoiinia jälkeläisillä on raportoitu epämuodostumia. Rotilla peri-/postnataalisia vaikutuksia ovat jälkeläisten kasvun hidastuminen ja käyttäytymiseen kohdistuva toksisuus. Fosfenytoiini ei vaikuttanut urosrottien hedelmällisyyteen. Naarailla havaittiin kiimakierron muutoksia, tiineysajan pitenemistä ja parittelun viivästymistä.
Paikallinen ärsytys laskimoon tai lihakseen tai tahattoman perivenöösin annon jälkeen oli vähäisempää fosfenytoiinilla kuin fenytoiinilla ja yleensä verrattavissa vehikkeli-injektioiden aiheuttamaan paikalliseen ärsytykseen. Ei ole tutkittu, aiheuttaako fosfenytoiini valtimonsisäistä ärsytystä.
Farmaseuttiset tiedot
Apuaineet
- Injektionesteisiin käytettävä vesi
- Trometamolipuskuri
- Kloorivetyhappo (pH:n säätöön)
Yhteensopimattomuudet
Lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa, lukuun ottamatta niitä, jotka mainitaan kohdassa Käyttö- ja käsittelyohjeet.
Kestoaika
2 vuotta.
Säilytys
Säilytä jääkaapissa (2 °C − 8 °C). Laimentamatonta valmistetta voi säilyttää huoneenlämmössä (8−25 ºC) enintään 24 tuntia.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
PRO-EPANUTIN infuusiokonsentraatti, liuosta varten/injektioneste, liuos
75 mg/ml (L:ei) 10 x 10 ml (50 mg/ml FE) (825,76 €)
PF-selosteen tieto
Käsittelemättömästä tyypin I kirkkaasta lasista valmistetut 5 ml:n (sisältää 2 ml liuosta) ja 10 ml:n (sisältää 10 ml liuosta) injektiopullot, joissa on Fluorotec-päällystetty tulppa, alumiinisinetti ja repäisykansi.
Pakkauskoot:
Kotelot: 5 x 2 ml, 10 x 2 ml tai 25 x 2 ml
Laatikot: 10 x (5 x 2 ml) (yhteensä 50 injektiopulloa)
Kotelot: 5 x 10 ml tai 10 x 10 ml
Laatikot: 5 x (5 x 10 ml) (yhteensä 25 injektiopulloa)
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Pro-Epanutin on kirkas, väritön tai vaaleankeltainen steriili liuos, joka on puskuroitu trometamolilla ja jonka happamuudeksi on säädetty 8,6–9,0 kloorivetyhapolla.
Käyttö- ja käsittelyohjeet
Pro-Epanutin on laimennettava ennen laskimoinfuusiota 5 % -glukoosi-infuusioliuoksella tai 0,9 % natriumkloridi-infuusioliuoksella pitoisuuteen 1,5−25 mg FE/ml (ks. kohta Annostus ja antotapa). Laimentamisen jälkeen Pro-Epanutin on käytettävä heti.
Vain kertakäyttöön. Avaamisen jälkeen käyttämätön valmiste on hävitettävä.
Liuosta, jossa on hiukkasia, ei saa käyttää.
Korvattavuus
PRO-EPANUTIN infuusiokonsentraatti, liuosta varten/injektioneste, liuos
75 mg/ml 10 x 10 ml
- Ei korvausta.
ATC-koodi
N03AB05
Valmisteyhteenvedon muuttamispäivämäärä
01.10.2024
Yhteystiedot
 PFIZER OY
PFIZER OY Tietokuja 4
00330 Helsinki
09 430 040
www.pfizer.fi
etunimi.sukunimi@pfizer.com
