DIENORETTE tabletti, kalvopäällysteinen 2/0,03 mg
 Lääketurva
Lääketurva
Riskienminimointimateriaalit
Potilas
Kysymyksiä ja vastauksia yhdistelmäehkäisyvalmisteista
Terveydenhuollon ammattilainen
Tärkeää tietoa yhdistelmäehkäisyvalmisteesta ja veritulppariskistä
Tarkistuslista yhdistelmäehkäisyvalmisteiden määrääjille
Yksilöllisten veritulppariskitekijöiden arviointiin, keskustelun tueksi ja sopivimman valmisteen valitsemiseksi
Vaikuttavat aineet ja niiden määrät
21 valkoista kalvopäällysteistä tablettia (vaikuttavat tabletit):
Vaikuttava aine: Etinyyliestradioli, dienogesti
Yksi päällystetty tabletti sisältää:
Etinyyliestradioli 30 mikrogrammaa
Dienogesti 2,0 mg
Apuaine(et), joiden vaikutus tunnetaan: laktoosimonohydraatti (60,90 mg).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
7 vihreää kalvopäällysteistä tablettia (lumetabletit):
Tabletit eivät sisällä vaikuttavia aineita.
Apuaine, jonka vaikutus tunnetaan: laktoosimonohydraatti (55,50 mg).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Kalvopäällysteinen tabletti
Kliiniset tiedot
Käyttöaiheet
Suun kautta otettava raskauden ehkäisy.
Keskivaikean aknen hoito naisilla, joille soveltuvasta paikallishoidosta tai suun kautta otettavasta antibioottihoidosta ei ole ollut apua, ja jotka valitsevat suun kautta otettavan ehkäisyvalmisteen.
Dienorette-valmisteen määräämistä koskevassa päätöksessä on otettava huomioon valmisteen käyttäjän nykyiset riskitekijät, erityisesti laskimotromboembolian (VTE) riskitekijät, ja millainen Dienorette-valmisteen käytön VTE:n riski on verrattuna muiden yhdistelmäehkäisyvalmisteiden riskeihin (ks. kohdat Vasta-aiheet ja Varoitukset ja käyttöön liittyvät varotoimet).
Annostus ja antotapa
Yksi Dienorette-tabletti vuorokaudessa 28 perättäisen päivän ajan.
Tabletit otetaan joka päivä suunnilleen samaan aikaan, tarvittaessa pienen nestemäärän kanssa.
Ensimmäinen tabletti otetaan läpipainopakkauksen kohdasta, johon merkitty viikonpäivä vastaa lääkkeen käytön aloituspäivää (esim. Ma = maanantai).
Loput tabletit otetaan nuolten osoittamassa järjestyksessä, kunnes koko läpipainopakkaus on otettu.
Jokainen uusi pakkaus aloitetaan edellisen pakkauksen viimeisen tabletin jälkeisenä päivänä. Tyhjennysvuoto alkaa tavallisesti 2–3 päivän kuluttua vihreiden lumetablettien (viimeisen rivin) käytön aloittamisesta, eikä se välttämättä pääty ennen seuraavan pakkauksen aloittamista.
Ehkäisyteho säilyy myös 7 päivän lumetablettijakson aikana.
Aknen näkyvä lieventyminen vie tavallisesti vähintään kolme kuukautta, ja paranemista on ilmoitettu vielä kuuden kuukauden jälkeen. Potilaiden hoidon jatkamistarve on arvioitava 3–6 kuukauden kuluttua hoidon aloituksesta ja säännöllisesti sen jälkeen.
Dienorette-valmisteen käytön aloittaminen
- Ei aiempaa hormonaalista ehkäisyä edeltäneen kuukauden aikana:
Tablettien käyttö on aloitettava kuukautiskierron ensimmäisenä päivänä (ensimmäinen vuotopäivä). Jos tabletit otetaan oikein, ehkäisyteho alkaa ensimmäisestä ottopäivästä.
Jos käyttö aloitetaan päivinä 2–5, ensimmäisten 7 päivän aikana on käytettävä lisäehkäisynä jotakin hormonitonta ehkäisymenetelmää (estemenetelmää).
- Vaihto toisesta yhdistelmäehkäisyvalmisteesta (yhdistelmäehkäisytabletit, ehkäisyrengas tai ehkäisylaastari):
Aiemmasta yhdistelmäehkäisytablettivalmisteesta riippuen Dienorette-valmisteen käyttö aloitetaan joko aiemman yhdistelmäehkäisytablettivalmisteen tavanomaisen tablettitauon jälkeisenä päivänä, viimeisen vaikuttavan tabletin ottamispäivän jälkeisenä päivänä tai viimeisen lumetabletin ottamispäivän jälkeisenä päivänä. Jos käytössä on ollut ehkäisyrengas tai ehkäisylaastari, Dienorette-valmisteen käyttö on aloitettava renkaan tai laastarin käytön tavanomaisen taukojakson jälkeisenä päivänä.
- Vaihto pelkkää progestiinia sisältävästä ehkäisyvalmisteesta (pelkkää progestiinia sisältävä ehkäisytabletti, implantaatti, injektio) tai ehkäisykierukasta:
Pelkkää progestiinia sisältävästä ehkäisytabletista voidaan siirtyä käyttämään Dienorette-valmistetta koska tahansa. Vaihto implantaatista tai ehkäisykierukasta Dienorette-valmisteeseen tapahtuu implantaatin tai kierukan poistopäivänä ja vaihto ehkäisyinjektiosta Dienorette-valmisteeseen taas seuraavana suunniteltuna injektiopäivänä. Joka tapauksessa naisen on käytettävä jotakin hormonitonta menetelmää (estemenetelmää) 7 ensimmäisen Dienorette-tablettipäivän ajan.
- Ensimmäisellä raskauskolmanneksella tapahtuneen raskauden keskeytymisen jälkeen Dienorette-valmisteen käytön voi aloittaa välittömästi. Muita ehkäisymenetelmiä ei tällöin tarvita.
- Synnytyksen tai toisella raskauskolmanneksella tapahtuneen raskauden keskeytymisen jälkeen (käyttö imetyksen aikana, ks. kohta Raskaus ja imetys).
Tromboembolisten tapahtumien riski on suurentunut heti synnytyksen jälkeen, joten ehkäisytablettien käyttöä ei pidä aloittaa ennen kuin on kulunut 21–28 päivää synnytyksestä (koskee äitejä, jotka eivät imetä) tai toisella raskauskolmanneksella tapahtuneesta raskauden keskeytymisestä. Ensimmäisten 7 käyttöpäivän aikana on käytettävä myös hormonitonta lisäehkäisyä (estemenetelmää). Jos nainen on jo ollut yhdynnässä, raskaus on suljettava pois ennen lääkkeen käytön aloittamista tai naisen on odotettava spontaanien kuukautisten alkamista.
Käytön kesto
Jos terveysriskejä ei ilmene, Dienorette-valmistetta voidaan käyttää niin kauan kuin nainen haluaa käyttää hormonaalista ehkäisyä (säännölliset kontrollitutkimukset, ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Annoksen unohtaminen
Dienorette-valmisteen ehkäisyteho voi heikentyä, jos tabletteja ei oteta säännöllisesti.
Jos tabletti unohtuu kerran mutta asia muistetaan 12 tunnin kuluessa tavanomaisesta ottoajankohdasta, valmisteen ehkäisyteho ei heikkene. Kaikki seuraavat tabletit otetaan tavanomaiseen aikaan.
Jos tabletti otetaan yli 12 tuntia tavanomaisen ottoajankohdan jälkeen, ehkäisytehoa ei enää voida taata. Raskauden riski on sitä suurempi, mitä lähempänä vihreitä lumetabletteja tabletti unohtuu.
Jos annoksen unohtumisen jälkeen ei tule tavanomaista tyhjennysvuotoa, raskauden mahdollisuus on suljettava pois ennen uuden läpipainopakkauksen aloittamista.
Jos tabletti unohtuu, on otettava huomioon seuraavat kaksi perussääntöä:
1. Vaikuttavien tablettien ottamista ei saa keskeyttää yli 7 päivän ajaksi.
2. Hypotalamus-aivolisäke-munasarja-akselin tehokas lamaaminen edellyttää vaikuttavien tablettien ottamista yhtäjaksoisesti vähintään 7 päivän ajan.
Jos tabletti unohtuu, toimitaan seuraavasti:
Viimeinen unohtunut tabletti otetaan mahdollisimman pian, vaikka samana päivänä pitäisikin ottaa 2 tablettia. Tämän jälkeen seuraavat tabletit otetaan tavanomaiseen aikaan. Seuraavien 7 päivän ajan käytetään lisäehkäisynä hormonitonta ehkäisymenetelmää.
Jos tabletti unohtuu vain kerran toisella viikolla, lisäehkäisyä ei tarvita.
Jos useampi kuin yksi tabletti unohtuu, on käytettävä hormonitonta lisäehkäisyä seuraavaan tyhjennysvuotoon asti.
1. Jos unohtuneen tabletin ja käytössä olevan läpipainopakkauksen viimeisen tabletin välillä on alle 7 päivää, seuraava läpipainopakkaus aloitetaan heti. Vihreiden lumetablettien sijasta aloitetaan tablettien ottaminen seuraavasta läpipainopakkauksesta. On hyvin todennäköistä, että tyhjennysvuotoa ei tule ennen toisen läpipainopakkauksen loppumista. Tiputtelu- tai läpäisyvuotoa voi esiintyä.
2. Tablettien ottaminen käytössä olevasta läpipainopakkauksesta voidaan myös keskeyttää ja siirtyä vihreisiin lumetabletteihin jo tavanomaista aiemmin. Vihreitä lumetabletteja otetaan enintään 7 päivän ajan, mukaan lukien päivät, joina tablettien otto unohtui. Tämän jälkeen aloitetaan uusi läpipainopakkaus.
Ohjeet oksentamisen tai ripulin yhteydessä
Jos nainen oksentaa tai hänellä on vaikeaa ripulia 4 tunnin kuluessa Dienorette-tabletin ottamisesta, tabletin vaikuttavat aineet eivät välttämättä imeydy täysin ja naisen tulee käyttää lisäehkäisyä. Tällöin noudatetaan samoja ohjeita kuin jos tabletti olisi unohtunut kerran (ks. myös kohta Annoksen unohtaminen). Jos nainen ei halua muuttaa tablettien normaalia ottoaikataulua, hänen on otettava ylimääräisiä tabletteja toisesta läpipainopakkauksesta. Jos ruoansulatuskanavan häiriöt pitkittyvät tai toistuvat, naisen on käytettävä hormonitonta lisäehkäisyä ja ilmoitettava asiasta lääkärille.
Tyhjennysvuodon siirtäminen eteenpäin
Jos nainen haluaa siirtää tyhjennysvuotoa eteenpäin, hänen on jätettävä vihreät lumetabletit ottamatta ja siirryttävä suoraan uuteen Dienorette-läpipainopakkaukseen. Tyhjennysvuotoa voidaan siirtää niin pitkälle kuin halutaan, mutta vain toisen läpipainopakkauksen loppumiseen asti. Tänä aikana voi esiintyä läpäisy- tai tiputteluvuotoa. Kun toisen pakkauksen vihreät lumetabletit on otettu, Dienorette-tablettien käyttöä jatketaan tavanomaiseen tapaan.
Vasta-aiheet
Dienorette on vasta-aiheinen jos samanaikaisesti käytetään ombitasviiria/paritapreviiria/ritonaviiria sisältäviä lääkevalmisteita ja dasabuviiria, glekapreviirin ja pibrentasviirin yhdistelmää tai sofosbuviirin, velpatasviirin ja voksilapreviirin yhdistelmää sisältäviä lääkevalmisteita (ks. kohta Yhteisvaikutukset).
Yhdistelmäehkäisyvalmisteita ei pidä käyttää seuraavien tilojen yhteydessä.
-
Laskimotromboembolia (VTE) tai sen riski
- Laskimotromboembolia – tällä hetkellä esiintyvä VTE (potilas antikoagulanttilääkityksellä) tai anamneesissa VTE (esim. syvä laskimotromboosi [SLT] tai keuhkoembolia)
- Tiedossa oleva perinnöllinen tai hankittu laskimotromboembolia-alttius, kuten APC-resistenssi (mukaan lukien faktori V Leiden), antitrombiini III:n puutos, C-proteiinin puutos, S-proteiinin puutos
- Suuri leikkaus ja siihen liittyvä pitkittynyt immobilisaatio (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
- Useiden riskitekijöiden aiheuttama suuri laskimotromboembolian riski (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
-
Valtimotromboembolia tai sen riski
- Valtimotromboembolia – tällä hetkellä esiintyvä tai aiemmin esiintynyt valtimotromboembolia (esim. sydäninfarkti) tai sitä ennakoiva tila (esim. angina pectoris)
- Aivoverisuonisairaus – tällä hetkellä esiintyvä tai aiemmin esiintynyt aivohalvaus tai sitä ennakoiva tila (esim. ohimenevä aivoverenkiertohäiriö, TIA)
- Tiedossa oleva perinnöllinen tai hankittu valtimotromboembolia-alttius, kuten hyperhomokysteinemia ja fosfolipidivasta-aineet (kardiolipiinivasta-aineet, lupusantikoagulantti).
- Anamneesissa migreeni, johon liittyy fokaalisia neurologisia oireita.
- Monista riskitekijöistä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) tai yhden vakavan riskitekijän esiintymisestä johtuva suuri valtimotromboemboliariski. Näitä riskitekijöitä voivat olla:
- diabetes, jossa esiintyy verisuonioireita
- vaikea hypertensio
- vaikea dyslipoproteinemia
- Ajankohtainen tai aiemmin esiintynyt haimatulehdus, johon liittyy vaikea hypertriglyseridemia.
- Ajankohtainen tai aiemmin esiintynyt maksasairaus niin kauan kuin maksa-arvot eivät ole palautuneet normaaleiksi (myös Dubin–Johnsonin oireyhtymä ja Rotorin oireyhtymä).
- Ajankohtainen tai aiemmin esiintynyt maksakasvain.
- Tiedossa oleva tai epäilty sukuelinten maligniteetti (esim. rinnan tai endometriumin maligniteetti)
- Emätinverenvuoto, jonka syy on selvittämättä.
- Yliherkkyys vaikuttaville aineille tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Dienorette-valmisteen soveltuvuudesta on keskusteltava naisen kanssa, jos hänellä esiintyy mikä tahansa alla mainituista tiloista tai riskitekijöistä.
Jos jokin näistä tiloista tai riskitekijöistä pahenee tai ilmenee ensimmäisen kerran, käyttäjää on kehotettava ottamaan yhteys lääkäriin, joka päättää, pitääkö Dienorette-valmisteen käyttö keskeyttää.
Dienorette-valmisteen käyttö on lopetettava, jos naiselle kehittyy laskimo- tai valtimotromboembolia tai sellaista epäillään. Jos naiselle aloitetaan antikoagulaatiohoito, hänen on aloitettava asianmukaisen ehkäisymenetelmävaihtoehdon käyttö antikoagulaatiohoidon (kumariinit) teratogeenisuuden vuoksi.
- Verenkiertohäiriöt
- Laskimotromboembolian (VTE) riski
- Minkä tahansa yhdistelmäehkäisyvalmisteen käyttö lisää laskimotromboembolian (VTE) riskiä verrattuna siihen, että tällaista valmistetta ei käytetä. Levonorgestreelia, norgestimaattia tai noretisteronia sisältäviin valmisteisiin liittyy pienin VTE:n riski. Muilla valmisteilla, kuten Dienorette-valmisteella, riski voi olla enimmillään 1,6‑kertainen tähän verrattuna. Päätöksen muun kuin VTE:n riskiltään pienimmän valmisteen käyttämisestä saa tehdä vasta sen jälkeen, kun ehkäisyä harkitsevan naisen kanssa on keskusteltu. Keskustelussa on varmistettava, että hän ymmärtää Dienorette‑valmisteeseen liittyvän VTE:n riskin, miten hänen nykyiset riskitekijänsä vaikuttavat tähän riskiin ja että hänen VTE:n riskinsä on suurimmillaan ensimmäisen vuoden aikana, jona hän käyttää yhdistelmäehkäisyvalmistetta ensimmäistä kertaa elämässään. On myös jonkin verran näyttöä siitä, että riski suurenee, kun yhdistelmäehkäisyvalmisteen käyttö aloitetaan uudelleen vähintään 4 viikon tauon jälkeen.
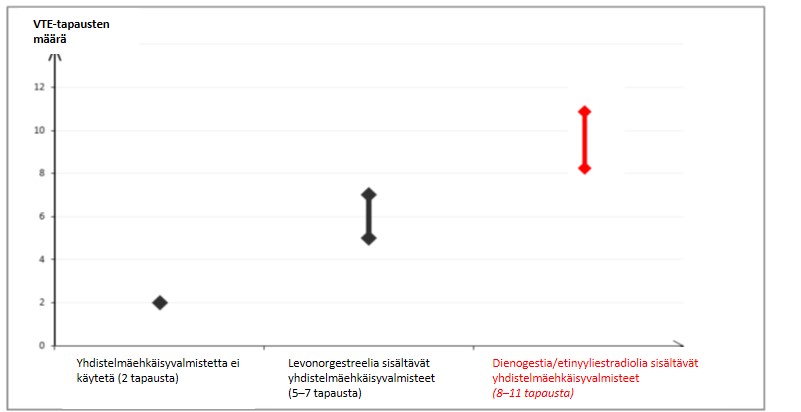
- Noin kahdelle naiselle 10 000:sta, jotka eivät käytä yhdistelmäehkäisyvalmistetta eivätkä ole raskaana, kehittyy VTE yhden vuoden aikana. Yksittäisellä naisella tämä riski voi kuitenkin olla suurempi riippuen hänen omista, taustalla vaikuttavista riskitekijöistä (ks. jäljempänä).
- Pieniannoksisia suun kautta otettavia yhdistelmäehkäisyvalmisteita (< 50 mikrog etinyyliestradiolia) käyttäville naisille tehdyissä epidemiologisissa tutkimuksissa on havaittu, että noin 6–12 naiselle 10 000:sta kehittyy VTE yhden vuoden aikana.
- Arviolta noin kuudelle1 naiselle 10 000:sta, jotka käyttävät levonorgestreelia sisältävää pieniannoksista yhdistelmäehkäisyvalmistetta, kehittyy VTE yhden vuoden aikana.
- Arviolta2 8–11 naiselle 10 000:sta, jotka käyttävät dienogestia ja etinyyliestradiolia sisältävää yhdistelmäehkäisyvalmistetta, kehittyy VTE yhden vuoden aikana.
1Vaihteluvälin 5–7 keskipiste 10 000 naisvuotta kohden, mikä perustuu levonorgestreelia sisältävien yhdistelmäehkäisyvalmisteiden käytön suhteelliseen riskiin verrattuna käyttämättömyyteen, jolloin riski on noin 2,3–3,6.
2Meta-analyysin tietojen perusteella on arvioitu, että Dienorette-valmisteen käyttäjillä VTE:n riski on lievästi suurempi kuin levonorgestreelia sisältävien yhdistelmäehkäisytablettien käyttäjillä (riskitiheyssuhde [HR] 1,57; riskin vaihteluväli 1,07–2,30).
VTE-tapausten määrä vuotta kohti on pienempi kuin määrä, joka on odotettavissa raskauden aikana tai synnytyksen jälkeisenä aikana.
VTE saattaa aiheuttaa kuoleman 1–2 %:ssa tapauksista.
VTE-tapausten määrä 10 000:ta naista kohti yhden vuoden aikana
Yhdistelmäehkäisyvalmisteiden käyttäjillä tromboosia on erittäin harvoin raportoitu esiintyneen muissa verisuonissa (esim. maksan, suoliliepeen, munuaisten tai verkkokalvon laskimoissa ja valtimoissa).
Laskimotromboembolian riskitekijät
Yhdistelmäehkäisyvalmisteiden käyttäjillä esiintyvien laskimotromboembolisten komplikaatioiden riski voi suurentua huomattavasti, jos naisella on muita riskitekijöitä, erityisesti jos riskitekijöitä on useita (ks. taulukko).
Dienorette on vasta-aiheinen naisella, jolla on useita riskitekijöitä, jotka aiheuttavat suuren VTE:n riskin (ks. kohta Vasta-aiheet). Jos naisella on useampia kuin yksi riskitekijä, nämä yhdessä voivat muodostaa yksittäisten tekijöiden summaa suuremman riskin – tässä tapauksessa VTE:n kokonaisriski on otettava huomioon. Jos hyöty-riski-suhteen katsotaan olevan negatiivinen, yhdistelmäehkäisyvalmistetta ei pidä määrätä (ks. kohta Vasta-aiheet).
Taulukko: Laskimotromboembolian (VTE) riskitekijät
Riskitekijä | Kommentti |
Ylipaino (painoindeksi yli 30 kg/m²) | Riski suurenee huomattavasti painoindeksin noustessa. Huomioitava erityisesti silloin, jos muita riskitekijöitä on myös olemassa. |
Pitkittynyt immobilisaatio, suuri leikkaus, kaikki jalkojen tai lantion alueen leikkaukset, neurokirurgia tai merkittävä trauma Huomioitavaa: väliaikainen immobilisaatio, mukaan lukien > 4 tunnin lentomatka, voi myös olla VTE:n riskitekijä, erityisesti naisilla, joilla on myös muita riskitekijöitä | Näissä tilanteissa on suositeltavaa lopettaa laastarin/tabletin/renkaan käyttö (elektiivisen leikkauksen kohdalla vähintään neljä viikkoa etukäteen), eikä sitä pidä jatkaa ennen kuin käyttäjä on ollut kaksi viikkoa täysin liikuntakykyinen. Jotain muuta raskaudenehkäisymenetelmää on käytettävä ei-toivotun raskauden ehkäisemiseksi. Antitromboottista hoitoa on harkittava, ellei Dienorette-valmisteen käyttöä ole lopetettu etukäteen. |
Positiivinen sukuanamneesi (tämänhetkinen tai aikaisempi VTE sisaruksella tai vanhemmalla, etenkin suhteellisen nuorella iällä, esim. alle 50-vuotiaana) | Jos perinnöllistä alttiutta epäillään, potilas on syytä ohjata erikoislääkärin tutkimuksiin ennen kuin minkään yhdistelmäehkäisyvalmisteen käytöstä päätetään. |
Muut laskimotromboemboliaan liitetyt sairaudet | Syöpä, systeeminen lupus erythematosus, hemolyyttis-ureeminen oireyhtymä, krooninen tulehduksellinen suolistosairaus (Crohnin tauti tai haavainen koliitti) ja sirppisoluanemia |
Ikääntyminen | Erityisesti yli 35 vuoden ikä |
Suonikohjujen ja pinnallisen laskimontukkotulehduksen mahdollisesta yhteydestä laskimotromboosin alkamiseen tai etenemiseen ei ole yksimielisyyttä.
Laskimotromboembolian suurempi riski raskauden aikana ja erityisesti synnytyksen jälkeisten noin 6 viikon aikana on otettava huomioon (ks. lisätiedot kohdasta Raskaus ja imetys ”Raskaus ja imetys”).
Laskimotromboembolian oireet (syvä laskimotromboosi ja keuhkoembolia)
Jos oireita ilmaantuu, naisia on neuvottava hakeutumaan välittömästi lääkärin hoitoon ja kertomaan, että he käyttävät yhdistelmäehkäisyvalmistetta.
Syvän laskimotromboosin (SLT) oireita voivat olla:
- toisen jalan ja/tai jalkaterän turvotus tai turvotus jalan laskimon kohdalla;
- jalan kipu tai arkuus, joka saattaa tuntua vain seistessä tai kävellessä;
- jalan lisääntynyt lämmöntunne, jalan ihon värin muutos tai punoitus.
Keuhkoembolian oireita voivat olla:
- äkillisesti alkanut, selittämätön hengenahdistus tai nopeutunut hengitys;
- äkillinen yskä, johon saattaa liittyä veriysköksiä;
- pistävä rintakipu;
- vaikea pyörrytys tai huimaus;
- nopea tai epäsäännöllinen sydämen syke.
Jotkin näistä oireista (esim. hengenahdistus, yskä) ovat epäspesifisiä, ja ne voidaan tulkita virheellisesti yleisluontoisemmiksi tai vähemmän vaikeiksi tapahtumiksi (esim. hengitystieinfektioksi).
Muita verisuonitukoksen merkkejä voivat olla mm. äkillinen kipu, turvotus ja sinertävä värimuutos raajassa.
Jos tukos tulee silmään, oireena voi olla esim. kivuton näön sumeneminen, joka voi edetä näön menetykseen. Joskus näön menetys voi tapahtua lähes välittömästi.
Valtimotromboembolian (ATE) riski
Epidemiologisissa tutkimuksissa on todettu, että yhdistelmäehkäisyvalmisteiden käyttöön liittyy suurentunut valtimotromboembolian (sydäninfarkti) tai aivoverisuonitapahtuman (esim. aivojen ohimenevä verenkiertohäiriö (TIA), aivohalvaus) riski. Valtimotromboemboliset tapahtumat voivat johtaa kuolemaan.
Valtimotromboembolian (ATE) riskitekijät
Valtimotromboembolisten komplikaatioiden tai aivoverisuonitapahtuman riski yhdistelmäehkäisyvalmisteen käyttäjillä on korkeampi niillä naisilla, joilla on riskitekijöitä (ks. taulukko). Dienorette on vasta-aiheinen, jos naisella on joko yksi vakava tai useampia ATE:n riskitekijöitä, mikä aiheuttaa suuren valtimotromboemboliariskin (ks. kohta Vasta-aiheet). Jos naisella on useampi kuin yksi riskitekijä, nämä yhdessä voivat muodostaa yksittäisten tekijöiden summaa suuremman riskin – tässä tapauksessa kokonaisriski on otettava huomioon. Jos hyöty-riski-suhteen katsotaan olevan negatiivinen, yhdistelmäehkäisyvalmistetta ei pidä määrätä (ks. kohta Vasta-aiheet).
Taulukko: Valtimotromboembolian (ATE) riskitekijät
Riskitekijä | Kommentti |
Ikääntyminen | Erityisesti yli 35 vuoden ikä |
Tupakointi | Yhdistelmäehkäisyvalmistetta käyttäviä naisia on neuvottava olemaan tupakoimatta. Yli 35-vuotiaita, tupakoimista jatkavia naisia on vakavasti kehotettava käyttämään jotakin muuta ehkäisymenetelmää. |
Korkea verenpaine | |
Ylipaino (painoindeksi yli 30 kg/m²) | Riski kasvaa huomattavasti painoindeksin noustessa. Erityisen tärkeää naisilla, joilla on muitakin riskitekijöitä |
Positiivinen sukuanamneesi (tämänhetkinen tai aikaisempi valtimotromboembolia sisaruksella tai vanhemmalla, etenkin suhteellisen nuorella iällä, esim. alle 50-vuotiaana) | Jos perinnöllistä alttiutta epäillään, potilas on syytä ohjata erikoislääkärin tutkimuksiin ennen kuin minkään yhdistelmäehkäisyvalmisteen käytöstä päätetään. |
Migreeni | Migreenin esiintymistiheyden kasvu tai vaikeusasteen lisääntyminen (mikä saattaa olla aivoverisuonitapahtumaa ennakoiva oire) yhdistelmäehkäisyvalmisteen käytön aikana voi olla syy yhdistelmäehkäisyvalmisteen käytön välittömään keskeyttämiseen. |
Muut verisuoniston haittatapahtumiin liitetyt sairaudet | Diabetes, hyperhomokysteinemia, sydämen läppävika ja eteisvärinä, dyslipoproteinemia ja systeeminen lupus erythematosus (SLE). |
Valtimotromboembolian (ATE) oireet
Jos oireita ilmaantuu, naisia on neuvottava hakeutumaan välittömästi lääkärin hoitoon ja kertomaan, että he käyttävät yhdistelmäehkäisyvalmistetta.
Aivoverisuonitapahtuman oireita voivat olla:
- kasvojen, käsivarren tai jalan äkillinen tunnottomuus tai heikkous (varsinkin vain yhdellä puolella vartaloa esiintyvä)
- äkillinen kävelyn vaikeutuminen, huimaus, tasapainon tai koordinaation menetys
- äkillinen sekavuus, puhe- tai ymmärtämisvaikeudet
- äkillinen näön heikentyminen yhdessä tai molemmissa silmissä
- äkillinen, voimakas tai pitkittynyt päänsärky, jonka syytä ei tiedetä
- tajunnan menetys tai pyörtyminen, johon saattaa liittyä kouristuskohtaus.
Ohimenevät oireet viittaavat siihen, että tapahtuma on ohimenevä aivoverenkiertohäiriö (TIA).
Sydäninfarktin oireita voivat olla:
- kipu, epämiellyttävä tunne, paineen tunne, painon tunne, puristuksen tai täysinäisyyden tunne rinnassa, käsivarressa tai rintalastan takana
- selkään, leukaan, kurkkuun, käsivarteen ja/tai vatsaan säteilevä epämiellyttävä tunne
- täyteläisyyden, ruoansulatushäiriöiden tai tukehtumisen tunne
- hikoilu, pahoinvointi, oksentelu tai huimaus
- erittäin voimakas heikkouden tunne, ahdistuneisuus tai hengenahdistus
- nopea tai epäsäännöllinen sydämen syke.
Kasvaimet
Kohdunkaula
Joissakin epidemiologisissa tutkimuksissa on raportoitu kohdunkaulan syövän riskin suurentuneen yhdistelmäehkäisytablettien pitkäaikaiskäytön (> 5 v käytön) yhteydessä. Vielä ei kuitenkaan ole yksimielisyyttä siitä, missä määrin tämä löydös johtuu seksikäyttäytymisen ja muiden tekijöiden kuten papilloomaviruksen (HPV) sekoittavista vaikutuksista.
Rinta
Meta-analyysi 54 epidemiologisesta tutkimuksesta osoitti, että rintasyöpädiagnoosin suhteellinen riski on hieman suurentunut (RR = 1,24) yhdistelmäehkäisytablettien käytön aikana. Suurentunut riski häviää vähitellen 10 vuoden sisällä yhdistelmäehkäisytablettien käytön lopettamisesta. Rintasyöpä on harvinainen alle 40-vuotiailla naisilla, joten rintasyöpädiagnoosien lisääntyminen yhdistelmäehkäisytabletteja käyttävillä ja niitä äskettäin käyttäneillä naisilla on vähäistä suhteessa rintasyövän elinikäiseen riskiin.
Tutkimuksissa ei saatu näyttöä syy-seuraussuhteesta. Havaittu riskin suureneminen voi johtua rintasyövän varhaisemmasta toteamisesta yhdistelmäehkäisytablettien käyttäjillä, yhdistelmäehkäisytablettien biologisista vaikutuksista tai näiden tekijöiden yhdistelmästä. Yhdistelmäehkäisytabletteja joskus käyttäneillä naisilla rintasyövät todetaan yleensä kliinisesti varhaisemmassa vaiheessa kuin naisilla, jotka eivät ole koskaan käyttäneet yhdistelmäehkäisytabletteja.
Maksa
Harvinaisissa tapauksissa yhdistelmäehkäisytablettien käyttäjillä on ilmoitettu hyvänlaatuisia maksakasvaimia ja vielä harvemmin pahanlaatuisia maksakasvaimia. Yksittäistapauksissa nämä kasvaimet ovat johtaneet hengenvaarallisiin sisäisiin vatsaonteloverenvuotoihin. Maksakasvaimen mahdollisuus on otettava huomioon erotusdiagnostiikassa, jos yhdistelmäehkäisytablettien käyttäjällä on vaikeaa ylävatsakipua, suurentunut maksa tai merkkejä verenvuodosta vatsaonteloon.
Suurempiannoksisten yhdistelmäehkäisytablettien (50 mikrogrammaa etinyyliestradiolia) käytön yhteydessä endometrium- ja munasarjasyöpien riski pienenee. On toistaiseksi epäselvää, tapahtuuko näin myös pienempiannoksisia yhdistelmäehkäisytabletteja käytettäessä.
Muut tilat
Hypertensio
Monilla yhdistelmäehkäisytabletteja käyttävillä naisilla on ilmoitettu vähäistä verenpaineen kohoamista. Kliinisesti merkittävä verenpaineen kohoaminen on harvinaista. Yhdistelmäehkäisytablettien käytön välitön lopettaminen on aiheellista vain näissä harvinaisissa tapauksissa. Yhdistelmäehkäisytablettien käyttö on lopetettava, jos naisella on entuudestaan hypertensio ja jatkuvasti koholla olevat verenpainearvot tai verenpaineen merkittävä nousu eivät reagoi riittävästi verenpainelääkitykseen niiden käytön aikana. Tablettien käyttöä voidaan tarvittaessa jatkaa, jos verenpainelääkityksellä saadaan aikaan normotensio.
Maksaläiskät
Maksaläiskiä voi esiintyä silloin tällöin etenkin naisilla, joille kehittyi niitä raskausaikana. Jos naisella on taipumusta saada maksaläiskiä, hänen tulee välttää altistumista auringonvalolle tai ultraviolettisäteilylle yhdistelmäehkäisytablettien käytön aikana.
Angioedeema
Estrogeenien käyttö saattaa aiheuttaa tai pahentaa perinnöllisen ja hankinnaisen angioedeeman oireita.
Naisilla, joilla on anamneesissa tai sukuanamneesissa hypertriglyseridemiaa, voi olla tavallista suurempi riski saada haimatulehdus yhdistelmäehkäisytablettien käytön aikana.
Seuraavia tiloja tai niiden pahenemista on raportoitu esiintyneen sekä raskauden että yhdistelmäehkäisytablettien käytön yhteydessä, mutta niiden yhteydestä yhdistelmäehkäisytablettien käyttöön ei ole pitävää näyttöä: kolestaasiin liittyvä ikterus ja/tai kutina, sappikivet, porfyria, systeeminen lupus erythematosus, hemolyyttis-ureeminen oireyhtymä, Sydenhamin korea, herpes gestationis ja otoskleroosiin liittyvä kuulon heikentyminen.
Yhdistelmäehkäisytablettien käytön keskeyttäminen voi olla tarpeen akuuteissa tai kroonisissa maksan toimintahäiriöissä, kunnes maksan toimintakoearvot ovat normalisoituneet. Yhdistelmäehkäisytablettien käyttö on lopetettava, jos aiemmin raskausaikana tai aiemman sukupuolisteroidien käytön aikana ilmennyt kolestaasiin liittyvä ikterus ja/tai kutina uusiutuu.
Yhdistelmäehkäisytabletit saattavat vaikuttaa perifeeriseen insuliiniresistenssiin ja glukoosinsietoon. Ei kuitenkaan ole saatu näyttöä siitä, että pieniannoksisia yhdistelmäehkäisytabletteja (< 0,05 mg etinyyliestradiolia) käyttävien diabeetikkojen lääkitystä tarvitsisi muuttaa. Yhdistelmäehkäisytabletteja käyttäviä diabeetikkoja on kuitenkin seurattava tarkoin erityisesti tablettien käytön alkuvaiheissa.
Endogeenisen depression, epilepsian, Crohnin taudin ja haavaisen koliitin pahenemista on raportoitu yhdistelmäehkäisytablettien käytön aikana.
Masentunut mieliala ja masennus ovat tunnettuja hormonaalisten ehkäisyvalmisteiden käyttöön liittyviä haittavaikutuksia (ks. kohta Haittavaikutukset). Masennus voi olla vakavaa, ja se on itsetuhoisen käyttäytymisen ja itsemurhan tunnettu riskitekijä. Naisia on kehotettava ottamaan yhteyttä lääkäriinsä, jos heillä esiintyy mielialan muutoksia ja masennuksen oireita, myös pian hoidon aloittamisen jälkeen.
Tehon heikkeneminen
Yhdistelmäehkäisytablettien teho voi heikentyä esim. tablettien unohtumisen (ks. kohta Annostus ja antotapa), ruoansulatuskanavan häiriöiden (ks. kohta Annostus ja antotapa) tai samanaikaisen lääkityksen yhteydessä (ks. kohta Yhteisvaikutukset).
Epäsäännölliset vuodot
Kaikkien yhdistelmäehkäisytablettien käytön yhteydessä voi esiintyä epäsäännöllistä tiputtelu- tai läpäisyvuotoa etenkin ensimmäisten hoitokuukausien aikana. Siksi epäsäännöllistä vuotoa kannattaa alkaa tutkia vasta noin kolme kiertoa kestävän sopeutumisvaiheen jälkeen.
Jos vuotohäiriöt jatkuvat tai niitä ilmaantuu kiertojen oltua aiemmin säännölliset, on otettava huomioon ei-hormonaaliset syyt ja ryhdyttävä riittäviin diagnostisiin toimiin mahdollisen maligniteetin tai raskauden poissulkemiseksi. Näihin voi sisältyä myös kaavinta.
Joillakin naisilla ei välttämättä esiinny tyhjennysvuotoa lumetablettijakson aikana. Jos yhdistelmäehkäisytabletteja on käytetty kohdassa Annostus ja antotapa kuvattujen ohjeiden mukaisesti, raskaus on epätodennäköinen. Jos yhdistelmäehkäisytabletteja ei kuitenkaan ole käytetty ohjeiden mukaisesti ennen tyhjennysvuodon ensimmäistä poisjääntiä tai jos kaksi tyhjennysvuotoa jää tulematta, raskauden mahdollisuus on suljettava pois ennen yhdistelmäehkäisytablettien käytön jatkamista.
Potilaiden, joilla on harvinainen perinnöllinen fruktoosi-intoleranssi, galaktoosi-intoleranssi, laktaasinpuutos, sakkaroosi-isomaltaasin vajaatoimintaa tai glukoosi-galaktoosi-imeytymishäiriö, ei tule käyttää Dienorette-valmistetta.
Lääkärintarkastus
Ennen Dienorette-valmisteen käytön aloittamista tai uudelleen aloittamista potilaan sairaushistoria on selvitettävä täydellisesti (mukaan lukien sukuanamneesi), ja raskaus on suljettava pois. Naisen verenpaine on mitattava, ja hänelle on tehtävä lääkärintarkastus ottaen huomioon vasta-aiheet (ks. kohta Vasta-aiheet) ja varoitukset (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). On tärkeää kiinnittää naisen huomiota laskimo- ja valtimoveritulppia koskeviin tietoihin, kuten Dienorette-valmisteen käyttöön liittyvään riskiin verrattuna muihin yhdistelmäehkäisyvalmisteisiin, laskimo- ja valtimoveritulppien oireisiin, tiedossa oleviin riskitekijöihin sekä siihen, mitä tehdä, jos epäilee veritulppaa.
Naista on myös neuvottava lukemaan pakkausseloste huolellisesti ja noudattamaan siinä annettuja ohjeita. Tarkastuskäyntien tiheyden ja luonteen pitää perustua vakiintuneisiin hoitosuosituksiin, ja ne on toteutettava kunkin naisen kliinisten tarpeiden mukaisesti.
Naisia on varoitettava siitä, että hormonaaliset ehkäisyvalmisteet eivät suojaa HIV-infektiolta (AIDS) tai muilta sukupuoliteitse tarttuvilta taudeilta.
Yhteisvaikutukset
Huom. Mahdollisten yhteisvaikutusten varalta on tutustuttava samanaikaisesti käytettävien lääkkeiden valmisteyhteenvetoihin.
Muiden lääkevalmisteiden vaikutukset Dienorette-valmisteeseen
Yhteisvaikutuksia voi esiintyä käytettäessä mikrosomaalisia entsyymejä indusoivia lääkkeitä, jotka voivat suurentaa sukupuolihormonien puhdistumaa ja johtaa läpäisyvuotoon ja/tai ehkäisyn pettämiseen.
Hoito
Entsyymi-induktio voidaan havaita jo muutaman hoitopäivän kuluttua. Maksimaalinen entsyymi-induktio havaitaan yleensä muutaman viikon kuluttua. Lääkehoidon lopettamisen jälkeen entsyymi-induktio voi jatkua vielä noin 4 viikon ajan.
Lyhytkestoinen hoito
Entsyymejä indusoivia lääkkeitä käyttävien naisten on käytettävä tilapäisesti estemenetelmää tai muuta ehkäisymenetelmää yhdistelmäehkäisytablettien lisäksi. Estemenetelmää on käytettävä koko samanaikaisen lääkehoidon ajan sekä 28 päivän ajan sen loppumisen jälkeen.
Jos yhdistelmäehkäisytablettipakkauksen vaikuttavat tabletit loppuvat ennen lääkehoidon päättymistä, lumetabletit on hävitettävä ja seuraava yhdistelmäehkäisytablettipakkaus on aloitettava heti.
Pitkäkestoinen hoito
Jos nainen käyttää pitkäaikaista lääkehoitoa, jossa vaikuttavana aineena on entsyymejä indusoiva aine, suositellaan toisen luotettavan, hormonittoman ehkäisymenetelmän käyttöä.
Seuraavia yhteisvaikutuksia on ilmoitettu kirjallisuudessa.
Yhdistelmäehkäisytablettien puhdistumaa suurentavat lääkeaineet (yhdistelmäehkäisytablettien teho heikentyy entsyymi-induktion vuoksi), esim.
Barbituraatit, bosentaani, karbamatsepiini, fenytoiini, primidoni, rifampisiini ja HIV-lääkkeet ritonaviiri, nevirapiini ja efavirentsi sekä mahdollisesti myös felbamaatti, griseofulviini, okskarbatsepiini, topiramaatti ja mäkikuismaa (Hypericum perforatum) sisältävät rohdosvalmisteet.
Yhdistelmäehkäisytablettien puhdistumaan vaihtelevasti vaikuttavat lääkeaineet
Monet HIV-proteaasinestäjien ja ei-nukleosidirakenteisten käänteiskopioijaentsyymien estäjien yhdistelmät, mukaan lukien yhdistelmät HCV-estäjien kanssa, voivat suurentaa tai pienentää estrogeenin tai progestiinien pitoisuutta plasmassa, kun yhdistelmäehkäisytabletteja käytetään samanaikaisesti. Näiden muutosten nettovaikutus voi joissain tapauksissa olla kliinisesti merkittävä.
Tästä syystä on perehdyttävä samanaikaisen HIV/HCV-lääkityksen valmisteyhteenvetoon mahdollisten yhteisvaikutusten ja mahdollisten niihin liittyvien suositusten osalta. Epävarmoissa tapauksissa proteaasinestäjää tai ei-nukleosidirakenteista käänteiskopioijaentsyymin estäjää käyttävän naisen on käytettävä lisäksi jotakin estemenetelmää.
Yhdistelmäehkäisytablettien puhdistumaa pienentävät lääkeaineet (entsyymi-inhibiittorit)
Entsyymi-inhibiittoreiden kanssa mahdollisesti esiintyvien yhteisvaikutusten kliinistä merkitystä ei vielä tunneta. Voimakkaiden CYP3A4-estäjien samanaikainen käyttö voi suurentaa estrogeenin, progestiinin tai niiden molempien pitoisuutta plasmassa.
60–120 mg/vrk ‑etorikoksibiannosten on todettu suurentavan plasman etinyyliestradiolipitoisuutta 1,4–1,6-kertaiseksi, kun etorikoksibia käytetään 0,035 mg etinyyliestradiolia sisältävien yhdistelmäehkäisyvalmisteiden kanssa.
Dienoretten vaikutukset muihin lääkevalmisteisiin
Yhdistelmäehkäisytabletit voivat vaikuttaa tiettyjen muiden vaikuttavien aineiden metaboliaan. Pitoisuus plasmassa ja kudoksissa voi siis joko suurentua (esim. siklosporiini) tai pienentyä (esim. lamotrigiini).
In vitro -tiedot viittaavat siihen, että dienogesti ei todennäköisesti estä CYP-entsyymitoimintaa hoitoannoksilla. Kliiniset tiedot viittaavat siihen, että etinyyliestradioli estää CYP1A2:n substraattien puhdistumaa, mikä johtaa niiden pitoisuuden lievään (esim. teofylliini) tai kohtalaiseen (esim. titsanidiini) suurenemiseen plasmassa.
Farmakodynaamiset yhteisvaikutukset
Kun kliinisissä tutkimuksissa hoidettiin hepatiitti C -virusinfektiota (HCV) ombitasviirin, paritapreviirin ja ritonaviirin yhdistelmällä ja dasabuviirilla ribaviriinin kanssa tai ilman, transaminaasiarvon (ALAT) kohoamista yli 5 x ULN (viitealueen yläraja) esiintyi merkitsevästi useammin naisilla, jotka käyttivät etinyyliestradiolia sisältävää valmistetta, kuten yhdistelmäehkäisyvalmistetta. Myös glekapreviirin ja pibrentasviirin yhdistelmää tai sofosbuviirin, velpatasviirin ja voksilapreviirin yhdistelmää käyttävillä potilailla ALAT-arvojen kohoamista havaittiin etinyyliestradiolia sisältävää valmistetta (kuten yhdistelmäehkäisyvalmistetta) käyttävillä naisilla (ks. kohta Vasta-aiheet).
Tästä syystä Dienorette-valmistetta käyttävien on vaihdettava toiseen ehkäisymenetelmään (esim. pelkkää progestiinia sisältävään tai hormonittomaan ehkäisymenetelmään) ennen kyseisten yhdistelmähoitojen aloittamista. Dienorette-valmisteen käyttö voidaan aloittaa uudelleen 2 viikon kuluttua näiden lääkeyhdistelmien käytön päättymisestä.
Laboratoriokokeet
Steroidiehkäisyn käyttö voi vaikuttaa eräiden laboratoriokokeiden tuloksiin, kuten maksan, kilpirauhasen, lisämunuaisten ja munuaisten toiminnan biokemiallisiin parametreihin, (kantaja)proteiinien kuten kortikosteroideja sitovan globuliinin ja lipidi/lipoproteiinifraktioiden pitoisuuksiin plasmassa, hiilihydraattiaineenvaihdunnan parametreihin ja veren hyytymis- ja fibrinolyysiparametreihin. Muutokset pysyvät yleensä laboratorioarvojen viitealueella. Dienogestin lievä antimineralokortikoidinen vaikutus suurentaa plasman reniiniaktiivisuutta ja plasman aldosteronipitoisuutta.
Raskaus ja imetys
Raskaus
Dienorette ei ole tarkoitettu käytettäväksi raskauden aikana.
Jos nainen tulee raskaaksi hoidon aikana, lääkitys on lopetettava välittömästi.
Epidemiologisten tutkimusten mukaan synnynnäisten epämuodostumien riski ei ole suurentunut, jos nainen on käyttänyt ehkäisytabletteja ennen raskautta. Useimpien tuoreiden epidemiologisten tutkimusten mukaan valmisteella ei myöskään ole teratogeenista vaikutusta, jos sitä käytetään tahattomasti raskauden varhaisvaiheessa. Dienorette-valmisteella ei ole tehty tällaisia tutkimuksia.
Dienorette-valmisteen raskausaikaisesta käytöstä on saatavilla niin niukasti tietoja, että niistä ei voida tehdä johtopäätöksiä Dienorette-valmisteen mahdollisista haitallisista vaikutuksista raskauteen ja sikiön tai vastasyntyneen terveyteen. Toistaiseksi saatavilla ei ole merkittävää epidemiologista tietoa.
Eläinkokeissa on havaittu haittavaikutuksia tiineyden ja imetyksen aikana (ks. kohta Prekliiniset tiedot turvallisuudesta). Näiden eläinkoetulosten perusteella ei voida sulkea pois mahdollisuutta, että vaikuttavilla aineilla on haitallinen hormonaalinen vaikutus. Yleisen kokemuksen perusteella ei kuitenkaan ole mitään näyttöä siitä, että yhdistelmäehkäisytablettien käytöllä raskauden aikana olisi haitallinen vaikutus ihmiselle.
Kun Dienorette-valmisteen käyttö aloitetaan uudelleen, on huomioitava, että laskimotromboembolian riski on suurentunut synnytyksen jälkeisenä aikana (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Imetys
Yhdistelmäehkäisytabletit saattavat vaikuttaa imetykseen, sillä ne voivat vähentää rintamaidon määrää ja muuttaa sen koostumusta. Pieniä määriä ehkäisyvalmisteen vaikuttavia steroideja ja/tai niiden metaboliitteja voi erittyä yhdistelmäehkäisytabletteja käyttävän naisen rintamaitoon. Näillä määrillä voi olla vaikutusta lapseen.
Siksi Dienorette-valmistetta ei pidä käyttää ennen kuin lapsen imetys on lopetettu kokonaan.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Dienorette-valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneiden käyttökykyyn.
Haittavaikutukset
Dienorette-valmistetta arvioitiin kliinisissä tutkimuksissa (N = 4 942) ehkäisytablettina ja keskivaikean aknen hoidossa, kun soveltuvat paikallishoidot tai suun kautta otettava antibioottihoito olivat epäonnistuneet ja nainen halusi käyttää ehkäisytabletteja. Löydösten yhteenveto esitetään alla.
Alla lueteltavien mahdollisten haittavaikutusten esiintymistiheydet on määritelty seuraavasti: yleiset (≥ 1/100, < 1/10), melko harvinaiset (≥ 1/1 000, < 1/100), harvinaiset (≥ 1/10 000, < 1/1 000), yleisyys tuntematon (koska saatavissa oleva tieto ei riitä arviointiin).
Haittavaikutukset on esitetty kussakin yleisyysluokassa vakavuusjärjestyksessä vakavimmasta alkaen.
Elinjärjestelmäluokka (MedDRA v.12.0) | Yleinen | Melko harvinainen | Harvinainen | Tuntematon |
Infektiot | Vaginiitti/vulvovaginiitti, emättimen hiivatulehdus tai muut vulvan tai vaginan sieni-infektiot | Salpingo-ooforiitti, virtsatieinfektio, kystiitti, mastiitti, servisiitti, sieni-infektio, kandidiaasi, suun herpes, influenssa, bronkiitti, sinuiitti, ylähengitystieinfektio, virusinfektio | ||
Hyvän- ja pahanlaatuiset kasvaimet (mukaan lukien kystat ja polyypit) | Kohdun myooma, rinnan lipooma | |||
Veri ja imukudos | Anemia | |||
Immuunijärjestelmä | Yliherkkyys | Perinnöllisen ja hankinnaisen angioedeeman oireiden paheneminen | ||
Umpieritys | Virilismi | |||
Aineenvaihdunta ja ravitsemus | Ruokahalun voimistuminen | Ruokahaluttomuus | ||
Psyykkiset häiriöt | Masentuneisuus | Masennus, psyyken häiriöt, unettomuus, unihäiriöt, aggressio | Mielialan muutokset, seksuaalisen halukkuuden väheneminen, seksuaalisen halukkuuden lisääntyminen | |
Hermosto | Päänsärky | Huimaus, migreeni | Aivoinfarkti, aivoverenkiertohäiriö, dystonia | |
Silmät | Silmien kuivuus, silmien ärsytys, oskillopsia, näköhäiriö | Huono piilolinssien sieto | ||
Kuulo ja tasapainoelin | Äkillinen kuulon menetys, korvien soiminen, kiertohuimaus, kuulon heikentyminen | |||
Sydän | Sydämen ja verisuoniston häiriöt, takykardia1 | |||
Verisuonisto | Hypertensio, hypotensio | Laskimotromboembolia (VTE), valtimotromboembolia (ATE), keuhkoembolia, tromboflebiitti, diastolinen hypertensio, ortostaattinen verenkierron säätelyhäiriö, kuumat aallot, suonikohjut, laskimoiden häiriöt, laskimokipu | ||
Hengityselimet, rintakehä ja välikarsina | Astma, hyperventilaatio | |||
Ruoansulatuselimistö | Vatsakipu2, pahoinvointi, oksentelu, ripuli | Gastriitti, enteriitti, dyspepsia | ||
Iho ja ihonalainen kudos | Akne, hiustenlähtö, ihottuma3, kutina4 | Allerginen dermatiitti, atooppinen ihottuma/neurodermatiitti, ekseema, psoriaasi, voimakas hikoilu, maksaläiskät, pigmentaatiohäiriö/hyperpigmentaatio, seborrea, hilse, hirsutismi, ihon häiriöt, ihoreaktio, appelsiini-iho, hämähäkkiluomi | Nokkosihottuma, erythema nodosum, erythema multiforme | |
Luusto, lihakset ja sidekudos | Selkäkipu, epämukava tunne tuki- ja liikuntaelimistössä, lihaskipu, raajakipu | |||
Sukupuolielimet ja rinnat | Rintojen kipu5 | Poikkeava tyhjennysvuoto6, vuoto kuukautisten välillä7, rintojen suureneminen8, rintojen turvotus, dysmenorrea, eritevuoto sukuelimistä/emättimestä, munasarjakystat, lantion alueen kipu | Kohdunkaulan dysplasia, kohdun sivuelinten kysta, kohdun sivuelinten kipu, rintojen kysta, fibrokystinen rinta, yhdyntäkivut, maitovuoto rinnoista, kuukautishäiriöt | Eritevuoto rinnoista |
Synnynnäiset ja perinnölliset/geneettiset häiriöt | Oireettoman ylimääräisen rintarauhaskudoksen manifestoituminen | |||
Yleisoireet ja antopaikassa todettavat haitat | Uupumus9 | Rintakipu, ääreisosien turvotus, influenssan kaltainen sairaus, inflammaatio, kuume, ärtyneisyys | Nesteretentio | |
Tutkimukset | Painonnousu | Veren triglyseridipitoisuuden suureneminen, hyperkolesterolemia, painon lasku, painon vaihtelu |
1 Mm. sydämen sykkeen nopeutuminen
2 Mm. ylä- ja alavatsakipu, epämukava tunne vatsassa / vatsan pullotus
3 Mm. makulaarinen ihottuma
4 Mm. yleistynyt kutina
5 Mm. epämukava tunne rinnoissa ja rintojen arkuus
6 Mm. menorragia, hypomenorrea, oligomenorrea ja amenorrea
7 Mukana verenvuoto emättimestä ja metrorragia
8 Mm. rintojen pingotus ja rintojen turvotus
9 Mm. voimattomuus ja yleinen sairaudentunne
Luettelossa esitetään tiettyä haittavaikutusta osuvimmin kuvaava MedDRA-termi. Synonyymejä tai samankaltaisia tiloja ei luetella, mutta nekin on aiheellista ottaa huomioon.
Tiettyjen haittavaikutusten kuvaus
Yhdistelmäehkäisytabletteja käyttävillä naisilla on havaittu valtimoiden ja laskimoiden tromboottisten ja tromboembolisten tapahtumien lisääntynyt riski. Näitä tapahtumia ovat mm. sydäninfarkti, aivohalvaus, ohimenevät aivoverenkiertohäiriöt (TIA), laskimoveritulppa ja keuhkoembolia. Tapahtumia kuvataan tarkemmin kohdassa Varoitukset ja käyttöön liittyvät varotoimet.
Kasvaimet
- Rintasyöpädiagnoosien frekvenssi on hyvin lievästi suurentunut ehkäisytablettien käyttäjillä. Rintasyöpä on harvinainen alle 40-vuotiailla naisilla, joten rintasyöpädiagnoosien ylimäärä on pieni verrattuna rintasyövän riskiin koko elinaikana. Syy-yhteyttä yhdistelmäehkäisytablettien käyttöön ei tunneta.
- Maksakasvaimet (hyvän- ja pahanlaatuiset)
- Kohdunkaulan syöpä
Muut tilat
- Naiset, joilla on hypertriglyseridemia (suurentunut haimatulehdusriski yhdistelmäehkäisytabletteja käytettäessä)
- Hypertensio
- Seuraavat sairaudet voivat ilmetä tai vaikeutua, mutta yhteydestä yhdistelmäehkäisytablettien käyttöön ei ole varmuutta: kolestaasiin liittyvä ikterus ja/tai kutina; sappikivimuodostus; porfyria; systeeminen lupus erythematosus; hemolyyttis-ureeminen oireyhtymä; Sydenhamin korea; herpes gestationis; otoskleroosiin liittyvä kuulon heikkeneminen
- Maksatoiminnan häiriöt
- Glukoosinsiedon muutokset tai vaikutus perifeeriseen insuliiniresistenssiin
- Crohnin tauti, haavainen koliitti
- Maksaläiskät
Yhteisvaikutukset
Muiden lääkkeiden (entsyymien indusoijien) ja ehkäisytablettien yhteisvaikutukset voivat johtaa läpäisyvuotoon ja/tai ehkäisyn pettämiseen (ks. kohta Yhteisvaikutukset).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty‐haitta‐tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Suun kautta annetun etinyyliestradiolin ja dienogestin akuutti toksisuus on hyvin vähäistä. Jos esimerkiksi lapsi ottaa useita Dienorette-tabletteja yhtä aikaa, on epätodennäköistä, että tämä aiheuttaisi toksisuusoireita. Tällaisessa tapauksessa mahdollisia oireita ovat pahoinvointi, oksentelu ja nuorilla tytöillä vähäinen verenvuoto emättimestä. Spesifistä hoitoa ei normaalisti tarvita. Tukihoitoa annetaan tarvittaessa.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Progestageenit ja estrogeenit, kiinteät yhdistelmävalmisteet
ATC-koodi: G03AA
Kaikkien hormonaalisten ehkäisymenetelmien ehkäisytehon pettämisprosentti on hyvin pieni, jos valmistetta käytetään ohjeiden mukaisesti. Ehkäisytehon pettämisprosentti voi olla suurempi, jos ohjeita ei noudateta (esim. tabletti unohtuu).
Dienorette-valmisteen kliinisissä tutkimuksissa laskettiin seuraavat Pearlin luvut:
Korjaamaton Pearlin luku: 0,454 (95 % luottamusvälin yläraja 0,701)
Korjattu Pearlin luku: 0,182 (95 % luottamusvälin yläraja 0,358).
Dienorette on yhdistelmäehkäisytabletti, joka sisältää etinyyliestradiolia ja dienogestia (progestiini).
Dienoretten ehkäisyteho perustuu useiden tekijöiden yhteisvaikutukseen. Tärkeimmät tekijät ovat ovulaation estyminen ja kohdunkaulan eritteen muuttuminen.
Dienogesti on nortestosteronijohdos, jonka affiniteetti progesteronireseptoriin on 10–30 kertaa pienempi kuin muiden synteettisten progestiinien in vitro. Eläinkokeista saadut in vivo ‑tiedot osoittavat, että sillä on vahva progesteronivaikutus ja antiandrogeeninen vaikutus. Dienogestilla ei ole merkittävää androgeeni-, mineralokortikoidi- eikä glukokortikoidivaikutusta in vivo.
Ovulaation estäväksi annokseksi todettiin pelkkää dienogestia käytettäessä 1 mg/vrk.
Suurempiannoksisten yhdistelmäehkäisytablettien (50 mikrogrammaa etinyyliestradiolia) käytön yhteydessä endometrium- ja munasarjasyöpien riski pienenee. On toistaiseksi epäselvää, tapahtuuko näin myös pienempiannoksisia yhdistelmäehkäisytabletteja käytettäessä.
Farmakokinetiikka
- Etinyyliestradioli
Imeytyminen
Suun kautta otettu etinyyliestradioli imeytyy nopeasti ja täydellisesti. Huippupitoisuus seerumissa, noin 67 pg/ml, saavutetaan 1,5–4 tunnissa.
Etinyyliestradioli metaboloituu tehokkaasti imeytymisen ja maksan ensikierron aikana, minkä johdosta suun kautta otetun lääkkeen biologinen hyötyosuus on keskimäärin noin 44 %.
Jakautuminen
Etinyyliestradioli sitoutuu voimakkaasti (noin 98-prosenttisesti) mutta epäspesifisesti seerumin albumiiniin ja suurentaa sukupuolihormoneja sitovan globuliinin (SHBG) pitoisuutta seerumissa. Etinyyliestradiolin näennäinen jakautumistilavuus on noin 2,8–8,6 l/kg.
Biotransformaatio
Etinyyliestradiolin presysteeminen konjugaatio tapahtuu sekä ohutsuolen limakalvolla että maksassa. Etinyyliestradioli metaboloituu pääasiassa aromaattisen hydroksylaation kautta. Reaktiossa muodostuu laajasti erilaisia hydroksyloituja ja metyloituja metaboliitteja, jotka esiintyvät seerumissa vapaina metaboliitteina tai konjugoituneina glukuronidien tai sulfaattien kanssa. Puhdistuman on ilmoitettu olevan noin 2,3–7 ml/min/kg.
Eliminaatio
Etinyyliestradiolin pitoisuus seerumissa pienenee kahdessa vaiheessa, joiden puoliintumisajat ovat noin 1 tunti ja 10–20 tuntia. Etinyyliestradioli ei erity muuttumattomassa muodossa. Sen metaboliitit erittyvät virtsaan ja sappeen suhteessa 4:6. Metaboliittien erityksen puoliintumisaika on noin 1 vrk.
Vakaa tila
Vakaa tila saavutetaan hoitokierron toisella puoliskolla, jolloin seerumin lääkepitoisuudet ovat noin 2-kertaisesti suuremmat kuin kerta-annoksen jälkeen.
Dienogesti
Imeytyminen
Suun kautta otettu dienogesti imeytyy nopeasti ja lähes täydellisesti. Huippupitoisuus seerumissa, noin 51 ng/ml, saavutetaan noin 2,5 tunnissa Dienorette-kerta-annoksesta. Kun lääke annettiin yhdessä etinyyliestradiolin kanssa, absoluuttinen biologinen hyötyosuus oli noin 96 %.
Jakautuminen
Dienogesti sitoutuu seerumin albumiiniin eikä sitoudu SHBG:hen eikä kortikosteroideja sitovaan globuliiniin (CBG). Noin 10 % lääkkeen kokonaispitoisuudesta seerumissa on vapaassa steroidimuodossa, ja 90 % on sitoutuneena epäspesifisesti albumiiniin. Etinyyliestradiolin indusoima SHBG-pitoisuuden suureneminen ei vaikuta dienogestin sitoutumiseen seerumin proteiineihin. Dienogestin näennäinen jakautumistilavuus on luokkaa 37–45 l.
Biotransformaatio
Dienogesti metaboloituu lähinnä hydroksylaation ja konjugaation kautta, jolloin muodostuu endokrinologisesti pitkälti inaktiivisia metaboliitteja. Nämä metaboliitit poistuvat nopeasti plasmasta, joten ihmisplasmassa ei todeta muuttumattoman dienogestin lisäksi merkittäviä metaboliitteja. Kokonaispuhdistuma (Cl/F) on kerta-annoksen jälkeen 3,6 l/h.
Eliminaatio
Seerumin dienogestipitoisuuksien pienenemisen puoliintumisaika on noin 9 tuntia. Vain mitättömän pieniä määriä dienogestia erittyy munuaisteitse muuttumattomassa muodossa. Kun suun kautta annetaan 0,1 mg painokiloa kohti, lääke erittyy munuaisten ja ulosteen kautta suhteessa 3,2. Noin 86 % annetusta annoksesta eliminoituu 6 päivässä, ja merkittävä osa, 42 %, eliminoituu lähinnä virtsaan ensimmäisten 24 tunnin aikana.
Vakaa tila
SHBG-pitoisuus ei vaikuta dienogestin farmakokinetiikkaan. Kun lääkettä otetaan päivittäin, sen pitoisuudet seerumissa suurenevat noin 1,5-kertaisesti. Vakaa tila saavutetaan, kun lääkettä on otettu päivittäin noin 4 päivänä.
Prekliiniset tiedot turvallisuudesta
Etinyyliestradiolia ja dienogestia koskevat prekliiniset tiedot vahvistavat, että lääkeaineilla on odotetut estrogeeni- ja progestiinivaikutukset.
Toistuvan altistuksen aiheuttamaa toksisuutta, geenitoksisuutta, karsinogeenisuutta ja lisääntymistoksisuutta koskevista konventionaalisista tutkimuksista saadut prekliiniset tiedot eivät osoittaneet mitään riskiä ihmisellä. On kuitenkin otettava huomioon, että sukupuolihormonit voivat stimuloida erilaisten hormoniriippuvaisten kudosten ja kasvainten kasvua.
Farmaseuttiset tiedot
Apuaineet
Vaikuttavat kalvopäällysteiset tabletit (valkoiset):
Tabletin ydin
Laktoosimonohydraatti
Magnesiumstearaatti
Maissitärkkelys
Povidoni
Kalvopäällyste
Hypromelloosi
Makrogoli
Titaanidioksidi (E171)
Kalvopäällysteiset lumetabletit (vihreät):
Tabletin ydin
Laktoosimonohydraatti
Magnesiumstearaatti
Maissitärkkelys
Povidoni
Vedetön kolloidinen piidioksidi
Kalvopäällyste
Hypromelloosi
Triasetiini
Polysorbaatti
Titaanidioksidi (E171)
Indigokarmiini (E132)
Keltainen rautaoksidi (E172)
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
2 vuotta
Säilytys
Säilytä alle 25 °C. Säilytä alkuperäispakkauksessa. Herkkä valolle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
DIENORETTE tabletti, kalvopäällysteinen
2/0,03 mg (L:kyllä) 3 x 28 fol (27,91 €)
PF-selosteen tieto
PVC/PVDC/Al-läpipainopakkaus, pakkauskoot 28, 3 x 28 ja 6 x 28 kalvopäällysteistä tablettia. Läpipainopakkausten mukana voi tulla pidike läpipainopakkausta varten.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Vaikuttavat tabletit: Valkoinen, pyöreä kalvopäällysteinen tabletti. Läpimitta noin 5,0 mm.
Lumetabletit: Vihreä, pyöreä kalvopäällysteinen tabletti. Läpimitta noin 5,0 mm.
Käyttö- ja käsittelyohjeet
Ei erityisvaatimuksia.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
DIENORETTE tabletti, kalvopäällysteinen
2/0,03 mg 3 x 28 fol
- Ei korvausta.
ATC-koodi
G03AA16
Valmisteyhteenvedon muuttamispäivämäärä
07.11.2022
Yhteystiedot
Strandvägen 7 A
114 56 Stockholm
Sweden
