OCTAPLEX infuusiokuiva-aine ja liuotin, liuosta varten 500 IU, 1000 IU
Vaikuttavat aineet ja niiden määrät
Octaplex-valmiste koostuu ihmisen protrombiinikompleksia sisältävästä infuusiokuiva-aineesta ja liuottimesta liuosta varten. Valmisteen sisältö on teoriassa seuraava:
| Aine | Octaplex 500 IU määrä / 20 ml:n injektiopullo (IU) | Octaplex 1000 IU määrä / 40 ml:n injektiopullo (IU) | Octaplex määrä, kun kuiva-aineeseen on lisätty injektionesteisiin käytettävä vesi (IU/ml) |
| Vaikuttavat aineet | |||
| Ihmisen hyytymistekijä II | 280–760 | 560–1520 | 14–38 |
| Ihmisen hyytymistekijä VII | 180–480 | 360–960 | 9–24 |
| Ihmisen hyytymistekijä IX | 500 | 1000 | 25 |
| Ihmisen hyytymistekijä X | 360–600 | 720–1200 | 18–30 |
| Lisäksi vaikuttavat ainesosat | |||
| Proteiini C | 260–620 | 520–1240 | 13–31 |
| Proteiini S | 240–640 | 480–1280 | 12–32 |
Proteiinien kokonaismäärä injektiopullossa on 260–820 mg (500 IU injektiopullo) / 520–1640 mg (1000 IU injektiopullo). Valmisteen spesifinen aktiivisuus on ≥ 0,6 IU proteiinimilligrammaa kohti tekijän IX aktiivisuutena ilmaistuna.
Apuaineet, joilla tiedetään olevan vaikutusta: natrium (75–125 mg / 500 IU injektiopullo; 150–250 mg / 1000 IU injektiopullo), hepariini (100–250 IU / 500 IU injektiopullo; 200–500 IU / 1000 IU injektiopullo, mikä vastaa 0,2–0,5 IU/IU FIX).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Infuusiokuiva-aine ja liuotin, liuosta varten.
Kliiniset tiedot
Käyttöaiheet
- Verenvuodon hoito ja verenvuodon perioperatiivinen ehkäisy, jos potilaalla on hankinnainen, esimerkiksi K-vitamiiniantagonistihoidosta johtuva, protrombiinikompleksin hyytymistekijän puutos tai hän on saanut yliannoksen K-vitamiiniantagonisteja, jolloin puutos on korjattava nopeasti.
- Verenvuodon hoito ja verenvuodon perioperatiivinen ehkäisy, jos potilaalla on K-vitamiinista riippuvaisten hyytymistekijöiden II ja X synnynnäinen puutos eikä puhdistettua spesifistä hyytymistekijävalmistetta ole saatavilla.
Ehto
Hoito tulee aloittaa hyytymishäiriöihin perehtyneen lääkärin valvonnassa.
Annostus ja antotapa
Annostus
Seuraavat ovat yleisiä annostusohjeita. Hoito on aloitettava hyytymishäiriöiden hoitoon perehtyneen lääkärin valvonnassa. Annos ja korvaushoidon kesto riippuvat hyytymishäiriön vaikeusasteesta, vuodon sijainnista ja määrästä sekä potilaan kliinisestä tilasta.
Annos ja annostiheys on laskettava kullekin potilaalle erikseen. Annosvälit on sovitettava sen mukaan, mikä eri protrombiinikompleksin hyytymistekijöiden puoliintumisaika verenkierrossa on (ks. kohta Farmakokinetiikka). Yksittäisen potilaan tarvitsemaa annostusta ei voi selvittää muuten kuin määrittämällä säännöllisesti puuttuvan hyytymistekijän pitoisuus plasmassa tai tekemällä yleisiä protrombiinikompleksin määrityksiä (protrombiiniaika, INR) sekä seuraamalla jatkuvasti potilaan kliinistä tilaa.
Suurten kirurgisten toimenpiteiden yhteydessä on tärkeää valvoa korvaushoitoa tarkasti tekemällä hyytymistestejä (määrittämällä tiettyjen hyytymistekijöiden pitoisuuksia ja/tai tekemällä yleisiä protrombiinikompleksin määrityksiä).
Verenvuoto ja sen perioperatiivinen ehkäisy K-vitamiiniantagonistihoidon aikana:
Annos riippuu hoitoa edeltävästä INR-arvosta ja painosta. Seuraavassa taulukossa on mainittu likimääräiset annokset (yksikköä käyttövalmista liuosta painokiloa kohti).
| Hoitoa edeltävä INR | 2 – < 4 | 4 – 6 | > 6 |
|---|---|---|---|
| Octaplex-annos (tekijä IX -yksikköä†) / painokilo | 25 | 35 | 50 |
| † Yksiköillä viitataan kansainvälisiin yksikköihin. | |||
Annos perustuu enintään 100 kg:n painoon. Jos potilaan paino on yli 100 kg, suurin sallittu kerta-annos (IU tekijää IX) ei siis saa olla yli 2 500 IU INR-arvolla 2 – < 4, 3 500 IU INR-arvolla 4 – 6 ja 5 000 IU INR-arvolla > 6.
Lääke korjaa K-vitamiiniantagonistin aiheuttaman hemostaasin häiriön noin 6–8 tunniksi, mutta jos potilaalle annetaan samanaikaisesti K-vitamiinia, se alkaa yleensä vaikuttaa 4–6 tunnissa. Siksi ihmisen protrombiinikompleksia ei yleensä tarvitse antaa toista kertaa, jos potilaalle on annettu myös K-vitamiinia.
Koska nämä suositukset perustuvat kokeellisiin havaintoihin, ja toipuminen ja vaikutuksen kesto saattavat vaihdella, INR-arvoa on seurattava hoidon aikana.
Verenvuoto ja sen perioperatiivinen ehkäisy K-vitamiinista riippuvaisten hyytymistekijöiden II ja X synnynnäistä puutosta sairastavilla, ellei spesifistä hyytymistekijävalmistetta ole saatavilla:
Laskettu hoitoannos perustuu siihen kokeelliseen havaintoon, että noin 1 IU tekijää II lisää tekijän II aktiivisuutta plasmassa 0,02 IU/ml ja 1 IU tekijää X tekijän X aktiivisuutta vastaavasti 0,017 IU/mL.
Annos ilmaistaan kansainvälisinä yksikköinä (IU) WHO:n kutakin tekijää koskevan standardin mukaisesti. Tietyn hyytymistekijän aktiivisuus plasmassa ilmaistaan joko prosentteina (suhteessa normaaliin plasmaan) tai kansainvälisinä yksikköinä (suhteessa kyseisen hyytymistekijän kansainväliseen standardiin).
Yksi kansainvälinen yksikkö (IU) hyytymistekijän aktiivisuutta vastaa kyseisen hyytymistekijän määrää millilitrassa normaalia ihmisen plasmaa.
Esimerkiksi tarvittavan tekijä X ‑annoksen laskeminen perustuu siihen kokeelliseen havaintoon, että 1 kansainvälinen yksikkö (IU) tekijää X painokiloa kohti lisää plasman tekijän X aktiivisuutta 0,017 IU/ml. Tarvittava annos määritetään seuraavaa kaavaa käyttäen:
Tarvittava yksikkömäärä = paino (kg) x haluttu hyytymistekijä X:n aktiivisuuden lisäys (IU/ml) x 60
missä 60 (ml/kg) on arvioidun korjautumisen korjauskerroin.
Tarvittava tekijän II annostus:
Tarvittava yksikkömäärä = paino (kg) x haluttu hyytymistekijä II:n aktiivisuuden lisäys (IU/ml) x 50
Jos tiedetään, paljonko kyseisen potilaan arvo on aiemmin korjautunut, laskelmat on tehtävä sen perusteella.
Pediatriset potilaat
Tietoja ei ole saatavilla Octaplex-valmisteen käytöstä pediatrisille potilaille.
Antotapa
Octaplex annetaan laskimoon infuusionopeudella 0,12 ml/kg/min (noin 3 yksikköä/kg/min); enimmäisnopeus on 8 ml/min (noin 210 yksikköä/min). Infuusio annetaan aseptisesti.
Vasta-aiheet
- Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
- Allergia hepariinille tai hepariinin aiheuttama trombosytopenia anamneesissa.
- IgA:n puutostila henkilöillä, joille on kehittynyt IgA:n vasta-aineita.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Hoito on annettava hyytymishäiriöiden hoitoon erikoistuneen asiantuntijan ohjeiden mukaan.
Jos potilaalla on hankinnainen (esim. K-vitamiiniantagonistien käytöstä johtuva) K-vitamiinista riippuvaisen hyytymistekijän puutos, Octaplex-valmistetta on syytä käyttää vain, jos protrombiinikompleksiarvon nopea korjaus on tarpeen, kuten suuren verenvuodon tai päivystysleikkauksen yhteydessä. Muissa tapauksissa riittää tavallisesti, kun K-vitamiiniantagonistin annosta vähennetään ja/tai annetaan K-vitamiinia.
Jos potilasta hoidetaan K-vitamiiniantagonistilla, taustalla voi olla liiallinen hyytymistaipumus, ja protrombiinikompleksitiivisteen antaminen infuusiona voi pahentaa sitä.
Allergisen tai anafylaktisen reaktion sattuessa infuusio on heti lopetettava. Sokin sattuessa se hoidetaan tavalliseen tapaan.
Ihmisen verestä tai plasmasta tehtyjen lääkevalmisteiden välityksellä tapahtuvien infektioiden torjuntaan käytetään yleensä seuraavia keinoja: luovuttajien valinta, spesifisten infektion merkkiaineiden seulonta yksittäisistä luovutuseristä ja plasmapooleista, ja virusten tehokas inaktivointi ja eliminointi valmistusvaiheissa. Silti ihmisen verestä tai plasmasta tehtyjä lääkevalmisteita käytettäessä infektion vaaraa ei pystytä sulkemaan kokonaan pois. Tämä koskee myös tuntemattomia ja uusia viruksia ja muita patogeeneja.
Käytettyjen toimenpiteiden katsotaan tehoavan vaipallisiin viruksiin, joita ovat esimerkiksi ihmisen immuunikatovirus (HIV), hepatiitti B -virus (HBV) ja hepatiitti C -virus (HCV). Niistä saattaa olla jonkin verran hyötyä myös hepatiitti A -viruksen (HAV) ja parvovirus B19:n kaltaisia vaipattomia viruksia vastaan. Parvovirus B19 ‑infektio voi olla vakava, jos potilas on raskaana (sikiön infektio), sairastaa immuunivajavuutta tai jos erytropoieesi on lisääntynyt (potilaalla on esim. hemolyyttinen anemia).
Asianmukaiset rokotukset (hepatiitti A:ta ja B:tä vastaan) ovat paikallaan, jos potilas saa säännöllisesti tai toistuvasti ihmisen plasmasta tehtyjä protrombiinikompleksivalmisteita.
Valmisteen nimi ja eränumero on syytä kirjata joka kerta, kun potilaalle annetaan Octaplex-valmistetta, että pystytään jäljittämään mitä erää potilas on saanut. Erityisesti jos synnynnäistä tai hankinnaista hyytymistekijän puutosta sairastavalle annetaan ihmisen protrombiinikompleksivalmisteita toistuvasti, tromboosin tai disseminoituneen intravaskulaarisen koagulaation vaara on olemassa. Ihmisen protrombiinikompleksivalmisteita käytettäessä potilasta on tarkkailtava huolellisesti intravaskulaarisen koagulaation ja tromboosin merkkien ja oireiden varalta. Jos potilaalla on anamneesissa sepelvaltimotauti tai hänellä on joku maksasairaus, kyseessä on peri- tai postoperatiivinen tilanne, vastasyntynyt tai potilas, jolla on tavallista suurempi tromboembolisten tapahtumien tai disseminoitununeen intravaskulaarisen koagulaation riski, hänen tilaansa on seurattava tarkasti tromboembolisten komplikaatioiden varalta. Kaikissa näissä tilanteissa hoidosta odotettavaa hyötyä on punnittava komplikaatioriskiin nähden.
Octaplex-valmisteen käytöstä K-vitamiinin puutoksesta johtuvan perinataalisen verenvuodon hoitoon vastasyntyneillä ei ole tietoa.
Tämä lääkevalmiste sisältää 75–125 mg natriumia per 500 IU:n injektiopullo ja 150–250 mg natriumia per 1000 IU:n injektiopullo, jotka vastaavat 3,8–6,3 %:a tai 7,5–12,5 %:a WHO:n suosittelemasta natriumin 2 g:n päivittäisestä enimmäissaannista aikuisille.
Jos potilas sairastaa synnynnäistä K-vitamiinista riippuvaisen hyytymistekijän puutosta, hänelle tulee mahdollisuuksien mukaan antaa juuri tarvittavaa hyytymistekijää.
Yhteisvaikutukset
Ihmisen protrombiinikompleksivalmisteet neutraloivat K-vitamiiniantagonistien vaikutuksen, mutta yhteisvaikutuksia muiden lääkevalmisteiden kanssa ei tiedetä olevan.
Vaikutus biologisiin testeihin:
Jos suuria annoksia ihmisen protrombiinikompleksia saavalle potilaalle tehdään hepariinin vaikutukselle herkkiä hyytymistestejä, valmisteen sisältämä hepariini täytyy ottaa huomioon tuloksia tulkittaessa.
Raskaus ja imetys
Ihmisen protrombiinikompleksin käytön turvallisuutta ihmisellä raskauden ja imetyksen aikana ei ole selvitetty. Eläinkokeet eivät sovi käytettäviksi arvioitaessa näiden valmisteiden turvallisuutta raskauden aikana, alkion tai sikiön kehityksen, synnytyksen tai syntymän jälkeisen kehityksen kannalta. Siksi ihmisen protrombiinikompleksia saa käyttää raskauden ja imetyksen aikana vain, jos se on selvästi tarpeen.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Tutkimuksia valmisteen vaikutuksesta ajokykyyn tai koneiden käyttökykyyn ei ole tehty.
Haittavaikutukset
Yhteenveto turvallisuusprofiilista
Korvaushoito voi aiheuttaa sen, että verenkiertoon syntyy vasta-aineita yhtä tai useampia ihmisen protrombiinikompleksin tekijöitä vastaan. Jos vasta-aineita syntyy, kliininen vaste on huono.
Allergisia tai anafylaktisia reaktioita saattaa esiintyä joissain harvoissa tapauksissa (≥ 1/10 000, < 1/1 000) mukaan lukien vakavat anafylaktiset reaktiot.
Lämmönnousua saattaa esiintyä hyvin harvoin (≥ /10 000).
Ihmisen protrombiinikompleksin annostelun jälkeen saattaa esiintyä tromboembolisia tapahtumia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Päänsärkyä saattaa esiintyä joskus harvoin (≥ 1/10 000, < 1/1000).
Taulukoitu lista Octaplex-valmisteen haittavaikutuksista
Seuraava taulukko esitetään MedDRAn elinjärjestelmäluokan mukaisesti ja suositeltuja termejä käyttäen. Esiintyvyydet perustuvat kliinisten tutkimusten tuloksiin, seuraavien esiintyvyysluokkien mukaisesti: hyvin yleinen (≥ 1/10);yleinen (≥ 1/100, < 1/10); melko harvinainen (≥ 1/1 000, < 1/100); harvinainen (≥ 1/10 000, < 1/1 000); hyvin harvinainen (< 1/10 000) tai tuntematon (koska saatavissa oleva tieto ei riitä arviointiin).
| MedDRAn elinjärjestelmäluokka | Haittavaikutus | Esiintyvyys |
| Psyykkiset häiriöt | Ahdistuneisuus | melko harvinainen |
| Verisuonisto | Syvä laskimotukos | yleinen |
| Tromboosi | melko harvinainen | |
| Kohonnut verenpaine | melko harvinainen | |
| Hengityselimet, rintakehä ja välikarsina | Keuhkoembolia | melko harvinainen |
| Bronkospasmi | melko harvinainen | |
| Veriyskä | melko harvinainen | |
| Nenäverenvuoto | melko harvinainen | |
| Yleisoireet ja antopaikassa todettavat haitat | Injektiokohdan kuumotus | melko harvinainen |
| Tutkimukset | Fibriinin D-dimeerin määrän nousu | melko harvinainen |
| Veren trombiinin määrän nousu | melko harvinainen | |
| Epänormaali maksan toiminta | melko harvinainen | |
| Vammat ja myrkytykset | Tromboosi laitteessa | melko harvinainen |
Seuraavat haittavaikutukset on raportoitu myyntiluvan myöntämisen jälkeisessä käytössä. Koska haittavaikutusten raportointi myyntiluvan myöntämisen jälkeen on vapaaehtoista ja kaikkien valmistetta käyttäneiden potilaiden määrä ei ole tiedossa, ei näiden haittavaikutusten esiintyvyyttä voida arvioida uskottavasti.
| Immuunijärjestelmä Anafylaktinen sokki, yliherkkyys |
| Hermosto Vapina |
| Sydän Sydämenpysähdys, takykardia |
| Verisuonisto Verenkierron romahtaminen, epänormaalin matala verenpaine |
| Hengityselimet, rintakehä ja välikarsina Hengenahdistus, hengitysvajaus |
| Ruoansulatuselimistö Pahoinvointi |
| Iho ja ihonalainen kudos Nokkosihottuma, ihotulehdus |
| Yleisoireet ja antopaikassa todettavat haitat Vilunväristykset |
Octaplex sisältää hepariinia. Hepariini saattaa aiheuttaa harvinaisissa tapauksissa äkillisen allergisen reaktion, jossa verihiutaleiden määrä vähenee alle 100 000/mikrol tai 50 % alkuarvosta (trombosytopenia tyyppi II). Potilailla, jotka eivät ole aiemmin saaneet allergista reaktiota hepariinista, reaktio saattaa ilmetä 6-14 päivän kuluessa siitä, kun hoito on aloitettu. Hepariinille yliherkkien potilaiden reaktio saattaa ilmetä muutaman tunnin kuluessa.
Octaplex-valmisteen käyttö tulee välittömästi lopettaa, jos allerginen reaktio ilmenee. Näillä potilailla ei voi jatkossakaan käyttää hepariinia sisältäviä valmisteita.
Turvallisuudesta tartuntojen kannalta on kerrottu kohdassa Varoitukset ja käyttöön liittyvät varotoimet.
Pediatriset potilaat
Tietoja ei ole saatavilla Octaplex-valmisteen käytöstä pediatrisille potilaille..
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
FI-00034 Fimea
Yliannostus
Käytettäessä suuria annoksia ihmisen protrombiinikompleksivalmisteita on ilmennyt sydäninfarkteja, disseminoitunutta intravaskulaarista koagulaatiota, laskimotrombooseja ja keuhkoembolioita. Tämän vuoksi tromboembolisten komplikaatioiden ja disseminoituneen intravaskulaarisen koagulaation mahdollisuus on yliannostuksen yhteydessä tavallista suurempi.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: hemostaatit, hyytymistekijät IX, II, VII ja X yhdistelmävalmisteina. ATC-koodi: B02BD01.
Hyytymistekijöitä II, VII, IX ja X syntyy maksassa K-vitamiinin vaikutuksesta, ja niitä kutsutaan yleensä protrombiinikompleksiksi.
Tekijä VII on veren hyytymisen ulkoisen aktivaatiotien käynnistävän aktiivisen seriiniproteaasitekijän VIIa tsymogeeni. Kudostekijän ja tekijän VIIa kompleksi aktivoi hyytymistekijöitä X ja IX, jolloin syntyy tekijöitä IXa ja Xa.
Hyytymiskaskadin edetessä protrombiini (tekijä II) aktivoituu ja muuttuu trombiiniksi. Trombiinin vaikutuksesta fibrinogeeni muuttuu fibriiniksi, mikä johtaa hyytymän muodostumiseen. Normaali trombiinin muodostus on myös ratkaisevan tärkeää verihiutaleiden toiminnan kannalta osana primaarista hemostaasia.
Erillinen vaikea tekijän VII puute vähentää trombiinin muodostusta sekä aiheuttaa verenvuototaipumuksen, joka johtuu fibriinin muodostuksen ja primaarisen hemostaasin häiriöstä. Erillinen tekijän IX puute aiheuttaa yhden klassisista verenvuototaudeista (B-hemofilian). Erillinen tekijän II tai tekijän X puute on hyvin harvinaista, mutta vaikeana ne voivat aiheuttaa samantyyppisen verenvuototaipumuksen kuin klassisissa hemofilioissa.
Hankinnaista K-vitamiinista riippuvaisten hyytymistekijöiden puutetta ilmenee K-vitamiini-antagonisteja käytettäessä. Jos puute on vaikea, se aiheuttaa vaikean verenvuototaipumuksen, jolle ovat tyypillisiä retroperitoneaaliset ja aivoverenvuodot, eivät niinkään lihas- tai nivelvuodot. Myös vaikea maksan vajaatoiminta vähentää merkittävästi K-vitamiinista riippuvaisten hyytymistekijöiden määrää, ja siihen liittyy kliininen verenvuototaipumus, joka johtuu kuitenkin usein samaan aikaan ilmenevistä vähäisestä intravaskulaarisesta koagulaatiosta, pienistä verihiutalemääristä, hyytymistä estävien tekijöiden puutteesta ja fibrinolyysin häiriöstä.
Ihmisen protrombiinikompleksin antaminen lisää K-vitamiinista riippuvaisten hyytymistekijöiden määrää plasmassa ja saattaa tilapäisesti korjata hyytymishäiriön, jos potilaalla on puutetta yhdestä tai useammasta siihen kuuluvista tekijöistä.
Farmakokinetiikka
Puoliintumisajat plasmassa:
| Hyytymistekijä | puoliintumisaika |
| Tekijä II | 48–60 tuntia |
| Tekijä VII | 1,5–6 tuntia |
| Tekijä IX | 20–24 tuntia |
| Tekijä X | 24–48 tuntia |
Koska Octaplex annetaan laskimoon, se on heti elimistön käytettävissä.
Prekliiniset tiedot turvallisuudesta
Kaikki prekliiniset tiedot, joilla katsotaan olevan merkitystä kliinisen turvallisuuden kannalta, on mainittu muissa valmisteyhteenvedon kohdissa.
Farmaseuttiset tiedot
Apuaineet
Kuiva-aine:
Hepariini: 0,2–0,5 IU/IU FIX
Trinatriumsitraattidihydraatti
Liuotin: injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
3 vuotta.
Käytön aikana kemiallisen ja fysikaalisen säilyvyyden on osoitettu olevan 8 tuntia 25 °C:ssa.
Mikrobiologiselta kannalta valmiste tulisi käyttää välittömästi, ellei avaamiseen tai käyttökuntoon saattamiseen käytetty menetelmä poista mikrobikontaminaation riskiä. Jos valmistetta ei käytetä heti, käyttöä edeltävä säilytysaika ja -olosuhteet ovat käyttäjän vastuulla.
Säilytys
Säilytä alle 25 ºC. Ei saa jäätyä. Säilytä alkuperäispakkauksessa. Herkkä valolle.
Käyttökuntoon saatetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
OCTAPLEX infuusiokuiva-aine ja liuotin, liuosta varten
500 IU (L:ei) 1 kpl (464,92 €)
1000 IU (L:ei) 1 kpl (902,46 €)
PF-selosteen tieto
Pakkauskoot:
Octaplex 500 IU
Pakkauksen sisältö:
- kuiva-aine (tyypin I lasisessa) injektiopullossa, joka on suljettu tulpalla (halobutyylikumia) ja korkilla (alumiinia).
- 20 ml injektionesteisiin käytettävää vettä (tyypin I tai tyypin II lasisessa) injektiopullossa, joka on suljettu tulpalla (halobutyylikumia) ja korkilla (alumiinia).
- 1 Nextaro-siirtopakkaus.
Octaplex 1000 IU
Pakkauksen sisältö:
- kuiva-aine (tyypin I lasisessa) injektiopullossa, joka on suljettu tulpalla (halobutyylikumia) ja korkilla (alumiinia).
- 40 ml injektionesteisiin käytettävää vettä (tyypin I lasisessa) injektiopullossa, joka on suljettu tulpalla (halobutyylikumia) ja korkilla (alumiinia).
- 1 Nextaro-siirtopakkaus.
Valmisteen kuvaus:
Infuusiokuiva-aine on sinertävän valkoista.
Liuotin on kirkas ja väritön neste.
Käyttö- ja käsittelyohjeet
Lukekaa kaikki ohjeet ja seuratkaa niitä huolellisesti!
Seuraavat toimenpiteet tulee tehdä aseptisesti!
Aine liukenee nopeasti huoneenlämmössä. Liuoksen tulee olla kirkasta tai hieman opalisoivaa. Älä käytä liuosta, joka on sameaa tai jossa on sakkaa. Ennen valmisteen antamista katso, ettei siinä ole hiukkasia eikä se ole värjäytynyt.
Liuottamisen jälkeen liuos tulee käyttää välittömästi.
Käyttämätön valmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Liuotusohjeet:
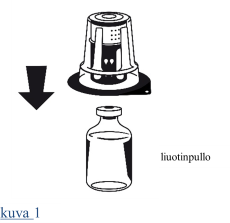
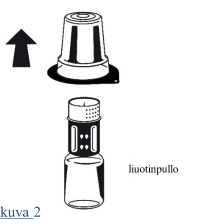
| 1. Anna suljetuissa injektiopulloissa olevien liuottimen (injektionesteisiin käytettävä vesi) ja infuusiokuiva-aineen tarvittaessa lämmetä huoneenlämpöisiksi. Tämä lämpötila tulee ylläpitää liuottamisen ajan. 2. Irrota kuiva-ainepullosta ja liuotinpullosta niiden irti napsautettavat korkit, ja desinfioi kummankin pullon kumitulppa asianmukaisesti. 3. Avaa Nextaro-pakkaus vetämällä suljin auki. Aseta liuotinpullo tasaiselle alustalle ja pidä siitä tukevasti kiinni. Poistamatta Nextaro-adapteria ulkopakkauksestaan aseta sen sininen osa liuotinpulloa vasten ja paina tiukasti, kunnes kuulet napsahduksen (kuva 1). Kiinnityksen yhteydessä osia ei saa kiertää! Pidä kiinni liuotinpullosta ja poista varovaisesti Nextaro-laitteen pakkaus. Huolehdi siitä, että Nextaro jää kunnolla kiinni liuotinpulloon (kuva 2). |
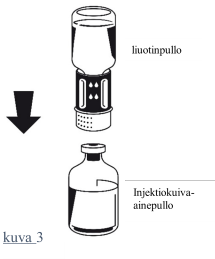 | 4. Aseta kuiva-ainepullo tasaiselle alustalle ja pidä siitä tukevasti kiinni. Käännä liuotinpullo, johon Nextaro on kiinnitetty, ylösalaisin. Aseta Nextaro-liittimen valkoinen osa kuiva-ainepulloa (jauhe) vasten ja paina lujasti, kunnes kuulet napsahduksen (kuva 3). Kiinnityksen yhteydessä osia ei saa kiertää! Liuotin valuu automaattisesti kuiva-ainepulloon. |
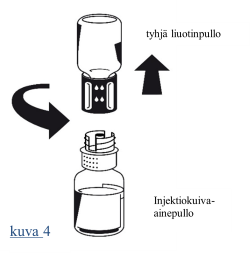 | 5. Pidä molemmat injektiopullot edelleen kiinni toisissaan ja pyöritä kuiva-ainepulloa varovasti, kunnes valmiste on liuennut. Hävitä tyhjä liuotinainepullo ja siinä oleva Nextaro-adapterin sininen osa. |
Jos kuiva-aine ei liukene täydellisesti tai muodostuu sakkaa, älä käytä valmistetta.
Infuusio-ohjeet:
Varotoimenpiteenä potilaan pulssi tulee mitata ennen infuusiota ja infuusion aikana. Jos merkittävää pulssin nopeutumista havaitaan, infuusionopeutta tulee hidastaa tai annostelu tulee keskeyttää.
- Kiinnitä yksi 20 ml:n (500 IU) tai 40 ml:n (1 000 IU) ruisku Nextaro-adapterin luer lock -portin valkoiseen osaan. Käännä pullo ylösalaisin ja vedä liuos ruiskuun. Kun liuos on siirretty, pidä ruiskun männästä tukevasti kiinni (ruisku edelleen ylösalaisin) ja irrota ruisku Nextaro-adapterista. Hävitä Nextaro sekä tyhjä injektiopullo.
- Desinfioi aiottu injektiokohta asianmukaisesti.
- Anna liuos laskimoon infuusionopeudella 0,12 ml/kg/min (noin 3 yksikköä/kg/min); enimmäisnopeus on 8 ml/min (noin 210 yksikköä/min). Infuusio annetaan aseptisesti.
Ruiskuun ei saa päästä verta, jottei syntyisi fibriinihyytymiä. Nextaro on tarkoitettu kertakäyttöön.
Korvattavuus
OCTAPLEX infuusiokuiva-aine ja liuotin, liuosta varten
500 IU 1 kpl
1000 IU 1 kpl
- Ei korvausta.
ATC-koodi
B02BD01
Valmisteyhteenvedon muuttamispäivämäärä
11.09.2024
Yhteystiedot
Rajatorpantie 41 C
01640 Vantaa
09 8520 2710
www.octapharma.fi
info@octapharma.fi