ULTIBRO BREEZHALER inhalaatiojauhe, kapseli, kova 85/43 mikrog
Vaikuttavat aineet ja niiden määrät
Yksi kapseli sisältää 143 mikrogrammaa indakaterolimaleaattia, joka vastaa 110 mikrogrammaa indakaterolia, ja 63 mikrogrammaa glykopyrroniumbromidia, joka vastaa 50 mikrogrammaa glykopyrroniumia (indakaterol./glykopyrronium.).
Jokainen inhalaattorista saatava annos (annos, joka vapautuu inhalaattorin suukappaleesta) sisältää 110 mikrogrammaa indakaterolimaleaattia, joka vastaa 85 mikrogrammaa indakaterolia, ja 54 mikrogrammaa glykopyrroniumbromidia, joka vastaa 43 mikrogrammaa glykopyrroniumia.
Apuaine(et), joiden vaikutus tunnetaan
Yksi kapseli sisältää 23,5 mg laktoosia (monohydraattina).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Inhalaatiojauhe, kova kapseli (inhalaatiojauhe).
Kliiniset tiedot
Käyttöaiheet
Ultibro Breezhaler on tarkoitettu oireita lievittäväksi bronkodilatoivaksi ylläpitohoidoksi aikuispotilaiden keuhkoahtaumataudissa (COPD).
Annostus ja antotapa
Annostus
Suositusannos on yhden kapselin sisältö inhaloituna kerran vuorokaudessa Ultibro Breezhaler -inhalaattorilla.
Ultibro Breezhaler -valmistetta suositellaan otettavaksi aina samaan aikaan päivästä joka päivä. Jos annos jää väliin, se on otettava mahdollisimman pian saman päivän kuluessa. Potilaita on neuvottava ottamaan enintään yksi annos vuorokaudessa.
Erityisryhmät
Iäkkäät potilaat
Ultibro Breezhaler -valmistetta voidaan käyttää suositusannoksella iäkkäille potilaille (75‑vuotiaille ja vanhemmille).
Munuaisten vajaatoiminta
Ultibro Breezhaler -valmistetta voidaan käyttää suositusannoksella potilaille, joilla on lievä tai kohtalainen munuaisten vajaatoiminta. Jos potilaalla on vaikea munuaisten vajaatoiminta tai dialyysihoitoa vaativa loppuvaiheen munuaissairaus, tätä lääkettä tulee käyttää vain, jos odotettavissa oleva hyöty arvioidaan suuremmaksi kuin hoidosta mahdollisesti aiheutuva riski (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Maksan vajaatoiminta
Lievää tai kohtalaista maksan vajaatoimintaa sairastavat potilaat voivat käyttää Ultibro Breezhaler -valmistetta tavanomaisin suositusannoksin. Tietoa Ultibro Breezhaler -valmisteen käytöstä vaikeaa maksan vajaatoimintaa sairastavien potilaiden hoidossa ei ole, joten näiden potilaiden osalta on syytä varovaisuuteen (ks. kohta Farmakokinetiikka).
Pediatriset potilaat
Ei ole asianmukaista käyttää Ultibro Breezhaler -valmistetta pediatrisille potilaille (alle 18‑vuotiaille) keuhkoahtaumataudin hoitoon. Ultibro Breezhaler -valmisteen turvallisuutta ja tehoa lasten hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
Antotapa
Vain inhalaatioon. Kapseleita ei saa niellä.
Kapselit pitää aina ottaa Ultibro Breezhaler -inhalaattoria käyttäen (ks. kohta Käyttö- ja käsittelyohjeet). Annostelussa on aina käytettävä jokaisen uuden pakkauksen mukana toimitettavaa inhalaattoria.
Potilaita pitää neuvoa lääkevalmisteen oikeasta käyttötavasta. Jos potilaan hengittäminen ei helpotu, häneltä on varmistettava, ettei hän niele lääkevalmistetta inhaloinnin sijaan.
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet ennen lääkkeen antoa.
Vasta-aiheet
Yliherkkyys vaikuttaville aineille tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Ultibro Breezhaler -valmistetta ei saa antaa samanaikaisesti muiden pitkävaikutteisia beeta-agonisteja tai pitkävaikutteisia muskariinireseptorin antagonisteja sisältävien lääkevalmisteiden, eli samoihin farmakoterapeuttisiin ryhmiin Ultibro Breezhaler -valmisteen sisältämien vaikuttavien aineiden kanssa kuuluvien lääkkeiden, kanssa (ks. kohta Yhteisvaikutukset).
Astma
Ultibro Breezhaler -valmistetta ei pidä käyttää astman hoitoon, sillä tietoja tämän käyttöaiheen osalta ei ole.
Pitkävaikutteiset beeta2-agonistit saattavat lisätä astmaan liittyvien vakavien haittatapahtumien riskiä, mukaan lukien astmaan liittyvä kuolema, kun niitä käytetään astman hoitoon.
Ei akuuttihoitoon
Ultibro Breezhaler -valmistetta ei ole tarkoitettu akuuttien bronkospasmijaksojen ensihoitoon.
Yliherkkyys
Indakaterolin tai glykopyrroniumin, eli Ultibro Breezhaler -valmisteen vaikuttavien aineiden annostelun jälkeisiä välittömiä yliherkkyysreaktioita on raportoitu. Jos allergiseen reaktioon viittaavia merkkejä ilmenee, etenkin angioedeemaa (hengitys- tai nielemisvaikeuksia; kielen, huulten tai kasvojen turpoamista), urtikariaa tai ihottumaa, on hoito välittömästi lopetettava ja muu, vaihtoehtoinen lääkitys aloitettava.
Paradoksaalinen bronkospasmi
Ultibro Breezhaler -valmisteen anto voi johtaa paradoksaaliseen bronkospasmiin, joka voi olla hengenvaarallinen. Jos potilaalle kehittyy paradoksaalinen bronkospasmi, hoito on lopetettava heti ja sen sijasta on aloitettava muu käypä hoito.
Glykopyrroniumiin liittyvät antikolinergiset vaikutukset
Ahdaskulmaglaukooma
Tietoja ahdaskulmaglaukoomaa sairastavien potilaiden hoidosta ei ole, joten näiden potilaiden hoidossa Ultibro Breezhaler -valmistetta on käytettävä varoen.
Potilaille on kerrottava akuutin ahdaskulmaglaukooman merkeistä ja oireista, ja heitä on kehotettava lopettamaan Ultibro Breezhaler -valmisteen käyttö, jos heille kehittyy jotain näistä merkeistä tai oireista.
Virtsaumpi
Tietoja virtsaummesta kärsivien potilaiden hoidosta ei ole, joten näiden potilaiden hoidossa Ultibro Breezhaler -valmistetta on käytettävä varoen.
Potilaat, joilla on vaikea munuaisten vajaatoiminta
Potilailla, joilla oli lievä tai kohtalainen munuaisten vajaatoiminta, todettiin kohtalainen glykopyrroniumin systeemisen kokonaisaltistuksen (AUClast) suurentuminen enimmillään keskimäärin 1,4‑kertaiseksi. Kun potilaalla oli vaikea munuaisen vajaatoiminta ja loppuvaiheen munuaissairaus, kokonaisaltistus suureni enimmillään keskimäärin 2,2‑kertaiseksi. Jos potilaalla on vaikea munuaisten vajaatoiminta (glomerulusten laskennallinen suodatusnopeus alle 30 ml/min/1,73 m2), mukaan lukien potilaat, joilla on dialyysihoitoa vaativa loppuvaiheen munuaissairaus, Ultibro Breezhaler -valmistetta tulee käyttää vain, jos odotettavissa oleva hyöty arvioidaan suuremmaksi kuin hoidosta mahdollisesti aiheutuva riski (ks. kohta Farmakokinetiikka). Näitä potilaita on seurattava huolellisesti mahdollisten haittavaikutusten varalta.
Kardiovaskulaariset vaikutukset
Ultibro Breezhaler -valmisteen käytössä tulee noudattaa varovaisuutta, jos potilaalla on jokin kardiovaskulaarisairaus (sepelvaltimotauti, akuutti sydäninfarkti, rytmihäiriöitä, hypertensio).
Beeta2-agonistit voivat aiheuttaa joillekin potilaille kliinisesti merkittäviä kardiovaskulaarivaikutuksia, jotka ilmenevät syketaajuuden tihenemisenä, verenpaineen kohoamisena ja/tai muina oireina. Tällaisessa tilanteessa hoito tällä lääkevalmisteella saatetaan joutua lopettamaan. Beeta-agonistit ovat aiheuttaneet myös EKG-muutoksia kuten T-aallon madaltumista, QTc-ajan pitenemistä ja ST-laskua. Havaintojen kliinisestä merkityksestä ei kuitenkaan ole tietoa. Siksi pitkävaikutteisia beeta2-agonisteja (LABA) tai LABA-valmistetta sisältäviä yhdistelmävalmisteita kuten Ultibro Breezhaleria tulee käyttää varoen potilaille, joilla tiedetään tai epäillään olevan pidentynyt QT-aika tai joita hoidetaan QT-ajan pitenemistä aiheuttavilla lääkevalmisteilla.
Kliinisistä tutkimuksista suljettiin pois ne potilaat, joilla oli epästabiili iskeeminen sydänsairaus, vasemman kammion vajaatoiminta, aikaisemmin sairastettu sydäninfarkti, rytmihäiriö (muu kuin krooninen stabiili eteisvärinä), sekä ne, joiden anamneesissa oli pitkä QT-oireyhtymä tai joiden QTc-aika oli pidentynyt (Friderician menetelmällä mitattuna, > 450 millisekuntia), joten kokemusta näiden potilasryhmien hoidosta ei ole. Ultibro Breezhaler -valmistetta on käytettävä varoen näissä potilasryhmissä.
Hypokalemia
Joillekin potilaille beeta2-agonistit saattavat aiheuttaa merkittävää hypokalemiaa, joka altistaa kardiovaskulaarihaitoille. Seerumin kaliumpitoisuuden pieneneminen on yleensä ohimenevää eikä vaadi kaliumlisän käyttöä. Vaikeaa keuhkoahtaumatautia sairastavilla hypoksia ja muu samanaikainen hoito saattavat pahentaa hypokalemiaa, mikä voi suurentaa rytmihäiriöherkkyyttä (ks. kohta Yhteisvaikutukset).
Kliinisesti merkittäviä hypokaleemisia vaikutuksia ei ole havaittu suositellulla terapeuttisella Ultibro Breezhaler - annoksella suoritetuissa kliinisissä tutkimuksissa (ks. kohta Farmakodynamiikka).
Hyperglykemia
Suurten beeta2-agonistiannosten inhaloiminen saattaa suurentaa plasman glukoosipitoisuuksia. Diabeetikkojen plasman glukoosipitoisuuksia tulee seurata tavanomaista tarkemmin Ultibro Breezhaler -hoidon aloittamisen yhteydessä.
Pitkäkestoisissa kliinisissä tutkimuksissa useammat Ultibro Breezhaler -valmistetta käyttäneet potilaat kokivat kliinisesti merkittäviä verensokerimuutoksia (4,9 %) kuin lumelääkettä käyttäneet potilaat (2,7 %). Ultibro Breezhaleria ei ole tutkittu potilailla, joilla on huonossa hoitotasapainossa oleva diabetes, siksi näiden potilaiden kohdalla suositellaan varovaisuutta ja asianmukaista seurantaa.
Yleisoireet
Ultibro Breezhaler -valmistetta on käytettävä varoen hoidettaessa potilaita, joilla on jokin kouristuksia aiheuttava sairaus tai tyreotoksikoosi, sekä potilaita, jotka ovat epätavallisen herkkiä beeta2-agonistien vaikutuksille.
Apuaineet
Tämä lääke sisältää laktoosia. Potilaiden, joilla on harvinainen perinnöllinen galaktoosi-intoleranssi, täydellinen laktaasinpuutos tai glukoosi-galaktoosi imeytymishäiriö, ei pidä käyttää tätä lääkettä.
Yhteisvaikutukset
Vakaassa tilassa molempien vaikuttavien aineiden, indakaterolin ja glykopyrroniumin, samanaikaisen suun kautta tapahtuvan inhalaation ei ole todettu vaikuttavan kummankaan vaikuttavien aineen farmakokineettisiin ominaisuuksiin.
Erityisiä yhteisvaikutustutkimuksia Ultibro Breezhaler -valmisteella ei ole tehty. Tiedot mahdollisista yhteisvaikutuksista perustuvat molempien vaikuttavien aineiden yhteisvaikutuspotentiaalia koskeviin tietoihin.
Samanaikaista käyttöä ei suositella
Beetasalpaajat
Beetasalpaajat saattavat heikentää tai estää beeta2-agonistien vaikutusta. Näin ollen Ultibro Breezhaler -valmistetta ei pidä käyttää yhdessä beetasalpaajien (myöskään silmätippojen) kanssa, ellei niiden käyttöön ole painavaa syytä. Jos beetasalpaajan käyttö on tarpeen, tulee ensisijaisesti valita kardioselektiivinen beetasalpaaja, mutta niidenkin käytössä on noudatettava varovaisuutta.
Antikolinergiset aineet
Ultibro Breezhaler -valmisteen käyttöä muiden antikolinergisiä lääkeaineita sisältävien valmisteiden kanssa ei ole tutkittu, joten yhteiskäyttöä ei suositella (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Sympatomimeetit
Muiden sympatomimeettien samanaikainen käyttö (joko monoterapiana tai yhdistelmähoidon osana) saattaa voimistaa indakaterolin haittavaikutuksia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Samanaikaisen käytön yhteydessä on syytä varovaisuuteen
Hypokalemiaa aiheuttavat hoidot
Samanaikainen hoito hypokalemiaa aiheuttavilla lääkkeillä (metyyliksantiinijohdokset, steroidit tai kaliumia säästämättömät diureetit) saattaa tehostaa beeta2-agonistien mahdollista hypokaleemista vaikutusta, joten käytä siksi varoen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Samanaikaisen käytön yhteydessä huomioitavat seikat
Metaboliset ja kuljettajaproteiineihin liittyvät yhteisvaikutukset
Indakaterolipuhdistuman kannalta keskeisten tekijöiden eli CYP3A4:n ja P-glykoproteiinin (P-gp) toiminnan estyminen suurentaa systeemisen indakaterolialtistuksen jopa kaksinkertaiseksi. Yhteisvaikutuksista johtuvan altistuksen suurenemisen ei katsota aiheuttavan turvallisuusriskiä, sillä indakaterolia käytettiin kliinisissä tutkimuksissa enimmillään vuoden ajan jopa kaksi kertaa indakaterolisuositusannosten suuruisilla annoksilla.
Simetidiini tai muut orgaanisten kationien kuljetusta estävät aineet
Terveille vapaaehtoisille tehdyssä kliinisessä tutkimuksessa glykopyrroniumin kokonaisaltistus (AUC) suureni 22 % ja munuaispuhdistuma pieneni 23 %, kun potilaille annettiin simetidiiniä, joka estää orgaanisten kationien kuljetusta ja jonka arvellaan vaikuttavan glykopyrroniumin munuaiseritykseen. Näiden muutosten suuruusluokan perusteella ei kliinisesti merkitseviä yhteisvaikutuksia ole odotettavissa, kun glykopyrroniumia annetaan samanaikaisesti simetidiinin tai muiden orgaanisten kationien kuljetuksen estäjien kanssa.
Raskaus ja imetys
Raskaus
Ei ole olemassa tietoja Ultibro Breezhaler -valmisteen käytöstä raskaana oleville naisille. Eläinkokeissa ei ole havaittu suoria tai epäsuoria lisääntymistoksisia vaikutuksia kliinisesti relevanteilla altistuksilla (ks. kohta Prekliiniset tiedot turvallisuudesta).
Indakateroli saattaa vaikeuttaa synnytystä relaksoimalla kohdun sileää lihasta. Siksi Ultibro Breezhaler -lääkitystä tulee käyttää raskauden aikana vain, jos hoidosta potilaalle koituvat hyödyt ovat suuremmat kuin mahdolliset sikiölle aiheutuvat riskit.
Imetys
Ei tiedetä, erittyvätkö indakateroli, glykopyrronium tai em. aineiden metaboliitit ihmisen rintamaitoon. Olemassa olevat farmakokineettiset/toksikologiset tiedot ovat osoittaneet indakaterolin, glykopyrroniumin ja em. aineiden metaboliittien erittyvän imettävien rottien maitoon. Ultibro Breezhaler -valmisteen käyttöä imettäville äideille tulee harkita vain, jos hoidosta odotettava hyöty naiselle on suurempi kuin lapselle mahdollisesti koituva riski (ks. kohta Prekliiniset tiedot turvallisuudesta).
Hedelmällisyys
Eläimillä tehdyt lisääntymistutkimukset ja muut tiedot eivät viittaa miehen tai naisen hedelmällisyyteen kohdistuviin huolenaiheisiin.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Tällä valmisteella ei ole haitallista vaikutusta tai on vähäinen vaikutus ajokykyyn ja koneidenkäyttökykyyn. Lääkkeen käytön yhteydessä mahdollisesti esiintyvä heitehuimaus saattaa kuitenkin vaikuttaa ajokykyyn ja koneidenkäyttökykyyn (ks. kohta Haittavaikutukset).
Haittavaikutukset
Tässä kappaleessa esitetty turvallisuusprofiili perustuu Ultibro Breezhaler -valmisteella sekä tämän valmisteen sisältämillä vaikuttavilla aineilla yksinään kertyneeseen kokemukseen.
Yhteenveto turvallisuusprofiilista
Ultibro Breezhaler -valmisteella kertynyt kokemus perustuu enimmillään 15 kuukauden altistukseen suositellulla terapeuttisella annostasolla.
Ultibro Breezhaler -valmisteella havaittiin samankaltaisia haittavaikutuksia kuin sen sisältämillä yksittäisillä lääkeaineilla. Koska lääkevalmiste sisältää indakaterolia ja glykopyrroniumia, molempien näiden yksittäisten lääkeaineiden yhteydessä ilmeneviä haittavaikutuksia voidaan olettaa esiintyvän laadultaan ja vakavuusasteeltaan samankaltaisina myös yhdistelmävalmisteen käytön yhteydessä.
Turvallisuusprofiilille ominaisia reaktioita ovat tämän yhdistelmävalmisteen yksittäisten osakomponentin aiheuttamat antikolinergiset ja beeta-adrenergiset oireet. Tähän lääkevalmisteeseen liittyvistä muista haittavaikutuksista kaikista yleisimmät (esiintyi vähintään 3 %:lla Ultibro Breezhaler -valmistetta käyttäneistä potilaista ja useammin kuin lumelääkkeellä) olivat yskä, nasofaryngiitti ja päänsärky.
Haittavaikutusten yhteenvetotaulukko
Kliinisistä tutkimuksista ja myyntiluvan myöntämisen jälkeisistä lähteistä havaitut haittavaikutukset on lueteltu MedDRA-elinjärjestelmäluokituksen mukaisesti (taulukko 1). Kunkin elinjärjestelmäluokan haittavaikutukset on järjestetty yleisyysjärjestykseen yleisimmästä alkaen. Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä. Lisäksi kunkin elinjärjestelmäluokan haittavaikutukset on järjestetty yleisyysjärjestykseen yleisimmästä alkaen käyttäen seuraavia määritelmiä: hyvin yleinen (≥ 1/10); yleinen (≥ 1/100, < 1/10); melko harvinainen (≥ 1/1 000, < 1/100); harvinainen (≥ 1/10 000, < 1/1 000); hyvin harvinainen (< 1/10 000); tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Taulukko 1 Haittavaikutukset
Haittavaikutukset | Yleisyysluokka |
Infektiot | |
Ylähengitystieinfektiot | Hyvin yleinen |
Nasofaryngiitti | Yleinen |
Virtsatietulehdus | Yleinen |
Sinuiitti | Yleinen |
Nuha | Yleinen |
Immuunijärjestelmä | |
Yliherkkyysreaktiot | Yleinen |
Angioedeema2 | Melko harvinainen |
Aineenvaihdunta ja ravitsemus | |
Hyperglykemia ja diabetes | Yleinen |
Psyykkiset häiriöt | |
Unettomuus | Melko harvinainen |
Hermosto | |
Huimaus | Yleinen |
Päänsärky | Yleinen |
Parestesiat | Harvinainen |
Silmät | |
Glaukooma1 | Melko harvinainen |
Sydän | |
Iskeeminen sydänsairaus | Melko harvinainen |
Eteisvärinä | Melko harvinainen |
Takykardia | Melko harvinainen |
Sydämentykytys | Melko harvinainen |
Hengityselimet, rintakehä ja välikarsina | |
Yskä | Yleinen |
Suun ja nielun alueen kipu, mukaan lukien kurkun ärsytys | Yleinen |
Paradoksaalinen bronkospasmi | Melko harvinainen |
Dysfonia2 | Melko harvinainen |
Nenäverenvuoto | Melko harvinainen |
Ruoansulatuselimistö | |
Ylävatsavaivat (dyspepsia) | Yleinen |
Hammaskaries | Yleinen |
Gastroenteriitti | Melko harvinainen |
Suun kuivuminen | Melko harvinainen |
Iho ja ihonalainen kudos | |
Kutina/ihottuma | Melko harvinainen |
Luusto, lihakset ja sidekudos | |
Muskuloskeletaaliset kivut | Melko harvinainen |
Lihasspasmit | Melko harvinainen |
Lihaskivut | Melko harvinainen |
Raajakipu | Melko harvinainen |
Munuaiset ja virtsatiet | |
Virtsarakon tukkeuma ja virtsaumpi | Yleinen |
Yleisoireet ja antopaikassa todettavat haitat | |
Kuume1 | Yleinen |
Rintakipu | Yleinen |
Perifeerinen turvotus | Melko harvinainen |
Uupumus | Melko harvinainen |
1Haittavaikutus, joka on havaittu vain Ultibro Breezhaler -valmisteen käytön yhteydessä mutta ei yksittäisten lääkeaineiden kanssa.
2 Myyntiluvan myöntämisen jälkeisestä käyttökokemuksesta vastaanotetut raportit; yleisyydet laskettu kliinisistä tutkimuksista saatujen tietojen perusteella.
Tiettyjen haittavaikutusten tarkemmat kuvaukset
Yskää raportoitiin yleisesti, mutta se oli yleensä lievää.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista kansallisen ilmoitusjärjestelmän kautta
www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 Fimea
Yliannostus
Kliinisesti merkittävästä Ultibro Breezhaler –valmisteen yliannostuksesta ei ole saatavilla tietoa.
Yliannostus voi aiheuttaa todennäköisesti beeta2-agonistien tyyppivaikutusten korostumista, ts. takykardiaa, vapinaa, sydämentykytystä, päänsärkyä, pahoinvointia, oksentelua, uneliaisuutta, kammioarytmioita, metabolista asidoosia, hypokalemiaa ja hyperglykemiaa, tai antikolinergisia vaikutuksia kuten silmänpaineen kohoamista (aiheuttaen kipua, näköhäiriöitä tai silmän punertuvuutta), ummetusta tai virtsaamisvaikeuksia. Elintoimintoja tukeva ja oireenmukainen hoito on aiheellista. Vaikeissa tapauksissa potilaat pitää ottaa sairaalahoitoon. Kardioselektiivisten beetasalpaajien käyttöä voidaan harkita beeta2-adrenergisten vaikutusten hoitoon, mutta sen tulee aina tapahtua lääkärin valvonnassa ja äärimmäistä varovaisuutta noudattaen, sillä beetasalpaajien käyttö voi johtaa bronkospasmiin.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Obstruktiivisten hengitystiesairauksien lääkkeet, adrenergisten ja antikolinergisten lääkeaineiden yhdistelmät, ATC-koodi: R03AL04
Vaikutusmekanismi
Ultibro Breezhaler
Kun indakaterolia ja glykopyrroniumia annetaan samanaikaisesti Ultibro Breezhaler -valmisteen muodossa, nämä lääkeaineet toimivat additiivisesti, sillä niillä on erilaiset vaikutustavat, jotka kohdistuvat eri reseptoreihin ja aikaansaavat sileiden lihasten relaksaation eri reittien kautta. Koska beeta2-adrenoreseptoreiden ja M3-reseptoreiden esiintymistiheydet eroavat toisistaan hengitysteiden keskeisimmissä ja perifeerisissä osissa, beeta2-agonistien pitäisi toimia tehokkaammin perifeeristen hengitysteiden lihasten rentouttajina ja antikolinergisten aineiden puolestaan keskeisempien osien rentouttajina. Bronkodilataation saavuttamiseksi ihmiskeuhkojen keskus- ja ääreisosissa voi siksi olla eduksi käyttää beeta2-agonistin ja muskariiniantagonistin yhdistelmää.
Indakateroli
Indakateroli on kerran vuorokaudessa annosteltavaksi tarkoitettu pitkävaikutteinen beeta2‑agonisti. Beeta2-agonistien (indakateroli mukaan lukien) farmakologiset vaikutukset johtuvat ainakin osittain solunsisäisen adenylaattisyklaasientsyymin aktivoitumisesta. Kyseinen entsyymi katalysoi adenosiinitrifosfaatin (ATP) muuntumista sykliseksi 3’, 5’-adenosiinimonofosfaatiksi (cAMP). cAMP-pitoisuuksien suureneminen johtaa keuhkoputkien sileän lihaksen relaksoitumiseen. In vitro -tutkimukset ovat osoittaneet, että indakaterolin beeta2-reseptorien kautta välittyvä agonistinen vaikutus on monta kertaa voimakkaampi kuin sen beeta1- ja beeta3-reseptorien kautta välittyvä vaikutus.
Inhaloidulla indakaterolilla on keuhkoissa paikallinen bronkodilatoiva vaikutus. Indakateroli on ihmisen beeta2-adrenoreseptorin osittainen agonisti, jonka teho ilmenee jo nanomolaarisilla pitoisuuksilla.
Vaikka beeta2-adrenergiset reseptorit ovat vallitsevia adrenergisia reseptoreja keuhkoputkien sileässä lihaksessa ja beeta1-adrenergiset reseptorit sydämessä, on ihmisen sydämessä silti myös beeta2-adrenergisia reseptoreja, joiden osuus kaikista adrenergisista reseptoreista on 10 ‑ 50 %. Niiden olemassaolon vuoksi on kuitenkin mahdollista, että myös erittäin selektiivisillä beeta2-agonisteilla saattaa olla sydänvaikutuksia.
Glykopyrronium
Glykopyrronium on inhaloitava pitkävaikutteinen, kerran päivässä otettava muskariinireseptorin antagonisti (antikolinergi) keuhkoahtaumataudin bronkodilatoivaan ylläpitohoitoon. Parasympaattiset hermot ovat hengitysteiden tärkein keuhkoputkien supistusta säätelevä hermorata, ja kolinerginen tonus on keuhkoahtaumataudissa esiintyvän hengitysvirtauksen ahtautumisen merkittävin palautuva tekijä. Glykopyrronium vaikuttaa estämällä asetyylikoliinin keuhkoputkia supistavaa vaikutusta hengitysteiden sileissä lihassoluissa ja sitä kautta laajentamalla hengitysteitä.
Glykopyrroniumbromidi on muskariinireseptorin antagonisti, jolla on suuri affiniteetti. Radioaktiivisesti leimattujen ligandien sitoutumistutkimuksissa on osoitettu, että glykopyrroniumbromidin selektiivisyys ihmisen M3-reseptoreihin on yli 4‑kertainen ihmisen M2‑reseptoreihin verrattuna.
Farmakodynaamiset vaikutukset
Tutkimuksissa Ultibro Breezhaler -valmisteen sisältämä indakaterolin ja glykopyrroniumin yhdistelmä osoitti nopean vaikutuksen alkamisen jo 5 minuutin kuluessa annostelusta. Teho säilyy samanlaisena koko 24 tunnin annosvälin ajan.
Keskimääräinen, 24 tunnin kuluessa toistuvin FEV1-mittauksin osoitettu bronkodilatoiva vaikutus 26 hoitoviikon jälkeen oli 320 ml. Ultibro Breezhaler -valmisteella saavutettu teho oli merkittävästi suurempi kuin indakaterolilla, glykopyrroniumilla tai tiotropiumilla yksinään saavutetut tehot (ero jokaista komponenttia kohden: 110 ml).
Ultibro Breezhaler -valmisteella ei nähty viitteitä ajan myötä kehittyvästä takyfylaksiasta, kun tilannetta verrattiin lumelääkkeeseen ja yhdistelmävalmisteen sisältämiin vaikuttaviin aineisiin yksinään.
Vaikutukset sydämen sykkeeseen
Mahdollisia vaikutuksia sydämen sykkeeseen selvitettiin terveillä vapaaehtoisilla koehenkilöillä, joille annettiin yksi, suositeltua terapeuttista annosta neljä kertaa suurempi Ultibro Breezhaler -annos. Annos annettiin neljässä osassa siten, että osa-annosten välillä pidettiin tunnin tauko. Tuloksia verrattiin lumelääkkeen, indakaterolin, glykopyrroniumin ja salmeterolin aikaansaamiin vaikutuksiin.
Suurin sydämen sykkeen nousu ajan suhteen verrattuna lumelääkkeeseen oli +5,69 lyöntiä minuutissa (90 %:n luottamusväli [2,71 ‑ 8,66]) ja suurin sykkeen lasku ‑2,51 lyöntiä minuutissa (90 %:n luottamusväli [‑5,48 ‑ 0,47]). Kaiken kaikkiaan sykkeen muutokset ajan funktiona eivät olleet yhdenmukaiset Ultibro Breezhaler -valmisteen farmakodynaamisten vaikutusten kanssa.
Keuhkoahtaumatautipotilailla tutkittiin sydämen sykettä terapeuttisia annoksia korkeammalla tasolla. Ultibro Breezhaler -valmisteella ei todettu merkittäviä vaikutuksia sykkeeseen 24 tunnin ajanjakson aikana, kun potilaiden sykkeet mitattiin 30 minuutin, 4 tunnin ja 24 tunnin kuluttua annoksesta.
QT-aika
Perusteellisessa QT-aikaa (TQT) selvittäneessä tutkimuksessa terveillä vapaaehtoisilla koehenkilöillä ja suurilla inhaloiduilla indakateroliannoksilla (enimmillään kaksi kertaa suositelluin hoitoannoksin) ei nähty viitteitä kliinisesti merkittävästä vaikutuksesta QT-aikaan. Glykopyrroniumilla suoritetussa TQT-tutkimuksessa ei myöskään nähty QT-ajan pidentymistä kahdeksan kertaa suositeltua terapeuttista inhalaatioannosta suuremman annoksen jälkeen.
Ultibro Breezhaler -lääkkeen vaikutuksia QTc-aikaan tutkittiin terveillä vapaaehtoisilla koehenkilöillä, joille annettiin enimmillään neljä kertaa suositeltua terapeuttista annosta suuremmat inhalaatioannokset. Inhalaatioannokset annettiin neljässä osassa siten, että inhalaatioiden välissä oli tunnin tauko. Suurin ajan suhteen havaittu ero lumelääkkeeseen nähden oli 4,62 ms (90 %:n luottamusväli: 0,40 ‑ 8,85 ms). Aika lyheni enimmillään ‑2,71 ms (90 %:n luottamusväli: ‑6,97 ‑ 1,54 ms), mikä viittaisi siihen, ettei Ultibro Breezhalerilla olisi ollut merkittävää vaikutusta QT-aikaan. Tämä tulos oli odotettavissa lääkevalmisteen sisältämien vaikuttavien aineiden ominaisuuksien perusteella.
Terapeuttista annosta suuremmilla, 116 mikrogrammaa/86 mikrogramman - 464 mikrogrammaa /86 mikrogramman Ultibro Breezhaler -annoksilla keuhkoahtaumatautia sairastavien potilaiden QTcF-aika pidentyi 30 - 60 millisekunnilla suhteessa lähtötilanteeseen tavallista suuremmalla osuudella potilaista (16,0 - 21,6 %:lla, vastaavan luvun ollessa 1,9 % lumelääkettä saaneilla potilailla), mutta yhtäkään QTcF-ajan > 60 millisekunnin pidentymistä lähtötasosta ei todettu. Suurimmalla, 464 mikrogrammaa /86 mikrogramman Ultibro Breezhaler -annoksella myös yli 450 millisekunnin QTcF-ajat olivat suhteessa yleisempiä (12,2 %:lla näistä potilaista, vastaavan luvun ollessa 5,7 % lumelääkkeellä).
Seerumin kaliumpitoisuus ja verensokeri
Kun terveille vapaaehtoisille koehenkilöille oli annettu neljä kertaa suositeltua terapeuttista Ultibro Breezhaler -annosta suurempi annos, seerumin kaliumpitoisuudessa todettu vaikutus oli hyvin pieni (suurin ero verrattuna lumelääkkeeseen: ‑0,14 mmol/l). Enimmäisvaikutus verensokeriin oli 0,67 mmol/l.
Kliininen teho ja turvallisuus
Ultibro Breezhaler -valmisteen kliinisen vaiheen III -tutkimuksiin kuului kuusi tutkimusta, joihin osallistui yli 8 000 potilasta: 1) 26 viikkoa kestänyt lumelääke- ja aktiivikontrolloitu tutkimus (kerran päivässä annettu indakateroli, kerran päivässä annettu glykopyrronium, kerran päivässä annettu sokkouttamaton tiotropium); 2) 26 viikkoa kestänyt aktiivikontrolloitu tutkimus (flutikasoni/salmeteroli -yhdistelmä kahdesti vuorokaudessa); 3) 64 viikkoa kestänyt aktiivikontrolloitu tutkimus (kerran päivässä annettu glykopyrronium, kerran päivässä annettu sokkouttamaton tiotropium); 4) 52 viikkoa kestänyt lumelääkekontrolloitu tutkimus; 5) kolme viikkoa kestänyt lume- ja aktiivikontrolloitu (tiotropium kerran päivässä) rasituksensietotutkimus ja 6) 52 viikkoa kestänyt aktiivikontrolloitu tutkimus (flutikasoni/salmeteroli kahdesti vuorokaudessa).
Neljään näistä tutkimuksista otettiin potilaita, joilla oli kliinisesti todettu keskivaikea - tai vaikea keuhkoahtaumatauti. 64 viikkoa kestäneeseen tutkimukseen otettiin potilaita, joilla oli vaikea tai hyvin vaikea keuhkoahtaumatauti ja anamneesissa ≥ 1 keskivaikea tai vaikea keuhkoahtaumataudin pahenemisvaihe edeltävän vuoden aikana. 52 viikkoa kestäneeseen aktiivikontrolloituun tutkimukseen otetuilla potilailla oli keskivaikea, vaikea tai hyvin vaikea keuhkoahtaumatauti ja anamneesissa ≥ 1 keskivaikea tai vaikea keuhkoahtaumataudin pahenemisvaihe edeltävän vuoden aikana.
Vaikutukset keuhkojen toimintaan
Ultibro Breezhaler -hoidolla on osoitettu kliinisesti merkitsevää keuhkotoimintojen paranemista (mitattuna uloshengityksen sekuntikapasiteettina, FEV1) useissa eri kliinisissä tutkimuksissa. Vaiheen III tutkimuksissa bronkodilatoivaa vaikutusta havaittiin 5 minuutin kuluessa ensimmäisestä annoksesta, ja tämä vaikutus säilyi 24 tunnin antovälin ajan heti ensimmäisestä annoksesta alkaen. Lääkkeen aikaansaama keuhkoputkia laajentava vaikutus ei heikentynyt ajan kuluessa.
Saavutetun tehon voimakkuus oli riippuvainen, hengitysteiden obstruktion palautuvuudesta lähtötasossa (testattiin lyhytvaikutteisen muskariiniantagonisti- ja lyhytvaikutteisen beeta2-agonisti-bronkodilataattoreiden avulla): Potilailla, joiden hengitysteiden obstruktion palautuvuus oli alhainen lähtötasossa, (< 5 %), saavutettiin yleisesti ottaen heikompi bronkodilatoiva vaste kuin potilailla, joiden hengitysteiden obstruktion palautuvuus oli suurempaa (≥ 5 %). 26. viikon kohdalla (tutkimuksen ensisijainen päätepiste) Ultibro Breezhaler lisäsi lumelääkkeeseen nähden (p < 0,001) annoksen jälkeistä alhaisinta FEV1-arvoa 80 ml niillä potilailla (Ultibro Breezhaler n = 82, lumelääke n = 42), joiden hengitysteiden obstruktion palautuvuus lähtötasossa oli alhainen (< 5 %) (p = 0,053), vastaavan arvon ollessa 220 ml niillä potilailla (Ultibro Breezhaler n = 392, lumelääke n = 190), joiden lähtötason hengitysteiden obstruktion palautuvuus oli suurempaa (≥ 5 %) (p < 0,001).
Alhaisin ja korkein FEV1-arvo:
26 viikkoa kestäneen tutkimuksen ensisijaisena päätepisteenä Ultibro Breezhaler suurensi annoksen jälkeistä alhaisinta FEV1-arvoa 200 ml verrattuna lumelääkkeeseen (p < 0,001). Lisäksi lääke osoitti tilastollisesti merkitsevää FEV1-arvon suurenemista verrattuna molempiin monoterapiahaaroihin (indakateroli ja glykopyrronium) sekä tiotropiumia saaneisiin potilaisiin (ks. alla oleva taulukko).
Annoksen jälkeiset alhaisimmat FEV1-arvot (pienimmän neliösumman keskiarvo) päivänä 1 ja viikkona 26 (ensisijainen päätepiste)
Hoitojen erot | Päivä 1 | Viikko 26 |
Ultibro Breezhaler – lumelääke | 190 ml (p < 0,001) | 200 ml (p < 0,001) |
Ultibro Breezhaler – indakateroli | 80 ml (p < 0,001) | 70 ml (p < 0,001) |
Ultibro Breezhaler – glykopyrronium | 80 ml (p < 0,001) | 90 ml (p < 0,001) |
Ultibro Breezhaler – tiotropium | 80 ml (p < 0,001) | 80 ml (p < 0,001) |
Keskimääräinen FEV1-arvo ennen lääkeannoksen ottoa (keskiarvot mitattu ‑45 minuuttia sekä ‑15 minuuttia ennen tutkimuslääkkeen aamuannosta) oli Ultibro Breezhaler -valmisteella tilastollisesti merkitsevästi suurempi verrattuna flutikasoni/salmeteroli-yhdistelmään viikolla 26 (hoitojen eron pienimmän neliösumman keskiarvo 100 ml, p < 0,001), lumelääkkeeseen viikolla 52 (hoitojen eron pienimmän neliösumman keskiarvo 189 ml, p < 0,001), sekä glykopyrroniumiin (hoitojen eron pienimmän neliösumman keskiarvo 70 ‑ 80 ml, p < 0,001) ja tiotropiumiin (hoitojen eron pienimmän neliösumman keskiarvo 60 ‑ 80 ml, p < 0,001) kaikilla käynneillä viikkoon 64 saakka. 52 viikkoa kestäneessä aktiivikontrolloidussa tutkimuksessa keskimääräinen FEV1-arvo ennen lääkeannoksen ottoa oli Ultibro Breezhaler ‑hoitoa saaneilla tilastollisesti merkitsevästi parempi kuin flutikasoni/salmeteroli-yhdistelmää saaneilla kaikilla käynneillä viikkoon 52 asti (hoitojen eron pienimmän neliösumman keskiarvo 62 ‑ 86 ml, p < 0,001). Viikolla 26 Ultibro Breezhaler -valmisteella todettiin tilastollisesti merkitsevästi suurempi huippu-FEV1-arvo verrattuna lumelääkkeeseen annoksen jälkeisten 4 tunnin aikana (hoitojen eron pienimmän neliösumman keskiarvo 330 ml) (p < 0,001).
FEV1 -arvon AUC:
Viikolla 26 Ultibro Breezhaler suurensi annoksen jälkeisen FEV1:n AUC0‑12-arvoa (ensisijainen päätepiste) 140 ml:lla verrattuna flutikasoni/salmeteroli-yhdistelmään (p < 0,001).
Vaikutus oireisiin
Hengenahdistus:
Ultibro Breezhaler -valmiste lievitti hengenahdistusta tilastollisesti merkitsevällä tavalla, kun tilannetta arvioitiin dyspneaindeksin (TDI) avulla. Lääkkeellä osoitettiin tilastollisesti merkitsevää fokaalisten TDI-pisteiden paranemista viikolla 26 verrattuna lumelääkkeeseen (hoitojen eron pienimmän neliösumman keskiarvo 1,09; p < 0,001), tiotropiumiin (hoitojen eron pienimmän neliösumman keskiarvo 0,51; p = 0,007) sekä flutikasoni/salmeteroli-yhdistelmään (hoitojen eron pienimmän neliösumman keskiarvo 0,76; p = 0,003). Pisteiden paranemiset suhteessa indakateroliin ja glykopyrroniumiin olivat 0,26 ja 0,21.
Tilastollisesti merkitsevästi suurempi prosentuaalinen osuus Ultibro Breezhaler -valmistetta saaneista potilaista saavutti 1 pisteen tai sitä suuremman fokaalisten TDI-pisteiden paranemisen viikolla 26 verrattuna lumelääkettä saaneisiin potilaisiin (68,1 % vs 57,5 %; p = 0,004). Suurempi osuus Ultibro Breezhaler -valmistetta saaneista potilaista saavutti kliinisesti merkittävän vasteen viikolla 26 verrattuna tiotropiumia (68,1 % Ultibro Breezhaler -valmisteella ja 59,2 % tiotropiumilla; p = 0,016) ja flutikasoni/salmeteroli-yhdistelmää saaneisiin potilaisiin (65,1 % Ultibro Breezhaler -valmisteella ja 55,5 % flutikasoni/salmeteroli-yhdistelmällä; p = 0,088).
Terveystilanteeseen liittyvä elämänlaatu:
Ultibro Breezhaler -valmisteella nähtiin myös tilastollisesti merkitsevä vaikutus terveystilanteeseen liittyvään elämänlaatuun, kun tilannetta arvioitiin St. George´s Respiratory Questionnaire -kyselyn (SGRQ) avulla. Viikolla 26 tulos nähtiin SGRQ-pisteiden kokonaisluvun vähenemisenä suhteessa lumelääkkeeseen (hoitojen eron pienimmän neliösumman keskiarvo ‑3,01; p = 0,002), tiotropiumiin (hoitojen eron pienimmän neliösumman keskiarvo ‑2,13; p = 0,009), indakateroliin (-1,09) ja glykopyrroniumiin (-1,18). Viikolla 64 väheneminensuhteessa tiotropiumiin oli tilastollisesti merkitsevä (hoitojen eron pienimmän neliösumman keskiarvo: ‑2,69; p < 0,001). Viikolla 52 väheneminen verrattuna flutikasoni/salmeterolihoitoon oli tilastollisesti merkitsevä (hoitojen eron pienimmän neliösumman keskiarvo ‑1,3, p = 0,003).
Suurempi prosentuaalinen osuus Ultibro Breezhaler -valmistetta saaneista potilaista saavutti kliinisesti merkitsevän SGRQ-pisteiden paranemisen (määriteltiin vähintään 4 pisteen paranemisena lähtötasosta) viikolla 26 kuin lumelääkettä (63,7 % vs 56,6 %; p = 0,088) tai tiotropiumia (63,7 % Ultibro Breezhaler -valmisteella ja 56,4 % tiotropiumilla; p = 0,047) saaneet potilaat. Sama koski viikolla 64 tehtyä vertailua glykopyrroniumia ja tiotropiumia saaneisiin potilaisiin (57,3 % Ultibro Breezhaler -valmisteella ja 51,8 % glykopyrroniumilla; p = 0,055, sekä 50,8 % tiotropiumilla; p = 0,051) ja viikolla 52 tehtyä vertailua flutikasoni/salmeterolihoitoon (49,2 % Ultibro Breezhaler ‑valmisteella ja 43,7 % flutikasoni/salmeterolihoidolla, vetosuhde 1,30, p < 0,001).
Päivittäiset toimet
Ultibro Breezhaler -valmisteella todettiin selkeästi tilastollisesti suurempi paraneminen prosentuaalisessa osuudessa ”päiviä, jolloin potilaat pystyivät suoriutumaan tavanomaisista päivittäisistä askareistaan” 26 viikon aikana verrattuna tiotropiumiin (hoitojen eron pienimmän neliösumman keskiarvo 8,45 %; p < 0,001). Viikolla 64 Ultibro Breezhalerilla nähtiin numeerinen paraneminen suhteessa glykopyrroniumiin (hoitojen eron pienimmän neliösumman keskiarvo 1,95 %; p = 0,175) ja tilastollinen paraneminen suhteessa tiotropiumiin (hoitojen eron pienimmän neliösumman keskiarvo 4,96 %; p = 0,001).
Keuhkoahtaumataudin pahenemisvaiheet
64 viikkoa kestäneessä Ultibro Breezhaler -valmistetta, (n = 729), glykopyrroniumia (n = 739) ja tiotropiumia (n = 737) verranneessa tutkimuksessa Ultibro Breezhaler vähensi vuositasolla keskivaikeiden tai vaikeiden keuhkoahtaumataudin pahenemisvaiheiden esiintyvyyttä 12 %:lla verrattuna glykopyrroniumiin (p = 0,038) ja 10 %:lla verrattuna tiotropiumiin (p = 0,096). COPD:n keskivaikeiden ja vaikeiden pahenemisvaiheiden lukumäärät potilailla vuotta kohden olivat 0,94 (Ultibro Breezhaler, 812 pahenemisvaihetta), 1,07 (glykopyrronium, 900 pahenemisvaihetta) ja 1,06 (tiotropium, 898 pahenemisvaihetta). Lisäksi Ultibro Breezhaler -valmisteen osoitettiin vuositasolla vähentävän tilastollisesti merkitsevästi kaikkien COPD-pahenemisvaiheiden lukumäärää (lievät, keskivaikeat tai vaikeat) 15 %:llä verrattuna glykopyrroniumiin (p = 0,001) ja 14 %:lla verrattuna tiotropiumiin (p = 0,002). Kaikkien COPD-pahenemisvaiheiden lukumäärä potilailla vuotta kohden oli Ultibro Breezhaler -valmisteella 3,34 (2 893 pahenemisvaihetta), glykopyrroniumilla 3,92 (3 294 pahenemisvaihetta) ja tiotropiumilla 3,89 (3 301 pahenemisvaihetta).
52 viikkoa kestäneessä tutkimuksessa, jossa Ultibro Breezhaler ‑valmistetta (n = 1 675) verrattiin flutikasoni/salmeterolihoitoon (n = 1 679) ja vertailuperusteena käytettiin kaikkien keuhkoahtaumataudin pahenemisvaiheiden määrää (lievät, keskivaikeat ja vaikeat pahenemisvaiheet), Ultibro Breezhaler ‑ryhmä saavutti tuloksen ensisijaisen tavoitteen eli osoittautui vähintään samanarvoiseksi kuin flutikasoni/salmeteroli. Kaikkien keuhkoahtaumataudin pahenemisvaiheiden määrä potilasvuotta kohti oli Ultibro Breezhaler ‑ryhmässä 3,59 (4 531 pahenemisvaihetta) ja flutikasoni/salmeteroli-yhdistelmäryhmässä 4,03 (4 969 pahenemisvaihetta). Lisäksi todettiin, että Ultibro Breezhaler vähensi kaikkien pahenemisvaiheiden vuotuista määrää tehokkaammin kuin flutikasoni/salmeteroli (ero 11 % Ultibro Breezhaler ‑hoidon hyväksi, p = 0,003).
Flutikasoni/salmeterolihoitoon verrattuna Ultibro Breezhaler vähensi keskivaikeiden ja vaikeiden pahenemisvaiheiden vuotuista määrää 17 % (p < 0,001) ja vaikeiden (sairaalahoitoa vaatineiden) pahenemisvaiheiden määrää 13 % (ei tilastollisesti merkitsevä, p = 0,231). Keskivaikeiden tai vaikeiden keuhkoahtaumataudin pahenemisvaiheiden määrä potilasvuotta kohti oli Ultibro Breezhaler ‑ryhmässä 0,98 (1 265 pahenemisvaihetta) ja flutikasoni/salmeteroliryhmässä 1,19 (1 452 pahenemisvaihetta). Ultibro Breezhaler pidensi ensimmäiseen keskivaikeaan tai vaikeaan pahenemisvaiheeseen kulunutta aikaa pienentäen pahenemisvaiheen riskiä 22 % (p < 0,001) sekä pidensi ensimmäiseen vaikeaan pahenemisvaiheeseen kulunutta aikaa pienentäen pahenemisvaiheen riskiä 19 % (p = 0,046).
Keuhkokuumeen ilmaantuvuus oli Ultibro Breezhaler ‑hoitoryhmässä 3,2 % ja flutikasoni/salmeteroli-yhdistelmähoitoryhmässä 4,8 % (p = 0,017). Ensimmäisen keuhkokuumeen kehittymiseen kulunut aika oli Ultibro Breezhaler ‑ryhmässä pidempi kuin flutikasoni/salmeteroliryhmässä (p = 0,013).
Toisessa tutkimuksessa, jossa verrattiin Ultibro Breezhaler -valmistetta (n = 258) ja flutikasoni/salmeteroli -valmistetta (n = 264) 26 viikon ajan, keskivaikeiden ja vaikeiden COPD-pahenemisvaiheiden määrä potilailla vuotta kohden oli Ultibro Breezhaler -valmisteella 0,15 (18 pahenemisvaihetta) ja flutikasoni-salmeteroli -valmisteella 0,18(22 pahenemisvaihetta) (p=0,512), ja kaikkien COPD-pahenemisvaiheiden (lievien, keskivaikeiden tai vaikeiden) määrä potilailla vuotta kohden oli 0,72 Ultibro Breezhaler -valmisteella (86 pahenemisvaihetta) ja 0,94 flutikasoni-salmeteroli –valmisteella (113 pahenemisvaihetta) (p=0,098).
Kohtauslääkkeen käyttö
Ultibro Breezhaler -valmisteella kohtauslääkkeen (salbutamoli) käyttö 26 viikon aikana oli tilastollisesti merkittävästi vähäisempää, eli 0,96 sumuteannosta vähemmän vuorokaudessa (p < 0,001) verrattuna lumelääkkeeseen; 0,54 sumuteannosta vähemmän vuorokaudessa (p < 0,001) verrattuna tiotropiumiin ja 0,39 sumuteannosta vähemmän vuorokaudessa (p = 0,019) verrattuna flutikasoni/salmeteroli-yhdistelmään. 64 viikon aikana väheneminen oli 0,76 sumuteannosta vuorokaudessa (p < 0,001) verrattuna tiotropiumiin. 52 viikon aikana Ultibro Breezhaler vähensi kohtauslääkkeen käyttöä 0,25 sumuteannosta vuorokaudessa verrattuna flutikasoniin/salmeteroliin (p < 0,001).
Rasituksen sietokyky
Aamuisin otettu Ultibro Breezhaler -lääkitys vähensi dynaamista hyperinflaatiota ja pidensi rasituksen sietoaikaa heti ensimmäisestä annoksesta lähtien. Ensimmäisenä hoitopäivänä sisäänhengityskapasiteetti rasituksessa parani merkittävästi (hoitojen eron pienimmän neliösumman keskiarvo 250 ml, p < 0,001) verrattuna lumelääkkeeseen. Kolmen viikon hoidon jälkeen sisäänhengityskapasiteetin (hoitojen eron pienimmän neliösumman keskiarvo 320 ml; p < 0,001) ja rasituksen sietoajan (hoitojen eron pienimmän neliösumman keskiarvo 59,5 sekuntia; p = 0,006) todettiin parantuneen suhteessa lumelääkkeeseen.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset Ultibro Breezhaler -valmisteen käytöstä keuhkoahtaumataudin (COPD) hoidossa kaikissa pediatrisissa potilasryhmissä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Imeytyminen
Ultibro Breezhaler
Ultibro Breezhaler -inhalaation jälkeen mediaaniaika indakaterolihuippupitoisuuden saavuttamiseen plasmassa on noin 15 minuuttia ja glykopyrroniumhuippupitoisuuden saavuttamiseen noin 5 minuuttia.
In vitro -tutkimuksista kerättyjen tietojen perusteella keuhkoihin jakautuvan indakaterolimäärän oletetaan olevan samankaltainen Ultibro Breezhaler -valmisteella kuin pelkkää indakaterolia sisältävällä valmisteella. Vakaassa tilassa Ultibro Breezhaler -lääkkeellä saavutettu indakaterolialtistus oli joko samanlainen tai hieman alhaisempi kuin pelkkää indakaterolia sisältävällä lääkevalmisteella saavutettu altistus.
Ultibro Breezhaler -valmisteen inhaloinnin seurauksena indakaterolin absoluuttisen hyötyosuuden on arvioitu vaihtelevan välillä 61 ‑ 85 % inhalaattorista vapautuvasta annoksesta, kun vastaava luku glykopyrroniumille on noin 47 %.
Vakaassa tilassa Ultibro Breezhaler -inhalaatiolla saavutettu altistus glykopyrroniumille oli vastaava kuin systeeminen altistus pelkkää glykopyrroniumia sisältävän valmisteen inhaloinnin jälkeen.
Indakateroli
Indakaterolin vakaan tilan pitoisuus saavutettiin 12 ‑ 15 päivässä kerran päivässä annosteltuna. Kun 60 ‑ 480 mikrogramman (inhalaattorin suukappaleesta vapautuvia) annoksia inhaloitiin kerran vuorokaudessa, indakaterolin keskimääräinen kumuloitumissuhde (24 tunnin AUC-arvo päivänä 14 tai 15 verrattuna päivään 1) oli 2,9 ‑ 3,8.
Glykopyrronium
Keuhkoahtaumatautipotilaiden elimistössä glykopyrroniumin farmakokineettinen vakaa tila saavutettiin viikon kuluessa hoidon aloittamisesta. Glykopyrroniumin keskimääräinen vakaan tilan huippupitoisuus plasmassa oli 166 pikogrammaa/ml ja alin plasmapitoisuus 24 tuntia annoksen jälkeen 8 pikogrammaa/ml, kun sitä annettiin suositelluin vuorokausiannoksin kerran päivässä. Glykopyrronium-altistus vakaassa tilassa (AUC 24 tunnin antovälin aikana) oli noin 1,4 ‑ 1,7 kertaa suurempi kuin ensimmäisen annoksen jälkeen.
Jakautuminen
Indakateroli
Laskimoinfuusion jälkeen indakaterolin jakautumistilavuus oli terminaalisessa eliminaatiovaiheessa 2 557 litraa, mikä viittaa siihen, että lääke jakautuu voimakkaasti kudoksiin. In vitro ‑kokeissa noin 95 % lääkkeestä sitoutui ihmisen seerumin ja plasman proteiineihin.
Glykopyrronium
Kun glykopyrroniumia annettiin laskimoon, vakaan tilan jakautumistilavuus oli 83 litraa ja terminaalivaiheen jakautumistilavuus oli 376 litraa. Terminaalivaiheen näennäinen jakaantumistilavuus inhalaation jälkeen oli lähes 20-kertaa suurempi, mikä kuvastaa paljon hitaampaa eliminaatiota inhalaation jälkeen. Glykopyrroniumin sitoutuminen ihmisen plasmaproteiineihin in vitro oli 38 ‑ 41 %, kun pitoisuudet olivat 1 ‑ 10 nanogrammaa/ml.
Biotransformaatio
Indakateroli
Kun radioaktiivisesti leimattua indakaterolia otettiin suun kautta ihmisellä tehdyssä imeytymis-, jakautumis-, metabolia- ja eliminaatiotutkimuksessa, seerumissa tavattiin lähinnä muuttumatonta indakaterolia, joka selitti noin kolmanneksen lääkkeen vuorokausialtistuksesta (24 tunnin AUC). Runsaimmin seerumissa tavattu metaboliitti oli indakaterolin hydroksyloitunut johdannainen. Muita runsaina esiintyneitä metaboliitteja olivat indakaterolin ja hydroksyloituneen indakaterolin fenoli-O-glukuronidit. Lisäksi tavattiin hydroksyloituneen metaboliitin diastereomeeriä, indakaterolin N-glukuronidia ja C- ja N-dealkylaation kautta muodostuneita metaboliitteja.
UGT1A1-isoformi on tärkeä indakaterolin metaboliseen puhdistumaan vaikuttava isoentsyymi in vitro. Kliinisissä tutkimuksissa, joihin osallistui eri UGT1A1-genotyyppejä edustavia henkilöitä, UGT1A1-genotyypeillää ei kuitenkaan todettu olevan merkittävää vaikutusta indakaterolialtistukseen.
Kun indakaterolia inkuboitiin rekombinanttien CYP1A1-, CYP2D6- ja CYP3A4-entsyymien kanssa, havaittiin oksidaatiotuotteita. CYP3A4:n todettiin olevan tärkein indakaterolia hydroksyloiva isoentsyymi. In vitro ‑tutkimukset viittasivat myös siihen, että indakateroli on P-gp-kuljettajaproteiinin substraatti. Sen P-gp-affiniteetti on kuitenkin pieni.
Glykopyrronium
Metaboliatutkimukset in vitro osoittivat glykopyrroniumbromidin metaboliareittien olevan samat eläimissä ja ihmisissä. Havaittiin hydroksylaatiota, josta syntyi erilaisia mono- ja bishydroksyloituja metaboliitteja samoin kuin suoraa hydrolyysia, josta muodostui karboksyylihappojohdosta (M9). In vivo M9 muodostuu inhaloidun glykopyrroniumbromidiannoksen niellystä osuudesta. Glukuronidia ja/tai glykopyrroniumin sulfaattikonjugaatteja havaittiin ihmisen virtsassa toistuvien inhalaatioiden jälkeen, ja niiden osuus oli noin 3 % inhalaattorin suukappaleesta vapautuneesta annoksesta.
Useat CYP-isoentsyymit osallistuvat glykopyrroniumin oksidatiiviseen biotransformaatioon. Glykopyrroniumin metabolian inhibitio tai induktio eivät todennäköisesti aiheuta merkityksellistä muutosta vaikuttavan aineen systeemisessä altistuksessa.
Inhibitiotutkimukset in vitro osoittivat, että glykopyrroniumbromidi ei estä merkitsevästi CYP1A2-, CYP2A6-, CYP2C8-, CYP2C9-, CYP2C19-, CYP2D6-, CYP2E1- tai CYP3A4/5-isoentsyymeitä, solusta poistavia kuljettajaproteiineja MDR1, MRP2 tai MXR eikä soluunoton kuljettajaproteiineja OCT1 tai OCT2. Entsyymi-induktiotutkimukset in vitro eivät viitanneet glykopyrroniumbromidin indusoivan kliinisesti merkitsevästi tutkittuja P450-isoentsyymejä tai UGT1A1:tä ja kuljettajia MDR1 ja MRP2.
Eliminaatio
Indakateroli
Kliinisissä tutkimuksissa todettiin, että yleensä alle 2,5 % inhalaattorin suukappaleesta vapautuneesta annoksesta erittyi muuttumattomana indakaterolina virtsaan. Indakaterolin munuaispuhdistuma oli keskimäärin 0,46 ‑ 1,2 l/h. Kun tätä verrataan indakaterolin puhdistumaan seerumista, joka on 23,3 l/h, on selvää, että munuaispuhdistumalla on vain vähäinen merkitys systeemiseen verenkiertoon päässeen indakaterolin eliminaation kannalta (noin 2 ‑ 5 % systeemisestä puhdistumasta).
Ihmisen imeytymis-, jakautumis-, metabolia- ja eliminaatiotutkimuksessa, jossa indakaterolia annettiin suun kautta, lääkettä erittyi ulosteeseen pääasiassa kanta-aineen muodossa (54 % annoksesta) ja vähäisemmässä määrin myös indakaterolin hydroksyloituneina metaboliitteina (23 % annoksesta).
Seerumin indakaterolipitoisuudet pienenivät monivaiheisesti, ja terminaalinen puoliintumisaika oli keskimäärin 45,5 ‑ 126 tuntia. Toistuvan indakateroliannostelun yhteydessä tapahtuvasta kumuloitumisesta laskettu efektiivinen puoliintumisaika oli 40 ‑ 52 tuntia. Tämä on yhtäpitävää sen kanssa, että vakaan tilan saavuttamiseen kuluva aika on havaintojen mukaan noin 12 ‑ 15 vrk.
Glykopyrronium
Kun [3H]-merkittyä glykopyrroniumbromidia annettiin laskimoon, keskimääräinen virtsaan erittynyt radioaktiivisuus 48 tunnin aikana oli 85 % annoksesta. Lisäksi sappinesteessä oli 5 % annoksesta.
Kanta-aineen eliminaatio munuaisten kautta muodostaa 60 ‑ 70 % systeemisen glykopyrroniumin kokonaispuhdistumasta, kun taas ei-renaalisen puhdistuman osuus on noin 30 ‑ 40 %. Biliaarinen puhdistuma on osa ei-renaalista puhdistumaa, mutta arvellaan, että suurin osa ei-renaalisesta puhdistumasta tapahtuu metaboloitumalla.
Glykopyrroniumin keskimääräinen munuaispuhdistuma inhalaation jälkeen oli 17,4 ‑ 24,4 litraa/h. Aktiivinen tubulaarinen eritys myötävaikuttaa glykopyrroniumin eliminaatioon munuaisten kautta. Jopa 23 % inhalaattorista saatavasta annoksesta oli virtsassa kanta-aineena.
Glykopyrroniumin pitoisuudet plasmassa alenivat monivaiheisesti. Keskimääräinen terminaalinen eliminaation puoliintumisaika oli paljon pidempi inhalaation jälkeen (33 ‑ 57 tuntia) verrattuna laskimonsisäiseen (6,2 tuntia) ja suun kautta (2,8 tuntia) tapahtuneeseen annosteluun. Eliminaatiotapa viittaa viivästyneeseen imeytymiseen keuhkoista ja/tai glykopyrroniumin siirtymiseen systeemiseen verenkiertoon 24 tunnin kuluttua ja pidempään inhalaation jälkeen.
Lineaarisuus/ei-lineaarisuus
Indakateroli
Kun indakateroliannosta suurennetaan (120 mikrogrammaa ‑ 480 mikrogrammaa), systeeminen altistus kasvaa suhteessa (inhalaattorista vapautuvaan) annokseen.
Glykopyrronium
Keuhkoahtaumatautipotilaiden elimistössä sekä systeeminen altistus että glykopyrroniumin kokonaiseritys virtsaan farmakokineettisesti vakaassa tilassa suurenivat suunnilleen samassa suhteessa annokseen (inhalaattorin suukappaleesta vapautuvilla) annoksilla 44 ‑ 176 mikrogrammaa.
Erityisryhmät
Ultibro Breezhaler
Ultibro Breezhaler -inhalaation jälkeen keuhkoahtaumatautipotilailta kerättyjen populaatiofarmakokineettisten tietojen analyysissä ei havaittu viitteitä siitä, että ikä, sukupuoli tai (kehon rasvaton) paino vaikuttaisivat merkitsevästi systeemiseen indakateroli- ja glykopyrroniumaltistukseen. Kehon rasvattoman painon (lasketaan painon ja pituuden perusteella) todettiin olevan kovariaatti. Selvityksessä havaittiin negatiivinen korrelaatio systeemisen altistuksen ja kehon rasvattoman painon (tai kehon painon) välillä, mutta annoksen muuttamista ei kuitenkaan suositella, sillä painonvaihtelut voivat olla suuria ja kehon rasvaton paino perustuu vain arvioon.
Tupakoinnilla/tupakoimattomuudella ja lähtötason FEV1-arvolla ei ollut selkeästi huomattavaa vaikutusta Ultibro Breezhaler -inhalaatiolla saavutettavaan indakateroli- ja glykopyrroniumaltistukseen.
Indakateroli
Populaatiofarmakokinetiikan analyysi osoitti, että iällä (enintään 88-vuotiaat aikuiset), sukupuolella, painolla (32 ‑ 168 kg) tai rodulla ei ole kliinisesti merkittää vaikutusta indakaterolin farmakokinetiikkaan. Tutkimus ei viitannut siihen, että eri etnisten ryhmien välillä olisi ollut eroja.
Glykopyrronium
Populaatiofarmakokineettisessä keuhkoahtaumatautipotilaiden tietojen analyysissä kehon paino ja ikä todettiin tekijöiksi, jotka vaikuttivat potilaiden väliseen systeemisen altistuksen vaihteluun. Suositeltua glykopyrroniumannosta voidaan turvallisesti käyttää kaikissa ikä- ja painoryhmissä.
Sukupuolella, tupakoinnilla ja lähtötilanteen FEV1-arvolla ei ollut ilmeistä vaikutusta systeemiseen altistukseen.
Potilaat, joilla on maksan vajaatoiminta
Ultibro Breezhaler:
Ultibro Breezhaler -valmisteen sisältämien vaikuttavien aineiden kliinisten farmakokineettisten ominaisuuksien perusteella tätä lääkettä voi käyttää suositelluin annoksin lievää tai kohtalaista maksan vajaatoimintaa sairastavien potilaiden hoidossa. Tietoja vaikeaa maksan vajaatoimintaa sairastavien potilaiden hoidosta ei ole.
Indakateroli:
Indakaterolin Cmax- ja AUC-arvoissa ei havaittu oleellisia muutoksia lievää tai keskivaikeaa maksan vajaatoimintaa sairastavilla potilailla, eivätkä nämä potilaat eronneet terveistä verrokeista myöskään proteiineihin sitoutumisen suhteen. Vaikeaa maksan vajaatoimintaa sairastavilla ei ole tehty tutkimuksia.
Glykopyrronium:
Maksan vajaatoimintaa sairastaville potilaille ei ole tehty kliinisiä tutkimuksia. Glykopyrronium poistuu systeemisestä verenkierrosta pääosin erittymällä munuaisten kautta. Glykopyrroniumin maksametabolian heikkenemisen ei oleteta aiheuttavan kliinisesti merkitsevää systeemisen altistuksen suurentumista.
Potilaat, joilla on munuaisten vajaatoiminta
Ultibro Breezhaler:
Ultibro Breezhaler -valmisteen sisältämien vaikuttavien aineiden kliinisten farmakokineettisten ominaisuuksien perusteella tätä lääkettä voi käyttää suositelluin annoksin lievää tai kohtalaista munuaisten vajaatoimintaa sairastavien potilaiden hoidossa. Vaikeaa munuaisten vajaatoimintaa tai dialyysihoitoa vaativaa loppuvaiheen munuaissairautta sairastaville potilaille Ultibro Breezhaler -valmistetta tulee määrätä vain, jos odotettavissa olevat hyödyt ylittävät hoidosta mahdollisesti aiheutuvat riskit.
Indakateroli:
Munuaisten vajaatoimintapotilailla ei tehty tutkimuksia, koska vain hyvin pieni osa kokonaiseliminaatiosta tapahtuu munuaisteitse.
Glykopyrronium:
Munuaisten vajaatoiminta vaikuttaa glykopyrroniumbromidin systeemiseen altistukseen. Potilailla, joilla oli lievä tai kohtalainen munuaisten vajaatoiminta, todettiin kohtalainen systeemisen kokonaisaltistuksen (AUClast) suurentuminen enimmillään keskimäärin 1,4‑kertaiseksi, ja potilailla, joilla oli vaikea munuaisen vajaatoiminta ja loppuvaiheen munuaissairaus kokonaisaltistus suureni enimmillään keskimäärin 2,2‑kertaiseksi. Lääkittäessä keuhkoahtaumatautipotilaita, joilla on lievä tai kohtalainen munuaisten vajaatoiminta (glomerulusten laskennallinen suodatusnopeus, eGFR ≥ 30 ml/min/1,73 m2), glykopyrroniumbromidia voidaan käyttää suositusannoksella.
Etninen tausta
Ultibro Breezhaler:
Systeemisessä kokonaisaltistuksessa (AUC) ei havaittu huomattavia eroja japanilaisten ja kaukasialaisten välillä kummankaan vaikuttavan aineen osalta. Muiden etnisten ryhmien tai ihmisrotujen osalta ei ole riittävästi farmakokineettistä tietoa saatavilla.
Indakateroli:
Etnisten alaryhmien välisiä eroja ei ole havaittu. Mustien potilaiden osalta hoitokokemusta on vain rajallisesti.
Glykopyrronium:
Systeemisessä kokonaisaltistuksessa (AUC) ei ollut huomattavia eroja japanilaisten ja kaukasialaisten välillä. Muista etnisistä ja rodullisista vaikutuksista ei ole riittävästi farmakokineettistä tietoa.
Prekliiniset tiedot turvallisuudesta
Ultibro Breezhaler
Prekliiniset tutkimukset muodostuivat in vitro- ja in vivo -kokeista koskien farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta rotilla ja koirilla, sekä alkioiden ja sikiöiden kehitystoksisuutta rotilla (yksi inhalaatiotutkimus).
Koirilla todettiin nopeutunutta sykettä kaikilla tutkituilla Ultibro Breezhaler -annoksilla ja molemmilla valmisteen sisältämillä lääkeaineilla yksinään. Ultibro Breezhaler -valmisteen aiheuttamat sykkeenmuutokset olivat huomattavammat ja pitkäkestoisemmat kuin yhdistelmävalmisteen sisältämien vaikuttavien aineiden monoterapioiden aiheuttamat muutokset. Tulos oli linjassa yhdistelmävalmisteen aikaansaaman additiivisen vasteen kanssa. EKG-käyrässä näkyvien välien lyhentymistä ja systolisen sekä diastolisen verenpaineen laskua todettiin myös. Indakaterolin antoon yksinään sekä Ultibro Breezhaler -valmisteen osana liittyi samansuuruinen sydänlihasvaurioiden esiintyvyys ja vaikeusaste. Systeemiset altistukset (AUC), jotka eivät aiheuttaneet sydänvaurioita (NOAEL-altistus), olivat vähintään 64 ja 59 kertaa suuremmat kuin ihmisillä saavutettava altistustaso eri vaikuttavien aineiden osalta.
Alkioiden ja sikiöiden kehitystä koskevassa, rotilla suoritetussa tutkimuksessa ei havaittu minkäänlaisia alkioihin tai sikiöihin kohdistuvia vaikutuksia yhdelläkään tutkitulla Ultibro Breezhaler -valmisteen altistustasolla. Systeemiset altistustasot (AUC), jotka eivät aiheuttaneet mitään haittavaikutuksia alkioille tai sikiöille (NOAEL-altistus), olivat indakaterolin osalta 79 kertaa ja glykopyrroniumin osalta 126 kertaa suuremmat kuin ihmisillä saavutettava altistustaso.
Indakateroli
Indakaterolin beeta2-agonistisesta vaikutuksesta johtuvia kardiovaskulaarisia vaikutuksia olivat koirilla havaitut takykardia, rytmihäiriöt ja sydänlihasvauriot. Jyrsijöillä todettiin lievää nenäontelon ja kurkunpään ärsytystä. Kaikki nämä löydökset havaittiin altistuksilla, jotka olivat huomattavasti ihmisen odotettavissa olevaa altistusta suuremmat.
Vaikka indakateroli ei vaikuttanut rottien tavallisiin lisääntymistoimintoihin rotilla tehdyssä hedelmällisyystutkimuksessa, pieneni tiineeksi tulleiden F1 -jälkeläisten osuus tehdyssä peri- ja postnataalisessa rottatutkimuksessa, jossa altistus oli 14-kertainen verrattuna indakaterolilla hoidettuihin ihmisiin. Indakateroli ja sen metaboliitit siirtyivät nopeasti imettävien rottien maitoon. Indakateroli ei ollut alkiotoksinen eikä teratogeeninen rotalla eikä kaniinilla.
Genotoksisuustutkimuksissa ei havaittu mutageenisuutta eikä klastogeenisuutta. Karsinogeenisuutta arvioitiin kaksivuotisessa tutkimuksessa rotalla ja 6 kk pituisessa tutkimuksessa siirtogeenisellä hiirellä. Rotalla havaittiin munasarjojen hyvänlaatuisten leiomyoomien ja munasarjojen sileän lihaksen paikallisen hyperplasian yleistymistä. Tämä vastasi muilla beeta2-agonisteilla tehtyjä samankaltaisia havaintoja. Hiirellä ei todettu viitteitä karsinogeenisuudesta. Systeemiset altistukset (AUC), jotka eivät aiheuttaneet mitään haittavaikutuksia (NOAEL-altistus), olivat rotalla vähintään 7 kertaa ja hiirellä vähintään 49 kertaa suuremmat kuin kerran vuorokaudessa indakaterolia enimmäissuositusannoksin käyttävän ihmisen altistus.
Glykopyrronium
Farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta, genotoksisuutta, karsinogeenisuutta sekä lisääntymis- ja kehitystoksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Glykopyrroniumbromidin muskariinireseptoriantagonistisista ominaisuuksista johtuviin vaikutuksiin sisältyivät lievä tai kohtalainen syketaajuuden kiihtyminen koirilla, linssin samentumat rotilla ja korjautuvat rauhaserityksen vähenemiseen liittyvät muutokset rotilla ja koirilla. Rotilla todettiin lievää ärsytystä tai adaptiivisia muutoksia hengitysteissä. Kaikki nämä löydökset havaittiin altistuksilla, jotka olivat riittävästi ihmisen odotettavissa olevaa altistusta suuremmat.
Glykopyrronium ei ollut teratogeeninen rotille tai kaniineille inhalaation jälkeen. Rotilla ei todettu vaikutuksia hedelmällisyyteen eikä jälkeläisten pre- ja postnataaliseen kehitykseen. Glykopyrroniumbromidi ja sen metaboliitit eivät merkittävässä määrin läpäisseet istukkaa tiineissä hiirissä, kaniineissa ja koirissa. Glykopyrroniumbromidi (mukaan lukien sen metaboliitit) erittyi imettävien rottien maitoon ja pitoisuudet olivat jopa 10‑kertaiset emon verestä mitattuihin pitoisuuksiin nähden.
Genotoksisuustutkimuksissa ei havaittu merkkejä glykopyrroniumbromidin mahdollisista mutageenisistä tai klastogeenisista vaikutuksista. Karsinogeenisuustutkimuksissa transgeenisillä hiirillä käyttäen antoa suun kautta ja rotilla käyttäen inhalaatioantoa ei ilmennyt viitteitä karsinogeenisuudesta, kun systeeminen altistus (AUC) oli hiirillä noin 53‑kertainen ja rotilla 75‑kertainen ihmiselle suositeltuun kerran vuorokaudessa annettavaan suositeltuun enimmäisvuorokausiannokseen nähden.
Farmaseuttiset tiedot
Apuaineet
Kapselin sisältö
Laktoosimonohydraatti
Magnesiumstearaatti
Kapselin kuori
Hypromelloosi
Kalsiumkloridi
Tartratsiini (E102)
Painomuste, musta (kansiosa)
Sellakka (E904)
Propyleeniglykoli
Ammoniumhydroksidi
Kaliumhydroksidi
Musta rautaoksidi (E172)
Painomuste, sininen (runko-osa)
Sellakka (E904)
Indigokarmiini (E132)
Titaanidioksidi (E171)
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
2 vuotta.
Jokaisen pakkauksen inhalaattori on hävitettävä, kun kaikki pakkauksen kapselit on käytetty.
Säilytys
Säilytä alle 25 ºC.
Säilytä kapselit aina alkuperäisessä repäisypakkauksessa. Herkkä kosteudelle. Kapseli poistetaan pakkauksesta vasta juuri ennen käyttöä.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
ULTIBRO BREEZHALER inhalaatiojauhe, kapseli, kova
85/43 mikrog (L:kyllä) 30 x 1 fol (inhalaattori) (58,06 €), 90 x 1 fol (inhalaattori) (162,10 €)
PF-selosteen tieto
Inhalaattorin runko-osa ja suojus on valmistettu akryylinitriilibutadieenistyreenistä (ABS). Painikkeet on valmistettu metyylimetakrylaatti-ABS:stä. Neulat ja jouset ovat ruostumatonta terästä.
PA/Alu/PVC – Alu-kerta-annospakattu perforoitu repäisypakkaus. Yksi läpipainopakkaus sisältää joko 6 tai 10 kovaa kapselia.
Yksittäispakkaus, jossa on 6 x 1, 10 x 1, 12 x 1, 30 x 1 tai 90 x 1 kovaa kapselia ja 1 inhalaattori.
Monipakkaus, jossa 96 (neljä 24 x 1 kapselin pakkausta) kovaa kapselia ja neljä inhalaattoria.
Monipakkaus, jossa 150 (viisitoista 10 x 1 kapselin pakkausta) kovaa kapselia ja 15 inhalaattoria.
Monipakkaus, jossa 150 (kaksikymmentäviisi 6 x 1 kapselin pakkausta) kovaa kapselia ja 25 inhalaattoria.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Läpinäkyvät kapselit, joiden kansiosa on keltainen ja runko luonnostaan kirkas, ja jotka sisältävät valkoista tai lähes valkoista jauhetta. Runko-osaan on sinisellä painettu tuotekoodi ”IGP110.50” kahden sinisen viivan alle ja kansiosaan on mustalla painettu yrityksen logo (
).
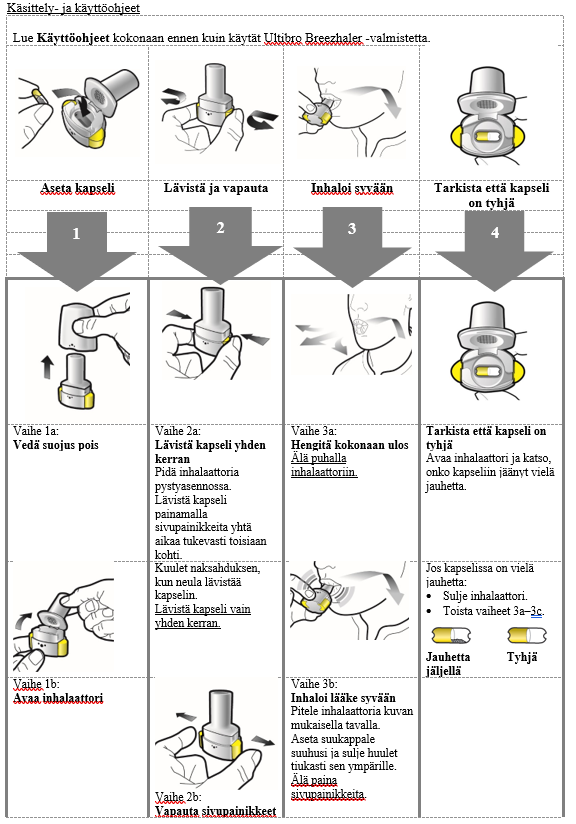
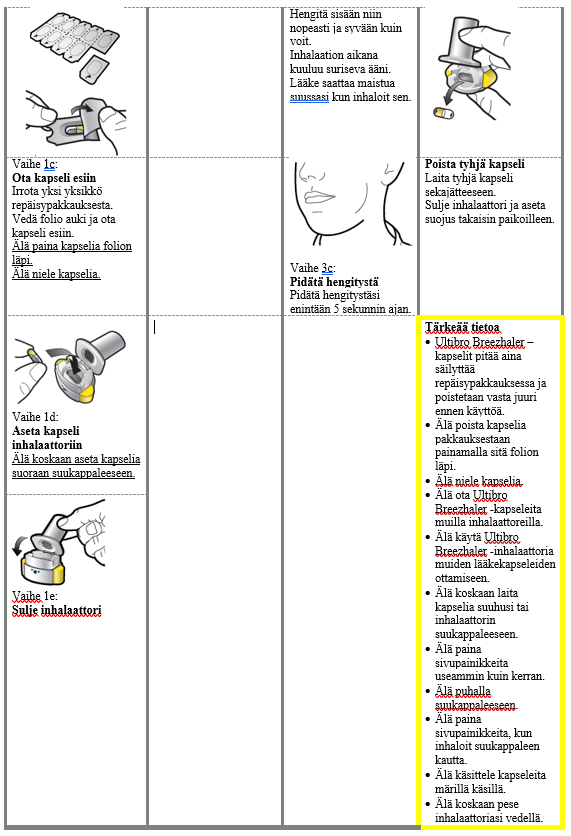
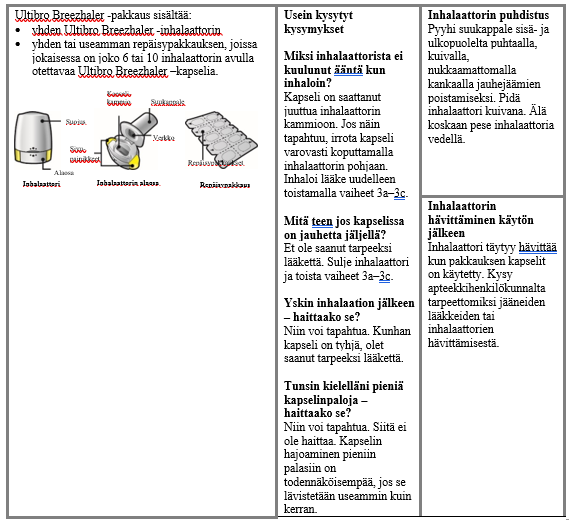
Käyttö- ja käsittelyohjeet
Potilaan tulee käyttää kunkin pakkauksen mukana toimitettavaa inhalaattoria. Jokaisen pakkauksen inhalaattori on hävitettävä, kun kaikki pakkauksen kapselit on käytetty.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
ULTIBRO BREEZHALER inhalaatiojauhe, kapseli, kova
85/43 mikrog 30 x 1 fol, 90 x 1 fol
- Alempi erityiskorvaus (65 %). Krooninen keuhkoastma ja sitä läheisesti muistuttavat krooniset obstruktiiviset keuhkosairaudet (203).
- Peruskorvaus (40 %).
ATC-koodi
R03AL04
Valmisteyhteenvedon muuttamispäivämäärä
24.07.2025
Yhteystiedot
 NOVARTIS FINLAND OY
NOVARTIS FINLAND OY Revontulenkuja 1
02100 Espoo
010 613 3200
www.novartis.fi
Lääkeinformaatiopalvelu 010 6133 210,
medinfo.nordics@novartis.com
