SEEBRI BREEZHALER inhalaatiojauhe, kapseli, kova 44 mikrog
Vaikuttavat aineet ja niiden määrät
Yksi kapseli sisältää 63 mikrogrammaa glykopyrroniumbromidia, mikä vastaa 50 mikrogrammaa glykopyrroniumia.
Jokainen Seebri Breezhaler -inhalaattorista saatava annos (annos, joka vapautuu inhalaattorin suukappaleesta) sisältää 55 mikrogrammaa glykopyrroniumbromidia, mikä vastaa 44 mikrogrammaa glykopyrroniumia.
Apuaineet, joiden vaikutus tunnetaan:
Yksi kapseli sisältää 23,6 mg laktoosia (monohydraattina).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Inhalaatiojauhe, kapseli, kova (inhalaatiojauhe).
Kliiniset tiedot
Käyttöaiheet
Seebri Breezhaler on tarkoitettu käytettäväksi oireita lievittävään bronkodilatoivaan ylläpitohoitoon aikuispotilaiden keuhkoahtaumataudissa (COPD).
Annostus ja antotapa
Annostus
Suositusannos on yhden kapselin sisältö inhaloituna kerran vuorokaudessa Seebri Breezhaler -inhalaattorilla.
Seebri Breezhaler suositellaan otettavaksi aina samaan aikaan päivästä joka päivä. Jos annos jää väliin, seuraava annos tulee ottaa mahdollisimman pian. Potilaita on neuvottava ottamaan enintään yksi annos vuorokaudessa.
Erityisryhmät
Iäkkäät potilaat
Seebri Breezhaler -kapseleita voidaan käyttää suositusannoksella iäkkäille potilaille (75‑vuotiaille ja vanhemmille) (ks. kohta Haittavaikutukset).
Munuaisten vajaatoiminta
Seebri Breezhaler -kapseleita voidaan käyttää suositusannoksella potilaille, joilla on lievä tai kohtalainen munuaisten vajaatoiminta. Jos potilaalla on vaikea munuaisten vajaatoiminta tai dialyysihoitoa vaativa loppuvaiheen munuaissairaus, Seebri Breezhaler -valmistetta tulee käyttää vain, jos odotettavissa oleva hyöty arvioidaan suuremmaksi kuin hoidosta mahdollisesti aiheutuva riski koska systeeminen altistus glykopyrroniumille voi suurentua tässä populaatiossa (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Maksan vajaatoiminta
Maksan vajaatoimintaa sairastaville potilaille ei ole tehty tutkimuksia. Glykopyrronium poistuu pääosin erittymällä munuaisten kautta, joten merkittävää altistuksen suurentumista ei ole odotettavissa lääkittäessä potilaita, joilla on maksan vajaatoiminta. Annosteluun ei tarvita muutoksia maksan vajaatoimintaa sairastaville potilaille.
Pediatriset potilaat
Ei ole asianmukaista käyttää Seebri Breezhaler -valmistetta pediatrisille potilaille (alle 18‑vuotiaille) keuhkoahtaumataudin hoitoon.
Antotapa
Vain inhalaatioon.
Kapselit tulee aina ottaa Seebri Breezhaler -inhalaattoria käyttäen (ks. kohta Käyttö- ja käsittelyohjeet).
Kapselit tulee poistaa repäisypakkauksesta vasta juuri ennen käyttöä.
Kapseleita ei saa niellä.
Potilaita tulee neuvoa lääkevalmisteen oikeasta käyttötavasta. Jos hengittäminen ei helpotu, potilaalta on varmistettava, ettei hän niele lääkevalmistetta inhaloinnin sijaan.
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet lääkevalmisteen käytöstä ennen lääkkeen antoa.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Ei akuuttihoitoon
Seebri Breezhaler on tarkoitettu kerran vuorokaudessa otettavaan ylläpitohoitoon eikä sitä ole tarkoitettu akuuttien bronkospasmijaksojen ensihoitoon, toisin sanoen kohtauslääkkeeksi.
Yliherkkyys
Välittömiä yliherkkyysreaktioita on raportoitu Seebri Breezhaler -lääkkeen oton jälkeen. Jos allergiseen reaktioon viittaavia merkkejä, ja etenkin angioedeemaa (hengitys- tai nielemisvaikeuksia; kielen, huulten tai kasvojen turpoamista), urtikariaa tai ihottumaa ilmenee, hoito on välittömästi lopetettava ja muu, vaihtoehtoinen lääkitys on aloitettava.
Paradoksaalinen bronkospasmi
Seebri Breezhaler -inhalaattorilla tehdyissä kliinisissä tutkimuksissa ei havaittu paradoksaalista bronkospasmia. Muiden inhalaatiovalmisteiden käytön yhteydessä on kuitenkin todettu paradoksaalista bronkospasmia, joka voi olla hengenvaarallinen. Jos potilaalle kehittyy paradoksaalinen bronkospasmi, hoito on välittömästi lopetettava ja muu, vaihtoehtoinen lääkitys on aloitettava.
Antikolinerginen vaikutus
Seebri Breezhaler -valmistetta on käytettävä varoen, jos potilaalla on ahdaskulmaglaukooma tai virtsaumpi.
Potilaalle on kerrottava akuutin ahdaskulmaglaukooman merkeistä ja oireista, ja häntä on kehotettava lopettamaan Seebri Breezhaler -valmisteen käyttö ja ottamaan välittömästi yhteyttä lääkäriin, jos hänelle kehittyy jotain näistä merkeistä tai oireista.
Potilaat, joilla on vaikea munuaisten vajaatoiminta
Potilailla, joilla oli lievä tai kohtalainen munuaisten vajaatoiminta, todettiin kohtalainen systeemisen kokonaisaltistuksen (AUClast) suurentuminen enimmillään keskimäärin 1,4‑kertaiseksi. Kun potilaalla oli vaikea munuaisen vajaatoiminta ja loppuvaiheen munuaissairaus, kokonaisaltistus suureni enimmillään keskimäärin 2,2‑kertaiseksi. Jos potilaalla on vaikea munuaisten vajaatoiminta (glomerulusten laskennallinen suodatusnopeus alle 30 ml/min/1,73 m2), mukaan lukien potilaat, joilla on dialyysihoitoa vaativa loppuvaiheen munuaissairaus, Seebri Breezhaler -valmistetta tulee käyttää vain, jos odotettavissa oleva hyöty arvioidaan suuremmaksi kuin hoidosta mahdollisesti aiheutuva riski (ks. kohta Farmakokinetiikka). Näitä potilaita on seurattava huolellisesti mahdollisten haittavaikutusten varalta.
Potilaat, joiden anamneesissa on kardiovaskulaarinen sairaus
Kliinisistä tutkimuksista suljettiin pois ne potilaat, joilla oli epästabiili iskeeminen sydänsairaus, vasemman kammion vajaatoiminta, aikaisemmin sairastettu sydäninfarkti tai jokin rytmihäiriö (muu kuin krooninen stabiili eteisvärinä), sekä ne, joiden anamneesissa oli pitkä QT-oireyhtymä tai joiden QTc-aika oli pidentynyt (Friderician menetelmällä mitattuna > 450 millisekuntia miehillä tai > 470 millisekuntia naisilla). Kokemusta näiden potilasryhmien hoidosta on siten vain vähän. Seebri Breezhaler -valmistetta on käytettävä varoen näissä potilasryhmissä.
Apuaineet
Potilaiden, joilla on harvinainen perinnöllinen galaktoosi-intoleranssi, täydellinen laktaasinpuutos tai glukoosi-galaktoosi-imeytymishäiriö, ei pidä käyttää tätä lääkevalmistetta.
Yhteisvaikutukset
Seebri Breezhaler -valmisteen samanaikaista antoa muiden antikolinergejä sisältävien lääkevalmisteiden kanssa ei ole tutkittu ja siksi sen samanaikaista käyttöä muiden antikolinergejä sisältävien valmisteiden kanssa ei suositella.
Vaikka virallisia yhteisvaikutustutkimuksia ei ole tehty, Seebri Breezhaler –valmistetta on käytetty yhdessä muiden keuhkoahtaumatautiin käytettävien lääkevalmisteiden kanssa ilman kliinistä näyttöä lääkeyhteisvaikutuksista. Käytettyihin lääkkeisiin sisältyvät sympatomimeettiset bronkodilataattorit, metyyliksantiinit, sekä suun kautta otettavat että hengitettävät steroidit.
Terveille vapaaehtoisille tehdyssä kliinisessä tutkimuksessa glykopyrroniumin kokonaisaltistus (AUC) suureni 22 % ja munuaispuhdistuma pieneni 23 %, kun potilaille annettiin simetidiiniä, joka estää orgaanisten kationien kuljetusta ja jonka arvellaan vaikuttavan glykopyrroniumin munuaiseritykseen. Näiden muutosten suuruusluokan perusteella ei kliinisesti merkitseviä yhteisvaikutuksia ole odotettavissa, kun glykopyrroniumia annetaan samanaikaisesti simetidiinin tai muiden orgaanisten kationien kuljetuksen estäjien kanssa.
Glykopyrroniumin ja suun kautta inhaloidun beeta2-adrenergisen agonistin, indakaterolin, samanaikainen anto molempien vaikuttavien aineiden vakaassa tilassa ei vaikuttanut kummankaan lääkevalmisteen farmakokinetiikkaan.
Raskaus ja imetys
Raskaus
Ei ole olemassa tietoja Seebri Breezhaler -valmisteen käytöstä raskaana oleville naisille. Eläinkokeissa ei ole havaittu suoria tai epäsuoria lisääntymistoksisia vaikutuksia (ks. kohta Prekliiniset tiedot turvallisuudesta). Glykopyrroniumia tulee käyttää raskauden aikana vain, jos hoidosta potilaalle koituvat hyödyt ovat suuremmat kuin mahdolliset sikiölle aiheutuvat riskit.
Imetys
Ei tiedetä erittyykö glykopyrroniumbromidi ihmisen rintamaitoon. Glykopyrroniumbromidi (mukaan lukien sen metaboliitit) erittyi kuitenkin imettävien rottien maitoon (ks. kohta Prekliiniset tiedot turvallisuudesta). Glykopyrroniumin käyttöä imettäville äideille tulee harkita vain, jos hoidosta odotettava hyöty naiselle on suurempi kuin lapselle mahdollisesti koituva riski (ks. kohta Prekliiniset tiedot turvallisuudesta).
Hedelmällisyys
Eläimillä tehdyt lisääntymistutkimukset ja muut tiedot eivät viittaa miehen tai naisen hedelmällisyyteen kohdistuviin huolenaiheisiin (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Glykopyrroniumilla ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Yhteenveto turvallisuusprofiilista
Yleisin antikolinerginen haittavaikutus oli suun kuivuminen (2,4 %). Suurimman osan raportoidusta suun kuivumisista epäiltiin liittyvän lääkevalmisteeseen ja ne olivat lieviä eikä yksikään tapaus ollut vakava.
Turvallisuusprofiilille tyypillisiä olivat lisäksi muut antikolinergisiin vaikutuksiin liittyvät oireet, kuten virtsaummen merkit, jotka olivat melko harvinaisia. Maha-suolikanavaan kohdistuvia vaikutuksia, kuten gastroenteriittiä ja dyspepsiaa, todettiin myös. Paikalliseen siedettävyyteen liittyviä haittavaikutuksia olivat muun muassa kurkun ärsytys, nenänielutulehdus, nuha ja sivuontelotulehdus.
Haittavaikutusten yhteenvetotaulukko
Kahden keskeisen vaihe III tutkimuksen, kestoltaan 6 ja 12 kuukautta, kuuden ensimmäisen kuukauden aikana raportoidut yhdistetyt haittavaikutukset on lueteltu MedDRA-elinjärjestelmäluokituksen mukaisesti (Taulukko 1). Kunkin elinjärjestelmäluokan haittavaikutukset on järjestetty yleisyysjärjestykseen yleisimmästä alkaen. Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä. Lisäksi kunkin elinjärjestelmäluokan haittavaikutukset on järjestetty yleisyysjärjestykseen yleisimmästä alkaen käyttäen seuraavia määritelmiä: hyvin yleinen (≥ 1/10); yleinen (≥ 1/100, < 1/10); melko harvinainen (≥ 1/1 000, < 1/100); harvinainen (≥ 1/10 000, < 1/1 000); hyvin harvinainen (< 1/10 000); tuntematon (koska saatavissa oleva tieto ei riitä arviointiin).
Taulukko 1. Haittavaikutukset
Haittavaikutukset | Yleisyysluokka |
Infektiot | |
Nasofaryngiitti1 ) | Yleinen |
Nuha | Melko harvinainen |
Kystiitti | Melko harvinainen |
Immuunijärjestelmä | |
Yliherkkyys | Melko harvinainen |
Angioedeema2) | Melko harvinainen |
Aineenvaihdunta ja ravitsemus | |
Hyperglykemia | Melko harvinainen |
Psyykkiset häiriöt | |
Unettomuus | Yleinen |
Hermosto | |
Päänsärky3 ) | Yleinen |
Heikentynyt tunto | Melko harvinainen |
Sydän | |
Eteisvärinä | Melko harvinainen |
Sydämentykytys | Melko harvinainen |
Hengityselimet, rintakehä ja välikarsina | |
Nenän sivuonteloiden limakalvoturvotus | Melko harvinainen |
Runsaasti limaa tuottava yskä | Melko harvinainen |
Kurkun ärsytys | Melko harvinainen |
Nenäverenvuoto | Melko harvinainen |
Dysfonia2) | Melko harvinainen |
Paradoksaalinen bronkospasmi2) | Tuntematon |
Ruoansulatuselimistö | |
Suun kuivuminen | Yleinen |
Gastroenteriitti | Yleinen |
| Pahoinvointi2) | Melko harvinainen |
Oksentelu1) 2) | Melko harvinainen |
Ylävatsavaivat (dyspepsia) | Melko harvinainen |
Hammaskaries | Melko harvinainen |
Iho ja ihonalainen kudos | |
Ihottuma | Melko harvinainen |
Kutina2) | Melko harvinainen |
Luusto, lihakset ja sidekudos | |
Lihaksiin ja luustoon liittyvä kipu1) 2) | Yleinen |
Raajakipu | Melko harvinainen |
Lihaksiin ja luustoon liittyvä rintakipu | Melko harvinainen |
Munuaiset ja virtsatiet | |
Virtsatietulehdus3 ) | Yleinen |
Virtsaamisvaivat | Melko harvinainen |
Virtsaumpi | Melko harvinainen |
Yleisoireet ja antopaikassa todettavat haitat | |
Uupumus | Melko harvinainen |
Voimattomuus | Melko harvinainen |
1) Yleisempi glykopyrroniumilla kuin lumelääkkeellä vain 12 kuukauden tietokannassa.
2) Raportteja on saatu myyntiluvan myöntämisen jälkeen tapahtuneen Seebri Breezhaler -valmisteen käytön yhteydessä. Nämä raportit perustuvat vapaaehtoiseen ilmoittamismenettelyyn ja ne ovat peräisin tuntemattoman suuruisesta populaatiosta, jolloin ei aina ole mahdollista esittää luotettavaa arviota kyseessä olevan haittavaikutuksen yleisyydestä tai sen mahdollisesta syy-yhteydestä lääkealtistukseen. Näin ollen esiintyvyys on laskettu kliinisissä tutkimuksissa kertyneen kokemuksen perusteella.
3) Todettu glykopyrroniumilla lumelääkettä useammin vain yli 75-vuotiailla, iäkkäillä henkilöillä.
Tiettyjen haittavaikutusten tarkemmat kuvaukset
Yhdistetyssä 6 kuukauden tietojen tietokannassa suun kuivumisen yleisyys oli Seebri Breezhaler ‑ryhmässä 2,2 % ja lumelääkeryhmässä 1,1 %, vastaavasti unettomuuden yleisyys oli 1,0 % ja 0,8 %, ja gastroenteriitin yleisyys 1,4 % ja 0,9 %.
Suun kuivumista raportoitiin pääasiassa hoidon 4 ensimmäisen viikon aikana, ja suurimmalla osalla potilaista se kesti keskimäärin neljä viikkoa. 40 %:lla oireet kuitenkin jatkuivat koko 6 kuukauden ajan. Uusia suun kuivumistapauksia ei raportoitu kuukausien 7 ‑ 12 aikana.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Suuret glykopyrroniumannokset voivat aiheuttaa antikolinergisiä löydöksiä ja oireita, joita voi olla aihetta hoitaa oireenmukaisesti.
Jos Seebri Breezhaler -kapseli niellään vahingossa, akuutti intoksikaatio on epätodennäköinen, koska suun kautta otetun lääkkeen biologinen hyötyosuus on pieni (noin 5 %).
Kun terveille vapaaehtoisille annettiin 150 mikrogrammaa glykopyrroniumbromidia (vastaa 120 mikrogrammaa glykopyrroniumia) laskimoon, huippupitoisuus plasmassa oli noin 50 kertaa ja systeeminen kokonaisaltistus noin 6 kertaa suurempi kuin vakaassa tilassa saavutettu huippupitoisuus ja kokonaisaltistus Seebri Breezhaler -valmisteen suositellulla annoksella (44 mikrogrammaa kerran vuorokaudessa), ja valmiste siedettiin hyvin.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Obstruktiivisten hengitystiesairauksien lääkkeet, antikolinergit, ATC-koodi: R03BB06
Vaikutusmekanismi
Glykopyrronium on inhaloitava pitkävaikutteinen, kerran päivässä otettava muskariinireseptorin antagonisti (antikolinergi) keuhkoahtaumataudin bronkodilatoivaan ylläpitohoitoon. Parasympaattiset hermot ovat hengitysteiden tärkein keuhkoputkien supistusta säätelevä hermorata, ja kolinerginen tonus on keuhkoahtaumataudissa esiintyvän hengitysvirtauksen ahtautumisen merkittävin palautuva tekijä. Glykopyrronium vaikuttaa estämällä asetyylikoliinin keuhkoputkia supistavaa vaikutusta hengitysteiden sileissä lihassoluissa ja sitä kautta laajentamalla hengitysteitä.
Glykopyrroniumbromidi on muskariinireseptorin antagonisti, jolla on suuri affiniteetti. Radioaktiivisesti leimattujen ligandien sitoutumistutkimuksissa on osoitettu, että glykopyrroniumbromidin selektiivisyys ihmisen M3-reseptoreihin on yli 4‑kertainen ihmisen M2‑reseptoreihin verrattuna. Vaikutus alkaa nopeasti, mikä näkyy reseptoriassosiaatio- ja dissosiaatiokineettisistä parametreista ja inhalaation jälkeisessä vaikutuksen alkamisessa kliinisissä tutkimuksissa.
Pitkä vaikutusaika saattaa osittain selittyä sillä, että vaikuttava aine pysyy pitkään keuhkoissa. Siihen viittaa glykopyrroniumin terminaalisen eliminaation puoliintumisajan pidentyminen, kun aine inhaloidaan Seebri Breezhaler ‑inhalaattorilla verrattuna laskimonsisäiseen antoon (ks. kohta Farmakokinetiikka).
Farmakodynaamiset vaikutukset
Vaiheen III kliininen tutkimusohjelma sisälsi kaksi vaiheen III tutkimusta, jotka tehtiin kliinisesti diagnosoitua kohtalaista tai vaikeaa keuhkoahtaumatautia sairastaville potilaille: 6 kuukauden pituinen lumelääkekontrolloitu tutkimus ja 12 kuukauden pituinen lumelääke- ja aktiivikontrolloitu tutkimus (tiotropium 18 mikrogrammaa kerran vuorokaudessa avoimena lääkityksenä).
Vaikutukset keuhkojen toimintaan
Kun Seebri Breezhaleria annettiin 44 mikrogrammaa kerran vuorokaudessa, todettiin useissa kliinisissä tutkimuksissa keuhkojen toimintakyvyn säännönmukaista tilastollisesti merkittävää paranemista (uloshengityksen sekuntikapasiteetti, FEV1, nopea vitaalikapasiteetti, FVC ja sisäänhengityskapasiteetti, IC). Vaiheen III tutkimuksissa keuhkoputkia laajentava vaikutus todettiin 5 minuutin kuluessa ensimmäisestä annoksesta, ja vaikutus säilyi 24 tunnin antovälin ensimmäisestä annoksesta. Keuhkoputkia laajentava vaikutus ei heikentynyt ajan kuluessa kuuden ja kahdentoista kuukauden kestoisissa tutkimuksissa. Vaikutuksen voimakkuus riippui ilmavirtauksen rajoittuneisuuden palautumisasteesta lähtötilanteessa (testattiin antamalla lyhytvaikutteista bronkodilatoivaa muskariiniantagonistia); potilailla, joilla oli lähtötilanteessa matalin palautumisaste (< 5 %), keuhkoputket laajenivat yleensä vähemmän kuin potilailla, joilla oli lähtötilanteessa korkeampi palautumisaste (≥ 5 %). 12 viikon kohdalla (ensisijainen päätepiste) Seebri Breezhaler oli suurentanut vuorokauden pienintä FEV1-arvoa 72 ml lumelääkettä enemmän niillä potilailla, joilla lähtötilanteessa oli matalin palautumisaste (< 5 %), ja 113 ml lumelääkettä enemmän niillä potilailla, joilla lähtötilanteessa oli korkeampi palautumisaste (≥ 5 %) (p-arvo molempien arvojen osalta < 0,05).
6 kuukauden tutkimuksessa Seebri Breezhaler suurensi FEV1-arvoa ensimmäisen annoksen jälkeen 93 ml 5 minuutin kuluessa ja 144 ml 15 minuutin kuluessa annosta lumelääkkeeseen verrattuna (molempien p < 0,001). 12 kuukauden tutkimuksessa parannukset olivat 87 ml 5 minuutin kohdalla ja 143 ml 15 minuutin kohdalla (molempien p < 0,001). 12 kuukauden tutkimuksessa Seebri Breezhaler paransi FEV1-arvoa tilastollisesti merkitsevästi tiotropiumiin verrattuna ensimmäisten 4 tunnin aikana lääkkeenannosta päivänä 1 ja viikolla 26, ja FEV1-arvot olivat numeerisesti suurempia kuin tiotropiumilla ensimmäisten 4 tunnin aikana annosta viikolla 12 ja viikolla 52.
FEV1-arvot antovälin lopussa (24 tuntia annoksen jälkeen) olivat samanlaiset ensimmäisen annoksen ja 1 vuoden käytön jälkeen. Viikon 12 kohdalla (ensisijainen päätemuuttuja) Seebri Breezhaler paransi minimipitoisuuksilla 24 tuntia annoksen jälkeen mitattua FEV1-arvoa 6 kuukauden tutkimuksessa 108 ml ja 12 kuukauden tutkimuksessa 97 ml lumelääkkeeseen verrattuna (molempien p < 0,001). 12 kuukauden tutkimuksessa paraneminen tiotropiumilla lumelääkkeeseen verrattuna oli 83 ml (p < 0,001).
Vaikutus oireisiin
Kun Seebri Breezhaleria annettiin 44 mikrogrammaa kerran vuorokaudessa, hengenahdistus lievittyi tilastollisesti merkitsevästi dyspneaindeksillä (Transitional Dyspnoea Index, TDI) arvioituna. Keskeisten, 6 ja 12 kuukauden tutkimusten yhdistettyjen tietojen analyysissä todettiin, että tilastollisesti merkitsevästi suuremmalla osalla Seebri Breezhaleria saaneista potilaista fokaaliset TDI-pisteet paranivat 1 pisteen tai enemmän viikolla 26 lumelääkkeeseen verrattuna (58,4 % ja 46,4 %, p < 0,001). Löydökset olivat samanlaiset kuin tiotropiumia saaneilla potilailla, joista 53,4 %:lla todettiin 1 pisteen tai suurempi paraneminen (p = 0,009 verrattuna lumelääkkeeseen).
Seebri Breezhaler kerran vuorokaudessa on myös vaikuttanut tilastollisesti merkitsevästi terveyteen liittyvään elämänlaatuun, jota on mitattu St. George’s Respiratory Questionnaire -kyselyllä (SGRQ). Keskeisten, 6 ja 12 kuukauden tutkimusten yhdistettyjen tietojen analyysissä todettiin, että tilastollisesti merkitsevästi suuremmalla osalla Seebri Breezhaleria saaneista potilaista saatiin 4 pisteen tai suurempi paraneminen SGRQ:ssa viikolla 26 lumelääkkeeseen verrattuna (57,8 % ja 47,6 %, p < 0,001). Tiotropiumia saaneista potilaista 61,0 %:lla todettiin 4 pisteen tai suurempi parannus SGRQ:ssa (p = 0,004 lumelääkkeeseen verrattuna).
Keuhkoahtaumataudin pahenemisvaiheiden väheneminen
Tiedot keuhkoahtaumataudin pahenemisvaiheista kerättiin keskeisistä 6 ja 12 kuukauden tutkimuksista. Molemmissa tutkimuksissa keskivaikean tai vaikean pahenemisvaiheen (määriteltynä tarpeeksi käyttää oraalista kortikosteroidihoitoa ja/tai antibioottihoitoa, tai sairaalaan joutumista) kokeneiden potilaiden määrä väheni. 6 kuukauden tutkimuksessa keskivaikean tai vaikean pahenemisvaiheen kokeneiden potilaiden osuus oli 17,5 % Seebri Breezhaleria käyttäneistä ja 24,2 % lumelääkettä käyttäneistä potilaista (riskitiheyksien suhde 0,69, p = 0,023), ja 12 kuukauden tutkimuksessa 32,8 % Seebri Breezhaleria käyttäneistä ja 40,2 % lumelääkettä käyttäneistä potilaista (riskitiheyksien suhde 0,66, p = 0,001). 6 ja 12 kuukauden tutkimusten 6 ensimmäisen hoitokuukauden yhdistettyjen tietojen analyysissä todettiin, että lumeeseen verrattuna Seebri Breezhaler pidensi tilastollisesti merkitsevästi aikaa ensimmäiseen keskivaikeaan tai vaikeaan pahenemisvaiheeseen ja vähensi keskivaikeiden tai vaikeiden keuhkoahtaumataudin pahenemisvaiheiden määrää (0,53 pahenemisvaihetta/vuosi vs. 0,77 pahenemisvaihetta/vuosi, p < 0,001). Yhdistettyjen hoitotulosten analyysissä todettiin, että Seebri Breezhaler -hoitoa saaneiden ryhmässä oli vähemmän sairaalahoitoa vaatineita pahenemisvaiheita lumelääkkeeseen verrattuna (1,7 % vs. 4,2 %, p = 0,003).
Muut vaikutukset
6 ja 12 kuukauden tutkimuksissa Seebri Breezhaler kerran vuorokaudessa otettuna vähensi tilastollisesti merkitsevästi kohtauslääkkeen (salbutamoli) käyttöä 0,46 annoksella vuorokaudessa (p = 0,005) 26 viikon aikana ja 0,37 annoksella vuorokaudessa (p = 0,039) 52 viikon aikana lumelääkkeeseen verrattuna.
Aamuisin annettu Seebri Breezhaler vähensi ensimmäisestä annoksesta lähtien dynaamista hyperinflaatiota ja pidensi rasituksen sietoaikaa 3 viikon tutkimuksessa, jossa rasituksensietoa tutkittiin polkupyöräergometrilla submaksimaalisella (80 %) rasitustasolla (submaksimaalinen kliininen rasituskoe). Ensimmäisenä hoitopäivänä sisäänhengityskapasiteetti rasituksessa parani 230 ml ja rasituksen sietoaika piteni 43 s (10 %:n parannus) lumelääkkeeseen verrattuna. Kun hoitoa oli jatkettu 3 viikon ajan, sisäänhengityskapasiteetin parannus Seebri Breezhaler -ryhmässä oli vastaava kuin ensimmäisenä päivänä (200 ml), rasituksen sietoaika puolestaan oli pidentynyt 89 s (21 %:n parannus) lumelääkkeeseen verrattuna. Seebri Breezhaler vähensi hengenahdistusta ja jalkavaivoja rasituksen aikana Borgin asteikolla arvioituna. Seebri Breezhaler vähensi Transitional Dyspnoea Indeksillä arvioitua hengenahdistusta myös levossa.
Toissijaiset farmakodynaamiset vaikutukset
Seebri Breezhalerin käytön yhteydessä ei todettu muutoksia keskimääräisessä syketaajuudessa tai QTc-ajassa, kun keuhkoahtaumatautipotilaille annettiin enintään 176 mikrogramman annoksia. Perusteellisessa QT-tutkimuksessa, johon osallistui 73 tervettä vapaaehtoista, inhaloitu 352 mikrogramman kerta-annos glykopyrroniumia (8 kertaa terapeuttinen annos) ei pidentänyt QTc-aikaa, ja pienensi syketaajuutta vähäisessä määrin (maksimaalinen vaikutus -5,9 lyöntiä minuutissa, keskimääräinen vaikutus 24 tunnin aikana -2,8 lyöntiä minuutissa) lumelääkkeeseen verrattuna. Laskimoon annetun glykopyrroniumbromidin 150 mikrogramman annoksen (vastaa 120 mikrogrammaa glykopyrroniumia) vaikutusta syketaajuuteen ja QTc-aikaan tutkittiin nuorilla terveillä vapaaehtoisilla. Saavutetut huippualtistukset (Cmax) olivat noin 50‑kertaisia vakaassa tilassa inhaloituun glykopyrroniumin 44 mikrogramman annokseen nähden eivätkä ne aiheuttaneet takykardiaa tai QTc-ajan pidentymistä. Havaittiin vähäistä syketaajuuden pienenemistä (keskimääräinen ero 24 tunnin aikana -2 lyöntiä minuutissa lumelääkkeeseen verrattuna), mikä on tunnettu antikolinergisille yhdisteille tapahtuvan vähäisen altistuksen vaikutus nuorissa terveissä henkilöissä.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset Seebri Breezhaler -valmisteen käytöstä keuhkoahtaumataudin hoidossa kaikissa pediatrisissa potilasryhmissä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Imeytyminen
Glykopyrronium imeytyi nopeasti ja huippupitoisuudet plasmassa saavutettiin 5 minuutin kuluttua suun kautta Seebri Breezhaler -inhalaattorilla inhaloidun annoksen jälkeen.
Seebri Breezhaler -inhalaattorilla inhaloidun glykopyrroniumin absoluuttisen hyötyosuuden arvioitiin olevan noin 45 % inhalaattorista saatavasta annoksesta. Noin 90 % inhalaation jälkeen todettavasta systeemisestä altistuksesta muodostuu keuhkoissa tapahtuvan imeytymisen ja 10 % maha-suolikanavassa tapahtuvan imeytymisen seurauksena.
Keuhkoahtaumatautipotilaiden elimistössä glykopyrroniumin farmakokineettinen vakaa tila saavutettiin viikon kuluessa hoidon aloittamisesta. Glykopyrroniumin keskimääräinen vakaan tilan huippupitoisuus plasmassa oli 166 pikogrammaa/ml ja alin plasmapitoisuus 24 tuntia annoksen jälkeen 8 pikogrammaa/ml, kun sitä annettiin 44 mikrogrammaa kerran vuorokaudessa. Glykopyrronium-altistus vakaassa tilassa (AUC 24 tunnin antovälin aikana) oli noin 1,4 ‑ 1,7 kertaa suurempi kuin ensimmäisen annoksen jälkeen.
Jakautuminen
Kun glykopyrroniumia annettiin laskimoon, vakaan tilan jakautumistilavuus oli 83 litraa ja terminaalivaiheen jakautumistilavuus oli 376 litraa. Terminaalivaiheen näennäinen jakaantumistilavuus inhalaation jälkeen oli lähes 20-kertaa suurempi, mikä kuvastaa paljon hitaampaa eliminaatiota inhalaation jälkeen. Glykopyrroniumin sitoutuminen ihmisen plasmaproteiineihin in vitro oli 38 ‑ 41 %, kun pitoisuudet olivat 1 ‑ 10 nanogrammaa/ml.
Biotransformaatio
Metaboliatutkimukset in vitro osoittivat glykopyrroniumbromidin metaboliareittien olevan samat eläimissä ja ihmisissä. Havaittiin hydroksylaatiota, josta syntyi erilaisia mono- ja bishydroksyloituja metaboliitteja samoin kuin suoraa hydrolyysia, josta muodostui karboksyylihappojohdosta (M9). In vivo M9 muodostuu inhaloidun glykopyrroniumbromidiannoksen niellystä osuudesta. Glukuronidia ja/tai glykopyrroniumin sulfaattikonjugaatteja havaittiin ihmisen virtsassa toistuvien inhalaatioiden jälkeen, ja niiden osuus oli noin 3 % annoksesta.
Useat CYP-isoentsyymit osallistuvat glykopyrroniumin oksidatiiviseen biotransformaatioon. Glykopyrroniumin metabolian inhibitio tai induktio eivät todennäköisesti aiheuta merkityksellistä muutosta vaikuttavan aineen systeemisessä altistuksessa.
Inhibitiotutkimukset in vitro osoittivat, että glykopyrroniumbromidi ei estä merkitsevästi CYP1A2-, CYP2A6-, CYP2C8-, CYP2C9-, CYP2C19-, CYP2D6-, CYP2E1- tai CYP3A4/5-isoentsyymeitä, solusta poistavia kuljettajaproteiineja MDR1, MRP2 tai MXR eikä soluunoton kuljettajaproteiineja OCT1 tai OCT2. Entsyymi-induktiotutkimukset in vitro eivät viitanneet glykopyrroniumbromidin indusoivan kliinisesti merkitsevästi P450-isoentsyymejä tai UGT1A1:tä ja kuljettajia MDR1 ja MRP2.
Eliminaatio
Kun [3H]-merkittyä glykopyrroniumbromidia annettiin ihmiselle laskimoon, keskimääräinen virtsaan erittynyt radioaktiivisuus 48 tunnin aikana oli 85 % annoksesta. Lisäksi sappinesteessä oli 5 % annoksesta.
Kanta-aineen eliminaatio munuaisten kautta muodostaa 60 ‑ 70 % systeemisen glykopyrroniumin kokonaispuhdistumasta, kun taas ei-renaalisen puhdistuman osuus on noin 30 ‑ 40 %. Biliaarinen puhdistuma on osa ei-renaalista puhdistumaa, mutta arvellaan, että suurin osa ei-renaalisesta puhdistumasta tapahtuu metaboloitumalla.
Glykopyrroniumin keskimääräinen munuaispuhdistuma inhalaation jälkeen oli 17,4 -‑ 24,4 litraa/h. Aktiivinen tubulaarinen eritys myötävaikuttaa glykopyrroniumin eliminaatioon munuaisten kautta. Jopa 23 % inhalaattorista saatavasta annoksesta oli virtsassa kanta-aineena.
Glykopyrroniumin pitoisuudet plasmassa alenivat monivaiheisesti. Keskimääräinen terminaalinen eliminaation puoliintumisaika oli paljon pidempi inhalaation jälkeen (33 ‑ 57 tuntia) verrattuna laskimonsisäiseen (6,2 tuntia) ja suun kautta (2,8 tuntia) tapahtuneeseen annosteluun. Eliminaatiotapa viittaa viivästyneeseen imeytymiseen keuhkoista ja/tai glykopyrroniumin siirtymiseen systeemiseen verenkiertoon 24 tunnin kuluttua ja pidempään inhalaation jälkeen.
Lineaarisuus/ei-lineaarisuus
Keuhkoahtaumatautipotilaiden elimistössä sekä systeeminen altistus että glykopyrroniumin kokonaiseritys virtsaan farmakokineettisesti vakaassa tilassa suurenivat suunnilleen samassa suhteessa annokseen annoksilla 44 - 176 mikrogrammaa.
Erityisryhmät
Populaatiofarmakokineettisessä keuhkoahtaumatautipotilaiden tietojen analyysissä kehon paino ja ikä todettiin tekijöiksi, jotka vaikuttivat potilaiden väliseen systeemisen altistuksen vaihteluun. Seebri Breezhaleria annoksella 44 mikrogrammaa kerran vuorokaudessa voidaan turvallisesti käyttää kaikissa ikä- ja painoryhmissä.
Sukupuolella, tupakoinnilla ja lähtötilanteen FEV1-arvolla ei ollut ilmeistä vaikutusta systeemiseen altistukseen.
Glykopyrroniumbromidin inhalaation jälkeisessä systeemisessä kokonaisaltistuksessa (AUC) ei ollut huomattavia eroja japanilaisten ja kaukasialaisten välillä. Muista etnisistä ja rodullisista vaikutuksista ei ole riittävästi farmakokineettistä tietoa.
Potilaat, joilla on maksan vajaatoiminta
Maksan vajaatoimintaa sairastaville potilaille ei ole tehty kliinisiä tutkimuksia. Glykopyrronium poistuu systeemisestä verenkierrosta pääosin erittymällä munuaisten kautta. Glykopyrroniumin maksametabolian heikkenemisen ei oleteta aiheuttavan kliinisesti merkitsevää systeemisen altistuksen suurentumista.
Potilaat, joilla on munuaisten vajaatoiminta
Munuaisten vajaatoiminta vaikuttaa glykopyrroniumbromidin systeemiseen altistukseen. Potilailla, joilla oli lievä tai kohtalainen munuaisten vajaatoiminta, todettiin kohtalainen systeemisen kokonaisaltistuksen (AUClast) suurentuminen enimmillään keskimäärin 1,4‑kertaiseksi, ja potilailla, joilla oli vaikea munuaisen vajaatoiminta ja loppuvaiheen munuaissairaus kokonaisaltistus suureni enimmillään keskimäärin 2,2‑kertaiseksi. Lääkittäessä keuhkoahtaumatautipotilaita, joilla on lievä tai kohtalainen munuaisten vajaatoiminta (glomerulusten laskennallinen suodatusnopeus, eGFR ≥ 30 ml/min/1,73 m2), Seebri Breezhaler -valmistetta voidaan käyttää suositusannoksella. Jos potilaalla on vaikea munuaisten vajaatoiminta (eGFR < 30 ml/min/1,73 m2), mukaan lukien potilaat, joilla on dialyysihoitoa vaativa loppuvaiheen munuaissairaus, Seebri Breezhaler -valmistetta tulee käyttää vain, jos odotettavissa oleva hyöty arvioidaan suuremmaksi kuin hoidosta mahdollisesti aiheutuva riski (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta, genotoksisuutta, karsinogeenisuutta sekä lisääntymis- ja kehitystoksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Glykopyrroniumbromidin muskariinireseptoriantagonistisista ominaisuuksista johtuviin vaikutuksiin sisältyivät lievä tai kohtalainen syketaajuuden kiihtyminen koirilla, linssin samentumat rotilla ja korjautuvat rauhaserityksen vähenemiseen liittyvät muutokset rotilla ja koirilla. Rotilla todettiin lievää ärsytystä tai adaptiivisia muutoksia hengitysteissä. Kaikki nämä löydökset havaittiin altistuksilla, jotka olivat riittävästi ihmisen odotettavissa olevaa altistusta suuremmat.
Glykopyrronium ei ollut teratogeeninen rotille tai kaneille inhalaation jälkeen. Rotilla ei todettu vaikutuksia hedelmällisyyteen eikä jälkeläisten pre- ja postnataaliseen kehitykseen. Glykopyrroniumbromidi ja sen metaboliitit eivät merkittävässä määrin läpäisseet istukkaa tiineissä hiirissä, kaneissa ja koirissa. Glykopyrroniumbromidi (mukaan lukien sen metaboliitit) erittyi imettävien rottien maitoon ja pitoisuudet olivat jopa 10‑kertaiset emon verestä mitattuihin pitoisuuksiin nähden.
Genotoksisuustutkimuksissa ei havaittu merkkejä glykopyrroniumbromidin mahdollisista mutageenisistä tai klastogeenisista vaikutuksista. Karsinogeenisuustutkimuksissa transgeenisillä hiirillä käyttäen antoa suun kautta ja rotilla käyttäen inhalaatioantoa ei ilmennyt viitteitä karsinogeenisuudesta, kun systeeminen altistus (AUC) oli hiirillä noin 53‑kertainen ja rotilla 75‑kertainen ihmiselle suositeltuun kerran vuorokaudessa annettavaan 44 mikrogramman enimmäisvuorokausiannokseen nähden.
Farmaseuttiset tiedot
Apuaineet
Kapselin sisältö
Laktoosimonohydraatti
Magnesiumstearaatti
Kapselin kuori
Hypromelloosi
Karrageeni
Kaliumkloridi
Paraoranssi (E110)
Painomuste
Sellakka (E904)
Propyleeniglykoli
Ammoniumhydroksidi
Kaliumhydroksidi
Musta rautaoksidi (E172)
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
2 vuotta
Jokaisen pakkauksen inhalaattori on hävitettävä, kun kaikki pakkauksen kapselit on käytetty.
Säilytys
Säilytä alle 25 ºC.
Kapselit tulee aina säilyttää repäisypakkauksessa. Herkkä kosteudelle. Kapselit tulee poistaa pakkauksesta vasta juuri ennen käyttöä.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
SEEBRI BREEZHALER inhalaatiojauhe, kapseli, kova
44 mikrog (L:kyllä) 30 x 1 fol (inhalaattori) (39,87 €), 90 x 1 fol (90 (3 x 30 x 1), 3 inhalaattoria) (112,80 €)
PF-selosteen tieto
Seebri Breezhaler on kerta-annosinhalaattori. Inhalaattorin runko-osa ja suojus on valmistettu akryylinitriilibutadieenistyreenistä (ABS). Painikkeet on valmistettu metyylimetakrylaatti-ABS:stä. Neulat ja jouset ovat ruostumatonta terästä. Yksi repäisypakkaus sisältää joko 6 tai 10 kovaa kapselia.
PA/Alu/PVC – Alu-kerta-annospakattu perforoitu repäisypakkaus
Pakkaus, jossa on 6 x 1, 10 x 1, 12 x 1 tai 30 x 1 kovaa kapselia ja yksi inhalaattori.
Monipakkaus, jossa 90 (kolme 30 x 1 kapselin pakkausta) kovaa kapselia ja kolme inhalaattoria.
Monipakkaus, jossa 96 (neljä 24 x 1 kapselin pakkausta) kovaa kapselia ja neljä inhalaattoria.
Monipakkaus, jossa 150 (viisitoista 10 x 1 kapselin pakkausta) kovaa kapselia ja 15 inhalaattoria.
Monipakkaus, jossa 150 (kaksikymmentäviisi 6 x 1 kapselin pakkausta) kovaa kapselia ja 25 inhalaattoria.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Läpinäkyvä, oranssi, valkoista jauhetta sisältävä kapseli, jossa on musta vaakaviiva. Viivan yläpuolelle on painettu mustalla tuotteen koodi “GPL50” ja viivan alapuolelle mustalla yrityksen logo (
).
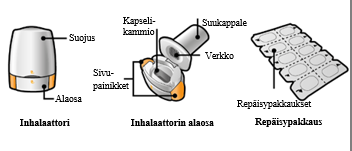
Käyttö- ja käsittelyohjeet
Potilaan tulee käyttää kunkin pakkauksen mukana toimitettavaa inhalaattoria. Jokaisen pakkauksen inhalaattori on hävitettävä, kun kaikki pakkauksen kapselit on käytetty.
Käsittely- ja käyttöohjeet
Lue Käyttöohjeet kokonaan ennen kuin käytät Seebri Breezhaler -valmistetta. | |||
|
|
|
|
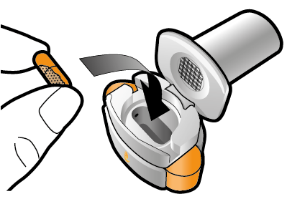
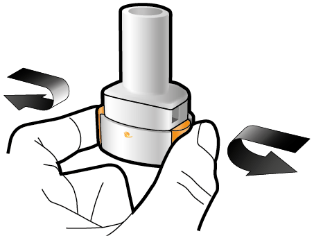
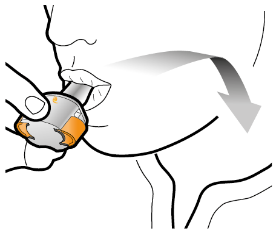
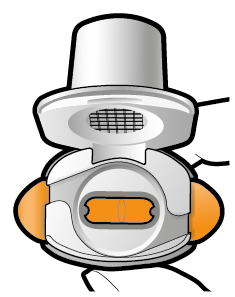
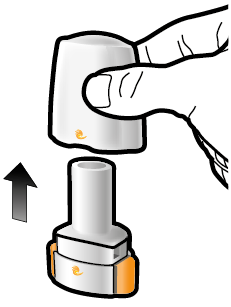
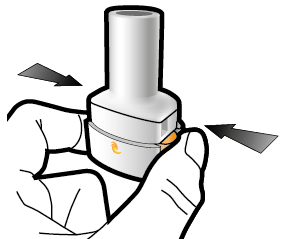
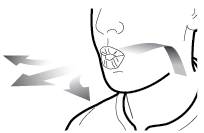
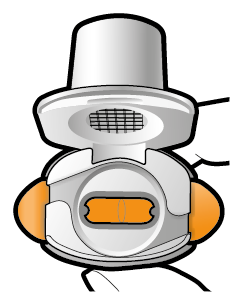
Aseta kapseli | Lävistä ja vapauta | Inhaloi syvään | Tarkista että kapseli on tyhjä |
1 ↓ | 2 ↓ | 3 ↓ | 4 ↓ |
|
|
|
|
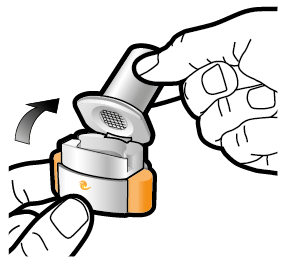
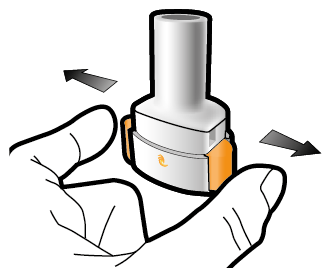
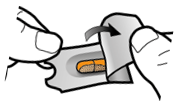
Vaihe 1a: Vedä suojus pois | Vaihe 2a: Lävistä kapseli yhden kerran Pidä inhalaattoria pystyasennossa. Lävistä kapseli painamalla sivupainikkeita yhtä aikaa tukevasti toisiaan kohti. | Vaihe 3a: Hengitä kokonaan ulos Älä puhalla inhalaattoriin. | Tarkista että kapseli on tyhjä Avaa inhalaattori ja katso, onko kapseliin jäänyt vielä jauhetta. |
| Kuulet naksahduksen, kun neula lävistää kapselin. Lävistä kapseli vain yhden kerran. |
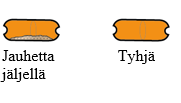
| Jos kapselissa on vielä jauhetta:
|
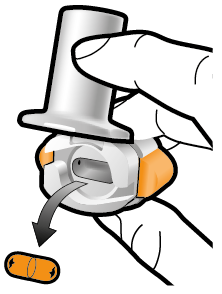
Vaihe 1b: Avaa inhalaattori |
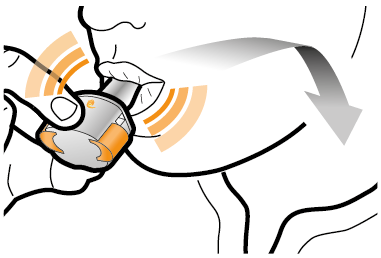
Vaihe 2b: Vapauta sivupainikkeet | Vaihe 3b: Inhaloi lääke syvään Pitele inhalaattoria kuvan mukaisella tavalla. Aseta suukappale suuhusi ja sulje huulet tiukasti sen ympärille. Älä paina sivupainikkeita. |
|
| Hengitä sisään niin nopeasti ja syvään kuin voit. Inhalaation aikana kuuluu suriseva ääni. Lääke saattaa maistua suussasi kun inhaloit sen. |
| |
Vaihe 1c: Ota kapseli esiin Irrota yksi yksikkö repäisypakkauksesta. Vedä folio auki ja ota kapseli esiin. Älä paina kapselia folion läpi. Älä niele kapselia. |
Vaihe 3c: Pidätä hengitystä Pidätä hengitystäsi enintään 5 sekunnin ajan. | Poista tyhjä kapseli Laita tyhjä kapseli sekajätteeseen. Sulje inhalaattori ja aseta suojus takaisin paikoilleen. | |
Vaihe 1d: Aseta kapseli inhalaattoriin Älä koskaan aseta kapselia suoraan suukappaleeseen. | Tärkeää tietoa
| ||
Vaihe 1e: Sulje inhalaattori | |||
Seebri Breezhaler -pakkaus sisältää:
| Usein kysytyt kysymykset Miksi inhalaattorista ei kuulunut ääntä kun inhaloin? Kapseli on saattanut juuttua inhalaattorin kammioon. Jos näin tapahtuu, irrota kapseli varovasti koputtamalla inhalaattorin pohjaan. Inhaloi lääke uudelleen toistamalla vaiheet 3a–3c. Mitä teen jos kapselissa on jauhetta jäljellä? Et ole saanut tarpeeksi lääkettä. Sulje inhalaattori ja toista vaiheet 3a–3c. Yskin inhalaation jälkeen – haittaako se? Niin voi tapahtua. Kunhan kapseli on tyhjä, olet saanut tarpeeksi lääkettä. Tunsin kielelläni pieniä kapselinpaloja – haittaako se? Niin voi tapahtua. Siitä ei ole haittaa. Kapselin hajoaminen pieniin palasiin on todennäköisempää, jos se lävistetään useammin kuin kerran. | Inhalaattorin puhdistus Pyyhi suukappale sisä- ja ulkopuolelta puhtaalla, kuivalla, nukkaamattomalla kankaalla jauhejäämien poistamiseksi. Pidä inhalaattori kuivana. Älä koskaan pese inhalaattoria vedellä. |
Inhalaattorin hävittäminen käytön jälkeen Inhalaattori täytyy hävittää kun pakkauksen kapselit on käytetty. Kysy apteekkihenkilökunnalta tarpeettomiksi jääneiden lääkkeiden tai inhalaattorien hävittämisestä. |
Korvattavuus
SEEBRI BREEZHALER inhalaatiojauhe, kapseli, kova
44 mikrog 30 x 1 fol, 90 x 1 fol
- Alempi erityiskorvaus (65 %). Krooninen keuhkoastma ja sitä läheisesti muistuttavat krooniset obstruktiiviset keuhkosairaudet (203).
- Peruskorvaus (40 %).
ATC-koodi
R03BB06
Valmisteyhteenvedon muuttamispäivämäärä
06.08.2025
Yhteystiedot
 NOVARTIS FINLAND OY
NOVARTIS FINLAND OY Revontulenkuja 1
02100 Espoo
010 613 3200
www.novartis.fi
Lääkeinformaatiopalvelu 010 6133 210,
medinfo.nordics@novartis.com