DACOGEN kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos 50 mg
Vaikuttavat aineet ja niiden määrät
Yksi kuiva-ainetta sisältävä injektiopullo sisältää 50 mg desitabiinia.
Kun kuiva-aine on liuotettu 10 ml:aan injektionesteisiin käytettävää vettä, yksi ml välikonsentraattia sisältää 5 mg desitabiinia.
Apuaineet, joiden vaikutus tunnetaan
Yksi injektiopullo sisältää 0,29 mmol natriumia (E524).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos (infuusiokuiva-aine).
Kliiniset tiedot
Käyttöaiheet
Dacogen on tarkoitettu sellaisten aikuispotilaiden hoitoon, joilla on äskettäin todettu de novo tai sekundaarinen akuutti myelooinen leukemia (AML) Maailman terveysjärjestön (WHO) luokituksen mukaan, ja joille tavanomainen induktiokemoterapia ei sovellu.
Ehto
Hoito tulee aloittaa kemoterapeuttisten aineiden käyttöön perehtyneen lääkärin valvonnassa.
Annostus ja antotapa
Dacogen-hoito tulee aloittaa kemoterapeuttisten lääkevalmisteiden käyttöön perehtyneen lääkärin valvonnassa.
Annostus
Hoitojakson aikana Dacogen-valmistetta annetaan 20 mg/m2 kehon pinta-alasta laskimonsisäisenä infuusiona 1 tunnin aikana 5 peräkkäisenä päivänä (yhteensä 5 annosta hoitojaksoa kohden). Päivittäinen kokonaisannos ei saa ylittää 20 mg/m2 eikä hoitojakson kokonaisannos saa ylittää 100 mg/m2. Jos annos jää väliin, hoitoa tulee jatkaa mahdollisimman pian. Hoitojakso toistetaan 4 viikon välein riippuen potilaan kliinisestä vasteesta ja havaitusta toksisuudesta. Suositeltavaa on, että potilaita hoidetaan vähintään 4 jakson ajan; täydellisen tai osittaisen remission saavuttaminen voi kuitenkin edellyttää enemmän kuin 4 hoitojaksoa. Hoitoa voidaan jatkaa niin kauan kuin potilaalla saavutetaan vaste, siitä on potilaalle hyötyä tai potilaan sairaudentila on stabiili, eli kunnes sairaus selvästi etenee.
Jos potilaan hematologiset arvot (esim. trombosyyttien määrä tai absoluuttinen neutrofiilimäärä) eivät ole palautuneet hoitoa edeltävälle tasolle neljän hoitojakson jälkeen tai jos tauti etenee (perifeerinen blastimäärä suurenee tai luuytimen blastimäärä lisääntyy), potilaan voidaan katsoa olevan hoitoon vastaamaton ja muita vaihtoehtoja Dacogen-hoidolle tulee harkita.
Pahoinvointia ja oksentelua estävää esilääkitystä ei rutiininomaisesti suositella, mutta sitä voidaan antaa tarpeen mukaan.
Myelosuppression ja siihen liittyvien komplikaatioiden hoito
Myelosuppressio ja myelosuppressioon liittyvät haittavaikutukset (trombosytopenia, anemia, neutropenia ja kuumeinen neutropenia) ovat yleisiä sekä hoidetuilla että hoitamattomilla AML-potilailla. Myelosuppression komplikaatioita ovat esimerkiksi infektiot ja verenvuodot. Hoitoa voidaan viivästyttää hoitavan lääkärin harkinnan mukaan, jos potilaalla esiintyy myelosuppressioon liittyviä komplikaatioita, kuten:
- Kuumeista neutropeniaa (lämpötila ≥ 38,5 °C ja absoluuttinen neutrofiilimäärä < 1 000/mikrolitra)
- Aktiivinen virus-, bakteeri- tai sieni-infektio (joka edellyttää laskimonsisäisiä infektiolääkkeitä tai laajamittaista tukihoitoa)
- Verenvuoto (maha-suolikanavassa, virtsa- ja sukupuolielimissä tai keuhkoissa ja trombosyyttimäärä < 25 000/mikrolitra, tai mikä tahansa keskushermoston verenvuoto).
Dacogen-hoitoa voidaan jatkaa, kun yllä mainitut tilat ovat parantuneet tai saatu hallintaan asianmukaisen hoidon avulla (infektiolääkehoito, verensiirrot tai kasvutekijät).
Kliinisissä tutkimuksissa noin kolmanneksella Dacogen-hoitoa saaneista potilaista annoksen antamista oli tarpeen siirtää myöhempään ajankohtaan. Annoksen pienentämistä ei suositella.
Pediatriset potilaat
Dacogen-valmistetta ei pidä käyttää alle 18 vuoden ikäisten lapsipotilaiden AML:n hoidossa, koska tehoa ei ole varmistettu. Saatavissa oleva tieto kuvataan kohdissa Haittavaikutukset, Farmakodynamiikka ja Farmakokinetiikka.
Maksan vajaatoiminta
Maksan vajaatoimintaa sairastavilla potilailla ei ole tehty tutkimuksia. Ei ole arvioitu, onko maksan vajaatoimintaa sairastavien potilaiden annosta tarpeellista muuttaa. Jos maksan toiminta heikkenee, potilaita tulee seurata tarkasti (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet sekä Farmakokinetiikka).
Munuaisten vajaatoiminta
Munuaisten vajaatoimintaa sairastavilla potilailla ei ole tehty tutkimuksia. Ei ole arvioitu, onko munuaisten vajaatoimintaa sairastavien potilaiden annosta tarpeellista muuttaa (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet sekä Farmakokinetiikka).
Antotapa
Dacogen annetaan laskimonsisäisenä infuusiona. Keskuslaskimokatetria ei tarvita.
Ks. kohdasta Erityiset varotoimet hävittämiselle ja muut käsittelyohjeet ohjeet lääkevalmisteen saattamisesta käyttökuntoon ja laimentamisesta ennen lääkkeen antoa.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Imetys (ks. kohta Raskaus ja imetys).
Varoitukset ja käyttöön liittyvät varotoimet
Myelosuppressio
AML-potilailla esiintyvä myelosuppressio sekä myelosuppressioon liittyvät komplikaatiot, kuten infektiot ja verenvuodot, voivat pahentua Dacogen-hoidon aikana. Potilailla on siksi tavanomaista suurempi vaikea-asteisten (minkä tahansa taudinaiheuttajan, kuten bakteerien, sienten ja virusten, aiheuttamien) infektioiden riski. Tällaiset infektiot voivat johtaa potilaan kuolemaan (ks. kohta Haittavaikutukset). Potilasta on seurattava infektion oireiden ja löydösten havaitsemiseksi, ja infektio on hoidettava viipymättä.
Kliinisissä tutkimuksissa suurimmalla osalla potilaista oli lähtötilanteessa luokan 3/4 myelosuppressio. Jos potilaalla on lähtötilanteessa luokan 2 poikkeavuuksia, myelosuppression havaittiin pahenevan useimmilla potilailla ja useammin kuin potilailla, joilla oli lähtötilanteessa luokan 1 tai 0 poikkeavuuksia. Dacogen-valmisteen aiheuttama myelosuppressio on palautuvaa. Täydellinen verenkuva ja trombosyyttilaskenta täytyy tehdä säännöllisesti ja kliinisen tarpeen mukaan sekä ennen jokaista hoitojaksoa. Jos myelosuppressiota tai sen komplikaatioita esiintyy, Dacogen-hoito voidaan keskeyttää ja/tai tukitoimet aloittaa (ks. kohdat Annostus ja antotapa sekä Haittavaikutukset).
Hengityselimien, rintakehän ja välikarsinan häiriöt
Desitabiinihoitoa saavilla potilailla on raportoitu interstitiaalista keuhkosairautta (keuhkoinfiltraatit, organisoituva pneumonia ja keuhkofibroosi mukaan lukien) ilman merkkejä infektiivisestä syystä. Jos potilaalle ilmaantuu äkillisesti keuhko-oireita tai keuhko-oireet pahenevat selittämättömästi, potilas on tutkittava huolellisesti interstitiaalisen keuhkosairauden poissulkemiseksi. Jos interstitiaalinen keuhkosairaus varmistuu, tarkoituksenmukainen hoito on aloitettava (ks. kohta Haittavaikutukset).
Maksan vajaatoiminta
Käyttöä maksan vajaatoimintaa sairastaville potilaille ei ole selvitetty. Dacogen-valmisteen käytössä on noudatettava varovaisuutta, jos potilaalla on maksan vajaatoimintaa tai potilaalle kehittyy maksan vajaatoiminnan oireita ja löydöksiä. Maksan toimintakokeet pitää tehdä ennen hoidon ja jokaisen hoitosyklin aloittamista sekä aina, kun se on kliinisesti aiheellista (ks. kohdat Annostus ja antotapa sekä Farmakokinetiikka).
Munuaisten vajaatoiminta
Käyttöä vaikea-asteista munuaisten vajaatoimintaa sairastaville potilaille ei ole tutkittu. Varovaisuutta on noudatettava, jos Dacogen-valmistetta käytetään vaikea-asteista munuaisten vajaatoimintaa sairastaville potilaille (kreatiniinipuhdistuma [CrCL] < 30 ml/min). Munuaisten toimintakokeet pitää tehdä ennen hoidon ja jokaisen hoitosyklin aloittamista sekä aina, kun se on kliinisesti aiheellista (ks. kohta Annostus ja antotapa).
Sydänsairaudet
Potilaat, joilla oli aiemmin ollut vaikea-asteinen kongestiivinen sydämen vajaatoiminta tai kliinisesti epävakaa sydänsairaus, suljettiin pois kliinisistä tutkimuksista, ja sen vuoksi Dacogen-valmisteen turvallisuutta ja tehoa ei ole määritelty näille potilaille. Markkinoille tulon jälkeen on raportoitu tapauksia, joissa on esiintynyt kardiomyopatiaa ja sydämen dekompensaatiota, jotka joissain tapauksissa ovat korjaantuneet hoidon keskeyttämisen, annoksen pienentämisen tai korjaavan hoidon jälkeen. Potilaita on seurattava sydämen vajaatoiminnan löydösten ja oireiden varalta, etenkin jos heillä on anamneesissa sydänsairaus.
Erilaistumisoireyhtymä
Desitabiinihoitoa saavilla potilailla on raportoitu erilaistumisoireyhtymää (tunnetaan myös nimellä retinoiinihappo-oireyhtymä). Erilaistumisoireyhtymä voi johtaa kuolemaan (ks. kohta Haittavaikutukset). Erilaistumisoireyhtymään viittaavien oireiden ja löydösten ilmaantuessa ensimmäistä kertaa pitää harkita hoitoa suurilla laskimoon annettavilla kortikosteroidiannoksilla ja hemodynaamista seurantaa. Dacogen-hoidon keskeyttämistä oireiden häviämiseen saakka pitää harkita. Jos hoitoa jatketaan, siinä kehotetaan noudattamaan varovaisuutta.
Apuaineet
Tämä lääkevalmiste sisältää kaliumia 0,5 mmol per injektiopullo. Kun laskimoon annettava infuusioliuos on saatettu käyttövalmiiksi ja laimennettu, tämä lääkevalmiste sisältää kaliumia alle 1 mmol (39 mg) per annos, eli se on olennaisesti ”kaliumiton”.
Tämä lääkevalmiste sisältää natriumia 0,29 mmol (6,67 mg) per injektiopullo. Kun laskimoon annettava infuusioliuos on saatettu käyttövalmiiksi ja laimennettu, tämä lääkevalmiste sisältää 13,8 mg − 138 mg (0,6−6 mmol) natriumia per annos (riippuen laimentamiseen käytetystä infuusionesteestä), joka vastaa 0,7–7 % WHO:n suosittelemasta natriumin 2 g:n päivittäisestä enimmäissaannista aikuisille.
Yhteisvaikutukset
Desitabiinilla ei ole tehty virallisia yhteisvaikutustutkimuksia.
Lääkkeiden yhteisvaikutukset ovat mahdollisia sellaisten muiden lääkeaineiden kanssa, jotka myös aktivoituvat sekventiaalisen fosforylaation vaikutuksesta (solunsisäisen fosfokinaasiaktiivisuuden kautta) ja/tai metaboloituvat desitabiinin inaktivaatioon osallistuvien entsyymien välityksellä (esim. sytidiinideaminaasi). Tämän vuoksi on noudatettava varovaisuutta, jos näitä vaikuttavia aineita yhdistetään desitabiiniin.
Samanaikaisesti annettujen lääkevalmisteiden vaikutus desitabiiniin
Sytokromi (CYP) 450 -välitteisiä metabolisia yhteisvaikutuksia ei ole odotettavissa, sillä desitabiini ei metaboloidu tämän järjestelmän, vaan oksidatiivisen deaminaation välityksellä.
Desitabiinin vaikutus samanaikaisesti annettuihin lääkevalmisteisiin
Ottaen huomioon desitabiinin vähäisen sitoutumisen in vitro plasman proteiineihin (< 1 %) on epätodennäköistä, että desitabiini syrjäyttäisi samanaikaisesti annettuja lääkevalmisteita plasman proteiinisidoksista. Desitabiinin on osoitettu olevan P-gp-välitteisen kuljetuksen heikko estäjä in vitro, ja näin ollen sen ei myöskään odoteta vaikuttavan samanaikaisesti annettujen lääkevalmisteiden P-gp-välitteiseen kuljetukseen (ks. kohta Farmakokinetiikka).
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi/Ehkäisy miehille ja naisille
Desitabiinin mahdollisen genotoksisuuden vuoksi (ks. kohta Prekliiniset tiedot turvallisuudesta) hedelmällisessä iässä olevien naisten on käytettävä tehokasta ehkäisyä ja vältettävä raskaaksi tulemista Dacogen-hoidon aikana ja 6 kuukautta hoidon päättymisen jälkeen. Miesten on käytettävä tehokasta ehkäisyä ja heitä on neuvottava välttämään lapsen siittämistä Dacogen-hoidon aikana ja kolmen kuukauden ajan hoidon jälkeen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Desitabiinin käyttöä hormonaalisten ehkäisyvalmisteiden kanssa ei ole tutkittu.
Raskaus
Ei ole olemassa riittävästi tietoja Dacogen-valmisteen käytöstä raskaana oleville naisille. Tutkimukset ovat osoittaneet, että desitabiini on teratogeeninen rotilla ja hiirillä (ks. kohta Prekliiniset tiedot turvallisuudesta). Mahdollista riskiä ihmisille ei tunneta. Eläinkokeiden tuloksiin ja lääkeaineen vaikutusmekanismiin perustuen Dacogen-valmistetta ei tule käyttää raskauden aikana eikä hedelmällisessä iässä oleville naisille, ellei tehokkaasta ehkäisystä ole huolehdittu. Kaikille naisille, jotka voivat tulla raskaaksi, pitää tehdä raskaustesti ennen hoidon aloittamista. Jos Dacogen-valmistetta käytetään raskauden aikana tai jos potilas tulee raskaaksi lääkehoidon aikana, potilaalle on kerrottava sikiöön kohdistuvista riskeistä.
Imetys
Ei tiedetä, erittyvätkö desitabiini tai sen metaboliitit rintamaitoon. Dacogen on vasta-aiheista imetyksen aikana, joten imetys on lopetettava, jos tämä lääke katsotaan tarpeelliseksi (ks. kohta Vasta-aiheet).
Hedelmällisyys
Desitabiinin vaikutuksesta ihmisen hedelmällisyyteen ei ole tietoja. Ei-kliinisissä eläinkokeissa desitabiini muutti urosten hedelmällisyyttä ja oli mutageeninen. Koska Dacogen-hoito saattaa aiheuttaa hedelmättömyyttä, miespotilaita on kehotettava kysymään neuvoa koskien siittiöiden talteenottoa ja hedelmällisessä iässä olevia naispotilaita on kehotettava kysymään neuvoa koskien munasolujen pakastussäilöntää ennen hoidon aloitusta.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Dacogen-valmisteella on kohtalainen vaikutus ajokykyyn ja koneidenkäyttökykyyn. Potilaille tulee kertoa, että he saattavat saada haittavaikutuksia, kuten anemiaa, hoidon aikana. Sen vuoksi on noudatettava varovaisuutta autolla ajettaessa tai käytettäessä koneita.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Yleisimmät raportoidut haittavaikutukset (≥ 35 %) ovat kuume, anemia ja trombosytopenia.
Yleisimmät luokan 3/4 haittavaikutukset (≥ 20 %) olivat pneumonia, trombosytopenia, neutropenia, kuumeinen neutropenia ja anemia.
Kliinisissä tutkimuksissa 30 %:lla Dacogen-hoitoa saaneista ja 25 %:lla verrokkiryhmässä hoitoa saaneista potilaista esiintyi hoidon aikana tai 30 vuorokauden kuluessa viimeisen tutkimuslääkeannoksen jälkeen kuolemaan johtanut haittavaikutus.
Dacogen-ryhmässä hoidon lopettamiseen johtaneiden haittavaikutusten esiintyvyys oli suurempi naisilla (43 %) verrattuna miehiin (32 %).
Taulukkomuotoinen luettelo haittavaikutuksista
Taulukkoon 1 on koottu 293:lla Dacogen-hoitoa saaneella AML-potilaalla raportoidut haittavaikutukset. Seuraava taulukko kuvastaa AML:n kliinisistä tutkimuksista sekä valmisteen markkinoille tulon jälkeen saatua tietoa. Haittavaikutukset on lueteltu esiintyvyyden mukaan. Esiintyvyydet on määritetty seuraavalla tavalla: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
| Taulukko 1: Dacogen-valmisteen käytön yhteydessä havaitut haittavaikutukset | ||||
| Elinjärjestelmäluokitus | Esiintyvyys (kaikki luokat) | Haittavaikutus | Esiintyvyys | |
| Kaikki luokata (%) | Luokat 3−4a (%) | |||
| Infektiot | Hyvin yleinen | pneumonia* | 24 | 20 |
| virtsatieinfektio* | 15 | 7 | ||
| kaikki muut infektiot (virus-, bakteeri-, sieni-infektiot)*,b, c, d | 63 | 39 | ||
| Yleinen | septinen sokki* | 6 | 4 | |
| sepsis* | 9 | 8 | ||
| sinuiitti | 3 | 1 | ||
| Hyvän- ja pahanlaatuiset kasvaimet (mukaan lukien kystat ja polyypit) | Tuntematon | erilaistumisoireyhtymä | Tuntematon | Tuntematon |
| Veri ja imukudos | Hyvin yleinen | kuumeinen neutropenia* | 34 | 32 |
| neutropenia* | 32 | 30 | ||
| trombosytopenia*, e | 41 | 38 | ||
| anemia | 38 | 31 | ||
| leukopenia | 20 | 18 | ||
| Melko harvinainen | pansytopenia* | < 1 | < 1 | |
| Immuunijärjestelmä | Yleinen | yliherkkyys mukaan lukien anafylaktinen reaktiof | 1 | < 1 |
| Aineenvaihdunta ja ravitsemus | Hyvin yleinen | hyperglykemia | 13 | 3 |
| Hermosto | Hyvin yleinen | päänsärky | 16 | 1 |
| Sydän | Melko harvinainen | kardiomyopatia | < 1 | < 1 |
| Hengityselimet, rintakehä ja välikarsina | Hyvin yleinen | nenäverenvuoto | 14 | 2 |
| Tuntematon | interstitiaalinen keuhkosairaus | Tuntematon | Tuntematon | |
| Ruoansulatuselimistö | Hyvin yleinen | ripuli | 31 | 2 |
| oksentelu | 18 | 1 | ||
| pahoinvointi | 33 | < 1 | ||
| Yleinen | suutulehdus | 7 | 1 | |
| Tuntematon | enterokoliitti, mukaan lukien neutropeeninen koliitti, umpisuolitulehdus* | Tuntematon | Tuntematon | |
| Maksa ja sappi | Hyvin yleinen | maksan toiminnan poikkeavuudet | 11 | 3 |
| Yleinen | hyperbilirubinemiag | 5 | < 1 | |
| Iho ja ihonalainen kudos | Melko harvinainen | akuutti kuumeinen neutrofiilinen dermatoosi (Sweetin oireyhtymä) | < 1 | NA |
| Yleisoireet ja antopaikassa todettavat haitat | Hyvin yleinen | kuume | 48 | 9 |
a CTCAE-luokitus (Worst National Cancer Institute Common Terminology Criteria for Adverse Events Grade). | ||||
Valikoitujen haittavaikutusten kuvaus
Hematologiset haittavaikutukset
Yleisimmin raportoidut Dacogen-hoitoon liittyvät hematologiset haittavaikutukset olivat kuumeinen neutropenia, trombosytopenia, neutropenia, anemia ja leukopenia.
Vakavia verenvuotoihin liittyviä haittavaikutuksia, joista osa oli kuolemaan johtavia, kuten keskushermoston verenvuotoja (2 %) ja ruoansulatuselimistön verenvuotoja (2 %) on raportoitu desitabiinia saavilla potilailla vaikea-asteisen trombosytopenian yhteydessä.
Hematologisia haittavaikutuksia tulee hoitaa täydellisen verenkuvan rutiininomaisella seurannalla sekä antamalla varhaista tukihoitoa tarpeen mukaan. Tukihoitona voidaan antaa antibioottiprofylaksiaa ja/tai kasvutekijätukea (esim. G-CSF) neutropeniassa sekä verensiirtoja anemiassa tai trombosytopeniassa vakiintuneiden ohjeiden mukaan. Tilanteet, joissa desitabiinin antoa tulee viivästyttää, ks. kohta Annostus ja antotapa.
Infektioihin liittyvät haittavaikutukset
Desitabiinia saavilla potilailla on raportoitu vakavia infektioihin liittyviä haittavaikutuksia, jotka saattavat johtaa potilaan kuolemaan, kuten septistä sokkia, sepsistä ja pneumoniaa sekä muita infektioita (virus-, bakteeri- ja sieni-infektioita).
Ruoansulatuselimistön haittavaikutukset
Desitabiinihoidon aikana on raportoitu esiintyneen enterokoliittia, mukaan lukien neutropeenista koliittia, ja umpisuolitulehduksia. Enterokoliitti saattaa johtaa septisiin komplikaatioihin ja potilaan kuolemaan.
Hengityselimien, rintakehän ja välikarsinan haittavaikutukset
Desitabiinihoitoa saavilla potilailla on raportoitu interstitiaalista keuhkosairautta (keuhkoinfiltraatit, organisoituva pneumonia ja keuhkofibroosi mukaan lukien) ilman merkkejä infektiivisestä syystä.
Erilaistumisoireyhtymä
Desitabiinihoitoa saavilla potilailla on raportoitu erilaistumisoireyhtymää (tunnetaan myös nimellä retinoiinihappo-oireyhtymä). Erilaistumisoireyhtymä voi johtaa kuolemaan. Sen oireita ja kliinisiä löydöksiä ovat mm. hengitysvaikeus, keuhkoinfiltraatit, kuume, ihottuma, keuhkoedeema, raajojen turvotus, nopea painon nousu, pleuraeffuusiot, perikardiumeffuusiot, hypotensio ja munuaisten toimintahäiriö. Erilaistumisoireyhtymän yhteydessä voi ilmetä samanaikaista leukosytoosia. Myös hiussuonivuoto-oireyhtymä ja hyytymishäiriö ovat mahdollisia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Pediatriset potilaat
Turvallisuuden arviointi pediatrisilla potilailla perustuu vähäisiin turvallisuutta koskeviin tietoihin vaiheen I/II tutkimuksesta, jossa arvioitiin Dacogen-valmisteen farmakokinetiikkaa, turvallisuutta ja tehoa pediatrisilla potilailla (iältään 1–14 vuotta), joilla oli uusiutunut tai hoitoon reagoimaton AML (n = 17) (ks. kohta Farmakodynamiikka). Uusia turvallisuussignaaleja ei havaittu tässä pediatrisessa tutkimuksessa.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Yliannostuksesta ihmisellä ei ole suoraa kokemusta eikä spesifistä vastalääkettä ole. On kuitenkin julkaistu varhaisvaiheen kliinisiä tutkimustuloksia, joissa yli 20 kertaa nykyistä hoitoannosta suurempien annosten raportoitiin johtavan myelosuppression lisääntymiseen sekä pitkittyneeseen neutropeniaan ja trombosytopeniaan. Toksisuus ilmenee todennäköisesti haittavaikutusten, etenkin myelosuppression, pahenemisena. Yliannostuksen hoidon tulee olla tukevaa.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Solunsalpaajat, antimetaboliitit, pyrimidiinianalogit, ATC-koodi: L01BC08
Vaikutusmekanismi
Desitabiini (5-atsa-2'-deoksisytidiini) on sytidiinideoksinukleosidianalogi, joka matalilla annoksilla estää selektiivisesti DNA-metyylitransferaasia ja saa aikaan geenien promoottoreiden hypometylaation, joka voi johtaa tuumorisuppressorigeenien uudelleenaktivointiin, solujen erilaistumisen induktioon tai solujen vanhenemiseen ja sitä seuraavaan ohjelmoituneeseen solukuolemaan.
Kliininen kokemus
Dacogen-valmisteen käyttöä tutkittiin avoimessa, satunnaistetussa faasin III monikeskustutkimuksessa (DACO-016) koehenkilöillä, joilla oli äskettäin todettu de novo tai sekundaarinen AML WHO:n luokituksen mukaan. Dacogen-valmistetta (n = 242) verrattiin potilaan lääkärin avulla valitsemaan hoitovalintaan (TC, n = 243), joka käsitti joko pelkän tukihoidon (n = 28, 11,5 %) tai 20 mg/m2 sytarabiinia ihon alle kerran vuorokaudessa 10 peräkkäisenä päivänä 4 viikon välein toistettuna (n = 215, 88,5 %). Dacogen-valmistetta annettiin tunnin mittaisena laskimonsisäisenä infuusiona annoksella 20 mg/m2 kerran vuorokaudessa 5 peräkkäisenä päivänä toistettuna 4 viikon välein.
Tutkimukseen ei otettu mukaan henkilöitä, joille tavanomaisen induktiokemoterapian katsottiin soveltuvan, mikä käy ilmi seuraavista lähtötilanteen tiedoista. ITT-populaation (intent-to-treat population) mediaani-ikä oli 73 vuotta (vaihteluväli 64−91 vuotta). 36 %:lla koehenkilöistä oli matala sytogeneettinen riski lähtötilanteessa. Loppuosalla sytogeneettinen riski oli keskisuuri. Potilaita, joiden sytogenetiikka oli suotuisa, ei otettu mukaan tutkimukseen. Koehenkilöistä 25 %:lla ECOG-suorituskykyluokitus oli ≥ 2. Koehenkilöistä 81 %:lla esiintyi merkittäviä komorbiditeettejä (esim. infektio, sydämen toimintahäiriö, keuhkojen toimintahäiriö). Dacogen-hoitoa saaneista potilaista 209 (86,4 %) oli valkoihoisia ja 33 (13,6 %) aasialaisia.
Tutkimuksen primaarinen päätetapahtuma oli kokonaiselossaoloaika. Sekundaarinen päätetapahtuma oli täydellinen remissio, joka arvioitiin riippumattoman asiantuntijan toimesta. Elinaika ilman taudin etenemistä sekä tapahtumavapaa elinaika olivat tertiäärisiä päätetapahtumia.
ITT-populaatiossa kokonaiselossaoloajan mediaani oli 7,7 kuukautta Dacogen-hoitoa saaneilla potilailla ja 5,0 kuukautta TC-haaran potilailla (riskisuhde 0,85; 95 % CI: 0,69, 1,04, p = 0,1079). Ero ei ollut kliinisesti merkitsevä, mutta Dacogen-haaran koehenkilöillä oli nähtävissä suuntaus elossaolon pitenemiseen ja kuolemanriskin pienenemiseen 15 %:lla (kuvaaja 1). Kun aineistosta oli poistettu taudinkulkua mahdollisesti muuttava jatkohoito (esim. induktiokemoterapia tai hypometyloiva aine), kokonaiselossaolon analyysi osoitti, että riski kuolla oli 20 % pienempi Dacogen-haaran koehenkilöillä [HR = 0,80, (95 % CI: 0,64; 0,99), p-arvo = 0,0437)].
| Kuvaaja 1. Kokonaiselossaolo (ITT-populaatio). | |
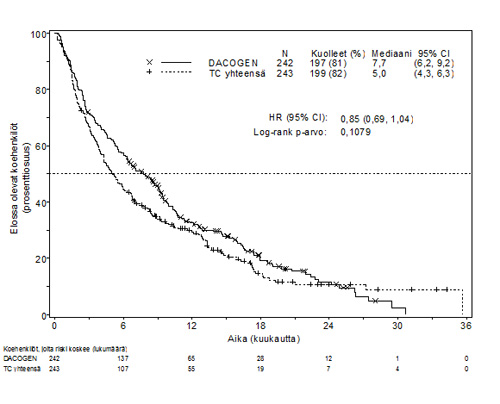 |
Kun analyysiin otettiin mukaan valmista elossaoloaineistoa yhdeltä lisävuodelta, Dacogen-valmisteen havaittiin pidentävän kokonaiselossaoloaikaa kliinisesti verrattuna TC-haaraan (7,7 kuukautta vs. 5,0 kuukautta, riskisuhde = 0,82, 95 % CI: 0,68, 0,99, nominaalinen p-arvo = 0,0373, kuvaaja 2).
| Kuvaaja 2. Valmiin kokonaiselossaoloa koskevan aineiston analyysi (ITT-populaatio). | |
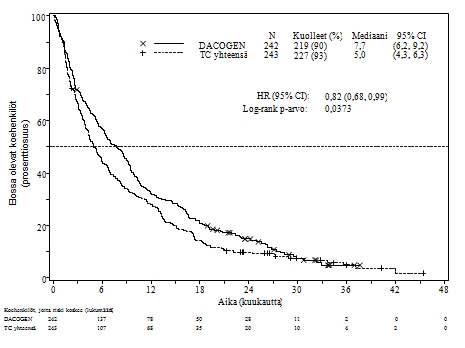 |
ITT-populaation ensimmäisessä analyysissa täydellisen remission (CR + CRp) havaittiin olevan tilastollisesti merkitsevästi yleisempää Dacogen-haaran koehenkilöillä (17,8 % eli 43/242) kuin TC-haarassa (7,8 % eli 19/243). Hoitoero oli 9,9 % (95 % CI: 4,07; 15,83), p = 0,0011. Potilailla, joilla saavutettiin CR tai CRp, mediaaniaika parhaan vasteen saavuttamiseen oli 4,3 kuukautta ja parhaan vasteen kesto 8,3 kuukautta. Dacogen-haaran koehenkilöillä elinaika ilman taudin etenemistä oli 3,7 kuukautta (95 % CI: 2,7; 4,6) eli merkitsevästi pidempi verrattuna TC-haaran koehenkilöihin, joilla vastaava aika oli 2,1 kuukautta (95 % CI: 1,9; 3,1); riskisuhde 0,75 (95 % CI: 0,62; 0,91), p = 0,0031. Nämä tulokset sekä muut päätetapahtumat on esitetty taulukossa 2.
| Taulukko 2: Muut tehokkuuden päätetapahtumat DACO-016-tutkimuksessa (ITT-populaatio) | |||
| Hoitotulokset | Dacogen n = 242 | TC (yhdistetty ryhmä) n = 243 | p-arvo |
| CR + CRp | 43 (17,8 %) | 19 (7,8 %) | 0,0011 |
| OR = 2,5 (1,40; 4,78)b | |||
| CR | 38 (15,7 %) | 18 (7,4 %) | - |
| EFSa | 3,5 (2,5; 4,1)b | 2,1 (1,9; 2,8)b | 0,0025 |
| HR = 0,75 (0,62; 0,90)b | |||
| PFSa | 3,7 (2,7; 4,6)b | 2,1 (1,9; 3,1)b | 0,0031 |
| HR = 0,75 (0,62; 0,91)b | |||
| CR = täydellinen remissio; CRp = täydellinen remissio, mutta ei täydellistä trombosyyttien korjautumista, EFS = tapahtumavapaa elinaika, PFS = elinaika ilman taudin etenemistä, OR = riskitulosuhde, HR = riskisuhde - = Ei arvioitavissa a Ilmoitettu kuukausien mediaanina b 95 % luottamusvälit | |||
Kokonaiselossaoloaika ja täydellisen remission esiintyvyys oli samansuuruista ennalta määritellyissä sairauteen liittyvissä alaryhmissä [esim. sytogeneettinen riski, ECOG-luokitus (Eastern Cooperative Oncology Group Score), ikä, AML-tyyppi sekä luuytimen blastimäärä lähtötilanteessa] kuin muussa tutkimuspopulaatiossa.
Dacogen-valmisteen käyttöä aloitushoitona arvioitiin myös avoimessa, yksihaaraisessa faasin II tutkimuksessa (DACO-017) 55:llä yli 60-vuotiaalla koehenkilöllä, joilla oli AML WHO:n luokituksen mukaan. Primaarinen päätetapahtuma oli täydellinen remissio (CR), joka arvioitiin riippumattoman asiantuntijan toimesta. Tutkimuksen sekundaarinen päätetapahtuma oli kokonaiselossaoloaika. Dacogen annettiin tunnin mittaisena laskimonsisäisenä infuusiona annoksella 20 mg/m2 kerran vuorokaudessa 5 peräkkäisenä päivänä 4 viikon välein toistettuna. ITT-analyysissä täydellinen remissio havaittiin 23,6 %:lla eli 13 koehenkilöllä 55:stä (95 % CI: 13,2, 37) Dacogen-hoitoa saaneista koehenkilöistä. Täydellisen remission saavuttamiseen kuluva mediaaniaika oli 4,1 kuukautta ja täydellisen remission mediaanikesto oli 18,2 kuukautta. ITT-populaatiossa kokonaiselossaoloajan mediaani oli 7,6 kuukautta (95 % CI: 5,7, 11,5).
Dacogen-valmisteen tehoa ja turvallisuutta ei ole arvioitu akuuttia promyelosyyttistä leukemiaa tai keskushermoston leukemiaa sairastavilla potilailla.
Pediatriset potilaat
Dacogen-valmisteen turvallisuutta ja tehoa arvioitiin sytarabiinin kanssa peräkkäin annettuna avoimessa vaiheen I/II monikeskustutkimuksessa 1 kuukauden – alle 18 vuoden ikäisillä lapsilla, joilla oli uusiutuva tai hoitoon reagoimaton AML. Tutkimuksessa oli mukana yhteensä 17 henkilöä, joille annettiin Dacogen-valmistetta 20 mg/m2. Näistä yhdeksän sai sytarabiinia annoksella 1 g/m2 ja kahdeksalle annettiin sytarabiinia suurin siedetty annos 2 g/m2. Kaikki henkilöt keskeyttivät tutkimushoidon. Syyt hoidon keskeyttämiseen olivat sairauden eteneminen (12 [70,6 %] henkilöllä), siirteen saaminen (3 [17,6 %]), tutkijan päätös (1 [5,9 %]) ja ”muu” (1 [5,9 %]). Raportoidut haittatapahtumat vastasivat Dacogen-valmisteen tunnettua turvallisuusprofiilia aikuisilla (ks. kohta Haittavaikutukset). Näiden negatiivisten tulosten perusteella Dacogen-valmistetta ei saa käyttää alle 18 vuoden ikäisille lapsipotilaille AML:n hoitoon, koska tehoa ei varmistettu (ks. kohta Annostus ja antotapa).
Farmakokinetiikka
Desitabiinin populaatiofarmakokineettiset parametrit yhdistettiin kolmesta kliinisestä tutkimuksesta, joihin osallistui 45 AML:ää tai myelodysplastista oireyhtymää (MDS) sairastavaa potilasta, joille noudatettiin viiden päivän hoito-ohjelmaa. Jokaisessa tutkimuksessa desitabiinin farmakokinetiikka arvioitiin ensimmäisen hoitojakson viidentenä päivänä.
Jakautuminen
Tunnin mittaisen laskimonsisäisen infuusion jälkeen desitabiinin farmakokinetiikka noudatti lineaarista kaksitilamallia, jolle tyypillistä on nopea eliminaatio sentraalisesta tilasta sekä jakautuminen suhteellisen hitaasti perifeerisestä tilasta. Desitabiinin farmakokineettiset parametrit tyypilliselle potilaalle (paino 70 kg/kehon pinta-ala 1,73 m2) on esitetty jäljempänä taulukossa 3.
| Taulukko 3: Yhteenveto populaatiofarmakokineettisestä analyysistä tyypilliselle potilaalle, joka saa Dacogen-valmistetta 20 mg/m2 päivittäin tunnin mittaisina infuusioina 5 päivänä 4 viikon välein | ||
| Parametria | Ennustettu arvo | 95 % CI |
| Cmax (ng/ml) | 107 | 88,5–129 |
| AUCcum (ng.h/ml) | 580 | 480–695 |
| t1/2 (min) | 68,2 | 54,2–79,6 |
| Vdss (l) | 116 | 84,1–153 |
| CL (l/h) | 298 | 249–359 |
| aKokonaisannos hoitojaksoa kohden oli 100 mg/m2 | ||
Desitabiinin farmakokinetiikka on lineaarista ja vakaan tilan pitoisuudet saavutetaan 0,5 tunnin sisällä laskimonsisäisestä annostelusta. Simuloidut farmakokineettiset parametrit olivat riippumattomia ajasta (eli ne eivät vaihdelleet eri hoitojaksojen välillä) eikä kertymistä havaittu käytetyllä annostuksella. Desitabiinin sitoutuminen plasman proteiineihin on vähäistä (< 1 %). Desitabiinin vakaan tilan jakaantumistilavuus (Vdss) syöpäpotilailla on suuri, mikä osoittaa sen jakautuvan perifeerisiin kudoksiin. Iän, kreatiniinipuhdistuman, kokonaisbilirubiinin tai sairauden mahdollisista vaikutuksista ei ollut näyttöä.
Biotransformaatio
Solun sisällä desitabiini aktivoituu fosfokinaasin välityksellä tapahtuvan sekventiaalisen fosforylaation kautta ja siitä muodostuu vastaava trifosfaatti, joka sitoutuu DNA-polymeraasiin. In vitro -metaboliatiedot sekä ihmisillä suoritetun massatasapainotutkimuksen tulokset osoittavat, että sytokromi P450 -järjestelmä ei osallistu desitabiinin metaboliaan. Ensisijainen metaboliareitti on todennäköisesti sytidiinideaminaasin välityksellä tapahtuva deaminaatio maksassa, munuaisissa, suolen epiteelissä ja veressä. Ihmisillä suoritetun massatasapainotutkimuksen tulosten perusteella plasmassa muuttumattomana esiintyvän desitabiinin osuus oli noin 2,4 % plasman kokonaisradioaktiivisuudesta. Päämetaboliittien ei uskota olevan farmakologisesti aktiivisia. Näiden metaboliittien esiintyminen virtsassa sekä elimistön suuri kokonaispuhdistuma ja muuttumattoman desitabiinin vähäinen erittyminen virtsaan (noin 4 % annoksesta) osoittaa, että desitabiini metaboloituu merkittävissä määrin in vivo. In vitro -tutkimukset osoittavat, että desitabiini estää tai indusoi CYP 450 -entsyymejä korkeintaan 20-kertaisesti plasmassa havaittuihin terapeuttisiin enimmäispitoisuuksiin nähden (Cmax). CYP-välitteisiä metabolisia yhteisvaikutuksia ei siten ole odotettavissa ja on epätodennäköistä, että desitabiinilla olisi yhteisvaikutuksia näiden reittien välityksellä metaboloituvien lääkeaineiden kanssa. In vitro -kokeista saadut tulokset osoittavat lisäksi, että desitabiini on heikko P-gp:n substraatti.
Eliminaatio
Syöpää sairastavilla koehenkilöillä keskimääräinen plasmapuhdistuma laskimonsisäisen annon jälkeen oli > 200 l/h ja koehenkilöiden välistä vaihtelua esiintyi kohtalaisesti (variaatiokerroin [CV] oli noin 50 %). Muuttumattoman lääkeaineen erittymisellä vaikuttaisi olevan vain vähäinen merkitys desitabiinin eliminaatiossa.
Syöpäpotilailla suoritettu massatasapainotutkimus, jossa käytettiin radioaktiivista 14C-desitabiinia, osoitti että 90 % desitabiiniannoksesta erittyy virtsaan (4 % muuttumattomana lääkeaineena).
Lisätietoa erityisryhmistä
Munuaisten tai maksan vajaatoiminnan, sukupuolen, iän tai rodun vaikutuksia desitabiinin farmakokinetiikkaan ei ole virallisesti tutkittu. Erityisryhmiä koskevat tiedot saatiin kolmen yllämainitun tutkimuksen farmakokineettisistä tiedoista sekä yhdestä faasin I tutkimuksesta myelodysplastista oireyhtymää (MDS) sairastavilla koehenkilöillä (n = 14; 15 mg/m2 x 3 tuntia 8 tunnin välein x 3 vrk).
Iäkkäät potilaat
Populaatiofarmakokineettinen analyysi osoitti, ettei desitabiinin farmakokinetiikka ole riippuvainen iästä (tutkittu ikähaarukka 40–87 vuotta, mediaani 70 vuotta).
Pediatriset potilaat
Desitabiinin populaatiofarmakokineettinen analyysi osoitti, että kehon kokoon suhteuttuna desitabiinin farmakokineettisissä parametreissa ei ole eroa AML:ää sairastavien lapsipotilaiden ja aikuisten AML- tai MDS-potilaiden välillä.
Sukupuoli
Populaatiofarmakokineettinen analyysi ei osoittanut kliinisesti merkitseviä eroja miesten ja naisten välillä.
Rotu
Suurin osa tutkituista potilaista oli valkoihoisia. Desitabiinin populaatiofarmakokineettinen analyysi osoitti kuitenkin, ettei rodulla ollut selvää vaikutusta desitabiinialtistukseen.
Maksan vajaatoiminta
Desitabiinin farmakokinetiikkaa ei ole virallisesti tutkittu maksan vajaatoimintaa sairastavilla potilailla. Ihmisillä suoritetusta massatasapainotutkimuksesta ja edellä mainituista in vitro -kokeista saadut tulokset osoittivat, että CYP-entsyymit eivät todennäköisesti osallistu desitabiinin metaboliaan. Populaatiofarmakokineettisestä analyysistä saatujen rajallisten tietojen perusteella farmakokineettiset parametrit eivät merkittävästi riipu kokonaisbilirubiinipitoisuudesta, vaikka kokonaisbilirubiinipitoisuuksien vaihteluväli oli laaja. Siten maksan vajaatoiminnalla ei todennäköisesti ole vaikutusta desitabiinialtistukseen.
Munuaisten vajaatoiminta
Desitabiinin farmakokinetiikkaa ei ole virallisesti tutkittu munuaisten vajaatoimintaa sairastavilla potilailla. Rajallisesta aineistosta tehdyn populaatiofarmakokineettisen analyysin perusteella desitabiinin farmakokineettiset parametrit eivät merkittävästi riipu normalisoidusta kreatiniinipuhdistumasta, joka on munuaistoiminnan indikaattori. Siten munuaisten vajaatoiminnalla ei todennäköisesti ole vaikutusta desitabiinialtistukseen.
Prekliiniset tiedot turvallisuudesta
Desitabiinilla ei ole tehty muodollisia karsinogeenisuustutkimuksia. Kirjallisuustiedot viittaavat karsinogeeniseen potentiaaliin. Saatavilla olevat in vitro- ja in vivo -tutkimusten tulokset tarjoavat riittävää näyttöä siitä, että desitabiinilla on geenitoksista potentiaalia. Kirjallisuustietojen perusteella desitabiinilla on lisäksi haitallinen vaikutus kaikkiin lisääntymissyklin eri osa-alueisiin, kuten hedelmällisyyteen, alkion/sikiön kehitykseen ja syntymänjälkeiseen kehitykseen. Rotilla ja kaneilla suoritettujen usean syklin toistuvan annoksen toksisuustutkimusten perusteella ensisijainen toksisuusmekanismi oli myelosuppressio, mukaan lukien luuytimeen kohdistuvat vaikutukset, joka korjaantui hoidon lopettamisen jälkeen. Lisäksi havaittiin gastrointestinaalista toksisuutta sekä uroksilla kivesten surkastumista, mikä ei korjaantunut ennalta suunniteltujen palautusjaksojen aikana. Desitabiinin yleinen toksisuusprofiili oli samankaltainen vastasyntyneillä/nuorilla rotilla kuin vanhemmilla rotilla. Myelosuppressiota aiheuttavilla annoksilla ei ollut vaikutusta neurobehavioraaliseen kehitykseen eikä lisääntymiskykyyn vastasyntyneillä/nuorilla rotilla. Ks. kohdasta Annostus ja antotapa lisätiedot pediatristen potilaiden hoidosta.
Farmaseuttiset tiedot
Apuaineet
Kaliumdivetyfosfaatti (E340)
Natriumhydroksidi (E524)
Kloorivetyhappo (pH:n säätöön)
Yhteensopimattomuudet
Tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa, lukuun ottamatta niitä, jotka mainitaan kohdassa Käyttö- ja käsittelyohjeet.
Kestoaika
Avaamaton injektiopullo
3 vuotta.
Liuotettu ja laimennettu liuos
Välikonsentraatti (10 ml:ssa injektionesteisiin käytettävää vettä) on laimennettava 15 minuutin kuluessa liuottamisesta edelleen kylmään (2 °C – 8 °C) infuusionesteeseen. Valmista laimennettua laskimoon annettavaa infuusioliuosta voidaan säilyttää 2 °C – 8 °C:ssa korkeintaan 3 tunnin ajan, jonka jälkeen liuosta voidaan säilyttää huoneenlämmössä (20 °C – 25 °C) enintään 1 tunnin ajan ennen antoa.
Mikrobiologiselta kannalta valmiste tulee käyttää yllä suositellun määräajan kuluessa. On käyttäjän vastuulla noudattaa suositeltuja säilytysaikoja ja -olosuhteita sekä varmistaa, että laimentaminen on suoritettu aseptisissa olosuhteissa.
Säilytys
Säilytä alle 25 °C.
Käyttökuntoon saatetun ja laimennetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
DACOGEN kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos
50 mg (L:ei) 1 kpl (1677,97 €)
PF-selosteen tieto
20 ml:n kirkas väritön tyypin I lasinen injektiopullo, joka on suljettu butyylikumitulpalla ja alumiinisinetillä ja joka on varustettu muovisella repäisykorkilla. Injektiopullo sisältää 50 mg desitabiinia.
Pakkauskoko: 1 injektiopullo.
Valmisteen kuvaus:
Valkoinen tai melkein valkoinen kylmäkuivattu kuiva-aine.
Käyttö- ja käsittelyohjeet
Turvallista käsittelyä koskevat suositukset
On vältettävä ihokontaktia liuoksen kanssa ja käytettävä suojakäsineitä. Sytotoksisten lääkevalmisteiden käsittelyä koskevia vakiomenettelyjä on noudatettava.
Käyttökuntoon saattaminen
Kuiva-aine liuotetaan aseptisesti lisäämällä 10 ml injektionesteisiin käytettävää vettä. Liuottamisen jälkeen yksi ml sisältää noin 5 mg desitabiinia ja pH on 6,7−7,3. Liuos on laimennettava 15 minuutin kuluessa kuiva-aineen liuottamisesta edelleen kylmään infuusionesteeseen (9 mg/ml [0,9 %] natriumkloridi-injektioneste tai 5 % glukoosi-injektioneste) lopulliseen pitoisuuteen 0,15−1,0 mg/ml.
Käyttökuntoon saatetun lääkevalmisteen kestoaika ja säilytykseen liittyvät varotoimet, ks. kohta Kestoaika.
Dacogen-valmistetta ei saa antaa saman laskimoyhteyden/letkun kautta muiden lääkevalmisteiden kanssa.
Hävittäminen
Tämä lääkevalmiste on tarkoitettu vain yhtä käyttökertaa varten. Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
DACOGEN kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos
50 mg 1 kpl
- Ei korvausta.
ATC-koodi
L01BC08
Valmisteyhteenvedon muuttamispäivämäärä
09.12.2025
Yhteystiedot
 JANSSEN-CILAG OY
JANSSEN-CILAG OY PL 15
02621 Espoo
020 753 1300
innovativemedicine.jnj.com/finland
jacfi@its.jnj.com
