DYSPORT injektiokuiva-aine, liuosta varten 300 U
Vaikuttavat aineet ja niiden määrät
Clostridium botulinum A-tyypin toksiini-hemagglutiniini-kompleksi 300 U*
* Koska kansainvälistä viitearvoa ei ole, määrä ilmoitetaan käyttäen valmistajan omaa viitearvoa.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektiokuiva-aine, liuosta varten.
Kliiniset tiedot
Käyttöaiheet
- Yläraajojen fokaalisen spastisuuden oireenmukainen hoito aikuisilla.
- Nilkkanivelen fokaalisen spastisuuden oireenmukainen hoito aikuisilla aivohalvauksen tai tapaturmaisen aivovaurion jälkeen.
- 2-vuotiaiden tai sitä vanhempien liikkumaan pystyvien CP-lasten spastisuudesta johtuvat alaraajojen toiminnalliset epämuodostumat.
- Yläraajojen fokaalisen spastisuuden oireenmukainen hoito 2-vuotiailla ja sitä vanhemmilla CP-lapsilla.
- Spastinen tortikollis aikuisilla.
- Blefarospasmi aikuisilla.
- Hemifasiaalispasmi aikuisilla.
- Virtsainkontinenssin hoito aikuisilla, joilla on (traumaattisesta tai ei-traumaattisesta) selkäydinvammasta tai multippeliskleroosista johtuva detrusorin neurogeeninen yliaktiivisuus ja jotka tekevät säännöllisesti puhtaita toistokatetrointeja.
- Primaarisen vakavan paikallishoidoille reagoimattoman kainaloiden liikahikoilun oireenmukainen hoito.
Huomaa:
Ennen Dysport-hoidon aloitusta potilaalle on kerrottava muista hoitovaihtoehdoista (lääkehoito, leikkaushoito) ja siitä, että kaikki potilaat eivät saa vastetta Dysport-hoitoon. On myös mahdollista, että oireet lievittyvät vain osittain.
Annostus ja antotapa
Dysportin yksiköt ovat valmistekohtaisia, eikä niitä voi soveltaa muihin botuliinitoksiinia sisältäviin valmisteisiin.
Dysportia saavat antaa vain asianmukaisen koulutuksen saaneet lääkärit.
Laimennusohjeet koskevat nimenomaan 300 yksikön injektiopulloa. Näillä tilavuuksilla saadaan pitoisuudet, jotka soveltuvat käytettäviksi kuhunkin käyttöaiheeseen (lukuun ottamatta detrusorin neurogeenisesta yliaktiivisuudesta johtuvaa virtsainkontinenssia, johon on erillinen ohje; ks. kohta Käyttö- ja käsittelyohjeet).
Annos | Laimenninta*/ |
500 | 0,6 ml |
| 200 | 1,5 ml |
| 100 | 3 ml |
* Säilöntäaineeton 9 mg/ml (0,9 %) natriumkloridi-injektioneste, liuos
CP-lasten spastisuutta hoidettaessa annostus määritetään yksikköinä painokiloa kohti, joten liuosta on mahdollisesti laimennettava edelleen lopullisen injektiovolyymin saavuttamiseksi.
Kumikorkin paljastunut keskiosa puhdistetaan alkoholilla juuri ennen kuin kalvo lävistetään neulalla. Steriiliä 23 tai 25 G neulaa tulee käyttää.
Fokaalisen spastisuuden oireenmukainen hoito aikuisilla
Yläraajat
Annostus
Enimmäisannos kullakin hoitokerralla ei saa ylittää 1000:ta yksikköä annettaessa injektio käsivarren lihaksiin tai 1500:aa yksikköä annettaessa injektio myös olkapään lihaksiin.
Aloitus- ja jatkohoitokertojen annostus tulee sovittaa yksilöllisesti perustuen kohdelihasten kokoon, lukumäärään ja sijaintiin, spastisuuden vaikeusasteeseen, paikalliseen lihasheikkouteen, potilaan aiempaan hoitovasteeseen ja/tai mahdollisiin aiempiin botuliinitoksiini-tyyppi A-hemagglutiniinikompleksin aiheuttamiin haittavaikutuksiin. Kliinisissä tutkimuksissa annokset 500 yksikköä, 1000 yksikköä ja 1500 yksikköä jaettiin eri lihaksiin alla olevan taulukon mukaisesti. Jos injektioita annetaan muiden yläraajan lihasten lisäksi myös olkapään lihaksiin, voidaan käyttää yli 1000 yksikön annoksia ja enintään 1500 yksikön kokonaisannoksia kullakin hoitokerralla lääkärin harkinnan mukaan riippuen aiemmilla hoitokerroilla saadusta teho- ja turvallisuusvasteesta. Suositeltu kokonaisannos valittuihin olkapäälihaksiin on enintään 500 yksikköä.
Yhteen injektiokohtaan saa antaa enintään 1 ml liuosta. 1500 yksikön aloitusannosta ja yli 1500 yksikön Dysport-annoksia ei ole tutkittu yläraajojen spastisuuden hoidossa aikuisilla.
Lihas, johon injektio annetaan | Suositeltu Dysport-annos |
Flexor carpi radialis (FCR) | 100–200 |
Flexor carpi ulnaris (FCU) | 100–200 |
Flexor digitorum profundus (FDP) | 100–200 |
Flexor digitorum superficialis (FDS) | 100–200 |
Flexor pollicis longus | 100–200 |
Adductor pollicis | 25–50 |
Brachialis | 200–400 |
Brachioradialis | 100–200 |
Biceps brachii (BB) | 200–400 |
Pronator teres | 100–200 |
Triceps brachii (long head) | 150–300 |
Pectoralis major | 150–300 |
Subscapularis | 150–300 |
Latissimus dorsi | 150–300 |
Vaikka todellinen injektiokohdan sijainti voidaan määrittää palpaatiolla, injektiota ohjaavan tekniikan, kuten elektromyografian, sähköstimulaation tai ultraäänen käyttöä suositellaan injektiokohdan paikallistamiseen.
Dysport-hoito toistetaan, kun aiemman injektion teho heikkenee, mutta ei ennen kuin 12 viikon kuluttua aiemmasta injektiosta. Suurin osa kliinisiin tutkimuksiin osallistuneista potilaista sai jatkohoitoa viikoilla 12–16; eräillä potilailla vaste kesti kuitenkin pitempään, ts. 20 viikkoa. Lihasten spastisuuden aste ja tyyppi uuden injektion ajankohtana voi vaatia Dysport-annoksen ja kohdelihasten muuttamista. Kliinistä paranemista voidaan odottaa viikon kuluessa Dysport-annoksesta.
Alaraajat
Annostus
Yhdellä hoitokerralla lihaksiin voidaan antaa enintään 1500 yksikön annos. Aloitus- ja jatkohoitokertojen tarkka annostus tulee sovittaa yksilöllisesti perustuen kohdelihasten kokoon ja lukumäärään sekä spastisuuden vaikeusasteeseen. Paikallinen lihasheikkous ja potilaan aiempi hoitovaste on myös otettava huomioon. Kokonaisannos ei saa ylittää 1500 yksikköä. Yhteen injektiokohtaan saa antaa enintään 1 ml liuosta.
| Lihas | Suositeltu Dysport-annos (yksikköä) | Injektiokohtien lukumäärä lihasta kohden |
| Distaalinen | ||
| Leveä kantalihas (soleus) | 300–550 | 2–4 |
| Kaksoiskantalihas (gastrocnemius) | ||
| Sisempi pää | 100–450 | 1–3 |
| Ulompi pää | 100–450 | 1–3 |
| Takimmainen säärilihas (tibialis posterior) | 100–250 | 1–3 |
| Flexor digitorum longus | 50–200 | 1–2 |
| Flexor digitorum brevis | 50–200 | 1–2 |
| Flexor hallucis longus | 50–200 | 1–2 |
| Flexor hallucis brevis | 50–100 | 1–2 |
Lihasten spastisuuden aste ja tyyppi uuden injektion ajankohtana voi vaatia Dysport-annoksen ja kohdelihasten muuttamista.
Vaikka todellinen injektiokohdan sijainti voidaan määrittää palpaatiolla, injektiota ohjaavan tekniikan, kuten elektromyografian, sähköstimulaation tai ultraäänen käyttöä suositellaan injektiokohdan tarkkaan paikallistamiseen.
Dysport-hoito toistetaan 12–16 viikon välein tai tarvittaessa pidemmin välein kliinisten oireiden palautumisen mukaan, mutta ei ennen kuin 12 viikon kuluttua aiemmasta injektiosta.
Ylä- ja alaraajat
Jos samalla hoitokerralla on annettava hoitoa sekä ylä- että alaraajoihin, kuhunkin raajaan injisoitava Dysport-annos on sovitettava yksilöllisesti eikä kokonaisannosta 1500 yksikköä saa ylittää.
Iäkkäät potilaat (≥ 65-vuotiaat): Kliinisessä käytössä ei ole havaittu eroja vasteessa iäkkäiden ja nuorempien aikuispotilaiden välillä.
Antotapa
Hoidettaessa ylä- ja alaraajojen fokaalista spastisuutta aikuisilla Dysport 300 U kuiva-aine liuotetaan natriumkloridi-injektioliuokseen (0,9 %) niin, että saadaan liuos, joka sisältää Dysportia joko 100 yksikköä, 200 yksikköä tai 500 yksikköä millilitrassa. Dysport annetaan lihaksensisäisenä injektiona yllämainittuihin lihaksiin.
Fokaalinen spastisuus 2-vuotiailla tai sitä vanhemmilla lapsilla
Liikkumaan pystyvien CP-lasten spastisuudesta johtuvat alaraajojen toiminnalliset epämuodostumat
Annostus
Aloitus- ja jatkohoitokertojen annostus tulee sovittaa yksilöllisesti perustuen kohdelihasten kokoon, lukumäärään ja sijaintiin, spastisuuden vaikeusasteeseen, paikalliseen lihasheikkouteen, potilaan aiempaan hoitovasteeseen ja/tai mahdollisiin aiempiin botuliinitoksiinin aiheuttamiin haittavaikutuksiin.
Dysport-valmisteen kokonaisannos saa kullakin hoitokerralla olla enintään 15 yksikköä/kg hoidettaessa yhtä alaraajaa tai 30 yksikköä/kg hoidettaessa molempia alaraajoja. Lisäksi Dysport-valmisteen kokonaisannos kullakin hoitokerralla saa olla korkeintaan 1000 yksikköä tai 30 yksikköä/kg sen mukaan, kumpi annos on pienempi. Annettava kokonaisannos jaetaan alaraajan/alaraajojen hoidettavien spastisten lihasten kesken. Jos mahdollista, yhteen lihakseen annettava annos jaetaan useampiin, eri kohtiin annettaviin injektioihin. Yhteen injektiokohtaan saa antaa korkeintaan 0,5 ml Dysport-valmistetta. Katso suositeltu annostus seuraavasta taulukosta.
Lihas | Suositeltu annosväli lihasta kohden / alaraaja (yksikköä/painokilo) | Injektiokohtien lukumäärä lihasta kohden |
Distaalinen | ||
Kaksoiskantalihas (gastrocnemius) | 5–15 U/kg | Enintään 4 |
Leveä kantalihas (soleus) | 4–6 U/kg | Enintään 2 |
Takimmainen säärilihas | 3–5 U/kg | Enintään 2 |
Kokonaisannos | Enintään 15 U/kg/alaraaja | |
Vaikka todellinen injektiokohdan sijainti voidaan määrittää palpaatiolla, injektiota ohjaavan tekniikan, kuten elektromyografian, sähköstimulaation tai ultraäänen käyttöä suositellaan injektiokohdan paikallistamiseen.
Dysport-hoito toistetaan, kun aiemman injektion teho heikkenee, mutta ei ennen kuin 12 viikon kuluttua aiemmasta injektiosta. Suurin osa kliinisiin tutkimuksiin osallistuneista potilaista sai jatkohoitoa viikoilla 16–22; eräillä potilailla vaste kesti kuitenkin pitempään, ts. 28 viikkoa. Lihasten spastisuuden aste ja tyyppi uuden injektion ajankohtana voi vaatia Dysport-annoksen ja kohdelihasten muuttamista.
Toimenpide edellyttää yleensä sedaatiota ja paikallispuudutusta tai joskus jopa yleisanestesiaa. Toimenpiteen jälkeen käsitelty raaja saattaa tarvita immobilisaatiota, esim. kipsilastalla ad 3 viikkoa.
Oireiden voidaan odottaa lievittyvän kahden viikon kuluessa injektiosta.
Yläraajojen fokaalinen spastisuus CP-lapsilla
Annostus
Aloitus- ja jatkohoitokertojen annostus tulee sovittaa yksilöllisesti perustuen kohdelihasten kokoon, lukumäärään ja sijaintiin, spastisuuden vaikeusasteeseen, paikalliseen lihasheikkouteen, potilaan aiempaan hoitovasteeseen ja/tai mahdollisiin aiempiin botuliinitoksiinin aiheuttamiin haittavaikutuksiin.
Dysport-valmisteen maksimiannos saa kullakin hoitokerralla olla yhtä yläraajaa hoidettaessa enintään 16 yksikköä/kg tai 640 yksikköä sen mukaan, kumpi annos on pienempi. Molempia yläraajoja hoidettaessa Dysport-valmisteen maksimiannos saa kullakin hoitokerralla olla enintään 21 yksikköä/kg tai 840 yksikköä sen mukaan, kumpi annos on pienempi.
Annettava kokonaisannos jaetaan yläraajan/yläraajojen hoidettavien spastisten lihasten kesken. Yhteen injektiokohtaan saa antaa korkeintaan 0,5 ml Dysport-valmistetta. Katso suositeltu annostus seuraavasta taulukosta.
Dysport-annostus lihasta kohden yläraajan spastisuuden hoidossa lapsilla
Lihas | Suositeltu annosväli lihasta kohden / yläraaja (yksikköä/painokilo) | Injektiokohtien lukumäärä lihasta kohden |
Brachialis | 3–6 U/kg | Enintään 2 |
Brachioradialis | 1,5–3 U/kg | 1 |
Biceps brachii | 3–6 U/kg | Enintään 2 |
Pronator teres | 1–2 U/kg | 1 |
Pronator quadratus | 0,5–1 U/kg | 1 |
Flexor carpi radialis | 2–4 U/kg | Enintään 2 |
Flexor carpi ulnaris | 1,5–3 U/kg | 1 |
Flexor digitorum profundus | 1–2 U/kg | 1 |
Flexor digitorum superficialis | 1,5–3 U/kg | Enintään 4 |
Flexor pollicis brevis/ | 0,5–1 U/kg | 1 |
Adductor pollicis | 0,5–1 U/kg | 1 |
Kokonaisannos | Enintään 16 U/kg yhteen yläraajaan (ja enintään 21 U/kg annettaessa kumpaankin yläraajaan) | |
Vaikka todellinen injektiokohdan sijainti voidaan määrittää palpaatiolla, injektiota ohjaavan tekniikan, kuten elektromyografian, sähköstimulaation tai ultraäänen käyttöä suositellaan injektiokohdan paikallistamiseen.
Dysport-hoito toistetaan, kun aiemman injektion teho heikkenee, mutta ei ennen kuin 16 viikon kuluttua aiemmasta injektiosta. Suurin osa kliinisiin tutkimuksiin osallistuneista potilaista sai jatkohoitoa viikoilla 16–28; eräillä potilailla vaste kesti kuitenkin pitempään, ts. 34 viikkoa tai vieläkin kauemmin. Lihasten spastisuuden aste ja tyyppi uuden injektion ajankohtana voi vaatia Dysport-annoksen ja kohdelihasten muuttamista.
Alaraajan toiminnalliseen epämuodostumaan liittyvä fokaalinen spastisuus ja yläraajojen fokaalinen spastisuus CP-lapsilla
Annostus
Katso annostusohjeet sekä ylä- että alaraajan spastisuuden hoitoon 2-vuotiailla tai sitä vanhemmilla lapsilla kyseisen käyttöaiheen kohdalta eli yläraajojen fokaalinen spastisuus tai alaraajan toiminnalliseen epämuodostumaan liittyvä fokaalinen spastisuus CP-lapsilla. Injisoitava Dysportin kokonaisannos sekä ylä- että alaraajan hoidossa saa kullakin hoitokerralla olla enintään 30 yksikköä/kg tai 1000 yksikköä sen mukaan, kumpi annos on pienempi.
Sekä ylä- että alaraajan uusintahoitoa harkitaan, kun aiemman injektion teho heikkenee, mutta ei ennen kuin 12–16 viikon kuluttua aiemmasta hoitokerrasta. Uusintahoidon optimaalinen ajankohta valitaan yksilöllisen edistymisen ja hoitovasteen perusteella.
Antotapa
Hoidettaessa CP-lasten alaraajan toiminnalliseen epämuodostumaan liittyvää fokaalista spastisuutta tai yläraajan fokaalista spastisuutta tai näiden yhdistelmää, Dysport liuotetaan natriumkloridi-injektioliuokseen (0,9 %) (ks. myös kohta Käyttö- ja käsittelyohjeet) ja annetaan lihaksensisäisenä injektiona yllämainittuihin lihaksiin.
Spastinen tortikollis
Annostus
Suositellut annokset koskevat kaiken ikäisiä aikuisia potilaita edellyttäen, että he ovat normaalipainoisia ja ettei heillä ole merkkejä niskan lihasmassan vähentymisestä.
Pienempi annos voi olla tarpeen, jos potilas on huomattavan alipainoinen tai iäkäs potilas, jolla voi esiintyä lihasmassan vähentymistä.
Suositeltu alkuannos on 500 yksikköä jaettuna osiin ja injisoituna kahteen tai kolmeen aktiivisimmista kaulalihaksista (musculus longus colli).
Jatkohoidossa annokset voidaan sovittaa kliinisen vasteen ja havaittujen haittojen mukaan. Suositellut annokset ovat 250–1000 yksikköä, joskin suurimpiin annoksiin liittyy haittavaikutusten, erityisesti dysfagian, lisääntyminen. Suurin sallittu annos on 1000 yksikköä. Injektiot voidaan toistaa noin joka 16. viikko tai niin usein, että vaste säilyy, ei kuitenkaan useammin kuin joka 12. viikko.
Rotaatiotortikolliksen ollessa kyseessä annetaan 500 yksikköä injisoimalla 350 yksikköä pään ohjaslihakseen (musculus splenius capitis) samansuuntaisesti leuan/pään rotaation kanssa ja 150 yksikköä päänkiertäjälihaksen (musculus sternocleidomastoideus) rotaatiosuunnan vastaisesti.
Kun on kyseessä laterocollis, 500 yksikköä annostellaan injisoimalla 350 yksikköä samanpuoleiseen pään ohjaslihakseen (musculus splenius capitis) ja 150 yksikköä samanpuoleiseen päänkiertäjälihakseen (musculus sternocleidomastoideus).
Olkapään kohotukseen liittyvissä tapauksissa samanpuoleiset epäkäslihas (musculus trapezius) tai lapaluun kohottajalihas (musculus levator scapulae) voivat myös olla hoidon tarpeessa riippuen lihaksen näkyvästä hypertrofiasta tai elektromyografisista (EMG) löydöksistä. Kun injisoiminen on tarpeen kolmessa lihaksessa, annostellaan 500 yksikköä seuraavasti: 300 yksikköä pään ohjaslihakseen (musculus splenius capitis), 100 yksikköä päänkiertäjälihakseen (musculus sternocleidomastoideus) ja 100 yksikköä kolmanteen lihakseen.
Kun on kyseessä retrocollis, 500 yksikköä annostellaan injisoimalla 250 yksikköä kumpaankin pään ohjaslihakseen (musculus splenius capitis). Molemminpuolinen ohjaslihaksen (musculus splenius) injisointi voi lisätä niskalihaksen heikentymisen riskiä.
Kaikkiin muihin tortikollismuotoihin ja EMG:hen vaaditaan erikoislääkärin tietämystä aktiivisimpien lihasten tunnistamiseksi ja hoitamiseksi. EMG:tä on sovellettava kaikkien komplisoitujen tortikollismuotojen diagnosointiin ja ei-komplisoitujen tapausten uudelleenarviointiin silloin, kun hoitotulos ei ole ollut riittävä sekä injisointien ohjaamiseksi syviin lihaksiin tai kun on kyse ylipainoisista potilaista, joiden kaulalihakset ovat vain heikosti käsin tunnusteltavissa.
Lapset: Dysportin turvallisuutta ja tehoa spastisen tortikolliksen hoidossa lapsilla ei ole tutkittu.
Antotapa
Hoidettaessa spastista tortikollista Dysport 300 U kuiva-aine liuotetaan 0,6 ml:aan keittosuolaliuosta (0,9 %), jolloin saadaan liuos, joka sisältää 500 yksikköä/ml Dysportia. Dysport annetaan lihaksensisäisenä injektiona, kuten edellä hoidettaessa spastista tortikollista.
Detrusorin neurogeenisesta yliaktiivisuudesta johtuva virtsainkontinenssi
Annostus
Suositeltu annos on 600 yksikköä. Jos vaste ei ole riittävä tai jos taudinkuva on vaikea (esim. oireiden ja löydösten vaikeusasteen ja/tai urodynaamisten parametrien mukaan), voidaan käyttää 800 yksikön annosta.
Dysportia annetaan potilaille, jotka tekevät säännöllisesti puhtaita toistokatetrointeja.
Kokonaisannos jaetaan 30 injektioon, jotka annetaan virtsarakon seinämälihakseen tasaisin välein välttäen virtsarakon kolmiota. Dysport injisoidaan taipuisan tai jäykän kystoskoopin kautta noin 2 mm:n syvyyteen. Kuhunkin pistoskohtaan injisoidaan 0,5 ml. Viimeiseksi injisoidaan noin 0,5 ml 9 mg/ml (0,9 %) natriumkloridi-injektioliuosta, jotta varmistetaan koko annoksen antaminen.
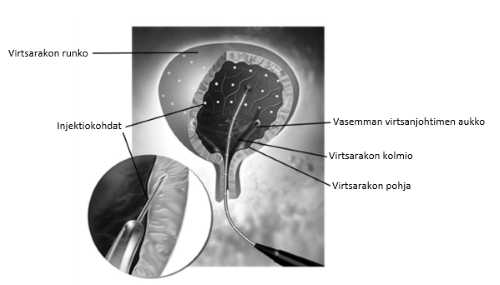
Antibioottiprofylaksi aloitetaan paikallisten suositusten ja ohjeiden mukaisesti tai kliinisissä tutkimuksissa käytetyllä tavalla (ks. kohta Farmakodynamiikka).
Veren hyytymistä estävien lääkevalmisteiden käyttö on keskeytettävä vähintään 3 vuorokautta ennen Dysportin injisointia, ja käytön saa aloittaa uudelleen vasta injektion annon jälkeisenä päivänä. Pienimolekyylistä hepariinia saa antaa 24 tuntia ennen Dysportin antoa, jos se on lääketieteellisesti aiheellista.
Ennen injektiota virtsaputkeen voidaan laittaa puudutetta tai liukastavaa geeliä helpottamaan kystoskoopin sisäänvientiä. Ennen injektiota voidaan tarvittaessa käyttää joko rakonsisäistä tippapuudutusta laimennetulla puudutusaineella (sedaation kanssa tai ilman) tai yleisanestesiaa. Tippapuudutusta käytettäessä puudutusliuos on dreneerattava ja rakko huuhdeltava 9 mg/ml (0,9 %) natriumkloridi-injektioliuoksella ja dreneerattava uudelleen ennen valmisteen injisointia virtsarakon seinämälihakseen.
Ennen injisointia virtsarakkoon tiputetaan riittävän visualisoinnin saavuttamiseksi tarvittava määrä 9 mg/ml (0,9 %) natriumkloridi-injektioliuosta.
Kun kaikki 30 injektiota on annettu, virtsarakon seinämän visualisointiin käytetty 9 mg/ml (0,9 %) natriumkloridi-injektioliuos dreneerataan. Potilasta tarkkaillaan vähintään 30 minuuttia injektion jälkeen.
Vaikutus alkaa yleensä 2 viikon kuluessa hoidosta. Dysport-hoito toistetaan, kun aiemman injektion teho heikkenee, mutta ei ennen kuin 12 viikon kuluttua aiemmasta injektiosta. Kliinisissä tutkimuksissa Dysportilla hoidetuilla potilailla aika uusintahoitoon (ks. kohta Farmakodynamiikka) oli 39–47 viikkoa (mediaani), mutta vaste voi kestää pidempäänkin, sillä yli 40 % potilaista ei saanut uusintahoitoa 48 viikkoon mennessä.
Lapset: Dysportin turvallisuutta ja tehoa lasten (alle 18-vuotiaiden) detrusorin neurogeenisesta yliaktiivisuudesta johtuvan virtsainkontinenssin hoidossa ei ole varmistettu.
Antotapa
Dysport annetaan injektiona virtsarakon seinämälihakseen edellä kuvatun mukaisesti.
Hoidettaessa detrusorin neurogeenisesta yliaktiivisuudesta johtuvaa virtsainkontinenssia Dysport liuotetaan natriumkloridi-injektioliuokseen (0,9 %) niin, että saadaan 15 ml liuosta, joka sisältää joko 600 yksikköä tai 800 yksikköä. Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet lääkevalmisteen saattamisesta käyttökuntoon.
Blefarospasmi ja hemifasiaalispasmi
Annostus
Kliinisissä tutkimuksissa, joissa hyvänlaatuista essentiaalia blefarospasmia (BEB) hoidettiin Dysportin eri annoksilla, 40 yksikköä silmää kohti oli merkitsevästi tehokas annos. Annos 80 yksikköä silmää kohti johti pidempään vaikutusaikaan. Kuitenkin haittavaikutusten, erityisesti ptoosin, esiintyvyys oli suhteessa annokseen. Blefarospasmin ja hemifasiaalispasmin hoidossa enimmäisannos saa olla korkeintaan 120 yksikköä silmää kohti.
10 yksikön (0,05 ml) injektio tulee antaa mediaalisesti ja 10 yksikön (0,05 ml) injektio lateraalisesti molempien silmien sekä ylemmän (3 ja 4) että alemman (5 ja 6) kehälihaksen (m. orbicularis oculi) preseptaali- ja orbitaalialueen väliseen liittymäkohtaan.
Ptoosin riskin vähentämiseksi injektioiden antamista yläluomen kohottajalihaksen lähelle tulee välttää.
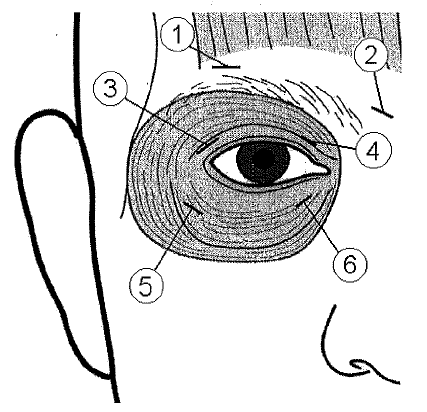
Yläluomeen annettavat injektiot tulee suunnata luomen keskiosasta poispäin kohottajalihakseen osumisen välttämiseksi. Kuva auttaa havainnollistamaan näiden injektioiden antokohtia. Oireiden lievittymisen voidaan odottaa alkavan 2–4 päivän kuluessa ja maksimivaikutus saavutetaan kahden viikon kuluessa.
Injektioiden anto tulee toistaa noin joka 12. viikko tai niin usein, kun sen on tarpeen oireiden uusiutumisen estämiseksi, mutta ei useammin kuin joka 12. viikko. Jos annoksia annetaan näin usein, mutta vaste hoidon alussa ei riitä, annosta silmää kohden voidaan joutua suurentamaan 60 yksikköön: 10 yksikköä (0,05 ml) mediaalisesti ja 20 yksikköä (0,1 ml) lateraalisesti, tai 80 yksikköön: 20 yksikköä (0,1 ml) mediaalisesti ja 20 yksikköä (0,1 ml) lateraalisesti tai enintään 120 yksikköön: 20 yksikköä (0,1 ml) mediaalisesti ja 40 yksikköä (0,2 ml) lateraalisesti kummankin silmän ylä- ja alapuolelle aiemmin kuvatulla tavalla. Injektioita voidaan lisäksi antaa otsalihakseen kulmakarvojen yläpuolelle (1 ja 2), jos spasmit tällä alueella häiritsevät näköä.
Toispuoleisessa blefarospasmissa injektiot tulee antaa vain sairaaseen silmään. Hemifasiaalinen spasmi tulee hoitaa samalla tavoin kuin toispuoleinen blefarospasmi. Suositusannokset sopivat kaiken ikäisille aikuisille, myös iäkkäille.
Lapset: Dysportin turvallisuutta ja tehoa blefarospasmin ja hemifasiaalisen spasmin hoidossa lapsilla ei ole osoitettu.
Antotapa
Hoidettaessa blefarospasmia ja hemifasiaalista spasmia Dysport 300 U kuiva-aine liuotetaan 1,5 millilitraan natriumkloridi-injektiota (0,9 %) niin, että saadaan Dysportia 200 yksikköä millilitrassa sisältävä liuos. Dysport annetaan ihonalaisena injektiona mediaalisesti ja lateraalisesti silmien ylemmän ja alemman kehälihaksen preseptaali- ja orbitaalikohtien liittymäkohtaan.
Kainaloiden liikahikoilu
Annostus
Suositeltu aloitusannos on 100 yksikköä kainaloa kohti. Jos toivottua vaikutusta ei saavuteta, annos voidaan seuraavilla pistoskerroilla nostaa 200 yksikköön kainaloa kohti. Pistosalue tulee määrittää etukäteen jodivärjäyksellä. Molemmat kainalot puhdistetaan ja desinfioidaan. Kumpaankin kainaloon pistetään intradermaalisesti kymmeneen kohtaan 10 yksikköä eli 100 yksikköä kainaloa kohti. Paras teho saavutetaan kahden viikon kuluessa. Suositellulla annoksella saavutetaan useimmissa tapauksissa riittävä hikoilun esto 48 viikon ajaksi. Jatkohoidon ajankohta on arvioitava yksilöllisesti, kun potilaan hieneritys on palautunut normaalille tasolle, ei kuitenkaan ennen kuin 12 viikkoa on kulunut edellisestä hoitokerrasta. Toistuvien annosten kumulatiivisesta vaikutuksesta on jonkin verran viitteitä, joten kunkin potilaan hoitoajankohta on arvioitava yksilöllisesti. Enimmäisannos ei saa ylittää 200 yksikköä kainaloa kohden.
Lapset: Dysportin turvallisuutta ja tehoa kainaloiden liikahikoilun hoidossa lapsilla ei ole tutkittu.
Antotapa
Hoidettaessa kainaloiden liikahikoilua Dysport 300 U kuiva-aine laimennetaan 1,5 ml:aan NaCl (0,9 %), jolloin liuoksessa on Dysportia 200 yksikköä per ml. Dysport annostellaan intradermaalisesti kymmeneen kohtaan per kainalo.
Vasta-aiheet
- Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
- Virtsatieinfektio hoidettaessa detrusorin neurogeenisesta yliaktiivisuudesta johtuvaa virtsainkontinenssia.
Varoitukset ja käyttöön liittyvät varotoimet
Haittavaikutuksia, jotka aiheutuvat toksiinin vaikutuksen leviämisestä kauas antopaikasta, on raportoitu (ks. kohta Haittavaikutukset). Hoitoannoksia saavilla potilailla saattaa esiintyä liiallista lihasheikkoutta. Tämänkaltaisten haittojen esiintymisen vaaraa saatetaan vähentää käyttämällä pienintä mahdollista tehokasta annosta ja olemalla ylittämättä suositeltuja enimmäisannoksia.
Botuliinitoksiini A:n tai B:n annon jälkeen on raportoitu hyvin harvoja kuolemantapauksia, jotka silloin tällöin esiintyivät dysfagian tai pneumopatian (mukaan lukien, mutta ei näihin rajoittuen: hengenahdistus, hengityksen vajaatoiminta, hengityksen pysähtyminen) yhteydessä ja/tai potilailla, joilla on ollut merkittävä astenia.
Potilailla, joilla on heikentyneeseen hermo-lihasjohtumiseen tai nielemis- tai hengitysvaikeuksiin johtavia häiriöitä, on suurempi riski näille vaikutuksille. Näille potilaille hoitoa saa antaa vain erikoislääkärin valvonnassa ja vain, jos hoidosta saatava hyöty ylittää siitä aiheutuvan riskin.
Dysportia on annettava varoen potilaille, joilla on jo ennestään esiintynyt nielemis- tai hengitysvaikeuksia, sillä nämä vaikeudet voivat pahentua toksiinin vaikutuksen levitessä tärkeisiin lihaksiin. Aspiraatiota on ilmennyt harvoin, ja se on riski hoidettaessa potilaita, joilla on krooninen hengitysteiden sairaus.
Dysportia on aina käytettävä varoen ja huolellisessa valvonnassa potilailla, joilla on subkliinisiä tai kliinisiä merkkejä huomattavasta hermoimpulssin siirtymisen heikentymisestä hermo-lihasliitoksessa (esimerkiksi myasthenia gravis). Tällaiset potilaat voivat olla erityisen herkkiä Dysportin kaltaisille valmisteille, mikä voi johtaa yhä suurempaan lihasheikkouteen.
Suositeltua Dysportin annostusta ja annostiheyttä ei saa ylittää (ks. kohta Annostus ja antotapa).
Potilaita ja heistä huolehtivia henkilöitä tulee varoittaa siitä, että potilas tarvitsee ehdottomasti välitöntä lääkärinhoitoa, jos hänellä ilmenee nielemis-, puhe- tai hengityshäiriöitä.
Varovaisuutta on noudatettava hoidettaessa alaraajojen fokaalista spastisuutta aikuisilla, etenkin iäkkäillä potilailla, joilla voi olla suurentunut kaatumisen riski.
Lumekontrolloiduissa kliinisissä tutkimuksissa, joissa hoidettiin potilaiden alaraajojen spastisuutta, kaatumisia ilmeni 9,4 %:lla (Dysport 1000 yksikköä), 6,3 %:lla (Dysport 1500 yksikköä) ja 3,7 %:lla potilaista (lumelääke).
Silmien kuivuutta on raportoitu käytettäessä Dysportia silmänympärysalueille (ks. kohta Haittavaikutukset). Tähän haittavaikutukseen on tärkeä kiinnittää huomiota, sillä silmien kuivuus voi altistaa sarveiskalvon häiriöille. Suojaavat tipat, voiteet tai silmän sulkeminen silmäpeitteellä tai muulla tavoin voivat olla tarpeen sarveiskalvon häiriöiden estämiseksi.
Dysportia ei saa käyttää spastisuuden hoitoon potilaille, joille on kehittynyt pysyvä kontraktuura.
Kuten mitä tahansa lihaksensisäistä injektiota annettaessa, Dysportia tulisi käyttää vain, jos se on ehdottoman välttämätöntä potilailla, joilla on pidentynyt vuotoaika tai infektio tai inflammaatio injektiokohdassa.
Dysportia on käytettävä varoen, jos kohdelihaksessa on atrofiaa. Botuliinitoksiinin käytön jälkeen on raportoitu lihasatrofiaa (ks. kohta Haittavaikutukset).
Hoidettaessa detrusorin neurogeenista yliaktiivisuutta toimenpiteeseen voi liittyä autonomista dysrefleksiaa. Välitön lääkärinhoito voi olla tarpeen.
Dysport on tarkoitettu vain yhden potilaan yhteen käsittelyyn. Käyttämättä jäänyt valmiste tulee hävittää kappaleen Erityiset varotoimet hävittämiselle ja muut käsittelyohjeet ohjeiden mukaisesti. Erityistä varovaisuutta tulee noudattaa valmisteen käyttövalmiiksi saattamisessa ja annossa; käyttämättä jääneen liuoksen inaktivointi ja hävittäminen (ks. kohta Erityiset varotoimet hävittämiselle ja muut käsittelyohjeet).
Spastisessa tortikolliksessa nielemishäiriöt ovat suhteessa annokseen ja niitä esiintyi useimmiten, kun injektio oli annettu päänkiertäjälihakseen. Pehmeä ruokavalio voi olla tarpeen, kunnes oireet häviävät.
Tämä tuote sisältää pienen määrän humaanialbumiinia. Virusinfektion riskiltä ei voida ehdottoman varmasti välttyä ihmisverta tai verituotteita käytettäessä.
Botuliinitoksiinin neutraloivien vasta-aineiden muodostusta on todettu harvoin potilailla, jotka ovat saaneet Dysportia. Neutraloivien vasta-aineiden muodostumista voidaan epäillä kliinisesti, kun hoitovaste huonontuu huomattavasti tai jos tarvitaan jatkuvasti suurempia annoksia.
Pediatrinen käyttö
CP-lasten spastisuutta hoidettaessa Dysportia tulisi käyttää vain vähintään 2-vuotiailla lapsilla. Markkinoille tulon jälkeen on hyvin harvoin ilmoitettu mahdollisesta toksiinin laajalle leviämisestä lapsilla, joilla on muita sairauksia, useimmiten CP-vamma. Yleensä näissä tapauksissa on käytetty annosta, joka oli suositeltua annosta suurempi (ks. kohta Haittavaikutukset).
Botuliinitoksiinihoidon jälkeen tapahtuneita kuolemantapauksia, joihin joskus on liittynyt aspiraatiopneumonia, on ilmoitettu harvinaisina lapsilla, joilla on ollut vakava CP-vamma. Näihin tapauksiin sisältyy myös indikaatioista poikkeava käyttö (esim. käyttö niskan alueella). Lapsia, joilla on merkittävä neurologinen vamma, dysfagia, tai äskettäinen aspiraatiopneumonia tai keuhkosairaus, tulee hoitaa erittäin varoen. Hoitoa tulisi antaa huonokuntoisille potilaille vain, jos kyseiselle potilaalle mahdollisesti koituvan hyödyn arvioidaan olevan suurempi kuin hoitoon liittyvät vaarat.
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Yhteisvaikutukset
Hermo-lihasliitokseen suorasti tai epäsuorasti vaikuttavat lääkkeet voivat lisätä botuliinitoksiinin vaikutuksia, ja näitä lääkkeitä tulee käyttää varoen potilailla, joita hoidetaan botuliinitoksiinilla. Sama pätee polymysiineihin, tetrasykliineihin ja linkomysiiniin. Lihasrelaksantteja tulee myös käyttää varoen; esimerkiksi aloitusannosta voidaan pienentää tai voidaan käyttää lyhytkestoisempaa valmistetta.
Raskaus ja imetys
Raskaus
Clostridium botulinum toksiini tyyppi A -hemagglutiniini-kompleksin käytöstä raskaana olevilla naisilla on vain vähän kokemusta. Eläintutkimukset eivät viittaa suoriin tai epäsuoriin haitallisiin vaikutuksiin ajatellen raskautta, alkion/sikiön kehitystä, synnytystä tai syntymän jälkeistä kehitystä, muutoin kuin suurilla annoksilla, jotka aiheuttavat toksisia vaikutuksia äidille (ks. kohta Prekliiniset tiedot turvallisuudesta).
Dysportia tulisi käyttää raskauden aikana vain, jos hyöty ylittää mahdollisen sikiöön kohdistuvan riskin. Varovaisuutta tulee noudattaa, jos lääkettä määrätään raskaana oleville naisille.
Imetys
Ei tiedetä, erittyykö Clostridium botulinum toksiini tyyppi A -hemagglutiniini-kompleksi äidinmaitoon. Clostridium botulinum toksiini tyyppi A -hemagglutiniini-kompleksin erittymistä maitoon ei ole tutkittu eläimillä. Clostridium botulinum toksiini tyyppi A -hemagglutiniini-kompleksin käyttöä ei voi suositella imetyksen aikana.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
On olemassa lihasheikkouden ja näköhäiriöiden mahdollinen vaara, joka esiintyessään voi väliaikaisesti heikentää ajokykyä tai koneidenkäyttökykyä.
Haittavaikutukset
Hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1000, < 1/100), harvinainen (≥ 1/10000, < 1/1000), hyvin harvinainen (< 1/10000), tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Noin 28 % kliinisissä tutkimuksissa Dysportilla hoidetuista potilaista sai haittavaikutuksia.
Yleistä
Seuraavia haittavaikutuksia esiintyi potilailla, joita hoidettiin eri indikaatioissa, mukaan lukien blefarospasmi, hemifasiaalispasmi, tortikollis, CP-vammaan liittyvä spastisuus, yläraajojen ja alaraajojen spastisuus aikuisilla, kainaloiden liikahikoilu ja detrusorin neurogeenisesta yliaktiivisuudesta johtuva virtsainkontinenssi.
Haittavaikutuksia, jotka aiheutuvat toksiinin vaikutuksen leviämisestä kauas injektiopaikasta, on raportoitu hyvin harvoin (liiallinen lihasheikkous, dysfagia, aspiraatiopneumonia, joka voi johtaa kuolemaan) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Elinjärjestelmä | Yleisyys | Haittavaikutus |
Hermosto | Harvinainen | Neuralginen amyotrofia |
Iho ja ihonalainen kudos | Melko harvinainen | Kutina |
Harvinainen | Ihottuma | |
Yleisoireet ja antopaikassa todettavat haitat | Yleinen | Voimattomuus, väsymys, influenssan kaltaiset oireet ja injektiokohdan kipu/mustelmat |
Lisäksi seuraavia eri käyttöaiheille tyypillisiä haittavaikutuksia raportoitiin:
Fokaalisen spastisuuden oireenmukainen hoito aikuisilla
Yläraajat
Seuraavia haittavaikutuksia esiintyi aikuispotilailla, joita hoidettiin Dysportilla käyttöaiheessa yläraajojen spastisuuden oireenmukainen hoito.
Elinjärjestelmä | Yleisyys | Haittavaikutus |
Hengityselimet, rintakehä ja välikarsina | Yleinen | Hengenahdistus |
Ruoansulatuselimistö | Melko harvinainen | Dysfagia* |
Luusto, lihakset ja sidekudos | Yleinen | Lihasheikkous, muskuloskeletaalinen kipu, raajakipu |
Yleisoireet ja antopaikassa todettavat haitat | Yleinen | Kuten on odotettavissa minkä tahansa injektion yhteydessä, injektiokohdan reaktioita (esim. kipua, eryteemaa, turvotusta jne.) on raportoitu injektion jälkeen, astenia, väsymys, influenssan kaltaiset oireet. |
* Dysfagian yleisyys johdettiin avointen tutkimusten yhdistetyistä tiedoista. Dysfagiaa ei todettu käyttöaiheessa yläraajojen spastisuuden oireenmukainen hoito aikuisilla tehdyissä kaksoissokkoutetuissa tutkimuksissa.
Alaraajat
Seuraavia haittavaikutuksia esiintyi aikuispotilailla, joita hoidettiin Dysportilla käyttöaiheessa alaraajojen spastisuuden oireenmukainen hoito.
Elinjärjestelmä | Yleisyys | Haittavaikutus |
Ruoansulatuselimistö | Yleinen | Dysfagia |
Luusto, lihakset ja sidekudos | Yleinen | Lihasheikkous, lihaskivut |
Yleisoireet ja antopaikassa todettavat haitat | Yleinen | Astenia, väsymys, influenssan kaltainen sairaus, injektiokohdan reaktiot (kipu, mustelmat, ihottuma, kutina) |
Vammat, myrkytykset ja hoitokomplikaatiot | Yleinen | Kaatuminen |
Ylä- ja alaraajojen samanaikaiseen hoitoon Dysportilla kokonaisannoksella enintään 1500 yksikköä ei liity turvallisuutta koskevia löydöksiä niiden lisäksi, joita on odotettavissa annettaessa hoitoa vain ylä- tai alaraajojen lihaksiin.
Fokaalinen spastisuus 2-vuotiailla tai sitä vanhemmilla CP-lapsilla
Liikkumaan pystyvien CP-lasten alaraajojen toiminnalliset epämuodostumat
Seuraavia haittavaikutuksia esiintyi lapsilla, joita hoidettiin Dysportilla käyttöaiheessa lasten CP-vammaan liittyvä jalkojen spastisuus.
Elinjärjestelmä | Yleisyys | Haittavaikutus |
Luusto, lihakset ja sidekudos | Yleinen | Lihaskivut, lihasheikkous |
Munuaiset ja virtsatiet | Yleinen | Virtsainkontinenssi |
Yleisoireet ja antopaikassa todettavat haitat | Yleinen | Influenssan kaltaiset oireet, injektiokohdan reaktiot (esim. kipu, punoitus ja mustelmat), kävelyvaikeudet, väsymys |
Melko harvinainen | Voimattomuus | |
Vammat, myrkytykset ja hoitokomplikaatiot | Yleinen | Kaatuminen |
Yläraajat CP-lapsilla
Elinjärjestelmä | Yleisyys | Haittavaikutus |
Luusto, lihakset ja sidekudos | Yleinen | Lihasheikkous, lihaskivut |
Yleisoireet ja antopaikassa todettavat haitat | Yleinen | Influenssan kaltaiset oireet, väsymys, injektiokohdan reaktiot (ekseema, mustelmat, kipu, turvotus, ihottuma) |
Melko harvinainen | Voimattomuus | |
Iho ja ihonalainen kudos | Yleinen | Ihottuma |
Liikkumaan pystyvien CP-lasten alaraajojen toiminnallisten epämuodostumien ja yläraajojen samanaikainen hoito
Tietoja lumelääkekontrolloiduista kliinisistä tutkimuksista ei ole saatavilla. Olemassa olevan tiedon perusteella hoitoon liittyvien haittavaikutusten määrä ei ole suurempi kuin hoidettaessa pelkästään yläraajan tai alaraajan lihaksia, kun käytetään annoksia, jotka ovat enintään 30 yksikköä/kg tai 1000 yksikköä sen mukaan, kumpi on pienempi.
Spastinen tortikollis
Seuraavia haittavaikutuksia esiintyi potilailla, joita hoidettiin Dysportilla käyttöaiheessa spastinen tortikollis.
Elinjärjestelmä | Yleisyys | Haittavaikutus |
Hermosto | Yleinen | Päänsärky, huimaus, kasvohermohalvaus |
Silmät | Yleinen | Näön hämärtyminen, näöntarkkuuden heikkeneminen |
Melko harvinainen | Diplopia, ptoosi | |
Hengityselimet, rintakehä ja välikarsina | Yleinen | Dysfonia, hengenahdistus |
Harvinainen | Aspiraatio | |
Ruoansulatuselimistö | Hyvin yleinen | Nielemishäiriöt, kuiva suu |
Melko harvinainen | Pahoinvointi | |
Luusto, lihakset ja sidekudos | Hyvin yleinen | Lihasheikkous |
Yleinen | Niskakipu, luu- ja lihaskivut, lihaskivut, raajakipu, jäykkyys | |
Melko harvinainen | Lihasatrofia, leuan toiminnanhäiriö |
Spastisessa tortikolliksessa nielemishäiriöt ovat suhteessa annokseen ja niitä esiintyi useimmiten, kun injektio oli annettu päänkiertäjälihakseen. Pehmeä ruokavalio voi olla tarpeen, kunnes oireet häviävät, ks. kohta Varoitukset ja käyttöön liittyvät varotoimet.
Detrusorin neurogeenisesta yliaktiivisuudesta johtuva virtsainkontinenssi
Elinjärjestelmä | Yleisyys | Haittavaikutus |
Infektiot | Yleinen | Virtsatieinfektioa,b, bakteriuriaa |
Hermosto | Yleinen | Päänsärky |
Melko harvinainen | Hypestesia | |
Ruoansulatuselimistö | Yleinen | Ummetus |
Luusto, lihakset ja sidekudos | Melko harvinainen | Lihasheikkous |
Munuaiset ja virtsatiet | Yleinen | Hematuriaa |
Melko harvinainen | Virtsaumpic, verenvuoto virtsaputkesta, verenvuoto virtsarakosta | |
Sukupuolielimet ja rinnat | Yleinen | Erektiohäiriö |
Yleisoireet ja antopaikassa todettavat haitat | Yleinen | Kuume |
Melko harvinainen | Virtsarakon kipua | |
Vammat, myrkytykset ja hoitokomplikaatiot | Melko harvinainen | Autonominen dysrefleksiaa |
a Voi liittyä toimenpiteeseen
b Kaksoissokkoutetuissa, lumekontrolloiduissa avaintutkimuksissa virtsatieinfektioita raportoitiin kahden ensimmäisen viikon aikana hoidon jälkeen 4 %:lla Dysportia saaneista potilaista ja 6,2 %:lla lumelääkettä saaneista potilaista. Virtsatieinfektio voi johtaa pyelonefriittiin.
c Voi ilmetä, jos potilas ei katetroi riittävän säännöllisesti
Blefarospasmi ja hemifasiaalispasmi
Seuraavia haittavaikutuksia esiintyi potilailla, joita hoidettiin Dysportilla käyttöaiheessa blefarospasmi tai hemifasiaalispasmi.
Elinjärjestelmä | Yleisyys | Haittavaikutus |
Hermosto | Yleinen | Kasvopareesi |
Melko harvinainen | Seitsemännen aivohermon halvaus | |
Silmät | Hyvin yleinen | Ptoosi |
Yleinen | Diplopia, silmien kuivuus, lisääntynyt kyynelnesteen eritys | |
Harvinainen | Silmälihashalvaus | |
Iho ja ihonalainen kudos | Yleinen | Silmäluomien turvotus |
Harvinainen | Silmäluomen reunan sisäänkääntymä |
Haittavaikutukset voivat johtua Dysportin syvästä tai väärään kohtaan annetusta injektiosta, jonka seurauksena on ohimenevä lähilihasten halvaantuminen.
Kainaloiden liikahikoilu
Seuraavia haittavaikutuksia esiintyi potilailla, joita hoidettiin Dysportilla käyttöaiheessa kainaloiden liikahikoilu.
Elinjärjestelmä | Yleisyys | Haittavaikutus |
Hermosto | Melko harvinainen | Huimaus, tuntoharhat, päänsärky, silmäluomen tahdosta riippumattomat lihassupistukset |
Verisuonisto | Melko harvinainen | Punoitus |
Hengityselimet, rintakehä ja välikarsina | Yleinen | Hengenahdistus |
Melko harvinainen | Nenäverenvuoto | |
Iho ja ihonalainen kudos | Yleinen | Hikoilun lisääntyminen muilla ihoalueilla |
Luusto, lihakset ja sidekudos | Yleinen | Kipu hartiaseudussa, käsivarren yläosassa tai niskassa, olkapään ja pohkeen lihaskipu |
Myyntiluvan saamisen jälkeinen kokemus
Valmistajalle myyntiluvan saamisen jälkeisen käytön aikana ilmoitettujen haittavaikutusten profiili kuvastaa valmisteen farmakologisia vaikutuksia ja kliinisten tutkimusten aikana havaittuja haittavaikutuksia.
Elinjärjestelmä | Yleisyys | Haittavaikutus |
Immuunijärjestelmä | Tuntematon | Yliherkkyys |
Hermosto | Tuntematon | Hypestesia |
| Luusto, lihakset ja sidekudos | Tuntematon | Lihasatrofia |
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty‐haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 Fimea
Yliannostus
Suuret annokset voivat aiheuttaa huomattavaa neuromuskulaarista halvausta kaukana antopaikasta. Yliannostus voi johtaa lisääntyneeseen riskiin neurotoksiinin kulkeutumiselle verenkiertoon, mikä voi johtaa komplikaatioihin, joihin liittyy oraalisen botuliinimyrkytyksen vaikutuksia (esim. dysfagia ja dysfonia).
Hengitystoimintojen ylläpitäminen voi olla tarpeen, jos liian suuret annokset aiheuttavat hengityslihasten halvaantumisen.
Yleistä supportiivista hoitoa suositellaan. Yliannostustapauksessa potilasta tulee tarkkailla huomattavan lihasheikkouden tai lihashalvauksen löydösten ja/tai oireiden varalta. Oireenmukaista hoitoa tulee antaa tarvittaessa.
Yliannostuksen oireet eivät esiinny välttämättä heti injektion jälkeen. Tahattoman injektion tai suun kautta ottamisen jälkeen potilasta tulisi tarkkailla lääketieteellisesti useiden viikkojen ajan huomattavan lihasheikkouden ja/tai lihashalvauksen löydösten ja/tai oireiden varalta.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Muut perifeerisesti vaikuttavat lihasrelaksantit.
ATC-koodi: M03AX01
Clostridium botulinum A-tyypin toksiinin ja hemagglutiinin yhdiste salpaa perifeerisen kolinergisen hermoimpulssin siirron hermo-lihasliitoksessa vaikuttamalla presynaptisesti asetyylikoliinin vapautumiseen. Toksiini vaikuttaa hermopäätteessä estämällä niitä kalsiumin säätelemiä prosesseja, joiden seurauksena välittäjäaineet vapautuvat. Sillä ei ole vaikutusta postganglionaariseen kolinergiseen tai sympaattiseen hermoimpulssin siirtoon.
Toksiinin vaikutukseen liittyy aluksi sitoutumisvaihe, jolloin toksiini kiinnittyy nopeasti presynaptiseen hermokalvoon. Tämän jälkeen seuraa internalisaatiovaihe, jolloin toksiini läpäisee presynaptisen kalvon aiheuttamatta halvausta. Lopulta toksiini estää asetyylikoliinin vapautumista keskeyttämällä Ca2+:n välittämän, asetyylikoliinin vapautumiseen liittyvän mekanismin ja vähentäen täten päätelevypotentiaalia ja aiheuttaen halvauksen.
Impulssin siirron toipuminen tapahtuu vähitellen, kun uusia hermopäätteitä syntyy ja saadaan yhteys postsynaptiseen motoriseen päätelevyyn. Koe-eläimeltä kuluu tähän prosessiin 6-8 viikkoa.
Detrusorin neurogeenisen yliaktiivisuuden hoidossa virtsarakon seinämälihakseen injisoinnin jälkeen toksiini vaikuttaa detrusorin aktiivisuuteen estämällä asetyylikoliinin vapautumista efferenteistä radoista. Lisäksi toksiini saattaa estää afferentteja hermovälittäjäaineita ja sensorisia hermoratoja.
Fokaalisen spastisuuden oireenmukainen hoito aikuisilla
Yläraajat
Dysportin tehoa ja turvallisuutta yläraajojen spastisuuden hoidossa tutkittiin satunnaistetussa, kaksoissokkoutetussa, lumelääkekontrolloidussa monikeskustutkimuksessa, johon osallistui 238 potilasta (Dysport-hoito 159 ja lumelääke 79), joilla oli yläraajojen spastisuutta vähintään 6 kuukautta aivohalvauksen tai traumaperäisen aivovaurion jälkeen. Spastisuus johtui tässä tutkimuksessa aivohalvauksesta 90,3 %:lla tutkittavista ja traumaperäisestä aivovauriosta 9,7 %:lla tutkittavista.
Ensisijainen tehoa kuvannut muuttuja oli primaarisen kohdelihasryhmän (PTMG) lihastonus viikolla 4 mitattuna MAS-asteikolla (Modified Ashworth Scale) ja ensimmäinen toissijainen muuttuja oli hoitovasteen PGA (Physician Global Assessment). Pääasialliset tulokset viikoilla 4. ja 12. on lueteltu alla:
Viikko 4 | Viikko 12 | |||||
Lumelääke | Dysport | Dysport | Lumelääke | Dysport | Dysport | |
PTMG lihastonuksen keskimääräinen*** muutos lähtötasosta MAS-pisteinä | -0,3 | -1,2** | -1,4** | -0,1 | -0,7** | -0,8** |
Keskimäärinen PGA hoitovaste*** | 0,7 | 1,4* | 1,8** | 0,4 | 0,5 | 1,0* |
Ranteen flexor-lihastonuksen keskimääräinen*** muutos lähtötasosta MAS-pisteinä | -0,3 | -1,4** | -1,6** | -0,3 | -0,7* | -0,9* |
Sormen flexor-lihastonuksen keskimääräinen*** muutos lähtötasosta MAS-pisteinä | -0,3 | -0,9* | -1,2** | -0,1 | -0,4* | -0,6* |
Kyynärpään flexor-lihastonuksen keskimääräinen*** muutos lähtötasosta MAS-pisteinä | -0,3 | -1,0* | -1,2** | -0,3 | -0,7* | -0,8* |
Olkapään extensor-lihastonuksen keskimääräinen muutos lähtötasosta MAS-pisteinä (1) | -0,4 | -0,6 | -0,7 | 0,0 | -0,9 | 0,0 |
* p < 0,05; ** p < 0,0001; | ||||||
Toimintavajauksen hoidon tehon tutkimuksissa käytettiin DAS-asteikkoa (Disability Assessment Scale).
Toinen toissijainen muuttuja oli DAS-asteikolla mitattavan hoidon päätavoitteen (Principal Target of Treatment, PPT) keskimääräinen muutos lähtötasosta. DAS-asteikolla mitattavan hoidon päätavoitteen keskimääräisen muutoksen lähtötasosta havaittiin viikolla 4 parantuneen jonkin verran Dysport-hoitoa saaneissa ryhmissä verrattuna lumelääkeryhmään, mutta muutos ei ollut tilastollisesti merkitsevä. Kolmas muuttuja oli DAS-asteikolla mitattavan hoidon päätavoitteen (hoitoaikeen mukainen potilasjoukko) pisteytyksen perusteella vasteen saaneet potilaat (vaikeusasteen väheneminen vähintään yhdellä vaikeusasteluokalla). Analyysin tulokset esitetään alla:
Hoitoryhmä | Viikko 4 | Viikko 12 |
Dysport 500 U | 50,0 | 41,3 |
Dysport 1000 U | 62,0 | 55,7 |
Lumelääke | 39,2 | 32,9 |
* DASin määrittelyjoukot: hygienia, raajojen asento, pukeutuminen ja kipu.
Sekä 500 yksikköä että 1000 yksikköä saivat aikaan tilastollisesti merkitsevän parannuksen spastisuuskulmassa ja spastisuusasteessa Tardieu-asteikolla mitattuna viikolla 4 kaikissa lihasryhmissä (sormen, ranteen tai kyynärpään koukistajat) verrattuna lumelääkkeeseen. Spastisuusasteen pieneneminen oli myös merkitsevä viikolla 12 kaikissa lihasryhmissä 1000 yksikön annoksella verrattuna lumelääkkeeseen.
Dysport 1000 U paransi tilastollisesti merkitsevästi liikeaktiivisuutta (AROM, active range of motion) kliinisesti merkittävällä erolla kyynärpään (+18,3 astetta), ranteen (+35,2 astetta) ja sormien lihaksissa (+11,8 astetta) viikolla 4, kun taas lumelääkeryhmässä ei havaittu parannusta. Dysport 500 U:lla saatiin samanlainen aktiivisuuden parannus sormien lihaksissa.
Parannus koehenkilön lastan käytössä oli tilastollisesti merkitsevästi suurempi Dysport 1000 U- ja 500 U -hoitoryhmissä kuin lumelääkeryhmässä viikoilla 4 ja 12.
Myöhemmin suoritetussa avoimessa jatkotutkimuksessa uusintahoitoa annettiin kliinisen tarpeen mukaan aikaisintaan 12 viikon kuluttua. Jos injektiot annettiin myös olkapään lihaksiin, voitiin käyttää yli 1000 yksikön annoksia ja enintään 1500 yksikön kokonaisannoksia. Tutkittaville, joilla oli myös alaraajojen spastisuutta, voitiin hoidettaviin alaraajoihin antaa injektiona 500 yksikköä yläraajoihin annetun 1000 yksikön lisäksi niin, että kokonaisannos oli 1500 yksikköä. Toistuvan annon jälkeen Dysport-hoidon teho säilyy jopa vuoden MAS-asteikolla (vasteen saaneiden määrä 75–80 % avoimessa tutkimuksessa ja lumelääkkeellä kontrolloidussa tutkimuksessa 75 %) ja PGA-asteikolla mitattuna, kun injektio annetaan yläraajan lihaksiin. Dysportin vaikutus passiivisiin toimintoihin (DAS-asteikolla mitattuna), spastisuuteen (Tardieu-asteikolla mitattuna), liikeaktiivisuuteen (AROM) ja lastan käyttöön myös säilyi tai parani.
Muutoksessa lähtötasosta tutkimuksen päättymiseen tai tutkimuskäyntiin, jolla potilas vetäytyi tutkimuksesta ennen sen päättymistä, ei todettu tilastollisesti merkitsevää eroa Dysport 500 U-, Dysport 1000 U- ja lumelääkeryhmien välillä, kun sitä mitattiin terveyttä ja elämänlaatua koskevilla kyselyillä Short Form Health Survey (SF-36) ja European Quality of Life 5 Dimensions (EQ-5D) QoL.
Alaraajat
Dysportin tehoa ja turvallisuutta alaraajojen spastisuuden hoidossa arvioitiin satunnaistetussa, kaksoissokkoutetussa, lumelääkekontrolloidussa, useassa tutkimuskeskuksessa tehdyssä avaintutkimuksessa, johon osallistui 385 aivohalvaus- ja aivovauriopotilasta (Dysport-hoito 255 ja lumelääke 130), joilla oli alaraajojen spastisuutta. Ensisijainen päätetapahtuma oli nilkkanivelen MAS-pistemäärä.
Dysportia 1000 yksikköä (N=127), Dysportia 1500 yksikköä (N=128) tai lumelääkettä (N=128) sisältänyt 7,5 ml:n kokonaismäärä jaettiin kliinisten oireiden perusteella gastrocnemius- ja soleus-lihaksiin sekä vähintään yhteen muuhun alaraajan lihakseen.
Arvioitaessa nilkan MAS-pistemäärää polven ollessa ojennettuna (johon osallistuvat kaikki pohjelihakset), havaittiin tilastollisesti merkitsevä paraneminen 1500 yksikköä saaneessa ryhmässä. Arvioitaessa nilkan MAS-pistemäärää polven ollessa koukistettuna (johon osallistuvat kaikki pohjelihakset gastrocnemius-lihasta lukuun ottamatta), havaittiin tilastollisesti merkitsevä paraneminen sekä 1000 yksikköä että 1500 yksikköä saaneessa ryhmässä.
Nilkkanivelen spastisuuden vaikeusasteen lievittyminen osoitettiin myös Tardieu-asteikolla sekä 1000 yksikön että 1500 yksikön annoksilla. Dysport-hoitoon liittyi myös tilastollisesti merkitsevä kliininen paraneminen molemmilla annoksilla PGA-asteikolla (Physician Global Assessment) mitattuna.
Tutkimuksen päätyttyä 345 potilasta osallistui avoimeen jatkotutkimukseen, jossa tutkittaville annettiin kliinisen tarpeen mukaan uusi 1000 yksikön tai 1500 yksikön Dysport-annos. Tutkittaville, joilla oli myös yläraajojen spastisuutta, voitiin hoidettaviin yläraajoihin antaa injektiona 500 yksikköä alaraajoihin annetun 1000 yksikön lisäksi niin, että kokonaisannos oli 1500 yksikköä. Tehon parametreissa (MAS, PGA ja Tardieu-asteikko) alaraajaan annetun 4 viikon kaksoissokkoutetun Dysport-hoidon jälkeen havaittu paraneminen jatkui toistetun hoidon jälkeen. Kaksoissokkoutetussa tutkimuksessa ei havaittu kävelynopeuden paranemista yksittäisen hoitokerran jälkeen, mutta se havaittiin toistetun hoidon jälkeen.
Liikkumaan pystyvien CP-lasten spastisuudesta johtuvien alaraajojen toiminnalliset epämuodostumat, 2-vuotiaat tai sitä vanhemmat lapset
Kaksoissokkoutettu lumekontrolloitu monikeskustutkimus (tutkimus Y-55-52120-141) tehtiin CP-lapsille, joilla oli spastisuudesta johtuvia alaraajojen toiminnallisia epämuodostumia. Tutkimukseen osallistui yhteensä 235 potilasta, joiden MAS (Modified Ashworth Score) -luokka oli vähintään 2; osa potilaista oli saanut aiempaa botuliinitoksiinihoitoa. Tutkimuksessa potilaat saivat joko Dysportia 10 yksikköä/kg/alaraaja, Dysportia 15 yksikköä/kg/alaraaja tai lumelääkettä. Potilaista 41 % sai hoitoa molempiin alaraajoihin, jolloin Dysportin kokonaisannos oli joko 20 yksikköä/kg tai 30 yksikköä/kg. Ensisijainen tehoa kuvannut muuttuja oli pohjelihasten MAS-luokan keskimääräinen muutos lähtötasosta viikolla 4. Toissijaiset tehoa kuvanneet muuttujat olivat keskimääräinen pistemäärä PGA-asteikolla (Physicians Global Assessment) ja keskimääräinen pistemäärä GAS-asteikolla (Goal Attainment Scaling) viikolla 4. Potilaita seurattiin vähintään 12 viikkoa hoidon jälkeen ja enintään 28 viikon ajan. Tutkimuksen päätyttyä potilailla oli mahdollisuus osallistua avoimeen jatkotutkimukseen (tutkimus Y-55-52120-147).
MAS-pistemäärän muutos lähtötasosta viikoilla 4 ja 12, PGA- ja GAS-pistemäärät viikoilla 4 ja 12 (hoitoaikeen mukainen [ITT] potilasjoukko)
Parametri | Lumelääke (N=77) | DYSPORT | |
10 U/kg/alaraaja (N=79) | 15 U/kg/alaraaja (N=79) | ||
Pohjelihasten MAS-pistemäärän keskimääräinen**** muutos lähtötasosta |
|
|
|
Viikko 4 | -0,5 | -0,9 ** | -1,0 *** |
Viikko 12 | -0,5 | -0,8 * | -1,0 *** |
Keskimääräinen**** PGA, hoitovaste |
|
|
|
Viikko 4 | 0,7 | 1,5 *** | 1,5 *** |
Viikko 12 | 0,4 | 0,8 * | 1,0 ** |
Keskimääräinen**** GAS-pistemäärä [a] |
|
|
|
Viikko 4 | 46,2 | 51,5 *** | 50,9 ** |
Viikko 12 | 45,9 | 52,5 *** | 50,5 * |
* p ≤ 0,05; ** p ≤ 0,003; *** p ≤ 0,0006 lumelääkkeeseen verrattuna; **** Pienimmän neliösumman keskiarvo [a] GAS-pistemäärä mittaa edistymistä kohti tavoitteita, jotka valittiin lähtötilanteessa 12 luokan joukosta. Viisi tavallisimmin valittua tavoitetta olivat kävelyn paraneminen (70,2 %), tasapainon paraneminen (32,3 %), kaatumisten esiintymistiheyden pieneneminen (31,1 %), kompastumisten esiintymistiheyden pieneneminen (19,6 %) ja kestävyyden paraneminen (17,0 %) | |||
Tutkimuksessa havaittiin pohjelihasten spastisuuden vähenemistä Tardieun asteikolla mitattuna. Spastisuuden luokka (Y) oli viikoilla 4 ja 12 tilastollisesti merkitsevästi parempi sekä Dysportia 10 yksikköä/kg/alaraaja että Dysportia 15 yksikköä/kg/alaraaja saaneessa ryhmässä lumelääkettä saaneeseen ryhmään verrattuna. Lisäksi catch-kulma (Xv3) oli merkitsevä Dysportia 10 yksikköä/kg/alaraaja saaneessa ryhmässä viikolla 12 ja Dysportia 15 yksikköä/kg/alaraaja viikoilla 4 ja 12.
Molemmissa Dysport-hoitoa saaneissa ryhmissä (10 yksikköä/kg/alaraaja ja 15 yksikköä/kg/alaraaja) OGS-asteikon (Observational Gait Scale) kokonaispistemäärän paraneminen lähtötilanteesta viikolla 4 oli tilastollisesti merkitsevä lumelääkkeeseen verrattuna. Myös jalan alkukontaktin osalta hoitovasteen (OGS-asteikolla mitattuna) saaneiden potilaiden osuus oli tilastollisesti merkitsevästi suurempi viikoilla 4 ja 12.
Vanhemmat täyttivät lasten elämänlaatumittarin (Paediatric Quality of Life Inventory) CP-vammaa koskevan osion. Väsymys väheni viikolla 12 lähtötilanteeseen verrattuna tilastollisesti merkitsevästi Dysportia 10 yksikköä/kg/alaraaja ja 15 yksikköä /kg/alaraaja saaneissa ryhmissä lumelääkettä saaneeseen ryhmään verrattuna. Muiden osioiden pistemäärissä ei havaittu tilastollisesti merkitsevää paranemista.
Tutkimuksen päätyttyä 216 potilasta otettiin avoimeen jatkotutkimukseen (Y-55-52120-147), jossa heillä oli mahdollisuus saada uusintahoitoa kliinisen tarpeen perusteella. Sekä distaalisiin (gastrocnemius, soleus ja tibialis posterior) että proksimaalisiin (reiden takaosan lihakset ja reiden lähentäjälihakset) lihaksiin annettavat injektiot, monitasoinjektiot mukaan lukien, olivat mahdollisia. MAS-, PGA- ja GAS-asteikolla mitattu teho havaittiin enintään vuoden ajan toistuvasti annettujen hoitokertojen yhteydessä.
Yläraajojen fokaalinen spastisuus 2-vuotiailla tai sitä vanhemmilla CP-lapsilla
Dysportin tehoa ja turvallisuutta yläraajan spastisuuden hoidossa lapsilla tutkittiin satunnaistetussa, kaksoissokkoutetussa, kontrolloidussa monikeskustutkimuksessa, jossa tutkimuksessa hoidettavaksi valittuun yläraajaan annettuja annoksia 8 yksikköä/kg ja 16 yksikköä/kg verrattiin verrokkiryhmään, joka sai pienempää annosta 2 yksikköä/kg. Tutkimukseen satunnaistettiin yhteensä 212 potilasta, joilla oli CP-oireyhtymästä johtuvaa yläraajan spastisuutta ja joiden primaarisen kohdelihasryhmän MAS (Modified Ashworth Score) ‑luokka oli vähintään 2; osa potilaista oli saanut aiempaa botuliinitoksiinihoitoa.
Aloitushoitokerran jälkeen voitiin antaa enintään kolme jatkohoitokertaa suunnitelluilla Dysport-annoksilla joko 8 yksikköä/kg tai 16 yksikköä/kg, mutta tutkija saattoi myös suurentaa tai pienentää annosta (kuitenkaan ylittämättä 16 yksikköä/kg).
Dysportin kokonaisannos annettiin injektiona hoidettavan yläraajan lihaksiin joko kyynärpään fleksoreiden tai ranteen fleksoreiden primaariseen kohdelihasryhmään sekä muihin yläraajan lihaksiin taudinkuvan mukaan. Yhteen injektiokohtaan sai antaa korkeintaan 0,5 ml. Injektiokohtia lihasta kohden sai kuitenkin olla enemmän kuin yksi.
Ensisijainen tehoa kuvannut muuttuja oli primaarisen kohdelihasryhmän MAS-pistemäärän keskimääräinen muutos lähtötasosta viikolla 6. Toissijaiset tehoa kuvanneet muuttujat olivat keskimääräinen pistemäärä PGA-asteikolla (Physicians Global Assessment) ja keskimääräinen pistemäärä GAS-asteikolla (Goal Attainment Scaling) viikolla 6.
Primaarisen kohdelihasryhmän (PTMG) MAS-pistemäärän muutos lähtötasosta viikoilla 6 ja 16, PGA- ja GAS-pistemäärät viikoilla 6 ja 16 – Hoitojakso 1 (satunnaistettu potilasjoukko)
| Dysport 2 U/kg (N=71) | Dysport 8 U/kg (N=70) | Dysport 16 U/kg (N=71) |
PTMG MAS-pistemäärä |
|
|
|
| Viikko 6 | |||
LS-keskiarvon muutos (95 % CI) | -1,4 (-1,7, -1,2) | -1,9 (-2,1, -1,6) | -2,2 (-2,4, -2,0) |
Ero annokseen 2 U/kg (95 % CI) |
| -0,4 (-0,8, -0,1) | -0,8 (-1,1, -0,5) |
p-arvo |
| 0,0093 | <0,0001 |
Viikko 16 |
|
|
|
LS-keskiarvon muutos (95 % CI) | -0,9 (-1,2, -0,7) | -1,3 (-1,5, -1,0) | -1,5 (-1,7, -1,2) |
Ero annokseen 2 U/kg (95 % CI) |
| -0,3 (-0,7, 0,0) | -0,8 (-1,1, -0,5) |
p-arvo |
| 0,0573 | 0,0008 |
MAS vasteen saaneet, viikko 6 |
|
|
|
parannusta ≥ 1 luokan verran |
|
|
|
Tutkimushenkilöiden määrä (%) | 56 (78,9) | 61 (87,1) | 66 (93,0) |
Kerroinsuhde vs 2 U/kg (95 % CI) |
| 1,7 (0,7, 4,2) | 4,6 (1,4, 15,4) |
p-arvo |
| 0,2801 | 0,0132 |
parannusta ≥ 2 luokan verran, n (%) |
|
|
|
Tutkimushenkilöiden määrä (%) | 32 (45,1) | 47 (67,1) | 55 (77,5) |
Kerroinsuhde vs 2 U/kg (95 % CI) |
| 2,4 (1,2, 4,8) | 4,3 (2,0, 9,0) |
p-arvo |
| 0,0129 | 0,0001 |
parannusta ≥ 3 luokan verran, n (%) |
|
|
|
Tutkimushenkilöiden määrä (%) | 14 (19,7) | 25 (35,7) | 35 (49,3) |
Kerroinsuhde vs 2 U/kg (95 % CI) |
| 2,3 (1,1, 5,1) | 4,2 (1,9, 9,0) |
p-arvo |
| 0,0326 | 0,0003 |
PGA-pistemäärä |
|
|
|
| Viikko 6 | |||
LS-keskiarvo (95 % CI) | 1,6 (1,4, 1,9) | 2,0 (1,7, 2,2) | 2,0 (1,7, 2,2) |
Ero annokseen 2 U/kg (95 % CI) |
| 0,3 (0,0, 0,7) | 0,3 (0,0, 0,7) |
p-arvo |
| 0,0445 | 0,0447 |
Viikko 16 |
|
|
|
LS-keskiarvo (95 % CI) | 1,6 (1,3, 1,8) | 1,5 (1,3, 1,8) | 1,7 (1,5, 2,0) |
Ero annokseen 2 U/kg (95 % CI) |
| -0,1 (-0,4, 0,3) | 0,2 (-0,2, 0,5) |
p-arvo |
| 0,7797 | 0,3880 |
GAS-kokonaispistemäärä [a] |
|
|
|
| Viikko 6 | |||
LS-keskiarvo (95 % CI) | 51,2 (48,8, 53,6) | 51,4 (48,9, 53,8) | 52,3 (49,8, 54,7) |
Ero annokseen 2 U/kg (95 % CI) |
| 0,2 (-3,2, 3,5) | 1,1 (-2,2, 4,4) |
p-arvo |
| 0,9255 | 0,5150 |
Viikko 16 |
|
|
|
LS-keskiarvo (95 % CI) | 53,3 (50,6, 56,1) | 52,8 (50,1, 55,6) | 54,6 (51,8, 57,4) |
Ero annokseen 2 U/kg (95 % CI) |
| -0,5 (-4,3, 3,3) | 1,3 (-2,5, 5,0) |
p-arvo |
| 0,7862 | 0,5039 |
LS = Pienimmän neliösumman keskiarvo PTMG: primaarinen kohdelihasryhmä (kyynärpään fleksorit tai ranteen fleksorit) [a] Neljä tavallisimmin valittua ensisijaista tavoitetta olivat kurottaminen, tarttuminen esineeseen ja otteen irrottaminen, raajan käyttö avustavana yläraajana liikkeen vakauttamiseksi ja hoidettavan yläraajan käyttö päivittäisissä askareissa. | |||
Tutkimuksessa havaittiin primaarisen kohdelihasryhmän (kyynärpään fleksori ja ranteen fleksori) spastisuuden vähenemistä Tardieun asteikolla mitattuna.
Kyynärpään fleksoreiden osalta catch-kulma (Xv3) oli merkitsevästi parempi Dysport-annoksilla 8 yksikköä/kg ja 16 yksikköä/kg viikoilla 6 ja 16 verrattuna Dysport-annokseen 2 yksikköä/kg. Spastisuuden luokka (Y) oli tilastollisesti merkitsevä Dysport-annoksella 16 yksikköä/kg viikoilla 6 ja 16, mutta ei Dysport-annoksella 8 yksikköä/kg.
Ranteen fleksoreiden osalta catch-kulma (Xv3) ja spastisuuden luokka (Y) olivat merkitsevästi parempia Dysport-annoksella 16 yksikköä/kg viikolla 6, mutta ei viikolla 16. Dysport-annoksella 8 yksikköä/kg ei nähty tilastollisesti merkitsevää tehoa verrattuna Dysport-annokseen 2 yksikköä/kg.
Ensisijaisten ja toissijaisten muuttujien tuloksia tukivat myös lasten elämänlaatumittarin (Paediatric Quality of Life Inventory) CP-vammaa koskevan osion suotuisat tulokset.
Ensimmäisessä tutkimusjaksossa suurin osa Dysport-hoitoa saaneista tutkimushenkilöistä sai uusintahoitoa viikkoon 28 mennessä (62,3 % Dysportia 8 yksikköä/kg saaneessa ryhmässä ja 61,4 % Dysportia 16 yksikköä/kg saaneessa ryhmässä), mutta kummassakin tutkimusryhmässä yli 24 % tutkimushenkilöistä ei ollut tarvinnut uusintahoitoa viikkoon 34 mennessä.
Detrusorin neurogeenisesta yliaktiivisuudesta johtuva virtsainkontinenssi
Kahteen satunnaistettuun, kaksoissokkoutettuun, lumekontrolloituun, monessa tutkimuskeskuksessa tehtyyn avaintutkimukseen osallistui potilaita, joilla oli detrusorin neurogeenisesta yliaktiivisuudesta johtuva virtsainkontinenssi. Kaikki potilaat tekivät jo ennestään säännöllisesti katetrointeja rakon tyhjentämiseksi, eikä suun kautta annettu lääkitys ollut riittävä; potilaat eivät olleet aiemmin saaneet botuliinitoksiinia tai he olivat saaneet aiempaa hoitoa virtsarakon seinämälihakseen. Näissä kahdessa tutkimuksessa yhteensä 485 potilasta, joilla oli selkäydinvamma (N = 341) tai multippeli skleroosi (N = 144) satunnaistettiin saamaan joko Dysportia 600 yksikköä (N = 162), Dysportia 800 yksikköä (N = 161) tai lumelääkettä (N = 162). Hoito annettiin kystoskoopin kautta 30 injektiona virtsarakon seinämälihakseen tasaisin välein välttäen virtsarakon kolmiota. Antibioottiprofylaksi aloitettiin vähintään 3 päivää ennen Dysportin antoa, ja sitä jatkettiin vähintään 3 päivää Dysportin annon jälkeen. Ensimmäisen hoitokerran jälkeen potilaiden oli mahdollista saada jatkohoitona Dysportia 600 yksikköä tai 800 yksikköä uusintahoidon kriteerien täyttyessä.
Tehon ensisijainen päätetapahtuma oli virtsainkontinenssiepisodien viikoittaisen lukumäärän muutos viikolla 6 lähtötilanteeseen verrattuna. Toissijaisia päätetapahtumia olivat niiden potilaiden osuus, joilla ei viikkoon 6 mennessä ollut yhtäkään virtsainkontinenssiepisodia (100 %:n vähenemä), muutos yhdellä virtsaamiskerralla rakosta tyhjentyneen virtsan määrässä viikolla 6 verrattuna lähtötilanteeseen, urodynaamiset parametrit (kystometria), potilaan raportoimaa inkontinenssin vaikutusta elämänlaatuun mittaava kysely (I-QOL; mukaan lukien käyttäytymistä rajoittava vaikutus, psykososiaalinen vaikutus ja kiusalliset sosiaaliset tilanteet) sekä kokonaismielikuva hoitovasteesta.
Yhdistettyjen avaintutkimusten tulokset esitetään seuraavassa taulukossa:
Ensisijaiset ja toissijaiset päätetapahtumat yhdistetyissä avaintutkimuksissa (satunnaistettu populaatio)
| Lumelääke (N = 162) | Dysport 600 U (N = 162) | Dysport 800 U (N = 161) |
Virtsainkontinenssiepisodien viikoittainen lukumäärä |
|
|
|
Viikko 2 |
|
|
|
LS-keskiarvon muutos (SE) | -11,3 (1,4) | -19,9 (1,4) | -21,9 (1,4) |
Ero lumelääkkeeseen (95 % CI) |
| -8,6 (-12,2, -4,9) | -10,6 (-14,3, -7,0) |
p-arvo |
| < 0,0001 | < 0,0001 |
Viikko 6 |
|
|
|
LS-keskiarvon muutos (SE) | -12,7 (1,4) | -22,7 (1,3) | -23,6 (1,3) |
Ero lumelääkkeeseen (95 % CI) |
| -10,0 (-13,5, -6,5) | -10,9 (-14,4, -7,4) |
p-arvo |
| < 0,0001 | < 0,0001 |
Viikko 12 |
|
|
|
LS-keskiarvon muutos (SE) | -9,2 (1,5) | -20,4 (1,5) | -22,8 (1,5) |
Ero lumelääkkeeseen (95 % CI) |
| -11,3 (-15,2, -7,3) | -13,6 (-17,6, -9,7) |
p-arvo |
| < 0,0001 | < 0,0001 |
Ei virtsainkontinenssiepisodeja, viikko 6 [a] |
|
|
|
Osuus tutkittavista | 2,9 % | 36,1 % | 28,8 % |
Kerroinsuhde vs lumelääke (95 % CI) |
| 18,9 (6,9, 51,9) | 15,5 (5,6, 42,9) |
p-arvo |
| < 0,0001 | < 0,0001 |
Maksimaalinen kystometrinen kapasiteetti (ml), viikko 6 [b] |
|
|
|
LS-keskiarvon muutos (SE) | -4,0 (13,9) | 164,6 (13,6) | 175,8 (13,7) |
Ero lumelääkkeeseen (95 % CI) |
| 168,5 (132,4, 204,7) | 179,8 (143,5, 216,1) |
p-arvo |
| < 0,0001 | < 0,0001 |
Ei tahattomia rakkolihaksen supistuksia, viikko 6 [b] |
|
|
|
Osuus tutkittavista | 6,6 % | 44,0 % | 55,0 % |
Kerroinsuhde vs lumelääke (95 % CI) |
| 11,9 (5,3, 26,6) | 18,6 (8,3, 41,7) |
p-arvo |
| < 0,0001 | < 0,0001 |
Virtsatilavuus (ml) rakkolihaksen ensimmäisen tahattoman supistuksen aikana, viikko 6 [b] |
|
|
|
LS-keskiarvon muutos (SE) | 12,3 (14,7) | 166,4 (14,4) | 191,2 (14,6) |
Ero lumelääkkeeseen (95 % CI) |
| 154,1 (116,0, 192,1) | 178,9 (140,4, 217,5) |
p-arvo |
| < 0,0001 | < 0,0001 |
Rakkolihaksen maksimipaine varastoitumisvaiheessa (cmH2O), viikko 6 [b] |
|
|
|
LS-keskiarvon muutos (SE) | -4,9 (2,3) | -33,1 (2,2) | -35,4 (2,2) |
Ero lumelääkkeeseen (95 % CI) |
| -28,2 (-34,0, -22,3) | -30,4 (-36,3, -24,5) |
p-arvo |
| < 0,0001 | < 0,0001 |
I-QOL-kokonaispisteet [c], viikko 6 |
|
|
|
LS-keskiarvon muutos (SE) | 7,1 (1,8) | 22,1 (1,8) | 22,2 (1,7) |
Ero lumelääkkeeseen (95 % CI) |
| 15,0 (10,4, 19,6) | 15,1 (10,5, 19,7) |
p-arvo |
| < 0,0001 | < 0,0001 |
I-QOL = virtsainkontinenssin vaikutus elämänlaatuun; LS = pienin neliösumma; SE = keskivirhe [a] Niiden potilaiden osuus, joiden inkontinenssiepisodit vähenivät 75 % viikolla 6 lähtötilanteeseen verrattuna, olivat 62,5 % Dysportia 600 yksikköä saaneessa ryhmässä ja 57,6 % Dysportia 800 yksikköä saaneessa ryhmässä, kun lumelääkettä saaneessa ryhmässä osuus oli 15,0 %. Niiden potilaiden osuudet, joilla episodit vähenivät vähintään 50 %, olivat 73,6 %, 67,6 % ja 34,3 %. | |||
Lisäksi kahdessa Dysport-ryhmässä havaittiin lumelääkkeeseen verrattuna merkitsevää paranemista lähtötilanteeseen verrattuna yhdellä virtsaamiskerralla rakosta tyhjentyneen virtsan määrän muutoksessa ja detrusorin komplianssia koskevassa urodynaamisessa parametrissa. Inkontinenssiin liittyvän elämänlaadun (jota mitattiin inkontinenssin vaikutusta elämänlaatuun mittaavalla I-QOL-kyselyllä) lisäksi potilaiden kokonaismielikuva hoitovasteesta mitattuna 7-portaisella asteikolla (’hyvin paljon parempi’ – ’hyvin paljon huonompi’) osoitti merkitsevästi parempaa vastetta Dysport-hoidon jälkeen lumelääkkeeseen verrattuna.
Potilaiden vasteet Dysport-uusintahoitoon olivat johdonmukaiset kaikissa tehon päätepisteissä; 426 potilasta sai Dysport-hoitoa vähintään kerran, 217 potilasta vähintään 2 kertaa ja 76 potilasta vähintään kolme kertaa. Virtsainkontinenssiepisodien viikoittainen lukumäärä viikolla 6 kaikissa Dysport-hoitosykleissä pieneni Dysportia 600 yksikköä saaneessa ryhmässä keskimäärin -21,2 –-22,3 ja Dysportia 800 yksikköä saaneessa ryhmässä -21,3 – -23,7.
Ensimmäisestä Dysport-hoitokerrasta uusintahoitoon kulunut aika (mediaani) oli 39–47 viikkoa, tosin yli 40 % tutkittavista ei saanut uusintahoitoa viikkoon 48 mennessä.
Farmakokinetiikka
Tutkimukset, joissa on käytetty I125-merkittyä botuliinitoksiinia, ovat osoittaneet, että reseptoriin sitoutuminen on spesifistä. Annos-vastetutkimukset apinoilla ovat osoittaneet, että pienillä annoksilla viive oli 2-3 päivää ja huippuvaikutus todettiin 5-6 päivää injektion jälkeen. Vaikutuksen kesto, joka mitattiin katseen kohdistumisessa tapahtuvina muutoksina sekä lihashalvauksena, vaihteli 2 viikon ja 8 kuukauden välillä. Tämä malli todetaan myös ihmisellä, ja sen katsotaan johtuvan toksiinin sitoutumisesta, siirtymisestä hermokalvon läpi ja muutoksesta hermo-lihasliitoksessa.
Prekliiniset tiedot turvallisuudesta
Anto lihakseen (poikkijuovaiset lihakset)
Pitkäaikaistoksisuutta koskevassa tutkimuksessa rotilla annokset olivat suurimmillaan 12 yksikköä/eläin, mikä ei aiheuttanut systeemistä toksisuutta.
Lisääntymistoksisuustutkimuksissa tiineinä olleille päivittäisinä injektioina annoksella 79 yksikköä/kg rotille ja 42 yksikköä/kg kaneille annettu Clostridium botulinum toksiini tyyppi A -hemagglutiniini-kompleksi ei aiheuttanut alkioon/sikiöön kohdistunutta toksisuutta. Vaikeaa emotoksisuutta, johon liittyi implantaation epäonnistumista, todettiin molemmilla eläinlajeilla. Clostridium botulinum toksiini tyyppi A -hemagglutiniini-kompleksilla ei todettu teratogeenisia vaikutuksia rotilla tai kaneilla, eikä mitään vaikutuksia havaittu pre- ja postnataalitutkimuksissa F1-sukupolvessa rotilla. Urosten ja naaraiden hedelmällisyys väheni johtuen siitä, että suuret annokset vähensivät parittelua johtuen lihasten halvautumisesta.
Nuorilla eläimillä tehdyssä toksisuustutkimuksessa rotille annettiin botuliinitoksiinia viikoittain 21. päivänä syntymän jälkeen tapahtuneesta vieroituksesta enintään 13 viikon ikään asti (11 antokertaa 10 viikon aikana, kokonaisannos enintään noin 33 yksikköä/kg), mikä on ihmisillä verrannollinen antoon 2 vuoden iästä nuoreen aikuisikään asti. Tutkimuksessa ei havaittu syntymän jälkeiseen kasvuun (mukaan lukien luuston arviointi), lisääntymiskehitykseen, neurologiseen ja neurobehavioraaliseen kehitykseen kohdistuvia vaikutuksia.
Prekliinisissä lisääntymistoksisuutta, nuoriin eläimiin kohdistuvaa toksisuutta sekä pitkäaikaistoksisuutta koskevissa tutkimuksissa havaitut vaikutukset rajoittuvat muutoksiin injisoiduissa lihaksissa ja ne johtuivat Clostridium botulinum toksiini tyyppi A -hemagglutiniini-kompleksin vaikutusmekanismista.
Clostridium botulinum toksiini tyyppi A -hemagglutiniini-kompleksin anto kanin silmiin ei aiheuttanut silmien ärsytystä.
Anto detrusorlihakseen
Rotilla ja apinoilla tehdyissä kerta-annoksen toksisuutta selvittäneissä tutkimuksissa ei havaittu virtsarakossa Clostridium botulinum toksiini tyyppi A:han liittyviä löydöksiä millään tutkitulla annoksella. Annettaessa rotille ja apinoille haitatonta annosta (NOAEL; rotta: 67 yksikköä/kg; apina: 40 yksikköä/kg) suurempia annoksia molemmilla eläinlajeilla ilmoitettiin painon laskua, vähentynyttä aktiivisuutta ja merkkejä hengitysvaikeuksista. Nämä löydökset viittaavat systeemiseen toksisuuteen, jota havaittiin myös prekliinisissä tutkimuksissa, joissa arvioitiin Clostridium botulinum toksiini tyyppi A:n turvallisuutta poikkijuovaisissa lihaksissa.
Farmaseuttiset tiedot
Apuaineet
Laktoosimonohydraatti, ihmisen albumiini.
Yhteensopimattomuudet
Tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa, lukuun ottamatta niitä, jotka mainitaan kohdassa Käyttö- ja käsittelyohjeet.
Kestoaika
Injektiokuiva-aineen kestoaika avaamattomassa pakkauksessa on 2 vuotta.
Käyttövalmiiksi saatetun liuoksen on osoitettu säilyvän 24 tuntia 2 °C – 8 °C:ssa. Mikrobiologiselta kannalta valmiste tulisi käyttää välittömästi. Jos sitä ei käytetä välittömästi, säilytysaika ja käyttöä edeltävät säilytysolosuhteet ovat käyttäjän vastuulla, eikä niiden tavallisesti tulisi olla yli 24 tuntia 2 °C – 8 °C:ssa.
Säilytys
Säilytä avaamattomat injektiopullot jääkaapissa (2 °C – 8 °C). Avaamattoman Dysport-injektiopullon voi käyttää sen jälkeen, kun se on kerran altistunut korkeintaan 25 °C:n lämpötilalle enintään 72 tuntia, minkä jälkeen avaamaton injektiopullo on säilytettävä jääkaapissa (2 °C – 8 °C) kestoajan loppuun asti. Ei saa jäätyä.
Käyttökuntoon saatetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
DYSPORT injektiokuiva-aine, liuosta varten
300 U (L:kyllä) 300 U (184,37 €)
PF-selosteen tieto
Pakkaustyyppi/sulkimen tyyppi:
3 ml:n injektiopullo on tyypin 1 väritöntä lasia ja se on sinetöity kumitulpalla ja alumiinikorkilla.
Pakkaukset 1 x 1 ja 2 x 1 injektiopulloa.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Valkoinen kylmäkuivattu liuotettava jauhe.
Käyttö- ja käsittelyohjeet
Dysport injektiokuiva-aine, joka on valkoista kylmäkuivattua jauhetta, on liuotettava ennen käyttöä 0,6 ml:aan, 1,5 ml:aan tai 3 ml:aan 0,9 % keittosuolaliuosta niin, että saadaan 500, 200 tai 100 U/ml sisältävä liuos. Dysport tulee laimentaa asianmukaisesti ja lämmittää huoneenlämpöiseksi. Kumikorkin vapaana oleva keskusta on puhdistettava alkoholilla ennen kuin neula työnnetään kalvon läpi. On käytettävä neulakokoa 23 tai 25.
Laimennusohjeet hoidettaessa detrusorin neurogeenisesta yliaktiivisuudesta johtuvaa virtsainkontinenssia
Käyttökuntoon saattamisen jälkeen tarvittava 15 ml käyttökuntoon saatettua Dysport-injektionestettä on jaettuna tasan kahteen 10 ml:n ruiskuun, joista kumpikin sisältää 7,5 ml käyttökuntoon saatettua Dysportia yhtäläisinä pitoisuuksina. Ruiskussa käyttökuntoon saatettu valmiste on käytettävä heti.
Laimennusohjeet käytettäessä 300 yksikön injektiopulloa
-
600 yksikön annos: Liuota kahden 300 yksikön injektiopullon sisältö kumpikin erikseen 1,5 ml:aan säilytysaineetonta 9 mg/ml (0,9 %) natriumkloridi-injektioliuosta. Vedä ensimmäiseen 10 ml:n ruiskuun kaikki 1,5 ml ensimmäisestä injektiopullosta ja toiseen 10 ml:n ruiskuun kaikki 1,5 ml toisesta injektiopullosta. Saata liuos käyttökuntoon lisäämällä lopuksi kumpaankin ruiskuun 6,0 ml säilytysaineetonta 9 mg/ml (0,9 %) natriumkloridi-injektioliuosta ja sekoita varovasti.
Näin saadaan kaksi 10 ml:n ruiskua, joissa on molemmissa 7,5 ml liuosta ja yhteensä 600 yksikköä käyttökuntoon saatettua Dysportia. -
800 yksikön annos: Liuota kolmen 300 yksikön injektiopullon sisältö kukin erikseen 1,5 ml:aan säilytysaineetonta 9 mg/ml (0,9 %) natriumkloridi-injektioliuosta. Vedä ensimmäiseen 10 ml:n ruiskuun kaikki 1,5 ml ensimmäisestä injektiopullosta ja 0,5 ml toisesta injektiopullosta. Vedä toiseen 10 ml:n ruiskuun 0,5 ml toisesta injektiopullosta ja kaikki 1,5 ml kolmannesta injektiopullosta. Saata liuos käyttökuntoon lisäämällä lopuksi kumpaankin ruiskuun 5,5 ml säilytysaineetonta 9 mg/ml (0,9 %) natriumkloridi-injektioliuosta ja sekoita varovasti.
Näin saadaan kaksi 10 ml:n ruiskua, joissa on molemmissa 7,5 ml liuosta ja yhteensä 800 yksikköä käyttökuntoon saatettua Dysportia.
Laimennusohjeet käytettäessä 300 yksikön ja 500 yksikön injektiopulloa (koskee vain 800 yksikön annosta)
-
800 yksikön annos: Liuota 500 yksikön injektiopullon sisältö 2,5 ml:aan säilytysaineetonta 9 mg/ml (0,9 %) natriumkloridi-injektioliuosta ja 300 yksikön injektiopullon sisältö 1,5 ml:aan säilytysaineetonta 9 mg/ml (0,9 %) natriumkloridi-injektioliuosta. Vedä ensimmäiseen 10 ml:n ruiskuun 2 ml 500 yksikön injektiopullosta. Vedä toiseen 10 ml:n ruiskuun loput 0,5 ml 500 yksikön injektiopullosta ja kaikki 1,5 ml 300 yksikön injektiopullosta. Saata liuos käyttökuntoon lisäämällä lopuksi kumpaankin ruiskuun 5,5 ml säilytysaineetonta 9 mg/ml (0,9 %) natriumkloridi-injektioliuosta ja sekoita varovasti.
Näin saadaan kaksi 10 ml:n ruiskua, joissa on molemmissa 7,5 ml liuosta ja yhteensä 800 yksikköä käyttökuntoon saatettua Dysportia.
Käyttökuntoon saatettu liuos: kirkas, väritön liuos, jossa ei ole hiukkasia.
Dysportin yksiköt (U) ovat valmistekohtaisia eikä niitä voi siirtää muihin botuliinituotteisiin.
Kaikki käytetyt injektiopullot, ruiskut ja jätettä sisältävät esineet on autoklavoitava, myös jäljelle jäänyt botulinumtoksiini A tulee inaktivoida laimennetulla hypokloriittiliuoksella (0,5 %).
Korvattavuus
DYSPORT injektiokuiva-aine, liuosta varten
300 U 300 U
- Peruskorvaus (40 %).
- Ei korvausta hammaslääkärin määräämästä lääkkeestä.
ATC-koodi
M03AX01
Valmisteyhteenvedon muuttamispäivämäärä
06.08.2025
Yhteystiedot
Kista Science Tower, Färögatan 33
SE-164 51 Kista
Sweden
+46 8 451 60 00
www.ipsen.com
info.se@ipsen.com
