HAVRIX injektioneste, suspensio, esitäytetty ruisku 1440 ELISA U/ml
Vaikuttavat aineet ja niiden määrät
Havrix 720
1 annos (0,5 ml) sisältää:
Hepatiitti A -virusta (inaktivoitu)1,2 720 ELISA yksikköä
1 tuotettu ihmisen diploidisoluissa (MRC-5)
2 adsorboitu hydratoituun alumiinihydroksidiin (tot. määrä 0,25 milligrammaa Al3+)
Havrix 1440
1 annos (1 ml) sisältää:
Hepatiitti A -virusta (inaktivoitu)1,2 1440 ELISA yksikköä
1 tuotettu ihmisen diploidisoluissa (MRC-5)
2 adsorboitu hydratoituun alumiinihydroksidiin (tot. määrä 0,5 milligrammaa Al3+)
Rokote voi sisältää jäämäaineena neomysiinia tai formaldehydia, joita käytetään valmistusprosessissa (ks. kohta Vasta-aiheet).
Apuaineet, joiden vaikutus tunnetaan:
Yksi Havrix 720 -annos sisältää 83 mikrogrammaa fenyylialaniinia ja 25 mikrogrammaa polysorbaatti 20:ta per annos (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Yksi Havrix 1440 -annos sisältää 166 mikrogrammaa fenyylialaniinia ja 50 mikrogrammaa polysorbaatti 20:ta per annos (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Täydellinen apuaineluettelo, katso kohta Apuaineet
Lääkemuoto
Injektiopullo:
injektioneste, suspensio.
Esitäytetty ruisku:
injektioneste, suspensio esitäytetyssä ruiskussa.
Kliiniset tiedot
Käyttöaiheet
Havrix on tarkoitettu aktiiviseen immunisaatioon hepatiitti A (HAV) -infektiota vastaan lapsille, nuorille ja aikuisille:
- Havrix 720: 1–15-vuotiaat henkilöt. Sitä voidaan käyttää myös alle 18-vuotiaille ja 18 vuotta täyttäneille nuorille.
- Havrix 1440: 16-vuotiaat ja sitä vanhemmat henkilöt.
Tätä rokotetta on käytettävä virallisten suositusten mukaisesti.
Annostus ja antotapa
Annostus
Perusrokote
Havrix 720 (0,5 ml suspensio)
1–15-vuotiaiden lasten ja nuorten immunisaatioon käytetään yksi Havrix 720 -annos.
Myös enintään 18-vuotiaiden nuorten immunisaatioon voidaan tarvittaessa käyttää yksi Havrix 720 lasten -annos.
Havrix 1440 (1,0 ml suspensio)
16 vuotta täyttäneiden nuorten ja aikuisten immunisaatioon käytetään yksi Havrix 1440 -annos.
Optimaalisen vasta-ainevasteen saavuttamiseksi perusrokote on annettava vähintään 2 mutta mieluiten 4 viikkoa ennen odotettua altistumista hepatiitti A -virukselle (ks. kohta Farmakodynamiikka).
Tehosterokote
Havrix 720 -perusrokotuksen tai Havrix 1440 -perusrokotuksen jälkeen suositellaan tehosteannosta pitkäaikaisen suojan varmistamiseksi. Tehosteannos tulee antaa mieluiten 6–12 kuukauden kuluttua perusrokotteesta, mutta se voidaan antaa 5 vuoteen asti ensimmäisestä rokotuksesta (ks. kohta Farmakodynamiikka).
Vaihdettavuus
Havrix -rokote on vaihdettavissa muiden inaktivoitujen hepatiitti A -rokotteiden kanssa
Iäkkäät potilaat
Inaktivoiduista hepatiitti A -rokotteista iäkkäillä henkilöillä on vain vähän tietoa.
Pediatriset potilaat
Havrix 720 -valmisteen turvallisuutta ja tehoa alle 1 vuoden ikäisten lasten hoidossa ei ole varmistettu. Tällä hetkellä saatavilla oleva tieto on kuvailtu kohdassa Farmakodynamiikka mutta annossuositusta ei ole tehty.
Antotapa
Havrix 720 (0,5 ml suspensio) annetaan lihakseen. Rokote pistetään lapsilla ja nuorilla olkalihaksen alueelle ja pikkulapsilla reiden etu-ulkosyrjään, jos olkalihas ei ole vielä riittävän kehittynyt (ks. kohta Käyttö- ja käsittelyohjeet).
Havrix 1440 (1,0 ml suspensio) annetaan lihakseen. Rokote pistetään nuorilla ja aikuisilla olkalihaksen alueelle (ks. kohta Käyttö- ja käsittelyohjeet).
Injektiokohdasta riippumatta tulee pistoskohtaa painaa (hieromatta) napakasti vähintään 2 minuutin ajan injektion antamisen jälkeen.
Havrix -rokotetta ei saa antaa pakaralihakseen.
Havrix -rokotetta ei saa missään tapauksessa antaa suonensisäisesti.
Havrix -rokotetta ei saa antaa ihon alle tai ihon sisään (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle, kohdassa Apuaineet mainituille apuaineille, neomysiinille tai formaldehydille.
Aikaisemman, minkä tahansa hepatiitti A -rokotuksen jälkeen ilmennyt yliherkkyys.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Yleiset suositukset
Havrix -rokotusta, kuten rokottamista yleensäkin, tulee siirtää akuutin vaikean kuumetaudin yhteydessä. Vähäinen infektio, kuten nuha, ei kuitenkaan ole rokotuksen este.
Kuten injisoitavien rokotteiden yhteydessä yleensäkin, saatavilla tulee olla asianmukainen hoitovalmius ja seuranta rokottamista seuraavan harvinaisen anafylaktisen tapahtuman varalta. Rokotuksen jälkeen suositellaan tarkkaa seurantaa vähintään 15 minuutin ajan.
Erityisesti nuorilla saattaa rokotuksen jälkeen, tai jopa ennen sitä, esiintyä pyörtymistä psykogeenisenä reaktiona neulanpistokselle. Toipumiseen voi liittyä useita neurologisia löydöksiä, kuten ohimeneviä näköhäiriöitä, tuntohäiriöitä ja toonis-kloonisia raajojen liikkeitä. Pyörtymisen aiheuttamien vammojen välttämiseksi on oltava asianmukaiset toimintavalmiudet.
Havrix ei estä muiden aiheuttajien, kuten hepatiitti B-viruksen, hepatiitti C-viruksen, hepatiitti E-viruksen tai muiden maksatulehdusta aiheuttavien taudinaiheuttajien aiheuttamaa maksatulehdusta.
Rokotettavalla voi olla rokotushetkellä itämisvaiheessa oleva hepatiitti A -infektio. Ei tiedetä, estääkö Havrix tällöin sairauden puhkeamisen.
Kuten kaikkien rokotteiden yhteydessä, immuunivastetta ei välttämättä saada aikaan kaikille rokotetuille.
Havrix ei välttämättä saa aikaan tehokasta immuunivastetta henkilöillä, joilla on immuunivajaus. Tällaiset henkilöt tarvitsevat aina kahden annoksen rokotusohjelman.
Havrixia on annettava varoen henkilöille, joilla on trombosytopenia tai verenvuotohäiriö, koska lihakseen tapahtuvaan antoon voi näillä potilailla liittyä verenvuotovaara. Poikkeuksellisesti rokote voidaan antaa näille henkilöille ihon alle, mikäli se on virallisten suositusten mukaista. Tämä antoreitti voi kuitenkin johtaa optimaalista tasoa vähäisempään anti-HAV-vasta-ainemuodostukseen. Kumpaakin antotapaa käytettäessä pistoskohtaa on painettava napakasti (hieromatta) vähintään kahden minuutin ajan injektion jälkeen.
Apuaineet
Havrix 720 sisältää 83 mikrogrammaa fenyylialaniinia per annos.
Havrix 1440 sisältää 166 mikrogrammaa fenyylialaniinia per annos.
Fenyylialaniini voi olla haitallista henkilöille, joilla on fenyyliketonuria (PKU).
Havrix 720 sisältää 25 mikrogrammaa polysorbaatti 20:ta per annos.
Havrix 1440 sisältää 50 mikrogrammaa polysorbaatti 20:ta per annos.
Polysorbaatit saattavat aiheuttaa allergisia reaktioita.
Tämä rokote sisältää alle 1 mmol natriumia (23 mg) per annos eli sen voidaan sanoa olevan ”natriumiton”.
Tämä rokote sisältää kaliumia alle 1 mmol (39 mg) per annos, eli sen voidaan sanoa olevan ”kaliumiton”.
Yhteisvaikutukset
Koska Havrix on inaktivoitu rokote, sen samanaikainen käyttö muiden inaktivoitujen rokotteiden kanssa ei todennäköisesti vaikuta immuunivasteeseen.
Havrix voidaan antaa samanaikaisesti minkä tahansa seuraavien rokotteiden kanssa: lavantauti, keltakuume, injisoitava kolera ja tetanus, sekä tuhkarokko-, sikotauti-, vihurirokko- ja vesirokkokomponentteja sisältävät monovalenttiset rokotteet ja yhdistelmärokotteet.
Havrix voidaan antaa samanaikaisesti immunoglobuliinien kanssa. Serokonversiotasot eivät muutu, mutta vasta-ainetitterit voivat olla pienemmät kuin pelkän Havrix -valmisteen annon yhteydessä.
Silloin kun muiden rokotteiden tai immunoglobuliinien samanaikainen anto katsotaan välttämättömäksi, ne on annettava eri ruiskuja ja neuloja käyttäen eri pistokohtiin.
Raskaus ja imetys
Raskaus
Kohtalaisen laajat tiedot raskaana olevista naisista (300–1 000 raskaudesta) eivät viittaa epämuodostumia aiheuttavaan tai fetaaliseen/neonataaliseen toksisuuteen.
Eläimillä tehdyissä tutkimuksissa ei ole havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta).
Havrix -valmisteen käyttöä raskauden aikana voidaan tarvittaessa harkita.
Imetys
Ei tiedetä, erittyykö Havrix ihmisillä äidinmaitoon. Vaikka riskiä voidaan pitää mitättömänä, Havrix -valmistetta tulee antaa imetyksen aikana vain, kun se on selvästi tarpeen.
Hedelmällisyys
Havrix -valmisteen vaikutuksista ihmisen hedelmällisyyteen ei ole olemassa tietoja. Vaikutuksia ihmisen hedelmällisyyteen ei ole arvioitu eläimillä tehdyissä tutkimuksissa.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Havrix -valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneiden käyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Yleisimmät paikalliset haittavaikutukset sekä lapsilla että aikuisilla ovat injektiokohdan kipu ja punoitus.
Yleisimmät yleiset haittavaikutukset ovat lapsilla ärtyneisyys ja aikuisilla uupumus ja päänsärky.
Haittavaikutustaulukko
Kliinisten tutkimusten tiedot
Alla olevassa taulukossa esitetty turvallisuusprofiili perustuu kliinisten tutkimusten tietoihin 5 331 henkilöstä (rokotettujen koko kohortti), joista 1 664 oli Havrix 720 -rokotteen saaneita lapsia ja 3 667 aikuisia (yli 16 vuotiaita), jotka oli rokotettu Havrix 1440 -rokotteella. Kliinisissä tutkimuksissa annettiin yhteensä 3 193 annosta Havrix 720 -rokotetta ja 7 131 annosta Havrix 1440 ‑rokotetta. Yhteensä 3 971 annosta Havrix 1440 -rokotetta annettiin samanaikaisesti Engerix-B -rokotteen kanssa 2 064 aikuiselle tutkittavalle.
Haittavaikutukset on esitetty yleisyyden mukaan seuraavasti:
Hyvin yleinen: (≥ 1/10)
Yleinen: (≥1/100 − < 1/10)
Melko harvinainen: (≥1/1 000 − < 1/100)
Harvinainen: (≥ 1/10 000 − < 1/1 000)
Hyvin harvinainen: (< 1/10 000)
Haittavaikutukset on esitetty kussakin yleisyysluokassa vakavuuden mukaan alenevassa järjestyksessä.
Elinjärjestelmäluokka | Yleisyys | Haittavaikutus |
Infektiot | Melko harvinainen | Ylähengitystieinfektiot (2), nuha |
Aineenvaihdunta ja ravitsemus | Yleinen | Ruokahaluttomuus |
Psyykkiset häiriöt | Hyvin yleinen | Ärtyneisyys (1) |
Hermosto | Hyvin yleinen | Päänsärky (3) |
Yleinen | Uneliaisuus (1) | |
Melko harvinainen | Huimaus (2) | |
Harvinainen | Alentunut tuntoherkkyys (2), tuntohäiriö (2) | |
Ruoansulatuselimistö | Yleinen | Ruoansulatuskanavan oireet (2) (5), ripuli (4), pahoinvointi |
Melko Harvinainen | Oksentelu | |
Iho ja ihonalainen kudos | Melko harvinainen | Ihottuma (1) |
Harvinainen | Kutina (2) | |
Luusto, lihakset ja sidekudos | Melko harvinainen | Lihaskipu (2), tuki- ja liikuntaelimistön jäykkyys (2) |
Yleisoireet ja antopaikassa todettavat haitat | Hyvin yleinen | Injektiokohdan kipu ja punoitus, uupumus (2) |
Yleinen | Huonovointisuus, kuume (≥ 37,5°C), injektiokohdan reaktio (kuten injektiokohdan kovettuma (4) tai turvotus) | |
Melko harvinainen | Influenssan kaltainen tauti (2) | |
Harvinainen | Vilunväristykset (2) |
(1) vain Havrix 720 -valmisteella
(2) vain Havrix 1440 -valmisteella
(3) raportoitu yleiseksi Havrix 720 -rokotteella
(4) raportoitu harvinaiseksi Havrix 720 -rokotteella
(5) ruoansulatuskanavan oireet = mukaan lukien pahoinvointi, oksentelu ja ripuli (oireita ei kirjattu erikseen)
Markkinoille tulon jälkeiset tiedot
Markkinoille tulon jälkeisessä seurannassa on todettu lisäksi seuraavia haittavaikutuksia Havrix 720 -rokotteella sekä Havrix 1440 -rokotteella.
Elinjärjestelmäluokka | Yleisyys | Haittavaikutus |
Immuunijärjestelmä | Harvinainen | Anafylaksia, allergiset reaktiot, mukaan lukien anafylaktoidit reaktiot ja seerumitaudin kaltainen reaktio |
Hermosto | Harvinainen | Kouristukset |
Verisuonisto | Harvinainen | Verisuonitulehdus |
Iho ja ihonalainen kudos | Harvinainen | Angioneuroottinen edeema, erythema multiforme, urtikaria |
Luusto, lihakset ja sidekudos | Harvinainen | Nivelkipu |
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista.
Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Markkinoille tulon jälkeen on raportoitu yliannostustapauksia. Yliannostuksen aiheuttamat haittatapahtumat olivat samanlaisia kuin normaaliannostuksessa.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Hepatiitti A -rokote, ATC-koodi: J07BC02
Vaikutusmekanismi
Havrix antaa suojan hepatiitti A:ta vastaan aikaansaamalla spesifisen immuunivasteen, joka voidaan todeta HAV-vasta-aineiden muodostumisesta.
Farmakodynaamiset vaikutukset
Havrix -valmisteen immunogeenisuutta on arvioitu 39 tutkimuksessa, yli 6 000 tutkittavalla mukaan lukien aikuiset, nuoret ja lapset.
Immuunivaste
Kliinisissä tutkimuksissa serokonversio oli havaittavissa 99 %:lla rokotetuista 30 päivän kuluttua ensimmäisestä annoksesta.
Aikuisia koskeneissa kliinisissä osatutkimuksissa, joissa immuunivasteen kinetiikkaa tutkittiin tarkemmin, varhainen ja nopea serokonversio todettiin ensimmäisen Havrix 1440 -annoksen jälkeen 79 %:lla rokotetuista päivänä 13, 86,3 %:lla rokotetuista päivänä 15, 95,2 %:lla rokotetuista päivänä 17 ja 100 %:lla rokotetuista päivänä 19.
Alle 1-vuotiailla imeväisillä tehdyistä kliinisistä tutkimuksista on saatavilla vain rajallisesti tietoa. Näissä tutkimuksissa Havrix 720 -rokotetta annettiin 2, 4 ja 6 kuukauden iässä tai kahtena annoksena 6 kuukauden välein 4–6 kuukauden iässä. Useimmilla rokotetuilla havaittiin humoraalisia vasta-aineita hepatiitti A-virusta vastaan yhden kuukauden kuluttua viimeisen rokoteannoksen antamisesta. Imeväisillä, joilla oli ennestään äidiltä peräisin olevia vasta-aineita, vaste oli huomattavasti heikompi kuin alun perin seronegatiivisilla imeväisillä (ks. kohta Annostus ja antotapa).
1–18-vuotiaita lapsia koskeneissa kliinisissä tutkimuksissa spesifisiä humoraalisia vasta-aineita hepatiitti A -virusta vastaan havaittiin yli 93 %:lla rokotetuista päivänä 15 ja 99 %:lla rokotetuista yhden kuukauden kuluttua Havrix 720 -rokotteen ensimmäisen annoksen antamisesta.
Kliinisissä tutkimuksissa, joissa 16–18-vuotiaat nuoret saivat Havrix 720 -rokotetta, humoraalisia vasta-aineita hepatiitti A -virusta vastaan havaittiin yli 94 %:lla rokotetuista päivänä 15 ja 100 %:lla rokotetuista kuukauden kuluttua Havrix 720 -rokotteen ensimmäisen annoksen antamisesta.
Immuunivaste potilailla, joilla on krooninen maksasairaus
Kahdessa kliinisessä tutkimuksessa, joihin osallistui 300 kroonista maksasairautta (krooninen hepatiitti B, krooninen hepatiitti C tai muu krooninen maksasairaus) sairastavaa potilasta, potilaat saivat kaksi Havrix 1440 -rokoteannosta 6 kuukauden välein. Rokote sai aikaan havaittavat vasta-ainetitterit vähintään 95 %:lla rokotetuista yhden kuukauden kuluttua jälkimmäisestä annoksesta.
Immuunivasteen säilyminen
Pitkäaikaisen suojan varmistamiseksi tehosterokote on annettava 6–12 kuukauden kuluttua Havrix 720 tai Havrix 1440 -perusrokotteen antamisesta. Kliinisissä tutkimuksissa kaikki rokotetut olivat seropositiivisia kuukauden kuluttua tehosteannoksen antamisesta.
Jos tehosterokotetta ei anneta 6–12 kuukauden kuluessa perusrokotteesta, se voidaan vielä antaa viiden vuoden kuluttua perusrokotteen antamisesta. Vertailevassa tutkimuksessa aikuisilla viiden vuoden kuluessa perusrokotteesta annettu tehosteannos indusoi samankaltaiset vasta-ainetasot kuin 6–12 kuukauden kuluessa perusrokotteesta annettu tehosteannos.
Hepatiitti A -vasta-aineiden pitkäaikaista pysyvyyttä kahden Havrix 1440 -annoksen jälkeen on tutkittu, kun annokset annettiin 6–12 kuukauden välein. Toisessa kahdesta aikuisia koskeneesta kliinisestä tutkimuksesta (HAV-112) 96,7 % rokotetuista oli seropositiivisia 17,5 vuoden kohdalla ja toisessa (HAV-123) 100 % rokotetuista oli seropositiivisia 17 vuoden kohdalla. 17 ja 17,5 vuoden seurantatietojen perusteella voidaan ennustaa, että vähintään 95 % rokotetuista pysyy seropositiivisina (≥ 15 mlU/ml) 30 vuotta ja 90 % rokotetuista 40 vuotta rokotuksen jälkeen.
Tämänhetkinen tieto ei puolla tehosteannoksen antamista immunokompetenteille henkilöille kahden annoksen rokotusohjelman jälkeen.
Voidaan olettaa, että lapsilla suojan kesto on kahden Havrix 720 -annoksen jälkeen verrattavissa edellä esitettyyn aikuisten suojan arvioituun kestoon.
Farmakokinetiikka
Rokotteilta ei vaadita farmakokineettisiä tutkimuksia.
Prekliiniset tiedot turvallisuudesta
Simpansseilla tehdyissä turvallisuustutkimuksissa ei havaittu erityistä vaaraa ihmisille.
Lisääntymistoksisuutta koskevia tutkimuksia on tehty rotilla hepatiitti A:n ja hepatiitti B:n yhdistelmärokotteella (HAB). Kyseinen yhdistelmärokote sisältää samaa vaikuttavaa ainetta kuin Havrix. Rotille annettiin lihakseen 1/5 ihmiselle tarkoitetusta HAB -annoksesta (200 mikrolitran injektio lihakseen, joka sisälsi 144 ELISA -yksikköä hepatiitti A -virusta (inaktivoitu), 4 mikrogrammaa hepatiitti B -viruksen pinta-antigeeniä ja 0,09 mg alumiinia alumiinisuoloina). Sen käyttöön ei liittynyt emoon kohdistuvaa toksisuutta eikä sikiöiden/poikasten pre- tai postnataaliseen kehitykseen liittyviä haittavaikutuksia tai muita rokotteeseen liittyviä vaikutuksia havaittu.
Farmaseuttiset tiedot
Apuaineet
Aminohappoja injektiota varten (sis. fenyylialaniinia)
Dinatriumfosfaatti
Kaliumdivetyfosfaatti
Polysorbaatti 20 (E432)
Kaliumkloridi
Natriumkloridi
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Yhteensopivuustutkimusten puuttuessa, tätä rokotetta ei pidä sekoittaa muiden rokotteiden kanssa.
Kestoaika
3 vuotta
Säilytys
Säilytä jääkaapissa (2°C - 8°C).
Ei saa jäätyä. Jäätynyt rokote on hävitettävä.
Säilytä alkuperäispakkauksessa. Herkkä valolle.
Säilyvyystutkimukset osoittavat, että Havrix säilyy huoneenlämmössä (enintään 25 °C) 3 päivää. Tämä tieto on tarkoitettu vain terveydenhuollon ammattilaisille siltä varalta, että rokote säilytetään tilapäisesti jääkaapin ulkopuolella.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
HAVRIX injektioneste, suspensio, esitäytetty ruisku
1440 ELISA U/ml (L:ei) 0,5 ml (46,76 €), 1 ml (71,98 €)
PF-selosteen tieto
Havrix 720
-
0,5 ml suspensiota esitäytetyssä ruiskussa (tyypin I lasia), jossa männän tulppa (butyylikumia) ja kuminen kärkikorkki.
Pakkauskoot 1, 5, 10 tai 25, neuloilla tai ilman.
Havrix 1440
-
1 ml suspensiota esitäytetyssä ruiskussa (tyypin I lasia), jossa männän tulppa (butyylikumia) ja kuminen kärkikorkki.
Pakkauskoot 1, 5, 10 ja 25 neuloilla tai ilman. - 1 ml suspensiota injektiopullossa (tyypin I lasia), jossa tulppa (butyylikumia). Pakauskoot 1, 5, 10 ja 25.
Esitäytetyn ruiskun kärkikorkki ja kuminen männän tulppa sekä injektiopullon tulppa ovat valmistettu synteettisestä kumista.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Samea valkoinen suspensio. Varastoitaessa saattaa muodostua hienojakoinen valkoinen sakka ja kirkas väritön supernatantti.
Käyttö- ja käsittelyohjeet
Samea valkoinen suspensio. Varastoitaessa saattaa muodostua hienojakoinen valkoinen sakka ja kirkas väritön supernatantti.
Ennen antamista rokote tulee tarkastaa silmämääräisesti vierashiukkasten ja/tai fysikaalisten muutosten varalta. Ennen Havrixin käyttöä injektiopulloa/ruiskua on ravistettava hyvin, jolloin saadaan heikosti opalisoiva valkoinen suspensio. Jos ulkonäkö poikkeaa tästä, rokote on hylättävä.
Esitäytetyn ruiskun käyttöohje
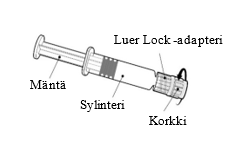 | Pidä kiinni ruiskun sylinteristä, ei männästä. Poista ruiskun korkki kiertämällä vastapäivään. |
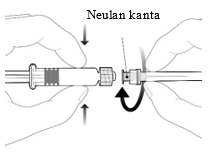 | Neula kiinnitetään ruiskuun yhdistämällä neulan kanta Luer Lock -adapteriin ja kiertämällä neulaa neljänneskierros myötäpäivään, kunnes neula tuntuu kiinnittyvän ruiskuun. Älä vedä ruiskun mäntää ulos sylinteristä. Jos mäntä irtoaa sylinteristä, älä anna rokotetta. |
Hävitys Käyttämätön lääkevalmiste ja jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
HAVRIX injektioneste, suspensio, esitäytetty ruisku
1440 ELISA U/ml 0,5 ml, 1 ml
- Ei korvausta.
ATC-koodi
J07BC02
Valmisteyhteenvedon muuttamispäivämäärä
08.04.2025
Yhteystiedot
 GLAXOSMITHKLINE OY
GLAXOSMITHKLINE OY Porkkalankatu 20 A
00180 Helsinki
010 303 030
www.glaxosmithkline.fi
