BREVIBLOC infuusioneste, liuos 10 mg/ml
Vaikuttavat aineet ja niiden määrät
Brevibloc 10 mg/ml infuusioneste, liuos sisältää 10 mg esmololihydrokloridia yhdessä millilitrassa. Yksi 250 ml:n pussi sisältää 2500 mg esmololihydrokloridia.
Apuaineet: Tämä lääkevalmiste sisältää noin 30,45 mmol (tai 700 mg) natriumia infuusiopussia kohti.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Infuusioneste, liuos.
Kirkas ja väritön tai kellertävä liuos.
Liuoksen pH on välillä 4,5–5,5 ja osmolaarisuus noin 300 mOsm/l.
Kliiniset tiedot
Käyttöaiheet
- Supraventrikulaarinen takykardia (lukuun ottamatta pre-eksitaatio-oireyhtymiä) tai nonkompensatorinen sinustakykardia
Brevibloc on tarkoitettu nopeasti ilmenevään kammiorytmin hallintaan potilailla, joilla on eteisvärinä tai eteislepatus perioperatiivisissa, postoperatiivisissa tai muissa tilanteissa, joissa tarvitaan lyhytkestoista kammioiden rytmin hallintaa lyhytvaikutteisella lääkkeellä. Brevibloc on tarkoitettu myös nonkompensatorisen sinustakykardian hoitoon, kun lääkärin arvion mukaan nopea syke edellyttää erityisiä toimenpiteitä.
- Takykardia ja hypertensio perioperatiivisessa vaiheessa
Anestesian induktion ja trakeaali-intubaation yhteydessä ilmenevän takykardian ja hypertension hoito leikkauksen aikana, anestesiasta heräämisen yhteydessä ja postoperatiivisessa vaiheessa, mikäli lääkäri katsoo näin spesifisen intervention aiheelliseksi.
Brevibloc-valmistetta ei ole tarkoitettu käytettäväksi alle 18-vuotiailla lapsilla (ks. kohta Annostus ja antotapa). Brevibloc-valmistetta ei ole tarkoitettu pitkäaikaiseen hoitoon.
Annostus ja antotapa
Annostus
Brevibloc 10 mg/ml infuusioneste, liuos on sellaisenaan käyttövalmis iso-osmoottinen liuos, joka suositellaan annettavaksi laskimoon.
SUPRAVENTRIKULAARINEN TAKYARYTMIA (lukuun ottamatta pre-eksitaatio-oireyhtymiä) TAI NONKOMPENSATORINEN SINUSTAKYKARDIA
Supraventrikulaarisessa takyarytmiassa Brevibloc-valmisteen annos on titrattava yksilöllisesti seuraavan vuokaavion mukaisesti.
Vuokaavio hoidon aloittamisesta ja ylläpitämisestä

Aloitusannos
Aloitusannoksen säätäminen voi olla tarpeen hemodynaamisesta vasteesta riippuen (syketaajuus, verenpaine).
Ylläpitoannos
Tehokas ylläpitoannos jatkuvaan ja progressiiviseen annosteluun on 50–200 mikrog/kg/min. Myös 25 mikrog/kg/min annoksia voidaan käyttää.
Ylläpitoannoksen säätäminen voi olla tarpeen halutusta hemodynaamisesta vasteesta riippuen.
Yli 200 mikrog/kg/min annoksilla ei saavuteta juurikaan lisätehoa syketaajuuden hidastamisessa, ja haittavaikutusten yleisyys nousee.
Aloitusannos ja ylläpitoannokset eri painoisille potilaille on esitetty taulukossa 1 ja 2.
Taulukko 1
Brevibloc 10 mg/ml tilavuus, joka tarvitaan
ENSIMMÄISEEN ALOITUSANNOKSEEN infuusionopeudella 500 mikrog/ kg / minuutti
| Potilaan paino (kg) | |||||||||
| 40 | 50 | 60 | 70 | 80 | 90 | 100 | 110 | 120 | |
| Tilavuus (ml) | 2 | 2,5 | 3 | 3,5 | 4 | 4,5 | 5 | 5,5 | 6 |
Taulukko 2
Brevibloc 10 mg/ml tilavuus, joka tarvitaan
YLLÄPITOANNOKSIIN infuusionopeudella 12.5 - 300 mikrog/kg/minuutti
| Potilaan paino (kg) | Infuusioannosnopeus | ||||||
12.5 mikrog/kg/min | 25 mikrog/kg/min | 50 mikrog/kg/min | 100 mikrog/kg/min | 150 mikrog/kg/min | 200 mikrog/kg/min | 300 mikrog/kg/min | |
| Tunnissa annosteltava määrä annosnopeuden saavuttamiseksi (ml / h) | |||||||
| 40 | 3 ml/h | 6 ml/h | 12 ml/h | 24 ml/h | 36 ml/h | 48 ml/h | 72 ml/h |
| 50 | 3,75 ml/h | 7,5 ml/h | 15 ml/h | 30 ml/h | 45 ml/h | 60 ml/h | 90 ml/h |
| 60 | 4,5 ml/h | 9 ml/h | 18 ml/h | 36 ml/h | 54 ml/h | 72 ml/h | 108 ml/h |
| 70 | 5,25 ml/h | 10,5 ml/h | 21 ml/h | 42 ml/h | 63 ml/h | 84 ml/h | 126 ml/h |
| 80 | 6 ml/h | 12 ml/h | 24 ml/h | 48 ml/h | 72 ml/h | 96 ml/h | 144 ml/h |
| 90 | 6,75 ml/h | 13,5 ml/h | 27 ml/h | 54 ml/h | 81 ml/h | 108 ml/h | 162 ml/h |
| 100 | 7,5 ml/h | 15 ml/h | 30 ml/h | 60 ml/h | 90 ml/h | 120 ml/h | 180 ml/h |
| 110 | 8,25 ml/h | 16,5 ml/h | 33 ml/h | 66 ml/h | 99 ml/h | 132 ml/h | 198 ml/h |
| 120 | 9 ml/h | 18 ml/h | 36 ml/h | 72 ml/h | 108 ml/h | 144 ml/h | 216 ml/h |
1 ml Brevibloc-valmistetta vastaa 10 mg:aa esmololia.
Lähestyttäessä tavoiteltua syketaajuutta tai turvallisen annoksen ylärajaa (esim. alentunut verenpaine), JÄTÄ POIS aloitusinfuusio ja pienennä ylläpitoinfuusion lisäystä annoksesta 50 mikrog/kg/min annokseen 25 mikrog/kg/min tai pienempään. Tarvittaessa titraatiovaiheiden väliaika voidaan nostaa viidestä minuutista kymmeneen.
PERIOPERATIIVINEN TAKYKARDIA JA HYPERTENSIO
Hoidettaessa takykardiaa ja/tai hypertensiota perioperatiivisissa tapauksissa, voidaan seuraavia annosteluohjeita käyttää.
Intraoperatiivisessa hoidossa, anestesian aikana, kun tarvitaan välittömiä toimenpiteitä:
- Anna bolusinjektiona 80 mg 15–30 sekunnin aikana, jonka jälkeen annetaan infuusiona 150 mikrog/kg/min. Titraa infuusioannos tarvittaessa enintään annokseen 300 mikrog/kg/min. Eripainoisille potilaille tarvittava infuusiomäärä on annettu taulukossa 2.
Herääminen anestesiasta
- Anna infuusiona 500 mikrog/kg/min neljän minuutin ajan ja sen jälkeen infuusiona 300 mikrog/kg/min. Eripainoisille potilaille tarvittava infuusiomäärä on annettu taulukossa 2.
Postoperatiivisissa tapauksissa, kun aikaa annostitraukseen on käytettävissä
- Anna aloitusannos 500 mikrog/kg/min yhden minuutin ajan ennen kutakin titraatiovaihetta, nopean vaikutuksen aikaansaamiseksi. Käytä titraatioaskeleita 50, 100, 150, 200, 250 ja 300 mikrog/kg/min aina neljän minuutin ajan, siihen askeleeseen asti, kunnes haluttu hoitovaikutus saavutetaan. Eripainoisille potilaille tarvittava infuusiomäärä on annettu taulukossa 2.
Suositeltu enimmäisannos:
- Verenpaineen riittävä hallinta voi vaatia suurempia annoksia (250–300 mikrog/kg/min). Yli 300 mikrog/kg/min annosten turvallisuutta ei ole tutkittu riittävästi.
Mahdollisia vaikutuksia, jotka on otettava huomioon Brevibloc-hoidon aikana:
Haittavaikutuksen ilmaantuessa Brevibloc-annosta voidaan pienentää tai anto keskeyttää. Farmakologisten haittavaikutusten pitäisi hävitä 30 minuutin sisällä.
Jos potilaalle kehittyy paikallinen infuusiokohdan reaktio, on käytettävä vaihtoehtoista infuusiokohtaa ja oltava huolellinen ekstravasaation estämiseksi.
Yli 24 tuntia kestäviä Brevibloc-infuusioita ei ole tutkittu riittävästi, joten yli vuorokauden kestävään Brevibloc-hoitoon tulee suhtautua varovaisuudella.
On suositeltavaa lopettaa infuusio asteittain takykardian ja korkean verenpaineen uusiutumisen riskin takia. Kuten kaikkien beetasalpaajien kohdalla, koska vieroitusoireiden mahdollisuutta ei voida sulkea pois, varovaisuutta on noudatettava Brevibloc-hoidon lopettamisessa äkillisesti, jos potilaalla on sepelvaltimotauti.
Brevibloc-hoidon korvaaminen vaihtoehtoisilla lääkkeillä
Kun potilaan syketiheys on riittävässä hallinnassa ja potilaan vointi on vakaa, voit siirtyä vaihtoehtoisiin lääkkeisiin (esim. rytmihäiriölääkkeet tai kalsiumkanavan salpaajat).
Annoksen pienentäminen:
Kun Brevibloc on tarkoitus korvata vaihtoehtoisilla lääkkeillä, lääkärin on tutkittava huolellisesti valitun vaihtoehtoisen lääkkeen annosteluohjeita ja pienennettävä Brevibloc-annosta seuraavasti:
- Ensimmäisen tunnin sisällä vaihtoehtoisen lääkkeen ensimmäisestä annoksesta vähennä Brevibloc-infuusionopeutta puolella (50 %).
- Kun vaihtoehtoista lääkettä on annettu toinen annos, tarkkaile potilaan vastetta ja jos vaste pysyy hyväksyttävänä ensimmäisen tunnin ajan, lopeta Brevibloc-infuusio.
Muut annostelutiedot
Lähestyttäessä toivottua terapeuttista vaikutusta tai turvallisen annoksen ylärajaa (esim. alentunut verenpaine), jätä aloitusannos pois ja pienennä ylläpitoinfuusion lisäystä 12,5–25 mikrog:aan/kg/min. Nosta tarvittaessa titraatiovaiheiden väliaikaa viidestä minuutista kymmeneen.
Brevibloc-valmisteen annostelu on keskeytettävä, kun syke tai verenpaine saavuttaa nopeasti turvallisuusrajan tai ylittää sen, ja aloitettava sitten uudelleen ilman aloitusinfuusiota pienemmällä annoksella, kun syke tai verenpaine on palannut hyväksyttäviin rajoihin.
Erityisryhmät
Iäkkäät
Iäkkäitä potilaita on hoidettava varovasti ja aloitettava pienemmällä annoksella.
Erityisiä tutkimuksia ei ole tehty iäkkäillä potilailla. 252:n yli 65-vuotiaan potilaan tietojen analyysi kuitenkin kertoi, ettei farmakodynaamisissa vaikutuksissa esiintynyt vaihtelua verrattuna alle 65-vuotiaiden potilaiden tietoihin.
Potilaat, joilla on munuaisten vajaatoiminta
Munuaisten vajaatoimintapotilaiden kohdalla on noudatettava varovaisuutta, kun Brevibloc-valmistetta annostellaan infusoimalla, koska Brevibloc-valmisteen hapan aineenvaihduntatuote erittyy munuaisten kautta muuttumattomana. Happaman aineenvaihduntatuotteen erittyminen pienenee huomattavasti potilailla, joilla on munuaissairaus, ja eliminaation puoliintumisaika nousee kymmenkertaiseksi normaaliin verrattuna. Tämän aineenvaihduntatuotteen pitoisuudet plasmassa nousevat myös huomattavasti.
Potilaat, joilla on maksan vajaatoiminta
Maksan vajaatoiminnan suhteen ei tarvita erityisiä varotoimia, koska punasolujen esteraasilla on päärooli Brevibloc-valmisteen metaboliassa.
Lapset
Brevibloc-valmisteen turvallisuutta ja tehoa 18-vuotiaiden tai sitä nuorempien lasten hoidossa ei ole vielä varmistettu. Tämän vuoksi Brevibloc-valmistetta ei ole tarkoitettu käytettäväksi lapsille (ks. kohta Käyttöaiheet). Parhaillaan saatavilla olevat tiedot on kuvattu kohdissa Farmakodynamiikka ja Farmakokinetiikka, mutta annossuosituksia ei voida antaa.
Vasta-aiheet
- yliherkkyys vaikuttavalle aineelle, apuaineille tai muille beetasalpaajille (ristiyliherkkyys beetasalpaajien välillä on mahdollista)
- vaikea sinusbradykardia (alle 50 lyöntiä minuutissa)
- sairas sinus -oireyhtymä; vaikea AV-solmukkeen johtumishäiriö (ilman tahdistinta); II tai III asteen AV-katkos
- kardiogeeninen sokki
- vaikea hypotensio
- kompensoimaton sydämen vajaatoiminta
- samanaikainen tai viimeaikainen laskimoon annettu verapamiili; Brevibloc-valmistetta ei saa antaa 48 tunnin sisällä verapamiilihoidon lopettamisesta (ks. kohta Yhteisvaikutukset)
- hoitamaton feokromosytooma
- keuhkoverenpainetauti
- akuutti astmakohtaus
- metabolinen asidoosi
Varoitukset ja käyttöön liittyvät varotoimet
Varoitukset
On suositeltavaa seurata jatkuvasti kaikkien Brevibloc-valmisteella hoidettavien potilaiden verenpainetta ja EKG:tä.
Brevibloc-valmistetta on käytettävä varoen kammiorytmin hallintaan potilailla, joilla on supraventrikulaarisia rytmihäiriöitä, kun potilaan hemodynamiikka on epävakaa tai hän ottaa muita lääkkeitä, jotka laskevat/pienentävät jotakin tai kaikkia seuraavista: perifeerinen vastus, sydämen täyttyminen, sydänlihaksen supistuvuus tai sähköisen impulssin eteneminen sydänlihaksessa. Huolimatta Brevibloc-valmisteen aiheuttamien vaikutusten nopeasta alkamisesta ja päättymisestä vaikeita reaktioita voi ilmetä, kuten tajunnanmenetys, kardiogeeninen sokki ja sydänpysähdys. Useita kuolemantapauksia on raportoitu monimutkaisissa hoitotilanteissa, jolloin Brevibloc-valmistetta käytettiin oletettavasti hallitsemaan potilaan kammiorytmiä.
Yleisin haittavaikutus on verenpaineen lasku, joka riippuu annoksen suuruudesta, mutta voi ilmetä käytettäessä mitä tahansa annosta. Tämä voi olla vaikea. Mikäli potilaan verenpaine laskee liikaa, infuusionopeutta on pienennettävä tai tarvittaessa infuusio on lopetettava. Matala verenpaine normaalistuu tyypillisesti 30 minuutin sisällä Brevibloc-valmisteen annostelun lopettamisesta. Joissakin tapauksissa lisätoimet voivat olla tarpeen verenpaineen kohottamiseksi. Jos potilaalla on matala systolinen verenpaine, tarvitaan erityistä varovaisuutta säädettäessä aloitusannosta sekä ylläpitoinfuusion aikana.
Brevibloc-valmisteen käytön yhteydessä on esiintynyt bradykardiaa, myös vaikeaa bradykardiaa, sekä sydänpysähdyksiä. Brevibloc-valmistetta on käytettävä erityisen varoen potilaille, joilla on hoitoa edeltävä matala syke, ja vain silloin, kun hyötyjen katsotaan olevan riskiä suurempia.
Brevibloc-valmiste on vasta-aiheinen potilaille, joilla on aiempi vaikea sinusbradykardia (ks. kohta Vasta-aiheet).
Jos potilaan leposyke laskee alle 50–55 lyöntiin minuutissa ja potilaalla esiintyy bradykardiaan liittyviä oireita, on annosta pienennettävä tai annostelu lopetettava.
Sympaattinen stimulaatio on tarpeen verenkierron tukemisessa kongestiivisessa sydämen vajaatoiminnassa ja beetasalpauksella on potentiaalinen vaara heikentää sydänlihaksen supistuvuutta lisää ja siten pahentaa sydämen vajaatoimintaa. Jatkuva sydänlihaksen lamaaminen vaimentaminen beetasalpaajilla voi ajan myötä joissakin tapauksissa johtaa sydämen vajaatoimintaan.
Varovaisuutta on kuitenkin noudatettava, kun Brevibloc-valmistetta käytetään sydämen vajaatoiminnassa. Kun uhkaavasta sydämen vajaatoiminnasta ilmaantuu ensimmäinen merkki tai oire, Brevibloc-hoito on lopetettava. Vaikka pelkkä hoidon lopettaminen voi korjata tilanteen Brevibloc-valmisteen lyhyen eliminaation puoliintumisajan takia, asianmukaista hoitoa voidaan myös harkita (ks. kohta Yliannostus). Brevibloc on vasta-aiheinen potilailla, joilla on kompensoimaton sydämen vajaatoiminta (ks. kohta Vasta-aiheet).
Koska beetasalpaajilla on negatiivinen vaikutus johtumisaikaan, niitä on annettava varoen potilaille, joilla on sydämen ensimmäisen asteen johtumiskatkos tai muu sydämen johtumishäiriö (ks. kohta Vasta-aiheet).
Brevibloc-valmistetta on käytettävä varoen ja vain alfasalpaajahoidon aloittamisen jälkeen potilaille, joilla on feokromosytooma (ks. kohta Vasta-aiheet).
Brevibloc-valmistetta on käytettävä varoen potilailla, jotka saavat hoitoa korkeaan verenpaineeseen, kun verenpaine on kohonnut hypotermian seurauksena.
Bronkospasmeihin taipuvaisilla potilailla beetasalpaajien käyttöä tulee yleensä välttää, mutta suhteellisen hyvän beeta1-selektiivisyyden ja annosteltavuuden vuoksi Brevibloc-valmistetta voidaan käyttää varovasti näillä potilailla. Koska beeta1-selektiivisyys ei kuitenkaan ole täydellistä, Brevibloc-valmisteen annos on titrattava huolellisesti, jotta saadaan pienin mahdollinen tehokas annos. Bronkospasmin ilmaantuessa, infuusio on lopetettava välittömästi ja beeta2-agonistia on annettava tarvittaessa.
Jos potilaalla on jo käytössä beeta2-reseptoreja stimuloiva valmiste, voi olla tarpeen arvioida uudelleen tämän valmisteen annos.
Brevibloc-valmistetta on käytettävä varoen potilailla, joilla on aikaisemmin esiintynyt vinkuvaa hengitystä tai astmaa.
Varotoimet
Brevibloc-valmistetta on käytettävä varoen diabetespotilailla tai potilailla, joilla on todellinen tai epäilty hypoglykemia. Beetasalpaajat voivat peittää hypoglykemian ensioireita, kuten takykardian. Ne eivät kuitenkaan ehkä vaikuta huimaukseen ja hikoiluun. Samanaikainen beetasalpaajien ja diabeteslääkkeiden käyttö voi suurentaa diabeteslääkityksen vaikutusta (verensokerin laskemista) (ks. kohta Yhteisvaikutukset).
Infuusiokohdan reaktioita on esiintynyt käytettäessä Brevibloc-valmistetta sekä annoksella 10 mg/ml että 20 mg/ml. Näitä reaktioita ovat olleet infuusiokohdan ärsytys ja tulehdus sekä vaikeammat reaktiot, kuten tromboflebiitti, nekroosi ja rakkuloiden muodostus, erityisesti liittyen ekstravasaatioon (ks. kohta Haittavaikutukset). Infusointia pieniin verisuoniin tai perhoskatetrin kautta on siten vältettävä. Jos potilaalle kehittyy paikallinen infuusiokohdan reaktio, on käytettävä vaihtoehtoista infuusiokohtaa.
Beetasalpaajat voivat lisätä angina-kohtausten määrää ja kestoa potilailla, joilla on Prinzmetalin angina, vääjäämättömän alfareseptorin välittämän sepelvaltimon vasokonstriktion takia. Näillä potilailla ei saa käyttää epäselektiivisiä beetasalpaajia ja beeta1-selektiivisiä salpaajia saa käyttää vain noudattaen äärimmäistä varovaisuutta.
Hypovoleemisilla potilailla Brevibloc voi vaimentaa refleksitakykardiaa ja suurentaa verenkierron pysähtymisen vaaraa. Tästä syystä Brevibloc-valmistetta on käytettävä varoen näillä potilailla.
Beetasalpaajia on käytettävä äärimmäistä varovaisuutta noudattaen potilailla, joilla on ääreisverenkierron häiriöitä (Raynaud’n tauti tai oireyhtymä, katkokävelyä), koska oireet voivat pahentua.
Beetasalpaajiin, erityisesti, laskimonsisäisesti annosteltuihin, myös Brevibloc-valmisteeseen, on liittynyt seerumin kaliumpitoisuuden nousua ja hyperkalemiaa. Vaara on suurempi potilailla, joilla on riskitekijöitä, kuten munuaisten vajaatoiminta tai hemodialyysi.
Beetasalpaajat voivat lisätä sekä herkkyyttä allergeeneille, että anafylaktisten reaktioiden vakavuutta. Beetasalpaajia saavilla potilailla ei ehkä esiinny vastetta tavallisiin adrenaliiniannoksiin, joita käytetään anafylaktisten tai anafylaktoidisten reaktioiden hoidossa (ks. kohta Yhteisvaikutukset).
Beetasalpaajat on liitetty psoriaasin kehittymiseen tai psoriaasin kaltaisten iho-oireiden puhkeamiseen sekä psoriaasin pahenemiseen. Potilaille, joilla itsellä tai perheenjäsenellä on tai on ollut psoriaasi, on annettava beetasalpaajia vain odotettujen hyötyjen ja riskien huolellisen harkinnan jälkeen.
Beetasalpaajat, kuten propranololi ja metoprololi, voivat peittää tiettyjä kilpirauhasen liikatoiminnan kliinisiä merkkejä (kuten takykardian). Äkillinen beetasalpaajahoidon lopettaminen riskipotilailla tai niillä, joille epäillään kehittyvän tyreotoksikoosi, voi ennakoida tyreotoksista kriisiä ja näitä potilaita on seurattava tarkasti.
Tämä lääkevalmiste sisältää noin 30,45 mmol (tai 700 mg) natriumia pussia kohden. Tämä tulee ottaa huomioon natriumrajoitettua ruokavaliota noudattavien potilaiden kohdalla.
Yhteisvaikutukset
Varovaisuutta on noudatettava aina, kun Brevibloc-valmistetta käytetään yhdessä muiden verenpainelääkkeiden kanssa tai muiden mahdollisesti hypotensiota tai bradykardiaa aiheuttavien lääkkeiden kanssa: Brevibloc-valmisteen vaikutukset voivat lisääntyä tai hypotensio- tai bradykardiasivuvaikutukset pahentua.
Kalsiumkanavan salpaajilla, kuten verapamiililla, ja pienemmissä määrin diltiatseemillä, on negatiivinen vaikutus sydämen supistuvuuteen ja eteis-kammiojohtumiseen. Lääkeyhdistelmää ei tule antaa potilaille, joilla on sydämen johtumishäiriöitä, eikä Brevibloc-valmistetta saa antaa 48 tunnin sisällä verapamiilihoidon lopettamisesta (ks. kohta Vasta-aiheet).
Kalsiumkanavan salpaajista dihydropyridiinijohdokset (esim. nifedipiini), voivat suurentaa hypotension riskiä. Sydämen vajaatoimintapotilailla, joita hoidetaan kalsiumkanavan salpaajilla, hoito beetasalpaajilla voi johtaa sydämen vajaatoimintaan. Huolellinen Brevibloc-valmisteen annoksen titraus ja asianmukainen verenkierron seuranta on suositeltavaa.
Samanaikainen Brevibloc-valmisteen ja luokan I rytmihäiriölääkkeiden (esim. disopyramidin, kinidiinin) ja amiodaronin käyttö voi voimistaa vaikutusta eteisjohtumisaikaan ja aiheuttaa negatiivisen inotrooppisen vaikutuksen.
Samanaikainen Brevibloc-valmisteen ja insuliinin tai suun kautta otettavien diabeteslääkkeiden käyttö voi voimistaa verensokeria laskevaa vaikutusta (erityisesti epäselektiiviset beetasalpaajat). Beeta-adrenerginen salpaus voi estää hypoglykemian merkkien ilmenemisen (takykardia), mutta muut oireet, kuten huimaus ja hikoilu, eivät ehkä peity.
Anestesialääkkeet: Tilanteissa, joissa potilaan nestetilavuudesta ei ole varmaa tietoa tai potilas saa samanaikaisesti hypertensiolääkkeitä, refleksitakykardia voi vaimentua ja verenpaineen laskun riski suurentua. Beetasalpauksen jatkaminen pienentää rytmihäiriöriskiä induktion ja intuboinnin aikana. Anestesialääkärille on kerrottava, jos potilas saa beetasalpaajaa Brevibloc-valmisteen lisäksi. Inhaloitavien anestesia-aineiden verenpainetta laskevat vaikutukset voivat voimistua, jos potilas käyttää Brevibloc-valmistetta. Kumman tahansa aineen annostusta voidaan muokata tarvittaessa, tavoiteltavan hemodynamiikan ylläpitämiseksi.
Brevibloc-valmisteen yhdistäminen ganglioita salpaaviin aineisiin voi tehostaa hypotensiovaikutusta.
Tulehduskipulääkkeet voivat vähentää beetasalpaajien verenpainetta alentavaa vaikutusta.
Erityistä varovaisuutta on noudatettava käytettäessä floktafeniiniä tai amisulpridia samanaikaisesti beetasalpaajien kanssa.
Samanaikainen trisyklisten antidepressanttien (kuten imipramiinin ja amitriptyliinin), barbituraattien ja fenotiatsiinien (kuten klooripromatsiinin) sekä muiden antipsykoottisten lääkkeiden (kuten klotsapiinin) annostelu voi lisätä verenpainetta laskevaa vaikutusta. Brevibloc-valmisteen annosta on säädettävä alaspäin odottamattoman verenpaineen laskun välttämiseksi.
Beetasalpaajia saavat potilaat, joilla on anafylaktisten reaktioiden riski, voivat reagoida enemmän allergeeneihin (tahattomiin, diagnostisiin tai terapeuttisiin). Beetasalpaajia saavilla potilailla ei ehkä esiinny vastetta tavallisiin adrenaliiniannoksiin, joita käytetään anafylaktisten reaktioiden hoidossa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Sympatomimeettiset lääkkeet, joilla on beeta-agonistiaktiviteettia, voivat samanaikaisesti annosteltuna ehkäistä Brevibloc-valmisteen vaikutuksia. Toisen aineen annosta on ehkä säädettävä potilaan vasteen perusteella tai vaihtoehtoisten lääkkeiden käyttöä harkittava.
Katekoliamiinivarastoja pienentävillä lääkeaineilla, esim. reserpiinillä, voi olla additiivinen vaikutus, kun niitä annetaan samanaikaisesti beetasalpaajien kanssa. Potilaita, joita hoidetaan samanaikaisesti Brevibloc-valmisteella ja katekoliamiinivarastoja pienentävillä lääkeaineilla, on siksi seurattava huolellisesti verenpaineen laskun tai huomattavan bradykardian merkkien varalta, mitkä voivat johtaa kiertohuimaukseen, pyörtymiseen tai posturaaliseen hypotensioon.
Samanaikainen beetasalpaajien ja alfa2-agonistia (kuten klonidiinia) tai moksonidiinia sisältävien lääkkeiden käyttö lisää lopetuksen aiheuttaman rebound-hypertension riskiä. Jos klonidiinia tai moksonidiinia käytetään samanaikaisesti beetasalpaajan kanssa ja molemmat hoidot on keskeytettävä, beetasalpaajalääkitys on aina lopetettava ensin ja sitten klonidiini- tai moksonidiinihoito muutaman päivän kuluttua.
Ergotalkaloidijohdosten ja beetasalpaajien samanaikainen käyttö voi aiheuttaa vaikean ääreisverisuonien supistumisen ja korkean verenpaineen.
Brevibloc-valmisteen ja varfariinin yhteisvaikutustutkimuksen tulokset osoittivat, että samanaikainen Brevibloc-valmisteen ja varfariinin anto ei muuta varfariinin pitoisuutta plasmassa. Brevibloc-pitoisuudet olivat kuitenkin korkeampia, kun Brevibloc-valmistetta annettiin varfariinin kanssa.
Kun digoksiinia ja Brevibloc-valmistetta annettiin samanaikaisesti laskimoon terveille vapaaehtoisille, oli veren digoksiinipitoisuuksissa joinakin mittausajankohtina 10–20 % nousu. Digitalisglykosidien ja Brevibloc-valmisteen yhdistelmä voi pidentää eteis-kammio-johtumisaikaa. Digoksiini ei vaikuttanut Brevibloc-valmisteen farmakokinetiikkaan.
Kun laskimoon annetun morfiinin ja Brevibloc-valmisteen yhteisvaikutuksia tutkittiin terveillä koehenkilöillä, vaikutusta veren morfiinipitoisuuksiin ei havaittu. Brevibloc-valmisteen vakaan tilan pitoisuus veressä nousi 46 % annosteltaessa morfiinia samanaikaisesti, mutta muut farmakokineettiset parametrit eivät muuttuneet.
Brevibloc-valmisteen vaikutusta suksametonikloridilla tai mivakuurilla indusoituun neuromuskulaariseen salpaukseen on tutkittu leikkauspotilailla. Brevibloc ei vaikuttanut suksametonikloridin aiheuttamaan neuromuskulaarisen salpauksen alkamiseen, mutta neuromuskulaarisen salpauksen kesto piteni 5 minuutista 8 minuuttiin. Brevibloc pidensi kohtalaisesti mivakuurin kliinistä kestoa (18,6 %) ja toipumisindeksiä (6,7 %).
Vaikka varfariini-, digoksiini-, morfiini-, suksametonikloridi- tai mivakuuritutkimuksissa havaitut yhteisvaikutukset eivät ole kliinisesti kovin merkittäviä, Brevibloc-valmistetta on annettava varoen potilaille, joita hoidetaan samanaikaisesti varfariinilla, digoksiinilla, morfiinilla, suksametonikloridilla tai mivakuurilla.
Raskaus ja imetys
Raskaus
On olemassa vain vähän tietoa esmololihydrokloridin käytöstä raskaana oleville naisille. Eläinkokeissa on havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta).
Esmololihydrokloridia ei suositella raskauden aikana.
Farmakologisen vaikutusmekanismin perusteella raskauden myöhemmässä vaiheessa on otettava huomioon sikiölle ja vastasyntyneelle aiheutuvat haittavaikutukset (erityisesti hypoglykemia, hypotensio ja bradykardia).
Jos Brevibloc-hoito katsotaan tarpeelliseksi, istukan ja kohdun verenkiertoa ja sikiön kasvua on tarkkailtava. Vastasyntynyttä on tarkkailtava huolellisesti.
Imetys
Rintaruokinta on lopetettava esmololihydrokloridihoidon ajaksi.
Ei tiedetä, erittyvätkö esmololihydrokloridi/metaboliitit ihmisen rintamaitoon. Vastasyntyneeseen/imeväiseen kohdistuvia riskejä ei voida poissulkea.
Hedelmällisyys
Ihmisillä tehtyjä tutkimuksia esmololin vaikutuksista hedelmällisyyteen ei ole.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Ei oleellinen.
Haittavaikutukset
Mikäli potilaalla esiintyy haittavaikutuksia, Brevibloc-annosta voidaan pienentää tai valmisteen anto keskeyttää.
Useimmat havaitut haittavaikutukset ovat olleet lieviä ja ohimeneviä. Tärkein haittavaikutus on ollut hypotensio.
Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Huomioi: Haittavaikutusten esiintyminen on luokiteltu seuraavasti:
- Hyvin yleinen (≥ 1/10)
- Yleinen (≥ 1/100, < 1/10)
- Melko harvinainen (≥ 1/1000, < 1/100)
- Hyvin harvinainen (<1/10000)
- Tuntematon (Koska saatavissa oleva tieto ei riitä arviointiin)
| Elinjärjestelmä | |
| Aineenvaihdunta ja ravitsemus | |
| yleinen: | anoreksia |
| tuntematon: | hyperkalemia, metabolinen asidoosi |
| Psyykkiset häiriöt | |
| yleinen: | depressio, ahdistus |
| melko harvinainen: | epänormaali ajattelu |
| Hermosto | |
| yleinen: | huimaus1, uneliaisuus, päänsärky, parestesiat, huomiohäiriö, sekavuustila, kiihtyneisyys |
| melko harvinainen: | pyörtyminen, kouristukset, puhehäiriö |
| Silmät | |
| melko harvinainen: | näön heikkeneminen |
| Sydän | |
| melko harvinainen: | bradykardia, eteis-kammiokatkos, keuhkovaltimoverenpaineen nousu, sydämen vajaatoiminta, kammiolisälyönnit, nodaalirytmi, angina pectoris |
| hyvin harvinainen: | sinuspysähdys, asystolia |
| tuntematon: | kiihtynyt idioventrikulaarinen rytmi, sydämen koronaarispasmi, sydänpysähdys |
| Verisuonisto | |
| hyvin yleinen: | hypotensio |
| melko harvinainen: | perifeerinen iskemia, kalpeus, punastelu |
| hyvin harvinainen: | tromboflebiitti2 |
| Hengityselimet, rintakehä ja välikarsina | |
| melko harvinainen: | hengenahdistus, keuhkoödeema, bronkospasmi, hengityksen vinkuminen, nenän tukkoisuus, rahinat, epätavalliset hengitysäänet |
| Ruoansulatuselimistö | |
| yleinen: | pahoinvointi, oksentelu |
| melko harvinainen: | makuhäiriöt, dyspepsia, ummetus, suun kuivuminen, vatsakipu |
| Iho ja ihonalainen kudos | |
| hyvin yleinen: | voimakas hikoilu1 |
| melko harvinainen: | ihon värimuutokset2, eryteema2 |
| hyvin harvinainen: | ihon nekroosi (ekstravasaation takia)2 |
| tuntematon: | psoriaasi3, angioödeema, urtikaria |
| Luusto, lihakset ja sidekudos | |
| melko harvinainen: | luu- ja lihaskivut 4 |
| Munuaiset ja virtsatiet | |
| melko harvinainen: | virtsaumpi |
| Yleisoireet ja antopaikassa todettavat haitat | |
| yleinen: | heikkous, väsymys, injektiokohdan reaktio, infuusiokohdan reaktio, infuusiokohdan tulehdus, infuusiokohdan kovettuma |
| melko harvinainen: | vilunväristykset, kuume, turvotus2, kipu2, infuusiokohdan polttelu, infuusiokohdan mustelmat |
| tuntematon: | infuusiokohdan flebiitti, infuusiokohdan vesirakkulat, rakkuloiden muodostuminen2 |
1 Huimaus ja voimakas hikoilu liittyvät matalan verenpaineen oireisiin.
2 Liittyy injektio- ja infuusiokohdan reaktioihin.
3 Beetasalpaajat voivat lääkeluokkana aiheuttaa psoriaasia joissakin tilanteissa tai pahentaa sitä.
4 Sisältää lapaluun keskialueen kivun ja Tietzen oireyhtymän (kostokondriitin)
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty‐haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Massiivisen tahattoman yliannostuksen tapauksia on esiintynyt Brevibloc-konsentraattiliuoksia käytettäessä. Jotkin näistä yliannostuksista ovat johtaneet kuolemaan ja toiset pysyvään vammaan. Aloitusannokset välillä 625 mg–2,5 g (12,5–50 mg/kg) ovat johtaneet kuolemaan.
Oireet
Yliannostustapauksessa voi ilmetä seuraavia oireita: vaikea hypotensio, sinusbradykardia, eteis-kammio-katkos, sydämen vajaatoiminta, kardiogeeninen sokki, sydänpysähdys, bronkospasmi, hengityksen vajaatoiminta, tajunnanmenetys tai kooma, kouristukset, pahoinvointi, oksentelu, hypoglykemia ja hyperkalemia.
Hoito
Brevibloc-valmisteen lyhyen eliminaation puoliintumisajan (noin 9 minuuttia) vuoksi ensimmäinen askel toksisuuden hoidossa on keskeyttää lääkkeen anto. Oireiden häviämisaika yliannostuksen jälkeen riippuu annostellusta Brevibloc-valmisteen määrästä. Tämä voi viedä pidempään kuin 30 minuuttia, kuten on havaittu keskeytettäessä Brevibloc-annostelu terapeuttisilla annostasoilla. Hengityksen tukeminen voi olla tarpeen. Havaittujen kliinisten vaikutusten perusteella seuraavia yleisiä toimenpiteitä on myös harkittava:
Bradykardia: atropiinia tai muuta antikolinergistä lääkettä on annettava laskimoon. Jos sydämen harvalyöntisyyttä ei pystytä hoitamaan riittävästi, tahdistin voi olla tarpeen.
Bronkospasmi: sumutettuja beeta2-sympatomimeettejä on annettava. Jos tämä ei riitä, laskimonsisäisen beeta2-sympatomimeetin tai aminofylliinin antoa voidaan harkita.
Oireinen hypotensio: nesteitä ja/tai verenpainetta nostavia aineita on annettava laskimoon.
Kardiovaskulaarinen depressio tai sydänperäinen sokki: diureetteja tai sympatomimeettejä voidaan antaa. Sympatomimeettiannos (riippuen oireista: dobutamiini, dopamiini, noradrenaliini, isoprenaliini jne.) riippuu hoidon vaikutuksesta.
Mikäli lisähoito on tarpeen, seuraavia lääkeaineita voidaan antaa laskimoon kliinisen tilanteen ja hoitavan lääkärin harkinnan perusteella:
- atropiini
- inotrooppiset aineet
- kalsium
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: selektiiviset beetasalpaajat.
ATC-koodi: C07AB09
Brevibloc on beetaselektiivinen (kardioselektiivinen) adrenergistä reseptoria salpaava yhdiste. Hoitoannoksilla Brevibloc-valmisteella ei ole merkittävää sympatomimeettistä ominaisvaikutusta (ISA) tai solukalvoja stabiloivaa vaikutusta.
Brevibloc-valmisteen vaikuttava ainesosa, esmololihydrokloridi, liittyy kemiallisesti fenoksipropanoliamiini-luokan beetasalpaajiin.
Farmakologisten ominaisuuksiensa perusteella Brevibloc-valmisteella on nopea vaikutuksen alku ja erittäin lyhyt vaikutuksen kesto, joten annosta voidaan säätää nopeasti.
Kun oikeaa aloitusannosta käytetään, steady state -taso veressä saavutetaan viiden minuutin sisällä. Hoitovaikutus saavutetaan kuitenkin nopeammin kuin vakaa plasmapitoisuus. Infuusionopeutta voidaan sitten säätää halutun farmakologisen vaikutuksen aikaansaamiseksi.
Brevibloc-valmisteella on tunnettu beetasalpaajien hemodynaaminen ja elektrofysiologinen vaikutus:
- sykkeen pieneneminen levon ja liikunnan aikana
- isoprenaliinin aiheuttaman sykkeen nousun pieneneminen
- sinussolmukkeen palautumisajan pidentyminen
- eteis-kammio-johtavuuden viivästäminen
- AV-intervallin pidentyminen normaalissa sinusrytmissä ja eteisstimulaation aikana ilman viivettä His-Purkinje-kudoksessa
- PQ-ajan pidentyminen, II asteen AV-katkoksen aiheuttaminen
- eteisten ja kammioiden toiminnan toipumisajan pidentyminen
- negatiivinen inotrooppinen vaikutus ja pienentynyt ejektiofraktio
- verenpaineen lasku
Lapset
Kontrolloimaton farmakokineettinen/tehokkuustutkimus tehtiin 26 lapsipotilaalle, jotka olivat 2–16-vuotiaita ja joilla oli supraventrikulaarinen takykardia (SVT). Potilaille annettiin Brevibloc-aloitusannos 1 000 mikrog/kg, minkä jälkeen annettiin jatkuvana infuusiona 300 mikrog/kg/min. Supraventrikulaarinen takykardia loppui 65 %:lla potilaista viiden minuutin kuluessa esmololihoidon aloittamisesta.
Satunnaistetussa mutta kontrolloimattomassa annosvertailututkimuksessa valmisteen tehokkuus määritettiin 116 lapsipotilaalla, jotka olivat 1 viikon - 7 vuoden ikäisiä ja joilla oli hypertensiota aortan ahtauman korjauksen jälkeen. Potilaat saivat alkuinfuusiona joko 125 mikrog/kg, 250 mikrog/kg tai 500 mikrog/kg, ja sen jälkeen jatkuvana infuusiona vastaavasti 125 mikrog/kg/min, 250 mikrog/kg/min tai 500 mikrog/kg/min. Kolmen annosryhmän välillä ei esiintynyt merkittävää eroa verenpaineen laskussa. 54 % kaikista potilaista tarvitsi muuta lääkitystä kuin Brevibloc-valmistetta tyydyttävän verenpaineen hallinnan saavuttamiseen. Eri annosryhmien välillä ei esiintynyt merkittävää eroa tämän suhteen.
Farmakokinetiikka
Imeytyminen
Esmololin farmakokinetiikka on lineaarinen terveillä aikuisilla ja plasmapitoisuus on verrannollinen käytettyyn annokseen. Jos aloitusannosta ei käytetä, steady state -pitoisuus veressä saavutetaan 30 minuutin sisällä, kun annos on 50–300 mikrog/kg/min.
Jakautuminen
Esmololin jakaantumisen puoliintumisaika on erittäin nopea, noin kaksi minuuttia.
Jakautumistilavuus on 3,4 l/kg.
Esmololihydrokloridi sitoutuu 55-prosenttisesti ihmisen plasman proteiineihin, kun taas happometaboliitista vain 10 % sitoutuu vastaavasti.
Biotransformaatio
Esmololihydrokloridin metabolia on itsenäinen, kun annos on 50–300 mikrog/kg/min.
Esmololihydrokloridi metaboloituu esteraasien vaikutuksesta happamaksi metaboliitiksi (ASL-8123) ja metanoliksi. Tämä tapahtuu punasolujen esteraasien aikaansaamalla esteriryhmän hydrolyysillä.
Eliminaatio
Eliminaation puoliintumisaika laskimoon annon jälkeen on noin 9 minuuttia.
Kokonaispuhdistuma on 285 ml/kg/min. Tämä on riippumaton maksan tai muiden elinten verenkierrosta. Esmololihydrokloridi erittyy munuaisten toimesta osittain muuttumattomana (alle 2 % annetusta määrästä) ja osittain happamana metaboliittina, jolla on heikko beetasalpausaktiviteetti (alle 0,1 % esmololin beetasalpausaktiviteetista). Hapan metaboliitti erittyy virtsaan ja sen puoliintumisaika on noin 3,7 tuntia.
Lapset
Farmakokineettinen tutkimus tehtiin 22 lapsipotilaalle, jotka olivat 3‑16‑vuotiaita. Potilaille annettiin Brevibloc-aloitusannos 1 000 mikrog/kg, minkä jälkeen annettiin jatkuvana infuusiona 300 mikrog/kg/min. Havaittu keskimääräinen koko kehon puhdistuma oli 119 ml/kg/min, jakautumistilavuus keskimäärin 283 ml/kg ja keskimääräinen lopullinen eliminaation puoliintumisaika 6,9 minuuttia, mitkä seikat viittaavat siihen, että Brevibloc-valmisteen kinetiikka lapsilla on samanlainen kuin aikuisten kinetiikka. Yksilöiden välillä havaittiin kuitenkin suurta vaihtelua.
Prekliiniset tiedot turvallisuudesta
Eläinkokeissa ei ole havaittu teratogeenisiä vaikutuksia. Kaneilla on havaittu sikiötoksisuutta (lisääntynyttä sikiön resorptiota), mikä oli luultavasti Brevibloc-valmisteen aiheuttamaa. Tämä vaikutus havaittiin annoksilla, jotka olivat vähintään 10 kertaa korkeampia kuin hoitoannos. Tutkimuksia Brevibloc-valmisteen vaikutuksesta hedelmällisyyteen ja sen peri- ja postnataalisiin vaikutuksiin ei ole tehty. Brevibloc-valmisteen ei havaittu olevan mutageeninen useissa in vitro- ja in vivo -kokeissa. Brevibloc-valmisteen turvallisuutta ei ole tutkittu pitkäkestoisissa tutkimuksissa.
Farmaseuttiset tiedot
Apuaineet
Natriumasetaatti
Etikkahappo, väkevä
Natriumkloridi
Natriumhydroksidi ja/tai suolahappo pH:n säätöön
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Yhteensopivuuskokeiden puuttuessa, tätä lääkevalmistetta ei saa sekoittaa muihin lääkevalmisteisiin tai natriumbikarbonaattiin.
Kestoaika
Valmiste Viaflo-pussissa: 21 kuukautta.
Valmiste IntraVia-pussissa: 24 kuukautta.
Avatun valmisteen fysikaalinen ja kemiallinen säilyvyys on 24 tuntia 2-8 °C:ssa.
Mikrobiologiselta kannalta valmiste olisi käytettävä heti lisäysten jälkeen. Jos valmistetta ei käytetä heti lisäysten jälkeen, säilytysaika ja -olosuhteet ovat käyttäjän vastuulla. Säilytysaika ei tavallisesti saa ylittää 24 tuntia 2–8 ºC:ssa, ellei lisäyksiä ole tehty valvotuissa ja validoiduissa aseptisissa olosuhteissa.
Säilytys
Säilytä alle 25 °C. Älä säilytä kylmässä. Ei saa jäätyä.
Avatun valmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
BREVIBLOC infuusioneste, liuos
10 mg/ml (L:ei) 250 ml (240,47 €)
PF-selosteen tieto
250 ml:aa infuusioliuosta polypropeenista (PP), polyamidista (PA) ja polyeteenistä (PE) koostuvasta pussissa, jossa on kaksinkertainen polyeteeni (PE) porttisysteemi ja päällyspussi, joka koostuu läpinäkyvästä keltaisesta kalvosta/läpinäkymättömästä alumiinifoliosta/foliopäällyspussista. Pakkauskoko on yksi pussi.
250 ml:aa infuusioliuosta polyolefiinipussissa (PO), jossa on kaksinkertaiset polyvinyylikloridi (PVC) portit ja läpinäkymätön alumiinifolio/foliopäällyspussi. Pakkauskoko on yksi pussi.
Valmisteen kuvaus:
Kirkas ja väritön tai kellertävä liuos.
Liuoksen pH on välillä 4,5–5,5 ja osmolaarisuus noin 300 mosm/l.
Käyttö- ja käsittelyohjeet
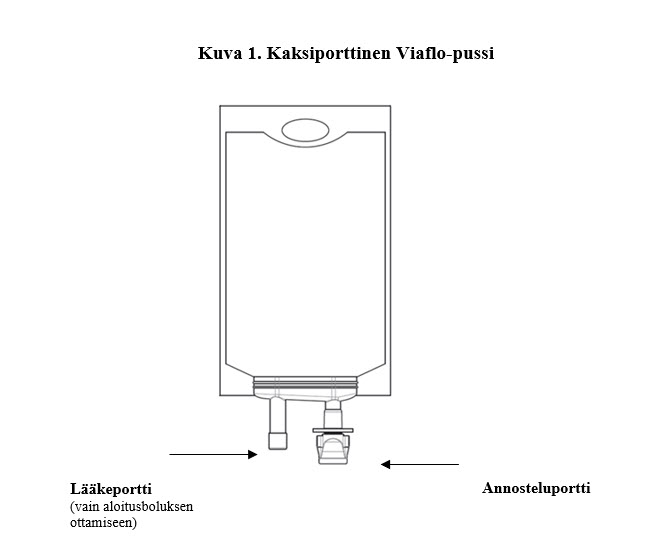
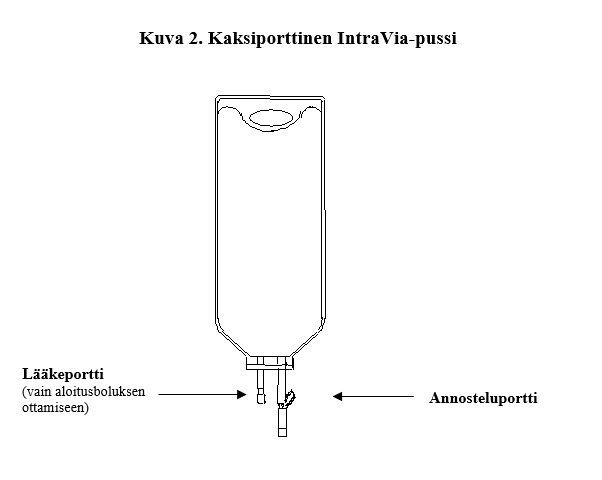
Brevibloc 10 mg/ml infuusioneste, liuos on 250 ml:n pussissa, joka on valmiskäyttöinen ja jossa on kaksi porttia, lääkeportti ja annosteluportti.
Brevibloc 10 mg/ml infuusionesteen, liuoksen kohdalla lääkeporttia on käytettävä vain aloitusboluksen ottamiseen pussista; lääkeporttia ei ole tarkoitettu toistuvaan boluksen antoon.Käytä aseptista tekniikkaa, kun otat bolusannoksen.Älä lisää mitään muita lääkkeitä Brevibloc 10 mg/ml infuusioneste, liuokseen.
Kukin pussi on vain potilaskohtaiseen käyttöön. Kun portin suojus on rikottu ja tuotetta otettu, pussi on käytettävä 24 tunnin sisällä. Käyttämätön neste ja pussit on hävitettävä paikallisten vaatimusten mukaisesti. Osittain käytettyjä pusseja ei saa käyttää uudelleen.
VAROITUS
Pusseja ei saa liittää sarjaan. Sarjaan liittäminen voi aiheuttaa ilmaembolian, joka johtuu ensimmäiseen pussiin jääneen ilman siirtymisestä eteenpäin, ennen kuin liuoksen annostelu toisesta pussista on loppunut.
AVAAMINEN
Poista päällyspussi vasta juuri ennen käyttöä. Älä käytä, jos päällyspussi on avattu tai vaurioitunut. Päällyspussi on kosteussuoja. Sisäpussi pitää liuoksen steriilinä.
Revi päällyspussi loven kohdalta ja poista esisekoitettu pussi. Muovissa voi olla himmeitä kohtia, jotka johtuvat steriloinnin aikana imeytyneestä kosteudesta. Tämä on normaalia eikä vaikuta liuoksen laatuun tai turvallisuuteen. Himmeys poistuu vähitellen.
Tarkista sisäpussi vuotojen varalta puristelemalla sitä napakasti. Jos pussi vuotaa, hävitä se, koska liuos ei tällöin ehkä enää ole steriili. Tutki liuos silmämääräisesti ylimääräisten hiukkasten ja värjäytymisen varalta ennen annostelua. Käytä vain, jos liuos on kirkas, väritön tai kellertävä.
Älä lisää mitään lisäaineita Brevibloc 10 mg/ml infuusionesteeseen.
LASKIMOON ANNOSTELUN VALMISTELU (käytä aseptista tekniikkaa)
- Ripusta pussi ripustussilmukasta.
- Irrota muovisuojus pussin pohjassa olevasta annosteluportista.
- Kiinnitä infuusiovälineistö. Katso letkuston mukana toimitetut täydelliset ohjeet.
Korvattavuus
BREVIBLOC infuusioneste, liuos
10 mg/ml 250 ml
- Ei korvausta.
ATC-koodi
C07AB09
Valmisteyhteenvedon muuttamispäivämäärä
10.11.2022
Yhteystiedot
Karhumäentie 3
01530 Vantaa
09 862 1111
