BRILIQUE tabletti, kalvopäällysteinen 60 mg, 90 mg
Vaikuttavat aineet ja niiden määrät
60 mg: Yksi tabletti sisältää 60 mg tikagreloria.
90 mg: Yksi tabletti sisältää 90 mg tikagreloria.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Tabletti, kalvopäällysteinen (tabletti).
Kliiniset tiedot
Käyttöaiheet
Brilique on tarkoitettu käytettäväksi samanaikaisesti asetyylisalisyylihapon (ASA) kanssa aterotromboottisten tapahtumien ehkäisyyn aikuisilla potilailla, joilla on
- akuutti koronaarioireyhtymä (ACS) tai
- aiemmin ollut sydäninfarkti (MI) ja joilla on suuri aterotromboottisen tapahtuman riski (ks. kohdat Annostus ja antotapa ja Farmakodynamiikka).
Annostus ja antotapa
Annostus
Brilique-valmistetta käyttävien potilaiden tulee ottaa päivittäin myös asetyylisalisyylihappoa pienellä ylläpitoannoksella 75−150 mg, ellei se ole nimenomaisesti vasta-aiheista.
Akuutti koronaarioireyhtymä
Brilique-hoito aloitetaan yhdellä 180 mg:n latausannoksella (kaksi 90 mg:n tablettia) ja sitä jatketaan tämän jälkeen ottamalla 90 mg kaksi kertaa vuorokaudessa. On suositeltavaa, että ACS-potilaiden Brilique 90 mg ‑hoitoa (kaksi kertaa vuorokaudessa) jatketaan 12 kuukautta, paitsi jos sen keskeyttäminen on kliinisesti aiheellista (ks. kohta Farmakodynamiikka).
Asetyylisalisyylihapon käytön keskeyttämistä voidaan harkita 3 kuukauden kuluttua ACS-potilailla, joille on tehty perkutaaninen sepelvaltimotoimenpide (PCI) ja joilla on suurentunut verenvuotoriski. Tällöin on jatkettava antitromboottista hoitoa yhdellä lääkkeellä, tikagrelorilla, 9 kuukauden ajan (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Aiempi sydäninfarkti
Pitkäaikaista hoitoa tarvitseville potilaille, joilla on vähintään yhtä vuotta aiemmin ollut sydäninfarkti ja joilla on suuri aterotromboottisen tapahtuman riski, suositeltu Brilique-annos on 60 mg kaksi kertaa vuorokaudessa (ks. kohta Farmakodynamiikka). Hoito voidaan aloittaa ilman keskeytystä jatkohoitona yhden vuoden Brilique 90 mg ‑hoidon tai muun adenosiinidifosfaatti- (ADP‑) reseptorin estäjällä toteutetun hoidon jälkeen ACS-potilailla, joilla on suuri aterotromboottisen tapahtuman riski. Hoito voidaan myös aloittaa enintään 2 vuoden kuluessa sydäninfarktista tai yhden vuoden sisällä aiemman ADP-reseptorin estäjähoidon päättymisestä. Tietoa tikagrelorin tehosta ja turvallisuudesta yli 3 vuoden pitkäaikaishoidossa on vähän.
Jos potilaan tarvitsee vaihtaa hoitoa, ensimmäinen Brilique-annos on annettava 24 tuntia muun antitromboottisen lääkkeen viimeisen annoksen jälkeen.
Unohtunut annos
Hoitotaukoja tulee myös välttää. Jos potilas unohtaa ottaa Brilique-annoksen, hänen tulee ottaa seuraava annos (ainoastaan yksi tabletti) normaaliin aikaan.
Erityisryhmät
Iäkkäät
Annosta ei tarvitse muuttaa iäkkäille potilaille (ks. kohta Farmakokinetiikka).
Munuaisten vajaatoiminta
Annosta ei tarvitse muuttaa potilaille, joilla on munuaisten vajaatoiminta (ks. kohta Farmakokinetiikka).
Maksan vajaatoiminta
Tikagreloria ei ole tutkittu potilailla, joilla on vaikea maksan vajaatoiminta ja siksi sen käyttö on vasta-aiheista tällaisille potilaille (ks. kohta Vasta-aiheet). Tikagrelorin käytöstä keskivaikeaa maksan vajaatoimintaa sairastaville potilaille on vain vähän tietoa. Annoksen muuttamista ei suositella, mutta tikagrelorin käytössä on noudatettava varovaisuutta (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka). Annosta ei tarvitse muuttaa maksan lievää vajaatoimintaa sairastaville potilaille (ks. kohta Farmakokinetiikka).
Pediatriset potilaat
Tikagrelorin turvallisuutta ja tehoa alle 18 vuoden ikäisten lasten hoidossa ei ole varmistettu. Ei ole asianmukaista käyttää tikagreloria lapsille, joilla on sirppisolutauti (ks. kohdat Farmakodynamiikka ja Farmakokinetiikka).
Antotapa
Suun kautta.
Brilique voidaan ottaa ruoan kanssa tai ilman ruokaa.
Jos potilas ei pysty nielemään kokonaista tablettia, tabletit voidaan murskata hienoksi jauheeksi ja sekoittaa puoleen lasilliseen vettä, joka juodaan heti. Tämän jälkeen lasi on huuhdottava puolella lasillisella vettä, joka juodaan. Seos voidaan myös antaa nenä-mahaletkulla (CH8 tai suurempi). On tärkeää huuhtoa nenä-mahaletku vedellä seoksen antamisen jälkeen.
Vasta-aiheet
- Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille (ks. kohta Haittavaikutukset).
- Aktiivinen patologinen verenvuoto.
- Aikaisempi kallonsisäinen verenvuoto (ks. kohta Haittavaikutukset).
- Vaikea maksan vajaatoiminta (ks. kohdat Annostus ja antotapa, Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
- Tikagrelorin samanaikainen käyttö voimakkaiden CYP3A4-estäjien (esim. ketokonatsolin, klaritromysiinin, nefatsodonin, ritonaviirin ja atatsanaviirin) kanssa, sillä samanaikainen käyttö voi lisätä huomattavasti tikagrelorialtistusta(ks. kohta Yhteisvaikutukset).
Varoitukset ja käyttöön liittyvät varotoimet
Verenvuotoriski
Tikagrelorilla saatava aterotromboottisia tapahtumia ehkäisevä hyötyvaikutus on punnittava tarkoin siitä mahdollisesti aiheutuvien haittojen kanssa potilailla, joilla on lisääntynyt verenvuotoriski (ks. kohdat Haittavaikutukset ja Farmakodynamiikka). Jos tikagrelorin käyttö on kliinisesti aiheellista seuraavilla potilasryhmillä, varovaisuutta tulee noudattaa sen käytössä:
- Potilaat, joilla on verenvuototaipumus (esim. tuoreen trauman tai leikkauksen, hyytymishäiriöiden, aktiivisen tai tuoreen maha-suolikanavan verenvuodon vuoksi) tai lisääntynyt traumariski. Tikagrelorin käyttö on vasta-aiheista potilaille, joilla on aktiivinen patologinen verenvuoto tai vaikea maksan vajaatoiminta tai joilla on aiemmin ollut kallonsisäinen verenvuoto (ks. kohta Vasta-aiheet).
- Potilaat, jotka saavat samanaikaisesti lääkkeitä, jotka voivat lisätä verenvuotoriskiä (esim. steroideihin kuulumattomia tulehduskipulääkkeitä (NSAID), suun kautta otettavia antikoagulantteja ja/tai fibrinolyyttisia aineita), 24 tunnin sisällä tikagreloriannoksesta.
Kahteen satunnaistettuun, kontrolloituun tutkimukseen (TICO ja TWILIGHT) osallistui ACS-potilaita, joille oli tehty perkutaaninen sepelvaltimotoimenpide (PCI) lääkestentillä. Potilaat keskeyttivät asetyylisalisyylihapon käytön saatuaan 3 kuukauden ajan antitromboottista hoitoa kahdella lääkkeellä (DAPT), jotka olivat tikagrelori ja asetyylisalisyylihappo, ja jatkoivat antitromboottista hoitoa yhdellä lääkkeellä (SAPT), tikagrelorilla, 9 kuukauden (TICO) tai 12 kuukauden (TWILIGHT) ajan. Näissä tutkimuksissa osoitettiin, että verenvuotoriski pieneni DAPT-hoidon jatkamiseen verrattuna, eikä vakavien sydän- ja verisuoniperäisten haittatapahtumien (MACE) riskin suurenemista havaittu. Päätös asetyylisalisyylihapon käytön keskeyttämisestä 3 kuukauden jälkeen ja tikagrelorin käytön jatkamisesta SAPT-hoitona 9 kuukauden ajan potilailla, joilla verenvuotoriski on suurentunut, on tehtävä kliinisen arvion perusteella ottaen huomioon toisaalta verenvuotoriski ja toisaalta tromboottisten tapahtumien riski (ks. kohta Annostus ja antotapa).
Trombosyyttisiirto ei kumonnut tikagrelorin antitromboottista vaikutusta terveillä vapaaehtoisilla ja siitä ei todennäköisesti ole kliinistä hyötyä verenvuotopotilaille. Koska tikagrelorin käyttö samanaikaisesti desmopressiinin kanssa ei alentanut standardoituihin muuttujiin suhteutettua vuotoaikaa (template bleeding time), desmopressiinillä ei todennäköisesti ole tehokasta vaikutusta kliinisten verenvuototapahtumien hallinnassa (ks. kohta Yhteisvaikutukset).
Antifibrinolyyttinen hoito (aminokapronihappo tai traneksaamihappo) ja/tai hoito rekombinantti tekijä VIIa:lla voivat tehostaa hemostaasia. Tikagrelorihoitoa voidaan jatkaa sitten, kun verenvuodon syy on tunnistettu ja vuoto on hallinnassa.
Kirurgiset toimenpiteet
Potilaita tulee neuvoa kertomaan lääkärille tai hammaslääkärille tikagrelorin käytöstä suunniteltaessa kirurgista toimenpidettä sekä ennen uusien lääkkeiden käytön aloittamista.
PLATO-tutkimuksessa potilailla, joille tehtiin ohitusleikkaus (CABG), esiintyi tikagrelorihoidossa enemmän verenvuotoja kuin klopidogreelihoidossa silloin, kun käyttö lopetettiin yksi päivä ennen kirurgista toimenpidettä. Merkittäviä verenvuotoja oli kuitenkin saman verran kuin klopidogreelilla silloin, kun hoito lopetettiin vähintään kaksi päivää ennen kirurgista toimenpidettä (ks. Haittavaikutukset). Jos potilaalle aiotaan tehdä elektiivinen kirurginen toimenpide ja antitromboottista vaikutusta ei toivota, tikagrelorihoito tulee keskeyttää viisi päivää ennen kirurgista toimenpidettä (ks. kohta Farmakodynamiikka).
Potilaat, joilla on aiemmin ollut iskeeminen aivohalvaus
ACS-potilaat, joilla on aiemmin ollut iskeeminen aivohalvaus, voivat käyttää tikagreloria korkeintaan 12 kuukauden ajan (PLATO-tutkimus).
PEGASUS-tutkimukseen ei osallistunut potilaita, joilla oli ollut aiemmin sydäninfarkti ja iskeeminen aivohalvaus. Siksi tietojen puuttuessa tällaisille potilaille ei suositella yli vuoden kestävää hoitoa.
Maksan vajaatoiminta
Tikagrelorin käyttö on vasta-aiheista vaikeaa maksan vajaatoimintaa sairastaville potilaille (ks. kohdat Annostus ja antotapa ja Vasta-aiheet). Tikagrelorin käytöstä keskivaikeaa maksan vajaatoimintaa sairastaville potilaille on vähän tietoa, joten tällaisten potilaiden hoidossa on noudatettava varovaisuutta (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka).
Potilaat, joilla on bradykardiatapahtumien riski
EKG:n Holter-monitoroinneissa osoitettiin, että kammioiden supistumisessa esiintyi enimmäkseen oireettomia taukoja enemmän tikagrelori- kuin klopidogreelihoidon aikana. Potilaat, joilla oli lisääntynyt bradykardiatapahtumien riski (esim. sairas sinus ‑oireyhtymä, 2. tai 3. asteen AV-katkos tai bradykardiaan liittyvä synkopee potilailla, joilla ei ole sydämentahdistinta), suljettiin pois päätutkimuksista, joissa arvioitiin tikagrelorin tehoa ja turvallisuutta. Tikagrelorin kliinisestä käytöstä näillä potilailla on vähäistä kokemusta ja siksi varovaisuutta on noudatettava (ks. kohta Farmakodynamiikka).
Lisäksi varovaisuutta on syytä noudattaa käytettäessä tikagreloria samanaikaisesti sellaisten lääkevalmisteiden kanssa, joiden tiedetään aiheuttavan bradykardiaa. PLATO-tutkimuksessa ei kuitenkaan havaittu kliinisesti merkitseviä haitallisia vaikutuksia yhden tai useamman sellaisen lääkevalmisteen samanaikaisen käytön jälkeen, jonka tiedetään aiheuttavan bradykardiaa (esim. beetasalpaajat 96 %, kalsiuminestäjät (kuten diltiatseemi ja verapamiili) 33 % sekä digoksiini 4 %) (ks. kohta Yhteisvaikutukset).
PLATO-tutkimuksessa tehdyn Holter-liitännäistutkimuksen aikana tikagrelorihoidossa esiintyi ≥ 3 sekuntia kestäviä taukoja kammioiden supistumisessa useammalla potilaalla kuin klopidogreelihoidossa ACS‑sairauden akuutin vaiheen aikana. Holter-tutkimuksessa havaittujen taukojen lisääntyminen kammioiden supistumisessa tikagrelorihoidossa ACS‑sairauden akuutin vaiheen aikana oli suurempaa kroonista sydämen vajaatoimintaa sairastavilla potilailla verrattuna koko tutkimuksen populaatioon. Tätä ei kuitenkaan havaittu yhden kuukauden päästä tikagrelorihoidossa eikä myöskään klopidogreeliin verrattuna. Tähän epätasapainoon ei liittynyt haitallisia kliinisiä seuraamuksia (mukaan lukien synkopee tai sydämentahdistinten asennukset) tässä potilasryhmässä (ks. kohta Farmakodynamiikka).
Bradyarytmiatapahtumia ja eteis-kammiokatkoksia on ilmoitettu tikagreloria käyttävillä potilailla valmisteen markkinoille tulon jälkeen (ks. kohta Haittavaikutukset), lähinnä ACS-potilailla, joilla sydänlihaksen hapenpuute ja samanaikaiset sydämen sykettä hidastavat tai sydämen johtorataan vaikuttavat lääkkeet ovat mahdollisia sekoittavia tekijöitä. Potilaan kliininen tila ja samanaikainen lääkitys on arvioitava mahdollisina syinä ennen hoidon muuttamista.
Hengenahdistus
Hengenahdistusta raportoitiin tikagreloria saaneilla potilailla. Hengenahdistus on yleensä lievää tai keskivaikeaa ja paranee yleensä ilman, että hoito täytyy keskeyttää. Potilailla, joilla on astma/keuhkoahtaumatauti, voi olla lisääntynyt absoluuttinen riski kokea hengenahdistusta tikagrelorin käytön yhteydessä. Varovaisuutta on noudatettava tikagrelorin käytössä potilaille, joilla on anamneesissaan astma ja/tai ahtauttava keuhkosairaus. Mekanismia ei ole täysin selvitetty. Jos potilaalla esiintyy uutta, pitkittynyttä tai pahentunutta hengenahdistusta, se tulee tutkia tarkoin, ja jos potilas ei siedä tikagreloria, hoito tulee lopettaa. Katso lisätietoja kohdasta Haittavaikutukset.
Sentraalinen uniapnea
Sentraalista uniapneaa, myös Cheyne–Stokesin hengitystä, on ilmoitettu tikagreloria käyttävillä potilailla valmisteen markkinoille tulon jälkeen. Jos sentraalista uniapneaa epäillään, on harkittava kliinistä jatkoarviointia.
Kreatiniinin kohoaminen
Kreatiniinitasot voivat kohota tikagrelorihoidon aikana. Mekanismia ei ole täysin selvitetty. Munuaistoiminta on tutkittava tavanomaisen hoitokäytännön mukaisesti. ACS-potilaiden munuaistoiminta on suositeltavaa tutkia myös yhden kuukauden kuluttua tikagrelorihoidon aloittamisesta. Erityistä huomiota tulee kiinnittää ≥ 75‑vuotiaisiin potilaisiin, potilaisiin, joilla on keskivaikea tai vaikea munuaisten vajaatoiminta, sekä samanaikaista angiotensiinireseptorisalpaajahoitoa saaviin potilaisiin.
Virtsahapon kohoaminen
Hyperurikemiaa saattaa ilmetä tikagrelorihoidon aikana (ks. kohta Haittavaikutukset). Varovaisuutta on noudatettava potilailla, joilla on aiemmin ollut hyperurikemia tai kihtiartriitti. Tikagrelorin käyttöä ei suositella varovaisuussyistä potilaille, joilla on virtsahapponefropatia.
Tromboottinen trombosytopeeninen purppura (TTP)
Tromboottista trombosytopeenista purppuraa on raportoitu hyvin harvoin tikagrelorin käytön yhteydessä. Sille ovat tyypillisiä trombosytopenia ja mikroangiopaattinen hemolyyttinen anemia, joihin liittyy joko neurologisia löydöksiä, munuaisten vajaatoimintaa tai kuumetta. Tromboottinen trombosytopeeninen purppura on mahdollisesti kuolemaan johtava tila, joka vaatii nopeasti hoitoa, mukaan lukien plasmafereesin.
Vaikutus hepariinin indusoiman trombosytopenian (HIT) toteamiseksi tehtäviin verihiutaleiden toimintakokeisiin
HIT:n toteamiseksi tehtävässä hepariinitrombosytopeniatutkimuksessa (HIPA) potilaan seerumin verihiutaletekijä 4:n ja hepariinin kompleksiin kohdistuvat vasta-aineet aktivoivat terveiden luovuttajien verihiutaleita hepariinin läsnä ollessa.
Tikagreloria saaneilla potilailla on ilmoitettu vääriä negatiivisia tuloksia HIT:n toteamiseksi tehtävissä verihiutaleiden toimintakokeissa (esimerkiksi HIPA-tutkimuksessa). Tämä liittyy siihen, että potilaan seerumin tai plasman tikagrelori estää terveen luovuttajan verihiutaleiden P2Y12-reseptorin toimintaa. Tieto samanaikaisesta tikagrelorihoidosta tarvitaan, jotta HIT:n toteamiseksi tehtäviä verihiutaleiden toimintakokeita voidaan tulkita.
Tikagrelorihoidon jatkamisen hyöty-riskisuhde on arvioitava potilailla, joilla on HIT. Arvioinnissa on huomioitava sekä HIT:n aiheuttama protromboottinen tila että samanaikaiseen antikoagulantti- ja tikagrelorihoitoon liittyvä suurentunut verenvuotoriski.
Muuta
Koska PLATO-tutkimuksessa havaittiin riippuvuussuhde ASA-ylläpitoannoksen ja tikagrelorin suhteellisen tehon välillä (klopidogreeliin verrattuna), tikagrelorin käyttöä ei suositella samanaikaisesti suuren ASA-ylläpitoannoksen (> 300 mg) kanssa (ks. kohta Farmakodynamiikka).
Hoidon ennenaikainen keskeytys
Brilique-hoidon ennenaikainen keskeytys voi, kuten minkä tahansa antitromboottisen hoidon keskeytys, lisätä sydän- ja verisuoniperäisen (CV) kuoleman, sydäninfarktin (MI) tai aivohalvauksen riskiä taustalla olevan sairauden vuoksi. Siksi hoidon ennenaikaista keskeyttämistä tulee välttää.
Natrium
Brilique sisältää alle 1 mmol (23 mg) natriumia per annos eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Tikagrelori on ensisijassa CYP3A4-substraatti ja heikko CYP3A4-estäjä. Tikagrelori on myös P-glykoproteiinin (P-gp) substraatti ja heikko P-gp:n estäjä, ja se voi lisätä P-gp:n substraattien altistusta. Tikagrelori on rintasyöpäresistenssiproteiinin (BCRP) estäjä.
Lääkevalmisteiden ja muiden valmisteiden vaikutus tikagrelorin tehoon
CYP3A4-estäjät
- Voimakkaat CYP3A4-estäjät: ketokonatsolin samanaikainen käyttö tikagrelorin kanssa nosti tikagrelorin Cmax-arvon 2,4-kertaiseksi ja AUC-arvon 7,3-kertaiseksi. Aktiivisen metaboliitin Cmax-arvo aleni 89 % ja AUC-arvo 56 %. Muilla voimakkailla CYP3A4-estäjillä (esim. klaritromysiinillä, nefatsodonilla, ritonaviirilla ja atatsanaviirilla) oletetaan olevan samanlainen vaikutus, ja siksi voimakkaiden CYP3A4-estäjien samanaikainen käyttö tikagrelorin kanssa on vasta-aiheista (ks. kohdat Vasta-aiheet).
- Kohtalaiset CYP3A4-estäjät: diltiatseemin samanaikainen käyttö tikagrelorin kanssa nosti tikagrelorin Cmax-arvoa 69 % ja AUC-arvon 2,7-kertaiseksi. Aktiivisen metaboliitin Cmax-arvo aleni 38 % ja AUC-arvo pysyi muuttumattomana. Tikagrelori ei vaikuttanut diltiatseemin pitoisuuksiin plasmassa. Myös muilla kohtalaisilla CYP3A4-estäjillä (esim. amprenaviirilla, aprepitantilla, erytromysiinillä ja flukonatsolilla) voidaan odottaa olevan samanlainen vaikutus, ja niitä voidaan käyttää samanaikaisesti tikagrelorin kanssa.
- Kun päivittäin käytettiin suuria määriä greippimehua (3 x 200 ml), havaittiin, että tikagrelorialtistus lisääntyi kaksinkertaiseksi. Tämän suuruisen altistuksen kasvun ei odoteta olevan kliinisesti merkittävää suurimmalle osalle potilaista.
CYP3A4-indusoijat
Rifampisiinin käyttö samanaikaisesti tikagrelorin kanssa alensi tikagrelorin Cmax-arvoa 73 % ja AUC-arvoa 86 %. Aktiivisen metaboliitin Cmax pysyi muuttumattomana ja AUC aleni 46 %. Myös muiden CYP3A-indusoijien (esim. fenytoiinin, karbamatsepiinin ja fenobarbitaalin) oletetaan alentavan tikagrelorialtistusta. Tikagrelorin samanaikainen käyttö voimakkaiden CYP3A-indusoijien kanssa voi alentaa tikagrelorialtistusta ja tehoa, siksi niiden samanaikaista käyttöä tikagrelorin kanssa ei suositella.
Siklosporiini (P‑glykoproteiinin ja CYP3A-estäjä)
Siklosporiinin (600 mg) samanaikainen käyttö tikagrelorin kanssa nosti tikagrelorin Cmax-arvon 2,3‑kertaiseksi ja AUC-arvon 2,8‑kertaiseksi. Aktiivisen metaboliitin AUC-arvo nousi 32 % ja Cmax-arvo laski 15 %.
Tietoa ei ole saatavilla tikagrelorin samanaikaisesta käytöstä muiden vaikuttavien aineiden kanssa, jotka ovat sekä voimakkaita P‑gp:n estäjiä että kohtalaisia CYP3A4:n estäjiä (esim. verapamiili ja kinidiini) ja jotka myös saattavat lisätä tikagrelorialtistusta. Jos samanaikaista käyttöä ei voida välttää, siinä on noudatettava varovaisuutta.
Muut
Kliinisen farmakologian yhteisvaikutustutkimukset osoittivat, että tikagrelorin samanaikainen käyttö hepariinin, enoksapariinin ja asetyylisalisyylihapon tai desmopressiinin kanssa ei vaikuttanut tikagrelorin farmakokinetiikkaan tai sen aktiiviseen metaboliittiin eikä ADP-välitteiseen trombosyyttien aggregaatioon verrattuna yksinään käytettyyn tikagreloriin. Jos hemostaasiin vaikuttavien lääkevalmisteiden käyttö on kliinisesti aiheellista, varovaisuutta tulee noudattaa niiden käytössä tikagrelorin kanssa.
Morfiinia saaneilla akuuttia koronaarisyndroomaa sairastavilla potilailla on havaittu viivästynyttä ja pienentynyttä altistusta suun kautta annettaville P2Y12-reseptorin antagonisteille, tikagrelori ja sen aktiivinen metaboliitti mukaan lukien (tikagrelorialtistuksen 35 %:n väheneminen). Tämä yhteisvaikutus saattaa liittyä ruuansulatuskanavan hidastuneeseen motiliteettiin ja koskea myös muita opioideja. Näiden tietojen kliinistä merkitystä ei tiedetä, mutta ne viittaavat siihen, että tikagrelorin tehon heikkeneminen on mahdollista potilailla, joille annetaan samanaikaisesti tikagreloria ja morfiinia. Akuuttia koronaarisyndroomaa sairastavilla potilailla, joiden hoitoa morfiinilla ei voida lopettaa ja joilla nopea P2Y12:n esto katsotaan ratkaisevan tärkeäksi, voidaan harkita P2Y12-reseptorin antagonistin antoa parenteraalisesti.
Tikagrelorin vaikutus muihin lääkevalmisteisiin
CYP3A4-entsyymin välityksellä metaboloituvat lääkevalmisteet
- Simvastatiini: tikagrelorin samanaikainen käyttö simvastatiinin kanssa nosti simvastatiinin Cmax-arvoa 81 % ja AUC-arvoa 56 % sekä simvastatiinihapon Cmax-arvoa 64 % ja AUC-arvoa 52 % joidenkin yksittäisten nousujen ollessa 2‑3‑kertaisia. Tikagrelorin samanaikainen käyttö yli 40 mg:n simvastatiinin vuorokausiannoksien kanssa voi aiheuttaa simvastatiinin haittavaikutuksia, ja haittavaikutusten vakavuus tulee punnita tarkoin hoidon mahdollisiin hyötyihin verrattuna. Simvastatiini ei vaikuttanut tikagrelorin pitoisuuksiin plasmassa. Tikagrelorilla voi olla samanlainen vaikutus lovastatiiniin. Tikagrelorin samanaikaista käyttöä yli 40 mg:n simvastatiini- tai lovastatiiniannosten kanssa ei suositella.
- Atorvastatiini: atorvastatiinin ja tikagrelorin samanaikainen käyttö nosti atorvastatiinihapon Cmax-arvoa 23 % ja AUC-arvoa 36 %. Samanlaiset AUC- ja Cmax-arvojen nousut havaittiin kaikilla atorvastatiinihapon metaboliiteilla. Näitä nousuja ei pidetä kliinisesti merkitsevinä.
- Samanlaista vaikutusta muihin CYP3A4-entsyymin välityksellä metaboloituviin statiineihin ei voida sulkea pois. PLATO-tukimuksessa tikagreloria saaneista potilaista 93 % käytti useita erilaisia statiineja eikä statiinien turvallisuus aiheuttanut ongelmaa kyseisessä PLATO-kohortissa.
Tikagrelori on heikko CYP3A4-estäjä. Tikagrelorin ja kapean terapeuttisen indeksin CYP3A4-substraattien (esim. sisapridin ja torajyväalkaloidien) samanaikaista käyttöä ei suositella, sillä tikagrelori voi lisätä näiden lääkeaineiden altistusta.
P‑gp:n substraatit (mukaan lukien digoksiini ja siklosporiini)
Tikagrelorin samanaikainen käyttö nosti digoksiinin Cmax-arvoa 75 % ja AUC-arvoa 28 %. Kun samanaikaisesti käytettiin tikagreloria, keskimääräiset alimmat digoksiinipitoisuudet lisääntyivät noin 30 % joidenkin yksittäisten maksimilisäysten ollessa kaksinkertaisia. Tikagrelorin ja sen aktiivisen metaboliitin Cmax- ja AUC-arvot eivät muuttuneet digoksiinin käytön yhteydessä. Siksi kliinistä ja/tai laboratorioseurantaa suositellaan, jos p‑glykoproteiinista riippuvaisia valmisteita, joiden terapeuttinen indeksi on kapea (esim. digoksiini), käytetään samanaikaisesti tikagrelorin kanssa.
Tikagrelorilla ei ollut vaikutusta veren siklosporiinipitoisuuteen. Tikagrelonin vaikutusta muihin P‑gp:n substraatteihin ei ole tutkittu.
CYP2C9-entsyymin välityksellä metaboloituvat lääkevalmisteet
Tikagrelorin samanaikainen käyttö tolbutamidin kanssa ei muuttanut kummankaan valmisteen pitoisuuksia plasmassa, mikä viittaa siihen, että tikagrelori ei ole CYP2C9-estäjä eikä se siis todennäköisesti muuta CYP2C9-entsyymin välityksellä tapahtuvaa varfariinin ja tolbutamidin kaltaisten valmisteiden metaboliaa.
Rosuvastatiini (BCRP:n substraatti)
Tikagrelorin on osoitettu suurentavan rosuvastatiinipitoisuuksia, mikä saattaa suurentaa myopatian (myös rabdomyolyysin) riskiä. Rosuvastatiinin käytöllä saavutettavia hyötyjä vakavien sydän- ja verisuoniperäisten tapahtumien ehkäisyssä on punnittava suhteessa plasman rosuvastatiinipitoisuuksien suurenemiseen liittyviin riskeihin.
Suun kautta otettavat ehkäisyvalmisteet
Tikagrelorin samanaikainen käyttö levonorgestreelin ja etinyyliestradiolin kanssa lisää etinyyliestradiolialtistusta noin 20 %, mutta ei muuta levonorgestreelin farmakokinetiikkaa. Levonorgestreelin ja etinyyliestradiolin samanaikaisella käytöllä tikagrelorin kanssa ei odoteta olevan kliinisesti merkittävää vaikutusta suun kautta otettavien ehkäisyvalmisteiden tehoon.
Lääkevalmisteet, joiden tiedetään aiheuttavan bradykardiaa
Johtuen havainnoista lähinnä asymptomaattisista tauoista kammioiden supistumisessa ja bradykardiasta varovaisuutta on syytä noudattaa annettaessa tikagreloria samanaikaisesti sellaisten lääkevalmisteiden kanssa, joiden tiedetään aiheuttavan bradykardiaa (ks. Varoitukset ja käyttöön liittyvät varotoimet). PLATO-tutkimuksessa ei kuitenkaan havaittu kliinisesti merkitseviä haitallisia vaikutuksia yhden tai useamman sellaisen lääkevalmisteen samanaikaisen käytön jälkeen, jonka tiedetään aiheuttavan bradykardiaa (PLATO-potilailla käytössä esim. beetasalpaajat 96 %, kalsiuminestäjät (kuten diltiatseemi ja verapamiili) 33 % sekä digoksiini 4 %).
Muu samanaikainen hoito
Kliinisissä tutkimuksissa tikagreloria annettiin pitkäaikaisesti asetyylisalisyylihapon (ASA), protonipumpun estäjien, statiinien, beetasalpaajien, angiotensiinikonvertaasin estäjien ja angiotensiinireseptorin salpaajien (ACE) kanssa liitännäissairauksiin tarpeen mukaan sekä lyhytaikaisesti hepariinin, pienimolekyylisen hepariinin ja laskimoon annettavien GpIIb/IIIa-estäjien kanssa (ks. kohta Farmakodynamiikka). Merkkejä kliinisesti merkitsevistä haitallisista yhteisvaikutuksista ei havaittu näiden valmisteiden kanssa.
Tikagrelorin samanaikaisella käytöllä hepariinin, enoksapariinin tai desmopressiinin kanssa ei ollut vaikutusta aktivoidun partiaalisen tromboplastiiniajan (aPTT), aktivoidun hyytymisajan (ACT) eikä tekijä Xa:n määrityksiin. Varovaisuutta on mahdollisten farmakodynaamisten yhteisvaikutusten vuoksi kuitenkin syytä noudattaa tikagrelorin samanaikaisessa käytössä sellaisten lääkevalmisteiden kanssa, joiden tiedetään vaikuttavan hemostaasiin.
Koska ihoverenvuotoja on raportoitu SSRI-lääkkeiden (esim. paroksetiinin, sertraliinin ja sitalopraamin) käytön yhteydessä, varovaisuutta on syytä noudattaa annettaessa SSRI-lääkkeitä tikagrelorin kanssa, sillä se voi lisätä verenvuotoriskiä.
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi
Naisten, jotka voivat tulla raskaaksi, tulee käyttää tarkoituksenmukaista ehkäisymenetelmää tikagrelorihoidon aikana raskauden ehkäisemiseksi.
Raskaus
Tikagrelorin käytöstä raskaana oleville naisille ei ole olemassa tietoja tai on vain vähän tietoja. Eläimillä tehdyissä tutkimuksissa on havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta). Tikagrelorin käyttöä ei suositella raskauden aikana.
Imetys
Olemassa olevat farmakodynaamiset/toksikologiset tiedot koe-eläimistä ovat osoittaneet tikagrelorin ja sen aktiivisten metaboliittien erittyvän maitoon (ks. kohta Prekliiniset tiedot turvallisuudesta). Imetettävään vauvaan kohdistuvia riskejä ei voida sulkea pois. On päätettävä, lopetetaanko imetys vai pidättäydytäänkö tikagrelorihoidosta, ottaen huomioon imetyksen hyödyt lapselle ja hoidosta koituvat hyödyt äidille.
Hedelmällisyys
Eläinkokeissa tikagrelorilla ei ollut vaikutusta uroksen tai naaraan hedelmällisyyteen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Tikagrelorilla ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn. Tikagrelorihoidon aikana on raportoitu heitehuimausta ja sekavuutta. Potilaiden, jotka kokevat tällaisia oireita, tulee siksi noudattaa varovaisuutta ajaessa tai koneita käyttäessä.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Tikagrelorin turvallisuusprofiilia on arvioitu kahdessa laajassa hoitotulosta arvioivassa vaiheen 3 tutkimuksessa (PLATO ja PEGASUS), joihin osallistui yli 39 000 potilasta (ks. kohta Farmakodynamiikka).
PLATO-tutkimuksessa haittatapahtumien vuoksi hoidon keskeyttäneiden määrä oli suurempi tikagreloria kuin klopidogreelia saaneilla potilailla (tikagrelori: 7,4 %, klopidogreeli: 5,4 %). PEGASUS-tutkimuksessa haittatapahtumien vuoksi hoidon keskeyttäneiden määrä oli suurempi tikagreloria kuin pelkästään asetyylisalisyylihappoa saaneilla potilailla (tikagrelori 60 mg yhdessä asetyylisalisyylihapon kanssa: 16,1 %, pelkästään asetyylisalisyylihappo: 8,5 %). Tikagrelorilla hoidetuilla potilailla yleisimmin raportoituja haittavaikutuksia olivat verenvuoto ja hengenahdistus (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Taulukoitu luettelo haittavaikutuksista
Alla lueteltuja haittavaikutuksia on havaittu tikagreloritutkimuksissa tai on raportoitu markkinoille tulon jälkeen (taulukko 1).
Haittavaikutukset on lueteltu MedDRA:n elinjärjestelmäluokituksen (SOC) mukaan. Haittavaikutukset on esitetty kussakin elinjärjestelmäluokassa yleisyyden mukaan. Haittavaikutusten yleisyys on luokiteltu seuraavasti: hyvin yleinen (≥ 1/10); yleinen (≥ 1/100, < 1/10); melko harvinainen (≥ 1/1 000, < 1/100); harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä arviointiin).
Taulukko 1. Haittavaikutukset yleisyys- ja elinjärjestelmäluokituksen mukaisesti
Elinjärjestelmä
| Hyvin yleinen
| Yleinen
| Melko harvinainen
| Tuntematon |
|---|---|---|---|---|
| Hyvän- ja pahanlaatuiset kasvaimet (mukaan lukien kystat ja polyypit) | Kasvaimiin liittyvät verenvuodota | |||
| Veri ja imukudos | Verisairauteen liittyvät verenvuodotb | Tromboottinen trombosytopeeninen purppurac | ||
| Immuunijärjestelmä | Yliherkkyys, angioedeema mukaan lukienc | |||
| Aineenvaihdunta ja ravitsemus | Hyperurikemiad | Kihti/kihtiartriitti | ||
| Psyykkiset häiriöt | Sekavuustila | |||
| Hermosto | Heitehuimaus, synkopee, päänsärky | Kallonsisäinen verenvuotom | ||
| Silmät | Silmän verenvuotoe | |||
| Kuulo ja tasapainoelin | Huimaus | Korvan verenvuoto | ||
| Sydän | Bradyarytmia, eteis-kammiokatkosc | |||
| Verisuonisto | Hypotensio | |||
| Hengityselimet, rintakehä ja välikarsina | Hengenahdistus | Hengityselinten verenvuodotf
| ||
| Ruoansulatuselimistö | Maha-suolikanavan verenvuotog, ripuli, pahoinvointi, dyspepsia, ummetus | Vatsakalvon takainen verenvuoto | ||
| Iho ja ihonalainen kudos | Ihonalaiskudoksen tai ihon verenvuotoh, ihottuma, kutina | |||
| Luusto, lihakset ja sidekudos | Verenvuodot lihaksissai
| |||
| Munuaiset ja virtsatiet | Virtsateiden verenvuotoj | |||
| Sukupuolielimet ja rinnat | Sukupuolielinten verenvuodotk | |||
| Tutkimukset | Kohonnut veren kreatiniinid | |||
| Vammat, myrkytykset ja hoitokomplikaatiot | Toimenpiteen jälkeinen verenvuoto, traumaattinen verenvuotol |
a esim. virtsarakko‑, maha- tai koolonsyövästä johtuva verenvuoto
b esim. lisääntynyt mustelmataipumus, spontaani hematooma, verenvuototaipumus
c Todettu markkinoille tulon jälkeen
d Yleisyydet on saatu laboratoriohavaintojen perusteella (virtsahappoarvo kohoaa normaalin ylärajan yläpuolelle lähtötilanteesta viitealueelta tai sen alapuolelta, kreatiniiniarvo suurenee yli 50 % lähtötilanteesta), ei karkean haittatapahtumailmoitusten yleisyyden perusteella.
e esim. sidekalvon tai verkkokalvon tai silmänsisäinen verenvuoto
f esim. nenäverenvuoto, veriyskä
g esim. ienverenvuoto, peräsuoliverenvuoto, mahahaavan verenvuoto
h esim. mustelma, ihon verenvuoto, petekia
i esim. hemartroosi, lihaksen verenvuoto
j esim. hematuria, virtsarakkotulehdus, johon liittyy verenvuotoa
k esim. emätinverenvuoto, hematospermia, postmenopausaalinen verenvuoto
l esim. kontuusio, traumaattinen hematooma, traumaattinen verenvuoto
m eli spontaani, toimenpiteeseen liittyvä tai traumaattinen kallonsisäinen verenvuoto
Valikoitujen haittavaikutusten kuvaus
Verenvuoto
Verenvuotolöydökset PLATO-tutkimuksessa
PLATO-tutkimuksessa esiintyneiden verenvuotojen kokonaistulokset on esitetty taulukossa 2.
Taulukko 2. Kaikkien verenvuototapahtumien analyysi, Kaplan‑Meier-estimaatit 12 kuukauden kohdalla (PLATO)
| Tikagrelori 90 mg kaksi kertaa vuorokaudessa N = 9 235 | Klopidogreeli N = 9 186 | p-arvo* | |
| PLATO kaikki merkittävät | 11,6 | 11,2 | 0,4336 |
| PLATO merkittävät kuolemaan johtavat/hengenvaaralliset | 5,8 | 5,8 | 0,6988 |
| Muut kuin ohitusleikkaukseen liittyvät PLATO merkittävät | 4,5 | 3,8 | 0,0264 |
| Muut kuin toimenpiteisiin liittyvät PLATO merkittävät | 3,1 | 2,3 | 0,0058 |
| PLATO kaikki merkittävät + vähäiset | 16,1 | 14,6 | 0,0084 |
| Muut kuin toimenpiteisiin liittyvät PLATO merkittävät + vähäiset | 5,9 | 4,3 | < 0,0001 |
| TIMI merkittävät | 7,9 | 7,7 | 0,5669 |
| TIMI merkittävät + vähäiset | 11,4 | 10,9 | 0,3272 |
| Verenvuotoluokitus: Merkittävä kuolemaan johtava/hengenvaarallinen verenvuoto: Kliinisesti ilmeinen verenvuoto, jossa hemoglobiini laskee > 50 g/l tai jonka vuoksi siirretään ≥ 4 punasoluyksikköä; tai kuolemaan johtava verenvuoto; tai kallonsisäinen verenvuoto; tai intraperikardiaalinen verenvuoto, jonka yhteydessä esiintyy sydämen tamponaatio; tai verenpainetta nostavia lääkkeitä tai kirurgista toimenpidettä vaativa hypovoleeminen sokki tai vakava hypotensio. Muu merkittävä verenvuoto: Kliinisesti ilmeinen verenvuoto, jossa hemoglobiini laskee 30−50 g/l tai jonka vuoksi siirretään 2−3 punasoluyksikköä, tai merkitsevästi vammauttava verenvuoto. Vähäinen verenvuoto: Verenvuodon pysäyttäminen tai hoito vaatii lääkinnällistä toimenpidettä. TIMI merkittävä -verenvuoto: Kliinisesti ilmeinen verenvuoto, jossa hemoglobiini laskee > 50 g/l, tai kallonsisäinen verenvuoto. TIMI vähäinen -verenvuoto: Kliinisesti ilmeinen verenvuoto, jossa hemoglobiini laskee 30−50 g/l. *p‑arvo on laskettu Coxin suhteellisten riskien mallilla, jossa ainoana selittävänä muuttujana oli hoitoryhmä. | |||
Tikagrelori ja klopidogreeli eivät eronneet merkittävien kuolemaan johtavien/hengenvaarallisten verenvuotojen (PLATO), kaikkien merkittävien (PLATO), "TIMI merkittävien"- tai "TIMI vähäisten" verenvuotojen osalta (taulukko 2). PLATO-tutkimuksen mukaisia merkittäviä + vähäisiä verenvuotoja esiintyi kuitenkin enemmän tikagrelorilla kuin klopidogreelilla. PLATO-tutkimuksessa harvoilla potilailla oli kuolemaan johtavia verenvuotoja: 20 (0,2 %) tikagrelorilla ja 23 (0,3 %) klopidogreelilla (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Ikä, sukupuoli, paino, rotu, maantieteellinen alue, muut samanaikaiset sairaudet, samanaikainen hoito tai potilashistoria mukaan lukien aiempi aivohalvaus tai ohimenevä aivojen iskeeminen kohtaus eivät ennakoineet yleistä tai toimenpiteeseen liittyvää PLATO-tutkimuksen mukaista merkittävää verenvuotoa. Siksi erityistä riskiryhmää ei tunnistettu missään verenvuotoryhmässä.
Ohitusleikkaukseen (CABG) liittyvä verenvuoto:
PLATO-tutkimuksessa 42 prosentilla niistä 1584 potilaasta (12 % kohortista), joille tehtiin ohitusleikkaus (CABG), esiintyi PLATO-tutkimuksen mukainen merkittävä kuolemaan johtava/hengenvaarallinen verenvuoto. Hoitoryhmien välillä ei ollut eroja. Kuolemaan johtavia ohitusleikkaukseen liittyviä verenvuotoja esiintyi kuudella potilaalla kummassakin hoitoryhmässä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Muu kuin ohitusleikkaukseen (CABG) tai toimenpiteeseen liittyvä verenvuoto:
PLATO-tutkimuksen mukaisissa, muissa kuin ohitusleikkaukseen liittyvissä, merkittävissä kuolemaan johtavissa/hengenvaarallisissa verenvuodoissa ei ollut eroa tikagrelori- ja klopidogreeliryhmien välillä, mutta luokitusten "PLATO kaikki merkittävät", "TIMI merkittävät" ja "TIMI merkittävät + vähäiset" mukaiset verenvuodot olivat yleisempiä tikagreloria käytettäessä. Kun mitään toimenpiteisiin liittyviä verenvuotoja ei otettu huomioon, verenvuotoja esiintyi vastaavasti useammin tikagreloria kuin klopidogreelia käytettäessä (taulukko 2). Hoidon keskeytys muun kuin toimenpiteeseen liittyvän verenvuodon vuoksi oli yleisempää tikagrelorilla (2,9 %) kuin klopidogreelilla (1,2 %; p < 0,001).
Kallonsisäinen verenvuoto:
Kallonsisäisiä verenvuotoja esiintyi tikagrelorilla (n = 27 verenvuotoa 26 potilaalla, 0,3 %) enemmän kuin klopidogreelilla (n=14 verenvuotoa, 0,2 %). Näistä kuolemaan johtavia oli tikagreloria käytettäessä 11 verenvuotoa ja klopidogreelia käytettäessä yksi verenvuoto. Eroja ei havaittu kaikkien kuolemaan johtavien verenvuotojen osalta.
Verenvuotolöydökset PEGASUS-tutkimuksessa
PEGASUS-tutkimuksen verenvuototapahtumien kokonaistulokset on esitetty taulukossa 3.
Taulukko 3 – Kaikkien verenvuototapahtumien analyysi, Kaplan-Meier-estimaatit 36 kuukauden kohdalla (PEGASUS)
Tikagrelori 60 mg kaksi kertaa vuorokaudessa + ASA N = 6 958 | Pelkkä ASA N = 6 996 | |||
| Turvallisuuspäätetapahtumat | KM-% | HR (95 % CI) | KM-% | p‑arvo |
| TIMI:n mukaan määritetty verenvuotoluokitus | ||||
| TIMI Merkittävät | 2,3 | 2,32 (1,68, 3,21) | 1,1 | < 0,0001 |
| Kuolemaan johtavat | 0,3 | 1,00 (0,44, 2,27) | 0,3 | 1,0000 |
| ICH | 0,6 | 1,33 (0,77, 2,31) | 0,5 | 0,3130 |
| Muu TIMI merkittävä | 1,6 | 3,61 (2,31, 5,65) | 0,5 | < 0,0001 |
| TIMI merkittävät tai vähäiset | 3,4 | 2,54 (1,93, 3,35) | 1,4 | < 0,0001 |
| TIMI merkittävät tai vähäiset tai lääkärin hoitoa vaatineet | 16,6 | 2,64 (2,35, 2,97) | 7,0 | < 0,0001 |
| PLATO:n mukaan määritetyt verenvuotokategoriat | ||||
| PLATO merkittävät | 3,5 | 2,57 (1,95, 3,37) | 1,4 | < 0,0001 |
| Kuolemaan johtavat / hengenvaaralliset | 2,4 | 2,38 (1,73, 3,26) | 1,1 | < 0,0001 |
| Muut PLATO merkittävät | 1,1 | 3,37 (1,95, 5,83) | 0,3 | < 0,0001 |
| PLATO merkittävät tai vähäiset | 15,2 | 2,71 (2,40, 3,08) | 6,2 | < 0,0001 |
Verenvuotoluokitus:
TIMI merkittävä: Kuolemaan johtava TAI mikä tahansa kallonsisäinen verenvuoto TAI kliinisesti ilmeiset merkit verenvuodosta, johon liittyy hemoglobiinin lasku ≥ 50 g/l, tai kun hemoglobiiniarvoa ei ole saatavilla, hematokriitin 15 %:n lasku.
Kuolemaan johtava: Verenvuototapahtuma, joka johti suoraan kuolemaan seitsemän päivän sisällä.
ICH: Kallonsisäinen verenvuoto.
Muu TIMI merkittävä: Muu kuin kuolemaan johtava, muu kuin kallonsisäinen verenvuoto, TIMI merkittävä verenvuoto.
TIMI vähäinen: Kliinisesti ilmeinen verenvuoto, jossa hemoglobiini laskee 30‑50 g/l.
TIMI lääkärinhoitoa vaativa: Vaatii hoitotoimenpiteitä TAI johtaa sairaalahoitoon TAI edellyttää arviointia.
PLATO merkittävä kuolemaan johtava/hengenvaarallinen: Kuolemaan johtava verenvuoto TAI mikä tahansa kallonsisäinen verenvuoto TAI intraperikardiaalinen verenvuoto, jonka yhteydessä esiintyy sydämen tamponaatio, TAI verenpainetta nostavia lääkkeitä tai kirurgista toimenpidettä vaativa hypovoleeminen sokki tai vakava hypotensio TAI kliinisesti ilmeinen verenvuoto, jossa hemoglobiini laskee > 50 g/l tai jonka vuoksi siirretään ≥ 4 punasoluyksikköä.
Muu PLATO merkittävä: Merkittävästi vammauttava TAI kliinisesti ilmeinen verenvuoto, jossa hemoglobiini laskee 30−50 g/l TAI jonka vuoksi siirretään 2‑3 punasoluyksikköä.
Plato vähäinen: Verenvuodon pysäyttäminen tai hoito vaatii lääkinnällistä toimenpidettä.
PEGASUS-tutkimuksessa TIMI merkittävää verenvuotoa esiintyi enemmän tikagrelorin 60 mg:n annoksella kaksi kertaa vuorokaudessa kuin pelkällä asetyylisalisyylihapolla. Lisääntynyttä verenvuodon riskiä ei havaittu kuolemaan johtavien verenvuotojen osalta ja kallonsisäisten verenvuotojen havaittiin lisääntyneen vain vähän pelkkään asetyylisalisyylihappoon verrattuna. Tutkimuksessa oli joitakin kuolemaan johtaneita verenvuototapahtumia, 11 (0,3 %) tikagreloria 60 mg:n annoksella saaneilla potilailla ja 12 (0,3 %) pelkkää asetyylisalisyylihappoa saaneilla potilailla. Havaittu TIMI merkittävän verenvuodon lisääntynyt riski tikagrelorin 60 mg:n annoksella johtui pääasiassa muiden, maha-suolikanavan elinjärjestelmän tapahtumista johtuvien TIMI merkittävien verenvuotojen suuremmasta esiintyvyydestä.
Samankaltaisia lisääntyneen verenvuodon tyyppejä kuin TIMI merkittävät havaittiin verenvuotoluokissa TIMI merkittävät tai vähäiset ja PLATO merkittävät ja PLATO merkittävät ja vähäiset (ks. taulukko 3). Hoito lopetettiin verenvuodon vuoksi useammin tikagreloria 60 mg saaneilla potilailla (6,2 %) kuin pelkkää asetyylisalisyylihappoa saaneilla potilailla (1,5 %). Suurin osa näistä verenvuodoista oli vähemmän vakavia (luokiteltiin TIMI lääkärin hoitoa vaatineiksi), kuten nenäverenvuoto, mustelmat ja hematoomat.
Tikagrelorin 60 mg annoksen verenvuotoprofiili oli yhdenmukainen monissa ennalta määritetyissä alaryhmissä (esimerkiksi iän, sukupuolen, painon, rodun, maantieteellisen alueen, muiden samanaikaisten sairauksien, samanaikaisen hoidon ja sairaushistorian mukaan) verenvuototapahtumaluokissa TIMI merkittävät, TIMI merkittävät tai vähäiset ja PLATO merkittävät.
Kallonsisäinen verenvuoto:
Spontaaneja kallonsisäisiä verenvuotoja raportoitiin vastaavia määriä tikagreloria 60 mg saaneilla potilailla ja pelkkää asetyylisalisyylihappoa saaneilla potilailla (n = 13, 0,2 % kummassakin hoitoryhmässä). Traumaattisia ja toimenpiteisiin liittyneitä kallonsisäisiä verenvuotoja esiintyi hieman enemmän tikagreloria 60 mg saaneilla potilailla (n = 15, 0,2 %) verrattuna pelkkää asetyylisalisyylihappoa saaneisiin potilaisiin (n = 10, 0,1 %). Kuolemaan johtavia kallonsisäisiä verenvuotoja oli 6 tikagreloria 60 mg saaneilla potilailla ja 5 pelkkää asetyylisalisyylihappoa saaneilla potilailla. Kallonsisäisten verenvuotojen esiintyvyys oli pieni kummassakin hoitoryhmässä, kun otetaan huomioon populaation huomattava komorbiditeetti ja CV-riskitekijät tutkimuksen aikana.
Hengenahdistus
Hengenahdistusta on raportoitu tikagrelorihoitoa saavilla potilailla. PLATO-tutkimuksessa hengenahdistushaittatapahtumia (hengenahdistusta, hengenahdistusta levossa, hengenahdistusta rasituksessa, kohtauksittaista yöllistä hengenahdistusta, yöllistä hengenahdistusta) esiintyi 13,8 %:lla tikagreloripotilaista ja 7,8 %:lla klopidogreelipotilaista. Tutkijoiden mukaan hengenahdistus oli PLATO-tutkimuksessa syy-yhteydessä hoitoon 2,2 %:lla tikagreloripotilaista ja 0,6 %:lla klopidogreelipotilaista, ja vain harvat niistä olivat vakavia (0,14 % tikagrelorilla; 0,02 % klopidogreelilla) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Useimmat raportoiduista hengenahdistusoireista olivat lieviä tai kohtalaisia, ja useimmat niistä olivat hoidon alkuvaiheessa esiintyviä yksittäisiä tapauksia.
Klopidogreeliin verrattuna voi tikagrelorihoidossa potilailla, joilla on astma/ keuhkoahtaumatauti, olla lisääntynyt riski kokea ei-vakavaa hengenahdistusta (tikagrelori 3,29 % vs. klopidogreeli 0,53 %) ja vakavaa hengenahdistusta (tikagrelori 0,38 % vs. klopidogreeli 0,00 %). Absoluuttinen riski oli suurempi kuin koko PLATO-populaatiossa. Varovaisuutta on noudatettava käytettäessä tikagreloria potilaille, joilla on anamneesissaan astma ja/tai ahtauttava keuhkosairaus (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Noin 30 % hengenahdistustapahtumista meni ohi seitsemässä päivässä. PLATO-tutkimuksessa oli mukana potilaita, joilla oli lähtötilanteessa kongestiivinen sydämen vajaatoiminta, keuhkoahtaumatauti tai astma. Hengenahdistusta raportoitiin useammin näillä potilailla sekä iäkkäillä potilailla. Tikagrelorihoitoa saavista potilaista 0,9 % keskeytti tutkittavan vaikuttavan aineen käytön hengenahdistuksen vuoksi, kun klopidogreeliryhmässä heidän osuus oli 0,1 %. Hengenahdistuksen korkeampi esiintyvyys tikagrelorin käytön yhteydessä ei liity uuteen tai pahenevaan sydän- tai keuhkosairauteen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Tikagrelorilla ei ole vaikutusta keuhkojen toimintaan.
PEGASUS-tutkimuksessa hengenahdistusta raportoitiin 14,2 %:lla potilaista, jotka saivat tikagreloria 60 mg kaksi kertaa vuorokaudessa, ja 5,5 %:lla potilaista, jotka saivat pelkästään asetyylisalisyylihappoa. Kuten PLATO-tutkimuksessa, suurin osa raportoiduista hengenahdistustapauksista oli vaikeusasteeltaan lieviä tai kohtalaisia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Hengenahdistusta raportoineet potilaat olivat yleensä iäkkäämpiä ja heillä oli useammin ollut lähtötilanteessa hengenahdistusta, keuhkoahtaumatauti tai astma.
Tutkimukset
Virtsahapon kohoaminen: PLATO-tutkimuksessa seerumin virtsahappoarvo nousi normaalialueen ylärajan yläpuolelle 22 %:lla tikagreloripotilaista ja 13 %:lla klopidogreelipotilaista. PEGASUS-tutkimuksessa seerumin virtsahappoarvo nousi normaalialueen ylärajan yläpuolelle 9,1 %:lla tikagreloria 90 mg saaneista, 8,8 %:lla tikagreloria 60 mg saaneista ja 5,5 %:lla lumelääkettä saaneista potilaista. Keskimääräinen seerumin virtsahappoarvo nousi noin 15 %:lla tikagreloria saaneista potilaista ja noin 7,5 %:lla klopidogreelia saaneista potilaista. Arvo laski hoidon lopettamisen jälkeen noin 7 %:iin tikagrelorilla, mutta arvon laskua ei havaittu klopidogreelilla. PEGASUS-tutkimuksessa todettiin 6,3 %:n ja 5,6 %:n keskimääräinen seerumin virtsahappoarvojen palautuva nousu tikagreloriannoksilla 90 mg ja 60 mg verrattuna 1,5 %:n laskuun lumelääkeryhmässä. PLATO-tutkimuksessa kihtiartriitin yleisyys oli 0,2 % tikagrelorilla ja 0,1 % klopidogreelilla. PEGASUS-tutkimuksessa kihdin/kihtiartriitin yleisyys oli 1,6 % tikagrelori 90 mg:lla, 1,5 % tikagrelori 60 mg:lla ja 1,1 % lumelääkkeellä.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Tikagrelori on hyvin siedetty aina 900 mg:n kerta-annokseen asti. Maha suolikanavan toksisuus oli annosta rajoittava haittavaikutus yhdessä nousevilla annoksilla tehdyssä tutkimuksessa. Muita kliinisesti merkittäviä yliannostuksen yhteydessä esiintyviä haittavaikutuksia ovat hengenahdistus ja tauot kammioiden supistumisessa (ks. kohta Haittavaikutukset).
Yliannostustapauksissa edellä mainittuja mahdollisia haittavaikutuksia voi ilmetä ja EKG-seurantaa on harkittava.
Tikagrelorin vaikutuksen kumoavaa vastalääkettä ei tunneta. Tikagrelori ei ole dialysoitavissa (ks. kohta Farmakokinetiikka). Yliannostuksen hoidossa tulee noudattaa tavanomaisia paikallisia hoitotoimenpiteitä. Tikagreloriyliannostuksen odotettu vaikutus on trombosyyttien estoon liittyvä verenvuotoriskin keston pitkittyminen. Trombosyyttisiirrosta ei todennäköisesti ole kliinistä hyötyä verenvuotopotilaille (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Jos verenvuotoja esiintyy, muihin asianmukaisiin tukitoimenpiteisiin tulee ryhtyä.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Verihiutaleiden aggregaation estäjät lukuun ottamatta hepariinia. ATC-koodi: B01AC24.
Vaikutusmekanismi
Brilique sisältää tikagreloria, joka kuuluu syklopentyylitriatsolopyrimidiinien (CPTP) kemialliseen luokkaan. Tikagrelori on suun kautta otettava suoravaikutteinen, selektiivinen ja reversiibelisti sitoutuva P2Y12 ‑reseptorin antagonisti, joka estää ADP‑välitteisen P2Y12:sta riippuvaisen trombosyyttien aktivoitumisen ja aggregaation. Tikagrelori ei estä ADP:n-sitoutumista, mutta P2Y12-reseptoriin sitoutuneena se estää ADP‑indusoidun signaalitransduktion. Koska verihiutaleet osallistuvat ateroskleroottisen sairauden tromboottisten komplikaatioiden alkamiseen ja/tai kehittymiseen, verihiutaleiden eston on osoitettu pienentävän sydän- ja verisuonitapahtumien (CV-tapahtumien), kuten kuoleman, sydäninfarktin (MI) ja aivohalvauksen, riskiä.
Tikagrelori myös suurentaa paikallisia endogeenisiä adenosiinipitoisuuksia estämällä tasapainottavaa nukleosidikuljettaja 1:tä (ENT‑1).
Tikagrelorin on raportoitu lisäävän seuraavia adenosiinin aiheuttamia vaikutuksia terveillä tutkittavilla ja potilailla, joilla on akuutti koronaarioireyhtymä: vasodilataatio (mitattiin lisääntyneenä koronaarivirtauksena terveillä vapaaehtoisilla ja potilailla, joilla oli akuutti koronaarioireyhtymä; päänsärkynä), verihiutaleiden toiminnan estyminen (ihmisen kokoveressä in vitro), hengenahdistus. Todetun adenosiinipitoisuuden suurenemisen ja kliinisten tulosten (esim. sairastuvuus-kuolleisuus) välistä yhteyttä ei kuitenkaan ole tarkasti selvitetty.
Farmakodynaamiset vaikutukset
Vaikutuksen alkaminen
Tikagrelorin farmakologinen vaikutus alkaa nopeasti asetyylisalisyylihappoa käyttävillä potilailla, joilla on stabiili sepelvaltimotauti (CAD), keskimääräisen trombosyyttien aggregaation eston (inhibition of platelet aggregation = IPA) ollessa noin 41 % puolen tunnin jälkeen 180 mg:n latausannoksesta. Trombosyyttien aggregaation maksimiestovaikutus on 89 % 2-4 tunnin kuluttua annoksen ottamisesta ja se pysyy yllä 2-8 tuntia. 90 %:lla potilaista lopullinen trombosyyttien aggregaation eston suuruus oli > 70 % kaksi tuntia annoksen ottamisesta.
Vaikutuksen loppuminen
Jos ohitusleikkausta suunnitellaan, tikagrelorin aiheuttama verenvuotoriski on lisääntynyt verrattuna klopidogreeliin silloin, kun hoito lopetetaan alle 96 tuntia ennen toimenpidettä.
Tiedot lääkkeiden vaihtamisesta
Kun siirrytään klopidogreelin 75 mg:n annoksesta tikagrelorin 90 mg:n annokseen kaksi kertaa vuorokaudessa, absoluuttinen IPA nousee 26,4 %, ja kun siirrytään tikagrelorista klopidogreeliin, se laskee 24,5 %. Klopidogreelista tikagreloriin siirtyminen voidaan tehdä ilman, että antitromboottinen vaikutus keskeytyy (ks. kohta Annostus ja antotapa).
Kliininen teho ja turvallisuus
Tikagrelorin tehosta ja turvallisuudesta on saatu kliinistä näyttöä kahdesta vaiheen 3 tutkimuksesta:
- PLATO- [PLATelet Inhibition and Patient Outcomes] tutkimus, jossa verrattiin tikagreloria klopidogreeliin, jotka molemmat annettiin yhdessä asetyylisalisyylihapon ja muun tavanomaisen hoidon kanssa.
- PEGASUS TIMI‑54 [PrEvention with TicaGrelor of SecondAry Thrombotic Events in High‑RiSk AcUte Coronary Syndrome Patients] ‑tutkimus, jossa verrattiin hoitoa asetyylisalisyylihappoon yhdistetyllä tikagrelorilla hoitoon pelkästään asetyylisalisyylihapolla.
PLATO-tutkimus (akuutti koronaarioireyhtymä)
PLATO-tutkimukseen osallistui 18 624 potilasta, joiden epästabiilin angina pectoriksen (UA), sydäninfarktin ilman ST-nousua (NSTEMI) tai ST-nousuinfarktin (STEMI) oireet olivat alkaneet enintään 24 tuntia ennen hoitoon hakeutumista ja joita ensin hoidettiin lääkkeillä tai joille tehtiin perkutaaninen sepelvaltimotoimenpide (PCI) tai ohitusleikkaus (CABG).
Kliininen teho
Yhdessä päivittäisen ASA-annoksen kanssa kaksi kertaa vuorokaudessa annettu 90 mg:n tikagreloriannos ehkäisi 75 mg:n klopidogreeliannosta paremmin tehokkuuden yhdistettyä päätetapahtumaa: CV‑kuolemaa, sydäninfarktia [MI] ja aivohalvausta. Tämä ero perustui CV-kuolemaan ja sydäninfarktiin. Potilaille annettiin 300 mg:n latausannos klopidogreelia (600 mg:n annos mahdollinen, jos potilaalle tehtiin PCI-toimenpide) tai 180 mg:aa tikagreloria.
Tämä tulos ilmeni varhaisessa vaiheessa (absoluuttisen riskin vähenemä [ARR] 0,6 % ja suhteellisen riskin vähenemä [RRR] 12 % 30 päivän kohdalla) ja 12 kuukauden pysyvä hoitovaikutus antoi 1,9 %:n vuosittaisen absoluuttisen riskin vähenemän ja 16 %:n suhteellisen riskin vähenemän. Tämä viittaa siihen, että on tarkoituksenmukaista hoitaa potilaita tikagrelorin 90 mg:n annoksella kaksi kertaa vuorokaudessa 12 kuukauden ajan (ks. kohta Annostus ja antotapa). 54 ACS-potilaan hoito tikagrelorilla klopidogreelin sijasta estää yhden aterotromboottisen tapahtuman; 91 potilaan hoito estää yhden CV-kuoleman (ks. kuva 1 ja taulukko 4).
Tikagrelorin suotuisampi hoitovaikutus klopidogreeliin verrattuna näyttää olevan yhdenmukainen monissa alaryhmissä mukaan lukien paino; sukupuoli; sairaushistoriassa diabetes mellitus, ohimenevä iskeeminen kohtaus tai aivohalvaus, johon ei liity verenvuotoa, tai revaskularisaatio; samanaikaisten hoitojen käyttö mukaan lukien hepariinit, GpIIb/IIIa-estäjät ja protonipumpun estäjät (ks. kohta Yhteisvaikutukset); lopullinen indeksitapahtuman diagnoosi (STEMI, NSTEMI tai UA); sekä satunnaistamisen aikaan potilaalle aiottu hoito (invasiivinen tai lääkehoito).
Heikosti merkitsevä alueellinen hoitovaikutus havaittiin, minkä mukaan ensisijaisen päätetapahtuman riskisuhde (HR) oli tikagrelorilla suotuisampi muualla kuin Pohjois-Amerikassa, kun taas riskisuhde klopidogreelillä oli suotuisampi Pohjois-Amerikassa, joka edusti noin 10 % koko tutkittavien ryhmästä (vaikutuksen p-arvo=0,045). Eksploratiiviset analyysit viittaavat mahdolliseen yhteyteen ASA-annoksen suuruuden kanssa niin, että tikagrelorin tehon heikentymistä havaittiin käytettäessä tikagreloria kasvavien ASA-annosten kanssa. Tikagrelorin kanssa käytettävät kroonisten päivittäisten ASA-annosten tulisi olla 75−150 mg (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Kuvassa 1 esitetään riskin arviointi minkä tahansa yhdistettyyn päätetapahtumaan kuuluvan tapahtuman ensiesiintymiselle.
Kuva 1. Kliinisen ensisijaisen yhdistetyn päätetapahtuman – CV-kuoleman, sydäninfarktin ja aivohalvauksen – analyysi (PLATO)
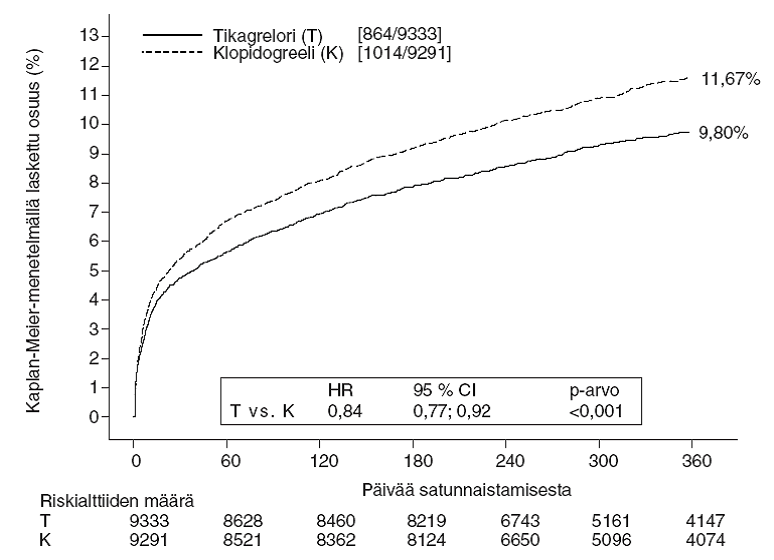
Tikagrelori vähensi ensisijaisen yhdistetyn päätetapahtuman esiintymistä klopidogreeliin verrattuna sekä UA/NSTEMI- että STEMI-ryhmissä (taulukko 4). Siten potilaille, joilla on ACS (epästabiili angina pectoris, sydäninfarkti ilman ST‑nousua (NSTEMI) tai ST‑nousuinfarkti (STEMI), mukaan lukien lääkkeillä hoidetut potilaat ja potilaat, joille on tehty perkutaaninen sepelvaltimotoimenpide (PCI) tai ohitusleikkaus (CABG), voidaan käyttää Brilique 90 mg ‑valmistetta kaksi kertaa vuorokaudessa yhdessä pieniannoksisen asetyylisalisyylihapon kanssa.
Taulukko 4. Ensisijaisten ja toissijaisten tehon päätetapahtumien analyysi (PLATO)
| Tikagrelori 90 mg kaksi kertaa vuorokaudessa (% potilaat, joilla tapahtuma) N=9333 | Klopidogreeli 75 mg kerran vuorokaudessa (% potilaat, joilla tapahtuma) N=9291 | ARRa (%/v) | RRRa (%) (95 % CI) | p-arvo | |
| CV-kuolema, MI (paitsi oireeton) tai aivohalvaus | 9,3 | 10,9 | 1,9 | 16 (8; 23) | 0,0003 |
| Invasiivinen hoitoaikomus | 8,5 | 10,0 | 1,7 | 16 (6; 25) | 0,0025 |
| Lääkehoitoaikomus | 11,3 | 13,2 | 2,3 | 15 (0,3; 27) | 0,0444d |
| CV-kuolema | 3,8 | 4,8 | 1,1 | 21 (9; 31) | 0,0013 |
| MI (paitsi oireeton)b | 5,4 | 6,4 | 1,1 | 16 (5; 25) | 0,0045 |
| Aivohalvaus | 1,3 | 1,1 | -0,2 | -17 (-52; 9) | 0,2249 |
| Kuolema mistä tahansa syystä, MI (paitsi oireeton) tai aivohalvaus | 9,7 | 11,5 | 2,1 | 16 (8; 23) | 0,0001 |
| CV-kuolema, MI (kaikki), aivohalvaus, SRI, RI, TIA tai muu ATEc | 13,8 | 15,7 | 2,1 | 12 (5; 19) | 0,0006 |
| Kuolema mistä tahansa syystä | 4,3 | 5,4 | 1,4 | 22 (11; 31) | 0,0003d |
| Selvä stenttitromboosi | 1,2 | 1,7 | 0,6 | 32 (8; 49) | 0,0123d |
| aARR = absoluuttisen riskin vähenemä; RRR = suhteellisen riskin vähenemä = (1‑riskisuhde) x 100 %. Negatiivinen RRR osoittaa suhteellisen riskin lisäystä. bOireeton MI suljettu pois. cSRI = vakava uusiutuva iskemia; RI = uusiutuva iskemia; TIA = ohimenevä aivojen iskeeminen kohtaus; ATE = valtimotukostapahtuma. "MI (kaikki)" sisältää oireettoman sydäninfarktin (tapahtuman päivämäärä on päivämäärä, jolloin havaittu). dNimellinen merkitsevyysarvo; kaikki muut ovat muodollisesti tilastollisesti merkitseviä ennalta määritetyn hierarkkisen testauksen perusteella | |||||
PLATO-tutkimuksen geneettinen liitännäistutkimus
PLATO-tutkimuksessa tehdyllä 10 285 potilaan CYP2C19- ja ABCB1-genotyypityksellä havaittiin yhteys genotyyppiryhmien ja PLATO-tulosten välillä. Potilaan CYP2C19- tai ABCB1-genotyypillä ei ollut merkitsevää vaikutusta tikagrelorin suotuisampaan vaikutukseen klopidogreeliin verrattuna merkittävien CV-tapahtumien ehkäisyssä. PLATO-tutkimuksen mukaiset merkittävät verenvuodot eivät eronneet CYP2C19- tai ABCB1-genotyypistä huolimatta tikagrelorin ja klopidogreelin välillä, mikä on yhdenmukainen koko PLATO-tutkimuksen kanssa. Klopidogreeliin verrattuna PLATO-tutkimuksen mukaisten, muiden kuin ohitusleikkaukseen liittyvien merkittävien verenvuotojen esiintyvyys lisääntyi tikagreloria käytettäessä potilailla, joilla oli yksi tai useampi toimimattomaan CYP2C19-proteiiniin johtava alleeli ("loss of function" -alleeli), mutta potilailla, joilla ei ollut tätä entsyymin inaktivoitumiseen johtavaa alleelia, esiintyvyys oli samanlainen kuin klopidogreelilla.
Tehon ja turvallisuuden yhdistetyt päätetapahtumat yhdessä
Tehon ja turvallisuuden yhdistetyt päätetapahtumat yhdessä (CV-kuolema, sydäninfarkti, aivohalvaus tai PLATO-tutkimuksen mukaiset "kaikki merkittävät" -verenvuodot) viittaavat siihen, että 12 kuukauden ajanjaksolla ACS-sairauden diagnoosin ja akuutin vaiheen jälkeen ilmenevät merkittävät verenvuototapahtumat eivät kumoa tikagrelorin tehokkuushyötyä klopidogreeliin verrattuna (ARR 1,4 %, RRR 8 %, HR 0,92; p=0,0257).
Kliininen turvallisuus
Holter-liitännäistutkimus:
Holter-monitorointeja tehtiin lähes 3 000 potilaan alaryhmässä, jotta voitiin tutkia PLATO-tutkimusten aikaisten kammioiden supistumisen taukojen ja muiden arytmiaepisodien esiintymistä. Noin 2 000 potilaalla monitorointi tehtiin sekä ACS-sairauden akuutin vaiheen aikana että yhden kuukauden kuluttua siitä. Ensisijainen kiinnostava muuttuja oli ≥ 3 sekunnin pituisten taukojen esiintyminen kammioiden supistumisessa. Taukoja kammioiden supistumisessa esiintyi akuutin vaiheen aikana useammilla tikagreloria (6,0 %:lla) kuin klopidogreelia (3,5 %:lla) saaneilla potilailla. Yhden kuukauden kuluttua taukoja kammioiden supistumisessa esiintyi 2,2 %:lla tikagreloria ja 1,6 %:lla klopidogreelia saaneista potilaista (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Taukojen lisääntyminen kammioiden supistumisessa ACS-sairauden akuutissa vaiheessa oli huomattavampaa tikagreloria saaneilla potilailla, joilla oli anamneesissaan kongestiivinen sydämen vajaatoiminta (9,2 % vs. 5,4 % tikagreloripotilailla, joilla ei ollut sydämen vajaatoimintaa, vastaavat luvut klopidogreelipotilailla: 4,0 % vs. 3,6 %). Tätä epätasapainoa ei ilmennyt yhden kuukauden kohdalla: 2,0 % tikagreloripotilailla, joilla oli anamneesissaan sydämen vajaatoiminta, vs. 2,1 % tikagreloripotilailla, joilla ei ollut sydämen vajaatoimintaa; vastaavat luvut klopidogreelilla: 3,8 % vs. 1,4 %. Tähän epätasapainoon ei liittynyt haitallisia kliinisiä seuraamuksia (mukaan lukien sydämentahdistinten asennukset) tässä potilasryhmässä.
PEGASUS-tutkimus (aiempi sydäninfarkti)
PEGASUS TIMI‑54 ‑tutkimus oli tapahtumapohjainen, satunnaistettu, kaksoissokkoutettu, lumekontrolloitu, rinnakkaisryhmillä toteutettu, kansainvälinen monikeskustutkimus, johon osallistui 21 162 potilasta ja jossa arvioitiin aterotromboottisten tapahtumien ehkäisyä tikagrelorin kahdella annoksella (joko 90 mg kaksi kertaa vuorokaudessa tai 60 mg kaksi kertaa vuorokaudessa) yhdessä pieniannoksisen asetyylisalisyylihapon (75‑150 mg) kanssa verrattuna pelkään asetyylisalisyylihappoon potilailla, joilla oli ollut aiemmin sydäninfarkti ja joilla oli muita aterotromboosin riskitekijöitä.
Potilaat soveltuivat tutkimukseen, jos he olivat vähintään 50‑vuotiaita, heillä oli ollut aiemmin sydäninfarkti (1‑3 vuotta ennen satunnaistamista) ja heillä oli ainakin yksi seuraavista aterotromboosin riskitekijöistä: vähintään 65 vuoden ikä, lääkitystä vaativa diabetes mellitus, toinen aiempi sydäninfarkti, monen suonen sepelvaltimotauti tai krooninen muu kuin loppuvaiheen munuaisen toimintahäiriö.
Potilaat eivät soveltuneet tutkimukseen, jos heille aiottiin antaa P2Y12-reseptorin antagonistia, dipyridamolia, silostatsolia tai antikoagulaatiohoitoa tutkimusjakson aikana, jos heillä oli verenvuotosairaus tai heillä oli aiemmin ollut iskeeminen aivohalvaus tai kallonsisäinen verenvuoto, keskushermoston kasvain tai kallonsisäisten verisuonten poikkeavuus tai jos heillä oli ollut maha-suolikanavan verenvuotoa kuuden viimeksi kuluneen kuukauden aikana tai heille oli tehty suuri leikkaus viimeksi kuluneiden 30 päivän sisällä.
Kliininen teho
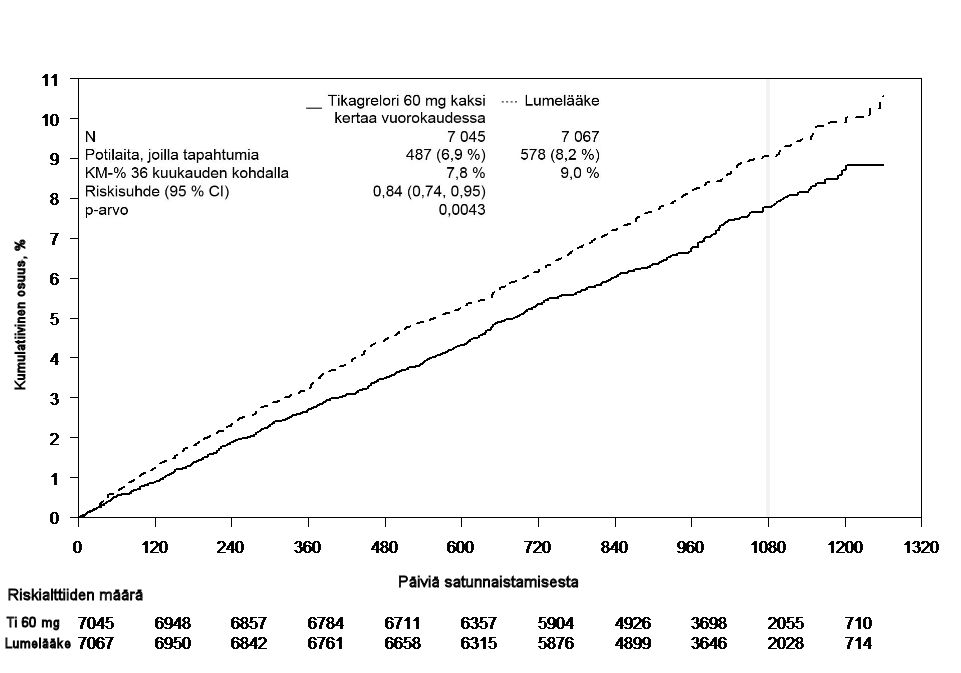
Kuva 2. Kliinisen ensisijaisen yhdistetyn päätetapahtuman – CV‑kuoleman, sydäninfarktin ja aivohalvauksen – analyysi (PEGASUS)
Taulukko 5 ‑ Ensisijaisten ja toissijaisten tehon päätetapahtumien analyysi (PEGASUS)
| Tikagrelori 60 mg kaksi kertaa vuorokaudessa + ASA N = 7 045 | Pelkkä ASA N = 7 067 | p‑arvo | ||||
|---|---|---|---|---|---|---|
| Kohde | Potilaita, joilla tapahtumia | KM‑% | HR (95 % CI) | Potilaita, joilla tapahtumia | KM‑% | |
| Ensisijainen päätetapahtuma | ||||||
| Yhdistetty CV‑kuolema/MI/aivohalvaus | 487 (6,9 %) | 7,8 % | 0,84 (0,74, 0,95) | 578 (8,2 %) | 9,0 % | 0,0043 (s) |
| CV‑kuolema | 174 (2,5 %) | 2,9 % | 0,83 (0,68, 1,01) | 210 (3,0 %) | 3,4 % | 0,0676 |
| MI | 285 (4,0 %) | 4,5 % | 0,84 (0,72, 0,98) | 338 (4,8 %) | 5,2 % | 0,0314 |
| Aivohalvaus | 91 (1,3 %) | 1,5 % | 0,75 (0,57, 0,98) | 122 (1,7 %) | 1,9 % | 0,0337 |
| Toissijainen päätetapahtuma | ||||||
| CV‑kuolema | 174 (2,5 %) | 2,9 % | 0,83 (0,68, 1,01) | 210 (3,0 %) | 3,4 % | ‑ |
| Kuolema mistä tahansa syystä | 289 (4,1 %) | 4,7 % | 0,89 (0,76, 1,04) | 326 (4,6 %) | 5,2 % | ‑ |
Riskisuhde ja p‑arvot laskettiin erikseen tikagrelorille verrattuna pelkkään asetyylisalisyylihappoon Coxin suhteellisten riskien mallilla, jossa ainoana selittävänä muuttujana oli hoitoryhmä.
KM:n prosentuaalinen osuus laskettiin 36 kuukauden kohdalla.
Huomattava: ensimmäisten tapahtumien määrä osatekijöiden CV‑kuolema, MI ja aivohalvaus osalta on kunkin osatekijän todellisten ensimmäisten tapahtumien määrä eikä se vastaa yhdistelmäpäätemuuttujan tapahtumien määrää.
(s) tarkoittaa tilastollista merkitsevyyttä.
CI = Luottamusväli; CV = sydän- ja verisuoni-; HR = riskisuhde; KM = Kaplan‑Meier; MI = sydäninfarkti; N = potilaiden määrä.
Sekä 60 mg kaksi kertaa vuorokaudessa että 90 mg kaksi kertaa vuorokaudessa annettu tikagreloriannos yhdessä asetyylisalisyylihapon kanssa ehkäisivät aterotromboottisia tapahtumia paremmin kuin pelkkä asetyylisalisyylihappo (yhdistetty päätetapahtuma: CV-kuolema, sydäninfarkti ja aivohalvaus) ja hoidon teho oli yhdenmukainen koko tutkimuksen ajan; tikagrelorin 60 mg annoksen suhteellisen riskin vähenemäksi (RRR) saatiin 16 % ja absoluuttisen riskin vähenemäksi (ARR) 1,27 % ja tikagrelorin 90 mg annoksen RRR:ksi saatiin 15 % ja ARR:ksi 1,19 %.
Vaikka 90 mg ja 60 mg annoksen tehoprofiilit olivat samankaltaiset, on olemassa näyttöä siitä, että pienemmällä annoksella on parempi siedettävyys ja turvallisuusprofiili verenvuodon ja hengenahdistuksen riskin suhteen. Siksi vain Brilique 60 mg ‑valmistetta on suositeltavaa antaa kaksi kertaa vuorokaudessa yhdessä asetyylisalisyylihapon kanssa aterotromboottisten tapahtumien (CV-kuoleman, sydäninfarktin ja aivohalvauksen) ehkäisyyn potilaille, joilla on aiemmin ollut sydäninfarkti ja joilla on suuri aterotromboottisen tapahtuman riski.
Pelkkään asetyylisalisyylihappoon verrattuna kaksi kertaa vuorokaudessa annettu tikagrelori 60 mg vähensi merkitsevästi ensisijaista yhdistettyä päätetapahtumaa CV-kuolemaa, sydäninfarktia ja aivohalvausta. Kaikki osatekijät vaikuttivat osaltaan ensisijaisen yhdistetyn päätetapahtuman vähenemiseen (CV-kuolemien suhteellisen riskin vähenemä 17 %, sydäninfarktin 16 % ja aivohalvauksen 25 %).
Suhteellisen riskin vähenemät (RRR) yhdistetylle päätetapahtumalle päivästä 1 päivään 360 asti (RRR 17 %) ja päivästä 361 eteenpäin (RRR 16 %) olivat samanlaiset. Tietoa Brilique-valmisteen tehosta ja turvallisuudesta yli 3 vuoden pitkäaikaishoidossa on vähän.
Näyttöä hyödystä ei ollut (ensisijainen yhdistelmäpäätemuuttuja eli CV-kuolema, sydäninfarkti ja aivohalvaus eivät vähentyneet, mutta merkittävä verenvuoto lisääntyi), kun kliinisesti vakaille potilaille aloitettiin tikagrelorihoito 60 mg:n annoksella kaksi kertaa vuorokaudessa yli 2 vuoden kuluttua sydäninfarktista tai yli yhden vuoden kuluttua edellisen ADP-reseptorin estäjällä toteutetun hoidon päättymisen jälkeen (ks. kohta Annostus ja antotapa).
Kliininen turvallisuus
Yli 75 vuotiaat tikagreloria 60 mg saaneet potilaat keskeyttivät hoidon verenvuodon ja hengenahdistuksen vuoksi useammin (42 %) kuin nuoremmat potilaat (vaihteluväli: 23‑31 %) ja ero lumeryhmään nähden yli 75‑vuotiailla potilailla oli yli 10 % (29 % lumeryhmä, 42 % tikagrelori 60 mg).
Pediatriset potilaat
Satunnaistetussa, kaksoissokkoutetussa, rinnakkaisryhmillä toteutetussa vaiheen 3 tutkimuksessa (HESTIA 3) 193 pediatrista potilasta (iältään 2 – < 18-vuotiaita), joilla oli sirppisolutauti, satunnaistettiin saamaan joko lumelääkettä tai tikagreloria annoksella 15–45 mg kaksi kertaa päivässä kehon painon mukaan määräytyen. Tikagreloriryhmässä trombosyyttien estovaikutuksen mediaani oli 35 % ennen annoksen ottamista ja 56 % 2 tuntia annoksen ottamisen jälkeen vakaassa tilassa.
Lumelääkkeeseen verrattuna tikagrelorihoidolla ei todettu hyötyä vaso-okklusiivisten kriisien määrään.
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset Brilique-valmisteen käytöstä akuutin koronaarioireyhtymän (ACS) ja aiemman sydäninfarktin (MI) hoidossa kaikissa pediatrisissa potilasryhmissä (ks. kohta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Tikagrelorin farmakokinetiikka on lineaarinen, ja altistus tikagrelorille ja sen aktiiviselle metaboliitille (AR-C124910XX) on 1260 mg:aan asti suunnilleen suhteessa annokseen.
Imeytyminen
Ticagrelorin imeytyminen on nopeaa tmax-arvon mediaanin ollessa noin 1,5 tuntia. Pääasiallisen veressä kiertävän (myöskin aktiivisen) metaboliitin AR‑C124910XX:n muodostuminen tikagrelorista on nopeaa tmax-arvon mediaanin ollessa noin 2,5 tuntia. Kun tikagreloria annetaan 90 mg suun kautta kerta-annoksena paaston jälkeen terveille tutkittaville, Cmax on 529 ng/ml ja AUC 3451 ng*h/ml. Metaboliitti-/kanta-aine-suhteet ovat 0,28 (Cmax) ja 0,42 (AUC). Tikagrelorin ja AR‑C124910XX:n farmakokinetiikka potilailla, joilla on ollut aiemmin sydäninfarkti, oli yleisesti samanlainen kuin ACS-populaatiolla. PEGASUS-tutkimuksen populaatiofarmakokineettisen analyysin perusteella tikagrelorin mediaani-Cmax oli 391 ng/ml ja AUC oli 3 801 ng*h/ml vakaassa tilassa tikagrelorin 60 mg:n annoksella. Tikagrelorin 90 mg:n annoksella Cmax oli 627 ng/ml ja AUC 6 255 ng*h/ml vakaassa tilassa.
Tikagrelorin keskimääräisen absoluuttisen hyötyosuuden arvioitiin olevan 36 %. Rasvapitoisen aterian nauttiminen nosti tikagrelorin AUC-arvoa 21 % ja alensi aktiivisen metaboliitin Cmax-arvoa 22 %, mutta sillä ei ollut vaikutusta tikagrelorin Cmax-arvoon eikä aktiivisen metaboliitin AUC-arvoon. Näiden pienten muutosten kliininen merkitys on vähäinen, ja siksi tikagreloria voidaan antaa ruoan kanssa tai ilman. Tikagrelori ja sen aktiivinen metaboliitti ovat P‑gp:n substraatteja.
Kun tikagrelori annetaan veteen sekoitettuina murskattuina tabletteina suun kautta tai nenä-mahaletkulla mahalaukkuun, sen hyötyosuus on verrannollinen kokonaisiin tabletteihin tikagrelorin ja aktiivisen metaboliitin AUC- ja Cmax-arvojen suhteen. Veteen sekoitetuista murskatuista tikagreloritableteista mitattu alkuvaiheen altistus (0,5 tuntia ja 1 tunti annoksen ottamisen jälkeen) oli suurempi kuin kokonaisilla tableteilla ja pitoisuusprofiili sen jälkeen (2-48 tuntia) oli yleensä täysin samanlainen.
Jakautuminen
Tikagrelorin vakaan tilan jakautumistilavuus on 87,5 litraa. Tikagrelori ja sen aktiivinen metaboliitti sitoutuvat voimakkaasti ihmisen plasman proteiineihin (> 99,0 %).
Biotransformaatio
CYP3A4 on tärkein tikagrelorin metaboliasta ja aktiivisen metaboliitin muodostumisesta vastaava entsyymi, ja niiden yhteisvaikutukset muiden CYP3A-substraattien kanssa vaihtelee aktivaatiosta estoon.
Tikagrelorin päämetaboliitti on aktiivinen AR‑C124910XX, joka sitoutuu verihiutaleiden P2Y12 ADP -reseptoriin in vitro. Systeeminen altistus aktiiviselle metaboliitille on noin 30-40 % tikagrelorilla saadusta altistuksesta.
Eliminaatio
Tikagrelorin pääasiallinen eliminaatioreitti on maksametabolia. Kun annetaan radioaktiivisesti merkittyä tikagreloria, radioaktiivisuudesta erittyy keskimäärin noin 84 % (57,8 % ulosteeseen, 26,5 % virtsaan). Sekä tikagrelorista että sen aktiivisesta metaboliitista erittyi virtsaan alle 1 % annoksesta. Aktiivisen metaboliitin pääasiallinen eliminaatioreitti on mitä todennäköisimmin sappieritys. Tikagrelorin keskimääräinen puoliintumisaika (t1/2) oli noin 7 tuntia ja aktiivisen metaboliitin 8,5 tuntia.
Erityisryhmät
Iäkkäät
Iäkkäillä ACS-potilailla (≥ 75-vuotiaat) havaittiin populaatiofarmakokineettisessä analyysissä nuorempiin potilaisiin verrattuna korkeammat tikagrelorin (Cmax ja AUC: noin 25 %) ja aktiivisen metaboliitin altistukset. Näitä eroja ei pidetä kliinisesti merkitsevinä (ks. kohta Annostus ja antotapa).
Pediatriset potilaat
Lapsista, joilla on sirppisolutauti, on vain vähän tietoja saatavilla (ks. kohdat Annostus ja antotapa ja Farmakodynamiikka).
HESTIA 3‑tutkimuksessa 2 – < 18-vuotiaille potilaille annettiin tikagreloria kaksi kertaa päivässä pediatrisille potilaille tarkoitettuina 15 mg:n liukenevina tabletteina kerta-annoksilla 15 mg ≥ 12 – ≤ 24 kg painaville potilaille, 30 mg > 24 – ≤ 48 kg painaville potilaille ja 45 mg > 48 kg painaville potilaille. Populaatiofarmakokineettisen analyysin perusteella keskimääräinen AUC oli 1 095–1 458 ng*h/ml ja keskimääräinen Cmax oli 143–206 ng/ml vakaassa tilassa.
Sukupuoli
Naisilla havaittiin miehiin verrattuna korkeammat tikagrelorin ja aktiivisen metaboliitin altistukset. Näitä eroja ei pidetä kliinisesti merkitsevinä.
Munuaisten vajaatoiminta
Vaikeaa munuaisten vajaatoimintaa sairastavilla potilailla (kreatiniinipuhdistuma < 30 ml/min) altistus tikagrelorille oli noin 20 % alhaisempi ja altistus sen aktiiviselle metaboliitille noin 17 % korkeampi kuin potilailla, joiden munuaistoiminta oli normaali.
Potilailla, joilla oli loppuvaiheen munuaissairaus ja jotka saivat hemodialyysihoitoa, muuna kuin dialyysipäivänä annetun tikagrelorin (90 mg) AUC oli 38 % ja Cmax 51 % suurempi kuin tutkittavilla, joiden munuaistoiminta oli normaali. Vastaavaa altistuksen suurenemista havaittiin, kun tikagrelori annettiin juuri ennen dialyysiä (AUC suureni 49 % ja Cmax 61 %), mikä osoittaa, että tikagrelori ei ole dialysoitavissa. Altistus aktiiviselle metaboliitille suureni vähemmän (AUC 13−14 % ja Cmax 17−36 %). Tikagrelorin trombosyyttien aggregaatiota estävä vaikutus (IPA) ei ollut dialyysistä riippuvainen potilailla, joilla oli loppuvaiheen munuaissairaus, ja se oli vastaavanlainen kuin tutkittavilla, joiden munuaistoiminta oli normaali (ks. kohta Annostus ja antotapa).
Maksan vajaatoiminta
Terveiden tutkittavien verrokkiryhmään verrattuna tikagrelorin Cmax oli 12 % ja AUC 23 % korkeampi potilailla, joilla oli lievä maksan vajaatoiminta. Tikagrelorin trombosyyttien aggregaation estovaikutus oli kuitenkin samanlainen kummassakin ryhmässä. Annosta ei ole tarpeen muuttaa potilailla, joilla on lievä maksan vajaatoiminta. Tikagreloria ei ole tutkittu potilailla, joilla on vaikea maksan vajaatoiminta, eikä sen käytöstä keskivaikeaa maksan vajaatoimintaa sairastaville potilaille ole farmakokineettistä tietoa. Potilailla, joiden vähintään yksi maksa-arvo oli kohtalaisesti tai huomattavasti kohonnut maksan toimintakokeissa lähtötilanteessa, tikagrelorin pitoisuudet plasmassa olivat keskimäärin samansuuruisia tai hieman suurempia verrattuna potilaisiin, joiden maksa-arvot eivät olleet kohonneet lähtötilanteessa. Annoksen muuttamista ei suositella kohtalaista maksan vajaatoimintaa sairastaville potilaille (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Etninen tausta
Aasialaista syntyperää olevilla potilailla on 39 % korkeampi keskimääräinen hyötyosuus verrattuna valkoihoisiin potilaisiin. Itsensä mustaihoisiksi määritelleillä potilailla tikagrelorin hyötyosuus oli 18 % alhaisempi kuin valkoihoisilla potilailla, kliinisissä farmakologiatutkimuksissa tikagrelorialtistus (Cmax ja AUC) oli japanilaisilla tutkittavilla noin 40 % (20 % painoon suhteuttamisen jälkeen) korkeampi kuin valkoihoisilla. Itsensä espanjalaissyntyisiksi tai latinalaisamerikkalaisiksi määritelleillä potilailla altistus oli samanlainen kuin valkoihoisilla.
Prekliiniset tiedot turvallisuudesta
Tikagrelorin ja sen päämetaboliitin prekliiniset tiedot eivät osoita liiallista haittavaikutusriskiä ihmisillä käytettynä. Tiedot perustuvat farmakologista turvallisuutta, kerta-annosten ja toistuvan altistuksen aiheuttamaa toksisuutta ja genotoksisuutta koskevien konventionaalisten tutkimusten tuloksiin.
Maha-suolikanavan ärsytystä havaittiin useilla eläinlajeilla kliinisesti merkittävillä altistustasoilla (ks. kohta Haittavaikutukset).
Naarasrotilla suuret tikagreloriannokset lisäsivät kohdun kasvainten (adenokarsinoomien) ja maksa-adenoomien esiintymistä. On todennäköistä, että kohdun kasvaimia aiheuttava mekanismi johtuu hormoniepätasapainosta, joka voi aiheuttaa kasvaimia rotilla. On todennäköistä, että maksa-adenoomia aiheuttava mekanismi johtuu jyrsijöille tyypillisestä maksan entsyymi-induktiosta. Siksi karsinogeenisuushavainnoilla ei todennäköisesti ole merkitystä ihmisille.
Vähäisiä kehityspoikkeamia havaittiin rotilla, kun käytettiin emolle toksista annosta (turvamarginaali 5,1). Kaneilla havaittiin vähäistä maksan ja luuston kehityksen viivästymistä sellaisilla sikiöillä, joiden emoille annettiin korkeita annoksia, vaikka annokset eivät osoittautuneet emolle toksisiksi (turvamarginaali 4,5).
Rotilla ja kaneilla tehdyt tutkimukset ovat osoittaneet lisääntymistoksisuutta mukaan lukien lievästi vähäisempää emon painonnousua sekä vastasyntyneiden poikasten elinkyvyn heikkenemistä, syntymäpainon laskua ja kasvun viivästymistä. Tikagrelori aiheutti epäsäännöllisiä kiimasyklejä (pääasiassa pidentyneitä syklejä) naarasrotilla, mutta se ei vaikuttanut uros- eikä naarasrottien yleiseen hedelmällisyyteen. Farmakokineettiset tutkimukset radioaktiivisesti merkityllä tikagrelorilla ovat osoittaneet, että kanta-ainetta ja sen metaboliitteja erittyy rottien maitoon (ks. kohta Raskaus ja imetys).
Farmaseuttiset tiedot
Apuaineet
60 ja 90 mg tabletti:Tablettiydin:mannitoli (E 421), kalsiumvetyfosfaattidihydraatti, magnesiumstearaatti (E 470b), natriumtärkkelysglykolaatti tyyppi A, hydroksipropyyliselluloosa (E 463).
60 mg tabletti: Tabletin päällys: titaanidioksidi (E 171), musta rautaoksidi (E 172), punainen rautaoksidi (E172), makrogoli 400, hypromelloosi (E 464).
90 mg tabletti: Tabletin päällys: talkki, titaanidioksidi (E 171), keltainen rautaoksidi (E 172), makrogoli 400, hypromelloosi (E 464).
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta.
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
BRILIQUE tabletti, kalvopäällysteinen
60 mg (L:ei) 56 fol (60,29 €), 168 fol (155,76 €)
90 mg (L:ei) 56 fol (65,32 €), 168 fol (182,20 €), 100 x 1 fol (155,10 €)
PF-selosteen tieto
60 mg ja 90 mg:
- 10 tablettia sisältävä läpinäkyvä PVC-PVDC/Al-läpipainopakkaus (jossa aurinko-/kuu-symboli) 60 tabletin (kuuden läpipainopakkauksen) ja 180 tabletin (18 läpipainopakkauksen) pahvikoteloissa.
- 14 tablettia sisältävä, viikonpäivillä merkitty läpinäkyvä PVC-PVDC/Al-läpipainopakkaus (jossa aurinko-/kuu-symboli) 14 tabletin (yhden läpipainopakkauksen), 56 tabletin (neljän läpipainopakkauksen) ja 168 tabletin (12 läpipainopakkauksen) pahvikoteloissa.
90 mg:
- 10 tablettia sisältävä, perforoitu läpinäkyvä yksittäispakattu PVC‑PVDC/Al-läpipainopakkaus 100x1 tabletin (10 läpipainopakkauksen) pahvikoteloissa.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
60 mg: Pyöreä, kaksoiskupera, vaaleanpunainen tabletti, jonka toisella puolella on merkintä "60" ja sen alapuolella kirjain T. Tabletin toinen puoli on sileä.
90 mg: Pyöreä, kaksoiskupera, keltainen tabletti, jonka toisella puolella on merkintä "90" ja sen alapuolella kirjain T. Tabletin toinen puoli on sileä.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
BRILIQUE tabletti, kalvopäällysteinen
60 mg 56 fol, 168 fol
- Alempi erityiskorvaus (65 %). Tikagrelori 60 mg: Sydäninfarktin sairastaneille sepelvaltimotautipotilaille erityisin edellytyksin (287).
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Tikagrelori 60 mg: Sydäninfarktin sairastaneille sepelvaltimotautipotilaille erityisin edellytyksin (386).
BRILIQUE tabletti, kalvopäällysteinen
90 mg 56 fol, 168 fol
- Rajoitettu alempi erityiskorvaus reseptimerkinnällä (65 %). Krooninen sepelvaltimotauti ja krooniseen sepelvaltimotautiin liittyvä rasva-aineenvaihdunnan häiriö (206). Merkintä lääkemääräyksen 'Perustelut'-kohdassa: Sepelvaltimotautikohtaus (E015).
- Rajoitettu peruskorvaus reseptimerkinnällä (40 %). Merkintä lääkemääräyksen 'Perustelut'-kohdassa: Sepelvaltimotautikohtaus (E015).
BRILIQUE tabletti, kalvopäällysteinen
90 mg 100 x 1 fol
- Ei korvausta.
ATC-koodi
B01AC24
Valmisteyhteenvedon muuttamispäivämäärä
05.09.2024
Yhteystiedot
Keilaranta 18
02150 Espoo
010 23 010
www.astrazeneca.fi
