OZURDEX implantaatti silmän lasiaiseen, asetin 700 mikrog
 Lääketurva
Lääketurva
Riskienminimointimateriaalit
Potilas
Potilasoppaan kuunneltava ääniversio/Ljudversion av patientbroschyren
Vaikuttavat aineet ja niiden määrät
Yksi implantaatti sisältää 700 mikrogrammaa deksametasonia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Implantaatti silmän lasiaiseen, asetin.
Kliiniset tiedot
Käyttöaiheet
OZURDEX on tarkoitettu sellaisten aikuispotilaiden hoitoon, joilla on
- diabeettisesta makulaturvotuksesta (DME) johtuva näön heikkeneminen ja pseudofakia tai riittämätön hoitovaste muille hoidoille kuin kortikosteroideille tai joille hoito muilla lääkkeillä kuin kortikosteroideilla ei sovellu
- makulaturvotusta joko verkkokalvon laskimon haaratukoksen tai verkkokalvon keskilaskimon tukoksen seurauksena (ks. kohta Farmakodynamiikka)
- ei-tarttuvana uveiittina ilmenevä silmän takaosan tulehdus
Ehto
Injektion antavalla silmälääkärillä on oltava kokemusta lasiaisen sisään annettavista injektioista.
Annostus ja antotapa
OZURDEX-hoitoa saa antaa pätevä silmätautien erikoislääkäri, jolla on kokemusta silmän lasiaiseen annettavista injektioista.
Annostus
Suositeltu annos on yksi OZURDEX-implantaatti hoidettavan silmän lasiaiseen. Annostelua molempiin silmiin samanaikaisesti ei suositella (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Diabeettinen makulaturvotus
Uusintahoitoa on harkittava, kun potilaalla on esiintynyt alkuvaste OZURDEX-hoitoon ja lääkärin mielestä potilas voi hyötyä uusintahoidosta ilman altistumista merkittävälle riskille.
Uusintahoito voidaan antaa noin 6 kuukauden kuluttua, jos potilaan näkö heikkenee ja/tai verkkokalvo paksuuntuu uusiutuvan tai pahenevan diabeettisen makulaturvotuksen takia.
Tällä hetkellä ei ole kokemusta toistuvan annoksen tehosta tai turvallisuudesta diabeettisen makulaturvotuksen hoidossa käytettäessä yli 7 implantaattia.
Verkkokalvon laskimotukos ja uveiitti
Annostuksen toistamista on harkittava, kun potilaalla esiintyy vaste hoitoon ja sen jälkeen näöntarkkuuden menetys ja lääkärin mielestä potilas voi hyötyä uusintahoidosta ilman altistumista merkittävälle riskille (ks. kohta Farmakodynamiikka).
Potilaita, joiden näkö paranee tai parantunut näkökyky säilyy, ei saa hoitaa uudelleen. Jos potilaan näkö heikkenee eikä OZURDEX hidasta sitä, potilasta ei saa hoitaa uudelleen.
Alle kuuden kuukauden välein toistetusta annostuksesta on hyvin rajoitetusti tietoja (ks. kohta Farmakodynamiikka).
Tämän hetkiset turvallisuustiedot useamman kuin kahden implantaatin toistuvasta annostelusta silmän takaosan ei-tarttuvassa uveiitissa ja verkkokalvon laskimotukoksessa, ks. kohta Haittavaikutukset.
Potilaita on tarkkailtava injektoinnin jälkeen, jotta mahdollinen infektio tai kohonnut silmänpaine voidaan hoitaa aikaisessa vaiheessa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Erityiset potilasryhmät
Iäkkäät potilaat (≥ 65-vuotiaat)
Iäkkäiden potilaiden annostusta ei tarvitse säätää.
Munuaisten toimintahäiriöt
OZURDEX-implantaattia ei ole tutkittu potilailla, joilla on munuaisten toimintahäiriö, mutta tälle potilasryhmälle ei kuitenkaan tarvita erikoisharkintaa.
Maksan toimintahäiriöt
OZURDEX-implantaattia ei ole tutkittu potilailla, joilla on maksan toimintahäiriö, mutta tälle potilasryhmälle ei kuitenkaan tarvita erikoisharkintaa.
Pediatriset potilaat
Ei ole asianmukaista käyttää OZURDEX-implantaattia pediatrisille potilaille
- diabeettisen makulaturvotuksen hoidossa
- verkkokalvon laskimon haaratukoksen tai verkkokalvon keskilaskimotukoksen jälkeisen makulaturvotuksen hoidossa.
OZURDEX-implantaatin turvallisuutta ja tehoa pediatristen potilaiden uveiitin hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
Antotapa
OZURDEX on kertakäyttöinen implantaatti asettimessa, silmän lasiaiseen, vain käytettäväksi silmän lasiaiseen.
Yhtä asetinta voidaan käyttää vain yhden silmän hoitoon.
Injektio silmän lasiaiseen on annettava kontrolloiduissa aseptisissa olosuhteissa, joita ovat mm. steriilien käsineiden, steriilin liinan ja steriilin luomenlevittimen (tai vastaavan) käyttö.
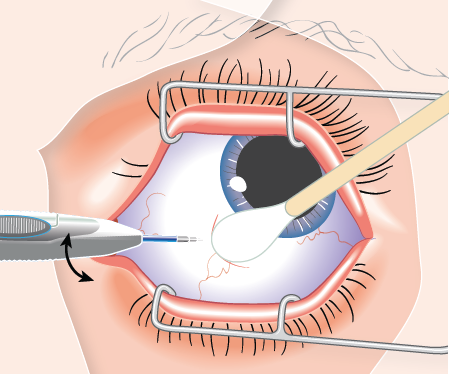
Potilasta on neuvottava käyttämään laajakirjoista antimikrobilääkettä sisältäviä tippoja kolmen päivän ajan ennen injektiota sekä sen jälkeen. Ennen injektiota on desinfioitava silmää ympäröivä iho, silmäluomi ja silmän pinta (esim. tiputettava 5-prosenttiset povidonijoditipat sidekalvolle, kuten tehtiin OZURDEXIN myyntilupahakemuksen kliinisissä tutkimuksissa) ja käytettävä riittävää paikallispuudutusta. Poista foliopussi pahvipakkauksesta ja tarkista, ettei pussi ole vaurioitunut (ks. kohta Käyttö- ja käsittelyohjeet). Avaa foliopussi sitten steriilillä alueella ja aseta asetin varovasti steriiliin koriin. Asetin on käytettävä välittömästi foliopussin avaamisen jälkeen.
Suorita perusteellinen visuaalinen tarkastus asettimelle. Varmista myös että laukaisinpainiketta ei ole painettu ja että turvakieleke on paikallaan. Poista varovasti muovinen suojakorkki varoen koskemasta neulan kärkeen. Tarkista neulan kärki vaurioiden varalta ennen käyttöä; implantaatin pidätystulppa voi olla näkyvissä neulan viisteessä, eikä sitä saa poistaa. Pidä asetinta toisessa kädessä ja vedä turvakieleke suoraan ulos asettimesta. Älä väännä tai taivuta kielekettä.
Pidä neulan viiste poispäin kovakalvosta ja työnnä neulaa noin 1 mm kovakalvon sisään. Suuntaa neula sitten uudelleen silmän keskikohtaa kohti lasiaisonteloon, kunnes holkki on sidekalvoa vasten. Paina laukaisinpainiketta hitaasti, kunnes kuulet ja/tai tunnet naksahduksen. Varmista ennen asettimen poistamista silmästä, että laukaisinpainike on painettu kokonaan sisään ja että se on lukkiutunut samaan tasoon asettimen pinnan kanssa. Poista neula samaan suuntaan, josta työnsit sen lasiaiseen.
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet silmän lasiaisen implantaattihoidon antamisesta.
Varmista implantaatin asettamisen onnistuminen heti OZURDEX-injektion jälkeen injektointialueen epäsuoralla silmäntähystyksellä. Visuaalinen varmistus on useimmissa tapauksissa mahdollista. Niissä tapauksissa, jolloin implantaattia ei näy, ota steriili pumpulipuikko ja paina injektointikohtaa kevyesti, jotta implantaatti tulee näkyviin.
Potilaan on jatkettava laajakirjoisten antimikrobitippojen käyttöä silmän lasiaiseen annetun injektion jälkeen.
Vasta-aiheet
- Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
- Aktiivinen tai epäilty silmän tai silmänympäryksen infektio, kuten useimmat sarveiskalvon ja sidekalvon virustaudit, mukaan lukien aktiivinen epiteliaalinen herpes simplex ‑keratiitti (dendriittinen keratiitti), lehmärokko, vesirokko, mykobakteeri-infektiot ja sienitaudit.
- Pitkälle edennyt glaukooma, jota ei saada riittävästi hallintaan pelkällä lääkehoidolla.
- Mykiöttömät silmät ja repeytynyt linssin takakapseli.
- Etukammiotekomykiö (ACIOL), värikalvoon tai kovakalvon läpi kiinnitetty tekomykiö ja repeytynyt linssin takakapseli.
Varoitukset ja käyttöön liittyvät varotoimet
Silmän lasiaiseen annettavien injektioiden, myös OZURDEX-injektion, yhteydessä voi esiintyä endoftalmiittia, silmänsisäistä tulehdusta, kohonnutta silmänpainetta ja verkkokalvon irtoamista. Asianmukaisia aseptisia injektointitekniikoita on käytettävä aina. Lisäksi potilaita on seurattava injektion jälkeen, jotta mahdollisen infektion tai kohonneen silmänpaineen varhainen hoito on mahdollista. Seuranta voi sisältää näköhermon pään perfuusion tarkistamisen heti injektoinnin jälkeen, tonometrian 30 minuutin kuluessa injektoinnista ja biomikroskopian 2–7 päivää injektoinnin jälkeen.
Potilaita on kehotettava ilmoittamaan viipymättä kaikista endoftalmiittiin viittaavista oireista ja kaikista edellä mainituista tapahtumista (esim. silmäkipu, sumentunut näkö jne.) (ks. kohta Haittavaikutukset).
Kaikilla potilailla, joilla on linssin takakapselin repeämä, kuten potilaat, joilla on takalinssi (esim. kaihileikkauksen takia) ja/tai aukko värikalvosta lasiaisonteloon (esim. iridektomian takia) ja anamneesissa mahdollisesti vitrektomia, on olemassa vaara, että implantaatti kulkeutuu etukammioon. Implantaatin kulkeutuminen etukammioon voi johtaa sarveiskalvon turvotukseen. Jatkuva, vaikea sarveiskalvon turvotus voi edellyttää sarveiskalvonsiirtoa. Jos OZURDEXIN käyttö on vasta-aiheista (ks. kohta Vasta-aiheet), sitä ei saa käyttää. Muiden potilaiden hoidossa OZURDEXIA on käytettävä varoen ja vasta huolellisen riski-hyötysuhteen punnitsemisen jälkeen. Heitä on seurattava tarkasti, jotta laitteen siirtyminen voidaan havaita ja hoitaa varhaisessa vaiheessa.
Kortikosteroidien käyttö (myös OZURDEX-hoito) voi aiheuttaa kaihin (myös takakapselinalaisen kaihin), kohonnutta silmänpainetta, steroidien aiheuttaman glaukooman ja mahdollisesti sekundaarisia silmätulehduksia.
Kolme vuotta kestäneissä diabeettista makulaturvotusta koskevissa kliinisissä tutkimuksissa 59 %:lle potilaista, joilla oli faakkinen silmä ja jotka saivat OZURDEX-hoitoa, tehtiin kaihileikkaus tutkittavaan silmään (ks. kohta Haittavaikutukset).
Kaihin ilmaantuvuus näyttää olevan suurempi ensimmäisen injektion jälkeen potilailla, joilla on silmän takaosan ei-tarttuva uveiitti, verrattuna BRVO-/CRVO-potilaisiin. Kliinisissä BRVO-/CRVO-tutkimuksissa kaihia raportoitiin useammin potilailla, joilla oli faakkinen linssi ja jotka saivat toisen injektion (ks. kohta Haittavaikutukset). Näistä 368 potilaasta vain yksi tarvitsi kaihileikkauksen ensimmäisen hoidon aikana ja kolme potilasta 302:sta toisen hoidon aikana. Ei-tarttuvaa uveiittia koskevassa tutkimuksessa kaihileikkaus tehtiin yhden injektion jälkeen yhdelle 62 potilaasta, joilla oli faakkinen linssi.
Sidekalvon verenvuotoa näyttää esiintyvän enemmän potilailla, joilla on silmän takaosan ei-tarttuva uveiitti, verrattuna potilaisiin, joilla on BRVO/CRVO tai diabeettista makulaturvotusta. Tämä voi johtua silmän lasiaiseen kohdistuvasta injektointitoimenpiteestä tai samanaikaisesta paikallisten ja/tai systeemisten kortikosteroidien tai steroideihin kuulumattomien tulehduskipulääkkeiden käytöstä. Mitään hoitoa ei tarvita, sillä oireet häviävät spontaanisti.
Kuten silmän steroidihoidon ja silmän lasiaiseen annettavien injektioiden yhteydessä voidaan odottaa, silmänpaine voi kohota. Kohonnut silmänpaine on tavallisesti hoidettavissa silmänpainelääkityksellä (ks. kohta Haittavaikutukset). Suurimmalla osalla niistä potilaista, joiden silmänpaine kohosi lähtötilanteesta ≥10 mmHg, tämä tapahtui 45–60 päivää injektoinnin jälkeen. Siksi silmänpaineen säännöllinen seuranta on välttämätöntä, lähtötilanteen silmänpaineesta riippumatta, ja paineen kohoaminen on injektoinnin jälkeen hoidettava asianmukaisesti tarpeen mukaan. Silmänpaine kohoaa todennäköisemmin alle 45-vuotiailla potilailla, joilla on makulaturvotusta verkkokalvon laskimotukoksen tai ei-tarttuvana uveiittina ilmenevän silmän takaosan tulehduksen seurauksena.
Kortikosteroideja on käytettävä varoen potilailla, joilla on aiemmin ollut silmän herpes simplex -virusinfektio, eikä niitä saa käyttää aktiivisessa silmän herpes simplex ‑infektiossa.
Kumpaankin silmään samanaikaisesti annetun OZURDEX-injektion turvallisuutta ja tehoa ei ole tutkittu. Siksi antoa kumpaankin silmään samanaikaisesti ei suositella.
OZURDEX-implantaattia ei ole tutkittu potilailla, joilla on verkkokalvon laskimotukoksen seurauksena kehittynyt makulaturvotus ja merkittävä verkkokalvon iskemia. Siksi OZURDEX-hoitoa ei suositella.
Vaiheen 3 tutkimuksissa oli vain muutamia tyypin 1 diabetesta sairastavia potilaita. Näiden potilaiden vaste OZURDEX-hoitoon ei eronnut merkitsevästi tyypin 2 diabetesta sairastavien vasteesta.
Verkkokalvon laskimotukosta koskevassa tutkimuksessa 2 % OZURDEX-implantaatin saaneista potilaista käytti antikoagulanttilääkitystä. Näillä potilailla ei raportoitu haittatapahtumana verenvuotoa. Diabeettista makulaturvotusta koskevassa tutkimuksessa antikoagulanttilääkitystä käytti 8 % potilaista. Antikoagulanttilääkitystä käyttäneiden potilaiden keskuudessa verenvuotojen esiintyvyys oli samankaltainen sekä OZURDEX- että lumehoitoryhmässä (29 % vs. 32 %). Niiden potilaiden keskuudessa, jotka eivät saaneet antikoagulanttilääkitystä, 27 %:lla OZURDEX-hoitoa saaneista raportoitiin haittatapahtumana verenvuotoa verrattuna 20 %:iin potilaista lumehoitoryhmässä. Lasiaisverenvuotoa raportoitiin enemmän niillä OZURDEX-hoitoa saaneilla, jotka käyttivät antikoagulanttilääkitystä (11 %), kuin niillä, jotka eivät saaneet antikoagulanttilääkitystä (6 %).
Aggregaation estäjälääkkeitä, kuten klopidogreeliä, käytti jossakin vaiheessa kliinisten tutkimusten aikana enintään 56 % potilaista. Samanaikaisesti aggregaation estäjälääkkeitä käyttäneillä potilailla havaittiin hieman enemmän verenvuotoja niillä potilailla, jotka saivat OZURDEX-injektiohoitoa (enintään 29 %:lla), kuin lumehoitoryhmässä (enintään 23 %:lla) riippumatta käyttöaiheesta tai hoitokertojen määrästä. Yleisin raportoitu verenvuotoon liittyvä haittatapahtuma oli sidekalvon verenvuoto (enintään 24 %:lla).
OZURDEX-hoidossa on oltava varovainen, jos potilas käyttää antikoagulanttilääkitystä tai aggregaation estäjälääkitystä.
Näköhäiriöt
Kortikosteroidien systeemisen ja paikallisen käytön yhteydessä voi esiintyä näköhäiriöitä. Jos potilaalla on oireita, kuten näön hämärtymistä tai muita näköhäiriöitä, harkitse potilaan tutkimista kortikosteroidien systeemisen ja paikallisen käytön jälkeen raportoitujen mahdollisten syiden, kuten kaihin, glaukooman, tai harvinaisten sairauksien, esim. sentraalisen seroosin korioretinopatian, toteamiseksi.
Yhteisvaikutukset
Yhteisvaikutustutkimuksia ei ole tehty.
Systeeminen imeytyminen on minimaalista eikä yhteisvaikutuksia odoteta esiintyvän.
Raskaus ja imetys
Raskaus
Eläinkokeissa on esiintynyt teratogeenisiä vaikutuksia paikallisen silmään tapahtuneen annon jälkeen (ks. kohta Prekliiniset tiedot turvallisuudesta). Tiedot silmän lasiaiseen annetun deksametasonin käytöstä raskaana oleville naisille ovat riittämättömiä. Pitkäkestoinen systeeminen hoito glukokortikoideilla raskauden aikana suurentaa kohdunsisäisen kasvun viivästymisen ja vastasyntyneen lisämunuaisen vajaatoiminnan riskiä. Vaikka deksametasonin systeemisten altistustasojen odotetaan olevan hyvin matalia paikallisen, silmänsisäisen hoidon jälkeen, OZURDEX-implantaattia ei suositella käytettäväksi raskauden aikana, ellei mahdollinen hyöty oikeuta mahdollista sikiölle aiheutuvaa vaaraa.
Imetys
Deksametasoni erittyy ihmisen rintamaitoon. Vaikutuksia lapseen ei odoteta esiintyvän antoreitin ja siitä aiheutuvan systeemisen altistuksen perusteella. OZURDEX-hoitoa ei kuitenkaan suositella imetyksen aikana, ellei se ole välttämätöntä.
Hedelmällisyys
Hedelmällisyyteen liittyviä tietoja ei ole saatavilla.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
OZURDEX-hoidolla voi olla kohtalainen vaikutus ajokykyyn ja koneidenkäyttökykyyn. Potilailla voi esiintyä tilapäistä näön heikkenemistä OZURDEX-implantaatin silmän lasiaiseen asettamisinjektion jälkeen (ks. kohta Haittavaikutukset). Potilaat eivät saa ajaa tai käyttää koneita, ennen kuin näkö palautuu.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
OZURDEX-hoidon jälkeen yleisimmin raportoidut haittatapahtumat ovat samoja kuin usein silmien steroidihoidon tai silmän lasiaiseen annettavien injektioiden yhteydessä havaitut haittatapahtumat (kohonnut silmänpaine, kaihin muodostuminen ja vastaavasti sidekalvon tai lasiaisen verenvuoto).
Harvemmin raportoituja mutta vakavampia haittavaikutuksia ovat mm. endoftalmiitti, nekrotisoiva retiniitti, verkkokalvon irtauma ja verkkokalvon repeämä.
Päänsärkyä ja migreeniä lukuun ottamatta systeemisiä haittavaikutuksia ei havaittu OZURDEX-hoidon yhteydessä.
Taulukkomuotoinen luettelo haittavaikutuksista
Vaiheen 3 kliinisissä tutkimuksissa (DME, BRVO/CRVO ja uveiitti) ja spontaanisti raportoidut OZURDEX-hoitoon liittyviksi katsotut haittavaikutukset on lueteltu alla olevassa taulukossa MedDRA:n elinjärjestelmäluokituksen mukaan seuraavasti:
Hyvin yleiset (≥ 1/10), yleiset (≥ 1/100, < 1/10), melko harvinaiset (≥ 1/1 000, < 1/100), harvinaiset (≥ 1/10 000, < 1/1 000) ja hyvin harvinaiset (< 1/10 000). Haittavaikutukset on esitetty kussakin yleisyysryhmässä vakavuuden mukaan alenevassa järjestyksessä.
Taulukko 1 Haittavaikutukset
| Elinjärjestelmä | Yleisyys | Haittavaikutus |
| Hermosto | Yleinen | Päänsärky |
| Melko harvinainen | Migreeni | |
| Silmät | Hyvin yleinen | Kohonnut silmänpaine**, kaihi**, sidekalvon verenvuoto* |
| Yleinen | Korkea silmänpaine, kapselinalainen kaihi, lasiaisen verenvuoto**, heikentynyt näöntarkkuus*, näön huononeminen / näköhäiriöt, lasiaisen irtauma*, lasiaiskellujat*, lasiaisen samentumat*, blefariitti, silmäkipu*, fotopsia*, sidekalvon turvotus*, sidekalvon verekkyys* | |
| Melko harvinainen | Nekrotisoiva retiniitti, endoftalmiitti*, glaukooma, verkkokalvon irtauma*, verkkokalvon repeämä*, matala silmänpaine*, etukammion tulehdus*, etukammiosolut / etukammion valotie*, epänormaali tunne silmässä*, silmäluomen kutina, kovakalvon verekkyys* | |
| Yleisoireet ja antopaikassa todettavat haitat | Melko harvinainen | Implantaatin paikaltaan siirtyminen* ja mahdollinen sarveiskalvon turvotus (ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet), implantaatin asetuksen komplikaatio, josta on seurauksena silmän kudosvaurio* (implantaatin virheasettelu) |
* osoittaa haittavaikutukset, joiden katsotaan liittyvän lasiaiseen tapahtuvaan injektointitoimenpiteeseen (näiden haittavaikutusten yleisyys on suhteessa annettujen hoitojen määrään)
** 24 kuukautta kestäneessä, todellisilla potilailla tehdyssä havainnoivassa tutkimuksessa, jossa valmistetta arvioitiin verkkokalvon laskimotukoksen jälkeisen makulaturvotuksen ja silmän takaosan ei-tarttuvan uveiitin hoidossa, näitä haittavaikutuksia raportoitiin useammin potilailla, jotka saivat > 2 injektiota, kuin ≤ 2 injektiota saaneilla potilailla; kaihin muodostuminen (24,7 % vs. 17,7 %), kaihin eteneminen (32,0 % vs. 13,1 %), lasiaisen verenvuoto (6,0 % vs. 2,0 %) ja kohonnut silmänpaine (24,0 % vs. 16,6 %).
Valikoitujen haittavaikutusten kuvaus
Diabeettinen makulaturvotus
OZURDEX-hoidon kliinistä turvallisuutta potilailla, joilla on diabeettista makulaturvotusta, arvioitiin kahdessa vaiheen 3 satunnaistetussa, kaksoissokkoutetussa, lumelääkekontrolloidussa tutkimuksessa. Kummassakin tutkimuksessa kaikkiaan 347 potilasta satunnaistettiin saamaan OZURDEX-hoitoa ja 350 potilasta saamaan lumehoitoa.
Koko tutkimusjakson aikana yleisimmin raportoituja haittavaikutuksia tutkittavassa silmässä potilailla, jotka saivat OZURDEX-hoitoa, olivat kaihi ja kohonnut silmänpaine (ks. alla).
Kolme vuotta kestäneissä diabeettista makulaturvotusta koskevissa kliinisissä tutkimuksissa 87 %:lla potilaista, joilla oli faakkinen silmä ja jotka saivat OZURDEX-hoitoa, oli lähtötilanteessa jonkinasteista linssin samentumista tai varhainen kaihi. Kolmen tutkimusvuoden aikana kaikkien havaittujen kaihityyppien (kuorikaihi, diabeteskaihi, tumakaihi, kapselinalainen kaihi, mykiökaihi, kaihi) ilmaantuvuus oli 68 % OZURDEX-hoitoa saaneilla potilailla, joilla oli faakkinen silmä. 59 % potilaista, joilla oli faakkinen silmä, oli tarvinnut kaihileikkausta kolme vuotta kestäneen tutkimuksen viimeiseen käyntiin mennessä; suurimmalle osalle leikkaus tehtiin toisena tai kolmantena vuotena.
Tutkittavan silmän keskimääräinen silmänpaine lähtötilanteessa oli sama kummassakin hoitoryhmässä (15,3 mmHg). OZURDEX-ryhmässä silmänpaine kohosi lähtötasosta keskimäärin enintään 3,2 mmHg kaikkien käyntien aikana; keskimääräinen silmänpaine oli suurimmillaan injektion jälkeisellä 1,5 kuukauden käynnillä. Silmänpaine palautui noin lähtötasoa vastaavalle tasolle kuudessa kuukaudessa kunkin injektion jälkeen. OZURDEX-hoidon jälkeisen silmänpaineen kohoamisen esiintymistiheys tai voimakkuus ei suurentunut toistettaessa OZURDEX-injektio.
Tutkimuksen aikana 28 %:lla OZURDEX-hoitoa saaneista potilaista silmänpaine oli kohonnut lähtötasosta ≥ 10 mmHg vähintään yhdellä käynnillä. Lähtötilanteessa 3 % potilaista tarvitsi silmänpainelääkitystä. Kaiken kaikkiaan 42 % potilaista tarvitsi silmänpainelääkitystä tutkittavaan silmään jossain vaiheessa kolme vuotta kestäneen tutkimuksen aikana. Käyttö oli suurimmillaan (33 %) ensimmäisten 12 kuukauden aikana, ja se pysyi samankaltaisena vuodesta toiseen.
Yhteensä neljällä OZURDEX-hoitoa saaneella potilaalla (1 %) tutkittavan silmän kohonnutta silmänpainetta hoidettiin toimenpitein. Yksi OZURDEX-hoitoa saanut potilas tarvitsi silmäleikkausta (trabekulektomiaa) steroidien aiheuttaman kohonneen silmänpaineen hoitamiseksi; yhdelle potilaalle tehtiin trabekulektomia, koska etukammion fibriini esti kammionesteen ulosvirtauksen, mikä johti kohonneeseen silmänpaineeseen; yhdelle potilaalle tehtiin iridotomia ahdaskulmaglaukooman takia ja yhdelle potilaalle tehtiin iridektomia kaihileikkauksen takia. Implantaattia ei tarvinnut poistaa vitrektomialla yhdeltäkään potilaalta silmänpaineen hallitsemiseksi.
BRVO/CRVO
OZURDEX-valmisteen kliinistä turvallisuutta potilailla, joilla on makulaturvotusta verkkokalvon keski- tai haaralaskimotukoksen seurauksena, on arvioitu kahdessa vaiheen 3 satunnaistetussa, kaksoissokkoutetussa, lumelääkekontrolloidussa tutkimuksessa. Yhteensä 427 potilasta satunnaistettiin saamaan OZURDEX-hoitoa ja 426 lumelääkettä kahdessa vaiheen 3 tutkimuksessa. Yhteensä 401 potilasta (94 %), jotka oli satunnaistettu saamaan OZURDEX-hoitoa, oli tutkimuksessa mukana aloitusjakson loppuun (päivään 180 asti).
Yhteensä 47,3 %:lla potilaista esiintyi ainakin yksi haittavaikutus. OZURDEX-hoitoa saaneilla potilailla yleisimmin raportoituja haittavaikutuksia olivat kohonnut silmänpaine (24,0 %) ja sidekalvon verenvuoto (14,7 %).
Verkkokalvon laskimon haaratukosta (BRVO) sairastaneiden potilaiden haittavaikutusprofiili oli samankaltainen kuin potilailla, joilla oli verkkokalvon keskilaskimotukos (CRVO), mutta haittavaikutusten kokonaisilmaantuvuus oli CRVO-alaryhmän potilailla suurempi.
OZURDEX-implantaattiin liittyvä kohonnut silmänpaine oli korkeimmillaan päivänä 60 ja palasi lähtötasolle päivään 180 mennessä. Silmänpaineen kohoaminen ei joko vaatinut hoitoa tai se hoidettiin käyttämällä tilapäisesti paikallista silmänpainetta alentavaa lääkevalmistetta. Hoidon aloitusjakson aikana 0,7 % (3/421) OZURDEX-hoitoa saaneista potilaista tarvitsi kirurgisen tai lasertoimenpiteen tutkittavan silmän kohonneen silmänpaineen saamiseksi hallintaan verrattuna 0,2 %:iin (1/423) lumehoitoa saaneista.
Toisen OZURDEX-injektion jälkeen analysoitu 341 potilaan haittavaikutusprofiili oli samankaltainen kuin ensimmäisen injektion jälkeen. Yhteensä 54 %:lla potilaista esiintyi ainakin yksi haittavaikutus. Kohonneen silmänpaineen ilmaantuvuus (24,9 %) oli samankaltainen kuin ensimmäisen injektion jälkeen ja palasi samalla tavoin lähtötasolle avoimen vaiheen päivänä 180. Kaihia esiintyi yleisesti ottaen enemmän yhden vuoden jälkeen verrattuna ensimmäisiin kuuteen kuukauteen.
Uveiitti
OZURDEX-implantaatin kliinistä turvallisuutta potilailla, joilla on ei-tarttuvana uveiittina ilmenevä silmän takaosan tulehdus, on arvioitu yhdessä sokkoutetussa, satunnaistetussa monikeskustutkimuksessa.
Yhteensä 77 potilasta satunnaistettiin saamaan OZURDEX-injektio ja 76 potilaalle annettiin lumeinjektio. OZURDEX-hoitoa saamaan satunnaistetuista potilaista kaikkiaan 73 (95 %) suoritti 26-viikkoisen tutkimuksen loppuun.
Tutkimuksessa yleisimmin raportoidut haittavaikutukset OZURDEX-valmistetta saaneilla potilailla olivat sidekalvon verenvuoto (30,3 %), suurentunut silmänpaine (25,0 %) ja kaihi (11,8 %).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Yliannostustapauksessa silmänpainetta on seurattava ja hoidettava, mikäli hoitava lääkäri katsoo sen tarpeelliseksi.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: silmätautien lääkkeet, tulehduslääkkeet, ATC-koodi: S01BA01
Deksametasonin, vahvan kortikosteroidin, on osoitettu vaimentavan tulehdusta estämällä turvotusta, fibriinin saostumista, hiussuonten vuotoa ja tulehdusvasteen aiheuttamaa fagosyyttien migraatiota. Verisuoniston endoteelikasvutekijä (VEGF) on sytokiini, jota esiintyy suurentuneina pitoisuuksina makulaturvotuksen yhteydessä. Se on voimakas verisuoniston läpäisevyyden lisääjä. Kortikosteroidien on osoitettu estävän VEGF:n ilmentymistä. Kortikosteroidit estävät lisäksi prostaglandiinien vapautumista. Osa prostaglandiineista on tunnistettu kystoidimakulaturvotuksen välittäjäaineiksi.
Kliininen teho ja turvallisuus
Diabeettinen makulaturvotus
OZURDEX-valmisteen tehoa arvioitiin kahdessa kolme vuotta kestäneessä kaksoissokkoutetussa, satunnaistetussa, lumelääkekontrolloidussa, rinnakkaistutkimuksina toteutetussa monikeskustutkimuksessa, joiden tutkimusasetelmat olivat samanlaiset ja joissa oli yhteensä mukana 1 048 potilasta (206207‑010- ja 206207‑011-tutkimukset). Potilaat satunnaistettiin niin, että 351 heistä sai OZURDEX-hoitoa, 347 sai deksametasonia 350 µg ja 350 sai lumehoitoa.
Potilaat soveltuivat saamaan uusintahoitoa, kun heidän verkkokalvonsa keskikentän paksuus oli > 175 mikronia optisessa koherenssitomografiassa (OCT) tai kun tutkijat havaitsivat OCT:ssä viitteitä verkkokalvon sisäisistä kystista johtuvasta jäännösturvotuksesta tai verkkokalvon keskikentän tai sen ulkopuolisten alueiden paksuuntumisesta. Potilaat saivat enintään 7 hoitoa vähintään noin 6 kuukauden välein.
Varahoito sallittiin missä tahansa vaiheessa tutkijoiden harkinnan mukaan, mutta se johti potilaan poistamiseen tutkimuksesta.
OZURDEX-hoitoa saaneista potilaista 36 % keskeytti tutkimuksen mistä tahansa syystä verrattuna 57 %:iin lumehoitoa saaneista. Haittavaikutusten takia hoidon keskeyttäneiden osuus oli samankaltainen sekä hoito- että lumehoitoryhmissä (13 % vs. 11 %). Tehottomuuden takia keskeyttäneiden osuus oli pienempi OZURDEX-ryhmässä kuin lumehoitoryhmässä (7 % vs. 24 %).
Tutkimusten 206207-010 ja -011 ensisijaiset ja tärkeimmät toissijaiset päätetapahtumat on esitetty taulukossa 2. Kaihin muodostuminen haittasi näön paranemista DEX700-ryhmässä. Näkö parani uudelleen, kun kaihi poistettiin.
Taulukko 2. Teho tutkimuksissa 206207-010 ja 206207-011 (ITT-populaatio)
| Päätetapahtuma | Tutkimus 206207-010 | Tutkimus 206207-011 | Yhdistetyt tutkimukset 206207-010 ja 206207-011 | ||||||
| DEX 700 N = 163 | Lume N = 165 | DEX 700 N = 188 | Lume N = 185 | DEX 700 N = 351 | Lume N = 350 | ||||
| BCVA:n keskimääräinen muutos 3 vuoden aikana, AUC-arvo (kirjaimina) | 4,1 | 1,9 | 2,9 | 2,0 | 3,5 | 2,0 | |||
| P-arvo | 0,016 | 0,366 | 0,023 | ||||||
| BCVA:n ≥ 15 kirjaimen parannus lähtötasosta kolmantena vuonna / viimeisellä käynnillä (%) | 22,1 | 13,3 | 22,3 | 10,8 | 22,2 | 12,0 | |||
| P-arvo | 0,038 | 0,003 | < 0,001 | ||||||
| BCVA:n keskimääräinen muutos lähtötasosta kolmantena vuonna / viimeisellä käynnillä (kirjaimina) | 4,1 | 0,8 | 1,3 | –0,0 | 2,6 | 0,4 | |||
| P-arvo | 0,020 | 0,505 | 0,054 | ||||||
| OCT:ssä verkkokalvon keskikentän paksuuden keskimääräinen muutos 3 vuoden aikana, AUC-arvo (µm) | –101,1 | –37,8 | –120,7 | –45,8 | –111,6 | –41,9 | |||
| P-arvo | < 0,001 | < 0,001 | < 0,001 | ||||||
Pseudofakiapotilaiden yhdistetyn analyysin ensisijaiset ja tärkeimmät toissijaiset päätetapahtumat on esitetty taulukossa 3.
Taulukko 3. Teho pseudofakiapotilailla (yhdistetyt tutkimukset 206207-010 ja 206207-011)
| Päätetapahtuma | DEX 700 N = 86 | Lume N = 101 | P-arvo |
| BCVA:n keskimääräinen muutos 3 vuoden aikana, AUC-arvo (kirjaimina) | 6,5 | 1,7 | < 0,001 |
| BCVA:n ≥ 15 kirjaimen parannus lähtötasosta kolmantena vuonna / viimeisellä käynnillä (%) | 23,3 | 10,9 | 0,024 |
| BCVA:n keskimääräinen muutos lähtötasosta kolmantena vuonna / viimeisellä käynnillä | 6,1 | 1,1 | 0,004 |
| OCT:ssä verkkokalvon keskikentän paksuuden keskimääräinen muutos 3 vuoden aikana, AUC-arvo (µm) | –131,8 | –50,8 | < 0,001 |
Mitä tahansa aiempaa hoitoa saaneiden potilaiden yhdistetyn analyysin ensisijaiset ja tärkeimmät toissijaiset päätetapahtumat on esitetty taulukossa 4.
Taulukko 4. Teho mitä tahansa aiempaa hoitoa saaneilla potilailla (yhdistetyt tutkimukset 206207-010 ja 206207-011)
| Päätetapahtuma | DEX 700 N = 247 | Lume N = 261 | P-arvo |
| BCVA:n keskimääräinen muutos 3 vuoden aikana, AUC-arvo (kirjaimina) | 3,2 | 1,5 | 0,024 |
| BCVA:n ≥ 15 kirjaimen parannus lähtötasosta kolmantena vuonna / viimeisellä käynnillä (%) | 21,5 | 11,1 | 0,002 |
| BCVA:n keskimääräinen muutos lähtötasosta kolmantena vuonna / viimeisellä käynnillä | 2,7 | 0,1 | 0,055 |
| OCT:ssä verkkokalvon keskikentän paksuuden keskimääräinen muutos 3 vuoden aikana, AUC-arvo (µm) | –126,1 | –39,0 | < 0,001 |
BRVO/CRVO
OZURDEX-valmisteen tehoa arvioitiin kahdessa kaksoissokkoutetussa, satunnaistetussa, lumelääkekontrolloidussa rinnakkaistutkimuksina toteutetussa monikeskustutkimuksessa, joiden tutkimusasetelmat olivat samanlaiset ja joissa oli yhteensä mukana 1 267 potilasta. Potilaat satunnaistettiin saamaan deksametasonihoitoa 350 µg:n tai 700 µg:n implantaatteina tai lumehoitoa (tutkimukset 206207-008 ja 206207-009). Potilaat satunnaistettiin niin, että 427 heistä sai OZURDEX-hoitoa, 414 sai deksametasonia 350 µg ja 426 sai lumehoitoa.
Yhdistettyjen analyysitulosten perusteella OZURDEX-implantaattihoitoon vasteen saaneiden potilaiden määrä oli tilastollisesti merkitsevästi suurempi. Tämä määritettiin potilaina, joiden näön tarkkuus parani ≥ 15 kirjainta lähtötasosta parhaalla lasikorjatulla näöntarkkuudella (Best Corrected Visual Acuity, BCVA) mitattuna 90 päivää yhden implantaatin injektoinnin jälkeen verrattuna lumehoitoon (p < 0,001).
Niiden potilaiden osuus, jotka saavuttivat ensisijaisen tehon mittarin, näöntarkkuuden paranemisen ≥ 15 kirjainta lähtötasosta BCVA-testissä yhden implantaatin injektoinnin jälkeen, on esitetty taulukossa 5. Hoitovaikutus havaittiin ensimmäisenä seuranta-ajankohtana, päivänä 30. Suurin hoitovaikutus havaittiin päivänä 60, ja ero hoitoon vasteen saaneiden potilaiden esiintyvyydessä oli tilastollisesti merkitsevä OZURDEX‑valmisteen eduksi verrattuna lumehoitoon kaikkina seuranta-ajankohtina päivään 90 saakka injektoinnin jälkeen. Lukumääräisesti vielä suurempi osa OZURDEX-hoitoa saaneista saavutti jatkuvasti näöntarkkuuden paranemisen ≥ 15 kirjainta lähtötasosta BCVA-testissä verrattuna lumehoidettuihin päivänä 180.
Taulukko 5. Niiden potilaiden osuus, joiden näöntarkkuus parani ≥ 15 kirjainta lähtötasosta tutkittavan silmän parhaan lasikorjatun näöntarkkuuden testissä (yhdistetty analyysi, ITT-populaatio)
| OZURDEX | Lume | |
| Käynti | N = 427 | N = 426 |
| Päivä 30 | 21,3 % a | 7,5 % |
| Päivä 60 | 29,3 % a | 11,3 % |
| Päivä 90 | 21,8 % a | 13,1 % |
| Päivä 180 | 21,5 % | 17,6 % |
a Osuus merkittävästi suurempi OZURDEX-hoidossa verrattuna lumehoitoon (p < 0,001)
Keskimääräinen muutos lähtötason BCVA-testistä oli kaikkina seuranta-ajankohtina huomattavasti suurempi OZURDEX-ryhmässä kuin lumeryhmässä.
Kummassakin vaiheen 3 tutkimuksessa ja yhdistetyssä analyysissä aika, jossa saavutettiin ≥ 15 kirjaimen (kolmen rivin) paraneminen BCVA-testissä, kumulatiiviset vastekäyrät olivat merkittävästi erilaisia OZURDEX-ryhmässä verrattuna lumeryhmään (p < 0,001), sillä OZURDEX-hoitoa saaneet potilaat saavuttivat kolmen rivin paranemisen BCVA-testissä aiemmin kuin lumehoidetut potilaat.
OZURDEX oli lukumääräisesti lumelääkettä parempi näönmenetyksen estämisessä, minkä osoittaa niiden potilaiden pienempi osuus OZURDEX-ryhmässä, joiden näkö heikkeni ≥ 15 kirjainta koko 6 kuukauden arviointijakson aikana.
Kummassakin vaiheen 3 tutkimuksessa ja yhdistetyssä analyysissä verkkokalvo oli OZURDEX-ryhmässä keskimäärin merkittävästi ohuempi ja keskimääräinen oheneminen lähtötasosta oli merkittävästi suurempaa (‑207,9 mikronia) verrattuna lumeryhmään (‑95,0 mikronia) päivänä 90 (p < 0,001, yhdistetyt tiedot). BCVA-testillä arvioitu hoitovaikutus päivänä 90 tuki siten tätä anatomista löydöstä. Verkkokalvon keskimääräinen oheneminen (–119,3 mikronia) verrattuna lumeryhmään päivään 180 mennessä ei ollut merkittävää.
Potilailla, joiden BCVA-pisteet olivat < 84 TAI joiden verkkokalvon paksuus oli > 250 mikronia optisessa koherenssitomografiassa (OCT) ja joilla hoito ei tutkijan mielestä olisi aiheuttanut vaaraa, soveltuivat saamaan OZURDEX-hoitoa avoimen vaiheen jatkotutkimuksessa. Avoimessa vaiheessa hoidetuista potilaista 98 % sai OZURDEX-injektion 5–7 kuukautta alkuhoidon jälkeen.
Alkuhoidossa puolestaan huippuvaste havaittiin avoimen vaiheen päivänä 60. Kumulatiiviset vastemäärät olivat suurempia koko avoimen vaiheen ajan niillä potilailla, jotka saivat kaksi peräkkäistä OZURDEX-injektiota, verrattuna niihin potilaisiin, jotka eivät olleet saaneet OZURDEX-injektiota alkuvaiheessa.
Vasteen saaneiden potilaiden osuus oli jokaisena ajankohtana aina suurempi toisen hoitokerran jälkeen verrattuna ensimmäiseen hoitokertaan. Hoidon viivyttäminen kuusi kuukautta taas tuotti pienemmän määrän hoitoon vasteen saaneita potilaita kaikkina avoimen vaiheen ajankohtina verrattuna niihin potilaisiin, jotka saivat toisen OZURDEX-injektion.
Uveiitti
OZURDEX-implantaatin kliinistä tehoa uveiittia sairastavien potilaiden silmän takaosan ei-tarttuvan tulehduksen hoidossa on arvioitu yhdessä sokkoutetussa, satunnaistetussa monikeskustutkimuksessa.
Yhteensä 229 potilasta satunnaistettiin saamaan joko deksametasonihoitoa 350 µg:n tai 700 µg:n implantaatteina tai lumehoitoa. Näistä yhteensä 77 potilasta satunnaistettiin OZURDEX-ryhmään, 76 potilasta 350 µg:n deksametasoniryhmään ja 76 potilasta lumeinjektioryhmään. Yhteensä 95 % potilaista suoritti 26-viikkoisen tutkimuksen loppuun.
Niiden potilaiden osuus, joiden tutkittavan silmän lasiaissamentumapistemäärä oli 0 viikolla 8 (ensisijainen päätetapahtuma), oli neljä kertaa suurempi OZURDEX-ryhmässä (46,8 %) kuin lumeryhmässä (11,8 %), p < 0,001. Tilastollinen paremmuus säilyi viikkoon 26 asti (p ≤ 0,014) (ks. taulukko 6).
Kumulatiiviset hoitovastekäyrät (aika lasiaissamentumapistemäärään 0) olivat merkitsevästi erilaisia OZURDEX-ryhmässä ja lumeryhmässä (p < 0,001), ja deksametasonia saaneiden potilaiden ryhmässä havaittiin parempi hoitovaste ja hoitovasteen aikaisempi alkaminen.
Lasiaissamentuman vähenemiseen liittyi parantunut näöntarkkuus. Niiden potilaiden osuus, joiden tutkittavan silmän näöntarkkuus parani vähintään 15 kirjainta lähtötason BCVA-arvosta viikolla 8, oli yli kuusi kertaa suurempi OZURDEX-ryhmässä (42,9 %) kuin lumeryhmässä (6,6 %), p < 0,001. Tilastollinen paremmuus saavutettiin viikolla 3, ja se säilyi viikkoon 26 asti (p < 0,001) (ks. taulukko 6).
Niiden potilaiden osuus, jotka tarvitsivat varalääkitystä lähtötason ja viikon 8 välisenä aikana, oli lähes kolme kertaa pienempi OZURDEX-ryhmässä (7,8 %) kuin lumeryhmässä (22,4 %), p = 0,012.
Taulukko 6. Niiden potilaiden osuus, joiden lasiaissamentumapistemäärä oli 0 ja joilla havaittiin ≥ 15 kirjaimen parantuminen lähtötason parhaasta lasikorjatusta näöntarkkuudesta tutkittavassa silmässä (ITT-populaatio)
| Käynti | Lasiaissamentumapistemäärä 0 | ≥ 15 kirjaimen BCVA-parannus lähtötasosta | ||
Deksametasoni 700 N = 77 | Lume N = 76 | Deksametasoni 700 N = 77 | Lume N = 76 | |
| Viikko 3 | 23,4 % | 11,8 % | 32,5 %a | 3,9 % |
| Viikko 6 | 42,9 %a | 9,2 % | 41,6 %a | 7,9 % |
| Viikko 8 | 46,8 %a | 11,8 % | 42,9 %a | 6,6 % |
| Viikko 12 | 45,5 %a | 13,2 % | 41,6 %a | 13,2 % |
| Viikko 16 | 40,3 %b | 21,1 % | 39,0 %a | 13,2 % |
| Viikko 20 | 39,0 %c | 19,7 % | 40,3 %a | 13,2 % |
| Viikko 26 | 31,2 %d | 14,5 % | 37,7 %a | 13,2 % |
a p < 0,001; b p = 0,010; c p = 0,009; d p = 0,014
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset OZURDEX-valmisteen käytöstä kaikkien pediatristen potilasryhmien verkkokalvon verisuonitukoksen ja myös diabeettisen makulaturvotuksen hoidossa (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Pitoisuudet plasmassa mitattiin 21 potilaan alaryhmältä kahdessa verkkokalvon laskimotukosta koskevassa 6 kuukauden tehotutkimuksessa ennen antoa sekä päivinä 7, 30, 60 ja 90 yhden silmän lasiaiseen asetettavan 350 µg tai 700 µg deksametasonia sisältävän implantaatin injektion jälkeen. 350 µg:n annosryhmässä 95 % ja 700 µg:n annosryhmässä 86 % plasman deksametasonipitoisuusarvoista oli määritysrajan (0,05 ng/ml)alapuolella. Suurin pitoisuusarvo plasmassa 0,094 ng/ml todettiin tutkimushenkilöllä, joka kuului 700 µg:n ryhmään. Plasman deksametasonipitoisuus ei vaikuttanut liittyvän potilaiden ikään, painoon tai sukupuoleen.
Kahdessa diabeettista makulaturvotusta koskevassa avaintutkimuksessa pitoisuudet plasmassa mitattiin potilaiden alaryhmältä ennen antoa sekä päivinä 1, 7 ja 21 sekä kuukausina 1,5 ja 3 silmän lasiaiseen asetettavan 350 µg tai 700 µg deksametasonia sisältävän implantaatin injektion jälkeen. 350 µg:n annosryhmässä 100 % ja 700 µg:n annosryhmässä 90 % plasman deksametasonipitoisuusarvoista oli määritysrajan (0,05 ng/ml) alapuolella. Suurin pitoisuusarvo plasmassa 0,102 ng/ml todettiin tutkimushenkilöllä, joka kuului 700 µg:n ryhmään. Plasman deksametasonipitoisuus ei vaikuttanut liittyvän potilaiden ikään, painoon tai sukupuoleen.
Kuuden kuukauden pituisessa apinoilla tehdyssä tutkimuksessa yhden silmän lasiaiseen annetun OZURDEX-injektion jälkeen deksametasonin huippupitoisuus(Cmax) silmän lasiaisnesteessä oli 100 ng/ml päivänä 42 injektoinnin jälkeen ja 5,57 ng/ml päivänä 91. Deksametasoni pysyi havaittavana lasiaisnesteessä kuusi kuukautta injektoinnin jälkeen. Deksametasonin pitoisuuden suuruusjärjestys oli verkkokalvo > iiris > sädekehä > lasiaisneste > kammioneste > plasma.
In vitro ‑metaboliatutkimuksessa, jossa [14C]-deksametasoni inkuboitui ihmisen sarveiskalvossa, iiriksessä ja sädekehässä, suonikalvossa, verkkokalvossa, lasiaisnesteessä ja kovakalvon kudoksissa 18 tuntia, metaboliitteja ei havaittu. Tämä on yhdenmukaista kaniineilla ja apinoilla tehtyjen silmän metaboliatutkimusten tulosten kanssa.
Deksametasoni metaboloituu lopulta lipidi- ja vesiliukoisiin metaboliitteihin, jotka voivat erittyä sappinesteeseen ja virtsaan.
OZURDEX-matriisi hajoaa hitaasti maitohapoksi ja glykolihapoksi yksinkertaisella hydrolyysillä ja hajoaa edelleen vielä hiilidioksidiksi ja vedeksi.
Prekliiniset tiedot turvallisuudesta
Ei-kliinisissä tutkimuksissa on todettu vaikutuksia vain silloin, kun on käytetty annoksia, jotka ylittävät suurimman ihmisille käytettävän annostuksen niin huomattavasti, että asialla on kliinisen käytön kannalta vain vähäinen merkitys.
OZURDEX-valmisteesta ei ole saatavilla mutageenisuus-, karsinogeenisuus-, lisääntymis- tai kehitystoksisuustietoja. Deksametasonin on osoitettu olevan teratogeeninen hiirillä ja kaniineilla paikallisen oftalmisen käytön jälkeen.
Kaniineilla terveessä/hoitamattomassa silmässä on havaittu deksametasonialtistusta kontralateraalisen diffuusion kautta sen jälkeen, kun implantaatti on asetettu silmän takaosaan.
Farmaseuttiset tiedot
Apuaineet
Esteriryhmään päättyvä poly-D, L-laktidikoglykolidi (50:50).
Karboksyyliryhmään päättyvä poly-D, L-laktidikoglykolidi (50:50).
Hypromelloosi.
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
OZURDEX implantaatti silmän lasiaiseen, asetin
700 mikrog (L:ei) 1 kpl (1363,36 €)
PF-selosteen tieto
Jokainen pakkaus sisältää:
Yksi pitkäkestoisesti lääkeainetta vapauttava steriili implantoitava sauvanmuotoinen implantaatti, joka sisältää 700 mikrogrammaa deksametasonia, kertakäyttöisessä asettimessa olevassa neulassa (ruostumatonta terästä).
Asettimessa on mäntä (ruostumatonta terästä) neulassa, jossa implantaattia pitää paikoillaan hypromelloosinen pidätyssysteemi. Mäntää ohjaa asettimen rungon sivussa oleva vipu. Neulaa suojaa korkki ja vipua turvakieleke.
Implantaatin sisältävä asetin on pakattu sinetöityyn foliopussiin, jossa on kuivausainetta. Pussi on pakattu kannelliseen lämpömuovattuun alustaan, joka on pakattu pahvipakkaukseen.
Valmisteen kuvaus:
Kertakäyttöinen injektiolaite, jossa on näkymätön, sauvanmuotoinen implantaatti. Implantaatin halkaisija on noin 0,46 mm ja pituus 6 mm.
Käyttö- ja käsittelyohjeet
OZURDEX on vain yhtä käyttökertaa varten.
Yhtä asetinta voidaan käyttää vain yhden silmän hoitoon.
Jos asettimen sisältävän foliopussin sinetti on vaurioitunut, asetinta ei saa käyttää. Kun foliopussi on avattu, asetin on käytettävä välittömästi.
OZURDEX-hoidon antaminen
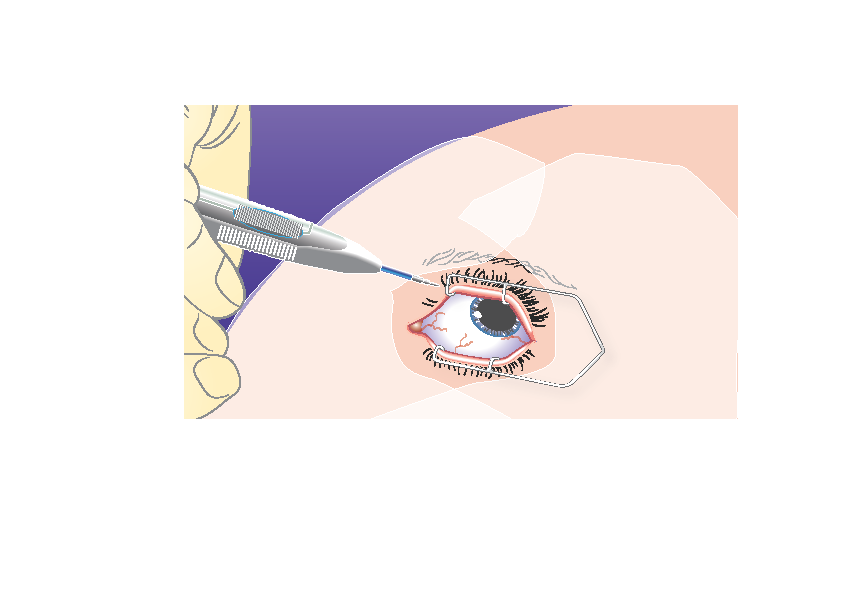
1) | Pidä asetinta pitkittäissuunnassa sarveiskalvon reunan (limbuksen) suuntaisesti. |
|
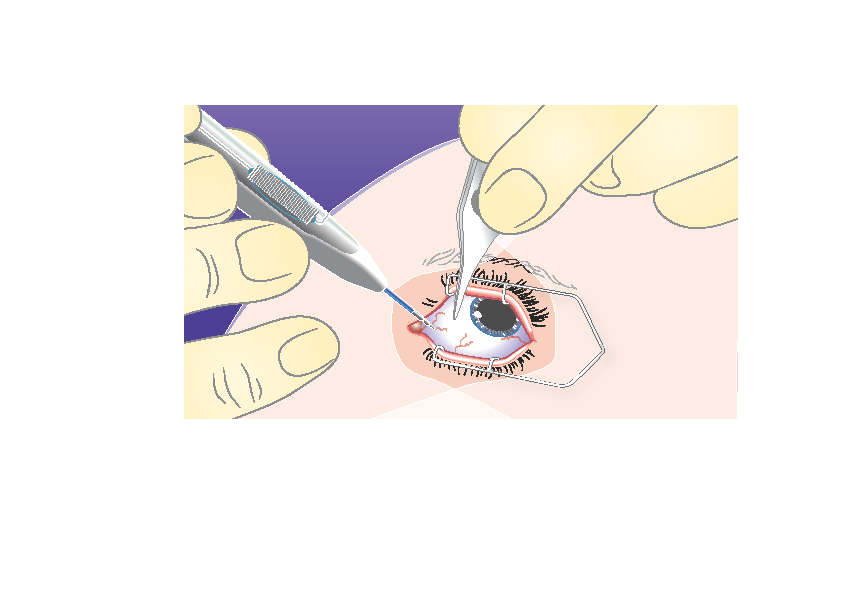
2) | Vie asetin kovakalvolle vinosti, neulan viiste ylöspäin ja poispäin kovakalvosta. Pidä neula limbuksen suuntaisena ja työnnä neulaa noin 1 mm kovakalvon sisään. |
|
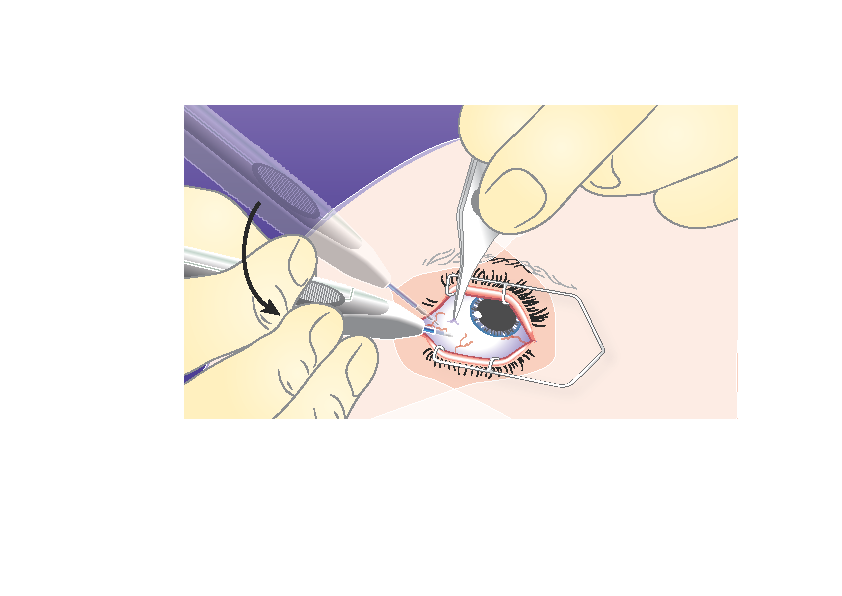
3) | Suuntaa neula uudelleen kohti silmän keskikohtaa lasiaisonteloon. Näin kovakalvolle syntyy viisto jälki. Työnnä neulaa, kunnes se on lasiaisontelossa. Älä työnnä neulaa syvemmälle, kun asettimen holkki koskettaa sidekalvoa. |
|
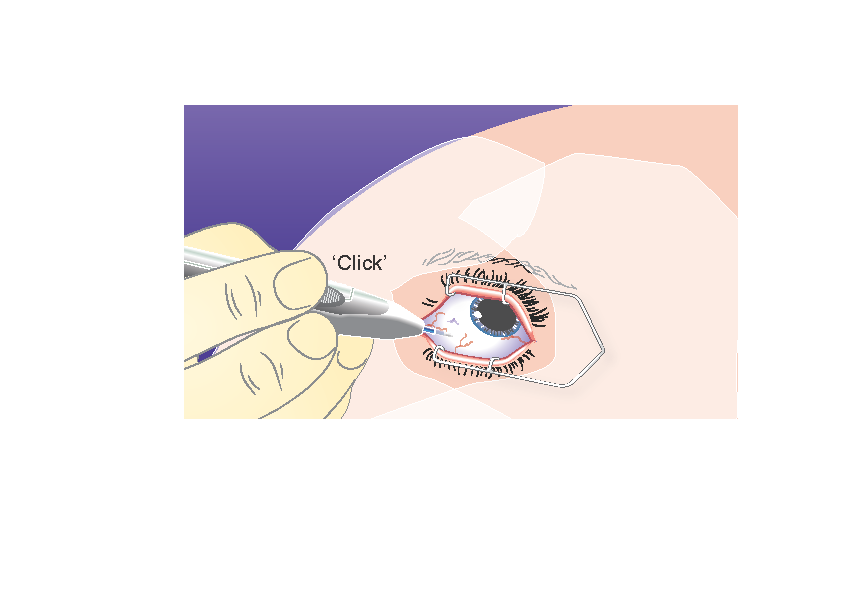
4) | Paina laukaisinpainiketta hitaasti, kunnes kuulet ja/tai tunnet naksahduksen. Varmista ennen asettimen vetämistä pois silmästä, että laukaisinpainike on painettu kokonaan sisään ja että se on lukkiutunut samaan tasoon asettimen pinnan kanssa. |
|
5) | Vedä asetin pois samaan suuntaan, josta työnsit sen lasiaiseen. |
|
6) | Hävitä asetin turvallisesti heti hoidon jälkeen. OZURDEX-asetin on kertakäyttöinen. |
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
OZURDEX implantaatti silmän lasiaiseen, asetin
700 mikrog 1 kpl
- Ei korvausta.
ATC-koodi
S01BA01
Valmisteyhteenvedon muuttamispäivämäärä
18.09.2025
Yhteystiedot
 ABBVIE OY
ABBVIE OY Veturitie 11 T 132
00520 Helsinki
010 2411 200
www.abbvie.fi