XERMELO tabletti, kalvopäällysteinen 250 mg
Vaikuttavat aineet ja niiden määrät
Yksi kalvopäällysteinen tabletti sisältää telotristaattietipraattia määrän, joka vastaa 250 mg:aa telotristaattietyyliä.
Apuaine, jonka vaikutus tunnetaan
Yksi tabletti sisältää 168 mg laktoosia.
Täydellinen apuaineluettelo, katso kohta Apuaineet.
Lääkemuoto
Tabletti, kalvopäällysteinen.
Kliiniset tiedot
Käyttöaiheet
Xermelo on tarkoitettu aikuisille karsinoidioireyhtymään liittyvän ripulin hoitoon yhdessä somatostatiinianalogihoidon kanssa, kun oireet eivät ole riittävästi hallinnassa somatostatiinianalogihoidolla.
Annostus ja antotapa
Annostus
Suositusannos on 250 mg kolme kertaa vuorokaudessa.
Käytettävissä olevat tiedot viittaavat siihen, että kliininen vaste saavutetaan yleensä 12 hoitoviikon aikana. Jos vastetta ei saavuteta tänä aikana, suositellaan arvioimaan uudelleen hoidon jatkamisen mahdolliset hyödyt.
Yksilöiden välisen vaihtelun on havaittu olevan suurta, joten kumuloitumista jossakin karsinoidioireyhtymää sairastavien potilaiden alaryhmässä ei voida sulkea pois. Suurten annosten käyttöä ei siksi suositella (ks. kohta Farmakokinetiikka).
Annoksen unohtuminen
Jos annos jää väliin, potilaan on otettava seuraava annos tavanomaiseen aikaan. Potilas ei saa ottaa kaksinkertaista annosta korvatakseen unohtuneen annoksen.
Erityiset potilasryhmät
Iäkkäät
Iäkkäille potilaille ei ole erityisiä annossuosituksia (ks. kohta Farmakokinetiikka).
Munuaisten vajaatoiminta
Lievää, keskivaikeaa tai vaikeaa munuaisten vajaatoimintaa, joka ei edellytä dialyysihoitoa, sairastavien potilaiden annostusta ei tarvitse muuttaa (ks. kohta Farmakokinetiikka). Varotoimena suositellaan, että vaikeaa munuaisten vajaatoimintaa sairastavia potilaita seurataan heikentyneen sietokyvyn merkkien varalta.
Xermelo-valmisteen käyttöä ei suositella, jos potilaalla on dialyysihoitoa edellyttävä loppuvaiheen munuaissairaus (eGFR < 15 ml/min, edellyttää dialyysihoitoa), koska Xermelo-valmisteen tehoa ja turvallisuutta näiden potilaiden hoidossa ei ole osoitettu.
Maksan vajaatoiminta
Lievää maksan vajaatoimintaa (Child–Pugh-luokka A) sairastavien potilaiden annosta voi olla tarpeen pienentää 250 mg:aan kahdesti päivässä siedettävyyden mukaan. Keskivaikeaa maksan vajaatoimintaa (Child–Pugh-luokka B) sairastavien potilaiden annosta voi olla tarpeen pienentää 250 mg:aan kerran päivässä siedettävyyden mukaan. Telotristaatin käyttöä ei suositella vaikeaa maksan vajaatoimintaa (Child–Pugh-luokka C) sairastaville potilaille (ks. kohta Farmakokinetiikka).
Pediatriset potilaat
Ei ole asianmukaista käyttää telotristaattia pediatristen potilaiden karsinoidioireyhtymän hoitoon.
Antotapa
Suun kautta
Xermelo pitää ottaa ruoan kanssa (ks. kohdat Farmakodynamiikka ja Farmakokinetiikka).
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Kohonneet maksaentsyymiarvot
Kliinisissä tutkimuksissa havaittiin kohonneita maksaentsyymiarvoja (ks. kohta Haittavaikutukset). Maksaentsyymien laboratorioseurantaa sekä ennen telotristaattihoitoa että hoidon aikana suositellaan kliinisen tarpeen mukaan. Maksan vajaatoimintaa sairastavien potilaiden jatkuvaa seurantaa suositellaan haittavaikutusten ja maksan toiminnan heikkenemisen havaitsemiseksi.
Maksan toimintahäiriöön viittaavien oireiden ilmetessä on tutkittava maksaentsyymit, ja telotristaattihoito on keskeytettävä, jos maksavauriota epäillään. Jos maksavauriolle ei löydy muuta syytä, telotristaattihoitoa ei saa aloittaa uudestaan.
Ummetus
Telotristaatti vähentää ulostamiskertojen tiheyttä. Suurta annosta (500 mg) käyttäneillä potilailla on ilmoitettu ummetusta. Potilaita pitää tarkkailla ummetuksen oireiden ja löydösten havaitsemiseksi. Ummetuksen ilmetessä telotristaatin ja muiden samanaikaisten suolen motiliteettiin vaikuttavien lääkkeiden käyttöä on arvioitava uudelleen.
Masennushäiriöt
Kliinisissä tutkimuksissa ja markkinoille tulon jälkeen on joillakin telotristaattia saaneilla potilailla ilmoitettu masennusta, masentuneisuutta ja mielenkiinnon vähenemistä (ks. kohta Haittavaikutukset). Potilaita on neuvottava ilmoittamaan lääkärille kaikista masennusoireista, masentuneisuudesta ja mielenkiinnon vähenemisestä.
Apuaineet
Laktoosi
Xermelo sisältää laktoosia. Potilaiden, joilla on harvinainen perinnöllinen galaktoosi-intoleranssi, täydellinen laktaasinpuutos tai glukoosi-galaktoosi-imeytymishäiriö, ei pidä käyttää tätä lääkettä.
Natrium
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per tabletti eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Muiden lääkevalmisteiden vaikutus Xermelo-valmisteeseen
Lyhytvaikutteinen oktreotidi
Lyhytvaikutteisen oktreotidin ja Xermelo-valmisteen samanaikainen anto vähensi merkitsevästi systeemistä altistusta telotristaattietyylille ja aktiiviselle metaboliitille telotristaatille (ks. kohta Farmakokinetiikka). Lyhytvaikutteinen oktreotidi pitää ottaa vähintään 30 minuuttia Xermelo-valmisteen oton jälkeen, jos lyhytaikaisen oktreotidin käyttö samanaikaisesti Xermelo-hoidon kanssa on tarpeen.
Karboksyyliesteraasi 2:n (CES2:n) estäjät
Loperamidi esti telotristaattietyylin metaboliaa karboksyyliesteraasi 2 -välitteisesti, ja eston IC50 oli 5,2 mikroM (ks. kohta Farmakokinetiikka). Vaiheen 3 kliinisissä lääketutkimuksissa telotristaattia annettiin yleisesti loperamidin kanssa, eikä turvallisuutta koskevista huolenaiheista ollut viitteitä
Xermelo-valmisteen vaikutus muihin lääkevalmisteisiin
CYP2B6:n substraatit
Telotristaatti indusoi CYP2B6:ta in vitro (ks. kohta Farmakokinetiikka). Xermelo-valmisteen samanaikainen käyttö saattaa vähentää systeemistä altistusta sellaisille lääkeaineille, jotka ovat CYP2B6:n substraatteja (esim. valproiinihapolle, bupropionille, sertraliinille), ja heikentää siten niiden tehoa. Hoidon riittämätöntä tehoa suositellaan seuraamaan.
CYP3A4:n substraatit
Xermelo-valmisteen samanaikainen käyttö saattaa vähentää systeemistä altistusta sellaisille lääkeaineille, jotka ovat CYP3A4:n substraatteja (esim. midatsolaamille, everolimuusille, sunitinibille, simvastatiinille, etinyyliestradiolille, amlodipiinille, siklosporiinille), ja heikentää siten niiden tehoa (ks. kohta Farmakokinetiikka). Hoidon riittämätöntä tehoa suositellaan seuraamaan.
Karboksyyliesteraasi 2:n (CES2:n) substraatit
Xermelo-valmisteen samanaikainen käyttö saattaa muuttaa altistusta sellaisille lääkeaineille, jotka ovat CES2:n substraatteja (esim. prasugreelille, irinotekaanille, kapesitabiinille ja flutamidille) (ks. kohta Farmakokinetiikka). Jos samanaikaista käyttöä ei voida välttää, on potilasta seurattava hoidon riittämättömän tehon ja haittavaikutusten varalta.
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi
Naisia, jotka voivat tulla raskaaksi, on kehotettava käyttämään asianmukaista ehkäisyä telotristaattihoidon aikana.
Raskaus
Ei ole olemassa tietoja telotristaattietyylin käytöstä raskaana oleville naisille. Eläinkokeissa on havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta). Xermelo-valmisteen käyttöä ei suositella raskauden aikana eikä sellaisten naisten hoitoon, jotka voivat tulla raskaaksi ja jotka eivät käytä ehkäisyä.
Imetys
Ei tiedetä, erittyykö telotristaattietyyli ja sen metaboliitti ihmisen rintamaitoon. Vastasyntyneeseen/imeväiseen kohdistuvia riskejä ei voida poissulkea. Xermelo-valmistetta ei pidä käyttää rintaruokinnan aikana.
Hedelmällisyys
Telotristaatin mahdollista vaikutusta ihmisen hedelmällisyyteen ei ole tutkittu. Eläinkokeissa ei havaittu vaikutuksia hedelmällisyyteen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Xermelo-valmisteella on vähäinen vaikutus ajokykyyn ja koneidenkäyttökykyyn. Telotristaatin annon jälkeen voi ilmetä väsymystä, jolloin potilaalle on neuvottava, että hänen ei pidä ajaa autoa eikä käyttää koneita, ennen kuin oireet ovat lakanneet (ks. kohta Haittavaikutukset).
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Telotristaattihoitoa saaneilla potilailla yleisimmin raportoituja haittavaikutuksia olivat vatsakipu (26 %), gammaglutamyylitransferaasipitoisuuden suureneminen (11 %) ja uupumus (10 %). Haittavaikutukset olivat yleensä lieviä tai keskivaikeita. Yleisimmin raportoitu telotristaattihoidon keskeyttämiseen johtanut haittavaikutus oli vatsakipu, jota ilmeni 7,1 %:lla potilaista (5/70).
Haittavaikutustaulukko
Taulukossa 1 on lueteltu haittavaikutukset, joita on raportoitu yhdistetyssä turvallisuustietoja koskevassa tietoaineistossa 70:stä karsinoidioireyhtymää sairastavasta potilaasta, jotka saivat lumekontrolloiduissa kliinisissä tutkimuksissa telotristaattietyyliä 250 mg kolme kertaa vuorokaudessa yhdessä somatostatiinianalogihoidon kanssa. Haittavaikutukset on lueteltu MedDRA-elinjärjestelmän ja yleisyyden mukaan seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000) ja tuntematon (koska saatavissa oleva tieto ei riitä arviointiin). Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Taulukko 1 – Xermelo-hoitoa saaneilla potilailla ilmoitetut haittavaikutukset
Elinjärjestelmäluokka | Hyvin yleinen | Yleinen | Melko harvinainen |
Aineenvaihdunta ja ravitsemus | Heikentynyt ruokahalu | ||
| Psyykkiset häiriöt | Masennus, masentuneisuus | ||
Hermosto | Päänsärky | ||
Ruoansulatuselimistö | Vatsakipua, | Vatsan pingottuneisuus | Fekaloomac, suolen tukkeutuminen |
Maksa ja sappi | Suurentunut gammaglutamyylitransferaasi-pitoisuusb | Suurentunut alaniiniaminotransferaasipitoisuus (ALAT) | |
Yleisoireet ja antopaikassa todettavat haitat | Uupumus | Perifeerinen turvotus |
a Vatsakipu (mukaan lukien ylä- ja alavatsakipu)
b Suurentunut gammaglutamyylitransferaasipitoisuus (sisältää Preferred Terms ‑termit suurentunut gammaglutamyylitransferaasipitoisuus, gammaglutamyylitransferaasipitoisuus ja maksan toimintakokeiden tulosten poikkeavuudet / suurentuneet maksaentsyyymiarvot, jolloin gammaglutamyylitransferaasipitoisuus oli suurentunut).
c Fekaloomaa on havaittu vain kliinisessä tutkimuksessa annoksella 500 mg kolme kertaa päivässä (kaksi kertaa suositeltu annos).
Valikoitujen haittavaikutusten kuvaus
Kohonneet maksaentsyymiarvot
Telotristaattihoitoa saavilla potilailla on ilmoitettu ALAT-arvon kohoamista > 3 × viitearvon normaalin ylärajan tai AFOS-arvon kohoamista > 2 x viitearvon normaalin ylärajan, useimmiten käytettäessä suurta annosta (500 mg). Näihin ei ole liittynyt samanaikaista seerumin kokonaisbilirubiinin kohoamista. Kohonneet arvot korjautuivat pitkälti, kun hoito keskeytettiin tai annosta pienennettiin, tai arvot palautuivat normaaleiksi jatkettaessa hoitoa samalla annoksella. Kohonneiden maksaentsyymiarvojen kliininen hoito, ks. kohta Varoitukset ja käyttöön liittyvät varotoimet.
Ruoansulatuselimistö
Yleisin haittavaikutus telotristaattietyyliä 250 mg kolme kertaa vuorokaudessa saaneilla potilailla oli vatsakipu (25,7 %; 18/70) vs. lume (19,7 %; 14/71). Vatsan pingottuneisuutta ilmoitettiin 7,1 %:lla (5/70) telotristaattietyyliä 250 mg kolme kertaa vuorokaudessa saaneista potilaista ja 4,2 %:lla (3/71) lumeryhmän potilaista. Ilmavaivoja oli 5,7 %:lla (4/70) telotristaattietyyliä 250 mg kolme kertaa vuorokaudessa saaneista potilaista ja 1,4 %:lla (1/71) lumeryhmän potilaista. Tapaukset olivat enimmäkseen lieviä tai keskivaikeita, eivätkä ne rajoittaneet tutkimuslääkityksen käyttöä.
Ummetusta ilmoitettiin 5,7 %:lla (4/70) telotristaattietyyliä 250 mg kolme kertaa vuorokaudessa saaneista potilaista ja 4,2 %:lla (3/71) lumeryhmän potilaista. Turvallisuuden selvittämisessä mukana olleessa potilasjoukossa (239 potilasta) vaikeaa ummetusta havaittiin kolmella suuriannoksista hoitoa (500 mg) saaneella potilaalla.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Oireet
Telotristaatin yliannostuksesta ihmisellä on vähän kliinistä tietoa. Ruoansulatuselimistön häiriöitä, mukaan lukien pahoinvointia, ripulia, vatsakipua, ummetusta ja oksentelua, on ilmoitettu vaiheen 1 tutkimuksessa, jossa terveille tutkittaville annettiin 1 500 mg:n kerta-annos.
Hoito
Yliannostuksen hoitoon tulisi kuulua yleinen oireenmukainen hoito.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Muut ruuansulatuselimistön sairauksien ja aineenvaihduntasairauksien lääkkeet: muut ruuansulatuselimistön sairauksien ja aineenvaihduntasairauksien lääkkeet, ATC-koodi: A16AX15
Vaikutusmekanismi
Sekä aihiolääke (telotristaattietyyli) että sen aktiivinen metaboliitti (telotristaatti) ovat L-tryptofaanihydroksylaasien (TPH1 ja TPH2, jotka ovat reaktion nopeutta rajoittavia vaiheita serotoniinin synteesissä) estäjiä. Serotoniinilla on keskeinen rooli useiden merkittävien fysiologisten prosessien säätelyssä, mukaan lukien eritys, motiliteetti, tulehdus ja maha-suolikanavan tuntoaistimus, ja karsinoidioireyhtymää sairastavilla potilailla sen eritys on liiallista. Telotristaatti vähentää serotoniinin tuotantoa estämällä perifeeristä TPH1:tä ja lievittää siten karsinoidioireyhtymään liittyviä oireita.
Farmakodynaamiset vaikutukset
Vaiheen 1 tutkimuksissa, joissa telotristaattietyyliä annettiin terveille tutkittaville (annosväli: 100 mg kerran vuorokaudessa – 500 mg kolme kertaa vuorokaudessa), kokoveren serotoniinipitoisuus ja 24 tunnin virtsan 5‑hydroksi-indolietikkahappo (5‑HIAA) pitoisuus pienenivät tilastollisesti merkitsevästi lähtötilanteesta lumevalmisteeseen verrattuna.
Karsinoidioireyhtymää sairastavilla potilailla telotristaatti pienensi virtsan 5‑HIAA-pitoisuuksia (ks. TELESTAR-tutkimusta koskeva taulukko 3 sekä TELECAST-tutkimusta koskevat tiedot). Molemmissa vaiheen 3 tutkimuksissa telotristaattietyyli 250 mg kolme kertaa vuorokaudessa pienensi virtsan 5‑HIAA-pitoisuuksia tilastollisesti merkitsevästi lumevalmisteeseen verrattuna.
Kliininen teho ja turvallisuus
Telotristaatin teho ja turvallisuus karsinoidioireyhtymän hoidossa potilailla, joilla oli metastaattinen neuroendokriininen kasvain ja joita hoidettiin somatostatiinianalogeilla, osoitettiin 12 viikkoa kestäneessä kaksoissokkoutetussa, lumekontrolloidussa, satunnaistetussa, aikuisille tehdyssä vaiheen 3 monikeskustutkimuksessa. Tutkimukseen kuului 36 viikkoa kestänyt avoin jatkotutkimus, jossa kaikille potilaille annettiin telotristaattia (TELESTAR-tutkimus).
Tehoa arvioitiin yhteensä 135 potilaalla. Keski-ikä oli 64 vuotta (vaihteluväli 37–88 vuotta), ja miehiä oli 52 % ja valkoihoisia 90 %. Kaikilla potilailla oli hyvin erilaistunut metastaattinen neuroendokriininen kasvain ja karsinoidioireyhtymä. Potilaita hoidettiin somatostatiinianalogeilla, ja heillä oli ≥ 4 ulostuskertaa/vrk.
Tutkimukseen kuului 12 viikon kaksoissokkojakso, jonka aikana potilaat saivat aluksi lumevalmistetta (n = 45), telotristaattietyyliä 250 mg (n = 45) tai suurempaa annosta (telotristaattietyyli 500 mg; n = 45) kolme kertaa vuorokaudessa. Potilaat saivat tutkimuksen aikana käyttää varahoitoa (lyhytvaikutteista somatostatiinianalogia) ja ripulilääkkeitä oireiden lievittämiseen, mutta kaksoissokkojakson aikana heidän piti käyttää pitkävaikutteista somatostatiinianalogia vakiintuneena annoksena. Xermelo otettiin 15 minuuttia ennen ateriaa tai tunnin kuluessa aterian jälkeen.
Taulukko 2: Ulostuskerroissa saavutettu vaste (TELESTAR-tutkimus)
Parametri | Lume | Telotristaattietyyli 250 mg 3 x /vrk | |
Ulostuskertoja/vrk lähtötilanteessa | Potilaiden lukumäärä | 45 | 45 |
Keskiarvo lähtötilanteessa (keskihajonta) | 5,2 (1,35) | 6,1 (2,07) | |
Ensisijainen päätetapahtuma: vuorokauden ulostuskertojen lukumäärän keskimääräinen muutos lähtötilanteesta 12 viikon aikana | Potilaiden lukumäärä | 45 | 45 |
Muutos 12 viikon aikana: keskiarvo (keskihajonta) | ˗0,6 (0,83) | ˗1,4 (1,37) | |
ANCOVAa | Pienimmän neliösumman keskimääräinen ero | --- | -0,6 |
Eron 97,5 %:n luottamusväli | --- | -1,16, -0,06 | |
p-arvo | --- | 0,01 | |
Kestävän vasteen saaneiden potilaiden prosentuaalinen osuusb | Potilaiden lukumäärä | 45 | 45 |
Vasteen saaneet, n (%) | 9 (20,0) | 20 (44,4)c | |
| |||
Kun telotristaatin täysi vaikutus oli havaittavissa (kaksoissokkojakson 6 viimeisen viikon aikana), niiden vasteen saaneiden osuus, joilla ulostuskertojen lukumäärä väheni vähintään 30 %, oli 51 % (23/45) telotristaattia 250 mg saaneessa ryhmässä ja 22 % (10/45) lumeryhmässä (post hoc ‑analyysi).
Tutkimuksen 12 viikkoa kestäneellä kaksoissokkojaksolla ulostuskertojen tiheys pieneni telotristaattihoitoa saaneilla jo kolmessa viikossa lumeeseen verrattuna, ja vaikutus oli suurin kaksoissokkojakson 6 viimeisen viikon aikana (ks. kuva 1).
Kuva 1 – Ulostuskertojen keskimääräinen muutos lähtötilanteesta tutkimusviikoittain kaksoissokkojakson aikana, hoitoaikeen mukainen (intent-to-treat) potilasjoukko
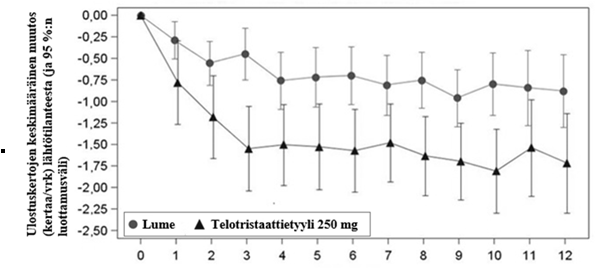
Tutkimusviikko
Huomaa: Kuvassa on esitetty aritmeettinen keskiarvo ja 95 %:n luottamusvälit (normaaliapproksimaation perusteella) päivittäisten ulostuskertojen muutokselle (kertoja/vrk) lähtötilanteesta laskettuna kullakin viikolla.
Niiden potilaiden osuudet, jotka ilmoittivat vuorokauden ulostuskertojen vähenemistä lähtötilanteesta (keskiarvo 12 viikon ajalta), olivat:
- potilaita, joilla keskimäärin vähintään 1 ulostuskerta/vrk vähemmän: 66,7 % (telotristaattietyyli 250 mg) ja 31,3 % (lume)
- potilaita, joilla keskimäärin vähintään 1,5 ulostuskertaa/vrk vähemmän: 46,7 % (telotristaattietyyli 250 mg) ja 20,0 % (lume)
- potilaita, joilla keskimäärin vähintään 2 ulostuskertaa/vrk vähemmän: 33,3 % (telotristaattietyyli 250 mg) ja 4,4 % (lume).
Taulukko 3: 5‑HIAA:n erittyminen virtsaan lähtötilanteessa ja viikolla 12 (TELESTAR-tutkimus)
Parametri | Lume | Telotristaattietyyli 250 mg kolme kertaa vuorokaudessa | |
5‑HIAA:n erittyminen virtsaan (mg/24 h) lähtötilanteessa | Potilaiden lukumäärä | 44 | 42 |
Keskiarvo lähtötilanteessaa (keskihajonta) | 81,0 (161,01) | 92,6 (114,90) | |
5‑HIAA:n virtsaan erittymisen (mg/24 h) prosentuaalinen muutos lähtötilanteesta viikolla 12 | Potilaiden lukumäärä | 28 | 32 |
Prosentuaalinen muutos viikolla 12: keskiarvo (keskihajonta) | 14,4 (57,80) | -42,3 (41,96) | |
Hoitojen arvioitu ero (95 %:n luottamusväli)b | --- | -53,4c | |
5‑HIAA = 5‑hydroksi-indolietikkahappo. a. Lähtötilanteen tiedot perustuvat kaikkien niiden potilaiden tietoihin, joista on lähtötilanteen tietoja saatavana b. Tilastollisissa testeissä käytettiin lohkottua 2 näytteen Wilcoxonin järjestyslukujen summatestiä (van Elterenin testi), joka ositettiin satunnaistamisen yhteydessä tehdyn virtsan 5‑HIAA-pitoisuuteen perustuvan osituksen mukaan. Luottamusvälit perustuivat Hodges-Lehmann-estimaattiin parittaisen eron mediaanista. c. p < 0,001 | |||
Hoitoryhmien välillä ei ollut merkittäviä eroja punoitusta ja vatsakipua koskevissa päätapahtumissa.
Post hoc -analyysi osoitti, että varahoitona käytetyn, injektioina annetun lyhytvaikutteisen somatostatiinianalogin käyttökertojen keskimääräinen päivittäinen lukumäärä 12 viikon kaksoissokkojakson aikana oli telotristaattietyyliä 250 mg saaneessa ryhmässä 0,3 ja lumeryhmässä 0,7.
Ennalta määritelty osatutkimus toteutettiin hoidon lopettavien potilaiden haastatteluna, ja siinä arvioitiin oireiden paranemisen merkitystä ja kliinistä merkityksellisyyttä 35 potilaalla. Sokkoutetuilta osanottajilta selvitettiin tarkemmin tutkimuksen aikana tapahtuneen muutoksen astetta. Kaksitoista potilasta oli ”hyvin tyytyväisiä”; kaikki potilaat saivat telotristaattihoitoa. Niiden potilaiden osuus, jotka olivat ”hyvin tyytyväisiä”, oli lumeryhmässä 0/9 (0 %), telotristaattietyyliä 250 mg kolme kertaa vuorokaudessa saaneessa ryhmässä 5/9 (56 %) ja suuriannoksista telotristaattietyyliä saaneessa ryhmässä 7/15 (47 %).
Kaksoissokkojakson aikana tutkimuksen keskeytti ennenaikaisesti kaiken kaikkiaan 18 potilasta (13,2 %): 7 potilasta lumeryhmässä, 3 potilasta telotristaattietyyliä 250 mg saaneessa ryhmässä ja 8 potilasta suuriannoksista telotristaattia saaneessa ryhmässä. 12 viikon kaksoissokkojakson päätyttyä 115 potilasta (85,2 %) osallistui 36 viikkoa kestäneeseen avoimeen jatkotutkimukseen, jossa kaikille potilaille annettiin suuriannoksista telotristaattietyyliä (500 mg) kolme kertaa vuorokaudessa.
Tutkimusasetelmaltaan samankaltaisessa vaiheen 3 tutkimuksessa (TELECAST) arvioitiin tehoa 76 potilaalla. Keski-ikä oli 63 vuotta (vaihteluväli 35–84 vuotta), ja miehiä oli 55 % ja valkoihoisia 97 %. Kaikilla potilailla oli hyvin erilaistunut metastaattinen neuroendokriininen kasvain ja karsinoidioireyhtymä. Useimmilla potilailla (92,1 %) oli vähemmän kuin 4 ulostuskertaa/vrk, ja yhdeksää potilasta lukuun ottamatta kaikki saivat somatostatiinianalogihoitoa.
Ensisijainen päätetapahtuma oli virtsan 5‑HIAA-pitoisuuden prosentuaalinen muutos lähtötilanteesta viikolla 12. Lähtötilanteessa 5‑HIAA:n keskimääräinen erittyminen virtsaan oli 250 mg:n annosta saaneessa ryhmässä (n = 17) 69,1 mg/24 h ja lumeryhmässä (n = 22) 84,8 mg/24 h. Virtsaan erittyneen 5‑HIAA:n prosentuaalinen muutos lähtötilanteesta viikolla 12 oli lumeryhmässä +97,7 % verrattuna ‑33,2 %:iin 250 mg:n annosta saaneessa ryhmässä.
Lähtötilanteessa ulostuskertojen keskimääräinen lukumäärä vuorokaudessa oli lumeryhmässä 2,2 (n = 25) ja 250 mg:n annosta saaneessa ryhmässä 2,5 (n = 25). Vuorokauden ulostuskertojen lukumäärän keskimääräinen muutos lähtötilanteesta 12 viikon aikana oli lumeryhmässä +0,1 ja 250 mg:n annosta saaneessa ryhmässä ‑0,5. Telotristaattietyyli 250 mg paransi ulosteen kiinteyttä (ulosteen muotoa kuvaavalla Bristolin asteikolla mitattuna) lumeeseen verrattuna. Kestävän vasteen (määritelty taulukossa 2) sai telotristaattietyyliä 250 mg saaneessa ryhmässä 40 % potilaista (10/25) ja lumeryhmässä 0 % potilaista (0/26) (p = 0,001).
Telotristaatin pitkän aikavälin turvallisuutta ja siedettävyyttä arvioitiin ei-pivotaalisessa (satunnaistamattomassa) avoimessa, pitkäkestoisessa, monessa keskuksessa tehdyssä vaiheen 3 jatkotutkimuksessa. Potilaat, jotka olivat osallistuneet mihin tahansa Xermelo-valmisteella tehtyyn vaiheen 2 tai 3 karsinoidioireyhtymää koskevaan tutkimukseen, voivat jatkaa jatkotutkimuksessa samalla annostuksella ja hoito-ohjelmalla kuin alkuperäisessä tutkimuksessa vähintään 84 hoitoviikon ajan. Uusia merkittäviä turvallisuussignaaleja ei havaittu.
Tutkimuksen toissijaisena tarkoituksena oli arvioida potilaiden elämänlaadun muutoksia viikolle 84 saakka. Elämänlaatu pysyi yleisesti vakaana tutkimuksen ajan.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset Xermelo-valmisteen käytöstä kaikkien pediatristen potilasryhmien karsinoidioireyhtymän hoidossa (ks. kohta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Telotristaattietyylin ja sen aktiivisen metaboliitin farmakokinetiikkaa on tutkittu terveillä vapaaehtoisilla sekä karsinoidioireyhtymää sairastavilla potilailla.
Imeytyminen
Terveille vapaaehtoisille suun kautta annettu telotristaattietyyli imeytyi nopeasti ja muuntui lähes kokonaan aktiiviseksi metaboliitiksi. Suun kautta annetun telotristaattietyylin huippupitoisuudet plasmassa saavutettiin 0,53–2,00 tunnin kuluessa ja aktiivisen metaboliitin huippupitoisuudet 1,50–3,00 tunnin kuluessa. Kun terveille vapaaehtoisille annettiin paastotilassa 500 mg:n kerta-annos telotristaattietyyliä (kaksi kertaa suositeltu annos), telotristaattietyylin keskimääräinen Cmax oli 4,4 ng/ml ja keskimääräinen AUC0-inf 6,23 ng•h/ml. Telotristaatin keskimääräinen Cmax oli 610 ng/ml ja keskimääräinen AUC0-inf oli 2320 ng•h/ml.
Lisäksi karsinoidioireyhtymää sairastavissa potilaissa, jotka käyttivät pitkävaikutteisia somatostatiinianalogeja, telotristaattietyyli muuntui nopeasti aktiiviseksi metaboliitiksi. Farmakokinetiikassa yleensä havaittiin telotristaattietyylin ja sen aktiivisen metaboliitin parametreissa suurta vaihtelua (variaatiokertoimen [%] vaihteluväli 18 % – 99 %). Telotristaattietyylin ja sen aktiivisen metaboliitin farmakokineettisten parametrien keskiarvoissa ei ilmennyt muutoksia viikon 24 ja viikon 48 välisenä aikana, mikä viittaa siihen, että vakaa tilaa saavutetaan viikolla 24 tai sitä ennen.
Ruoan vaikutus
Ruoan vaikutusta selvittäneessä tutkimuksessa runsasrasvaisen aterian yhteydessä otettu 500 mg:n telotristaattietyyliannos suurensi altistusta kanta-aineelle (Cmax suureni 112 %, AUC0-tlast 272 % ja AUC0-∞ 264 % verrattuna paastotilaan) ja sen aktiiviselle metaboliitille (Cmax suureni 47 %, AUC0-tlast 32 % ja AUC0-∞ 33 % verrattuna paastotilaan).
Jakautuminen
Sekä telotristaattietyyli että sen aktiivinen metaboliitti sitoutuvat yli 99-prosenttisesti ihmisen plasman proteiineihin.
Biotransformaatio
Suun kautta otettu telotristaattietyyli hydrolysoituu karboksyyliesteraasien välityksellä aktiiviseksi ja pääasialliseksi metaboliitikseen. Telotristaatin ainoa metaboliitti (aktiivinen metaboliitti), jota oli johdonmukaisesti > 10 % kaikista lääkeaineeseen liittyvistä yhdisteistä plasmassa, oli sen oksidatiivinen dekarboksyloitunut deaminoitunut metaboliitti, LP‑951757. Massatasetutkimuksessa systeeminen altistus LP‑951757:lle oli noin 35 % verrattuna systeemiseen altistukseen telotristaatille (aktiiviselle metaboliitille). LP‑951757 oli TPH1-entsyymissä farmakologisesti inaktiivinen in vitro.
Yhteisvaikutukset
Sytokromit
CYP2B6
Telotristaatti (aktiivinen metaboliitti) suurensi pitoisuudesta riippuvaisesti CYP2B6 mRNA ‑pitoisuuksia in vitro (yli kaksinkertaisiksi ja > 20 % positiivisesta kontrolliaineesta, ja suurin havaittu vaikutus on samankaltainen kuin positiivisella kontrolliaineella), mikä viittaa mahdolliseen CYP2B6-induktioon (ks. kohta Yhteisvaikutukset).
CYP3A4
Telotristaattietyylin ja sen aktiivisen metaboliitin ei in vitro ‑löydösten perusteella ole osoitettu indusoivan CYP3A4:ää systeemisesti merkityksellisinä pitoisuuksina. Koska telotristaattietyylin liukoisuus in vitro on vähäinen, sen CYP3A4:ää indusoivaa vaikutusta ei ole arvioitu suolistossa oletettavissa olevilla pitoisuuksilla.
Telotristaattietyylillä on allosteerinen yhteisvaikutus CYP3A4:n kanssa in vitro, mikä vähentää paitsi midatsolaamin konversiota 1’hydroksimidatsolaamiksi, myös lisää konversiota 4-hydroksimidatsolaamiksi.
Midatsolaamilla (herkkä CYP3A4:n substraatti) tehdyssä kliinisessä lääkkeiden välisiä yhteisvaikutuksia selvittäneessä in vivo ‑tutkimuksessa telotristaattietyyliannosten toistuva anto pienensi merkitsevästi systeemistä altistusta samanaikaisesti annetulle midatsolaamille (ks. kohta Yhteisvaikutukset). Kun midatsolaamia annettiin samanaikaisesti 3 mg suun kautta 5 päivää kestäneen telotristaattihoidon (500 mg kolme kertaa vuorokaudessa; kaksi kertaa suositeltu annos) jälkeen, midatsolaamin keskimääräinen Cmax pieneni 25 % ja AUC0-inf 48 % verrattuna yksinään annettuun midatsolaamiin. Myös aktiivisen metaboliitin 1’-hydroksimidatsolaamin Cmax pieneni 34 % ja AUC0-inf 48 %.
Muut CYP-entsyymit
In vitro ‑löydösten perusteella ei ole odotettavissa kliinisesti merkityksellisiä yhteisvaikutuksia muiden sytokromi P450 ‑isoentsyymien kautta.
Karboksyyliesteraasit
Loperamidi esti telotristaattietyylin metaboliaa CES2-välitteisesti, ja eston IC50 oli 5,2 mikroM (ks. kohta Yhteisvaikutukset).
Telotristaattietyyli esti CES2:ta in vitro, ja IC50 oli noin 0,56 mikroM.
Kuljettajaproteiinit
P-glykoproteiini (P‑gp) ja monilääkeresistenssiin liittyvä proteiini 2 (MRP2)
Telotristaattietyyli esti P‑gp:tä in vitro kliinisesti oleellisina pitoisuuksina, toisin kuin sen aktiivinen metaboliitti.
Telotristaattietyyli esti MRP2:n välittämää kuljetusta (98-prosenttinen esto).
Kun erityisessä kliinisessä lääkkeiden välisiä yhteisvaikutuksia selvittäneessä tutkimuksessa tutkittaville, jotka olivat saaneet telotristaattietyyliä 500 mg kolme kertaa vuorokaudessa (kaksi kertaa suositeltu annos) viiden vuorokauden ajan, annettiin samanaikaisesti suun kautta feksofenadiinia 180 mg:n kerta-annos, feksofenadiinin (P‑gp:n ja MRP2:n substraatti) Cmax ja AUC suurenivat 16 %, Havaitun vähäisen suurenemisen perusteella kliinisesti merkitykselliset yhteisvaikutukset P‑gp:n ja MRP2:n substraattien kanssa ovat epätodennäköisiä.
Rintasyövän resistenssiproteiini (BCRP)
Telotristaattietyyli esti BCRP:tä (IC50 = 20 mikroM) in vitro, mutta sen aktiivinen metaboliitti telotristaatti ei estänyt merkitsevästi BRCP:n aktiivisuutta (IC50 > 30 mikroM). BCRP:n estoon perustuvaa lääkeyhteisvaikutusten mahdollisuutta in vivo pidetään vähäisenä.
Muut kuljettajaproteiinit
In vitro ‑löydösten perusteella kliinisesti merkityksellisiä yhteisvaikutuksia muiden kuljettajaproteiinien kanssa ei ole odotettavissa.
Lyhytvaikutteinen oktreotidi
Terveille vapaaehtoisille tehdyssä tutkimuksessa, jossa selvitettiin lyhytvaikutteisen oktreotidin (kolme 200 mikrogramman annosta injisoituna ihon alle 8 tunnin välein) vaikutusta telotristaattietyylin 500 mg:n kerta-annoksen farmakokinetiikkaan, telotristaattietyylin Cmax-arvon geometrinen keskiarvo pieneni 86 % ja AUC0-tlast-arvon geometrinen keskiarvo pieneni 81 % (ks. kohta Yhteisvaikutukset). 12 viikkoa kestäneessä kaksoissokkoutetussa, satunnaistetussa lumekontrolloidussa monikeskustutkimuksessa, joka tehtiin karsinoidioireyhtymää sairastavilla aikuispotilailla, joita hoidettiin pitkävaikutteisilla somatostatiinianalogeilla, ei havaittu altistuksen pienenemistä.
Farmakokineettiset/farmakodynaamiset suhteet
Hapon eritystä vähentävät lääkeaineet
Telotristaattietipraatin (Xermelo, telotristaattietyylin hippuraattisuola) ja hapon eritystä vähentävien lääkeaineiden (omepratsolin ja famotidiinin) samanaikaisessa käytössä telotristaattietyylin AUC-arvo suureni 2–3-kertaiseksi, mutta aktiivisen metaboliitin (telotristaatin) AUC ei muuttunut. Koska telotristaattietyyli metaboloituu nopeasti aktiiviseksi metaboliitikseen, joka on yli 25 kertaa aktiivisempi kuin telotristaattietyyli, annosta ei tarvitse muuttaa käytettäessä Xermelo-valmistetta hapon eritystä vähentävien lääkeaineiden kanssa.
Eliminaatio
Suun kautta annetusta 14C-telotristaattietyylin 500 mg:n kerta-annoksesta poistui noin 93 %. Suurin osa erittyi ulosteisiin.
Suun kautta otetun telotristaattietyylin ja telotristaatin munuaispuhdistuma on vähäinen (alle 1 % annoksesta erittyy virtsaan.)
Terveille vapaaehtoisille suun kautta annetun 250 mg:n telotristaattietyylikerta-annoksen jälkeen virtsan telotristaattietyylipitoisuus oli lähellä määritysrajaa tai sen alle (< 0,1 ng/ml). Telotristaatin munuaispuhdistuma oli 0,126 l/h.
Terveillä vapaaehtoisilla, joille annettiin suun kautta 500 mg:n kerta-annos 14C-telotristaattietyyliä, telotristaattietyylin näennäinen puoliintumisaika oli noin 0,6 tuntia ja sen aktiivisen metaboliitin näennäinen puoliintumisaika oli 5 tuntia. Kolme kertaa vuorokaudessa annetun 500 mg:n annoksen jälkeen näennäinen terminaalinen puoliintumisaika oli noin 11 tuntia.
Lineaarisuus/ei-lineaarisuus
Telotristaattia 250 mg kolme kertaa vuorokaudessa saaneilla potilailla havaittiin vähäistä telotristaatin kumuloitumista. AUC0-4h-arvoon perustuvan kumuloitumissuhteen mediaani oli 1,55 [minimi 0,25; maksimi 5,00; n = 11; viikko 12], ja yksilöiden välinen vaihtelu oli suurta (variaatiokerroin [%] = 72 %). 500 mg:n annosta kolme kertaa vuorokaudessa (kaksi kertaa suositeltu annos) saaneilla potilailla AUC0-4h-arvoon perustuvan kumuloitumissuhteen mediaani oli 1,095 (minimi 0,274; maksimi 11,46; n = 16; viikko 24), ja yksilöiden välinen vaihtelu oli suurta (variaatiokerroin [%] = 141,8 %).
Koska yksilöiden välisen vaihtelun on havaittu olevan suurta, kumuloitumista jossakin karsinoidioireyhtymää sairastavien potilaiden alaryhmässä ei voida sulkea pois.
Erityiset potilasryhmät
Iäkkäät
Iän vaikutusta telotristaattietyylin ja sen aktiivisen metaboliitin farmakokinetiikkaan ei ole lopullisesti arvioitu. Iäkkäillä ei ole tehty erityisiä tutkimuksia.
Munuaisten vajaatoiminta
Munuaisten vajaatoiminnan vaikutusta kerta-annoksena (250 mg) annetun telotristaattietyylin farmakokinetiikkaan on selvitetty yhdessä tutkimuksessa. Tutkimuksessa oli mukana kahdeksan tutkittavaa, joilla oli vaikea tai keskivaikea munuaisten vajaatoiminta, joka ei edellyttänyt dialyysihoitoa [eGFR ≤ 33 ml/min seulontahetkellä ja ≤ 40 ml/min annoksen antamista edeltävänä päivänä], ja kahdeksan tervettä tai lievää munuaisten vajaatoimintaa [eGFR ≥ 88 ml/min seulontahetkellä ja ≥ 83 ml/min annoksen antamista edeltävänä päivänä] sairastavaa tutkittavaa.
Vaikeaa tai keskivaikeaa munuaisten vajaatoimintaa sairastavilla tutkittavilla telotristaattietyylin huippupitoisuuden (Cmax) havaittiin suurentuneen (1,3-kertaiseksi) ja sen aktiivisen metaboliitin telotristaatin altistuksen plasmassa (AUC) ja huippupitoisuuden (Cmax) havaittiin suurentuneen (< 1,52 kertaiseksi) terveisiin tai lievää munuaisten vajaatoimintaa sairastaviin tutkittaviin verrattuna. Pääasiallisen plasmassa havaitun metaboliitin LP-778902 farmakokineettisissä parametreissä oli enemmän vaihtelua potilailla, joilla oli vaikea tai keskivaikea munuaisten vajaatoiminta. Näillä potilailla variaatiokerroin [%] oli Cmax-arvon osalta 53,3 % ja AUC-arvon osalta 77,3 %, kun se terveillä tai lievää munuaisten vajaatoimintaa sairastavilla tutkittavilla oli Cmax-arvon osalta 45,4 % ja AUC-arvon osalta 39,7 %.
Vaikeaa tai keskivaikeaa munuaisten vajaatoimintaa sairastavat tutkittavat sietivät suun kautta otetun 250 mg:n telotristaattietyylikerta-annoksen hyvin.
Vaikeasta tai keskivaikeasta munuaisten vajaatoiminnasta ei yleisesti aiheutunut kliinisesti merkittäviä muutoksia telotristaattietyylin tai sen metaboliitin telotristaatin farmakokineettiseen profiiliin tai turvallisuuteen. Tästä syystä annoksen muuttaminen ei vaikuta olevan tarpeen potilailla, joilla on lievä, keskivaikea tai vaikea munuaisten vajaatoiminta, joka ei edellytä dialyysihoitoa. Ottaen huomioon, että yksilöiden välinen vaihtelu on suurta, varotoimena suositellaan, että vaikeaa munuaisten vajaatoimintaa sairastavia potilaita seurataan heikentyneen sietokyvyn merkkien varalta.
Tehoa ja turvallisuutta ei ole varmistettu potilailla, jotka sairastavat loppuvaiheen munuaissairautta ja tarvitsevat dialyysihoitoa (eGFR < 15 ml/min/1,73 m², edellyttää dialyysia).
Maksan vajaatoiminta
Maksan vajaatoiminnan vaikutusta selvitettiin tutkimuksessa, johon osallistui lievää ja keskivaikeaa maksan vajaatoimintaa sairastavia sekä terveitä tutkittavia. 500 mg:n kerta-annoksella altistus kanta-aineelle ja sen aktiiviselle metaboliitille (AUC0-last-arvon perusteella) oli lievää ja keskivaikeaa maksan vajaatoimintaa sairastavilla suurempi kuin terveillä tutkittavilla (lievää maksan vajaatoimintaa sairastavilla altistus kanta-aineelle oli 2,3-kertainen ja altistus aktiiviselle metaboliitille 2,4-kertainen, ja keskivaikeaa maksan vajaatoimintaa sairastavilla altistus kanta-aineelle oli 3,2-kertainen ja altistus aktiiviselle metaboliitille 3,5-kertainen). 500 mg:n kerta-annos oli hyvin siedetty. Lievää (Child–Pugh-luokka A) tai keskivaikeaa (Child–Pugh-luokka B) maksan vajaatoimintaa sairastavien potilaiden annosta voi olla tarpeen pienentää siedettävyyden mukaan (ks. kohta Annostus ja antotapa).
Maksan vajaatoiminnan vaikutusta selvitettiin myös tutkimuksessa, johon osallistui vaikeaa maksan vajaatoimintaa sairastavia potilaita sekä terveitä tutkittavia. 250 mg:n kerta-annos suurensi vaikeaa maksan vajaatoimintaa sairastavien altistusta kanta-aineelle niin, että AUCt suureni 317,0 % ja Cmax suureni 529,5 % verrattuna tutkittaviin, joiden maksan toiminta oli normaali. Altistus aktiiviselle metaboliitille suureni niin, että AUCt suureni 497 %, AUCinf suureni 500 % ja Cmax suureni 217 % verrattuna tutkittaviin, joiden maksan toiminta oli normaali. Lisäksi aktiivisen metaboliitin puoliintumisaika piteni, ts. keskimääräinen puoliintumisaika oli vaikeaa maksan vajaatoimintaa sairastavilla 16,0 tuntia ja terveillä tutkittavilla 5,47 tuntia. Näiden löydösten perusteella telotristaattietipraatin käyttöä vaikeaa maksan vajaatoimintaa (Child-Pugh–luokka C) sairastavien potilaiden hoitoon ei suositella.
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta, genotoksisuutta ja karsinogeenisuutta koskevien tavanomaisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Rotilla, joille annettiin telotristaattietipraattia suun kautta ≥ 1000 mg/kg/vrk annoksina, havaittiin serotoniinin (5-HT) määrän vähenemistä aivoissa. 5-HIAA:n määrä aivoissa pysyi muuttumattomana kaikilla tutkituilla telotristaattietyyliannoksilla. Altistus on aktiivisen metaboliitin LP‑778902:n osalta noin 14-kertainen ihmiselle suositellusta enimmäisannoksesta (750 mg/vrk) aiheutuvaan altistukseen (kokonais-AUC) nähden.
Rotille tehdyssä toistuvan altistuksen aiheuttamaa toksisuutta selvittäneessä 26 viikkoa kestäneessä tutkimuksessa haitattomaksi annokseksi (No-Observed Adverse Effect Level, NOAEL) määritettiin 50 mg/kg/vrk. Altistus on aktiivisen metaboliitin LP‑778902:n osalta noin 0,4-kertainen ihmiselle suositellusta enimmäisannoksesta (750 mg/vrk) aiheutuvaan altistukseen (kokonais-AUC) nähden. Annoksilla 200 ja 500 mg/kg/vrk havaittiin etumahan ja/tai rauhasmahan rappeutumista/nekroosia ja/tai proteiinipisaroita rauhasmahassa. Maha-suolikanavan mikroskooppiset muutokset palautuivat 4 viikon palautumisjakson aikana. Näiden maha-suolikanavan löydösten merkitystä ihmiselle ei tiedetä.
Kun telotristaattietipraattia annettiin koirille suun kautta, 200 mg/kg/vrk aiheutti 5‑HT:n ja 30 mg/kg/vrk 5-HIAA:n määrän vähenemistä aivoissa. Altistus on aktiivisen metaboliitin LP‑778902:n osalta noin 21-kertainen ihmiselle suositellusta enimmäisannoksesta (750 mg/vrk) aiheutuvaan altistukseen (kokonais-AUC) nähden. Kun aktiivista metaboliittia annettiin laskimoon, 5‑HT:n ja 5‑HIAA:n määrien vähenemistä aivoissa ei havaittu. 5‑HIAA:n määrän vähenemisen (johon voi liittyä samanaikainen 5‑HT:n määrän väheneminen aivoissa) kliinistä merkitystä ei tiedetä.
Koirilla tehdyssä toistuvan altistuksen aiheuttamaa toksisuutta selvittäneessä 39 viikkoa kestäneessä tutkimuksessa haitattomaksi annokseksi (NOAEL) määritettiin 300 mg/kg/vrk. Ainoa kliininen oire oli kaikilla annoksilla nestemäisten ulosteiden yleisyyden lisääntyminen. Altistus on aktiivisen metaboliitin LP‑778902:n osalta noin 20-kertainen ihmiselle suositellusta enimmäisannoksesta (750 mg/vrk) aiheutuvaan altistukseen (kokonais-AUC) nähden.
Telotristaattietipraatin karsinogeenisuutta tutkittiin transgeenisillä hiirillä (26 viikkoa) ja rotilla (104 viikkoa). Tutkimukset vahvistivat, ettei telotristaatti lisännyt kasvainten esiintymistä kummallakaan lajilla eikä eri sukupuolilla käytettäessä annoksia, joista aiheutuva altistus oli hiirillä 10–15-kertainen ja rotilla 2–4,5-kertainen verrattuna ihmiselle suositellusta enimmäisannoksesta aiheutuvaan altistukseen aktiiviselle metaboliitille.
Rotilla ei havaittu haitallisia vaikutuksia urosten tai naaraiden hedelmällisyyteen. Prenataalisen letaliteetin lisääntyminen (varhaisten ja myöhäisten resorptioiden lisääntyminen) vaikutti rotilla ja kaneilla prenataaliseen kehitykseen, mutta rotilla ei havaittu vaikutuksia postnataaliseen kehitykseen. Parentaalisen, maternaalisen sekä pre- ja postnataalisen toksisuuden osalta haitaton annos (NOAEL) on rotilla 500 mg/kg/vrk, mikä on 3–4 kertaa aktiivisen metaboliitin LP‑778902:n enimmäisannoksesta ihmiselle aiheutuva arvioitu altistus (AUC0‑24). Kaneilla emoon kohdistuvan toksisuuden ja prenataalisen toksisuuden osalta NOAEL on 125 mg/kg/vrk, mikä on 1,5–4 kertaa aktiivisen metaboliitin LP‑778902:n enimmäisannoksesta ihmiselle aiheutuva arvioitu altistus (AUC0‑24).
Farmaseuttiset tiedot
Apuaineet
Tabletin ydin
Laktoosi
Hydroksipropyyliselluloosa
Kroskarmelloosinatrium
Magnesiumstearaatti
Vedetön kolloidinen piidioksidi
Kalvopäällyste
Poly(vinyylialkoholi) (E1203)
Titaanidioksidi (E171)
Makrogoli 3350 (E1521)
Talkki (E553b)
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
5 vuotta
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
XERMELO tabletti, kalvopäällysteinen
250 mg (L:kyllä) 90 fol (1576,65 €)
PF-selosteen tieto
PVC/PCTFE/PVC/alumiini-läpipainopakkaus
Läpipainopakkaukset on pakattu pahvikoteloon.
Pakkauskoot: 90 ja 180 kalvopäällysteistä tablettia. Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Valkoinen tai luonnonvalkoinen, soikea kalvopäällysteinen tabletti (pituus noin 17 mm ja leveys noin 7,5 mm), jonka toisella puolella on merkintä ’T-E’ ja toisella ’250’.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
XERMELO tabletti, kalvopäällysteinen
250 mg 90 fol
- Ei korvausta.
ATC-koodi
A16AX15
Valmisteyhteenvedon muuttamispäivämäärä
05.12.2025
Yhteystiedot
Avenue Louise 480 / 40 Avenue geogres V
1050 / 75008 Brussels / Patis
Belgium / France
+ 32 (0) 2 792 05 00
