POMBILITI kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos 105 mg
 Lääketurva
Lääketurva
Riskienminimointimateriaalit
Potilas
Terveydenhuollon ammattilainen
Huomioitavaa

Tähän lääkevalmisteeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti turvallisuutta koskevaa uutta tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä lääkkeen haittavaikutuksista. Ks. kohdasta Haittavaikutukset, miten haittavaikutuksista ilmoitetaan.
Vaikuttavat aineet ja niiden määrät
Yksi injektiopullo sisältää 105 mg sipaglukosidaasi alfaa.
Kunkin injektiopullon käyttökuntoon saattamisen jälkeen (ks. kohta Käyttö- ja käsittelyohjeet) konsentroitu liuos sisältää 15 mg sipaglukosidaasi alfaa* per ml.
*Ihmisen hapan α-glukosidaasi ja bisfosforyloidut N-glykaanit (bis-M6P) on tuotettu kiinanhamsterin munasarjasoluissa (CHO) yhdistelmä-DNA-tekniikalla.
Apuaine(et), joiden vaikutus tunnetaan
Yksi injektiopullo sisältää 10,5 mg natriumia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos (kuiva-aine välikonsentraatiksi)
Kliiniset tiedot
Käyttöaiheet
Pombiliti (sipaglukosidaasi alfa) on pitkäaikainen entsyymikorvaushoito, jota käytetään yhdessä miglustaatin, entsyymitoimintaa vakauttavan aineen, kanssa aikuisten hoitoon, joilla on myöhään alkanut Pompen tauti (happaman α-glukosidaasin [GAA] puutos).
Ehto
Hoito tulee antaa sellaisen lääkärin valvonnassa, jolla on kokemusta Pompen tautia tai muita perinnöllisiä metabolisia tai neuromuskulaarisia tauteja sairastavien potilaiden hoidosta.
Annostus ja antotapa
Hoito on toteutettava Pompen tautia tai muita perinnöllisiä metabolisia tai
neuromuskulaarisia tauteja sairastavien potilaiden hoitoon perehtyneen lääkärin valvonnassa.
Sipaglukosidaasi alfaa on käytettävä yhdessä miglustaatti 65 mg kovien kapseleiden kanssa. Tämän vuoksi ennen sipaglukosidaasi alfan käyttöä on perehdyttävä miglustaatti 65 mg kovien kapseleiden valmisteyhteenvetoon koskien kapseleiden määrää (perustuu painoon), annoksen ottoaikaa ja paastoamista.
Annostus
Suositeltu sipaglukosidaasi alfa ‑annos on 20 mg/kg joka toinen viikko. sipaglukosidaasi alfa -infuusio on aloitettava 1 tunnin kuluttua miglustaattikapseleiden ottamisesta. Jos infuusio viivästyy, infuusio on aloitettava viimeistään 3 tunnin kuluttua miglustaatin ottamisesta.
Kuva 1. Annoksen aikajana
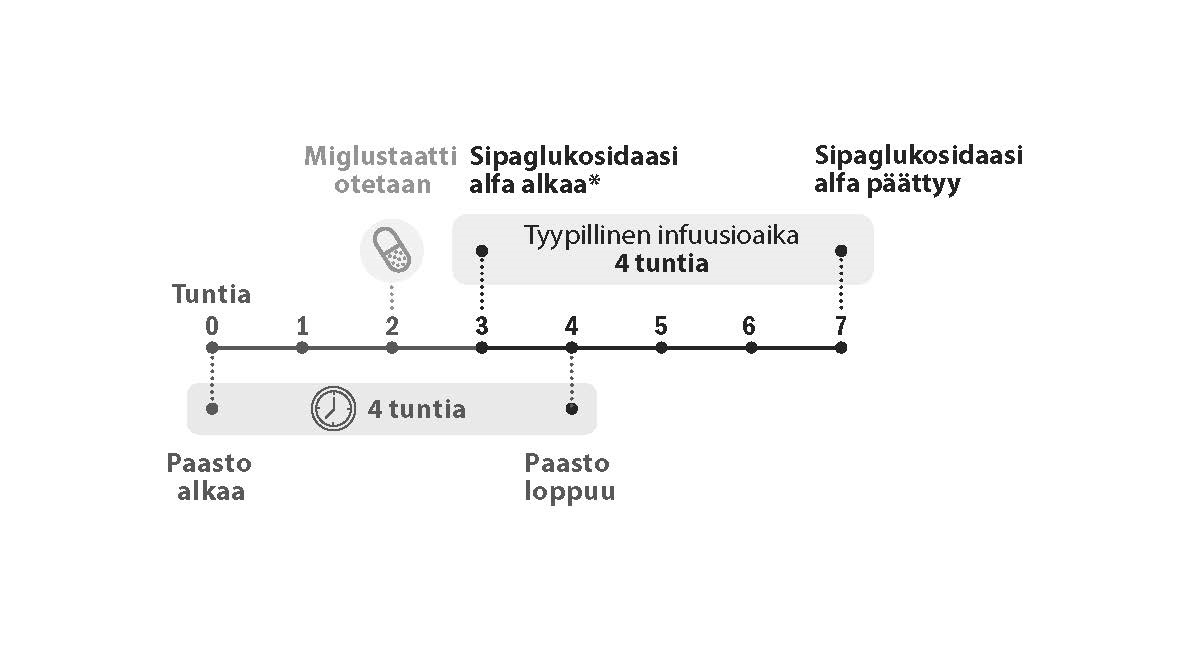
*Sipaglukosidaasi alfa -infuusio on aloitettava 1 tunnin kuluttua miglustaattikapseleiden ottamisesta. Jos infuusio viivästyy, infuusio on aloitettava viimeistään 3 tunnin kuluttua miglustaatin ottamisesta.
Potilaan hoitovaste on arvioitava rutiininomaisesti kaikkien taudin kliinisten ilmentymien kattavan arvioinnin perusteella. Riittämättömän vasteen tai kohtuuttomien turvallisuusriskien tapauksessa on harkittava sipaglukosidaasi alfan ja miglustaattihoidon yhdistelmän käytön lopettamista, ks. kohta Varoitukset ja käyttöön liittyvät varotoimet. Joko molempien lääkevalmisteiden käyttöä on jatkettava tai molempien lääkevalmisteiden käyttö on lopetettava.
Potilaan siirtyminen toisesta entsyymikorvaushoidosta
Jos potilas vaihtaa toisesta entsyymikorvaushoidosta sipaglukosidaasi alfan ja miglustaattihoidon yhdistelmään, hoito sipaglukosidaasi alfan ja miglustaatin yhdistelmällä voidaan aloittaa seuraavana aikataulun mukaisena antoaikana (eli noin 2 viikkoa viimeisimmän entsyymikorvaushoidon antokerran jälkeen).
Potilaita, jotka ovat vaihtaneet toisesta entsyymikorvaushoidosta sipaglukosidaasi alfan ja miglustaattihoidon yhdistelmään, on neuvottava jatkamaan aiemman entsyymikorvaushoidon kanssa mahdollisesti käytettyjen esilääkitysten käyttöä infuusioon liittyvien reaktioiden minimoimiseksi. Siedettävyydestä riippuen esilääkitystä voidaan muuttaa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Väliin jäänyt annos
Jos sipaglukosidaasi alfa ‑infuusiota ei voida aloittaa 3 tunnin kuluessa suun kautta otettavan miglustaatin annosta, sipaglukosidaasi alfan ja miglustaatin yhdistelmähoito on aikataulutettava uudelleen vähintään 24 tunnin päähän miglustaatin ottamisesta. Jos sekä sipaglukosidaasi alfa että miglustaatti jäävät väliin, hoito on toteutettava mahdollisimman pian.
Erityisryhmät
Iäkkäät potilaat
Miglustaattihoitoon yhdistetyn sipaglukosidaasi alfan käytöstä yli 65-vuotiaille potilaille on vain vähän kokemusta. Annoksen muuttaminen ei ole tarpeen iäkkäille potilaille (ks. kohta Farmakokinetiikka).
Munuaisten ja maksan vajaatoiminta
Miglustaattihoitoon yhdistetyn sipaglukosidaasi alfan turvallisuutta ja tehoa ei ole arvioitu munuaisten ja/tai maksan vajaatoimintaa sairastavilla potilailla. Kun hoito annetaan joka toinen viikko, plasman miglustaattialtistuksen suureneminen keskivaikean tai vaikean munuaisten tai maksan vajaatoiminnan seurauksena ei todennäköisesti vaikuta merkittävästi sipaglukosidaasi alfa ‑altistukseen eikä sen odoteta vaikuttavan sipaglukosidaasi alfan tehoon ja turvallisuuteen kliinisesti merkityksellisellä tavalla. Annoksen muuttamista ei tarvita munuaisten vajaatoimintaa sairastavilla potilailla. Sipaglukosidaasi alfan turvallisuutta ja tehoa maksan vajaatoimintaa sairastavilla potilailla ei ole arvioitu eikä näille potilaille voida suositella mitään tiettyä annostusta.
Pediatriset potilaat
Miglustaattihoitoon yhdistetyn sipaglukosidaasi alfan turvallisuutta ja tehoa alle 18 vuoden ikäisten lasten hoidossa ei ole vielä varmistettu. Tietoja ei ole saatavilla.
Antotapa
Sipaglukosidaasi alfa annetaan laskimoinfuusiona.
20 mg/kg:n annoksen infuusio annetaan normaalisti 4 tunnin aikana, jos tämä antonopeus on siedetty. Infuusio on annettava vaiheittain. Suositellaan, että sipaglukosidaasi alfa ‑infuusio aloitetaan nopeudella 1 mg/kg/h. Tätä infuusionopeutta nostetaan asteittain 2 mg/kg/h:lla noin 30 minuutin välein, jos merkkejä infuusioon liittyvistä reaktioista ei ole, kunnes saavutetaan enimmäisinfuusionopeus 7 mg/kg/h. Infuusionopeutta määrittävänä tekijänä ovat potilaan aiemmat kokemukset infuusion aikana. Infuusionopeutta voidaan hidastaa tai infuusio voidaan keskeyttää väliaikaisesti, jos ilmenee lieviä tai keskivaikeita infuusioon liittyviä reaktioita. Vaikea‑asteisen allergisen reaktion, anafylaksin tai vakavien tai vaikea-asteisten infuusioon liittyvien reaktioiden tapauksessa anto on lopetettava välittömästi ja asianmukainen lääketieteellinen hoito on aloitettava (ks. kohdat Vasta-aiheet ja Varoitukset ja käyttöön liittyvät varotoimet).
Kotona annettava infuusio
Sipaglukosidaasi alfan kotona annettavaa infuusiota voidaan harkita potilaille, jotka sietävät infuusionsa hyvin ja joilla ei ole ollut keskivaikeita tai vaikeita infuusioon liittyviä reaktioita muutamaan kuukauteen. Päätös siitä, että potilaan hoito muutetaan kotona toteutettaviksi infuusioiksi, on tehtävä hoitavan lääkärin arvion ja suosituksen myötä. Potilaan samanaikaiset perussairaudet ja kyky noudattaa kotona toteutettavien infuusioiden vaatimuksia on otettava huomioon arvioitaessa potilaan soveltuvuutta kotona toteutettaviin infuusioihin. Seuraavat kriteerit on otettava huomioon:
- Potilaalla ei saa olla samanaikaista meneillään olevaa tilaa, joka voi lääkärin mielestä vaikuttaa potilaan kykyyn sietää infuusiota.
- Potilaan katsotaan olevan lääketieteellisesti vakaa. Kattava arviointi on suoritettava ennen kotona toteutettavien infuusioiden aloittamista.
- Potilaan on täytynyt saada sipaglukosidaasi alfa ‑infuusioita sellaisen lääkärin valvonnassa, jolla on asiantuntemusta Pompen tautia sairastavien potilaiden hoidosta, muutaman kuukauden ajan sairaalassa tai muussa asianmukaisessa avohoidon toimipaikassa. Toistuvasti hyvin siedettyjen infuusioiden dokumentaatio on edellytyksenä kotona toteutettavien infuusioiden aloittamiselle.
- Potilaan on oltava halukas ja kykenevä noudattamaan kotona toteutettavien infuusioiden menettelytapoja.
- Kotona toteutettavien infuusioiden puitteet, resurssit ja menettelyt, mukaan lukien koulutus, on määritettävä ja niiden on oltava terveydenhuollon ammattilaisen saatavilla. Terveydenhuollon ammattilaisen on oltava aina tavoitettavissa kotona toteuttavien infuusioiden aikana ja määrätyn ajan infuusion jälkeen riippuen potilaan sietokyvystä ennen kotona toteuttavien infuusioiden aloittamista.
Jos potilaalla ilmenee haittavaikutuksia kotona toteutettavien infuusioiden aikana, infuusioprosessi on lopetettava välittömästi ja asianmukainen hoito on aloitettava (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Myöhemmät infuusiot voi olla tarpeen toteuttaa sairaalassa tai asianmukaisessa avohoitoympäristössä, kunnes tällaisia haittavaikutuksia ei enää esiinny. Annosta ja infuusionopeutta ei saa muuttaa kysymättä ensin neuvoa hoidosta vastaavalta lääkäriltä.
Käyttökuntoon saatettu valmiste on ennen laimentamista kirkasta tai opaalinhohtoista, väritöntä tai hieman keltaista liuosta. Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet lääkevalmisteen saattamisesta käyttökuntoon ja laimentamisesta ennen lääkkeen antoa.
Vasta-aiheet
Hengenvaarallinen yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille, kun hoidon uudelleen aloittaminen ei ole onnistunut (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset).
Jokin miglustaatin vasta-aihe.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Anafylaksi ja infuusioon liittyvät reaktiot
Joillakin potilailla on esiintynyt vakavaa anafylaksia ja infuusioon liittyviä reaktioita sipaglukosidaasi alfa ‑infuusion aikana ja ‑infuusion jälkeen, ks. kohta Haittavaikutukset. Aiemman entsyymikorvaushoidon yhteydessä ilmenneiden infuusioon liittyvien reaktioiden oireiden ja löydösten lievittämiseksi voidaan antaa esilääkitystä suun kautta otettavalla antihistamiinilla, antipyreeteillä ja/tai kortikosteroideilla. Infuusionopeuden hidastamista, infuusion väliaikaista keskeytystä, oireenmukaista hoitoa suun kautta otettavalla antihistamiinilla tai antipyreeteillä sekä asianmukaisia elvytystoimenpiteitä on harkittava vakavien infuusioon liittyvien reaktioiden hallitsemiseksi. Lieviä tai keskivaikeita ja ohimeneviä infuusioon liittyviä reaktioita voidaan hallita riittävästi hidastamalla infuusionopeutta tai keskeyttämällä infuusio; lääkehoito tai sipaglukosidaasi alfan käytön lopettaminen ei välttämättä ole tarpeen.
Jos anafylaksia tai vaikea-asteisia allergisia reaktioita ilmenee, infuusio on keskeytettävä välittömästi ja asianmukainen hoito on aloitettava. Tämänhetkisiä anafylaktisten reaktioiden kiireelliseen hoitoon liittyviä lääketieteellisiä standardeja on noudatettava, ja kardiopulmonaalisen elvytyksen välineiden on oltava helposti saatavilla. Sipaglukosidaasi alfan uudelleenannon riskejä ja hyötyjä anafylaksin tai vaikea-asteisen allergisen reaktion jälkeen on harkittava huolellisesti, ja asianmukaisten elvytystoimenpiteiden on oltava saatavilla, jos päätös lääkkeen uudelleenannosta tehdään. Jos potilaalla ilmenee anafylaksia tai vaikea-asteisia allergisia reaktioita kotiympäristössä ja jos potilas jatkaa hoitoa, seuraavat infuusiot on annettava kliinisessä ympäristössä, jossa on valmius tällaisten lääketieteellisten hätätilanteiden hoitamiseen.
Akuutin kardiorespiratorisen vajaatoiminnan riski sille alttiilla potilailla
Potilailla, joilla on akuutti taustalla oleva hengitystiesairaus tai heikentynyt sydämen ja/tai hengityselinten toiminta, voi olla sydämen tai hengityselinten toiminnanvajauksen pahenemisen riski infuusioiden aikana. Asianmukaisten lääketieteellisten tuki- ja seurantatoimenpiteiden on oltava helposti toteutettavissa sipaglukosidaasi alfa ‑infuusion aikana.
Immuunikompleksiin liittyvät reaktiot
Immuunikompleksiin liittyviä reaktioita on raportoitu muiden entsyymikorvaushoitojen yhteydessä potilailla, joilla oli korkeat IgG-vasta-ainetitterit, mukaan lukien vaikea-asteiset ihoreaktiot ja nefroottinen oireyhtymä. Mahdollista luokkavaikutusta ei voi poissulkea. Potilaita on seurattava systeemisten immuunikompleksiin liittyvien reaktioiden kliinisten oireiden ja löydösten varalta, kun he saavat sipaglukosidaasi alfaa yhdessä miglustaatin kanssa. Jos immuunikompleksiin liittyviä reaktioita ilmenee, on harkittava sipaglukosidaasi alfan käytön lopettamista ja asianmukainen lääketieteellinen hoito tulee aloittaa. Sipaglukosidaasi alfan uudelleenannon riskejä ja hyötyjä immuunikompleksiin liittyvän reaktion jälkeen on arvioitava uudelleen jokaisen yksittäisen potilaan kohdalla.
Natrium
Tämä lääkevalmiste sisältää 10,5 mg natriumia per injektiopullo, joka vastaa 0,52 % WHO:n suosittelemasta natriumin 2 g:n päivittäisestä enimmäissaannista aikuisille.
Yhteisvaikutukset
Yhteisvaikutustutkimuksia ei ole tehty pelkän sipaglukosidaasi alfan eikä sipaglukosidaasi alfan ja miglustaatin yhdistelmän käyttöön liittyen. Koska sipaglukosidaasi alfa on rekombinantti ihmisen proteiini, se on epätodennäköinen kandidaatti sytokromi P450- tai P-gP-välitteisiin yhteisvaikutuksiin muiden lääkevalmisteiden kanssa.
Raskaus ja imetys
Ehkäisy naisilla
Naisten, jotka voivat tulla raskaaksi, on käytettävä luotettavia ehkäisymenetelmiä sipaglukosidaasi alfan ja miglustaatin yhdistelmähoidon aikana sekä 4 viikon ajan hoidon päättymisen jälkeen (ks. kohta Prekliiniset tiedot turvallisuudesta). Lääkevalmisteen käyttöä ei suositella sellaisten naisten hoitoon, jotka voivat tulla raskaaksi ja jotka eivät käytä luotettavaa ehkäisyä.
Raskaus
Ei ole olemassa kliinisiä tietoja sipaglukosidaasi alfan käytöstä yhdessä miglustaatin kanssa raskaana oleville naisille. Pelkkää miglustaattia sekä sipaglukosidaasi alfan ja miglustaatin yhdistelmää koskeneissa eläinkokeissa on havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta). Sipaglukosidaasi alfan ja miglustaattihoidon yhdistelmän käyttöä ei suositella raskauden aikana.
Imetys
Ei tiedetä, erittyvätkö sipaglukosidaasi alfa ja miglustaatti ihmisen rintamaitoon. Olemassa olevat farmakodynaamiset/toksikologiset tiedot koe-eläimistä ovat osoittaneet miglustaatin sekä sipaglukosidaasi alfan erittyvän rintamaitoon (ks. kohta Prekliiniset tiedot turvallisuudesta). Vastasyntyneeseen/Imeväiseen kohdistuvia riskejä ei voida poissulkea. On päätettävä, lopetetaanko rintaruokinta vai lopetetaanko sipaglukosidaasi alfan ja miglustaatin yhdistelmähoito ottaen huomioon rintaruokinnasta aiheutuvat hyödyt lapselle ja hoidosta koituvat hyödyt äidille.
Hedelmällisyys
Ei ole olemassa kliinisiä tietoja pelkän sipaglukosidaasi alfan tai sipaglukosidaasi alfan ja miglustaatin yhdistelmän vaikutuksista hedelmällisyyteen.
Urospuolisila rotilla ei havaittu vaikutusta spermatogeneesiin, kun niille annettiin sipaglukosidaasi alfaa yhdessä miglustaatin kanssa tai pelkästään sipaglukosidaasi alfaa.
Naaraspuolisilla rotilla havaittiin preimplantaatiotappioiden lisääntymistä, kun niille annettiin sipaglukosidaasi alfaa yhdessä miglustaatin kanssa tai pelkästään miglustaattia (ks. Kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Sipaglukosidaasi alfalla on vähäinen vaikutus ajokykyyn ja koneidenkäyttökykyyn, koska haittavaikutuksina on raportoitu heitehuimausta, hypotensiota ja uneliaisuutta. Varovaisuutta on noudatettava ajettaessa autoa tai käytettäessä työkaluja tai koneita sipaglukosidaasi alfan saamisen jälkeen.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Yleisimmin ilmoitetut haittavaikutukset, joiden voidaan katsoa johtuneen vain sipaglukosidaasi alfasta, olivat heitehuimaus (2,6 %), punoitus (2,0 %), uneliaisuus (2,0 %), epämukava tunne rinnassa (1,3 %), yskä (1,3 %), infuusiokohdan turvotus (1,3 %) ja kipu (1,3 %).
Ilmoitettuja vakavia haittavaikutuksia, joiden voidaan katsoa johtuneen vain sipaglukosidaasi alfasta, olivat nielun turvotus (0,7 %), presynkopee (0,7 %), kuume (0,7 %), vilunväristykset (0,7 %), hengenahdistus (0,7 %) ja hengityksen vinkuminen (0,7 %).
Haittavaikutustaulukko
Haittavaikutusten arviointiin saatiin tietoja tutkittavista, joita hoidettiin sipaglukosidaasi alfan ja miglustaattihoidon yhdistelmällä, kolmen kliinisen tutkimuksen yhdistetystä turvallisuusanalyysistä. Altistuksen keskimääräinen kokonaiskesto oli 28,0 kuukautta.
Taulukossa 1 on lueteltu haittavaikutukset MedDRA-elinjärjestelmäluokan perusteella jaoteltuina. Esiintymistiheydet on määritelty seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000) ja tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Taulukko 1: Yhteenveto haittavaikutuksista sipaglukosidaasi alfaa saaneilla potilailla
Elinjärjestelmäluokka (SOC) | Esiintymistiheys | Haittavaikutus (suositeltu termi) |
Immuunijärjestelmä | Yleinen | Anafylaktinen reaktio‡1 |
Melko harvinainen | Yliherkkyys | |
Hermosto | Hyvin yleinen | Päänsärky |
Yleinen | Heitehuimaus*, vapina, uneliaisuus*, dysgeusia, parestesia | |
Melko harvinainen | Tasapainohäiriö, polttava tunne*, migreeni4, presynkopee* | |
Sydän | Yleinen | Takykardia6 |
Verisuonisto | Yleinen | Punoitus*, hypotensio |
Melko harvinainen | Kalpeus | |
Hengityselimet, rintakehä ja välikarsina | Yleinen | Hengenahdistus, yskä* |
Melko harvinainen | Astma, epämukava tunne suunielussa*, nielun turvotus*, hengityksen vinkuminen* | |
Ruoansulatuselimistö | Yleinen | Ripuli, pahoinvointi, vatsakipu7, ilmavaivat, vatsan pullotus, oksentelu |
Melko harvinainen | Dyspepsia*, ruokatorven kipu*, ruokatorven spasmi, epämukava tunne suussa*, suun kipu, kielen turvotus* | |
Iho ja ihonalainen kudos | Yleinen | Urtikaria3, ihottuma2, kutina, hyperhidroosi |
Melko harvinainen | Ihon värimuutokset, ihon turvotus* | |
Luusto, lihakset ja sidekudos | Yleinen | Lihaskouristukset, lihaskipu, nivelkipu, lihasheikkous |
Melko harvinainen | Kylkikipu, lihasväsymys, muskuloskeletaalinen jäykkyys | |
Yleisoireet ja antopaikassa todettavat haitat | Yleinen | Väsymys/uupumus, kuume, vilunväristykset, epämukava tunne rinnassa*, infuusiokohdan turvotus*, kipu*, perifeerinen turvotus |
Melko harvinainen | Astenia, kasvokipu, infuusiokohdan kipu*, huonovointisuus*, ei-sydänperäinen rintakipu, kasvojen turvotus* | |
Tutkimukset | Yleinen | Kohonnut verenpaine5 |
Melko harvinainen | Kehon lämpötilan vaihtelu*, lymfosyyttien määrän väheneminen | |
Vammat, myrkytykset ja hoitokomplikaatiot | Melko harvinainen | Ihon abraasio* |
* Raportoitu vain sipaglukosidaasi alfan käytön yhteydessä
‡ Ks. jäljempänä kohta ”Infuusioon liittyvät reaktiot”.
1 Anafylaksi, anafylaktinen reaktio ja anafylaktoidinen reaktio on ryhmitelty anafylaktisen reaktion alle.
2 Ihottuma, punoittava ihottuma ja makulaarinen ihottuma on ryhmitelty ihottuman alle.
3 Urtikaria, urtikariaihottuma ja mekaaninen urtikaria on ryhmitelty urtikarian alle.
4 Migreeni ja aurallinen migreeni on ryhmitelty migreenin alle.
5 Hypertensio ja kohonnut verenpaine on ryhmitelty kohonneen verenpaineen alle.
6 Takykardia ja sinustakykardia on ryhmitelty takykardian alle.
7 Vatsakipu, ylävatsakipu ja alavatsakipu on ryhmitelty vatsakivun alle.
Valikoitujen haittavaikutusten kuvaukset
Infuusioon liittyvät reaktiot
Vaiheen 3 tutkimuksessa sipaglukosidaasi alfa ‑infuusion aikana tai 2 tunnin kuluessa tämän infuusion päättymisestä raportoitiin seuraavia infuusioon liittyviä reaktioita: vatsan pullotus, vilunväristykset, kuume, heitehuimaus, dysgeusia, hengenahdistus, kutina, ihottuma ja punoitus.
0,7 %:lla sipaglukosidaasi alfaa ja miglustaattia saaneista potilaista ilmeni vakavana haittavaikutuksena anafylaksi (tunnuspiirteinä yleistynyt kutina, hengenahdistus ja hypotensio) vaiheen 3 tutkimuksen aikana. 1,3 % sipaglukosidaasi alfaa ja miglustaattia saaneista potilaista lopetti hoidon infuusioon liittyvän reaktion (anafylaksin ja vilunväristysten) vuoksi. Useimmat infuusioon liittyvät reaktiot olivat vaikeusasteeltaan lieviä tai keskivaikeita ja luonteeltaan ohimeneviä.
Immunogeenisuus
Vaiheen 3 tutkimuksessa niiden aiempaa entsyymikorvaushoitoa saamattomien sipaglukosidaasi alfalla hoidettujen tutkittavien prosenttiosuus, joilla todettiin positiivinen tulos spesifisten rhGAA‑vasta-aineiden osalta ja havaittavia tittereitä, nousi lähtötilanteen 0 %:sta 87,5 %:iin viimeisellä tutkimuskäynnillä. Niiden entsyymikorvaushoitoa aiemmin saaneiden sipaglukosidaasi alfalla hoidettujen tutkittavien prosenttiosuus, joilla oli positiivinen tulos spesifisten rhGAA‑vasta‑aineiden osalta ja havaittavia tittereitä, pysyi vakaana (lähtötilanteessa 83,1 % ja viimeisellä tutkimuskäynnillä 74,1 %).
Suurimmalla osalla entsyymikorvaushoitoa aiemmin saaneista ja entsyymikorvaushoitoa aiemmin saamattomista tutkittavista, joita hoidettiin sipaglukosidaasi alfalla, oli hoidon jälkeen positiivinen tulos neutraloivien vasta-aineiden (Nab) osalta. Entsyymiaktiivisuutta estävien neutraloivien vasta‑aineiden ilmaantuvuus oli sipaglukosidaasi alfalla hoidetuilla tutkittavilla samaa luokkaa kuin alglukosidaasi alfalla hoidetuilla tutkittavilla.
Tutkittavat, joilla oli hoidon jälkeinen infuusioon liittyvä reaktio, testattiin rhGAA IgE (immunoglobuliini E) ‑vasta-aineiden osalta infuusion liittyvän reaktion jälkeen. Infuusioon liittyvien reaktioiden esiintymisessä ei ollut selkeää trendiä rhGAA IgE ‑vasta-aineiden ilmaantuvuuden tai rhGAA‑vasta-aineiden kokonaismäärän osalta.
Yleisesti ottaen immunogeenisuuden ja turvallisuuden, farmakokinetiikan tai farmakodynaamisten vaikutusten välillä ei ollut ilmeistä yhteyttä. Potilaita on kuitenkin seurattava systeemiseen immuunikompleksiin liittyvien reaktioiden oireiden ja löydösten varalta, ks. kohta Varoitukset ja käyttöön liittyvät varotoimet.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Yli 20 mg/kg:n sipaglukosidaasi alfa ‑annoksia ei ole tutkittu, eikä sellaista tahatonta yliannostusta ole havaittu, josta saataisiin yliannostuksen hoitoa koskevia tietoja. Ks. tiedot haittavaikutusten hoidosta kohdista Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: muut ruuansulatuselimistön sairauksien ja aineenvaihduntasairauksien lääkkeet, entsyymit, ATC-koodi: A16AB23
Vaikutusmekanismi
Pompen taudin aiheuttaa glykogeenin glukoosiksi lysosomissa hajottavan happaman alfaglukosidaasin (GAA) puutos. Sipaglukosidaasi alfa on tarkoitettu korvaamaan puuttuva tai heikentynyt endogeeninen entsyymi.
Sipaglukosidaasi alfa stabiloituu miglustaatin avulla, joka minimoi entsyymiaktiivisuuden menetyksen veressä tämän hydrolyyttisen glykogeenispesifisen entsyymin infuusion aikana. Entsyymiin on lisätty bis‑M6P‑N‑glykaaneja korkean affiniteetin kationista riippumattomaan mannoosi‑6‑fosfaattireseptoriin (CI‑MPR) sitoutumista varten. Sitoutumisen jälkeen se viedään lysosomin sisään, jossa se käy läpi proteolyyttisen pilkkoutumisen ja N‑glykaanitrimmauksen, joita molempia tarvitaan tuottamaan kaikkein kypsin ja aktiivisin GAA‑entsyymin muoto. Sen jälkeen sipaglukosidaasi alfa toteuttaa entsymaattista aktiivisuutta pilkkomalla glykogeenia ja vähentämällä lihaksensisäistä glykogeenia ja lievittää kudosvaurioita.
Kliininen teho ja turvallisuus
52 viikon pituinen vaiheen 3 satunnaistettu, kaksoissokkoutettu, aktiivikontrolloitu, kansainvälinen, kliininen monikeskustutkimus toteutettiin aikuisilla (≥ 18-vuotiailla) tutkittavilla, joilla oli diagnosoitu Pompen tauti. Tutkittavat satunnaistettiin suhteessa 2:1 saamaan 20 mg/kg sipaglukosidaasi alfaa yhdessä tutkittavan painon perusteella määräytyneen 195 mg:n tai 260 mg:n miglustaattiannoksen kanssa tai 20 mg/kg sipaglukosidaasi alfaa yhdessä lumelääkkeen kanssa joka toinen viikko 52 viikon ajan. Tehopopulaatioon kuului yhteensä 122 tutkittavaa, joista 95 tutkittavaa oli saanut aiemmin alglukosidaasi alfaa sisältävää entsyymikorvaushoitoa (entsyymikorvaushoitoa aiemmin saaneet) ja 27 tutkittavaa ei ollut koskaan saanut entsyymikorvaushoitoa (entsyymikorvaushoitoa aiemmin saamattomat).
Demografiset ominaisuudet, lähtötilanteen 6 minuutin kävelymatka (6MWD) ja prosenttimääräinen ennustettu nopea vitaalikapasiteetti (FVC) istuma‑asennossa olivat yleisesti ottaen samanlaisia kahdessa hoitohaarassa, ks. taulukko 2. Yli kaksi kolmasosaa (67 %) entsyymikorvaushoitoa saaneista tutkittavista oli saanut entsyymikorvaushoitoa yli 5 vuoden ajan ennen vaiheen 3 tutkimukseen osallistumista (keskiarvo 7,4 vuotta).
Taulukko 2: Tutkittavien demografiset tiedot ja lähtötilanteen ominaisuudet
| Lähtötilanteen ominaisuudet | Sipaglukosidaasi alfa yhdessä miglustaatin kanssa n = 85 | Alglukosidaasi alfa yhdessä lumelääkkeen kanssa n = 37 |
Ikä tietoon perustuvan suostumuksen antohetkellä (vuotta), keskiarvo (SD) | 47,6 (13,3) | 45,4 (13,4) |
| Miessukupuoli, n % | 36 (42,4) | 19 (51,4) |
| Paino (kg), keskiarvo (SD) | 72,8 (14,7) | 79,4 (25,0) |
| ERT-hoitoa aiemmin saaneet, n (%) | 65 (76,5) | 30 (81,1) |
| Ikä ensimmäisen ERT-hoidon annoksen kohdalla (vuotta), keskiarvo (SD) | 40,8 (12,7) | 38,7 (15,1) |
| 6MWD (m), keskiarvo (SD) | 357,9 (111,8) | 351,0 (121,3) |
| %‑määräinen FVC istuma‑asennossa, keskiarvo (SD) | 70,7 (19,6) | 69,7 (21,5) |
6MWD = 6 minuutin kävelymatka; ERT-hoito = entsyymikorvaushoito; FVC = prosenttimääräinen ennustettu nopea vitaalikapasiteetti istuma‑asennossa; SD = keskihajonta
Keskeisiä tehon päätetapahtumia olivat 6MWD-kävelytesti (ensisijainen päätetapahtuma) ja prosenttimääräinen ennustettu nopea vitaalikapasiteetti istuma‑asennossa. Tärkeimmät farmakodynaamiset päätetapahtumat olivat seerumin kreatiinikinaasi ja virtsan glukoositetrasakkaridit (Hex‑4).
Motoriset toiminnot
6 minuutin kävelymatka (6MWD) 52 viikon kohdalla
Kaikkien sipaglukosidaasi alfan ja miglustaattihoidon yhdistelmällä hoidettujen tutkittavien (entsyymikorvaushoitoa aiemmin saaneiden ja entsyymikorvaushoitoa aiemmin saamattomien) kävelymatka piteni keskimäärin 20,0 metriä lähtötilanteeseen nähden verrattuna alglukosidaasi alfan ja lumelääkkeen yhdistelmällä hoidettuihin, joiden kävelymatka piteni keskimäärin 8,3 metriä. Tämä osoittaa, että sipaglukosidaasi alfan ja miglustaattihoidon yhdistelmän hoitovaikutus oli 11,7 metriä (95 %:n luottamusväli [−1,0, 24,4]; p = 0,07) (taulukko 3).
Entsyymikorvaushoitoa aiemmin saaneilla tutkittavilla, joita hoidettiin sipaglukosidaasi alfan ja miglustaattihoidon yhdistelmällä (n = 65), kävelymatka piteni keskimäärin 15,8 metriä lähtötilanteesta verrattuna alglukosidaasi alfan ja lumelääkkeen yhdistelmän (n = 30) keskimääräiseen 0,9 metrin pitenemään. Tämä osoittaa, että sipaglukosidaasi alfan ja miglustaattihoidon yhdistelmän hoitovaikutus oli 14,9 metriä (95 %:n luottamusväli [1,2, 28,6] ).
Entsyymikorvaushoitoa aiemmin saamattomilla tutkittavilla, joita hoidettiin sipaglukosidaasi alfan ja miglustaattihoidon yhdistelmällä (n = 20), kävelymatka piteni keskimäärin 28,5 metriä lähtötilanteesta verrattuna alglukosidaasi alfan ja lumelääkkeen yhdistelmän (n = 7) keskimääräiseen 52,7 metrin pitenemään. Tämä osoittaa, että sipaglukosidaasi alfan ja miglustaattihoidon yhdistelmän hoitovaikutus oli −24,2 metriä (95 %:n luottamusväli [−60,0, 11,7]).
Taulukko 3: Yhteenveto 6MWD-testin tuloksista kaikilla tutkittavilla 52 viikon kohdalla
| 6MWD (metriä) | Sipaglukosidaasi alfa yhdessä miglustaatin kanssa | Alglukosidaasi alfa yhdessä lumelääkkeen kanssa |
Lähtötilanne n Keskiarvo (SD) Mediaani |
n = 85 357,9 (111,8) 359,5 |
n = 37 351,0 (121,3) 365,5 |
Muutos lähtötilanteeseen nähden viikon 52 kohdalla n Keskiarvo (SD) (95 %:n luottamusväli) |
n = 85 20,0 (3,5) (13,1; 26,9) |
n = 37 8,3 (5,3) (−2,2; 18,8) |
Muutos viikkoon 52 mennessä Keskiarvojen ero (SE) (95 %:n luottamusväli) 2-suuntainen p-arvo |
11,7 (6,4) (−1,0; 24,4) p = 0,07* | |
SD = keskihajonta; SE = keskivirhe
Raportoidut tiedot perustuvat toistomittausten sekamallin (MMRM) analyysiin ja todelliseen arviointien ajankohtaan (ITT‑OBS-populaatio), lukuun ottamatta ITT-populaation poikkeavia tietoja.
* Ensisijaisessa päätetapahtumassa ei saavutettu paremmuutta.
Keuhkojen toiminta
Prosenttimääräinen ennustettu FVC istuma‑asennossa 52 viikon kohdalla
Kaikkien sipaglukosidaasi alfan ja miglustaattihoidon yhdistelmällä hoidettujen tutkittavien (aiemmin entsyymikorvaushoitoa saaneiden ja aiemmin entsyymikorvaushoitoa saamattomien) FVC-arvossa havaittiin keskimäärin −1,4 %:n muutos lähtötilanteeseen nähden verrattuna alglukosidaasi alfan ja lumelääkkeen yhdistelmällä hoidettujen tutkittavien −3,7 %:n muutokseen. Tämä osoittaa sipaglukosidaasi alfan ja miglustaatin yhdistelmän hoitovaikutuksen olevan 2,3 % (95 %:n luottamusväli [0,2, 4,4]) (taulukko 4).
Sipaglukosidaasi alfan ja miglustaattihoidon yhdistelmällä hoidettujen, aiemmin entsyymikorvaushoitoa saaneiden tutkittavien (n = 65) FVC-arvossa havaittiin keskimäärin −0,2 %:n muutos lähtötilanteeseen nähden, kun taas alglukosidaasi alfan ja lumelääkkeen yhdistelmällä hoidetuilla tutkittavilla (n = 30) keskimääräinen muutos oli −3,8 %. Tämä osoittaa sipaglukosidaasi alfan ja miglustaatin yhdistelmän hoitovaikutuksen olevan 3,6 % (95 %:n luottamusväli [1,3, 5,9]).
Sipaglukosidaasi alfan ja miglustaattihoidon yhdistelmällä hoidettujen, aiemmin entsyymikorvaushoitoa saamattomien tutkittavien (n = 20) FVC-arvossa havaittiin keskimäärin −5,2 %:n muutos lähtötilanteeseen nähden, kun taas alglukosidaasi alfan ja lumelääkkeen yhdistelmällä hoidetuilla tutkittavilla (n = 7) keskimääräinen muutos oli −2,4 %. Tämä osoittaa heikentymisen nopeuden olleen samanlaista molemmissa ryhmissä –2,8 %:n ero; 95 %:n luottamusväli (–7,8, 2,3).
Taulukko 4: Yhteenveto prosenttimääräisestä ennustetusta nopeasta vitaalikapasiteetista kaikilla tutkittavilla 52 viikon kohdalla
| Prosenttimääräinen ennustettu FVC istuma‑asennossa | Sipaglukosidaasi alfa yhdessä miglustaatin kanssa | Alglukosidaasi alfa yhdessä lumelääkkeen kanssa |
Lähtötilanne n Keskiarvo (SD) Mediaani |
n = 85 70,7 (19,6) 70,0 |
n = 37 69,7 (21,5) 71,0 |
Muutos lähtötilanteeseen nähden viikon 52 kohdalla n Keskiarvo (SD) (95 %:n luottamusväli) |
n = 85 −1,4 (0,6) (−2,5; −0,3) |
n = 37 −3,7 (0,9) (−5,4; −2,0) |
Muutos viikkoon 52 mennessä Keskiarvojen ero (SE) (95 %:n luottamusväli) | 2,3 (1,1) (0,2; 4,4) | |
SD = keskihajonta; SE = keskivirhe
Raportoidut tiedot perustuvat toistomittausten sekamallin (MMRM) analyysiin ja todelliseen arviointien ajankohtaan (ITT‑OBS-populaatio), lukuun ottamatta ITT-populaation poikkeavia tietoja.
Toissijaiset päätetapahtumat
Toissijaisten päätetapahtumien kohdalla havaitut vaikutukset tukivat 6MWD-testistä ja istuma‑asennon prosenttimääräisestä ennustetusta FVC‑arvosta tehtyjä johtopäätöksiä.
Tutkittavilla, joita hoidettiin sipaglukosidaasi alfan (20 mg/kg) ja entsyymitoimintaa vakauttavan miglustaatin yhdistelmällä joka toinen viikko, kreatiinikinaasipitoisuus väheni keskimäärin −22,4 % verrattuna alglukosidaasi alfan ja lumelääkkeen yhdistelmällä hoidettujen tutkittavien keskimääräiseen +15,6 %:n lisääntymiseen. Hex‑4-pitoisuus väheni keskimäärin −31,5 % verrattuna alglukosidaasi alfan ja lumelääkkeen yhdistelmällä hoidettujen tutkittavien keskimääräiseen +11,0 %:n lisääntymiseen 52 viikon jälkeen.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt lykkäyksen velvoitteelle toimittaa tutkimustulokset sipaglukosidaasi alfan käytöstä tyypin II glykogeenikertymäsairauden (Pompen tauti) hoidossa yhdessä tai useammassa pediatrisessa potilasryhmässä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Imeytyminen
Sipaglukosidaasi alfaa arvioitiin miglustaatin kanssa ja ilman sitä 11 liikuntakykyisellä entsyymikorvaushoitoa aiemmin saaneella potilaalla, joilla oli myöhään alkanut Pompen tauti (LOPD). Sipaglukosidaasi alfan huippupitoisuudet saavutettiin suunnilleen 4 tunnin pituisen laskimoinfuusion lopussa ja pitoisuudet vähenivät kaksivaiheisesti 24 tuntiin saakka infuusion aloittamisesta lukien.
Taulukko 5: Farmakokineettinen yhteenveto kliinisellä annoksella
| Farmakokineettinen parametri | Sipaglukosidaasi alfa 20 mg/kg yhdessä miglustaatin 260 mg kanssa | Sipaglukosidaasi alfa20 mg/kg |
| Cmax (mikrog/ml) | 345 (18,5) | 325 (13,5) |
| AUC0-∞ (mikrog*h/ml) | 1 812 (20,8) | 1 410 (15,9) |
AUC0‐∞= aika-pitoisuuskäyrän alle jäävä alue ajalla 0 – ääretön; Cmax = suurin havaittu pitoisuus plasmassa
Jakautuminen
Sipaglukosidaasi alfan ei odoteta sitoutuvan plasman proteiineihin. Sipaglukosidaasi alfan keskimääräinen jakautumistilavuus oli 2,0–4,7 l. Jakautumisen puoliintumisaika piteni 48 % sipaglukosidaasi alfan ja miglustaatin yhteiskäytön jälkeen. Vastaavasti plasmapuhdistuma väheni 27 %.
Kun 260 mg:n miglustaattikerta-annos annettiin yhdessä 20 mg/kg:n sipaglukosidaasi alfa ‑annoksen kanssa paastoaville Pompen tautia sairastaville aikuisille vaiheen 1/2 tutkimuksessa, kokonais-GAA-proteiinin osittainen AUCtmax–24h-arvo (aika enimmäispitoisuudesta infuusion lopussa 24 tuntiin infuusion aloittamisen jälkeen) suureni 44 % verrattuna pelkkään 20 mg/kg:n sipaglukosidaasi alfa ‑annokseen.
Sipaglukosidaasi alfa ei ylitä veri-aivoestettä.
Eliminaatio
Sipaglukosidaasi alfa eliminoituu pääasiassa maksassa proteolyyttisellä hydrolyysillä. Sipaglukosidaasi alfan terminaalisen eliminaation keskimääräinen puoliintumisaika oli 1,6–2,6 tuntia.
Erityisryhmät
Sukupuoli, iäkkäät ja rotu/ etninen alkuperä
Yhdistetyn populaatiofarmakokineettisen analyysin perusteella sukupuolella, iällä (18–74 vuotta) ja rodulla/ etnisellä alkuperällä ei ollut kliinisesti merkittävää vaikutusta sipaglukosidaasi alfan ja miglustaatin yhdistelmän altistukseen. Niistä potilaista, joita hoidettiin sipaglukosidaasi alfalla yhdessä miglustaatin kanssa kliinisissä LOPD-tutkimuksissa, 17 (11 %) oli 65–74‑vuotiaita, eikä kukaan ollut täyttänyt 75:tä vuotta.
Maksan vajaatoiminta
Miglustaattihoitoon yhdistetyn sipaglukosidaasi alfan farmakokinetiikkaa ei ole arvioitu maksan vajaatoimintaa sairastavilla potilailla.
Munuaisten vajaatoiminta
Sipaglukosidaasi alfan ja miglustaattihoidon yhdistelmästä ei ole tehty tutkimuksia tutkittavilla, joilla on munuaisten vajaatoiminta. Munuaisten vajaatoiminta ei todennäköisesti vaikuta sipaglukosidaasi alfan kertymiseen.
Prekliiniset tiedot turvallisuudesta
Sipaglukosidaasi alfan farmakologista turvallisuutta, kerta-annoksen ja toistuvan altistuksen aiheuttamaa toksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Lisääntymis- ja kehitystoksisuus
Miglustaattihoitoon yhdistetyllä sipaglukosidaasi alfalla tai pelkästään sipaglukosidaasi alfalla ei ollut vaikutusta spermatogeneesiin urospuolisilla rotilla tehdyn tutkimuksen segmentissä I.
Segmentin I rotilla tehdyn hedelmällisyyden ja varhaisen alkionkehityksen tutkimuksen naaraiden hedelmällisyysosiossa havaittiin preimplantaatiotappioita sekä pelkästään miglustaattia että yhdistelmähoitoa käyttävässä ryhmässä, minkä katsottiin johtuvan miglustaatista. Yhdistelmähoidossa suurimman suositellun ihmisen annoksen (MRHD) -marginaalit olivat sipaglukosidaasi alfan osalta 27-kertaiset ja miglustaatin osalta 4-kertaiset plasman AUC-altistuksen perusteella.
Segmentin II alkioiden ja sikiöiden kehitystutkimuksessa ei havaittu suoraan sipaglukosidaasi alfasta tai miglustaatista johtuvia haitallisia löydöksiä tiineillä rotilla eikä niiden jälkeläisillä
Kaneilla tehdyssä alkion ja sikiön kehitystutkimuksessa havaittiin ilmeisiä emoon kohdistuvia vaikutuksia, kuten vähentynyttä ravinnon kulutusta ja painon lisääntymistä sekä pelkkää miglustaattia että yhdistelmähoitoa saaneessa ryhmässä.
Nämä tulokset osoittavat, että sipaglukosidaasi alfan ja miglustaatin yhdistelmä johti kardiovaskulaaristen epämuodostumien (umpeutunut keuhkovaltimorunko, kammioväliseinän aukko ja laajentunut aortankaari) lisääntymiseen kaneilla, kun sipaglukosidaasi alfa ‑annos oli 16 kertaa ja miglustaattiannos 3 kertaa MRHD pohjautuen yhteen annokseen tai sipaglukosidaasi alfa ‑annos 112 kertaa ja miglustaattiannos 21 kertaa MRHD kumulatiivisella annostuksella. Ei kuitenkaan voida sulkea pois mahdollisuutta, että kaneilla havaitut alkion ja sikiön haittavaikutukset olisivat seurausta yksittäisestä yhdistelmälle altistuksesta. Yhdistelmäryhmälle ei voitu määrittää korkeinta havaittavia haittavaikutuksia aiheuttamatonta tasoa (NOAEL), koska yhdistelmäaltistusta testattiin vain yhdellä annoksella.
Rotilla tehdyssä segmentin III pre- ja postnataalisen kehityksen tutkimuksessa ei havaittu haitallisia emojen ja poikasten kehitysvaikutuksia, jotka olisivat suoraan johtuneet sipaglukosidaasi alfasta tai miglustaatista. Maidon arviointi yhdistelmähoitoryhmässä olevilla rotilla osoitti miglustaatin eritystä ja sipaglukosidaasin erittymistä rotan maitoon. 2,5 tuntia annoksen jälkeen rotan maidon ja plasman sipaglukosidaasi alfa ‑altistusten suhde oli 0,038.
Farmaseuttiset tiedot
Apuaineet
Natriumsitraattidihydraatti (E331), Sitruunahappomonohydraatti (E330), Mannitoli (E421), Polysorbaatti 80 (E433)
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
Avaamaton pakkaus
3 vuotta
Käyttökuntoon saatettu lääkevalmiste
Käyttökuntoon saattamisen jälkeen kemiallinen, fysikaalinen ja mikrobiologinen stabiilius käytössä on osoitettu 24 tunnin ajan lämpötilassa 2 °C – 8 °C.
Mikrobiologiselta kannalta käyttökuntoon saatettu valmiste on käytettävä heti. Jos sitä ei laimenneta heti, käytön aikainen säilytysaika ja olosuhteet ennen laimennusta ovat käyttäjän vastuulla eivätkä ne normaalisti ylittäisi 24:ää tuntia 2 °C – 8 °C:ssa.
Laimennettu lääkevalmiste
Käyttökuntoon saattamisen jälkeen tehdyn laimennuksen jälkeen kemiallinen, fysikaalinen ja mikrobiologinen stabiilius käytössä on osoitettu välillä 0,5 mg/ml – 4 mg/ml 24 tunnin ajan 2 °C – 8 °C:ssa, jota seuraa 6 tuntia huoneenlämpötilassa (enintään 25 °C) infuusion mahdollistamiseksi.
Aseptisten tekniikoiden käyttö
Mikrobiologiselta kannalta lääkevalmiste on käytettävä heti. Jos sitä ei käytetä heti, käytön aikainen säilytysaika ja olosuhteet ovat käyttäjän vastuulla eivätkä ne normaalisti ylittäisi 24:ää tuntia 2 °C – 8 °C:ssa, jota seuraa 6 tuntia huoneenlämpötilassa (enintään 25 °C) infuusion mahdollistamiseksi.
Käyttökuntoon saatettu injektiopullo tai laimennettu sipaglukosidaasi alfa ‑liuos ei saa jäätyä infuusiopussissa.
Säilytys
Säilytä jääkaapissa (2 °C – 8 °C).
Pidä injektiopullo ulkopakkauksessa. Herkkä valolle.
Käyttökuntoon saatetun ja laimennetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
POMBILITI kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos
105 mg (L:ei) 1 kpl (1460,20 €)
PF-selosteen tieto
105 mg kuiva-ainetta välikonsentraatiksi infuusionestettä varten, liuos 20 ml:n neutraalissa, kirkkaassa tyypin I borosilikaattilasisessa injektiopullossa, joka on suljettu 20 mm:n klorobutyylikumitulpalla sekä alumiinisella päällyssinetillä, jossa on tummanharmaa muovinappi.
Pakkaukset sisältävät 1, 10 tai 25 injektiopulloa.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Valkoinen tai hieman kellertävä kylmäkuivattu jauhe
Käyttö- ja käsittelyohjeet
Infusioon valmistautuminen
Käytä aseptista tekniikkaa.
Jokainen Pombiliti-injektiopullo on kertakäyttöinen.
Annoksen laskeminen
Määritä käyttökuntoon saatettavien Pombiliti-injektiopullojen määrä potilaan painon perusteella.
- Potilaan paino (kg) x annos (mg/kg) = potilaan annos (mg)
- Potilaan annos (mg) jaettuna 105:llä (mg per injektiopullo) = käyttökuntoon saatettavien injektiopullojen määrä
- Jos injektiopullojen määrä sisältää murtoluvun, pyöristä seuraavaan kokonaislukuun.
Esimerkki: 65 kg painavalla potilaalla, jonka annos on 20 mg/kg
- Potilaan annos (mg): 65 kg x 20 mg/kg = 1 300 mg:n kokonaisannos
- Käyttökuntoon saatettavien injektiopullojen määrä: 1 300 jaettuna 105 mg:lla per injektiopullo = 12,38 injektiopulloa eli pyöristettynä 13 injektiopulloa.
- Ota 7,0 ml jokaisesta 12 ensimmäisestä injektiopullosta; 0,38 x 7,0 ml = 2,66 ml eli pyöristettynä 2,7 ml 13. injektiopullosta.
Käyttökuntoon saattamiseen ja laimentamiseen tarvittavat välineet
- Pombiliti 105 mg injektiopullot
- Steriili injektionesteisiin käytettävä vesi, joka on huoneenlämpöistä (20 °C – 25 °C)
-
Injektionesteisiin käytettävä natriumkloridi 9 mg/ml (0,9 %) ‑liuos, joka on huoneenlämpöistä (20 °C – 25 °C)
Huom. Valitse pussin koko potilaan painon perusteella. - Neula, jonka läpimitta on 18 G tai pienempi
Toimenpiteet ennen käyttökuntoon saattamista
- Pombiliti-injektiopullot on otettava jääkaapista (2 °C – 8 °C) ja niiden on annettava lämmetä huoneenlämpötilaan (eli noin 30 minuuttia 20 °C – 25 °C:ssa).
- Ei saa käyttää, jos kylmäkuivatussa jauheessa on värimuutoksia tai jos suljin on vaurioitunut tai päällyssinetin nappi on irrotettu.
Kylmäkuivatun jauheen käyttökuntoon saattaminen
- Saata kukin injektiopullo käyttökuntoon lisäämällä hitaasti 7,2 ml steriiliä injektionesteisiin käytettävää vettä tiputtamalla sitä tipoittain injektiopullon sisäpuolta pitkin alaspäin sen sijaan, että lisäisit injektionesteisiin käytettävän veden suoraan kylmäkuivattuun jauheeseen. Vältä steriilin injektionesteisiin käytettävän veden voimakasta iskeytymistä kylmäkuivattuun jauheeseen ja vältä vaahtoamista.
- Liuota jauhe kallistamalla ja pyörittelemällä jokaista injektiopulloa varovasti. Älä käännä ylösalaisin, kieputa äläkä ravista. Kylmäkuivatun jauheen käyttökuntoon saattaminen kestää tyypillisesti 2 minuuttia.
- Tarkasta käyttökuntoon saatetut injektiopullot hiukkasten ja värimuutosten varalta. Käyttökuntoon saatettu tilavuus näyttää kirkkaalta tai opaalinhohtoiselta, värittömältä tai hieman keltaiselta liuokselta, jossa ei ole vierashiukkasia eikä käytännössä lainkaan valkoisia tai läpikuultavia hiukkasia. Jos välittömässä tarkastuksessa havaitaan vierasaineita tai jos liuoksessa on värimuutoksia, sitä ei saa käyttää.
- Toista yllä olevat vaiheet tarvittavalle määrälle injektiopulloja.
Laimentaminen ja infuusiopussin valmistelu
- Valitse laskimoantoon (i.v.) tarkoitettu pussi, jonka tilavuus on riittävä, jotta saavutetaan laimennetun sipaglukosidaasi alfa ‑liuoksen lopullinen tavoitepitoisuusalue 0,5 mg/ml – 4 mg/ml laskimoinfuusiota varten.
- Poista ilmatila infuusiopussista. Ota pois vastaava määrä injektionesteisiin käytettävää 9 mg/ml (0,9 %) natriumkloridiliuosta, joka korvataan käyttökuntoon saatetun sipaglukosidaasi alfan kokonaistilavuudella (ml).
- Käyttökuntoon saatettu tilavuus mahdollistaa 7,0 ml:n (vastaa 105 mg:aa) tarkan ottamisen kustakin injektiopullosta. Vedä käyttökuntoon saatettu liuos hitaasti injektiopulloista ruiskulla, jonka neulan läpimitta on enintään 18 G, mukaan lukien alle 7,0 ml osittain käytettävästä injektiopullosta, kunnes potilaan annos saavutetaan. Vältä vaahtoamista ruiskussa. Hävitä kaikki viimeisessä injektiopullossa jäljellä oleva käyttökuntoon saatettu liuos.
- Injisoi käyttökuntoon saatettu sipaglukosidaasi alfa ‑liuos hitaasti suoraan injektiopussin natriumkloridi 9 mg/ml (0,9 %) ‑liuokseen. Älä lisää sitä suoraan ilmatilaan, joka on saattanut jäädä infuusiopussiin.
- Käännä pussi varovasti ylösalaisin tai hiero varovasti pussia laimennetun liuoksen sekoittamiseksi. Älä ravista tai heiluttele voimakkaasti infuusiopussia. Älä käytä pneumaattista letkua infuusiopussin kuljettamiseen.
- Toista vaiheet jäljellä oleville infuusiopusseille, kunnes olet saavuttanut potilaan annosta varten tarvittavan kokonaistilavuuden (ml) käyttökuntoon saatettua sipaglukosidaasi alfaa.
Infuusioliuos on annettava mahdollisimman pian laimennusvalmistelun jälkeen huoneenlämpötilaisena, ks. kohta Annostus ja antotapa.
Antoon valmistautuminen
Jos infuusiota ei voida aloittaa laimentamisen jälkeen, laimennettu liuos on stabiilia enintään 24 tunnin ajan jääkaapissa 2 °C – 8 °C:ssa. Säilytystä huoneenlämpötilassa ei suositella, ks. käytön aikaiset säilytysolosuhteet. Ei saa jäätyä. Ei saa ravistaa.
Laimennettua sipaglukosidaasi alfaa sisältävä natriumkloridiliuos 9 mg/ml (0,9 %) annetaan infuusiopumpun avulla.
Tarkasta ennen infuusiota, ettei infuusiopussissa ole vaahtoa. Jos siinä on vaahtoa, anna vaahdon hävitä. Vältä ravistamista ja käsittele infuusiopussia varovasti, jotta sen sisältö ei vaahtoa.
Laskimoantosettiä on käytettävä proteiinia vähän sitovan 0,2 mikronin inline-suodattimen kanssa. Jos laskimoletku tukkeutuu infuusion aikana, vaihda suodatin.
Muita lääkevalmisteita ei saa infusoida samaan laimennetun sipaglukosidaasi alfa ‑liuoksen laskimoletkuun.
Hävittäminen
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
POMBILITI kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos
105 mg 1 kpl, 10 kpl, 25 kpl
- Ei korvausta.
ATC-koodi
A16AB23
Valmisteyhteenvedon muuttamispäivämäärä
12.09.2024
Yhteystiedot
Block 1, Blanchardstown Corporate Park, Ballycoolen Road, Blanchardstown
D15 AKK1 Dublin
Ireland
Tel:+353(0)1588 6850
