VALGANCICLOVIR ORION tabletti, kalvopäällysteinen 450 mg
Vaikuttavat aineet ja niiden määrät
Jokainen kalvopäällysteinen tabletti sisältää valgansikloviirihydrokloridia, joka vastaa 450 mg valgansikloviiria.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Tabletti, kalvopäällysteinen.
Kliiniset tiedot
Käyttöaiheet
Valganciclovir Orion on tarkoitettu sytomegaloviruksen (CMV) aiheuttaman retiniitin aloitus- ja ylläpitohoitoon aikuisille potilaille, joilla on immuunikato (AIDS).
Valganciclovir Orion on tarkoitettu CMV-infektion estohoitoon CMV-negatiivisille elinsiirron saaneille aikuisille ja lapsille (syntymästä 18 vuoden ikäisiin), jotka ovat saaneet elinsiirteen CMV-positiiviselta luovuttajalta.
Annostus ja antotapa
Annostus
Varoitus – annostussuosituksia on noudatettava tarkasti yliannostuksen välttämiseksi (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Yliannostus).
Valgansikloviiri metaboloituu nopeasti ja tehokkaasti gansikloviiriksi peroraalisen annostelun jälkeen. Suun kautta otettava valgansikloviiriannos 900 mg kahdesti vuorokaudessa on terapeuttisesti samanarvoinen kuin laskimonsisäinen gansikloviiriannos 5 mg/kg kahdesti vuorokaudessa.
Sytomegaloviruksen (CMV) aiheuttaman retiniitin hoito
Aikuispotilaat
CMV-retiniitin aloitushoito:
Aktiivista CMV-retiniittiä sairastaville potilaille suositeltu annos on 900 mg valgansikloviiria (kaksi 450 mg:n Valganciclovir Orion -tablettia) kaksi kertaa vuorokaudessa 21 vuorokauden ajan. Tabletit on otettava mahdollisuuksien mukaan aterian yhteydessä. Pitempi aloitushoito saattaa suurentaa luuydintoksisuuden riskiä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
CMV-retiniitin ylläpitohoito:
Aloitushoidon jälkeen tai potilaille, joilla on inaktiivinen CMV-retiniitti, suositeltu annos on 900 mg valgansikloviiria (kaksi 450 mg:n Valganciclovir Orion -tablettia) kerran vuorokaudessa. Tabletit on otettava mahdollisuuksien mukaan aterian yhteydessä. Jos potilaan retiniitti pahenee, aloitushoito voidaan uusia, mutta viruslääkeresistenssin mahdollisuus on otettava huomioon.
Ylläpitohoidon kesto pitää päättää yksilöllisesti.
Pediatriset potilaat
Vagansikloviirin turvallisuutta ja tehoa lasten sytomegaloviruksen (CMV) aiheuttaman retiniitin hoidossa ei ole varmistettu riittävissä ja hyvin kontrolloiduissa kliinisissä tutkimuksissa.
CMV-infektion estohoito elinsiirtopotilailla:
Aikuispotilaat
Munuaisensiirtopotilaille suositeltu annos on 900 mg (kaksi 450 mg:n Valganciclovir Orion ‑tablettia) kerran vuorokaudessa alkaen 10 päivän kuluessa elinsiirtoleikkauksesta ja jatkuen siihen saakka, kunnes elinsiirrosta on kulunut 100 vuorokautta. Estohoitoa voidaan jatkaa, kunnes elinsiirrosta on kulunut 200 vuorokautta (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet, Haittavaikutukset ja Farmakodynamiikka).
Muun elinsiirteen kuin munuaisen saaneille potilaille suositeltu annos on 900 mg (kaksi 450 mg:n Valganciclovir Orion -tablettia) kerran vuorokaudessa alkaen 10 päivän kuluessa elinsiirtoleikkauksesta ja jatkuen siihen saakka, kunnes elinsiirrosta on kulunut 100 vuorokautta.
Tabletit on otettava mahdollisuuksien mukaan aterian yhteydessä.
Pediatriset potilaat
Vagansikloviirin kerran vuorokaudessa otettava suositusannos siirrännäisen saaneille lapsipotilaille (vastasyntyneistä alkaen), joilla on riski kehittää CMV-infektio, perustuu kehon pinta-alaan (body surface area, BSA) ja kreatiniinipuhdistumaan (Pt-Krea-Cl), joka arvioidaan käyttämällä Schwartzin kaavaa (Pt-Krea-Cl):
Pediatristen potilaiden annos (mg) = 7 x BSA x Pt-Krea-Cl (ks. Mostellerin BSA-kaava ja Schwartzin kreatiniinipuhdistuman kaava jäljempänä).
Jos laskettu Schwartzin kreatiniinipuhdistuma on suurempi kuin 150 ml/min/1,73 m2, yhtälössä on käytettävä maksimiarvoa 150 ml/min/1,73 m2:
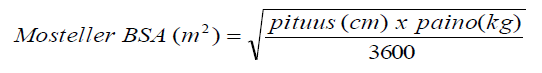

jossa, muuttujalle k annettiin seuraavat arvot: alle 2-vuotiaille potilaille k = 0,45*; 2 ‑ < 13-vuotiaille pojille ja 2–16-vuotiaille tytöille k = 0,55 sekä 13–16-vuotiaille pojille k = 0,7. Ks. yli 16-vuotiaiden potilaiden annostus aikuisten annostuskohdasta.
Mainitut k:n arvot perustuvat seerumin kreatiniinipitoisuuden mittaamiseen käytettävään Jaffen menetelmään ja sitä saattaa olla tarpeen korjata, jos käytetään entsymaattista menetelmää.
*Pienempi k:n arvo saattaa olla tarpeen tietyille potilasjoukoille (esim. pediatrisille potilaille, joiden syntymäpaino on pieni).
Pediatrisille munuaisensiirtopotilaille lääkitys on aloitettava suositusannoksella (7 x BSA x Pt-Krea-Cl) 10 päivän kuluessa elinsiirtoleikkauksesta ja jatkuen siihen saakka, kunnes leikkauksesta on kulunut 200 päivää. Muun elinsiirteen kuin munuaisen saaneille pediatrisille elinsiirtopotilaille lääkitys on aloitettava suositusannoksella (7 x BSA x Pt-Krea-Cl) 10 päivän kuluessa elinsiirtoleikkauksesta ja jatkuen siihen saakka, kunnes leikkauksesta on kulunut 100 päivää.
Kaikki lasketut annokset pitää pyöristää ylöspäin seuraavaan 25 mg:aan, jotta saadaan varsinainen annettava annos. Jos laskennallinen annos ylittää 900 mg, annetaan maksimiannos 900 mg. Oraaliliuoksen käyttämistä suositellaan, koska sitä on mahdollista antaa edellä mainitun kaavan mukaisesti laskettuina annoksina. Valganciclovir Orion kalvopäällysteisiä tabletteja voidaan kuitenkin käyttää, jos laskettu annos on 10 %:n sisällä annoksesta, joka on mahdollista ottaa tabletteina, ja potilas kykenee nielemään tabletteja. Jos laskettu annos on esimerkiksi 405–495 mg, voidaan ottaa yksi 450 mg:n tabletti.
Seerumin kreatiniinipitoisuuksia suositellaan seuraamaan säännöllisesti ja huomioimaan pituuden ja painon muutokset annoksen muuttamiseksi asianmukaisesti estohoidon aikana.
Erityiset annostusohjeet
Pediatriset potilaat:
Elinsiirteen saaneiden pediatristen potilaiden annostus on yksilöllinen ja perustuu potilaan munuaistoimintaan sekä kehon pinta-alaan.
Iäkkäät potilaat:
Lääkkeen turvallisuutta ja tehoa ei ole tutkittu tässä potilasryhmässä. Yli 65-vuotiailla aikuisilla ei ole tehty tutkimuksia. Koska munuaisten toiminta heikkenee iän myötä, valgansikloviirin antamisessa iäkkäille pitää olla varovainen ja heidän munuaistensa toiminta pitää huomioida erityisesti (ks. edempänä oleva taulukko sekä kohta Farmakokinetiikka).
Potilaat, joilla on munuaisten vajaatoiminta:
Seerumin kreatiniinipitoisuuksia tai arvioitua kreatiniinipuhdistumaa on seurattava huolellisesti. Annostusta on muutettava kreatiniinipuhdistuman mukaan seuraavan taulukon mukaisesti (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Arvioitu kreatiniinipuhdistuma (ml/min) voidaan laskea seerumin kreatiniinista seuraavalla kaavalla:

Naiset = 0,85 × miesten arvo
Kreatiniinipuhdistuma (ml/min) | Valgansikloviirin aloitusannos | Valgansikloviirin ylläpito- ja estoannos |
≥ 60 | 900 mg (kaksi tablettia) kaksi kertaa vuorokaudessa | 900 mg (kaksi tablettia) kerran vuorokaudessa |
40–59 | 450 mg (yksi tabletti) kaksi kertaa vuorokaudessa | 450 mg (yksi tabletti) kerran vuorokaudessa |
25–39 | 450 mg (yksi tabletti) kerran vuorokaudessa | 450 mg (yksi tabletti) joka toinen vuorokausi |
10–24 | 450 mg (yksi tabletti) joka toinen vuorokausi | 450 mg (yksi tabletti) kaksi kertaa viikossa |
< 10 | ei suositella | ei suositella |
Hemodialyysihoitoa saavat potilaat:
Hemodialyysipotilaille (kreatiniinipuhdistuma < 10 ml/min) ei voida antaa annossuositusta. Siksi Valganciclovir Orion kalvopäällysteisiä tabletteja ei saa käyttää näille potilaille (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Potilaat, joilla on maksan vajaatoiminta:
Valgansikloviiritablettien turvallisuutta ja tehoa ei ole varmistettu maksan vajaatoimintaa sairastavien potilaiden hoidossa (ks. kohta Farmakokinetiikka).
Potilaat, joilla on vaikea leukopenia, neutropenia, anemia, trombosytopenia ja pansytopenia:
Ks. kohta Varoitukset ja käyttöön liittyvät varotoimet ennen hoidon aloittamista.
Jos verisolujen määrä laskee huomattavasti valgansikloviirihoidon aikana, hoitoa hematopoieettisilla kasvutekijöillä ja/tai hoidon keskeyttämistä on harkittava (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Antotapa
Valgansikloviiri otetaan suun kautta ja mahdollisuuksien mukaan aterian yhteydessä (ks. kohta Farmakokinetiikka).
Jos lapsipotilas ei pysty nielemään Valganciclovir Orion kalvopäällysteisiä tabletteja, voidaan käyttää Valganciclovir Orion jauhetta oraaliliuosta varten.
Ennen lääkkeen käsittelyä tai antoa huomioon otettavat varotoimet
Tabletteja ei saa jakaa eikä murskata. Koska valgansikloviiria pidetään ihmisille mahdollisesti teratogeenisena ja karsinogeenisena, rikkoutuneita tabletteja on käsiteltävä varovasti (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Rikkoutuneiden tai murskattujen tablettien joutumista suoraan iholle tai limakalvoille on vältettävä. Altistunut kohta on pestävä tarvittaessa huolellisesti saippualla ja vedellä ja silmät on huuhdeltava huolellisesti steriilillä vedellä tai tavallisella vedellä, jos steriiliä vettä ei ole saatavissa.
Vasta-aiheet
Valganciclovir Orion on vasta-aiheinen potilailla, jotka ovat yliherkkiä valgansikloviirille, gansikloviirille tai kohdassa Apuaineet mainituille apuaineille.
Valganciclovir Orion on vasta-aiheinen imetyksen aikana (ks. kohta Raskaus ja imetys).
Varoitukset ja käyttöön liittyvät varotoimet
Ristiyliherkkyys
Gansikloviirin kemiallinen rakenne on samankaltainen kuin asikloviirin ja pensikloviirin kemiallinen rakenne, joten näiden lääkkeiden välillä voi esiintyä ristiyliherkkyyttä. Sen vuoksi valgansikloviirin määräämisessä on oltava varovainen, jos potilaan tiedetään olevan yliherkkä asikloviirille tai pensikloviirille (tai niiden aihiolääkkeille valasikloviirille tai famsikloviirille).
Mutageenisuus, teratogeenisuus, karsinogeenisuus, hedelmällisyys ja raskauden ehkäisy
Ennen valgansikloviirihoidon aloittamista potilaille on kerrottava mahdollisista riskeistä sikiölle. Eläinkokeissa on havaittu, että gansikloviiri on mutageeninen, teratogeeninen, aspermatogeeninen ja karsinogeeninen ja heikentää naaraiden hedelmällisyyttä. Valgansikloviiria on siksi pidettävä ihmisille mahdollisesti teratogeenisena ja karsinogeenisena aineena, joka mahdollisesti aiheuttaa sikiön epämuodostumia ja syöpiä (ks. kohta Prekliiniset tiedot turvallisuudesta). Lisäksi pidetään todennäköisenä, että valgansikloviiri estää spermatogeneesin väliaikaisesti tai pysyvästi. Hedelmällisessä iässä olevia naisia on neuvottava käyttämään tehokasta ehkäisyä hoidon aikana ja vähintään 30 vuorokauden ajan hoidon jälkeen. Miehiä on neuvottava käyttämään mekaanista ehkäisymenetelmää hoidon aikana ja vähintään 90 vuorokautta hoidon jälkeen, ellei ole täysin varmaa, ettei naispuolisella kumppanilla ole raskausriskiä (ks. kohdat Raskaus ja imetys, Haittavaikutukset ja Prekliiniset tiedot turvallisuudesta).
Valgansikloviiri voi olla pitkällä aikavälillä karsinogeeninen ja aiheuttaa lisääntymistoksisuutta.
Luuydinlama
Valgansikloviirilla (ja gansikloviirilla) hoidetuilla potilailla on todettu vaikeaa leukopeniaa, neutropeniaa, anemiaa, trombosytopeniaa, pansytopeniaa, luuytimen vajaatoimintaa ja aplastista anemiaa. Hoitoa ei saa aloittaa, jos neutrofiilien absoluuttinen määrä on alle 500 solua/μl tai jos verihiutaleiden määrä on alle 25 000/μl tai jos hemoglobiinipitoisuus on alle 8 g/dl (ks. kohdat Annostus ja antotapa ja Haittavaikutukset).
Jos estohoitoa jatketaan yli 100 vuorokautta, leukopenian ja neutropenian kehittymisen mahdollinen riski on otettava huomioon (ks. kohdat Annostus ja antotapa, Haittavaikutukset ja Farmakodynamiikka).
Varovaisuutta on noudatettava käytettäessä valgansikloviiria potilaille, joilla on hematologinen sytopenia tai aikaisemmin todettu lääkkeestä johtuva hematologinen sytopenia, tai sädehoitoa saaville potilaille.
Täydellisen verenkuvan ja verihiutaleiden määrän säännöllinen seuranta on suositeltavaa hoidon aikana. Hematologisen seurannan tehostaminen voi olla aiheellista potilailla, joilla on munuaisten vajaatoiminta, ja myös pediatrisilla potilailla. Seuranta tehdään vähintään joka kerta kun potilas käy elinsiirtoklinikalla. Hoitoa hematopoieettisilla kasvutekijöillä ja/tai hoidon keskeyttämistä on suositeltavaa harkita potilaille, joille kehittyy vaikea leukopenia, neutropenia, anemia ja/tai trombosytopenia (ks. kohta Annostus ja antotapa).
Hyötyosuuden ero oraalisen gansikloviiriannoksen jälkeen
Gansikloviirin hyötyosuus valgansikloviirin 900 mg:n kerta-annoksen jälkeen on noin 60 % ja 1 000 mg:n oraalisen gansikloviiriannoksen jälkeen (kapseleina otettuna) noin 6 %. Liialliseen gansikloviirialtistukseen voi liittyä hengenvaarallisia haittavaikutuksia. Siksi suositellaan, että annossuosituksia noudatetaan huolellisesti aloitushoidossa, aloitushoidosta ylläpitohoitoon siirryttäessä ja potilailla, jotka vaihtavat oraalisesta gansikloviirista valgansikloviiriin, koska gansikloviirikapseleita ei voi korvata valgansikloviirilla suhteessa 1:1. Gansikloviirikapseleista vaihtavia potilaita on varoitettava yliannostuksen vaarasta, jos he ottavat enemmän Valganciclovir Orion -tabletteja kuin lääkäri on määrännyt (ks. kohdat Annostus ja antotapa ja Yliannostus).
Munuaisten vajaatoiminta
Potilailla, joilla on munuaisten vajaatoiminta, annostusta on muutettava kreatiniinipuhdistuman mukaan (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka).
Valgansikloviiri-tabletteja ei saa käyttää hemodialyysihoitoa saaville potilaille (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka).
Muiden lääkkeiden käyttö
Kouristuksia on ilmoitettu esiintyneen imipeneemi-silastatiinia ja gansikloviiria ottavilla potilailla. Valgansikloviiria ei saa käyttää samanaikaisesti imipeneemi-silastatiinin kanssa, elleivät hoidon mahdolliset hyödyt ole suurempia kuin mahdolliset riskit (ks. kohta Yhteisvaikutukset).
Potilaita, joita hoidetaan valgansikloviirilla ja (a) didanosiinilla, (b) lääkkeillä, joilla tiedetään olevan myelosuppressiivinen vaikutus (esimerkiksi tsidovudiinilla), tai (c) munuaisten toimintaan vaikuttavilla lääkkeillä, on seurattava tarkasti suurentuneen toksisuuden varalta (ks. kohta Yhteisvaikutukset).
Kontrolloituun kliiniseen tutkimukseen, jossa käytettiin valgansikloviiria CMV-infektion estohoidossa elinsiirtopotilaille ja jonka tulokset on esitetty kohdassa Farmakodynamiikka, ei osallistunut keuhko- tai suolisiirteen saaneita potilaita. Siksi lääkkeen käytöstä näille elinsiirtopotilaille on vain vähän kokemusta.
Yhteisvaikutukset
Yhteisvaikutukset valgansikloviirin kanssa
Valgansikloviirilla ei ole tehty in vivo -yhteisvaikutustutkimuksia. Koska valgansikloviiri metaboloituu tehokkaasti ja nopeasti gansikloviiriksi, on odotettavissa, että gansikloviirin käytön yhteydessä havaittuja yhteisvaikutuksia esiintyy valgansikloviiria käytettäessä.
Yhteisvaikutukset gansikloviirin kanssa
Farmakokineettiset yhteisvaikutukset
Probenesidi
Probenesidi ja samanaikaisesti suun kautta otettu gansikloviiri johtivat tilastollisesti merkitsevään gansikloviirin munuaispuhdistuman laskuun (20 %) ja aiheuttivat altistuksen tilastollisesti merkitsevän nousun (40 %). Nämä muutokset johtuvat interaktiomekanismista, johon liittyy kilpailua erityksestä munuaistiehyissä. Siksi probenesidiä ja valgansikloviiria ottavia potilaita on seurattava tarkasti gansikloviirista aiheutuvan toksisuuden varalta.
Didanosiini
Plasman didanosiinipitoisuuksien havaittiin johdonmukaisesti nousseen yhdistelmähoidossa laskimonsisäisesti annetun gansikloviirin kanssa. Laskimoon annettujen annosten 5 mg/kg/vrk ja 10 mg/kg/vrk havaittiin suurentaneen didanosiinin AUC-arvoa 38–67 %, joka vahvistaa, että näiden lääkkeiden samanaikaisen käytön yhteydessä esiintyy farmakokineettisiä yhteisvaikutuksia. Gansikloviiripitoisuuksissa ei havaittu merkittäviä muutoksia. Potilaita on seurattava huolellisesti didanosiinista aiheutuvan toksisuuden, esim. haimatulehduksen varalta (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Muut antiretroviraaliset lääkkeet
Sytokromi P450 -isoentsyymit eivät vaikuta gansikloviirin farmakokinetiikkaan. Farmakokineettisiä yhteisvaikutuksia proteaasin estäjien ja NNRTI-lääkkeiden kanssa ei tämän vuoksi oletettavasti esiinny.
Farmakodynaamiset yhteisvaikutukset
Imipeneemi/silastatiini
Kouristuksia on raportoitu imipeneemia/silastatiinia ja gansikloviiria samanaikaisesti käyttävillä potilailla, siksi farmakodynaamisen yhteisvaikutuksen mahdollisuutta ei voida sulkea pois. Näitä lääkeaineita ei pidä käyttää samanaikaisesti, ellei hoidon mahdollista hyötyä arvioida suuremmaksi kuin mahdollista riskiä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Tsidovudiini
Sekä tsidovudiini että gansikloviiri voivat aiheuttaa neutropeniaa ja anemiaa. Näiden lääkkeiden samanaikaisessa käytössä voi esiintyä farmakodynaaminen yhteisvaikutus. Jotkut potilaat eivät välttämättä siedä samanaikaista hoitoa täysinä annoksina (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Mahdolliset lääkkeiden yhteisvaikutukset
Toksisuus saattaa suurentua, kun valgansikloviiria annetaan yhdessä muiden sellaisten lääkkeiden kanssa, joiden tiedetään aiheuttavan luuydinlamaa tai joihin tiedetään liittyvän munuaisten vajaatoimintaa. Tämä koskee nukleosideja (esim. tsidovudiini, didanosiini, stavudiini) ja nukleotidianalogeja (esim. tenofoviiri, adefoviiri), immunosuppressiivisia lääkkeitä (esim. siklosporiini, takrolimuusi, mykofenolaattimofetiili), syöpälääkkeitä (esim. doksorubisiini, vinblastiini, vinkristiini, hydroksiurea) ja infektiolääkkeitä (trimetopriimi/sulfametoksatsoli, dapsoni, amfoterisiini B, flusytosiini, pentamidiini).
Sen vuoksi näiden lääkkeiden käyttöä samanaikaisesti valgansikloviirin kanssa voidaan harkita vain, jos hoidon mahdolliset hyödyt ovat sen mahdollisia riskejä suuremmat (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Raskaus ja imetys
Ehkäisy miehille ja naisille
Mahdollisen lisääntymistoksisuuden ja teratogeenisuuden vuoksi naisia, jotka voivat tulla raskaaksi, tulisi neuvoa käyttämään tehokasta ehkäisyä hoidon aikana ja vähintään 30 vuorokauden ajan hoidon jälkeen. Miespotilaiden tulisi huolehtia ehkäisystä käyttämällä kondomia valgansikloviirihoidon aikana ja vähintään 90 päivää hoidon jälkeen, ellei raskausriski ole täysin poissuljettu (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Prekliiniset tiedot turvallisuudesta).
Raskaus
Valgansikloviirin turvallisuutta raskaana oleville naisille ei ole varmistettu. Sen aktiivinen metaboliitti, gansikloviiri, läpäisee ihmisen istukan helposti. Sen farmakologisen vaikutusmekanismin ja gansikloviirilla tehdyissä eläinkokeissa havaitun lisääntymistoksisuuden perusteella (ks. kohta Prekliiniset tiedot turvallisuudesta) on olemassa teoreettinen riski, että gansikloviiri on teratogeeninen ihmiselle.
Valgansikloviiritabletteja ei saa käyttää raskauden aikana, ellei terapeuttinen hyöty äidille ole suurempi kuin mahdollinen teratogeeninen riski sikiölle.
Imetys
Ei tiedetä, erittyykö gansikloviiri ihmisen rintamaitoon, mutta mahdollisuutta, että gansikloviiri erittyy rintamaitoon ja aiheuttaa vakavia haittavaikutuksia imetettävälle vauvalle, ei voida jättää huomioimatta. Eläinkokeet osoittavat, että gansikloviiri erittyy imettävien rottien maitoon. Siksi imetys on lopetettava valgansikloviirihoidon ajaksi (ks. kohta Vasta-aiheet).
Hedelmällisyys
Valgansikloviirin vaikutuksesta ihmisen hedelmällisyyteen ei ole tietoja saatavissa. Hedelmällisyystutkimuksia ei ole toistettu valgansikloviirilla, koska valgansikloviiri muuntuu elimistössä nopeasti ja tehokkaasti gansikloviiriksi. Gansikloviiriin on eläinkokeissa liittynyt hedelmällisyyden heikentymistä (ks. kohdat Vasta-aiheet ja Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Tutkimuksia valmisteen vaikutuksesta ajokykyyn tai koneiden käyttökykyyn ei ole tehty.
Valgansikloviirin ja/tai gansikloviirin käytön yhteydessä on ilmoitettu esiintyneen kouristuksia, heitehuimausta ja sekavuutta. Jos näitä oireita esiintyy, ne voivat vaikuttaa potilaan valppauteen ja siten myös ajokykyyn ja koneiden käyttökykyyn.
Haittavaikutukset
a. Turvallisuusprofiilin yhteenveto
Valgansikloviiri on gansikloviirin aihiolääke, joka suun kautta otettuna metaboloituu nopeasti ja tehokkaasti gansikloviiriksi. On odotettavissa, että gansikloviirin käyttöön liittyviä tunnettuja haittavaikutuksia esiintyy myös valgansikloviirin käytön yhteydessä. Kaikkia valgansikloviirilla tehdyissä kliinisissä tutkimuksissa havaittuja haittavaikutuksia on aikaisemmin esiintynyt gansikloviirin käytön yhteydessä. Sen vuoksi edempänä olevassa haittavaikutustaulukossa mainitaan laskimoon annettavan tai suun kautta (lääkemuoto ei enää saatavissa) otettavan gansikloviirin tai valgansikloviirin käytössä raportoidut haittavaikutukset.
Gansikloviiri- tai valgansikloviirihoitoa saaneilla potilailla yleisimmin esiintyneitä ja vakavimpia haittavaikutuksia olivat hematologiset haittavaikutukset, kuten neutropenia, anemia ja trombosytopenia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Taulukossa mainitut haittavaikutusten esiintyvyydet perustuvat HIV-infektiota sairastavien potilaiden yhdistettyyn potilasjoukkoon (n = 1 704), joka sai ylläpitohoitona gansikloviiria tai valgansikloviiria. Poikkeuksen muodostavat anafylaktiset reaktiot, agranulosytoosi ja granulosytopeniaa, joiden esiintyvyydet perustuvat valmisteen markkinoille tulon jälkeiseen kokemukseen. Haittavaikutukset luetellaan MedDRA-elinjärjestelmäluokkien mukaisesti. Esiintyvyydet esitetään seuraavan esitystavan mukaisesti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000) ja hyvin harvinainen (< 1/10 000).
Gansikloviirin ja valgansikloviirin kokonaisturvallisuusprofiili on HIV- ja elinsiirtopotilailla yhdenmukainen lukuun ottamatta verkkokalvon irtaumaa, jota on raportoitu vain HIV-potilailla, joilla on sytomegalovirusperäinen verkkokalvotulehdus. Tiettyjen haittavaikutusten esiintyvyydessä on kuitenkin joitakin eroja. Valgansikloviirin käyttöön liittyy suurempi ripulin riski verrattuna laskimonsisäiseen gansikloviiriin. Kuumetta, Candida-infektioita, masennusta, vaikea-asteista neutropeniaa (absoluuttinen neutrofiilimäärä < 500/µl) ja ihoreaktioita on raportoitu useammin HIV-potilailla. Munuaisten ja maksan toimintahäiriöitä on raportoitu useammin elinsiirron saaneilla.
b. Haittavaikutustaulukko
Haittavaikutus (MedDRA) Elinjärjestelmä | Esiintyvyysluokka |
Infektiot: | |
Candida-infektiot, mukaan lukien sammas | Hyvin yleinen |
Ylähengitystieinfektiot | |
Sepsis | Yleinen |
Influenssa | |
Virtsatieinfektio | |
Selluliitti | |
Veri ja imukudos: | |
Neutropenia | Hyvin yleinen |
Anemia | |
Trombosytopenia | Yleinen |
Leukopenia | |
Pansytopenia | |
Luuytimen vajaatoiminta | Melko harvinainen |
Aplastinen anemia | Harvinainen |
Agranulosytoosi* | |
Granulosytopenia* | |
Immuunijärjestelmä: | |
Yliherkkyys | Yleinen |
Anafylaktinen reaktio* | Harvinainen |
Aineenvaihdunta ja ravitsemus: | |
Heikentynyt ruokahalu | Hyvin yleinen |
Painon lasku | Yleinen |
Psyykkiset häiriöt: | |
Masennus | Yleinen |
Sekavuustila | |
Ahdistuneisuus | |
Agitaatio | Melko harvinainen |
Psykoottiset häiriöt | |
Poikkeava ajattelu | |
Hallusinaatiot | |
Hermosto: | |
Päänsärky | Hyvin yleinen |
Unettomuus | Yleinen |
Perifeerinen neuropatia | |
Heitehuimaus | |
Parestesia | |
Hypestesia | |
Kouristukset | |
Dysgeusia (makuhäiriöt) | |
Vapina | Melko harvinainen |
Silmät: | |
Näkökyvyn heikkeneminen | Yleinen |
Verkkokalvon irtauma** | |
Lasiaiskellujat | |
Silmäkipu | |
Konjunktiviitti | |
Makulaturvotus | |
Kuulo ja tasapainoelin: | |
Korvakipu | Yleinen |
Kuuroutuminen | Melko harvinainen |
Sydän: | |
Sydämen rytmihäiriöt | Melko harvinainen |
Verisuonisto: | |
Hypotensio | Yleinen |
Hengityselimet, rintakehä ja välikarsina: | |
Yskä | Hyvin yleinen |
Hengenahdistus | |
Ruoansulatuselimistö: | |
Ripuli | Hyvin yleinen |
Pahoinvointi | |
Oksentelu | |
Vatsakipu | |
Ruoansulatushäiriöt | Yleinen |
Ilmavaivat | |
Ylävatsakipu | |
Ummetus | |
Suun haavaumat | |
Nielemishäiriöt | |
Vatsan pingottuneisuus | |
Haimatulehdus | |
Maksa ja sappi: | |
Kohonnut veren alkalisen fosfataasin pitoisuus | Yleinen |
Maksan toimintahäiriö | |
Kohonnut aspartaattiaminotransferaasipitoisuus | |
Kohonnut alaniiniaminotransferaasipitoisuus | |
Iho ja ihonalainen kudos: | |
Dermatiitti | Hyvin yleinen |
Yöhikoilu | Yleinen |
Kutina | |
Ihottuma | |
Hiustenlähtö | |
Kuiva iho | Melko harvinainen |
Urtikaria | |
Luusto, lihakset ja sidekudos: | |
Selkäkipu | Yleinen |
Lihassärky | |
Nivelsärky | |
Lihaskrampit | |
Munuaiset ja virtsatiet: | |
Munuaisten vajaatoiminta | Yleinen |
Vähentynyt munuaisten kreatiniinipuhdistuma | |
Kohonnut veren kreatiniinipitoisuus | |
Munuaisten vajaatoiminta | Melko harvinainen |
Hematuria | |
Sukupuolielimet ja rinnat: | |
Miehen hedelmättömyys | Melko harvinainen |
Yleisoireet ja antopaikassa todettavat haitat: | |
Kuume | Hyvin yleinen |
Uupumus | |
Kipu | Yleinen |
Vilunväreet | |
Huonovointisuus | |
Voimattomuus | |
Rintakehän kipu | Melko harvinainen |
*Näiden haittavaikutusten esiintyvyydet perustuvat valmisteen markkinoille tulon jälkeiseen kokemukseen.
** Verkkokalvon irtoamisia on raportoitu vain AIDS-potilailla, jotka ovat saaneet hoitoa CMVretiniitiin.
Valikoitujen haittavaikutusten kuvaus
Neutropenia
Neutropenian riski ei ole ennakoitavissa hoitoa edeltävän neutrofiilimäärän perusteella. Neutropenia ilmaantuu tavallisesti aloitushoidon ensimmäisellä tai toisella viikolla. Solumäärä normalisoituu tavallisesti 2–5 päivän kuluessa siitä, kun lääkkeen käyttö on lopetettu tai annosta on pienennetty (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Trombosytopenia
Potilailla, joiden trombosyyttimäärä on ennen hoitoa pieni (< 100 000/µl), on tavanomaista suurempi trombosytopenian kehittymisen riski. Jos potilaalla on immunosuppressiivisesta lääkehoidosta aiheutuva iatrogeeninen immuunivaje, trombosytopenian riski on suurempi kuin AIDS-potilailla (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Vaikea-asteiseen trombosytopeniaan saattaa liittyä mahdollisesti hengenvaarallista verenvuotoa.
Hoidon keston tai käyttöaiheen vaikutus haittavaikutuksiin
Vaikea-asteista neutropeniaa (ANC < 0,5 x 109/l) raportoitiin useammin CMV-retiniittiä sairastavilla potilailla (14 %), jotka saivat ylläpitohoitona valgansikloviiria tai suun kautta otettavaa tai laskimoon annettavaa gansikloviiria, kuin elinsiirtopotilailla, jotka saivat valgansikloviiria tai suun kautta otettavaa gansikloviiria. Valgansikloviiria tai suun kautta otettavaa gansikloviiria 100 päivää elinsiirron jälkeen saaneilla potilailla vaikea-asteisen neutropenian ilmaantuvuus oli 5 % (valgansikloviiri) ja 3 % (suun kautta otettava gansikloviiri), kun taas valgansikloviiria 200 päivää elinsiirron jälkeen saaneilla potilailla vaikea-asteisen neutropenian ilmaantuvuus oli 10 %.
Seerumin kreatiniinipitoisuus suureni enemmän kiinteän elinsiirteen saaneilla potilailla, jotka olivat saaneet sekä valgansikloviirihoitoa että oraalista gansikloviiria 100 päivän tai 200 päivän ajan elinsiirron jälkeen, verrattuna CMV-retiniittiä sairastaviin potilaisiin. Kiinteän elinsiirteen saaneilla potilailla munuaisten toiminnan heikentyminen on kuitenkin yleistä.
Valgansikloviirin kokonaisturvallisuusprofiili ei muuttunut, kun estohoitoa jatkettiin aikuisilla korkean riskin munuaissiirtopotilailla, enintään 200 vuorokauteen saakka. Leukopeniaa raportoitiin hieman yleisemmin haarassa, jossa potilaita hoidettiin 200 vuorokauden ajan, mutta neutropenian, anemian ja trombosytopenian esiintyvyys oli kummassakin haarassa samankaltainen.
c. Pediatriset potilaat
Valgansikloviiria on tutkittu 179:llä kiinteän elinsiirron saaneella pediatrisella (iältään 3 viikosta 16 vuoteen) potilaalla, joilla oli CMV-taudin kehittymisen riski, sekä 133 vastasyntyneellä (iältään 2−31 päivää), joilla oli oireinen synnynnäinen CMV-tauti. Gansikloviirihoidon kesto vaihteli 2 vuorokaudesta 200 vuorokauteen.
Pediatrisilla potilailla tehdyissä kliinisissä tutkimuksissa hoidosta aiheutuneita yleisimmin raportoituja haittavaikutuksia olivat ripuli, pahoinvointi, neutropenia, leukopenia ja anemia.
Elinsiirteen saaneiden potilaiden kokonaisturvallisuusprofiili oli pediatrisilla potilailla samankaltainen kuin aikuisilla. Neutropeniaa raportoitiin näissä kahdessa tutkimuksessa kiinteän elinsiirron saaneilla pediatrisilla potilailla hieman yleisemmin kuin aikuisilla, mutta neutropenian ja infektioon liittyvien haittavaikutusten välillä ei pediatrisella potilasjoukolla ollut yhteyttä keskenään.
Valgansikloviirialtistuksen pidentämiseen munuaissiirteen saaneilla pediatrisilla potilailla enintään 200 vuorokauteen ei liittynyt haittavaikutusten ilmaantuvuuden yleistä lisääntymistä. Vaikea-asteisen neutropenian (ANC < 500/μl) ilmaantuvuus oli suurempi pediatrisilla munuaispotilailla, jotka saivat hoitoa päivään 200 saakka, verrattuna hoitoa päivään 100 saakka saaneisiin pediatrisiin potilaisiin sekä verrattuna aikuisiin munuaissiirtopotilaisiin, jotka saivat hoitoa päivään 100 tai päivään 200 saakka (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Valgansikloviirihoitoa saaneista oireista synnynnäistä CMV-infektiota sairastavista vastasyntyneistä tai imeväisistä on vain vähän tietoja saatavissa, mutta turvallisuus näyttää olevan yhdenmukainen valgansikloviirin/gansikloviirin tunnetun turvallisuusprofiilin kanssa.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA.
Yliannostus
Yliannostuskokemukset valgansikloviirin ja laskimonsisäisen gansikloviirin käytöstä
On odotettavissa, että valgansikloviirin yliannostus voi mahdollisesti johtaa suurentuneeseen munuaistoksisuuteen (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Kliinisissä tutkimuksissa ja valmisteen markkinoille tulon jälkeisessä käytössä on raportoitu laskimoon annetun gansikloviirin yliannostustapauksia, joista osa on johtanut potilaan kuolemaan. Muutamissa näistä tapauksista ei ilmoitettu haittavaikutuksia. Suurimmalla osalla potilaista ilmeni yksi tai useampi seuraavista haittavaikutuksista:
- hematologinen toksisuus: luuydinlama, mukaan lukien pansytopenia, luuytimen aplasia, leukopenia, neutropenia, granulosytopenia
- maksatoksisuus: hepatiitti, maksan toimintahäiriö
- munuaistoksisuus: hematurian paheneminen potilaalla, jonka munuaistoiminta on heikentynyt; akuutti munuaisten vajaatoiminta, kohonnut kreatiniiniarvo
- maha-suolikanavan toksisuus: vatsakipu, ripuli, oksentelu
- neurotoksisuus: yleistynyt vapina, kouristukset.
Yliannostustapauksissa hemodialyysistä ja nesteytyksestä voi olla hyötyä valgansikloviiripitoisuuksien alentamisessa plasmassa (ks. kohta Farmakokinetiikka).
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Systeemiset viruslääkkeet; nukleosidit ja nukleotidit lukuun ottamatta käänteiskopioijan estäjiä, ATC-koodi: J05A B14.
Vaikutusmekanismi:
Valgansikloviiri on gansikloviirin L-valyyliesteri (aihiolääke). Suun kautta otettuna valgansikloviiri metaboloituu nopeasti ja tehokkaasti gansikloviiriksi suoliston ja maksan esteraasien avulla. Gansikloviiri on 2'-deoksiguanosiinin synteettinen analogi, joka estää herpesvirusten replikaatiota in vitro ja in vivo. Valgansikloviirille herkkiä ihmisviruksia ovat ihmisen sytomegalovirus (HCMV), herpes simplex -virus 1 ja 2 (HSV-1 ja HSV-2), ihmisen herpesvirus 6, 7 ja 8 (HHV-6, HHV-7, HHV-8), Epstein–Barrin virus (EBV), varicella-zostervirus (VZV) ja hepatiitti B -virus (HBV).
CMV:n infektoimissa soluissa viruksen proteiinikinaasi pUL97 fosforyloi gansikloviirin ensin monofosfaatiksi. Solun kinaasit fosforyloivat sen edelleen gansikloviiritrifosfaatiksi, joka sen jälkeen metaboloituu hitaasti solun sisällä. Trifosfaattimetaboliaa on havaittu HSV:n ja HCMV:n infektoimissa soluissa, joissa gansikloviirin puoliintumisaika on 18 tuntia (HSV) ja 6–24 tuntia (HCMV), sen jälkeen kun solunulkoinen gansikloviiri on poistettu. Koska fosforylaatio riippuu pitkälti viruskinaasista, gansikloviirin fosforylaatiota esiintyy pääasiassa viruksen infektoimissa soluissa.
Gansikloviirin virustaattinen vaikutus perustuu viruksen DNA-synteesin estoon kahdella mekanismilla: (a) gansikloviiri estää kilpailevasti viruksen DNA-polymeraasin katalysoimaa deoksiguanosiinitrifosfaatin liittymistä DNA:han, ja (b) gansikloviiritrifosfaatti liittyy viruksen DNA:han, jolloin DNA-ketjun pidentyminen loppuu tai on hyvin vähäistä.
Antiviraalinen vaikutus
Gansikloviirin antiviraalinen IC50-arvo CMV:tä vastaan on in vitro 0,08–14 μM (0,02–3,5 μg/ml).
Valgansikloviirin kliininen antiviraalinen teho on osoitettu sellaisten AIDS-potilaiden hoidossa, joilla oli äskettäin diagnosoitu CMV-retiniitti. Tutkittavista potilaista 46 % (32/69) eritti CMV:tä virtsaan tutkimuksen alussa, jaa neljä viikkoa kestäneen valgansikloviirihoidon jälkeen määrä laski 7 %:iin (4/55).
Kliininen teho ja turvallisuus
Aikuispotilaat
CMV-retiniitin hoito:
Eräässä tutkimuksessa potilaat, joilla oli äskettäin diagnosoitu CMV-retiniitti, satunnaistettiin kahteen ryhmään, joista toiselle annettiin aloitushoitona 900 mg valgansikloviiria kahdesti vuorokaudessa ja toiselle 5 mg gansikloviiria painokiloa kohden laskimonsisäisesti kahdesti vuorokaudessa. CMV-retiniitin valokuvaamalla todettu eteneminen oli neljän viikon kohdalla samankaltainen molemmissa hoitoryhmissä: laskimonsisäistä gansikloviiria saaneiden ryhmässä tauti oli edennyt 7 potilaalla 70:stä ja valgansikloviiria saaneiden ryhmässä 7 potilaalla 71:stä.
Aloitushoidon annostuksen jälkeen kaikille tämän tutkimuksen potilaille annettiin ylläpitohoitona 900 mg valgansikloviiria kerran vuorokaudessa. Keskimääräinen aika (mediaaniaika) satunnaistamishetkestä CMV-retiniitin etenemiseen oli valgansikloviiria sekä aloitus- että ylläpitohoitona saaneiden ryhmässä 226 (160) vuorokautta ja laskimonsisäistä gansikloviiria aloitushoitona sekä valgansikloviiria ylläpitohoitona saaneiden ryhmässä vastaavasti 219 (125) vuorokautta.
Elinsiirtopotilaiden CMV-infektion estohoito:
Kaksoissokkoutettuun, kaksoislumetekniikalla ja aktiivisen vertailuryhmän kanssa toteutettuun kliiniseen tutkimukseen osallistui sydämen-, maksan- ja munuaisensiirtopotilaita, joilla oli suuri CMV-infektion riski (D+/R–). Tutkimukseen ei osallistunut keuhko- tai suolisiirteen saaneita potilaita. Tutkittavat saivat joko valgansikloviiria (900 mg kerran vuorokaudessa) tai suun kautta otettavaa gansikloviiria (1 000 mg kolmesti vuorokaudessa). Hoito aloitettiin 10 vuorokauden kuluessa elinsiirrosta ja jatkui, kunnes elinsiirrosta oli kulunut 100 vuorokautta. Ensimmäisten kuuden kuukauden kuluessa elinsiirron jälkeen CMV-infektion (oireellinen CMV-infektion + CMV-löydös kudoksesta) ilmaantuvuus oli 12,1 % valgansikloviirihaarassa (n = 239) verrattuna 15,2 %:iin suun kautta otettavaa gansikloviiria saaneiden haarassa (n = 125). Suurin osa tapauksista ilmeni estolääkityksen lopettamisen jälkeen (100. vuorokauden jälkeen) ja siten, että valgansikloviirihaarassa tapaukset ilmenivät keskimäärin myöhemmin kuin suun kautta otettavaa gansikloviiria saaneiden potilaiden haarassa. Akuutin hylkimisreaktion ilmaantuvuus ensimmäisten kuuden kuukauden aikana oli valgansikloviiriryhmään satunnaistetuilla potilailla 29,7 %, suun kautta otettavaa gansikloviiria saaneiden haarassa 36,0 %. Siirteen menettämisen ilmaantuvuus oli 0,8 % molemmissa haaroissa.
Erääseen kaksoissokkoutettuun, lumelääkekontrolloituun tutkimukseen osallistui 326 munuaisensiirtopotilasta, joilla oli suuri CMV-infektion riski (D+/R–). Tutkimuksessa arvioitiin valgansikloviirin tehoa ja turvallisuutta CMV-infektion estohoidossa, kun hoitoa pidennetään 100 vuorokaudesta 200 vuorokauteen elinsiirrosta. Potilaat satunnaistettiin suhteessa 1:1 saamaan valgansikloviiritabletteja (900 mg kerran vuorokaudessa) 10 vuorokauden kuluessa elinsiirrosta joko 200 vuorokauden ajan elinsiirrosta tai 100 vuorokauden ajan elinsiirrosta. Jälkimmäisessä tapauksessa lääkitystä seurasi 100 vuorokauden lumelääkejakso.
Seuraavassa taulukossa esitetään niiden potilaiden osuudet, joille kehittyi CMV-infektio elinsiirtoa seuranneiden ensimmäisten 12 kuukauden aikana.
Niiden munuaisensiirtopotilaiden prosenttiosuus, joilla kehittyi CMV-infektio1, 12 kuukauden ITT-populaatio A
| Valgansikloviiri 900 mg kerran vuorokaudessa 100 vuorokautta (N = 163) | Valgansikloviiri 900 mg kerran vuorokaudessa 200 vuorokautta (N = 155) | Hoitoryhmien välinen ero |
Potilaat, joilla on vahvistettu tai epäilty CMV-infektio2 | 71 (43,6 %) [35,8 % ; 51,5 %] | 36 (23,2 %) [16,8 % ; 30,7 %] | 20,3 % [9,9 % ; 30,8 %] |
Potilaat, joilla on vahvistettu CMV-infektio | 60 (36,8 %) [29,4 % ; 44,7 %] | 25 (16,1 %) [10,7 % ; 22,9 %] | 20,7 % [10,9 % ; 30,4 %] |
1 CMV-infektion määritelmä: oireellinen CMV-infektio tai CMV-löydös kudoksista.
2 Vahvistettu CMV on CMV-infektion kliinisesti varmistettu tapaus. Potilailla epäiltiin olevan CMV-infektio, jos arviointia ei tehty viikolla 52 eikä CMV:tä ollut vahvistettu ennen tätä ajankohtaa.
A 24 kuukauden tulokset olivat linjassa 12 kuukauden tulosten kanssa: vahvistettu tai epäilty CMV-infektio havaittiin 48,5 %:lla potilaista, joita hoidettiin 100 vuorokautta, ja 34,2 %:lla potilaista, joita hoidettiin 200 vuorokautta; hoitoryhmien välinen ero oli 14,3 % [3,2 %; 25,3 %].
Huomattavasti pienemmälle osalle suuren riskin munuaisensiirtopotilaista kehittyi CMV-infektio saatuaan valgansikloviiria CMV:n estohoitona 200 vuorokautta elinsiirron jälkeen verrattuna potilaisiin, jotka saivat valgansikloviiria CMV:n estohoitona 100 vuorokautta elinsiirron jälkeen.
Siirteen eloonjäämisprosentti ja akuutin, biopsialla varmistetun hylkäämisreaktion ilmaantuvuus oli samankaltainen molemmissa ryhmissä. Siirteen eloonjäämisprosentti 12 kuukautta elinsiirron jälkeen oli 98,2 % (160/163) 100 vuorokauden annostusohjelmassa ja 98,1 % (152/155) 200 vuorokauden annostusohjelmassa. Enimmillään 24 kuukautta elinsiirron jälkeen ilmoitettiin lisäksi neljä uutta siirteen menettämistapausta, kaikki 100 vuorokauden annostusryhmästä. Akuutin, biopsialla varmistetun hylkäämisreaktion ilmaantuvuus 12 kuukautta elinsiirron jälkeen oli 17,2 % (28/163) 100 vuorokauden annostusohjelmassa ja 11,0 % (17/155) 200 vuorokauden annostusohjelmassa. Enimmillään 24 kuukautta elinsiirron jälkeen ilmoitettiin lisäksi yksi uusi tapaus 200 vuorokauden annostusryhmästä.
Virusresistenssi
Gansikloviirille resistenttejä viruksia voi kehittyä valgansikloviirin pitkäaikaisen käytön jälkeen, kun gansikloviirin monofosforylaatiosta vastaavassa viruksen kinaasigeenissä (UL97) ja/tai viruksen polymeraasigeenissä (UL54) tapahtuu mutaatioita. Gansikloviiriresistenssiin liittyvistä substituutioista on kliinisissä isolaateissa raportoitu yleisimmin seitsemän säännönmukaista UL97-substituutiota: M460V/I, H520Q, C592G, A594V, L595S, C603W. Virukset, joilla on mutaatioita UL97-geenissä, ovat resistenttejä ainoastaan gansikloviirille, kun taas virukset, joilla on mutaatioita UL54-geenissä, ovat resistenttejä gansikloviirille, mutta voivat osoittaa ristiresistenssiä muille viruksen polymeraasiin vaikuttaville viruslääkkeille.
CMV-retiniitin hoito:
Yhdessä kliinisessä tutkimuksessa tehty genotyyppianalyysi 148 CMV-retiniittipotilaan polymorfonukleaaristen leukosyyttien (PMNL) isolaattien CMV:stä osoitti, että 2,2 %, 6,5 %, 12,8 % ja 15,3 % isolaateista sisälsi mutaatioita UL97-geenissä 3, 6, 12 ja 18 kuukautta kestäneen valgansikloviirihoidon jälkeen.
Elinsiirtopotilaiden CMV-infektion estohoito:
Tutkimus, jossa käytettiin aktiivista vertailuryhmää
Resistenssiä selvitettiin genotyyppianalyysillä, jolla tutkittiin PMNL-näytteiden CMV:tä, kun näytteet oli otettu i) tutkimuksen 100. vuorokautena (kun estohoito tutkimuslääkkeellä oli lopetettu) ja ii) tapauksissa, joissa epäilty CMV-infektio ilmaantui kuuden kuukauden kuluessa elinsiirrosta. Niiltä 245 potilaalta, jotka satunnaistettiin saamaan valgansikloviiria, testaukseen oli käytettävissä 198 näytettä 100. vuorokautena. Näytteissä ei havaittu gansikloviiriresistenssimutaatioita. Tutkimuksen vertailevassa haarassa potilaat saivat gansikloviiria suun kautta, ja näiltä potilailta testattiin 103 näytettä, joista kahdesta (1,9 %:sta) löytyi gansikloviiriresistenssimutaatioita.
Niistä 245 potilaasta, jotka satunnaistettiin saamaan valgansikloviiria, tutkittiin näytteet 50 potilaalta, joilla oli epäilty CMV-infektio. Näytteistä ei löydetty resistenssimutaatioita. Gansikloviiria saaneeseen vertailuhaaraan satunnaistettiin yhteensä 127 potilasta. Näytteitä tutkittiin heistä 29 potilaalta, joilla oli epäilty CMV-infektio, ja näistä näytteistä löydettiin kaksi resistenssimutaatiota. Resistenssin ilmaantuvuus oli näin ollen 6,9 %.
Tutkimus, jossa estohoitoa pidennettiin 100 vuorokaudesta 200 vuorokauteen elinsiirron jälkeen
Genotyyppianalyysi tehtiin 72 potilaalta eristetyn viruksen UL54- ja UL97-geeneille. Potilaat täyttivät resistenssianalyysin kriteerit, jotka olivat positiivinen viruskuorma (> 600 kopiota/ml) estohoidon päättyessä ja/tai varmistettu CMV-infektio enimmillään 12 kuukautta (52 viikkoa) elinsiirron jälkeen. Molemmissa hoitoryhmissä kolmella potilaalla tiedettiin olevan gansikloviiriresistenssimutaatio.
Pediatriset potilaat
CMV-retiniitin hoito
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset valgansikloviirin käytöstä kaikkien immuunipuutteisten pediatristen potilasryhmien CMV-infektion hoidossa (ks. kohta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Elinsiirtopotilaiden CMV-taudin estohoito
Farmakokinetiikkaa ja turvallisuutta selvittävässä faasin II tutkimuksessa elinsiirteen saaneille lapsipotilaille (iältään 4 kuukaudesta 16 vuoteen, n = 63) annettiin valgansikloviiria kerran vuorokaudessa enintään 100 vuorokauden ajan tietyn pediatrisia potilaita koskevan annostusalgoritmin mukaan (ks. kohta Annostus ja antotapa). Aikaansaadut altistukset olivat samankaltaisia kuin aikuisilla (ks. kohta Farmakokinetiikka). Hoidon jälkeinen seuranta-aika oli 12 viikkoa. Potilaiden serologinen status (CMV D/R) lähtötilanteessa oli D+/R– 40 %, D+/R+ 38 %, D–/R+ 19 % ja D–/R– 3 %. Seitsemällä potilaalla ilmoitettiin olevan CMV-virus. Havaitut haittavaikutukset olivat luonteeltaan samankaltaisia kuin aikuisilla (ks. kohta Haittavaikutukset).
Siedettävyyttä selvittäneessä faasin IV tutkimuksessa pediatrisilla munuaissiirtopotilailla (iältään 1‑16 vuotta, n = 57), jotka saivat valgansikloviiria kerran päivässä enintään 200 päivän ajan annostuskaavan (ks. kohta Annostus ja antotapa) mukaan laskettuina annoksina, CMV-taudin ilmaantuvuus oli vähäistä. Seuranta-aika hoidon jälkeen oli 24 viikkoa. CMV-infektion D/R-serologiastatus oli lähtötilanteessa 45 %:lla potilaista D+/R+, 39 %:lla potilaista D+/R-, 7 %:lla potilaista D-/R+, 7 %:lla potilaista D-/R- ja 2 %:lla potilaista ND/R+. CMV-viremiaa raportoitiin 3 potilaalla ja CMV-oireyhtymätapausta epäiltiin yhdellä potilaalla, mutta sitä ei varmistettu keskuslaboratoriossa CMV PCR -analyysilla. Havaitut haittavaikutukset olivat luonteeltaan samankaltaisia kuin aikuisilla (ks. kohta Haittavaikutukset).
Nämä tiedot tukevat päätelmää, että tiedot tehosta aikuisilla voidaan soveltaa lapsiin ja käyttää pediatristen potilaiden annossuositusten antamiseen.
Farmakokinetiikkaa ja turvallisuutta selvittäneessä faasin I tutkimuksessa sydämensiirtopotilailla (iältään 3 viikosta 125 päivään, n = 14), jotka saivat yhden kerta-annoksen valgansikloviiria kerran päivässä kahtena peräkkäisenä päivänä pediatrisia potilaita koskevan annostuskaavan mukaisella annostuksella (ks. kohta Annostus ja antotapa), altistus oli samankaltainen kuin aikuisilla (ks. kohta Farmakokinetiikka). Seuranta-aika hoidon jälkeen oli 7 vuorokautta. Turvallisuusprofiili muissa pediatrisilla potilailla ja aikuisilla tehdyissä tutkimuksissa oli yhdenmukainen, mutta potilasmäärä ja valgansikloviirialtistus olivat tässä tutkimuksessa pienet.
Synnynnäinen CMV
Gansikloviirin ja/tai valgansikloviirin tehoa ja turvallisuutta tutkittiin kahdessa tutkimuksessa synnynnäistä oireista CMV-infektiota sairastavilla vastasyntyneillä ja imeväisillä.
Ensimmäisessä tutkimuksessa tutkittiin valgansikloviirin kerta-annoksen (annosvaihtelu 14, 16, 20 mg/kg/annos) farmakokinetiikkaa ja turvallisuutta 24 vastasyntyneellä (iältään 8–34 päivää), joilla oli oireellinen synnynnäinen CMV-infektio (ks. kohta Farmakokinetiikka). Vastasyntyneet saivat antiviraalista hoitoa 6 viikon ajan siten, että 19:ää potilasta 24:stä hoidettiin ensin 4 viikkoa oraalisella valgansikloviirilla, minkä jälkeen he saivat gansikloviiria laskimonsisäisesti 2 viikon ajan. Loput 5 potilasta saivat laskimonsisäistä gansikloviiria suurimman osan tutkimusjaksosta. Toisessa tutkimuksessa tehoa ja turvallisuutta verrattiin kuuden viikon ja kuuden kuukauden valgansikloviirihoidon aikana 109 iältään 2–30 päivän ikäisellä imeväisellä, joilla oli oireinen synnynnäinen CMV-tauti. Kaikki imeväiset saivat valgansikloviiria suun kautta annoksina 16 mg/kg kahdesti vuorokaudessa 6 viikon ajan. Imeväiset satunnaistettiin 6 viikon hoidon jälkeen suhteessa 1:1 jatkamaan valgansikloviirihoitoa samalla annoksella tai saamaan kaltaistettua lumehoitoa, kunnes hoitoa oli kestänyt 6 kuukautta.
Tätä käyttöaihetta ei tällä hetkellä suositella valgansikloviirille. Tutkimusasettelu ja saadut tulokset ovat liian rajalliset, jotta voitaisiin tehdä johtopäätöksiä valgansikloviirin tehosta ja turvallisuudesta.
Farmakokinetiikka
Valgansikloviirin farmakokinetiikkaa on tutkittu HIV- ja CMV-seropositiivisilla potilailla, AIDS-potilailla, joilla on CMV-retiniitti, sekä elinsiirtopotilailla.
Annoksen verrannollisuutta gansikloviirin AUC-arvoon tutkittiin antamalla ruokailun yhteydessä valgansikloviiriannoksia, jotka vaihtelivat 450 mg:sta 2 625 mg:aan.
Imeytyminen
Valgansikloviiri on gansikloviirin aihiolääke. Se imeytyy hyvin maha-suolikanavasta ja metaboloituu nopeasti ja tehokkaasti gansikloviiriksi suolen seinämässä ja maksassa. Valgansikloviirin systeeminen altistus on lyhytaikaista ja pientä. Suun kautta otetusta valgansikloviirista saadun gansikloviirin hyötyosuus on noin 60 % koko tutkitussa potilaspopulaatiossa, ja saavutettu gansikloviirialtistus on samankaltainen kuin gansikloviirin laskimonsisäisen annon jälkeen (ks. alla olevat tiedot). Vastaavasti gansikloviirin hyötyosuus on 6–8 % oraalisen 1 000 mg:n (kapseleina otetun) gansikloviiriannoksen jälkeen.
HIV- ja CMV-positiivisille potilaille annettu valgansikloviiri:
HIV- ja CMV-positiivisten potilaiden systeeminen altistus, kun gansikloviiria ja valgansikloviiria on annettu kaksi kertaa vuorokaudessa yhden viikon ajan:
Muuttuja | Gansikloviiri (5 mg/kg, i.v.) n = 18 | Valgansikloviiri (900 mg, p.o.) n = 25 | |
Gansikloviiri | Valgansikloviiri | ||
AUC (0–12 h) (μg.h/ml) | 28,6 ± 9,0 | 32,8 ± 10,1 | 0,37 ± 0,22 |
Cmax (μg/ml) | 10,4 ± 4,9 | 6,7 ± 2,1 | 0,18 ± 0,06 |
Gansikloviirin tehon, joka mitataan kykynä pidentää CMV-retiniitin etenemiseen kuluvaa aikaa, on osoitettu korreloivan systeemisen altistuksen (AUC) kanssa.
Elinsiirtopotilaille annettu valgansikloviiri:
Elinsiirtopotilaiden vakaan tilan systeeminen altistus suun kautta otettavan gansikloviirin ja valgansikloviirin päivittäisen annon jälkeen:
Muuttuja | Gansikloviiri (1 000 mg 3 kertaa vrk:ssa) n = 82 | Valgansikloviiri (900 mg kerran vrk:ssa) n = 161 |
Gansikloviiri | ||
AUC (0–24 h) (μg.h/ml) | 28,0 ± 10,9 | 46,3 ± 15,2 |
Cmax (μg/ml) | 1,4 ± 0,5 | 5,3 ± 1,5 |
Gansikloviirin systeeminen altistus oli samankaltainen sydämen-, munuaisen- ja maksansiirtopotilailla munuaistoiminnan mukaisen annostusalgoritmin mukaisen, suun kautta otetun valgansikloviiriannoksen jälkeen.
Ruoan vaikutus:
Kun valgansikloviirin suositusannos 900 mg annettiin aterian yhteydessä, sekä gansikloviirin keskimääräinen AUC-arvo (noin 30 %) että gansikloviirin keskimääräinen Cmax-arvo (noin 14 %) nousivat verrattuna paastotilanteeseen. Lisäksi gansikloviirialtistuksen yksilöllinen vaihtelu pienenee, kun valgansikloviiri otetaan aterian yhteydessä. Kliinisissä tutkimuksissa valgansikloviiri annettiin vain ruoan kanssa. Siksi valgansikloviiri on suositeltavaa ottaa aterian yhteydessä (ks. kohta Annostus ja antotapa).
Jakautuminen:
Koska valgansikloviiri muuttuu nopeasti gansikloviiriksi, valgansikloviirin sitoutumista proteiineihin ei ole määritetty. Gansikloviirin vakaan tilan jakautumistilavuus (Vd) oli laskimonsisäisen annon jälkeen 0,680 ± 0,161 l/kg (n = 114). Laskimoon annetun gansikloviirin jakautumistilavuus korreloi painon kanssa, ja vakaan tilan jakautumistilavuus on 0,54 ± 0,87 l/kg. Gansikloviiri kulkeutuu aivo-selkäydinnesteeseen. Gansikloviiripitoisuuksilla 0,5–51 µg/ml plasman proteiineihin sitoutui 1–2 %.
Biotransformaatio
Valgansikloviiri metaboloituu nopeasti ja tehokkaasti gansikloviiriksi; muita metaboliitteja ei ole löydetty. Itse gansikloviiri ei metaboloidu merkittävässä määrin.
Eliminaatio
Oraalisen annoksen jälkeen valgansikloviiri hydrolysoituu nopeasti gansikloviiriksi. Gansikloviiri eliminoituu systeemisestä verenkierrosta glomerulusfiltraation ja aktiivisen tubulaarisen erittymisen kautta. Potilailla, joiden munuaisten toiminta oli normaali, yli 90 % laskimoon annetusta gansikloviiriannoksesta oli havaittavissa 24 tunnin kuluessa muuttumattomana aineena virtsassa. Potilailla, joiden munuaisten toiminta oli normaali, valgansikloviirin annon jälkeinen gansikloviirin pitoisuus pienenee plasmassa saavutetun huippupitoisuuden jälkeen siten, että puoliintumisaika on 0,4–2,0 tuntia.
Farmakokinetiikka erityisissä kliinisissä tilanteissa
Pediatriset potilaat
Farmakokinetiikkaa ja turvallisuutta selvittävässä faasin II tutkimuksessa, johon osallistui elinsiirteen saaneita lapsipotilaita (iältään 4 kuukaudesta 16 vuoteen, n = 63), annettiin valgansikloviiria kerran vuorokaudessa 100 vuorokauden ajan. Farmakokineettiset muuttujat olivat samankaltaiset elinsiirteestä ja iästä riippumatta ja verrattavissa aikuisten muuttujiin. Populaatiofarmakokineettinen mallinnus viittasi siihen, että hyötyosuus olisi noin 60 %. Sekä kehon pinta-ala että munuaisten toiminta vaikuttivat myönteisesti puhdistumaan. Farmakokinetiikkaa ja turvallisuutta selvittäneessä faasin I tutkimuksessa sydänsiirron saaneille pediatrisille potilaille (iältään 3 viikkoa – 125 päivää, n = 14) annettiin valgansikloviiria kerran vuorokaudessa kahden tutkimuspäivän ajan. Populaatiofarmakokinetiikan perusteella arvioitu keskimääräinen biologinen hyötyosuus oli 64 %. Näiden kahden tutkimuksen tulosten ja aikuispotilasjoukon farmakokineettisten tulosten vertailu osoittaa, että AUC0-24h-arvojen vaihteluväli oli kaikissa ikäryhmissä, myös aikuisilla, hyvin samankaltainen. Keskimääräiset AUC0-24h- ja Cmax-arvot olivat samankaltaiset myös kaikissa < 12‑vuotiaissa pediatrisissa ikäryhmissä, vaikka AUC0-24h- ja Cmax-arvojen keskiarvot yleensä pienenivätkin kaikissa pediatrisissa ikäryhmissä, mikä vaikutti olevan yhteydessä iän lisääntymiseen. Tällainen muutos oli puhdistuman ja puoliintumisajan (t1/2) keskimääräisillä arvoilla selkeämpi. Tämä oli kuitenkin oletettavissa, koska paino, pituus ja potilaan kasvuun liittyvä munuaisten toiminta vaikuttavat puhdistumaan, minkä populaatiofarmakokineettinen mallinnus osoitti.
Seuraavassa taulukossa esitetään yhteenveto näissä kahdessa tutkimuksessa mallin perusteella arvioiduista gansikloviirin AUC0-24h -arvoista sekä AUC0-24h-, Cmax-, CL- ja t1/2-arvojen keskiarvoista ja keskihajonnasta tutkituissa pediatristen potilaiden ikäryhmissä verrattuina aikuisten arvoihin:
PK-muuttuja | Aikuiset* | Pediatriset potilaat | |||
≥ 18vuotta (n = 160) | < 4 kuukautta (n = 14) | 4 kuukautta – ≤ 2 vuotta (n = 17) | > 2 – < 12 vuotta (n = 21) | ≥ 12 vuotta – 16 vuotta (n = 25) | |
AUC0-24h (μg.h/ml) | 46,3 ± 15,2 | 68,1 ± 19,8 | 64,3 ± 29,2 | 59,2 ± 15,1 | 50,3 ± 15,0 |
AUC0-24h-arvon vaihteluväli | 15,4–116,1 | 34–124 | 34–152 | 36–108 | 22–93 |
Cmax (μg/ml) | 5,3 ± 1,5 | 10,5 ± 3,36 | 10,3 ± 3,3 | 9,4 ± 2,7 | 8,0 ± 2,4 |
Puhdistuma (l/h) | 12,7 ± 4,5 | 1,25 ± 0,473 | 2,5 ± 2,4 | 4,5 ± 2,9 | 6,4 ± 2,9 |
t1/2 (h) | 6,5 ± 1,4 | 1,97 ± 0,185 | 3,1 ± 1,4 | 4,1 ± 1,3 | 5,5 ± 1,1 |
* Tiedot otettu tutkimusraportista PV 16000
Edellä kuvattu kerran vuorokaudessa annetun valgansikloviiriannoksen suuruus perustui kummassakin tutkimuksessa kehon pinta-alaan (BSA) ja modifioidulla Schwartzin kaavalla saatuun kreatiniinin puhdistumaan (Pt-Krea-Cl) ja se laskettiin kohdassa Annostus ja antotapa esitetyn annoslaskukaavan mukaan.
Gansikloviirin farmakokinetiikkaa arvioitiin valgansikloviirin antamisen jälkeen kahdessa tutkimuksessa myös oireista synnynnäistä CMV-tautia sairastavilla vastasyntyneillä ja imeväisillä. Ensimmäisessä tutkimuksessa 24 vastasyntynyttä (iältään 8–34 päivää) sai laskimonsisäistä gansikloviiria annostuksella 6 mg/kg kahdesti vuorokaudessa. Tämän jälkeen potilaita hoidettiin suun kautta annettavalla valgansikloviirilla (jauheella oraaliliuosta varten), jonka annostus oli 14 mg/kg–20 mg/kg kahdesti vuorokaudessa, ja hoidon kokonaiskesto oli 6 viikkoa. Valgansikloviirin (jauheen oraaliliuosta varten) annos 16 mg/kg kahdesti vuorokaudessa johti vastasyntyneillä samanlaiseen gansikloviirialtistukseen, joka saatiin aikaan laskimonsisäisellä gansikloviiriannoksella 6 mg/kg kahdesti vuorokaudessa. Sillä saavutettiin myös samankaltainen gansikloviirialtistus kuin aikuisten laskimonsisäisellä annoksella 5 mg/kg.
Toisessa tutkimuksessa 109 vastasyntynyttä (iältään 2–30 päivää) sai 16 mg/kg valgansikloviiria jauheena oraaliliuosta varten kaksi kertaa päivässä 6 viikon ajan, minkä jälkeen näistä 109 tutkimukseen mukaan otetusta potilaasta 96 satunnaistettiin jatkamaan valgansikloviirihoitoa tai saamaan lumelääkettä 6 kuukauden ajan. Keskimääräinen AUC0-12h-arvo oli kuitenkin pienempi verrattuna ensimmäisen tutkimuksen AUC0-12h-arvoihin. Seuraavassa taulukossa esitetään AUC-, Cmax- ja t1/2 -arvojen keskiarvot ja keskihajonnat verrattuina aikuisten tietoihin:
PK-muuttuja | Aikuiset | Pediatriset potilaat (vastasyntyneet ja imeväiset) | ||
| 5 mg/kg GAN kerta-annos (n = 8) | 6 mg/kg GAN kahdesti vuorokaudessa (n = 19) | 16 mg/kg VAL kahdesti vuorokaudessa (n = 19) | 16 mg/kg VAL kahdesti vuorokaudessa (n = 100) |
AUC0-∞ (μg.h/ml) | 25,4 ± 4,32 | – | – | – |
AUC12 h (μg.h/ml) | – | 38,2 ± 42,7 | 30,1 ± 15,1 | 20,85 ± 5,40 |
Cmax (μg/ml) | 9,03 ± 1,26 | 12,9 ± 21,5 | 5,44 ± 4,04 | – |
t1/2 (h) | 3,32 ± 0,47 | 2,52 ± 0,55 | 2,98 ± 1,26 | 2,98 ± 1,12 |
GAN = gansikloviiri laskimoon
VAL = valgansikloviiri suun kautta
Nämä tiedot ovat liian rajalliset, jotta voitaisiin tehdä johtopäätöksiä tehosta tai antaa annostussuosituksia lapsipotilaille, joilla on synnynnäinen CMV-infektio.
Iäkkäät potilaat
Valgansikloviirin tai gansikloviirin farmakokinetiikkaa ei ole tutkittu yli 65-vuotiailla aikuisilla (ks. kohta Annostus ja antotapa).
Munuaisten vajaatoimintaa sairastavat potilaat
Suun kautta otetun 900 mg:n valgansikloviirikerta-annoksen jälkeistä gansikloviirin farmakokinetiikkaa tutkittiin 24 munuaisten vajaatoimintaa sairastavalla henkilöllä, jotka olivat muuten terveitä.
Gansikloviirin farmakokineettiset parametrit suun kautta otetun valgansikloviirin (tabletti, 900 mg:n kerta-annos) jälkeen potilailla, joilla on eriasteista munuaisten vajaatoimintaa:
Arvioitu kreatiniinipuhdistuma (ml/min) | N | Näennäinen puhdistuma (ml/min), keskiarvo ± keskihajonta | AUClast (μg∙h/ml), keskiarvo ± keskihajonta | Puoliintumisaika (tuntia), keskiarvo ± keskihajonta |
51–70 | 6 | 249 ± 99 | 49,5 ± 22,4 | 4,85 ± 1,4 |
21–50 | 6 | 136 ± 64 | 91,9 ± 43,9 | 10,2 ± 4,4 |
11–20 | 6 | 45 ± 11 | 223 ± 46 | 21,8 ± 5,2 |
≤ 10 | 6 | 12,8 ± 8 | 366 ± 66 | 67,5 ± 34 |
Munuaisten toiminnan heikkeneminen vähensi valgansikloviirista peräisin olevan gansikloviirin puhdistumaa ja pidensi vastaavasti terminaalista puoliintumisaikaa. Siksi annosmuutoksia tarvitaan munuaisten vajaatoimintaa sairastavilla potilailla (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Hemodialyysihoitoa saavat potilaat
Hemodialyysipotilaille ei voida antaa Valganciclovir Orion 450 mg sisältävien kalvopäällysteisten tablettien annossuosituksia. Tämä johtuu siitä, että näiden potilaiden tarvitsema yksittäinen annos on pienempi kuin tabletin vahvuus 450 mg. Siksi Valganciclovir Orion kalvopäällysteisiä tabletteja ei saa käyttää näiden potilaiden hoitoon (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Maksansiirtopotilaat joiden tila on vakaa
Valgansikloviirista peräisin olevan gansikloviirin farmakokinetiikkaa tutkittiin stabiileilla maksansiirtopotilailla eräässä avoimessa neliosaisessa ristikkäistutkimuksessa (N = 28). 900 mg:n valgansikloviirikerta-annoksen jälkeen valgansikloviirista peräisin olevan gansikloviirin biologinen hyötyosuus ruokailun jälkeen oli noin 60 %. Gansikloviirin AUC0-24h-arvo oli verrannollinen sen arvon kanssa, joka todettiin 5 mg/kg gansikloviiria laskimoon saaneilla maksansiirtopotilailla.
Maksan vajaatoimintaa sairastavat potilaat
Valgansikloviiri-tablettien turvallisuutta ja tehoa ei ole tutkittu maksan vajaatoimintaa sairastavilla potilailla. Maksan vajaatoiminta ei vaikuttane merkittävästi gansikloviirin farmakokinetiikkaan, koska se erittyy munuaisten kautta ja siksi erityisiä annossuosituksia ei anneta.
Kystistä fibroosia sairastavat potilaat
Farmakokinetiikkaa koskevassa faasin I tutkimuksessa kystistä fibroosia sairastavilla ja sairastamattomilla keuhkonsiirron saaneilla potilailla 31 potilasta (16 kystistä fibroosia sairastavaa/15 kystistä fibroosia sairastamatonta) sai siirtoleikkauksen jälkeen estohoitona valgansikloviiriä 900 mg/vrk. Tutkimus osoitti, että kystisellä fibroosilla ei ollut keuhkonsiirtopotilailla tilastollisesti merkitsevää vaikutusta gansikloviirin keskimääräiseen systeemiseen kokonaisaltistukseen. Keuhkonsiirtopotilaiden gansikloviirialtistus oli verrattavissa altistukseen, jonka osoitettiin olevan tehokas CMV-taudin estossa muun elinsiirteen saaneilla potilailla.
Prekliiniset tiedot turvallisuudesta
Valgansikloviiri on gansikloviirin aihiolääke, joten gansikloviirin havaitut vaikutukset koskevat myös valgansikloviiria.
Gansikloviiri oli mutageeninen hiiren lymfoomasoluissa ja klastogeeninen nisäkässoluissa. Tällaiset tulokset ovat yhdenmukaisia gansikloviiria koskevien positiivisten hiiren karsinogeenisuustutkimusten kanssa. Gansikloviiri on mahdollisesti karsinogeeninen.
Gansikloviiri heikentää eläinten hedelmällisyyttä ja on eläimillä teratogeeninen. Eläinkokeissa indusoitiin aspermatogeneesi hoitoannoksia pienemmillä systeemisillä gansikloviirialtistuksilla, joten tämän perusteella katsotaan todennäköiseksi, että gansikloviiri estää ihmisen spermatogeneesin.
Eläimistä saadut tiedot osoittavat, että gansikloviiri erittyy imettävien rottien maitoon.
Farmaseuttiset tiedot
Apuaineet
Tabletin ydin
Mikrokiteinen selluloosa (tyyppi 101 ja tyyppi 102)
Krospovidoni (tyyppi B)
Povidoni (K-30)
Magnesiumstearaatti
Kalvopäällyste
Hypromelloosi (3 cP, 6 cP)
Titaanidioksidi (E171)
Makrogoli 400
Polysorbaatti 80
Punainen rautaoksidi (E172)
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta.
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
VALGANCICLOVIR ORION tabletti, kalvopäällysteinen
450 mg (L:ei) 60 kpl (1817,77 €)
PF-selosteen tieto
Kalvopäällysteiset Valganciclovir Orion -tabletit ovat saatavissa läpipainopakkauksessa (polyamidi-alumiini-PVC/alumiini) ja HDPE-pullossa, jossa on polypropeenikorkki ja täytevanua.
Pakkauskoot:
Läpipainopakkaukset: 10, 30, 60 ja 100 kalvopäällysteistä tablettia.
HDPE-pakkaukset: 60 ja 1 000 kalvopäällysteistä tablettia.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Vaaleanpunainen, soikion muotoinen, kaksoiskupera, kalvopäällysteinen tabletti, jonka toisella puolella on kohokuviona H-kirjain ja toisella puolella ”96”. Koko on 16,8 mm x 7,9 mm.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
VALGANCICLOVIR ORION tabletti, kalvopäällysteinen
450 mg 60 kpl
- Ei korvausta.
ATC-koodi
J05AB14
Valmisteyhteenvedon muuttamispäivämäärä
13.04.2018
Yhteystiedot
 ORION OYJ ORION PHARMA
ORION OYJ ORION PHARMA Orionintie 1, PL 65
02101 Espoo
010 4261
www.orion.fi
etunimi.sukunimi@orionpharma.com
