DUVYZAT oraalisuspensio 8,86 mg/ml
Huomioitavaa
▼Tähän lääkevalmisteeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti turvallisuutta koskevaa uutta tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä lääkkeen haittavaikutuksista. Ks. kohdasta Haittavaikutukset, miten haittavaikutuksista ilmoitetaan.
Vaikuttavat aineet ja niiden määrät
Yksi ml sisältää 8,86 mg givinostaattia (hydrokloridimonohydraattina).
Apuaine(et), joiden vaikutus tunnetaan
Yksi ml sisältää 4,4 mg natriumbentsoaattia (E211).
Yksi ml sisältää 400 mg sorbitolia (E420).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Oraalisuspensio.
Kliiniset tiedot
Käyttöaiheet
Duvyzat on tarkoitettu Duchennen lihasdystrofian (DMD) hoitoon kävelykykyisille vähintään 6 vuoden ikäisille potilaille yhdessä kortikosteroidihoidon kanssa.
Ehto
Valmisteen käyttöaiheissa mainittujen sairauksien hoitoon perehtyneen lääkärin on aloitettava hoito.
Annostus ja antotapa
Givinostaattihoidon saa aloittaa vain Duchennen lihasdystrofian hoitoon perehtynyt lääkäri.
Annostus
Lähtötilanteen verihiutalemäärä ja triglyseridipitoisuus on määritettävä ennen givinostaattihoidon aloittamista. Givinostaattihoitoa ei saa aloittaa potilaille, joiden verihiutalemäärä on alle 150 x 109/l. Verihiutalemäärää ja triglyseridipitoisuutta on seurattava suositusten mukaisesti hoidon aikana, ja annostusta on tarvittaessa muutettava niiden perusteella (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet sekä alla olevat ohjeet annoksen muuttamiseen).
Lisäksi potilaille, joilla on sydänsairaus tai jotka saavat samanaikaista hoitoa QT-aikaa pidentävillä lääkkeillä, on tehtävä EKG-tutkimus givinostaattihoitoa aloitettaessa, samanaikaisen käytön aikana sekä kliinisen tarpeen mukaan (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Suositeltu givinostaattiannos perustuu potilaan painoon, ja givinostaattia otetaan suun kautta kahdesti päivässä (ks. taulukko 1).
Taulukko 1 – Suositeltu annostus
| Paino(a) | Annostus | Oraalisuspension määrä |
| 15 kg – alle 20 kg | 22,2 mg kahdesti päivässä | 2,5 ml kahdesti päivässä |
| 20 kg – alle 40 kg | 31 mg kahdesti päivässä | 3,5 ml kahdesti päivässä |
| 40 kg – alle 60 kg | 44,3 mg kahdesti päivässä | 5 ml kahdesti päivässä |
| Vähintään 60 kg | 53,2 mg kahdesti päivässä | 6 ml kahdesti päivässä |
(a)Potilaan nykyinen paino
Päätöksen jatkaa hoitoa potilaille, jotka menettävät kävelykykynsä hoidon aikana, tulee perustua lääkärin hyöty-riskiarvioon.
Annoksen muuttaminen trombosytopenian, ripulin tai hypertriglyseridemian takia
Annosta on pienennettävä (ks. taulukko 2) seuraavissa tapauksissa:
-
verihiutalemäärä < 150 x 109/l vahvistettu kahdella mittauksella, joiden välissä 1 viikko
tai -
keskivaikea tai vaikea ripuli (yli 4 ulostuskertaa päivässä)
tai - triglyseridien paastoarvo >300 mg/dl vahvistettu kahdella mittauksella, joiden välissä 1 viikko.
Hoidon keskeyttämistä ennen annoksen muuttamista on harkittava näiden haittavaikutusten vaikeusasteen perusteella.
Taulukko 2 – Annostuksen muuttaminen haittavaikutusten takia
| Ensimmäinen annosmuutos(b) | Toinen annosmuutos(c) | |||
| Paino(a) | Annostus | Oraalisuspension määrä | Annostus | Oraalisuspension määrä |
| 15 kg – alle 20 kg | 17,7 mg kahdesti päivässä | 2 ml kahdesti päivässä | 13,3 mg kahdesti päivässä | 1,5 ml kahdesti päivässä |
| 20 kg – alle 40 kg | 22,2 mg kahdesti päivässä | 2,5 ml kahdesti päivässä | 17,7 mg kahdesti päivässä | 2 ml kahdesti päivässä |
| 40 kg – alle 60 kg | 31 mg kahdesti päivässä | 3,5 ml kahdesti päivässä | 26,6 mg kahdesti päivässä | 3 ml kahdesti päivässä |
| Vähintään 60 kg | 39,9 mg kahdesti päivässä | 4,5 ml kahdesti päivässä | 35,4 mg kahdesti päivässä | 4 ml kahdesti päivässä |
(a)Potilaan nykyinen paino
(b) Jos haittavaikutus ei korjaannu ensimmäisen annosmuutoksen jälkeen, tee toinen annosmuutos.
(c) Jos haittavaikutus ei korjaannu toisen annosmuutoksen jälkeen, Duvyzat-hoito on lopetettava.
Annoksen unohtuessa potilaan ei pidä ottaa kaksinkertaista tai ylimääräistä annosta.
Pediatriset potilaat
Duvyzat-valmisteen tehoa ja turvallisuutta alle 6 vuoden ikäisten lasten hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
Antotapa
Suun kautta.
Ennen käyttöä suspensio on sekoitettava vähintään 30 sekunnin ajan kääntelemällä pulloa ylösalaisin 180° noin 40 kertaa. Suspension homogeenisuus on myös varmistettava silmämääräisesti ennen käyttöä.
Väärällä tavalla tehty sekoittaminen saattaa johtaa liian suuren tai pienen annoksen ottamiseen.
Duvyzat on otettava sellaisenaan (sitä ei saa laimentaa vedellä tai muulla nesteellä).
Suspensio on otettava mukana tulevalla asteikollisella mittaruiskulla, johon vedetään oikea, potilaalle määrättyä annosta vastaava määrä suspensiota.
Duvyzat on otettava ruoan kanssa givinostaatin karvaan maun vähentämiseksi.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Hematologiset vaikutukset
Givinostaattihoitoon liittyy annosriippuvaista trombosytopeniaa ja muita myelosuppression merkkejä, kuten hemoglobiinipitoisuuden laskua ja neutropeniaa.
Vaikutus kohdistuu selvimmin verihiutalemäärään (ks. kohta Haittavaikutukset).
Potilaan täydellinen verenkuva on määritettävä ennen givinostaattihoidon aloittamista. Verihiutalemäärää on seurattava huolellisesti givinostaattihoidon aikana: 2 viikon välein ensimmäisten 2 hoitokuukauden ajan, 3 kuukauden kohdalla sekä 3 kuukauden välein tämän jälkeen.
Persistoivan trombosytopenian tapauksessa givinostaattiannosta on muutettava. Hoito on lopetettava, mikäli poikkeavuudet eivät korjaannu annosmuutoksista huolimatta (ks. kohta Annostus ja antotapa).
Jos potilaan annosta suurennetaan painon nousun takia, verihiutalemäärää on seurattava huolellisesti 2 viikon välein annoksen suurentamisen jälkeisten 2 kuukauden ajan.
Triglyseridipitoisuuden nousu
Givinostaattihoitoon liittyy seerumin triglyseridipitoisuuden nousua.
Triglyseridipitoisuus on määritettävä ennen givinostaattihoidon aloittamista.
Triglyseridipitoisuutta on sen jälkeen seurattava vähintään kolmantena ja kuudentena hoitokuukautena sekä sen jälkeen 6 kuukauden välein.
Persistoivan korkean triglyseridien paastoarvon (> 300 mg/dl) tapauksessa givinostaattiannosta on muutettava kohdassa Annostus ja antotapa annettujen ohjeiden mukaisesti.
Givinostaattihoito on lopetettava, mikäli triglyseridit ovat koholla asianmukaisista ruokavaliomuutoksista sekä annosmuutoksista huolimatta (ks. kohta Annostus ja antotapa).
Maha-suolikanavan häiriöt
Ripuli ja oksentelu olivat hyvin yleisiä lääkehaittavaikutuksia givinostaatin kliinisissä tutkimuksissa Duchennen lihasdystrofiaa sairastavilla potilailla (ks. kohta Haittavaikutukset).
Ripuli ja oksentelu ilmaantuvat yleensä muutaman viikon kuluessa givinostaattihoidon aloittamisesta.
Pahoinvointilääkkeiden tai ripulilääkkeiden käyttöä voidaan harkita givinostaattihoidon aikana.
Nesteytystä ja elektrolyyttejä on tarvittaessa annettava kuivumisen ehkäisemiseksi.
Keskivaikean tai vaikean ripulin (yli 4 ulostuskertaa päivässä) tapauksessa givinostaattiannosta on muutettava (ks. kohta Annostus ja antotapa).
Hoito on lopetettava, mikäli oireet eivät korjaannu annosmuutoksista huolimatta (ks. kohta Annostus ja antotapa).
QTc-ajan pidentyminen
Givinostaatti saattaa pidentää QTc-aikaa suositeltua annosta 5 kertaa suuremmilla annoksilla.
Givinostaattia on käytettävä varoen potilaille, joilla on suurentunut kammioperäisten rytmihäiriöiden (mukaan lukien torsades de pointes, kääntyvien kärkien takykardian) riski, synnynnäinen pitkä QT -oireyhtymä, sepelvaltimotauti, elektrolyyttihäiriöitä tai jotka käyttävät samanaikaisesti muita lääkevalmisteita, joiden tiedetään pidentävän QT-aikaa. Tällaisille potilaille on tehtävä EKG-tutkimus Duvyzat-hoitoa aloitettaessa, samanaikaisen käytön aikana sekä kliinisen tarpeen mukaan.
Duvyzat-hoito on keskeytettävä, jos QTc-aika on > 500 ms tai pidentynyt > 60 ms lähtötilanteesta.
Jos potilaalla on hypokalemia, se on korjattava ennen givinostaattihoidon aloittamista, ja ripulin aiheuttaman kuivumisen tapauksessa potilaan kaliumpitoisuutta on seurattava.
Apuaineet, joiden vaikutus tunnetaan
Tätä lääkevalmistetta ei pidä antaa potilaille, joilla on perinnöllinen fruktoosi-intoleranssi (HFI).
Tämä lääkevalmiste sisältää 400 mg sorbitolia per ml, joka vastaa 40 mg:aa/kg.
Sorbitolia (tai fruktoosia) sisältävien muiden valmisteiden samanaikaisen annon sekä ravinnosta saatavan sorbitolin (tai fruktoosin) additiivinen vaikutus on huomioitava.
Suun kautta otettavien lääkevalmisteiden sorbitoli saattaa vaikuttaa muiden suun kautta otettavien lääkkeiden biologiseen hyötyosuuteen.
Tämä lääkevalmiste sisältää 4,4 mg natriumbentsoaattia per ml, joka vastaa 0,44 mg:aa/kg.
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per annos eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Varovaisuutta on noudatettava, kun Duvyzat-valmistetta määrätään samanaikaisesti QT-aikaa pidentävien lääkevalmisteiden kanssa, tai joihin saattaa liittyä torsades de pointes, kääntyvien kärkien takykardian riski. Tällaisia valmisteita ovat esimerkiksi nukutusaineet (esim. sevofluraani, propofoli), luokan III rytmihäiriölääkkeet (esim. amiodaroni, sotaloli), antiemeetit (esim. ondansetroni), antibiootit (esim., atsitromysiini, klaritromysiini, siprofloksasiini), sienilääkkeet (flukonatsoli), psykoosilääkkeet (esim. aripipratsoli, risperidoni) ja antihistamiinit (esim. famotidiini). Tämä luettelo on suuntaa antava eikä ole täydellinen.
Duvyzat-valmisteen ja antikoagulanttien samanaikaisen käytön vaikutusta verihiutalemäärään ei tunneta.
Duvyzat-valmistetta on käytettävä varoen potilaille, jotka käyttävät samanaikaisesti lääkkeitä, joiden tiedetään nostavan triglyseridipitoisuutta, sillä samanaikainen käyttö saattaa lisätä hypertriglyseridemian riskiä.
Givinostaatin vaikutus muiden lääkevalmisteiden farmakokinetiikkaan
Ihmisillä tehdyssä lääkeyhteisvaikutustutkimuksessa havaittiin lievä CYP3A4-estovaikutus, pääasiassa suolistossa. Varovaisuutta on noudatettava, kun givinostaattia käytetään samanaikaisesti sellaisten lääkevalmisteiden kanssa, jotka ovat CYP3A4:n substraatteja ja terapeuttiselta indeksiltään kapeita.
Mahdollista suoliston kuljettajaproteiini P‑gp:n estoa ei voida sulkea pois. Terapeuttiselta indeksiltään kapeita lääkevalmisteita, joiden tiedetään olevan P‑gp:n substraatteja, on käytettävä varoen givinostaattihoidon aikana.
Lievä munuaisten kuljettajaproteiini OCT2:n estovaikutus havaittiin in vitro sekä givinostaatin kliinisissä tutkimuksissa kreatiniinin mittausten perusteella. Terapeuttiselta indeksiltään kapeita lääkevalmisteita, joiden tiedetään olevan OCT2:n substraatteja, on käytettävä varoen givinostaattihoidon aikana.
Raskaus ja imetys
Raskaus
Givinostaatin käytöstä raskaana oleville naisille ei ole olemassa tietoja. Eläimillä tehdyissä tutkimuksissa on havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta).
Varmuuden vuoksi givinostaatin käyttöä on suositeltavaa välttää raskauden aikana.
Imetys
Ei tiedetä, erittyvätkö givinostaatti tai sen metaboliitit ihmisillä äidinmaitoon. Imetettävään vauvaan kohdistuvia riskejä ei voida sulkea pois. Givinostaattia ei pidä käyttää imetyksen aikana.
Hedelmällisyys
Givinostaatin vaikutuksesta ihmisen hedelmällisyyteen ei ole olemassa tietoja. Givinostaatti aiheutti lisäsukupuolirauhasiin kohdistuvia haittavaikutuksia urosrotilla, mutta tämä ei vaikuttanut eläinten hedelmällisyyteen (ks. kohta Prekliiniset tiedot turvallisuudesta). Löydöksen merkitystä ihmiselle ei tunneta.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Givinostaatilla saattaa olla vähäinen vaikutus ajokykyyn ja koneidenkäyttökykyyn.
Givinostaatin ottamisen jälkeen saattaa esiintyä huimausta ja väsymystä (ks. kohta Haittavaikutukset).
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Duvyzat-valmisteen turvallisuusprofiili perustuu faasin 3 kaksoissokkoutettuun, lumekontrolloituun, 18 kuukauden pituiseen tutkimukseen yhteensä 179 kävelykykyisellä Duchennen lihasdystrofiaa sairastavalla, vähintään 6‑vuotiaalla potilaalla, jotka saivat samanaikaista steroidihoitoa ja joista 118 sai givinostaattia enintään 62 mg kahdesti päivässä ja 61 lumelääkettä (EPIDYS-tutkimus).
Lumekontrolloidussa tutkimuksessa yleisimmin esiintyneet haittatapahtumat (yhdistelmätermien mukaan, mikäli sovellettavissa) olivat ripuli (38,1 %), vatsakipu (33,9 %), trombosytopenia (32,2 %), oksentelu (28,8 %) ja hypertriglyseridemia (22,9 %).
Haittavaikutusten taulukkomuotoinen luettelo
Haittavaikutukset on lueteltu MedDRA:n elinjärjestelmä- ja yleisyysluokkien mukaan (ks. taulukko 3). Taulukko sisältää EPIDYS-tutkimuksessa givinostaattia saaneilla potilailla raportoidut haittatapahtumat, joiden yleisyys oli yli 2 % suurempi verrattuna lumelääkettä saaneisiin potilaisiin.
Yleisyysluokat ovat seuraavat: Hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Taulukko 3 – Lumekontrolloidussa EPIDYS-tutkimuksessa givinostaattia saaneilla potilailla raportoidut lääkehaittavaikutukset, joiden yleisyys oli yli 2 % suurempi verrattuna lumelääkettä saaneisiin potilaisiin
| Elinjärjestelmäluokka | Hyvin yleinen | Yleinen |
| Infektiot | Maha-suolitulehdus | |
| Veri ja imukudos | Trombosytopenia(a) | |
| Aineenvaihdunta ja ravitsemus | Hypertriglyseridemia(b) | Ruokahalun heikentyminen |
| Psyykkiset häiriöt | Ahdistus | |
| Hermosto | Huimaus | |
| Verisuonisto | Hematooma | |
| Ruoansulatuselimistö | Ripuli(c), oksentelu, vatsakipu(d) | Ummetus |
| Iho ja ihonalainen kudos | Eryteema, ihottuma | |
| Luusto, lihakset ja sidekudos | Lihaskipu, nivelkipu, lihasheikkous | |
| Yleisoireet ja antopaikassa todettavat haitat | Kuume | Väsymys |
| Tutkimukset | Kohonnut veren tyreotropiinipitoisuus(e) |
(a) Trombosytopenia käsittää pienentyneen verihiutalemäärän ja trombosytopenian.
(b) Hypertriglyseridemia käsittää hypertriglyseridemian ja kohonneen veren triglyseridipitoisuuden.
(c) Ripuli käsittää ripulin ja löysän ulosteen.
(d) Vatsakipu käsittää vatsakivun ja ylävatsakivun.
(e) Kohonnut veren tyreotropiinipitoisuus käsittää kilpirauhasen toimintakokeen poikkeavan tuloksen ja kohonneen veren tyreotropiinipitoisuuden.
Valittujen haittavaikutusten kuvaus
Hematologiset muutokset
Givinostaatin on osoitettu pienentävän verihiutalemäärää. Verihiutalemäärä oli pienimmillään noin 88 päivän jälkeen, ja se pysyi alhaisena koko hoidon ajan. Trombosytopeniaan liittyviä vakavia verenvuototapahtumia ei esiintynyt. Givinostaattiannoksen pienentämisen jälkeen verihiutalemäärä palasi viitealueelle noin 3–4 viikossa.
Trombosytopeniaa esiintyi 32,2 %:lla Duvyzat-hoitoa saaneista potilaista, eikä kenelläkään lumelääkettä saaneista potilaista. Tapahtumista 86,8 % raportoitiin lievinä ja 13,2 % keskivaikeina.
Alhainen verihiutalemäärä johti givinostat-annoksen alentamiseen 28%:lla potilaista. Potilaita, joiden verisolumäärä oli lähtötilanteessa viitealueen alapuolella, ei otettu mukaan tutkimuksiin.
Givinostaattihoitoa saaneilla potilailla havaittiin myös hemoglobiinipitoisuuden ja neutrofiilimäärän laskua verrattuna lumelääkkeeseen.
Triglyseridien muutokset
Givinostaatin on osoitettu suurentavan triglyseridipitoisuutta. Pitoisuus oli suurimmillaan noin 221 päivän jälkeen. Givinostaattihoidon keskeyttämisen jälkeen triglyseridipitoisuus laski lähtötilanteen tasolle noin 90 päivässä.
Korkea triglyseridipitoisuus (> 300 mg/dl) johti hoidon lopettamiseen 2 %:lla ja annoksen muuttamiseen 8 %:lla Duvyzat-hoitoa saaneista potilaista.
Hypertriglyseridemiaa esiintyi 22,9 %:lla Duvyzat-hoitoa saaneista potilaista. Tapahtumista 70,4 % raportoitiin lievinä ja 25,9 % keskivaikeina. Yksi tapaus (3,7 %) oli vaikea.
Maha-suolikanavan häiriöt
Givinostaattihoitoa saaneilla potilailla esiintyi maha-suolikanavan häiriöitä, mukaan lukien ripulia, oksentelua ja vatsakipua.
Ripulia raportoitiin 38 %:lla Duvyzat-hoitoa saaneista potilaista (mukaan lukien 1 vaikea tapaus) ja 18 %:lla lumelääkettä saaneista potilaista. Ripuli ilmaantui yleensä muutaman viikon kuluessa Duvyzat-hoidon aloittamisesta.
Oksentelua raportoitiin 29 %:lla Duvyzat-hoitoa saaneista potilaista (mukaan lukien 2 vaikeaa tapausta) ja 13 %:lla lumelääkettä saaneista potilaista. Oksentelu ilmaantui yleensä 2 ensimmäisen hoitokuukauden kuluessa.
Vatsakipua raportoitiin 34 %:lla Duvyzat-hoitoa saaneista potilaista (mukaan lukien 1 vaikea tapaus) ja 23 %:lla lumelääkettä saaneista potilaista.
Muut laboratorioarvojen poikkeavuudet
Haittavaikutuksina raportoitua kilpirauhasen vajaatoimintaa ja/tai veren tyreotropiinipitoisuuden (TSH) nousua esiintyi 5 %:lla Duvyzat-hoitoa saaneista ja 2 %:lla lumelääkettä saaneista potilaista.
Pitkäaikaisessa hoidossa havaittiin lisäksi kilpirauhasen vajaatoimintaa (yleinen).
Tyreotropiinipitoisuudet olivat pääosin enintään 2 kertaa viitealueen ylärajaa suurempia. Kilpirauhashormonien pitoisuuksissa ei havaittu muutoksia tai ne olivat lieviä.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea Lääkkeiden haittavaikutusrekisteri
PL 55
00034 Fimea
Yliannostus
Yliannostusta epäiltäessä on annettava elintoimintoja tukevaa hoitoa, ja potilaan sydämen toimintaa on seurattava.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Muut tuki- ja liikuntaelinten sairauksien lääkkeet, ATC-koodi: M09AX14.
Vaikutusmekanismi
Givinostaatti on luokan I ja II histonideasetylaasien estäjä, joka moduloi Duchennen lihasdystrofian patologiaan liittyvää hallitsematonta histonideasetylaasin aktiivisuutta dystrofisissa lihaksissa.
Givinostaatin histonideasetylaasia estävän vaikutuksen on osoitettu vähentävän lihassyiden vaurioitumista, kroonista tulehdusta ja fibroosia, vähentävän rasvan kertymistä lihaksiin sekä edistävän mitokondrioiden biogeneesiä.
Givinostaatin vaikutusmekanismi on riippumaton taustalla olevasta, sairauden aiheuttavasta dystrofiinigeenin mutaatiosta.
Lihasten rasvan osuus magneettiresonanssispektroskopialla mitattuna
Ulomman reisilihaksen rasvaprosentti mitattiin EPIDYS-tutkimuksessa magneettiresonanssispektroskopialla. Potilailla, joilla ulomman reisilihaksen rasvaprosentti oli lähtötilanteessa alueella > 5 – 30 %, rasvaprosentin suurentumisen pienimmän neliösumman keskiarvo 18 kuukauden kohdalla oli Duvyzat-ryhmässä 7,63 % ja lumelääkeryhmässä 10,56 %.
Kliininen teho ja turvallisuus
Duvyzat-valmisteen turvallisuutta ja tehoa Duchennen lihasdystrofiaa sairastavilla potilailla arvioitiin EPIDYS-tutkimuksessa. EPIDYS oli 18 kuukauden pituinen, 2:1-suhteessa satunnaistettu, kaksoissokkoutettu, lumekontrolloitu faasin 3 tutkimus, johon osallistui 179 kävelykykyistä vähintään 6 vuoden ikäistä Duchennen lihasdystrofiaa sairastavaa potilasta. Givinostaatin tai lumelääkkeen lisäksi potilaille annettiin koko tutkimuksen ajan kortikosteroideja vakaalla annoksella. Potilaat jaettiin kahteen ryhmään:
- ryhmä A (120 potilasta): ulomman reisilihaksen rasvaprosentti lähtötilanteessa alueella > 5 – 30 % magneettispektroskopialla (MRS) mitattuna
- ryhmä B (59 potilasta): ulomman reisilihaksen rasvaprosentti lähtötilanteessa edellä mainitun alueen ulkopuolella (muut kriteerit olivat samat).
Tutkimushoidon annostus oli painoon perustuva. Aloitusannos oli aluksi 17,7–62 mg givinostaattia suun kautta kahdesti päivässä ja pienennetty annos 11,8–41,4 mg kahdesti päivässä. Tutkimussuunnitelmaa muutettiin sen jälkeen niin, että aloitusannosta uusille tutkimukseen osallistujille laskettiin annokseen 11,8–41,4 mg kahdesti päivässä sallien edelleenpienennetyn annoksen 9,4–33,1 mg kahdesti päivässä.
Ensisijainen päätetapahtuma ryhmässä A (ennalta määritetty ensisijainen analyysijoukko) oli muutos 4 porrasaskelman kiipeämiseen kuluvassa ajassa (4SC-ajassa) 18 kuukauden kohdalla.
Ensisijainen päätetapahtuma saavutettiin eli givinostaatti vähensi merkitsevästi (p = 0,035) 4SC-ajan huonontumista verrattuna lumelääkkeeseen ennalta määritetyn logaritmiseen asteikkoon perustuvan analyysin mukaan (taulukko 4). Kun tulokset analysoitiin ei‑logaritmista asteikkoa käyttämällä, keskimääräinen 4SC-aika pidentyi 1,25 sekunnilla givinostaattiryhmässä vs. 3,03 sekunnilla lumelääkeryhmässä (ks. taulukko 4). Näin ollen hoitovaikutus (muutos lähtötilanteesta, givinostaatti miinus lumelääke) oli -1,78 sekuntia (p = 0,037).
Taulukko 4 – EPIDYS-tutkimus: 4SC-aika (sekuntia), muutos lähtötilanteesta 18 kuukauden kohdalla (ryhmä A)
| 4SC-aika | Givinostaatti§(N = 81) | Lumelääke§(N = 39) |
| Logaritmiseen asteikkoon perustuva analyysi* | ||
| Yleistetyn pienimmän neliösumman keskiarvo (logaritminen asteikko, keskivirhe) (95 %:n luottamusväli) | 1,27 (0,040) (1,172; 1,372) | 1,48 (0,058) (1,317; 1,657) |
Yleistetyn pienimmän neliösumman keskisuhde (givinostaatti/lumelääke) (logaritminen asteikko, keskivirhe) (95 %:n luottamusväli) p‑arvo | 0,86 (0,071) 0,0345 | |
| Ei‑logaritmiseen asteikkoon perustuva analyysi* | ||
| Pienimmän neliösumman keskiarvo (95 %:n luottamusväli) | 1,25 (0,311; 2,181) | 3,03 (1,666; 4,394) |
Pienimmän neliösumman keskiarvojen erotus (givinostaatti - lumelääke) (95 %:n luottamusväli) p‑arvo | -1,78 (-3,462; -0,106) 0,0374 | |
Logaritmiseen asteikkoon perustuva analyysi tehtiin, koska tiedot eivät noudattaneet normaalijakaumaa.
§ Givinostaatin tai lumelääkkeen lisäksi potilaille annettiin koko tutkimuksen ajan kortikosteroideja vakaalla annoksella.
Huomautus: Pienimmän neliösumman keskiarvot, luottamusvälit ja p‑arvot perustuvat kovarianssianalyysimalliin, joka koskee 4SC-ajan muutosta lähtötilanteesta kuukauden 18 kohdalla.
Yleistetyn pienimmän neliösumman keskiarvo lähtötilanteen jälkeiselle muutokselle tarkoittaa muutosta suhteessa (tutkimuksen loppu / lähtötilanne).
Kuva 1 osoittaa hoitoryhmien keskimääräiset havaitut 4SC-ajat 72 hoitoviikon aikana.
Kuva 1 – EPIDYS-tutkimus: 4SC-ajan havaittu keskimuutos sekunteina hoitoryhmän mukaan ajan kuluessa (ryhmä A)
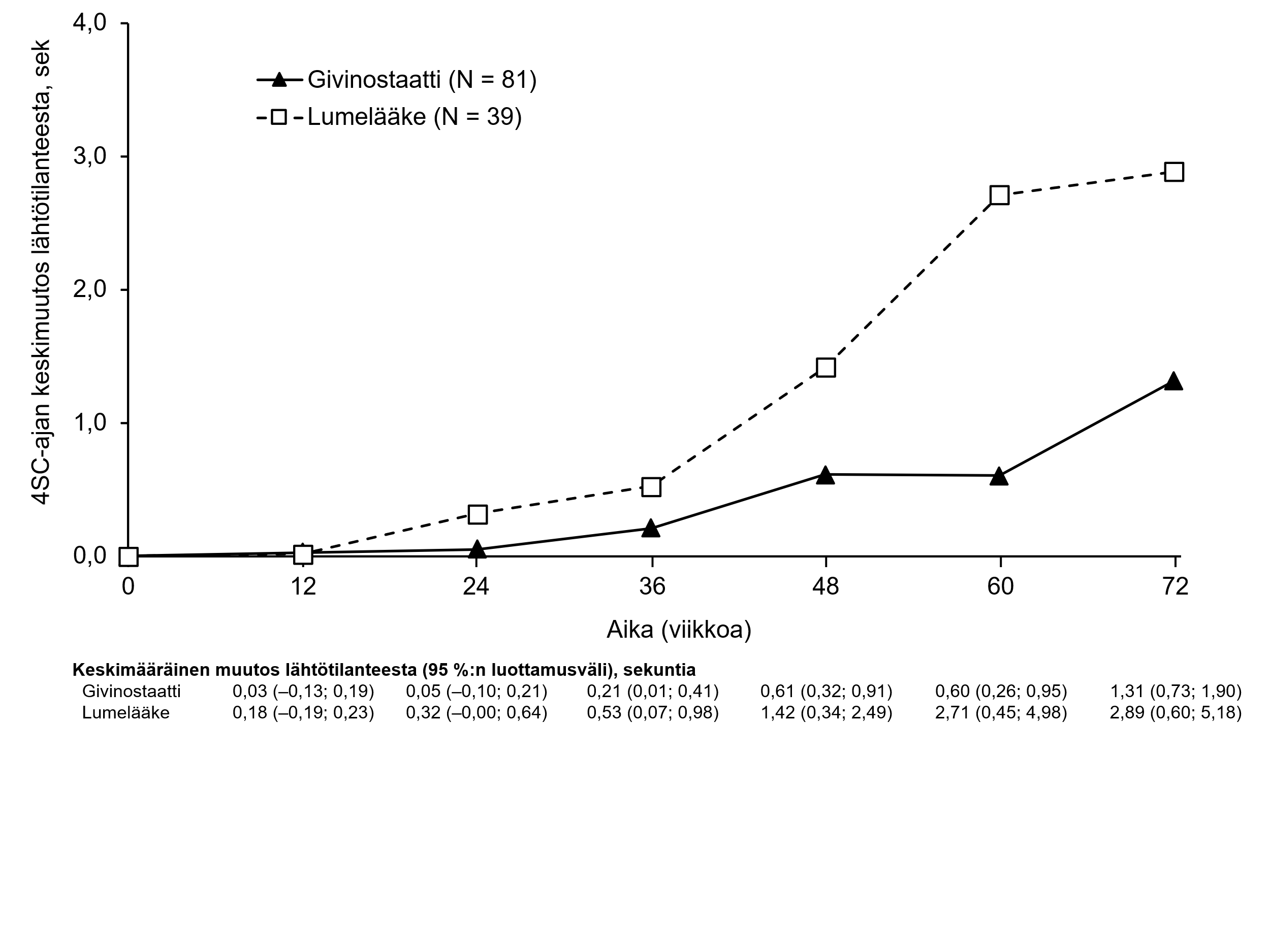
*Givinostaatin tai lumelääkkeen lisäksi potilaille annettiin koko tutkimuksen ajan kortikosteroideja vakaalla annoksella.
Keskeiset toissijaiset päätetapahtumat ryhmässä A olivat lähtötilanteen jälkeinen muutos 18 kuukauden kohdalla NSAA-testillä (North Star Ambulatory Assessment) arvioidussa fyysisessä toimintakyvyssä, lattialta ylös nousuun kuluvassa ajassa (TTR), 6 minuutin kävelytestissä (6MWT), dynamometrilla (HHM) mitatussa lihasvoimassa polven ojennuksen ja kyynärpään koukistuksen perusteella sekä magneettispektroskopialla mitatussa ulomman reisilihaksen rasvaprosentissa. Toimintakykyä, voimaa ja lihasmorfologiaa koskevien keskeisten toissijaisten päätetapahtumien tulokset eivät saavuttaneet tilastollista merkitsevyyttä ennalta määritetyn Hochbergin analyysin perusteella, mutta kaikki tulokset suosivat givinostaattia (kuva 2).
Kuva 2 – EPIDYS-tutkimus: Ensisijaiset ja tärkeimmät toissijaiset tehon päätetapahtumat givinostaatilla vs. lumelääkkeellä (ryhmä A)§
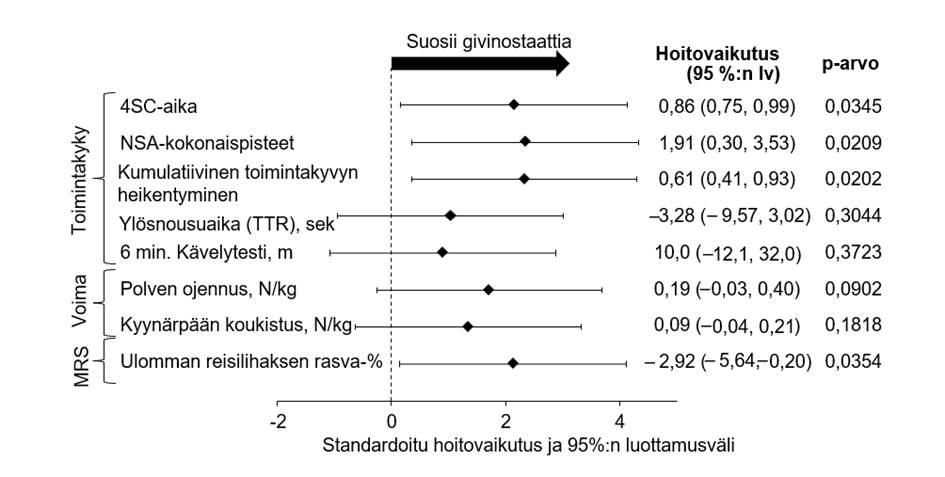
§ Givinostaatin tai lumelääkkeen lisäksi potilaille annettiin koko tutkimuksen ajan kortikosteroideja vakaalla annoksella.
Givinostaatin pitkäaikaista turvallisuutta, siedettävyyttä ja tehoa arvioidaan parhaillaan käynnissä olevassa prospektiivisessa, avoimessa, pitkäaikaisessa jatkotutkimuksessa (STUDY 51). STUDY 51-tutkimukseen otettiin potilaita, jotka olivat olleet mukana givinostaatin faasin 2 tutkimuksessa (STUDY 43) loppuun asti, sekä potilaita, jotka olivat olleet mukana givinostaatin faasin 3 tutkimuksessa (EPIDYS) loppuun asti. Lisäksi tutkimukseen otettiin 30 potilasta, jotka eivät olleet saaneet givinostaattia aikaisemmin. Tutkimukseen otettiin yhteensä 207 poikaa ja miestä. Potilaat saavat givinostaattia painoon perustuvalla annostuksella, joka vaihtelee 9,4 mg:sta kahdesti päivässä 62 mg:aan kahdesti päivässä. Kaikki potilaat saivat kortikosteroidihoitoa vakaalla annoksella ennen tutkimukseen osallistumista, ja tätä hoitoa jatketaan koko tutkimuksen ajan.
Givinostaatin hyöty-haittasuhdetta ei ole määritetty Duchennen lihasdystrofiaa sairastavilla potilailla, jotka eivät saa samanaikaista kortikosteroidihoitoa.
Givinostaatin hyöty-haittasuhdetta ei ole määritetty potilailla, jotka eivät ole kävelykykyisiä.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt lykkäyksen velvoitteelle toimittaa tutkimustulokset Duvyzat-valmisteen käytöstä Duchennen lihasdystrofian hoidossa yhdessä tai useammassa pediatrisessa potilasryhmässä.
Tämä lääkevalmiste on saanut ns. ehdollisen myyntiluvan. Se tarkoittaa, että lääkevalmisteesta odotetaan uutta tietoa. Euroopan lääkevirasto arvioi vähintään kerran vuodessa tätä lääkevalmistetta koskevat uudet tiedot, ja tarvittaessa tämä valmisteyhteenveto päivitetään.
Farmakokinetiikka
Imeytyminen
Givinostaatti imeytyy hyvin suun kautta annon jälkeen. Keskimääräinen pitoisuus plasmassa suurenee suhteessa annokseen, ja huippupitoisuus plasmassa saavutetaan noin 2–3 tunnin jälkeen annosta. Tavanomainen runsasrasvainen ateria lisäsi altistusta jonkin verran (pitoisuus-aikakäyrän alle jäävä pinta-ala [AUC] suurentui noin 30 % ja huippupitoisuus plasmassa [Cmax] noin 20 %) sekä pidensi huippupitoisuutta edeltävä aikaa (Tmax) 2 tunnista 3 tuntiin. Vakaan tilan pitoisuus saavutetaan noin 5–7 päivän kuluessa sekä kerran päivässä että kahdesti päivässä annossa. Kahdesti päivässä annossa havaittiin kohtalaista, alle 2‑kertaista kumuloitumista.
Fysiologiaan ja terveiltä tutkittavilta saatuihin tietoihin perustuvan farmakokineettisen analyysin mukaan biologisen hyötyosuuden ihmisillä ennustetaan olevan ≥ 50 % suun kautta otetun 44,3–177,2 mg:n kerta-annoksen jälkeen.
Jakautuminen
Givinostaatti sitoutuu noin 96‑prosenttisesti ihmisen plasman proteiineihin, ja pieni osa jakautuu punasoluihin (vereen ja plasmaan jakautumisen suhde on 1,3).
Biotransformaatio
Ihmisen entsyymivalmisteilla tehdyt in vitro -tutkimukset sekä metaboliaa eläimillä koskevat in vitro- ja in vivo -tutkimukset osoittavat givinostaatin metaboloituvan laajasti ja muodostavan useita metaboliitteja. CYP450 ja UGT-entsyymit eivät osallistu tärkeimpiin metabolisiin reaktioihin. Päämetaboliitit muodostavat entsyymit tunnetaan vain osittain. Ihmisillä ja eläinlajeilla on kuvattu neljä päämetaboliittia, joiden määrät kuitenkin vaihtelevat eri lajien välillä. Metaboliitit ovat inaktiivisia.
Eliminaatio
Givinostaatin eliminoituminen plasmasta on kaksivaiheista. Keskimääräinen näennäinen eliminaation puoliintumisaika on noin 6 tuntia. Givinostaatin eliminoituminen on todennäköisesti riippuvaista metaboliasta ja sen jälkeisestä munuaisten ja sapen kautta erittymisestä. Givinostaatin ja päämetaboliittien erittymistä virtsaan on arvioitu terveillä tutkittavilla kerta-annoksen ja toistuvien annosten jälkeen. Virtsaan erittyvän muuttumattoman givinostaatin prosenttiosuus oli hyvin pieni (< 3 % annoksesta) sekä kerta-annoksen että toistuvien kahdesti päivässä annettujen annosten jälkeen.
Lineaarisuus/ei-lineaarisuus
Givinostaatin farmakokinetiikka on lineaarista, koska AUC∞-arvot ovat samankaltaisia kerta-annoksen ja toistuvien annosten jälkeen. Minimaalinen ilmeinen kumuloituminen ajan kuluessa on mahdollista (havaittu kumulaatiokertoimen vaihteluväli on 1,0–1,7).
Lineaarisuutta testattiin 44,3–354,4 mg:n kerta-annoksilla ja 44,3–177,2 mg:n toistuvilla annoksilla.
Paino
Populaatiofarmakokineettisten analyysien perusteella painolla on huomattava vaikutus givinostaatin puhdistumaan.
Vaikutus ei ole lineaarinen: se on suurempi pienipainoisilla ja pienempi vähintään 30 kg painavilla henkilöillä. Painoon perustuvaa annostusta suositellaan tämän vuoksi.
Ominaisuudet erityisryhmissä
Populaatiofarmakokineettisten analyysien perusteella ikä ja samanaikainen kortikosteroidien käyttö eivät vaikuta givinostaatin farmakokinetiikkaan.
Givinostaatin farmakokinetiikkaa Duchennen lihasdystrofiaa sairastavilla pediatrisilla potilailla on arvioitu vähintään 6 vuoden ikäisillä pojilla.
Maksan vajaatoiminta
Givinostaattia ei ole tutkittu maksan vajaatoimintaa sairastavilla potilailla. Valmistetta on käytettävä varoen tällaisille potilaille, ja potilaita on seurattava huolellisesti.
Munuaisten vajaatoiminta
Givinostaattia ei ole tutkittu munuaisten vajaatoimintaa sairastavilla potilailla. Munuaisten vajaatoiminnan ei kuitenkaan odoteta vaikuttavan givinostaattialtistukseen, sillä munuaisten kautta erittyminen ei ole merkittävä givinostaatin eliminaatioreitti.
Prekliiniset tiedot turvallisuudesta
Rotilla ja apinoilla tehdyissä toistuvien suun kautta annettujen annosten toksisuutta arvioivissa tutkimuksissa givinostaatin havaittiin aiheuttavan annosriippuvaista valkosolumäärän laskua ja siihen liittyvää imukudoselinten (kateenkorvan, imusolmukkeiden ja pernan) atrofiaa, punasolu- ja verihiutalemäärien laskua sekä luuytimen solukkuuden vähentymistä. Myös maksaentsyymiarvojen nousua havaittiin. Lisäksi apinoilla havaittiin sappiteiden hyperplasiaa. Nämä toksisuudet olivat yleisesti palautuvia lääkkeen käytön lopettamisen jälkeen, mutta ilmenivät eläimillä alemmilla givinostaatin altistustasoilla kuin mitä ihmiselle suositellulla enimmäisannoksella (MRHD) saavutetaan.
Genotoksisuus ja karsinogeenisuus
Givinostaatti oli suurilla annoksilla positiivinen bakteerien kehyssiirtymämutaatioille in vitro (Amesin testi), negatiivinen nisäkässoluissa (TK+/- hiiren lymfoomasoluissa) ja negatiivinen in vivo siirtogeenisillä BigBlue-rotilla ja Pig‑a-lokuksessa.
Näin ollen givinostaatti ei aiheuta oleellista genotoksisuuden riskiä in vivo.
Givinostaatin karsinogeenisuustutkimuksista ei toistaiseksi ole saatavilla tietoja.
Lisääntymis- ja kehitystoksisuus
Givinostaatti aiheutti annosriippuvaista urosten lisäsukupuolirauhasten pienentymistä ja painon laskua alkaen pienimmästä annoksesta. Keskisuuria ja suuria annoksia saaneilla eläimillä havaittiin parittelua edeltävän jakson pidentymistä ja vaginatulppien määrän vähentymistä, joka johtui todennäköisesti ejakulaattimuodostuksen häiriintymisestä. Vaikutuksia siittiöiden parametreihin ja tiineiden naaraiden lukumäärään ei kuitenkaan havaittu.
Emoon kohdistuvia haittavaikutuksia havaittiin alkio- ja sikiötoksisuutta ja pre- ja postnataalista kehitystoksisuutta koskevissa tutkimuksissa suurilla annostasoilla. Tiineyteen, alkioiden ja sikiöiden kehitykseen ja poikueiden parametreihin kohdistuvien vaikutusten katsottiin johtuvan toksisuudesta emolle. Vaikutuksia alkioiden ja sikiöiden kehitykseen ja poikueiden parametreihin havaittiin kuitenkin jo keskisuurilla annoksilla rotilla ja kaniineilla tehdyssä sikiöiden ja alkioiden kehitystä koskevassa tutkimuksessa sekä pienen annoksen ryhmässä pre- ja postnataalista kehitystä koskevassa tutkimuksessa. Poikasten käyttäytymiseen, neurologiseen kasvuun, sukupuoliseen kypsymiseen tai lisääntymiseen kohdistuvia haittavaikutuksia ei havaittu.
Lisääntymistoksisuutta havaittiin yleisesti ottaen pienemmillä eläinten givinostaattialtistuksilla kuin MRHD-annoksella saavutettava ihmisten altistus. Poikkeuksen muodosti sikiöiden ja alkioiden kehitystä koskeva tutkimus kaniineilla, jossa turvallisuusmarginaali oli noin 10‑kertainen suhteessa ihmisen altistukseen MRHD-annoksella.
Toksisuus nuorilla eläimillä
Rotilla havaittiin joitakin hematologisiin parametreihin ja imukudoselimiin kohdistuvia vaikutuksia korkeilla annostasoilla. Vaikutukset olivat osittain tai kokonaan korjautuvia, ja niitä havaittiin pienemmillä eläinten givinostaattialtistuksilla kuin MRHD-annoksella saavutettava ihmisten altistus. Hoitoon liittyviä vaikutuksia eläinten kasvuun, sukupuoliseen kypsymiseen, lisääntymiskykyyn tai neurobehavioraaliseen kehitykseen ei havaittu.
Farmaseuttiset tiedot
Apuaineet
Polysorbaatti 20 (E432)
Glyseroli (E422)
Tragantti (E413)
Natriumbentsoaatti (E211)
Persikka-aromi: luontaiset aromiaineet, aromiaineet, propyleeniglykoli (E1520)
Kerma-aromi: luontaiset aromiaineet, aromiaineet, propyleeniglykoli (E1520)
Sakariininatrium (E954)
Nestemäinen sorbitoli (E420)
Viinihappo (E334)
Natriumhydroksidi (E524)
Puhdistettu vesi
Yhteensopimattomuudet
Ei sovellettavissa.
Kestoaika
3 vuotta.
Avaamisen jälkeen: 60 päivää.
Säilytys
Tämä lääkevalmiste ei vaadi lämpötilan suhteen erityisiä säilytysolosuhteita.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
DUVYZAT oraalisuspensio
8,86 mg/ml (L:ei) 140 ml (asteikollinen 5 ml mittaruisku) (19026,14 €)
PF-selosteen tieto
140 ml oraalisuspensiota sisältävä meripihkanvärinen polyetyleenitereftalaattipullo, jossa on suurtiheyspolyeteeninen turvakorkki ja pientiheyspolyeteeninen ruiskuadapteri.
Yksi pakkaus sisältää yhden pullon ja yhden asteikollisen 5 ml:n mittaruiskun.
Mittaruiskussa on asteikkoviivat 1 ml:sta 5 ml:aan 0,5 ml:n välein.
Valmisteen kuvaus:
Valkoinen, luonnonvalkoinen tai hieman vaaleanpunertava homogeeninen suspensio sekoitettuna.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
DUVYZAT oraalisuspensio
8,86 mg/ml 140 ml
- Ei korvausta.
ATC-koodi
M09AX14
Valmisteyhteenvedon muuttamispäivämäärä
09.06.2025
Yhteystiedot
Karl Gustavsgatan 1A
SE-411 25 Göteborg
Sweden
+46 3120 5020
www.campuspharma.se
info@campuspharma.se
