WEGOVY FLEXTOUCH injektioneste, liuos, esitäytetty kynä 0,25 mg, 0,5 mg, 1 mg, 1,7 mg, 2,4 mg
Huomioitavaa
▼Tähän lääkevalmisteeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti turvallisuutta koskevaa uutta tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä lääkkeen haittavaikutuksista. Ks. kohdasta Haittavaikutukset, miten haittavaikutuksista ilmoitetaan.
Vaikuttavat aineet ja niiden määrät
Esitäytetty kynä, FlexTouch
Wegovy 0,25 mg FlexTouch injektioneste, liuos, esitäytetty kynä
Yksi esitäytetty kynä sisältää 1 mg semaglutidia* 1,5 millilitrassa liuosta. Yksi millilitra liuosta sisältää 0,68 mg semaglutidia*. Yksi esitäytetty kynä sisältää 4 annosta, kukin 0,25 mg.
Wegovy 0,5 mg FlexTouch injektioneste, liuos, esitäytetty kynä
1,5 ml: Yksi esitäytetty kynä sisältää 2 mg semaglutidia* 1,5 millilitrassa liuosta. Yksi millilitra liuosta sisältää 1,34 mg semaglutidia*. Yksi esitäytetty kynä sisältää 4 annosta, kukin 0,5 mg.
3 ml: Yksi esitäytetty kynä sisältää 2 mg semaglutidia* 3 millilitrassa liuosta. Yksi millilitra liuosta sisältää 0,68 mg semaglutidia*. Yksi esitäytetty kynä sisältää 4 annosta, kukin 0,5 mg.
Wegovy 1 mg FlexTouch injektioneste, liuos, esitäytetty kynä
Yksi esitäytetty kynä sisältää 4 mg semaglutidia* 3 millilitrassa liuosta. Yksi millilitra liuosta sisältää 1,34 mg semaglutidia*. Yksi esitäytetty kynä sisältää 4 annosta, kukin 1 mg.
Wegovy 1,7 mg FlexTouch injektioneste, liuos, esitäytetty kynä
Yksi esitäytetty kynä sisältää 6,8 mg semaglutidia* 3 millilitrassa liuosta. Yksi millilitra liuosta sisältää 2,27 mg semaglutidia*. Yksi esitäytetty kynä sisältää 4 annosta, kukin 1,7 mg.
Wegovy 2,4 mg FlexTouch injektioneste, liuos, esitäytetty kynä
Yksi esitäytetty kynä sisältää 9,6 mg semaglutidia* 3 millilitrassa liuosta. Yksi millilitra liuosta sisältää 3,2 mg semaglutidia*. Yksi esitäytetty kynä sisältää 4 annosta, kukin 2,4 mg.
* ihmisen glukagonin kaltaisen peptidi l:n (GLP-1) analogi, joka on tuotettu yhdistelmä-DNA- tekniikalla Saccharomyces cerevisiae -soluissa.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, liuos (injektio)
Kliiniset tiedot
Käyttöaiheet
Aikuiset
Wegovy on tarkoitettu painon hallinnan avuksi vähäenergiaisen ruokavalion ja fyysisen aktiivisuuden lisäämisen rinnalla. Se on tarkoitettu aikuisten painonpudotukseen ja painon ylläpitoon tapauksissa, joissa painoindeksi (BMI) on hoitoa aloitettaessa
- ≥ 30 kg/m2 (lihavuus) tai
- ≥ 27 kg/m2 ja < 30 kg/m2 (ylipaino), kun potilaalla on lisäksi vähintään yksi painoon liittyvä sairaus, kuten dysglykemia (diabeteksen esiaste tai tyypin 2 diabetes mellitus), kohonnut verenpaine, dyslipidemia, obstruktiivinen uniapnea tai sydän- ja verisuonitauti.
Tutkimustuloksista koskien sydän- ja verisuonitautiriskin vähentämistä ja lihavuuteen liittyvää sydämen vajaatoimintaa sekä tutkituista populaatioista, ks. kohta Farmakodynamiikka.
Nuoret (≥ 12-vuotiaat)
Wegovy on tarkoitettu painon hallinnan avuksi vähäenergiaisen ruokavalion ja fyysisen aktiivisuuden lisäämisen rinnalla vähintään 12-vuotiaille nuorille, joilla on
- lihavuus* ja
- paino yli 60 kg.
Wegovy-hoito on lopetettava ja arvioitava uudelleen, jos nuoren potilaan painoindeksi ei ole pienentynyt vähintään 5 %, kun hoitoa on annettu 12 viikkoa 2,4 mg:n annoksella tai suurimmalla siedetyllä annoksella.
*Lihavuus (BMI ≥ 95. persentiili) määriteltynä sukupuoli- ja ikävakioitujen painoindeksikäyrien (CDC.gov) mukaan (ks. taulukko 1).
Taulukko 1 Painoindeksin katkaisupisteet lihavuuden (≥ 95. persentiili) kohdalla sukupuolen ja iän mukaan vähintään 12-vuotiaille nuorille potilaille (CDC:n kriteerit)
| Ikä (vuosina) | BMI (kg/m2) 95. persentiilin kohdalla | |
| Pojat | Tytöt | |
| 12 | 24,2 | 25,2 |
| 12,5 | 24,7 | 25,7 |
| 13 | 25,1 | 26,3 |
| 13,5 | 25,6 | 26,8 |
| 14 | 26,0 | 27,2 |
| 14,5 | 26,4 | 27,7 |
| 15 | 26,8 | 28,1 |
| 15,5 | 27,2 | 28,5 |
| 16 | 27,5 | 28,9 |
| 16,5 | 27,9 | 29,3 |
| 17 | 28,2 | 29,6 |
| 17,5 | 28,6 | 30,0 |
Annostus ja antotapa
Annostus
Aikuiset
Kerran viikossa annettava 2,4 mg:n semaglutidiylläpitoannos saavutetaan aloittamalla 0,25 mg:n annoksella. Ruoansulatuskanavan oireiden todennäköisyyden vähentämiseksi annos nostetaan viikoittaiseen 2,4 mg:n ylläpitoannokseen 16 viikon pituisella jaksolla (ks. taulukko 2).
Kun 2,4 mg:n annosta on käytetty vähintään 4 viikon ajan, annos voidaan tarvittaessa suurentaa kerran viikossa otettavaan 7,2 mg:n annokseen aikuisilla, joiden painoindeksi oli hoidon alussa ≥ 30 kg/m2.
Jos 7,2 mg:n annoksella ei havaita kliinistä lisähyötyä painon suhteen, annos pienennetään kerran viikossa otettavaan 2,4 mg:n annokseen.
Jos potilaalla on merkittäviä ruoansulatuskanavan oireita, on harkittava annoksen suurentamisen hidastamista tai annoksen pienentämistä edelliseen annokseen, kunnes oireet ovat lievittyneet.
Taulukko 2. Annoksen suurentamisaikataulu
| Annoksen suurentaminen | Viikoittainen annos |
| Viikot 1–4 | 0,25 mg |
| Viikot 5–8 | 0,5 mg |
| Viikot 9–12 | 1 mg |
| Viikot 13–16 | 1,7 mg |
| Ylläpitoannos | 2,4 mg |
| Ylläpitoannos | 7,2 mg |
Nuoret
Vähintään 12-vuotiaille nuorille noudatetaan samaa annoksen suurentamisaikataulua kuin aikuisille (ks. taulukko 2). Annosta suurennetaan, kunnes 2,4 mg (ylläpitoannos) tai suurin siedetty annos on saavutettu. Yli 2,4 mg:n viikkoannoksia ei suositella.
Potilaat, joilla on tyypin 2 diabetes
Kun semaglutidihoito aloitetaan tyypin 2 diabetesta sairastavilla potilailla, on harkittava samanaikaisesti annettavan insuliinin tai insuliinin eritystä lisäävien lääkkeiden (kuten sulfonyyliurean) annoksen pienentämistä hypoglykemiariskin pienentämiseksi, ks. kohta Varoitukset ja käyttöön liittyvät varotoimet.
Annoksen unohtuminen
Unohtunut annos tulee ottaa mahdollisimman pian ja 5 päivän kuluessa annoksen unohtamisesta. Jos aikaa on kulunut yli 5 päivää, unohtunut annos jätetään väliin, ja seuraava annos otetaan tavanomaisen aikataulun mukaisena päivänä. Molemmissa tapauksissa potilas voi palata tavanomaiseen kerran viikossa tapahtuvaan annosteluun. Jos väliin jää useampia annoksia, on harkittava aloitusannoksen pienentämistä uudelleen aloittamisen yhteydessä.
Erityisryhmät
Iäkkäät (≥ 65-vuotiaat)
Annosta ei tarvitse säätää iän perusteella. 85-vuotiaiden ja sitä vanhempien potilaiden hoidosta on vain vähän kokemusta.
Potilaat, joilla on munuaisten vajaatoiminta
Annoksen säätäminen ei ole tarpeen, jos potilaalla on lievä tai keskivaikea munuaisten vajaatoiminta. Vaikeaa munuaisten vajaatoimintaa sairastavien potilaiden semaglutidihoidosta on vain vähän kokemusta. Semaglutidia ei suositella potilaille, joilla on vaikea munuaisten vajaatoiminta (eGFR-arvo < 30 ml/min/1,73 m2), loppuvaiheen munuaissairaus mukaan lukien (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet, Haittavaikutukset ja Farmakokinetiikka).
Potilaat, joilla on maksan vajaatoiminta
Annoksen säätäminen ei ole tarpeen, jos potilaalla on lievä tai keskivaikea maksan vajaatoiminta. Vaikeaa maksan vajaatoimintaa sairastavien potilaiden semaglutidihoidosta on vain vähän kokemusta. Semaglutidia ei suositella potilaille, joilla on vaikea maksan vajaatoiminta, ja sitä on käytettävä varoen potilaille, joilla on lievä tai keskivaikea maksan vajaatoiminta (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Pediatriset potilaat
Annoksen säätäminen ei ole tarpeen vähintään 12-vuotiaille nuorille. Yli 2,4 mg:n annoksia ei suositella.
Semaglutidin turvallisuutta ja tehoa alle 12 vuoden ikäisten lasten hoidossa ei ole varmistettu.
Antotapa
Ihon alle.
Wegovy annetaan kerran viikossa mihin vuorokaudenaikaan tahansa, aterian kanssa tai ilman.
Wegovy pistetään ihon alle vatsaan, reiteen tai olkavarteen. Pistoskohtaa voidaan muutella. Wegovy-valmistetta ei saa pistää laskimoon eikä lihakseen.
Jos annos on 7,2 mg, kolme 2,4 mg:n annosta pistetään peräkkäin. Pistokset voidaan antaa samalle alueelle, mutta ne on annettava vähintään 5 cm:n etäisyydelle toisistaan.
Viikoittaista antopäivää voidaan tarpeen mukaan muuttaa, kunhan annosten väliin jää aina vähintään 3 päivää (> 72 tuntia). Kun uusi antopäivä on valittu, jatketaan kerran viikossa tapahtuvaa annostelua.
Kun esitäytettyä, kertakäyttöistä Wegovy-kynää käytetään, kynä on painettava tiiviisti ihoa vasten, kunnes keltainen palkki on lakannut liikkumasta. Pistäminen kestää noin 5–10 sekuntia.
Potilaita on neuvottava lukemaan pakkausselosteessa olevat käyttöohjeet huolellisesti ennen lääkevalmisteen pistämistä.
Lisätietoja ennen lääkevalmisteen ottamista huomioitavista seikoista on kohdassa Käyttö- ja käsittelyohjeet.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Aspiraatio yleisanestesian tai syvän sedaation yhteydessä
GLP-1-reseptoriagonisteja yleisanestesiassa tai syvässä sedaatiossa saaneilla potilailla on ilmoitettu aspiraatiopneumoniatapauksista. Siksi on otettava huomioon lisääntynyt riski mahaan jääneestä sisällöstä viivästyneen tyhjentymisen takia (ks. kohta Haittavaikutukset) ennen yleisanestesian tai syvän sedaation aikana suoritettavia toimenpiteitä.
Vaikutukset ruoansulatuselimistöön ja kuivuminen
GLP-1-reseptoriagonistien käyttöön voi liittyä ruoansulatuselimistön haittavaikutuksia. Tämä on otettava huomioon hoidettaessa munuaisten vajaatoimintaa sairastavia potilaita, sillä pahoinvointi, oksentelu ja ripuli voivat aiheuttaa kuivumista, joka voi harvinaisissa tapauksissa johtaa munuaisten toiminnan heikkenemiseen (ks. kohta Haittavaikutukset). Semaglutidia saaville potilaille on kerrottava ruoansulatuselimistön haittavaikutuksiin liittyvästä mahdollisesta kuivumisen riskistä ja heitä on neuvottava ryhtymään varotoimiin nestevajeen välttämiseksi.
Akuutti haimatulehdus
GLP-1-reseptoriagonistien käytön yhteydessä on todettu akuutteja haimatulehduksia (ks. kohta Haittavaikutukset). Potilaille on kerrottava akuutille haimatulehdukselle tyypillisistä oireista. Jos haimatulehdusta epäillään, semaglutidilääkitys on keskeytettävä. Jos akuutti haimatulehdus varmistuu, semaglutidilääkitystä ei pidä aloittaa uudelleen. Varovaisuutta on noudatettava sellaisten potilaiden kohdalla, joilla on joskus ollut haimatulehdus.
Jos muita akuutin haimatulehduksen merkkejä ja oireita ei esiinny, pelkkä haimaentsyymiarvojen nousu ei ennusta akuuttia haimatulehdusta.
Non-arteriittinen anteriorinen iskeeminen optikusneuropatia (NAION)
Epidemiologisista tutkimuksista saatujen tietojen perusteella non-arteriittisen anteriorisen iskeemisen optikusneuropatian (NAION) riski on suurentunut semaglutidihoidon aikana. Aikaväli, jolla NAION saattaa kehittyä hoidon aloittamisen jälkeen, ei ole tiedossa. Äkillisen näönmenetyksen tapauksessa on tehtävä silmätutkimus, ja jos NAION-diagnoosi varmistuu, semaglutidihoito on lopetettava (ks. kohta Haittavaikutukset).
Tyypin 2 diabetesta sairastavat potilaat
Semaglutidia ei pidä käyttää insuliinin korvikkeena tyypin 2 diabetesta sairastavilla potilailla.
Semaglutidia ei pidä käyttää yhdessä muiden GLP-1-reseptoriagonistivalmisteiden kanssa. Tätä ei ole arvioitu ja yliannostukseen liittyvien haittavaikutusten riskin suurenemista pidetään todennäköisenä.
Hypoglykemia tyypin 2 diabetesta sairastavilla potilailla
Insuliinin ja sulfonyyliurean tiedetään aiheuttavan hypoglykemiaa. Potilailla, jotka saavat semaglutidia yhdessä sulfonyyliurean tai insuliinin kanssa, voi olla suurentunut hypoglykemian riski. Hypoglykemian riskiä voidaan GLP-1-reseptoriagonistihoitoa aloitettaessa pienentää pienentämällä sulfonyyliurea- tai insuliiniannosta.
Diabeettinen retinopatia tyypin 2 diabetesta sairastavilla potilailla
Diabeettisen retinopatian komplikaatioiden kehittymisriskin on todettu suurentuvan diabeettista retinopatiaa sairastavilla, semaglutidihoitoa saavilla potilailla (ks. kohta Haittavaikutukset). Verensokeritasapainon nopeaan paranemiseen on liittynyt diabeettisen retinopatian väliaikaista vaikeutumista, mutta myös muut mekanismit ovat mahdollisia. Potilaita, joilla on diabeettinen retinopatia ja joita hoidetaan semaglutidilla, on seurattava huolellisesti, ja hoidettava kliinisten suositusten mukaisesti. Wegovy-valmisteen käytöstä tyypin 2 diabetesta sairastavilla potilailla, joilla on hallitsematon tai mahdollisesti epävakaa diabeettinen retinopatia, ei ole kokemusta. Wegovy-hoitoa ei suositella näille potilaille.
Potilaat, joilla on gastropareesi
Gastropareesia sairastavat potilaat, joita hoidetaan semaglutidilla, voivat saada vakavampia tai vaikeampia ruoansulatuselimistön haittavaikutuksia. Semaglutidia tulee käyttää varoen näillä potilailla ja sitä ei suositella käytettäväksi, mikäli gastropareesi on vaikea (ks. kohta Haittavaikutukset).
Potilasryhmät, joita ei ole tutkittu
Wegovy-valmisteen turvallisuutta ja tehoa ei ole tutkittu seuraavilla potilasryhmillä:
- muilla painonhallintaan tarkoitetuilla valmisteilla hoidetut potilaat
- tyypin 1 diabetesta sairastavat potilaat
- potilaat, joilla on vaikea munuaisten vajaatoiminta (ks. kohta Annostus ja antotapa)
- potilaat, joilla on vaikea maksan vajaatoiminta (ks. kohta Annostus ja antotapa)
- potilaat, joilla on New York Heart Associationin (NYHA) luokan IV sydämen kongestiivinen vajaatoiminta.
Valmisteen käyttöä näille potilaille ei suositella.
Wegovy-valmisteen käytöstä seuraavilla potilasryhmillä on vain vähän kokemusta:
- vähintään 85-vuotiaat potilaat (ks. kohta Annostus ja antotapa)
- potilaat, joilla on lievä tai keskivaikea maksan vajaatoiminta (ks. kohta Annostus ja antotapa)
- potilaat, joilla on tulehduksellinen suolistosairaus.
Valmistetta on käytettävä varoen näille potilaille.
Natriumpitoisuus
Tämä lääkevalmiste sisältää alle 1 mmol (23 mg) natriumia per annos eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Semaglutidi viivästyttää mahan tyhjentymistä ja saattaa mahdollisesti vaikuttaa samanaikaisesti annettujen suun kautta otettavien lääkevalmisteiden imeytymiseen. Semaglutidin 2,4 mg:n annoksella ei havaittu kliinisesti merkittävää vaikutusta mahan tyhjenemisnopeuteen, todennäköisesti toleranssivaikutuksen vuoksi. Semaglutidin 7,2 mg:n annosten vaikutusta mahan tyhjenemisnopeuteen ei ole tutkittu. Semaglutidia on käytettävä varoen, jos potilas saa samanaikaisesti suun kautta otettavia lääkevalmisteita, jotka vaativat nopeaa imeytymistä ruoansulatuskanavasta.
Parasetamoli
Parasetamolin farmakokinetiikan perusteella arvioituna semaglutidin todettiin hidastavan mahan tyhjenemistä vakioidun ateriatestin aikana. Parasetamolin AUC0-60min pieneni 27 % ja Cmax 23 %, kun samanaikaisesti annettiin 1 mg semaglutidia. Parasetamolin kokonaisaltistus (AUC0‑5h) ei muuttunut. Parasetamoliin ei semaglutidia käytettäessä havaittu kohdistuvan kliinisesti merkittävää vaikutusta. Semaglutidin kanssa samanaikaisesti annettavan parasetamolin annosta ei tarvitse muuttaa.
Suun kautta otettavat ehkäisyvalmisteet
Semaglutidin ei odoteta heikentävän suun kautta otettavien ehkäisyvalmisteiden tehoa, koska semaglutidi ei muuttanut etinyyliestradiolin eikä levonorgestreelin kokonaisaltistusta kliinisesti merkittävässä määrin, kun suun kautta otettavaa yhdistelmäehkäisyvalmistetta (0,03 mg etinyyliestradiolia/0,15 mg levonorgestreelia) annettiin samanaikaisesti semaglutidin kanssa. Etinyyliestradiolialtistus ei muuttunut. Levonorgestreelialtistuksen todettiin suurentuneen 20 % vakaassa tilassa. Cmax ei muuttunut yhdelläkään näistä yhdisteistä.
Atorvastatiini
Semaglutidi ei muuttanut atorvastatiinin kokonaisaltistusta atorvastatiinikerta-annoksen (40 mg) jälkeen. Atorvastatiinin Cmax pieneni 38 %. Tätä ei pidetty kliinisesti merkittävänä.
Digoksiini
Semaglutidi ei muuttanut digoksiinin kokonaisaltistusta eikä Cmax-arvoa digoksiinikerta-annoksen (0,5 mg) jälkeen.
Metformiini
Semaglutidi ei muuttanut metformiinin kokonaisaltistusta tai Cmax -arvoa, kun metformiinia annettiin 500 mg kahdesti päivässä 3,5 päivän ajan.
Varfariini ja muut kumariinijohdokset
Semaglutidi ei muuttanut R- eikä S-varfariinin kokonaisaltistusta tai Cmax -arvoa varfariinikerta-annoksen (25 mg) jälkeen, eivätkä INR-arvona (International Normalised Ratio) mitatut varfariinin farmakodynaamiset vaikutukset muuttuneet kliinisesti merkittävässä määrin. Tapauksia, joissa INR-arvo on pienentynyt, on kuitenkin raportoitu käytettäessä asenokumarolia ja semaglutidia samanaikaisesti. Semaglutidihoidon aloittamisen myötä suositellaan, että varfariinia tai muita kumariinijohdannaisia käyttävien potilaiden INR-arvoa seurataan tiuhaan.
Pediatriset potilaat
Yhteisvaikutuksia on tutkittu vain aikuisille tehdyissä tutkimuksissa.
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi
Naisten, jotka voivat tulla raskaaksi, suositellaan käyttävän ehkäisyä semaglutidihoidon aikana (ks. kohta Yhteisvaikutukset).
Raskaus
Eläinkokeissa on havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta). On vain vähän tietoja semaglutidin käytöstä raskaana oleville naisille. Siksi semaglutidia ei pidä käyttää raskauden aikana. Jos potilas suunnittelee raskautta tai tulee raskaaksi, semaglutidihoito on lopetettava. Semaglutidin käyttö on lopetettava vähintään 2 kuukautta ennen aiotun raskauden alkua sen pitkän puoliintumisajan vuoksi (ks. kohta Farmakokinetiikka).
Imetys
Semaglutidi erittyi imettävien rottien maitoon. Imeväiseen kohdistuvia riskejä ei voida poissulkea, joten semaglutidia ei pidä käyttää rintaruokinnan aikana.
Hedelmällisyys
Semaglutidin vaikutusta ihmisen hedelmällisyyteen ei tunneta. Semaglutidi ei vaikuttanut urosrottien hedelmällisyyteen. Naarasrottien kiimakierron todettiin pidentyvän ja ovulaatioiden lukumäärän hieman pienentyvän käytettäessä annoksia, joilla emon paino laski.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Semaglutidilla ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn. Huimausta voi kuitenkin esiintyä pääasiassa annoksen suurentamisjakson aikana. Jos huimausta esiintyy, ajaminen tai koneiden käyttö on suoritettava varoen.
Tyypin 2 diabetesta sairastavat potilaat
Kun semaglutidia käytetään yhdessä sulfonyyliurean tai insuliinin kanssa, potilaita on neuvottava ryhtymään varotoimiin hypoglykemian välttämiseksi autoa ajettaessa ja koneita käyttäessä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Neljässä faasin 3a tutkimuksessa 2 650 aikuispotilaalle annettiin Wegovy-valmistetta. Tutkimusten kesto oli 68 viikkoa. Useimmin raportoituja haittavaikutuksia olivat ruoansulatuskanavan häiriöt, kuten pahoinvointi, ripuli, ummetus ja oksentelu.
Taulukoitu haittavaikutuslista
Taulukossa 3 luetellaan haittavaikutukset, joita on todettu kliinisissä tutkimuksissa aikuisilla ja markkinoilletulon jälkeen saaduissa raporteissa. Esiintyvyydet perustuvat faasin 3a tutkimusten yhdistettyihin tietoihin.
Wegovy-valmisteen haittavaikutukset on lueteltu alla elinjärjestelmäluokan ja esiintyvyyden mukaisesti. Esiintymistiheydet on määritetty seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000) ja tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Taulukko 3. Semaglutidin haittavaikutusten esiintymistiheydet
| MedDRA-elinjärjestelmä-luokka | Hyvin yleinen | Yleinen | Melko harvinainen | Harvinainen | Hyvin harvinainen | Tuntematon |
| Immuunijärjestelmä | Anafylaktinen reaktio | |||||
| Aineenvaihdunta ja ravitsemus | Hypoglykemia potilailla, joilla on tyypin 2 diabetesa | |||||
| Hermosto | Päänsärkyb | Huimausb Dysgeusiab,c Dysestesiaa,d | ||||
| Silmät | Diabeettinen retinopatia tyypin 2 diabetesta sairastavilla potilaillaa | Non-arteriittinen anteriorinen iskeeminen optikusneuro-patia (NAION) | ||||
| Sydän | Hypotensio Ortostaattinen hypotensio Nopeutunut sydämen sykea,c | |||||
| Ruoansulatuselimistö | Oksentelua,b Ripulia,b Ummetusa,b Pahoinvointia,b Vatsakipub,c | Mahatulehdusb,c Gastroesofageaalinen refluksitautib Dyspepsiab Röyhtäilyb Ilmavaivatb Vatsan turvotusb | Akuutti haimatulehdusa Viivästynyt mahan tyhjeneminen | Suolitukos | ||
| Maksa ja sappi | Sappikivitautia | |||||
| Iho ja ihonalainen kudos | Hiusten lähtöa | Angioedeema | ||||
| Yleisoireet ja antopaikassa todettavat haitat | Väsymys/ uupumusb,c | Pistoskohdan reaktiotc | ||||
| Tutkimukset | Suurentunut amylaasiarvoc Suurentunut lipaasiarvoc |
a) Ks. alla oleva valikoitujen haittavaikutusten kuvaus
b) Havaittu pääasiassa annoksen nostamisvaiheessa
c) Ryhmitellyt suositellut termit
d) Esiintymistiheys perustuu faasin 3a tutkimusohjelmaan. Esiintymistiheyden on havaittu suurentuneen 7,2 mg:n annoksella. Lisätietoja on jäljempänä alaotsikon ”dysestesia” alla.
Valikoitujen haittavaikutusten kuvaus
Seuraavat tiedot valikoiduista haittavaikutuksista koskevat faasin 3a tutkimuksia, ellei toisin erikseen mainita.
Ruoansulatuselimistön haittavaikutukset
68 viikon pituisen tutkimusjakson aikana pahoinvointia esiintyi 43,9 %:lla semaglutidilla hoidetuista potilaista (16,1 %:lla lumelääkettä saaneista), ripulia 29,7 %:lla (15,9 %:lla lumelääkettä saaneista) ja oksentelua 24,5 %:lla (6,3 %:lla lumelääkettä saaneista). Useimmat tapahtumat olivat lieviä tai keskivaikeita ja lyhytkestoisia. Ummetusta esiintyi 24,2 %:lla semaglutidilla hoidetuista potilaista (11,1 %:lla lumelääkettä saaneista) ja sen vaikeusaste oli lievä tai keskivaikea ja kesto pidempi. Semaglutidilla hoidetuilla potilailla pahoinvoinnin mediaanikesto oli 8 päivää, oksentelun 2 päivää, ripulin 3 päivää ja ummetuksen 47 päivää.
Potilailla, joilla on keskivaikea munuaisten vajaatoiminta (eGFR-arvo ≥ 30 –< 60 ml/min/1,73 m2), voi ilmetä enemmän ruoansulatuskanavan vaikutuksia, kun heitä hoidetaan semaglutidilla.
Ruoansulatuskanavan tapahtumat johtivat hoidon pysyvään keskeyttämiseen 4,3 %:lla potilaista.
Gastropareesia sairastavilla potilailla voi esiintyä vakavampia tai vaikeampia ruoansulatuselimistön haittavaikutuksia semaglutidihoidon aikana.
Akuutti haimatulehdus
Faasin 3a kliinisissä tutkimuksissa raportoitiin keskitetysti vahvistettuja akuutteja haimatulehduksia 0,2 %:lla semaglutidia saaneista ja < 0,1 %:lla lumelääkettä saaneista potilaista. Kardiovaskulaarisia tuloksia koskeneessa SELECT-tutkimuksessa keskitetysti vahvistettuja akuutteja haimatulehduksia ilmeni 0,2 %:lla semaglutidia saaneista ja 0,3 %:lla lumelääkettä saaneista potilaista.
Akuutti sappikivitauti
Sappikivitautia raportoitiin 1,6 %:lla, ja se johti sappirakkotulehdukseen 0,6 %:lla potilaista, joita hoidettiin semaglutidilla. Sappikivitautia raportoitiin 1,1 %:lla lumelääkettä saaneista potilaista ja sappirakkotulehdusta 0,3 %:lla lumelääkettä saaneista potilaista.
Hiustenlähtö
Hiustenlähtöä raportoitiin 2,5 %:lla semaglutidilla hoidetuista potilaista ja 1,0 %:lla lumelääkettä saaneista potilaista. STEP UP ‑tutkimuksissa ilmoitettiin hiustenlähtöä 5,3 %:lla potilaista, jotka saivat semaglutidia 7,2 mg:n annoksella, ja 1,0 %:lla potilaista, jotka saivat lumelääkettä. Tapahtumat olivat pääasiassa lieviä, ja useimmat potilaat toipuivat hoidon jatkuessa. Hiustenlähtöä raportoitiin useammin potilailla, joilla painon lasku oli suurempaa (≥ 20 %).
Sydämen sykkeen nousu
Faasin 3a tutkimuksissa semaglutidilla hoidetuilla potilailla havaittiin sykkeessä nousua, joka oli keskimäärin 3 lyöntiä/minuutti (bpm) lähtötason ollessa keskimäärin 72 lyöntiä/minuutti. Niiden tutkittavien osuus, joiden sykkeen nousu oli jonakin hoitojakson mittausajankohtana ≥ 10 lyöntiä/minuutti lähtötasoon verrattuna, oli 67,0 % semaglutidiryhmässä ja 50,1 % lumelääkeryhmässä.
Immunogeenisuus
Proteiineja tai peptidejä sisältävillä lääkevalmisteilla saattaa olla immunogeenisia vaikutuksia, joten potilaille voi kehittyä vasta-aineita semaglutidihoidon jälkeen. Niiden potilaiden osuus, joilla todettiin semaglutidivasta-aineita milloin tahansa lähtötilanteen jälkeen, oli semaglutidin 2,4 mg:n annoksella 2,9–10,9 % ja semaglutidin 7,2 mg:n annoksella 15,3 %. Yhdelläkään potilaalla ei ollut semaglutidia neutraloivia vasta-aineita eikä semaglutidivasta-aineita, joilla olisi ollut endogeenista GLP-1:tä neutraloiva vaikutus. Hoidon aikana korkeat semaglutidin pitoisuudet ovat voineet heikentää määritysten sensitiivisyyttä, joten väärien negatiivisten tulosten riskiä ei voida poissulkea. Tutkittavilla, joilla oli positiivinen vasta-aineiden testitulos hoidon aikana ja sen jälkeen, vasta-aineiden ilmeneminen oli kuitenkin ohimenevää, eikä ilmeistä vaikutusta tehoon ja turvallisuuteen havaittu.
Hypoglykemia tyypin 2 diabetesta sairastavilla potilailla
STEP 2 -tutkimuksessa kliinisesti merkittävää hypoglykemiaa havaittiin 6,2 %:lla (0,1 tapahtumaa/potilasvuosi) semaglutidilla hoidetuista tutkittavista ja 2,5 %:lla (0,03 tapahtumaa/potilasvuosi) lumelääkettä saaneista tutkittavista. Semaglutidin käyttöön liittyvää hypoglykemiaa havaittiin sekä samanaikaisen sulfonyyliurean käytön yhteydessä että ilman sitä. Yhden tapauksen (0,2 %:lla tutkittavista, 0,002 tapahtumaa/potilasvuosi) raportoitiin olleen vakava tutkittavalla, joka ei ollut saanut samanaikaisesti sulfonyyliureahoitoa. Hypoglykemian riski kasvoi, kun semaglutidia käytettiin sulfonyyliurean kanssa.
STEP-HFpEF-DM-tutkimuksessa kliinisesti merkittävää hypoglykemiaa havaittiin 4,2 %:lla tutkittavista sekä semaglutidi- että lumelääkeryhmissä, kun valmistetta käytettiin yhdessä sulfonyyliurean ja/tai insuliinin kanssa (0,065 tapahtumaa/potilasvuosi semaglutidia saaneilla ja 0,098 tapahtumaa/potilasvuosi lumelääkettä saaneilla).
Diabeettinen retinopatia tyypin 2 diabetesta sairastavilla potilailla
Kahden vuoden pituisessa kliinisessä tutkimuksessa tutkittiin semaglutidin 0,5 mg:n ja 1 mg:n annosta lumelääkkeeseen verrattuna 3 297:llä tyypin 2 diabetesta sairastavalla potilaalla, joilla oli korkea sydän- ja verisuonitautien riski, pitkä diabeteksen kesto ja huonosti hallinnassa oleva verenglukoosi. Tässä tutkimuksessa diabeettisen retinopatian komplikaatioita arvioitiin ilmenneen enemmän semaglutidilla hoidetuilla potilailla (3,0 %) kuin lumelääkettä saaneilla (1,8 %). Nämä havainnot tehtiin insuliinihoitoa saaneilla potilailla, joilla oli todettu diabeettinen retinopatia. Hoitoero ilmeni varhain ja säilyi koko tutkimuksen ajan. STEP 2-tutkimuksessa raportoitiin verkkokalvon sairauksia 6,9 %:lla Wegovy-valmisteella hoidetuista potilaista, 6,2 %:lla semaglutidi 1 mg:n annoksella hoidetuista potilaista ja 4,2 %:lla lumelääkettä saaneista potilaista. Suurin osa raportoiduista tapauksista oli diabeettista retinopatiaa, jota havaittiin 4,0 %:lla Wegovy-valmistetta saaneista, 2,7 %:lla semaglutidi 1 mg:aa saaneista ja 2,7 %:lla lumelääkettä saaneista potilaista, sekä ei-proliferatiivista retinopatiaa, jota havaittiin 0,7 %:lla Wegovy-valmistetta saaneista, 0 %:lla semaglutidi 1 mg:aa saaneista ja 0 %:lla lumelääkettä saaneista potilaista.
Dysestesia
Tapahtumia, jotka liittyivät taudinkuvaltaan ihon tuntemuksen muutoksiin kuten parestesiaa, ihon kipua, ihon herkkyyttä, dysestesiaa ja polttavaa tuntemusta ihossa raportoitiin 2,1 %:lla semaglutidi 2,4 mg:lla hoidetuista potilaista ja 1,2 %:lla lumelääkettä saaneista potilaista. Tapahtumat olivat vakavuudeltaan lievästä keskivaikeaan ja useimmat potilaat toipuivat hoidon jatkuessa.
STEP UP-tutkimuksessa raportoitiin dysestesiaan liittyviä tapahtumia 21,6 %:lla potilaista, jotka saivat semaglutidia 7,2 mg:n annoksella, ja 0,3 %:lla potilaista, jotka saivat lumelääkettä. Ryhmässä, jossa potilaat saivat 7,2 mg:n annosta, useimmat tapahtumat olivat lieviä tai keskivaikeita, ja 85 % tapahtumista (368 tapahtumaa 434:stä) korjautui hoidon aikana. Ryhmässä, jossa potilaat saivat 7,2 mg semaglutidia ihon alle, 28 % tapahtumista (123 kaikista 434 tapahtumasta) korjautui, kun tutkimusvalmisteen annosta muutettiin.
Non-arteriittinen anteriorinen iskeeminen optikusneuropatia (NAION)
Useista laajoista epidemiologisista tutkimuksista saadut tulokset viittaavat siihen, että NAION-tilan kehittymisen suhteellinen riski suurenee tyypin 2 diabetesta sairastavilla aikuisilla semaglutidialtistuksen yhteydessä noin kaksinkertaiseksi, mikä vastaa noin yhtä lisätapausta 10 000:ta henkilöhoitovuotta kohti.
Pediatriset potilaat
Kliinisessä tutkimuksessa Wegovy-valmistetta annettiin 133:lle iältään 12 – < 18-vuotiaalle nuorelle, joilla oli lihavuus tai ylipaino ja vähintään yksi painoon liittyvä sairaus. Tutkimuksen kesto oli 68 viikkoa.
Havaittujen haittavaikutusten esiintymistiheys, tyyppi ja vaikeusaste olivat nuorilla yleisesti ottaen vastaavanlaiset kuin aikuisilla. Sappikivitautia ilmoitettiin 3,8 %:lla Wegovy-hoitoa saaneista potilaista ja 0 %:lla lumelääkettä saaneista potilaista.
68 viikon pituisen hoidon jälkeen ei todettu vaikutuksia kasvuun tai puberteettikehitykseen.
Muut erityisryhmät
SELECT- ja SUSTAIN 6 ‑tutkimuksissa, joihin osallistui aikuisia, joilla oli todettu sydän- ja verisuonitauti, haittavaikutusprofiili oli samankaltainen kuin painonhallintaa koskeneissa faasin 3a tutkimuksissa.
HFpEF-tutkimuksissa aikuisilla, joilla oli lihavuuteen liittyvä sydämen vajaatoiminta ja säilynyt ejektiofraktio (HFpEF), haittavaikutusprofiili oli samankaltainen kuin painonhallintaa koskeneissa faasin 3a tutkimuksissa.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Semaglutidin yliannostukseen voi liittyä ruoansulatuselimistön häiriöitä, jotka voivat johtaa nestehukkaan. Yliannostustapauksissa on aloitettava asianmukainen, potilaan kliinisiin oireisiin perustuva tukihoito.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Diabeteslääkkeet, GLP-1-analogit, ATC-koodi: A10BJ06
Vaikutusmekanismi
Semaglutidi on GLP-1-analogi, jonka aminohappojärjestys on 94-prosenttisesti homologinen ihmisen GLP-1:n kanssa. Semaglutidi vaikuttaa GLP-1-reseptoriagonistina, joka sitoutuu selektiivisesti GLP-1-reseptoriin ja aktivoi sen. GLP-1-reseptori on luontaisen GLP-1:n kohdereseptori.
GLP-1 on ruokahalun ja kalorien nauttimisen fysiologinen säätelijä, ja GLP-1-reseptoria esiintyy useilla ruokahalun säätelyyn osallistuvilla aivojen alueilla.
Eläinkokeet osoittavat, että semaglutidi vaikuttaa aivoissa GLP-1-reseptorin kautta. Semaglutidilla on suoria vaikutuksia hypotalamuksessa ja aivorungossa sijaitseviin aivojen alueisiin, jotka osallistuvat homeostaattiseen ruoan nauttimisen säätelyyn. Semaglutidi voi vaikuttaa hedoniseen palkkiojärjestelmään sellaisilla aivojen alueilla kuin septum, talamus ja amygdala, sekä suorien että epäsuorien vaikutusten kautta.
Kliiniset tutkimukset osoittavat, että semaglutidi vähentää energiansaantia, lisää kylläisyyden, täysinäisyyden ja syömisen hallinnan tunnetta, vähentää nälän tunnetta ja ruokaa koskevan mielihalun määrää ja voimakkuutta. Lisäksi semaglutidi vähentää mieltymystä runsaasti rasvaa sisältäviin ruokiin.
Semaglutidi säätelee homeostaattisten ja hedonisten vaikutusten kautta kaloriensaantiin, ruokahaluun, palkkiomekanismeihin ja ruokamieltymyksiin liittyvää toiminnanohjausta.
Kliinisissä tutkimuksissa semaglutidin on myös todettu pienentävän veren glukoosipitoisuutta glukoosista riippuvaisesti stimuloimalla insuliinin eritystä ja vähentämällä glukagonin eritystä veren glukoosipitoisuuden ollessa korkea. Veren glukoosipitoisuutta pienentävään vaikutukseen liittyy myös lievä mahan tyhjenemisen hidastuminen pian aterian jälkeen. Hypoglykemian aikana semaglutidi vähentää insuliinin eritystä eikä vaikuta glukagonin eritykseen.
GLP1-reseptoreita ilmennetään myös sydämessä, verisuonistossa, immuunijärjestelmässä ja munuaisissa. Kliinisissä tutkimuksissa semaglutidilla on todettu olevan hyödyllinen vaikutus plasman lipideihin, systolisen verenpaineen alenemiseen ja tulehdusten vähenemiseen. Lisäksi eläinkokeet ovat osoittaneet, että semaglutidi vähensi ateroskleroosin kehittymistä ja sai aikaan anti-inflammatorisen vaikutuksen kardiovaskulaarisessa järjestelmässä.
Semaglutidin vaikutusmekanismi sydän- ja verisuonitautiriskin pienentämisessä on todennäköisesti monitekijäinen ja perustuu osittain painonpudotuksen vaikutuksiin sekä sydän- ja verisuonitautien tunnettuihin riskitekijöihin kohdistuviin vaikutuksiin (verenpaineen alenemiseen, lipidiprofiilin ja glukoosiaineenvaihdunnan paranemiseen sekä anti-inflammatorisiin vaikutuksiin, jotka ilmenevät herkän CRP-arvon [hsCRP] pienenemisenä). Sydän- ja verisuonitautiriskin pienenemisen tarkkaa mekanismia ei ole vahvistettu.
Farmakodynaamiset vaikutukset
Ruokahalu, energiansaanti ja ruokaa koskevat mieltymykset
Semaglutidi vähentää ruokahalua lisäämällä täysinäisyyden ja kylläisyyden tunnetta ja vähentäen samalla nälän tunnetta ja mahdollista ruoan kulutusta. Vaiheen 1 tutkimuksessa energiansaanti rajoittamattomalla aterialla oli semaglutidia käytettäessä 35 % vähäisempää lumelääkkeeseen verrattuna 20 viikon lääkityksen jälkeen. Tulosta tukivat parempi syömisen hallinta, vähäisemmät ruokaa koskevat mielihalut ja suhteellisesti vähäisempi mieltymys rasvapitoiseen ruokaan. Ruokaa koskevia mielihaluja arvioitiin myös STEP 5 -tutkimuksessa käyttämällä CoEQ-kyselylomaketta (Control of Eating Questionnaire). Viikon 104 kohdalla arvio hoitojen välisestä erosta suosi merkitsevästi semaglutidia sekä mielihalujen hallinnan että suolaista ruokaa koskevien mielihalujen osalta, kun taas makeaa ruokaa koskevien mielihalujen suhteen ei havaittu selvää vaikutusta.
Paastolipidit ja aterian jälkeiset lipidit
Semaglutidi 1 mg vähensi lumelääkkeeseen verrattuna triglyseridien paastopitoisuuksia 12 %:lla ja erittäin matalatiheyksisten lipoproteiinien (VLDL) paastopitoisuuksia 21 %:lla. Aterian jälkeinen triglyseridi- ja VLDL-vaste hyvin rasvapitoiseen ateriaan väheni yli 40 %:lla.
Kliininen teho ja turvallisuus
Semaglutidin tehoa ja turvallisuutta painonhallinnassa, kun se yhdistettiin kalorien saannin vähentämiseen ja fyysisen aktiivisuuden lisäämiseen, arvioitiin neljässä 68 viikon pituisessa, kaksoissokkoutetussa, satunnaistetussa, lumelääkekontrolloidussa faasin 3a tutkimuksessa (STEP 1–4). Näissä tutkimuksissa oli yhteensä 4 684 aikuispotilasta (2 652 satunnaistettua potilasta, jotka saivat hoitona semaglutidia). Semaglutidihoidon kahden vuoden teho- ja turvallisuustietoja lumelääkkeeseen verrattuna arvioitiin myös kaksoissokkoutetussa satunnaistetussa lumelääkekontrolloidussa faasin 3b tutkimuksessa (STEP 5), johon osallistui 304 potilasta (152 saivat semaglutidihoitoa).
Semaglutidin (7,2 mg) tehoa ja turvallisuutta arvioitiin kahdessa 72 viikon pituisessa kaksoissokkoutetussa, satunnaistetussa, lumekontrolloidussa, kolmihaaraisessa faasin 3b tutkimuksessa (STEP UP ja STEP UP T2D), joihin osallistui 1 919 potilasta (1 312 satunnaistettiin saamaan semaglutidia 7,2 mg:n annoksella).
Semaglutidilla hoidettaessa havaittiin lumelääkkeeseen verrattuna suurempaa, kliinisesti merkittävää ja pitkäkestoista painon laskua potilailla, joilla oli lihavuus (painoindeksi ≥ 30 kg/m2) tai ylipaino (painoindeksi välillä ≥ 27 kg/m2 ja < 30 kg/m2) sekä vähintään yksi painoon liittyvä sairaus. Lisäksi lumelääkkeeseen verrattuna suurempi osa potilaista saavutti STEP-tutkimuksissa ≥ 5 %:n, ≥ 10 %:n, ≥ 15 %:n ja ≥ 20 %:n painon laskun semaglutidia käytettäessä. Painon lasku tapahtui riippumatta ruoansulatuselimistön oireista, kuten pahoinvoinnista, oksentelusta tai ripulista.
Semaglutidilla toteutetun hoidon havaittiin myös parantavan tilastollisesti merkitsevästi vyötärön ympärysmittaa, systolista verenpainetta ja fyysistä toimintakykyä lumelääkkeeseen verrattuna.
Teho osoitettiin riippumatta iästä, sukupuolesta, rodusta, etnisestä taustasta, lähtötason painosta, painoindeksistä, tyypin 2 diabeteksesta ja munuaisten toiminnan tasosta. Teho vaihteli kaikkien alaryhmien sisällä. Suhteellisesti suurinta painonlaskua havaittiin naisilla ja potilailla, joilla ei ollut tyypin 2 diabetesta, sekä potilailla, joilla lähtötason paino oli alhaisempi.
STEP 1 -tutkimus: Painonhallinta
68 viikkoa kestäneessä kaksoissokkoutetussa tutkimuksessa satunnaistettiin 1 961 potilasta, joilla oli lihavuus (painoindeksi ≥ 30 kg/m2) tai ylipaino (painoindeksi ≥ 27 kg/m2 – < 30 kg/m2) ja vähintään yksi painoon liittyvä sairaus, saamaan semaglutidia tai lumelääkettä. Kaikki potilaat noudattivat vähäkalorista ruokavaliota ja olivat fyysisesti aktiivisempia koko tutkimuksen ajan.
Painon lasku ilmeni varhain ja paino pysyi pienempänä koko tutkimuksen ajan. Hoidon lopussa (viikko 68) painon lasku oli suurempaa ja kliinisesti merkittävää lumelääkkeeseen verrattuna (ks. taulukko 4 ja kuva 1). Lisäksi suurempi osa semaglutidia saaneista potilaista saavutti ≥ 5 %:n, ≥ 10 %:n, ≥ 15 %:n ja ≥ 20 %:n painon laskun kuin lumelääkettä saaneista (ks. taulukko 4). Niistä potilaista, joilla oli lähtötilanteessa esidiabetes, suurempi osuus oli normoglykeemisia semaglutidihoidon lopussa verrattuna lumelääkkeeseen (84,1 % vs. 47,8 %).
Taulukko 4. STEP 1 -tutkimus: Viikon 68 tulokset
| Semaglutidi 2,4 mg | Lumelääke | |
| Koko analyysijoukko (N) | 1 306 | 655 |
| Paino | ||
| Lähtötaso (kg) | 105,4 | 105,2 |
| Muutos (%) lähtötasosta1,2 | -14,9 | -2,4 |
| Ero (%) lumelääkkeeseen verrattuna1 [95 %:n luottamusväli] | -12,4 [-13,4; -11,5]* | - |
| Muutos (kg) lähtötasosta | -15,3 | -2,6 |
| Ero (kg) lumelääkkeeseen verrattuna1 [95 %:n luottamusväli] | -12,7 [-13,7; -11,7] | - |
| Potilaat (%), jotka saavuttivat ≥ 5 %:n painon laskun3 | 83,5* | 31,1 |
| Potilaat (%), jotka saavuttivat ≥ 10 %:n painon laskun 3 | 66,1* | 12,0 |
| Potilaat (%),jotka saavuttivat ≥ 15 %:n painon laskun 3 | 47,9* | 4,8 |
| Vyötärön ympärysmitta (cm) | ||
| Lähtötaso | 114,6 | 114,8 |
| Muutos lähtötasosta1 | -13,5 | -4,1 |
| Ero lumelääkkeeseen verrattuna1 [95 %:n luottamusväli] | -9,4 [-10,3; -8,5]* | - |
| Systolinen verenpaine (mmHg) | ||
| Lähtötaso | 126 | 127 |
| Muutos lähtötasosta1 | -6,2 | -1,1 |
| Ero lumelääkkeeseen verrattuna1 [95 %:n luottamusväli] | -5,1 [-6,3; -3,9]* | - |
* p < 0,0001 (korjaamaton kaksipuolinen) paremmuuden suhteen.
1 Arvioitu käyttäen ANCOVA-mallia, jossa on käytetty moni-imputointia. Malli perustuu kaikkiin tietoihin riippumatta satunnaistetun hoidon keskeyttämisestä, muun lihavuuslääkityksen aloittamisesta tai lihavuusleikkauksesta.
2 Tutkimuksen aikana satunnaistettu hoito keskeytettiin pysyvästi 17,1 %:lla semaglutidi 2,4 mg:a saamaan satunnaistetuista potilaista ja 22,4 %:lla lumelääkeryhmään satunnaistetuista potilaista. Olettaen, että kaikki satunnaistetut potilaat jatkoivat hoitoa eivätkä saaneet muita lihavuuteen tarkoitettuja hoitoja, arvioidut painonmuutokset satunnaistamisesta viikolle 68, jotka perustuvat toistomittausten sekamalliin sisältäen kaikki havainnot ensimmäiseen keskeyttämiseen asti, olivat semaglutidi 2,4 mg:lle -16,9 % ja lumelääkkeelle -2,4 %.
3 Arvioitu binaarisesta regressiomallista perustuen samaan imputointimenettelyyn kuin ensisijaisessa analyysissä.
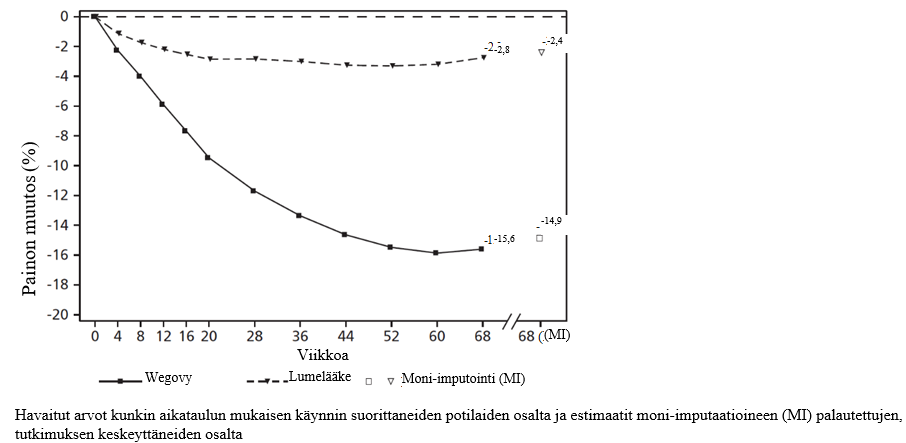
Kuva 1. STEP 1 -tutkimus: Keskimääräinen painon muutos (%) lähtötasosta viikolla 68
68 viikkoa kestäneen tutkimuksen jälkeen toteutettiin 52 viikkoa kestävä jatkovaihe, jonka aikana potilaat eivät saaneet hoitoa. Siihen osallistui 327 potilasta, jotka olivat suorittaneet päätutkimuksen loppuun saaden joko semaglutidia ylläpitoannoksella tai lumelääkettä. Viikolta 68 viikolle 120, eli aikana, jolloin potilaat eivät saaneet hoitoa, painon keskiarvo nousi kummassakin hoitoryhmässä. Potilailla, jotka olivat päätutkimuksen aikana saaneet semaglutidihoitoa, paino kuitenkin pysyi 5,6 % lähtötilannetta pienempänä, kun taas lumeryhmässä se pysyi 0,1 % pienempänä.
STEP 2 -tutkimus: Painonhallinta tyypin 2 diabetesta sairastavilla potilailla
68 viikkoa kestäneessä kaksoissokkoutetussa tutkimuksessa 1 210 potilasta, joilla oli lihavuus tai ylipaino (painoindeksi ≥ 27 kg/m2) ja tyypin 2 diabetes, satunnaistettiin saamaan kerran viikossa semaglutidi 2,4 mg:a, semaglutidi 1 mg:a tai lumelääkettä. Tutkimukseen osallistuneilla potilailla diabetes oli riittämättömässä hoitotasapainossa (HbA1c 7–10 %), ja heitä hoidettiin joko pelkällä ruokavaliolla ja liikunnalla tai 1–3 suun kautta otettavalla diabeteslääkkeellä. Kaikki potilaat noudattivat vähäkalorista ruokavaliota ja olivat fyysisesti aktiivisempia koko tutkimuksen ajan.
68 viikon pituinen semaglutidihoito johti parempaan ja kliinisesti merkittävään painon ja HbA1c-tason laskuun lumelääkkeeseen verrattuna (ks. taulukko 5 ja kuva 2).
Taulukko 5. STEP 2 -tutkimus: Tulokset viikon 68 kohdalla
| Semaglutidi 2,4 mg | Lumelääke | |
| Koko analyysijoukko (N) | 404 | 403 |
| Paino | ||
| Lähtötaso (kg) | 99,9 | 100,5 |
| Muutos (%) lähtötasosta1,2 | -9,6 | -3,4 |
| Ero (%) lumelääkkeeseen verrattuna1 [95 %:n luottamusväli] | -6,2 [-7,3; -5,2]* | - |
| Muutos (kg) lähtötasosta | -9,7 | -3,5 |
| Ero (kg) lumelääkkeeseen verrattuna1 [95 %:n luottamusväli] | -6,1 [-7,2; -5,0] | - |
| Potilaat (%), jotka saavuttivat ≥ 5 %:n painon laskun3 | 67,4* | 30,2 |
| Potilaat (%), jotka saavuttivat ≥ 10 %:n painon laskun 3 | 44,5* | 10,2 |
| Potilaat (%), jotka saavuttivat ≥ 15 %:n painon laskun 3 | 25,0* | 4,3 |
| Vyötärön ympärysmitta (cm) | ||
| Lähtötaso | 114,5 | 115,5 |
| Muutos lähtötasosta1 | -9,4 | -4,5 |
| Ero lumelääkkeeseen verrattuna1 [95 %:n luottamusväli] | -4,9 [-6,0; -3,8]* | - |
| Systolinen verenpaine (mmHg) | ||
| Lähtötaso | 130 | 130 |
| Muutos lähtötasosta1 | -3,9 | -0,5 |
| Ero lumelääkkeeseen verrattuna1 [95 %:n luottamusväli] | -3,4 [-5,6; -1,3]** | - |
| HbA1c (mmol/mol (%)) | ||
| Lähtötaso | 65,3 (8,1) | 65,3 (8,1) |
| Muutos lähtötasosta1 | -17,5 (-1,6) | -4,1 (-0,4) |
| Ero lumelääkkeeseen verrattuna1 [95 %:n luottamusväli] | -13,5 [-15,5; -11,4] (-1,2 [-1,4; -1,1])* | - - |
* p < 0,0001 (korjaamaton kaksipuolinen) paremmuuden osalta; **p < 0,05 (korjaamaton kaksipuolinen) paremmuuden suhteen.
1 Arvioitu käyttäen ANCOVA-mallia, jossa on käytetty moni-imputointia. Malli perustuu kaikkiin tietoihin riippumatta satunnaistetun hoidon keskeyttämisestä, muun lihavuuslääkityksen aloittamisesta tai lihavuusleikkauksesta.
2 Tutkimuksen aikana satunnaistettu hoito lopetettiin pysyvästi 11,6 %:lla semaglutidi 2,4 mg:a saamaan satunnaistetuista potilaista ja 13,9 %:lla lumelääkeryhmään satunnaistetuista potilaista. Olettaen, että kaikki satunnaistetut potilaat jatkoivat hoitoa eivätkä saaneet muita lihavuuteen tarkoitettuja hoitoja, arvioidut painonmuutokset satunnaistamisesta viikolle 68, jotka perustuvat toistomittausten sekamalliin sisältäen kaikki havainnot ensimmäiseen keskeyttämiseen asti, olivat semaglutidi 2,4 mg:lle -10,6 % ja lumelääkkeelle -3,1 %.
3 Arvioitu binaarisesta regressiomallista perustuen samaan imputointimenettelyyn kuin ensisijaisessa analyysissä.
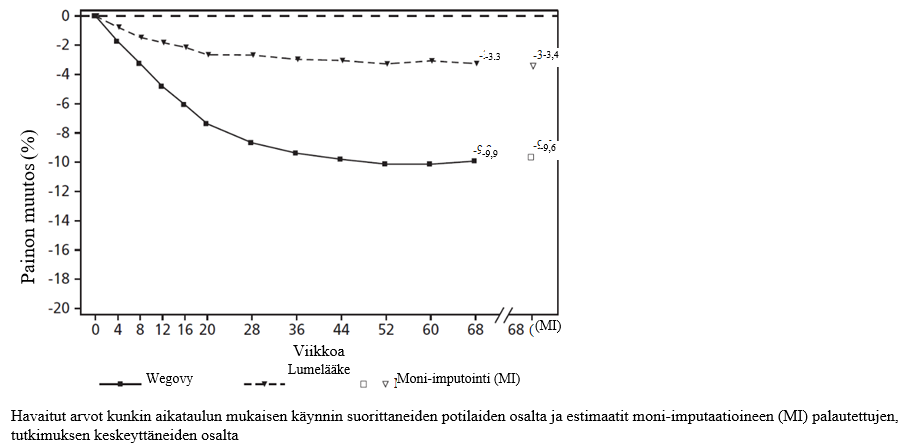
Kuva 2. STEP 2 -tutkimus: Keskimääräinen painon muutos (%) lähtötasosta viikolla 68
STEP 3 -tutkimus: Painonhallinta intensiivisen käyttäytymisterapian avulla
68 viikon pituisessa kaksoissokkoutetussa tutkimuksessa 611 potilasta, joilla oli lihavuus (painoindeksi ≥ 30 kg/m2) tai ylipaino (painoindeksi ≥ 27 kg/m2 – < 30 kg/m2) ja ainakin yksi painoon liittyvä sairaus, satunnaistettiin saamaan semaglutidia tai lumelääkettä. Tutkimuksen aikana kaikki potilaat saivat intensiivistä käyttäytymisterapiaa (IBT), joka koostuu erittäin rajoitetusta ruokavaliosta, fyysisen aktiivisuuden lisäämisestä ja käyttäytymistä koskevasta neuvonnasta.
Semaglutidin ja IBT:n yhdistelmähoito 68 viikon ajan johti lumelääkkeeseen verrattuna parempaan ja kliinisesti merkittävään painon laskuun (ks. taulukko 6).
Taulukko 6. STEP 3 -tutkimus: Tulokset viikon 68 kohdalla
| Semaglutidi 2,4 mg | Lumelääke | |
| Koko analyysijoukko (N) | 407 | 204 |
| Paino | ||
| Lähtötaso (kg) | 106,9 | 103,7 |
| Muutos (%) lähtötasosta1,2 | -16,0 | -5,7 |
| Ero (%) lumelääkkeeseen verrattuna1 [95 %:n luottamusväli] | -10,3 [-12,0; -8,6]* | - |
| Muutos (kg) lähtötasosta | -16,8 | -6,2 |
| Ero (kg) lumelääkkeeseen verrattuna1 [95 %:n luottamusväli] | -10,6 [-12,5; -8,8] | - |
| Potilaat (%), jotka saavuttivat ≥ 5 %:n painon laskun3 | 84,8* | 47,8 |
| Potilaat (%), jotka saavuttivat ≥ 10 %:n painon laskun3 | 73,0* | 27,1 |
| Potilaat (%), jotka saavuttivat ≥ 15 %:n painon laskun3 | 53,5* | 13,2 |
| Vyötärön ympärysmitta (cm) | ||
| Lähtötaso | 113,6 | 111,8 |
| Muutos lähtötasosta1 | -14,6 | -6,3 |
| Ero lumelääkkeeseen verrattuna1 [95 %:n luottamusväli] | -8,3 [-10,1; -6,6]* | - |
| Systolinen verenpaine (mmHg) | ||
| Lähtötaso | 124 | 124 |
| Muutos lähtötasosta1 | -5,6 | -1,6 |
| Ero lumelääkkeeseen verrattuna1 [95 %:n luottamusväli] | -3,9 [-6,4; -1,5]* | - |
* p < 0,005 (korjaamaton kaksipuolinen) paremmuuden suhteen.
1 Arvioitu käyttäen ANCOVA-mallia, jossa on käytetty moni-imputointia. Malli perustuu kaikkiin tietoihin riippumatta satunnaistetun hoidon keskeyttämisestä, muun lihavuuslääkityksen aloittamisesta tai lihavuusleikkauksesta.
2 Tutkimuksen aikana satunnaistettu hoito lopetettiin pysyvästi 16,7 %:lla semaglutidi 2,4 mg:a saamaan satunnaistetuista potilaista ja 18,6 %:lla lumelääkeryhmään satunnaistetuista potilaista. Olettaen, että kaikki satunnaistetut potilaat jatkoivat hoitoa eivätkä saaneet muita lihavuuteen tarkoitettuja hoitoja, arvioidut painon muutokset satunnaistamisesta viikolle 68, jotka perustuvat toistomittausten sekamalliin joka sisältää kaikki havainnot ensimmäiseen keskeyttämiseen asti, olivat semaglutidi 2,4 mg:lle ‑17,6 % ja lumelääkkeelle -5,0 %.
3 Arvioitu binaarisesta regressiomallista perustuen samaan imputointimenettelyyn kuin ensisijaisessa analyysissä.
STEP 4 -tutkimus: Pitkäjänteinen painonhallinta
68 viikkoa kestäneeseen kaksoissokkoutettuun tutkimukseen otettiin mukaan 902 potilasta, joilla oli lihavuus (painoindeksi ≥ 30 kg/m2) tai ylipaino (painoindeksi ≥ 27 kg/m2 – < 30 kg/m2) ja joilla oli vähintään yksi painoon liittyvä sairaus. Kaikki potilaat noudattivat vähäkalorista ruokavaliota ja olivat fyysisesti aktiivisempia koko tutkimuksen ajan. Kaikki potilaat saivat semaglutidia viikolta 0 viikolle 20 (alkuseuranta). Viikolla 20 (lähtötaso) potilaat, jotka olivat saavuttaneet ylläpitoannoksen 2,4 mg, satunnaistettiin jatkamaan hoitoa tai vaihtamaan lumelääkkeeseen. Viikolla 0 (alkuseurantajakson alussa) potilaiden keskimääräinen paino oli 107,2 kg ja keskimääräinen painoindeksi 38,4 kg/m2.
Potilailla, jotka olivat saavuttaneet 2,4 mg:n ylläpitoannoksen viikolla 20 (lähtötaso) ja jotka jatkoivat semaglutidihoitoa 48 viikon ajan (viikot 20–68), paino laski edelleen. Heidän painonsa laski lumelääkehoitoon vaihdettuihin tutkittaviin verrattuna enemmän ja kliinisesti merkittävästi (ks. taulukko 7 ja kuva 3). Paino nousi tasaisesti viikosta 20 viikkoon 68 potilailla, jotka siirtyivät käyttämään lumelääkettä viikolla 20 (lähtötaso). Havaittu keskimääräinen paino oli kuitenkin pienempi viikolla 68 kuin alkuseurantajakson alussa (viikko 0) (ks. kuva 3). Potilaat, joita hoidettiin semaglutidilla viikosta 0 (alkuseuranta) viikkoon 68 (hoidon päättyminen), saavuttivat keskimäärin -17,4 %:n painon muutoksen. 87,8 %:lla potilaista paino laski ≥ 5 %; 78,0 %:lla paino laski ≥ 10 %, 62,2 %:lla paino laski ≥ 15 % ja 38,6 %:lla paino laski ≥ 20 %.
Taulukko 7. STEP 4 -tutkimus: Tulokset viikolta 20 viikolle 68
| Semaglutidi 2,4 mg | Lumelääke | |
| Koko analyysijoukko (N) | 535 | 268 |
| Paino | ||
| Lähtötaso1 (kg) | 96,5 | 95,4 |
| Muutos (%) lähtötasosta1,2,3 | -7,9 | 6,9 |
| Ero (%) lumelääkkeeseen verrattuna2 [95 %:n luottamusväli] | -14,8 [-16,0; -13,5]* | - |
| Muutos (kg) lähtötasosta | -7,1 | 6,1 |
| Ero (kg) lumelääkkeeseen verrattuna2 [95 %:n luottamusväli] | -13,2 [-14,3; -12,0] | - |
| Vyötärön ympärysmitta (cm) | ||
| Lähtötaso | 105,5 | 104,7 |
| Muutos lähtötasosta1 | -6,4 | 3,3 |
| Ero lumelääkkeeseen verrattuna2 [95 %:n luottamusväli] | -9,7 [-10,9; -8,5]* | - |
| Systolinen verenpaine (mmHg) | ||
| Lähtötaso1 | 121 | 121 |
| Muutos lähtötasosta1,2 | 0,5 | 4,4 |
| Ero lumelääkkeeseen verrattuna2 [95 %:n luottamusväli] | -3,9 [-5,8; -2,0]* | - |
* p < 0,0001 (korjaamaton kaksipuolinen) paremmuuden suhteen.
1 Lähtötaso = viikko 20
2 Arvioitu käyttäen ANCOVA-mallia, jossa on käytetty moni-imputointia. Malli perustuu kaikkiin tietoihin riippumatta satunnaistetun hoidon keskeyttämisestä, muun lihavuuslääkityksen aloittamisesta tai lihavuusleikkauksesta.
3 Tutkimuksen aikana satunnaistettu hoito keskeytettiin pysyvästi 5,8 %:lla semaglutidi 2,4 mg:a saamaan satunnaistetuista potilaista ja 11,6 %:lla lumelääkeryhmään satunnaistetuista potilaista. Olettaen, että kaikki satunnaistetut potilaat jatkoivat hoitoa eivätkä saaneet muita lihavuuteen tarkoitettuja hoitoja, arvioidut painonmuutokset satunnaistamisesta viikolle 68, jotka perustuvat toistomittausten sekamalliin sisältäen kaikki havainnot ensimmäiseen keskeyttämiseen asti, olivat semaglutidi 2,4 mg:lle ‑8,8 % ja lumelääkkeelle 6,5 %.
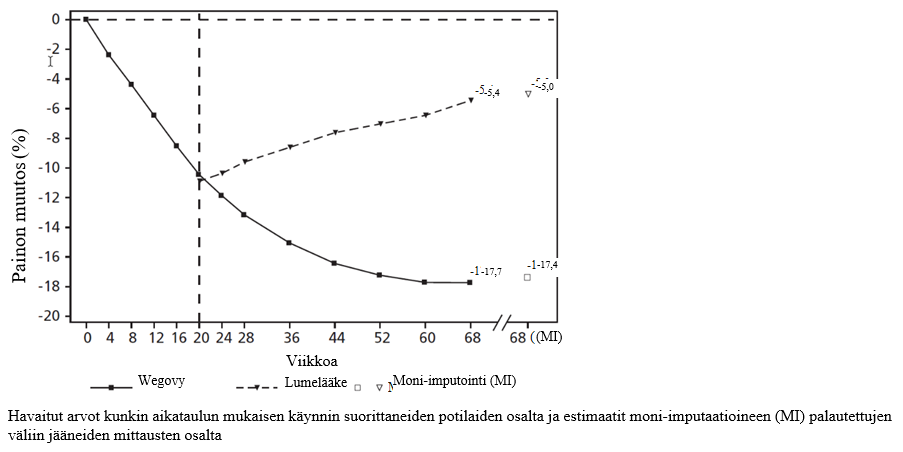
Kuva 3. STEP 4 -tutkimus: Keskimääräinen painon muutos (%) viikosta 0 viikolle 68
STEP 5 -tutkimus: Kahden vuoden tulokset
104 viikkoa kestäneessä kaksoissokkoutetussa tutkimuksessa 304 potilasta, joilla oli lihavuus (painoindeksi ≥ 30 kg/m2) tai ylipaino (painoindeksi ≥ 27 kg/m2 – < 30 kg/m2) ja vähintään yksi painoon liittyvä sairaus, satunnaistettiin saamaan semaglutidia tai lumelääkettä. Kaikki potilaat noudattivat vähäkalorista ruokavaliota ja olivat fyysisesti aktiivisempia koko tutkimuksen ajan. Lähtötilanteessa potilaiden painoindeksin keskiarvo oli 38,5 kg/m2 ja painon keskiarvo oli 106,0 kg.
104 viikon pituinen semaglutidihoito johti suurempaan ja kliinisesti merkittävään painon laskuun lumelääkkeeseen verrattuna. Painon keskiarvo pieneni semaglutidihoidolla lähtötilanteesta viikolle 68, minkä jälkeen se vakiintui. Lumelääkkeellä painon keskiarvo pieneni vähemmän, ja se vakiintui noin 20 hoitoviikon kuluttua (ks. taulukko 8 ja kuva 4). Semaglutidilla hoidetut potilaat saavuttivat keskimäärin -15,2 % painon muutoksen, joista 74,7 %:lla painon lasku oli ≥ 5 %, 59,2 %:lla painon lasku oli ≥ 10 % ja 49,7 %:lla painon lasku oli ≥ 15 %. Niistä potilaista, joilla oli lähtötilanteessa esidiabetes, normoglykeemisia oli semaglutidihoidon lopussa 80 % ja lumelääkehoidon lopussa 37 %.
Taulukko 8. STEP 5 -tutkimus: Tulokset viikon 104 kohdalla
| Semaglutidi 2,4 mg | Lumelääke | |
| Koko analyysijoukko (N) | 152 | 152 |
| Paino | ||
| Lähtötaso (kg) | 105,6 | 106,5 |
| Muutos (%) lähtötasosta1, 2 | -15,2 | -2,6 |
| Ero (%) lumelääkkeeseen verrattuna1 [95 %:n luottamusväli] | -12,6 [-15,3; -9,8]* | - |
| Muutos (kg) lähtötasosta | -16,1 | -3,2 |
| Ero (kg) lumelääkkeeseen verrattuna1 [95 %:n luottamusväli] | -12,9 [‑16,1; ‑9,8] | - |
| Potilaat (%), jotka saavuttivat ≥ 5 %:n painon laskun3 | 74,7* | 37,3 |
| Potilaat (%), jotka saavuttivat ≥ 10 %:n painon laskun3 | 59,2* | 16,8 |
| Potilaat (%), jotka saavuttivat ≥ 15 %:n painon laskun3 | 49,7* | 9,2 |
| Vyötärön ympärysmitta (cm) | ||
| Lähtötaso | 115,8 | 115,7 |
| Muutos lähtötasosta1 | -14,4 | 5,2 |
| Ero lumelääkkeeseen verrattuna1 [95 %:n luottamusväli] | -9,2 [-12,2; -6,2]* | - |
| Systolinen verenpaine (mmHg) | ||
| Lähtötaso | 126 | 125 |
| Muutos lähtötasosta1 | -5,7 | -1,6 |
| Ero lumelääkkeeseen verrattuna1 [95 %:n luottamusväli] | -4,2 [-7,3; -1,0]* | - |
* p < 0,0001 (korjaamaton kaksipuolinen) paremmuuden suhteen.
1 Arvioitu käyttäen ANCOVA-mallia, jossa on käytetty moni-imputointia. Malli perustuu kaikkiin tietoihin riippumatta satunnaistetun hoidon keskeyttämisestä, muun lihavuuslääkityksen aloittamisesta tai lihavuusleikkauksesta.
2 Tutkimuksen aikana satunnaistettu hoito keskeytettiin pysyvästi 13,2 %:lla semaglutidia saamaan satunnaistetuista potilaista ja 27,0 %:lla lumelääkeryhmään satunnaistetuista potilaista. Olettaen, että kaikki satunnaistetut potilaat jatkoivat hoitoa eivätkä saaneet muita lihavuuteen tarkoitettuja hoitoja, arvioidut painonmuutokset satunnaistamisesta viikolle 104, jotka perustuvat toistomittausten sekamalliin sisältäen kaikki havainnot ensimmäiseen keskeyttämiseen asti, olivat semaglutidille ‑16,7 % ja lumelääkkeelle -0,6 %.
3 Arvioitu binaarisesta regressiomallista perustuen samaan imputointimenettelyyn kuin ensisijaisessa analyysissä.
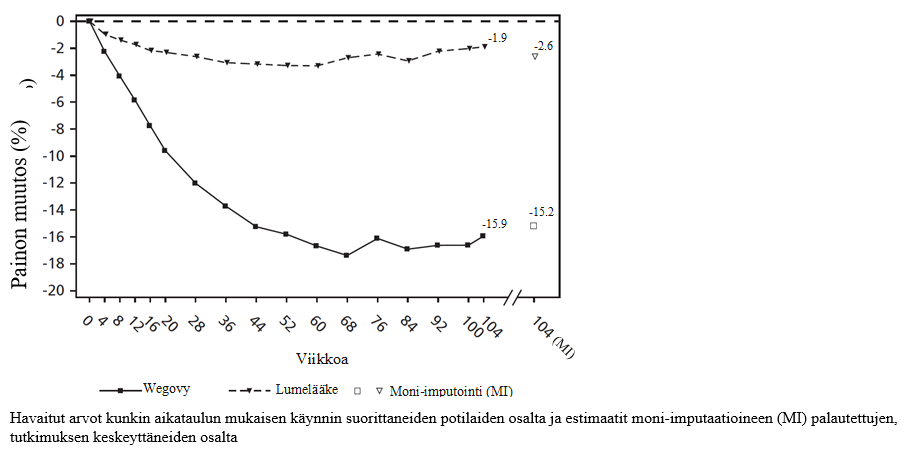
Kuva 4 STEP 5 -tutkimus: Painon keskimuutos (%) viikolta 0 viikolle 104
STEP 8: Semaglutidi vs. liraglutidi
68 viikkoa kestäneessä, satunnaistetussa, avoimessa, pareittain lumelääkekontrolloidussa tutkimuksessa 338 potilasta, joilla oli lihavuus (painoindeksi ≥ 30 kg/m2) tai ylipaino (painoindeksi ≥ 27 kg/m2 – < 30 kg/m2) ja vähintään yksi painoon liittyvä sairaus, satunnaistettiin saamaan semaglutidia kerran viikossa, 3 mg liraglutidia kerran päivässä tai lumelääkettä. Tutkimus oli avoin sen suhteen, kuuluiko potilas semaglutidia kerran viikossa vai 3 mg liraglutidia saavaan ryhmään, mutta kumpikin aktiivisen hoidon ryhmä oli kaksoissokkoutettu samalla antotiheydellä annettavan lumelääkkeen suhteen. Kaikki potilaat noudattivat vähäkalorista ruokavaliota ja olivat fyysisesti aktiivisempia koko tutkimuksen ajan. Lähtötilanteessa potilaiden painoindeksin keskiarvo oli 37,5 kg/m2 ja painon keskiarvo oli 104,5 kg.
68 viikon pituinen kerran viikossa annettu semaglutidihoito johti suurempaan ja kliinisesti merkittävään painon laskuun liraglutidiin verrattuna. Painon keskiarvo pieneni semaglutidihoidolla lähtötasosta viikolle 68. Liraglutidihoidolla painon keskiarvo pieneni vähemmän (ks. taulukko 9). Semaglutidihoitoa saaneista potilaista 37,4 %:lla paino pieneni vähintään 20 %, kun taas liraglutidihoitoa saaneilla vastaava luku oli 7,0 %. Taulukossa 9 esitetään vahvistavia päätemuuttujia eli ≥ 10 %:n, ≥ 15 %:n ja ≥ 20 %:n painon laskua koskevat tulokset.
Taulukko 9. STEP 8 -tutkimus: Tulokset 68 viikkoa kestäneestä tutkimuksesta, jossa verrattiin semaglutidia ja liraglutidia
| Semaglutidi 2,4 mg | Liraglutidi 3 mg | |
| Koko analyysijoukko (N) | 126 | 127 |
| Paino | ||
| Lähtötaso (kg) | 102,5 | 103,7 |
| Muutos (%) lähtötasosta1, 2 | -15,8 | -6,4 |
| Ero (%) liraglutidiin verrattuna1 [95 %:n luottamusväli] | ‑9,4 [‑12,0; ‑6,8]* | - |
| Muutos (kg) lähtötasosta | ‑15,3 | ‑6,8 |
| Ero (kg) liraglutidiin verrattuna1 [95 %:n luottamusväli] | ‑8,5 [‑11,2; ‑5,7] | - |
| Potilaat (%), jotka saavuttivat ≥ 10 %:n painon laskun3 | 69,4* | 27,2 |
| Potilaat (%), jotka saavuttivat ≥ 15 %:n painon laskun3 | 54,0* | 13,4 |
| Potilaat (%), jotka saavuttivat ≥ 20 %:n painon laskun3 | 37,4* | 7,0 |
* p < 0,005 (korjaamaton kaksipuolinen) paremmuuden suhteen.
1 Arvioitu käyttäen ANCOVA-mallia, jossa on käytetty moni-imputointia. Malli perustuu kaikkiin tietoihin riippumatta satunnaistetun hoidon keskeyttämisestä, muun lihavuuslääkityksen aloittamisesta tai lihavuusleikkauksesta.
2 Tutkimuksen aikana satunnaistettu hoito keskeytettiin pysyvästi 13,5 %:lla semaglutidia (2,4 mg) saamaan satunnaistetuista potilaista ja 27,6 %:lla liraglutidia (3 mg) saamaan satunnaistetuista potilaista. Olettaen, että kaikki satunnaistetut potilaat jatkoivat hoitoa eivätkä saaneet muita lihavuuteen tarkoitettuja hoitoja, arvioidut painonmuutokset satunnaistamisesta viikolle 68, jotka perustuvat toistomittausten sekamalliin sisältäen kaikki havainnot ensimmäiseen keskeyttämiseen asti, olivat semaglutidille (2,4 mg) -16,7 % ja liraglutidille (3 mg) -6,7 %.
3 Arvioitu binaarisesta regressiomallista perustuen samaan imputointimenettelyyn kuin ensisijaisessa analyysissä.
STEP 9: Painonhallinta polven nivelrikkoa sairastavilla potilailla
68 viikkoa kestäneessä kaksoissokkoutetussa tutkimuksessa 407 potilasta, joilla oli lihavuus ja keskivaikea toisen polven tai molempien polvien nivelrikko, satunnaistettiin saamaan joko semaglutidia tai lumelääkettä. Tämän rinnalla heille annettiin neuvontaa vähäenergiaisesta ruokavaliosta ja fyysisen aktiivisuuden lisäämisestä. Hoidon vaikutusta polven nivelrikkoon liittyvään kipuun arvioitiin WOMAC-indeksin (Western Ontario and McMaster Universities Osteoarthritis) versiolla 3.1. Indeksi on kehitetty hoitoon liittyvien oireiden ja alaraajojen toiminnan muutosten arviointiin potilailla, joilla on lonkan ja/tai polven nivelrikko. Lähtötilanteessa potilaiden painoindeksin keskiarvo oli 40,3 kg/m2 ja painon keskiarvo oli 108,6 kg. Kaikilla potilailla oli kliinisesti todettu polven nivelrikko, ja kipua kuvaavan WOMAC-pistemäärän keskiarvo oli lähtötilanteessa 70,9 (asteikolla 0–100).
68 viikon pituinen semaglutidihoito johti parempaan ja kliinisesti merkittävään painon laskuun lumelääkkeeseen verrattuna (ks. taulukko 10).
Semaglutidilla hoidettaessa havaittiin lumelääkkeeseen verrattuna kliinisesti merkittävää polven nivelrikkoon liittyvän kivun lievittymistä (ks. taulukko 10). Polven nivelrikkoon liittyvän kivun lievittyminen saavutettiin semaglutidihoidolla ilman kipulääkityksen käytön lisääntymistä.
Taulukko 10 STEP 9: Tulokset viikon 68 kohdalla
| Semaglutidi 2,4 mg | Lumelääke | |
| Koko analyysijoukko (N) | 271 | 136 |
| Paino | ||
| Lähtötaso (kg) | 108,7 | 108,5 |
| Muutos lähtötasosta (%)1,2 | -13,7 | -3,2 |
| Ero (%) lumelääkkeeseen verrattuna1 [95 %:n luottamusväli] | -10,5 [-12,3; -8,6]* | - |
| Potilaat (%), jotka saavuttivat ≥ 5 %:n painon laskun3 | 85,2* | 33,6 |
| Kipua kuvaava WOMAC-pistemäärä4 | ||
| Lähtötaso | 72,8 | 67,2 |
| Muutos lähtötasosta1,2 | -41,7 | -27,5 |
| Ero lumelääkkeeseen verrattuna1 [95 %:n luottamusväli] | -14,1 [-20,0; -8,3]* | - |
| Potilaat (%), jotka saavuttivat kliinisesti merkittävää lievittymistä3, 5 | 59,0 | 35,0 |
* p < 0,0001 (korjaamaton kaksipuolinen) paremmuuden suhteen.
1 Arvioitu käyttäen ANCOVA-mallia, jossa on käytetty moni-imputointia. Malli perustuu kaikkiin tietoihin riippumatta satunnaistetun hoidon keskeyttämisestä, muun lihavuuslääkityksen tai muiden polven nivelrikon hoitojen aloittamisesta sekä siitä, pidettiinkö kipulääkityksen suhteen lääkityskatko (viimeinen kohta koskee vain WOMAC-pistemäärään liittyvää päätetapahtumaa). Tutkimuksen aikana satunnaistettu hoito lopetettiin pysyvästi 12,5 %:lla semaglutidi 2,4 mg:aa saamaan satunnaistetuista potilaista ja 21,3 %:lla lumelääkeryhmään satunnaistetuista potilaista.
2 Perustuu toistomittausten sekamalliin, jossa oletettiin, että kaikki satunnaistetut potilaat jatkoivat hoitoa eivätkä saaneet muuta lihavuuslääkitystä tai muita polven nivelrikon hoitoja ja pitivät kipulääkityksen suhteen lääkityskatkon (viimeinen kohta koskee vain polven nivelrikkoon liittyvää kipua), ja johon sisällytettiin kaikki havainnot ensimmäiseen keskeyttämiseen asti. Arvioitu painon muutos lähtötilanteesta viikon 68 kohdalle oli semaglutidi 2,4 mg -ryhmässä -14,5 % ja lumelääkeryhmässä -2,3 % ja arvioitu kipua kuvaavan WOMAC-pistemäärän muutos lähtötilanteesta viikon 68 kohdalle semaglutidi 2,4 mg -ryhmässä -43,0 ja lumelääkeryhmässä -28,3.
3 Arvioitu logistisesta regressiomallista perustuen samaan imputointimenettelyyn kuin ensisijaisessa analyysissä.
4 WOMAC-pistemäärät esitetään asteikolla 0–100, jossa pienempi pistemäärä tarkoittaa vähäisempää haittaa.
5 Merkittävän lievittymisen kynnysarvona oli ≤ -37,3 pisteen muutos kipua kuvaavassa WOMAC-pistemäärässä. Kynnysarvo saatiin tutkimustiedoista ankkurimenetelmillä (anchor-based methods).
Vaikutus kehon koostumukseen
STEP 1 -tutkimuksen (N = 140) osatutkimuksessa kehon koostumus mitattiin käyttämällä kaksienergistä röntgenabsorptiometriaa (DEXA). DEXA-arvioinnin tulokset osoittivat, että semaglutidihoitoa käytettäessä rasvamassa väheni enemmän kuin kehon rasvaton massa, mikä paransi kehon koostumusta lumelääkkeeseen verrattuna 68 viikon jälkeen. Lisäksi tähän rasvamassan kokonaismäärän pienenemiseen liittyi viskeraalisen rasvan väheneminen. Nämä tulokset viittaavat siihen, että suurin osa kokonaispainonpudotuksesta johtui rasvakudoksen, myös viskeraalisen rasvan, vähenemisestä.
STEP UP ‑tutkimuksen osatutkimuksessa (N = 55) kehon koostumus mitattiin magneettikuvauksella. Magneettikuvaustulokset osoittivat, että 2,4 mg:n ja 7,2 mg:n annoksilla annettua semaglutidipistoshoitoa käytettäessä rasvamassa/rasvatilavuus pieneni enemmän kuin kehon rasvaton massa/tilavuus, mikä paransi kehon koostumusta lumelääkkeeseen verrattuna 72 viikon jälkeen.
Fyysisen toimintakyvyn parantuminen
Semaglutidia käytettäessä havaittiin fyysisen toimintakyvyn pistemäärissä vähäistä paranemista. Fyysinen toimintakyky arvioitiin käyttämällä sekä yleistä terveyteen liittyvää elämänlaatua koskevaa kyselylomaketta Short Form-36v2 Health Survey, Acute Version (SF-36) että lihavuuteen keskittyvää kyselylomaketta Weight Impact of Quality of Life Lite Clinical Trials Version (IWQOL-Lite-CT).
STEP UP ja STEP UP T2D: Painon hallinta suuremmalla semaglutidiannoksella
Kahdessa 72 viikon pituisessa kaksoissokkoutetussa kliinisessä tutkimuksessa 1 407 potilasta, joilla oli lihavuus (STEP UP), ja 514 potilasta, joilla oli lihavuus ja tyypin 2 diabetes (STEP UP T2D), satunnaistettiin suhteessa 5:1:1 (STEP UP) tai suhteessa 3:1:1 (STEP UP T2D) saamaan semaglutidia 7,2 mg, semaglutidia 2,4 mg tai lumelääkettä kerran viikossa. Kaikki potilaat noudattivat vähäkalorista ruokavaliota ja olivat fyysisesti aktiivisempia koko tutkimusten ajan.
STEP UP ‑tutkimuksen lähtötilanteessa potilaiden iän keskiarvo oli 47 vuotta, painoindeksin keskiarvo 39,9 kg/m2 ja painon keskiarvo 113 kg. 26,3 % potilaista oli miehiä, 73,7 % naisia, 85,5 % valkoihoisia, 8,6 % mustaihoisia tai afroamerikkalaisia, 4,5 % aasialaisia ja 1,2 % muita. Yhteensä 4,5 % oli espanjalaistaustaisia tai latinalaisamerikkalaisia.
STEP UP T2D ‑tutkimuksen lähtötilanteessa potilaiden iän keskiarvo oli 56 vuotta, painoindeksin keskiarvo 38,6 kg/m2 ja painon keskiarvo 110,1 kg. 48,2 % potilaista oli miehiä, 51,8 % naisia, 83,6 % valkoihoisia, 8,6 % mustaihoisia tai afroamerikkalaisia, 6,3 % aasialaisia ja 1,6 % muita. Yhteensä 5,7 % oli espanjalaistaustaisia tai latinalaisamerikkalaisia.
Näissä kahdessa tutkimuksessa, STEP UP ja STEP UP T2D, hoidon lopussa (viikolla 72) paino oli laskenut 7,2 mg:n semaglutidipistoksia saaneilla enemmän ja kliinisesti merkittävästi lumelääkkeeseen verrattuna (ks. taulukko 11 sekä kuvat 5 ja 6). Lisäksi lumelääkkeeseen verrattuna suurempi osa potilaista saavutti ≥ 5 %:n, ≥ 10 %:n, ≥ 15 %:n ja ≥ 20 %:n painon laskun semaglutidia 7,2 mg:n annoksella käytettäessä.
STEP UP ‑tutkimuksessa 7,2 mg:n semaglutidipistoksia saaneilla paino laski enemmän ja suurempi osa potilaista saavutti ≥ 20 %:n ja ≥ 25 %:n painon laskun kuin 2,4 mg:n semaglutidipistoksia saaneilla (ks. taulukko 11).
Taulukko 11 STEP UP ja STEP UP T2D: Tulokset viikolla 72
| STEP UP | STEP UP T2D | ||||
| Semaglutidipistoshoito 7,2 mg | Semaglutidipistoshoito 2,4 mg | Lumelääke | Semaglutidipistoshoito 7,2 mg | Lumelääke | |
| Koko analyysijoukko (N) | 1 005 | 201 | 201 | 307 | 102 |
| Paino / kehon koostumus | |||||
| Lähtötaso (kg) | 112,4 | 116,5 | 112,4 | 110,5 | 112,1 |
| Muutos (%) lähtötasosta1 | ‑18,7 | ‑15,6 | ‑3,9 | ‑13,2 | ‑3,9 |
| Muutos (%) lähtötasosta, tutkimusvalmiste estimoitavana parametrina2 | ‑20,7 | ‑17,5 | ‑2,4 | ‑14,1 | ‑3,6 |
| Ero (%) lumelääkkeeseen verrattuna1 [95 %:n luottamusväli] | ‑14,8 [‑16,2; ‑13,4]* | - | - | ‑9,3 [‑11,0; ‑7,7]* | - |
| Ero (%) 2,4 mg:n pistoksiin verrattuna [95 %:n luottamusväli]1 | ‑3,1 [‑4,7; ‑1,6]* | - | - | - | - |
| Muutos (kg) lähtötasosta | ‑20,9 | ‑17,3 | ‑4,6 | ‑14,5 | ‑4,3 |
| Ero (kg) lumelääkkeeseen verrattuna1 [95 %:n luottamusväli]1 | ‑16,3 [‑17,9; ‑14,8] | - | - | ‑10,2 [‑12,1; ‑8,4] | - |
| Potilaat (%), jotka saavuttivat ≥ 5 %:n painon laskun3 | 90,7 | 89,9 | 36,8 | 86,3 | 34,7 |
| Potilaat (%), jotka saavuttivat ≥ 10 %:n painon laskun3 | 82,4 | 75,1 | 20,5 | 62,9 | 11,6 |
| Potilaat (%), jotka saavuttivat ≥ 15 %:n painon laskun3 | 66,5 | 54,5 | 7,6 | 41,2 | 7,4 |
| Potilaat (%), jotka saavuttivat ≥ 20 %:n painon laskun3,4 | 47,7 | 33,3 | 2,9 | 21,3 | 2,1 |
| Potilaat (%), jotka saavuttivat ≥ 25 %:n painon laskun3,5 | 31,2 | 15,3 | 0 | - | - |
| Vyötärön ympärysmitta (cm) | |||||
| Lähtötaso | 118,4 | 120,3 | 118,6 | 121,8 | 123,9 |
| Muutos lähtötasosta1 | ‑17,5 | ‑14,6 | ‑5,9 | ‑12,3 | ‑5,8 |
| Ero lumelääkkeeseen verrattuna1 [95 %:n luottamusväli] | ‑11,7 [‑13,0; ‑10,4]* | - | - | ‑6,5 [‑9,0; ‑4,1]* | - |
| HbA1c (%) | |||||
| Lähtötaso | 5,7 | 5,6 | 5,7 | 8,0 | 8,2 |
| Muutos lähtötasosta1 | ‑0,3 | ‑0,3 | ‑0,02 | ‑1,7 | ‑0,2 |
| Ero lumelääkkeeseen verrattuna1 [95 %:n luottamusväli] | ‑0,3 [‑0,4; ‑0,2] | - | - | ‑1,5 [‑1,8; ‑1,2]* | - |
* p < 0,0001 (korjaamaton kaksipuolinen) paremmuuden suhteen.
1 Arvioitu käyttäen ANCOVA-mallia, jossa on käytetty moni-imputointia. Malli perustuu kaikkiin tietoihin riippumatta hoidon keskeyttämisestä, muun lihavuuslääkityksen aloittamisesta tai lihavuusleikkauksesta.
2 Arvioidut muutokset satunnaistamisesta viikolle 72 perustuvat toistomittausten sekamalliin, joka sisältää kaikki havainnot ensimmäiseen hoidon keskeyttämiseen asti, olettaen, että kaikki satunnaistetut potilaat jatkoivat hoitoa eivätkä saaneet muuta lihavuuslääkitystä eikä heille tehty lihavuusleikkausta.
3 Havaittujen osuuksien perustana on tutkimukseen osallistumisen jakso (keskeytyksetön aika satunnaistamisesta viimeiseen tutkimuskäyntiin) riippumatta hoidon keskeyttämisestä, annoksen pienentämisestä, muun lihavuuslääkityksen aloittamisesta tai lihavuusleikkauksesta.
4 STEP UP ‑tutkimuksen aikana havaitut hoidonaikaiset (pois lukien tiedot ajalta, jolloin tutkittavat eivät saaneet hoitoa eli jolloin vähintään kaksi peräkkäistä annosta oli jäänyt väliin) osuudet potilaista, joiden paino laski vähintään 20 %, olivat semaglutidi 7,2 mg ‑ryhmään satunnaistetuilla 50,9 %, semaglutidi 2,4 mg ‑ryhmään satunnaistetuilla 35,1 % ja lumelääkeryhmään satunnaistetuilla 2,9 %.
5 STEP UP ‑tutkimuksen aikana havaitut hoidonaikaiset osuudet potilaista, joiden paino laski vähintään 25 %, olivat semaglutidi 7,2 mg ‑ryhmään satunnaistetuilla 33,2 %, semaglutidi 2,4 mg ‑ryhmään satunnaistetuilla 16,7 % ja lumelääkeryhmään satunnaistetuilla 0 %.
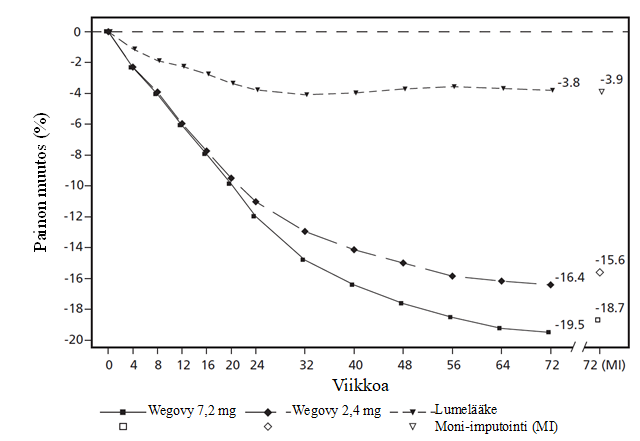
Havaitut arvot kunkin aikataulun mukaisen käynnin suorittaneiden potilaiden osalta ja estimaatit moni-imputaatioineen (MI) palautettujen, tutkimuksen keskeyttäneiden osalta
Kuva 5 STEP UP: Painon keskimuutos (%) viikolta 0 viikolle 72
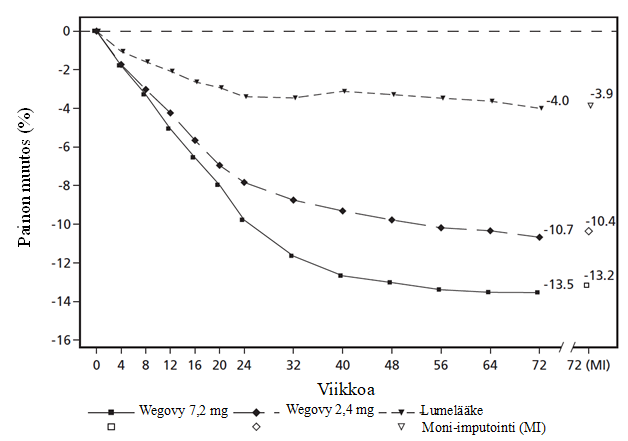
Havaitut arvot kunkin aikataulun mukaisen käynnin suorittaneiden potilaiden osalta ja estimaatit moni-imputaatioineen (MI) palautettujen, tutkimuksen keskeyttäneiden osalta
Kuva 6 STEP UP T2D: Painon keskimuutos (%) viikolta 0 viikolle 72
Sydän- ja verisuonitautien arviointi
SELECT: Kardiovaskulaarisia tuloksia koskeva tutkimus potilailla, joilla oli ylipaino tai lihavuus
SELECT oli satunnaistettu, kaksoissokkoutettu, lumelääkekontrolloitu, tapahtumalähtöinen tutkimus, johon osallistui 17 604 potilasta, joilla oli todettu sydän- ja verisuonitauti ja joiden painoindeksi oli ≥ 27 kg/m2. Potilaat satunnaistettiin saamaan tavanomaisen hoidon lisäksi joko semaglutidia 2,4 mg:n annoksella (n = 8 803) tai lumelääkettä (n = 8 801). Tutkimukseen osallistumisen keston mediaani oli 41,8 kuukautta. Elossaolotiedot olivat saatavilla 99,4 %:sta tutkittavia.
Tutkimuspopulaation potilaista 27,7 % oli naisia ja 72,3 % miehiä. Potilaiden keskimääräinen ikä oli 61,6 vuotta, ja 38,2 % potilaista oli ≥ 65‑vuotiaita (n = 6 728) ja 7,8 % potilaista ≥ 75‑vuotiaita (n = 1 366). Painoindeksin keskiarvo oli 33,3 kg/m2 ja painon keskiarvo 96,7 kg. Tutkimuksesta suljettiin pois potilaat, joilla oli anamneesissa tyypin 1 tai tyypin 2 diabetes.
Ensisijainen päätetapahtuma oli aika satunnaistamisesta ensimmäiseen vakavaan sydän- ja verisuonihaittatapahtumaan (major adverse cardiovascular event, MACE), joka määriteltiin sydän- ja verisuonikuoleman (mukaan lukien määrittämätön kuolinsyy), ei-fataalin sydäninfarktin ja ei-fataalin aivohaverin sisältäväksi yhdistetyksi päätetapahtumaksi. Ensisijainen päätetapahtuma, aika ensimmäiseen MACE-tapahtumaan, ilmeni 1 270 potilaalla SELECT-tutkimukseen osallistuneista 17 604 potilaasta. Tarkemmin sanottuna semaglutidihoitoa saaneilla 8 803 potilaalla ensimmäisiä MACE-tapahtumia kirjattiin 569 (6,5 %:lla potilaista), kun taas lumelääkettä saaneilla 8 801 potilaalla ensimmäisiä MACE-tapahtumia kirjattiin 701 (8,0 %:lla potilaista). Kuolinsyy oli määrittämätön yhteensä 63:ssa (11,1 %:ssa) semaglutidihoitoa saaneilla ja 80:ssä (11,4 %:ssa) lumelääkettä saaneilla ilmenneistä ensimmäisistä MACE-tapahtumista.
2,4 mg:n semaglutidiannoksen paremmuus lumelääkkeeseen verrattuna MACE-tapahtumien suhteen osoitettiin riskisuhteella 0,80 [0,72; 0,90] [95 %:n luottamusväli], joka vastaa MACE-tapahtumien suhteellisen riskin 20 %:n pienenemistä (ks. kuva 7). Kuvassa 8 on esitetty kunkin osatekijän vaikutus MACE-tapahtumien vähenemiseen. Ikä, sukupuoli, rotu, etninen tausta, lähtötilanteessa todettu painoindeksi tai munuaisten toiminnan heikkenemisen taso eivät vaikuttaneet MACE-tapahtumien vähenemiseen 2,4 mg:n semaglutidiannosta saaneessa ryhmässä.
Sydän- ja verisuonikuoleman (ensimmäinen vahvistava toissijainen päätetapahtuma) analyysin perusteella laskettu riskisuhde oli 0,85 [0,71; 1,01] [95 %:n luottamusväli].
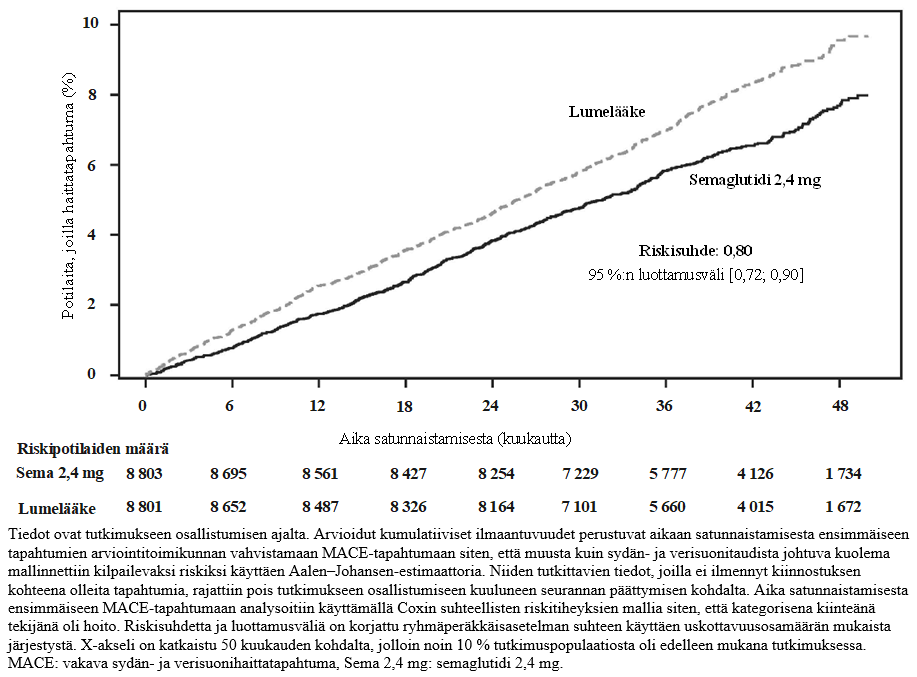
Kuva 7: Aika satunnaistamisesta ensimmäiseen MACE-tapahtumaan – kumulatiivisen ilmaantuvuuden funktiota kuvaava käyrä
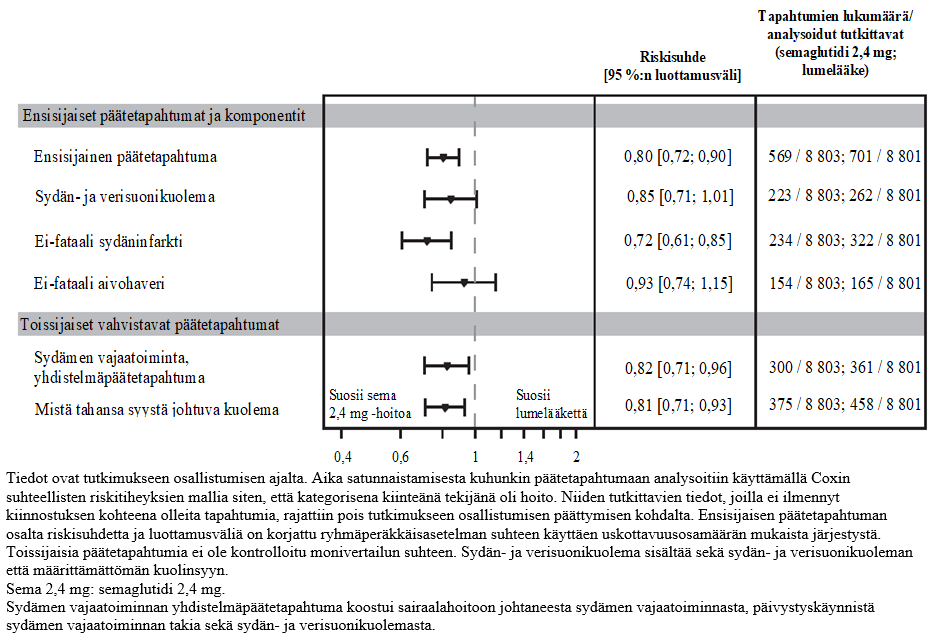
Kuva 8: Metsikkökuvio, joka kuvaa aikaa satunnaistamisesta ensimmäiseen MACE-tapahtumaan, MACE-osatekijöitä ja toissijaisia vahvistavia päätetapahtumia
SUSTAIN 6: Kardiovaskulaarisia tuloksia koskeva tutkimus tyypin 2 diabetesta sairastavilla potilailla
SUSTAIN 6 -tutkimuksessa 3 297 potilasta, joiden tyypin 2 diabetes on riittämättömästi hallinnassa ja joilla oli suuri sydän- ja verisuonitapahtumien riski, satunnaistettiin saamaan perushoidon lisäksi kerran viikossa ihon alle 0,5 mg tai 1 mg semaglutidia, tai lumelääkettä. Hoidon kesto oli 104 viikkoa. Potilaiden keskimääräinen ikä oli 65 vuotta ja keskimääräinen painoindeksi 33 kg/m2.
Ensisijainen päätetapahtuma oli aika satunnaistamisesta ensimmäiseen vakavaan sydän- ja verisuonihaittatapahtumaan (MACE): sydän- ja verisuonikuolemaan, ei-fataaliin sydäninfarktiin tai ei-fataaliin aivohaveriin. MACE-päätetapahtumien kokonaismäärä oli 254, joista 108 (6,6 %) oli semaglutidia saaneilla ja 146 (8,9 %) lumelääkettä saaneilla potilailla.
Semaglutidihoidon (0,5 mg tai 1 mg) kardiovaskulaarinen turvallisuus vahvistettiin, sillä semaglutidin riskisuhde (HR) lumelääkkeeseen verrattuna oli 0,74, [0,58; 0,95] [95 %:n luottamusväli]. Tämä johtuu ei-fataalien aivohaverien ja ei-fataalien sydäninfarktien vähenemisestä ilman eroa sydän- ja verisuonikuolemissa (ks. kuva 9).
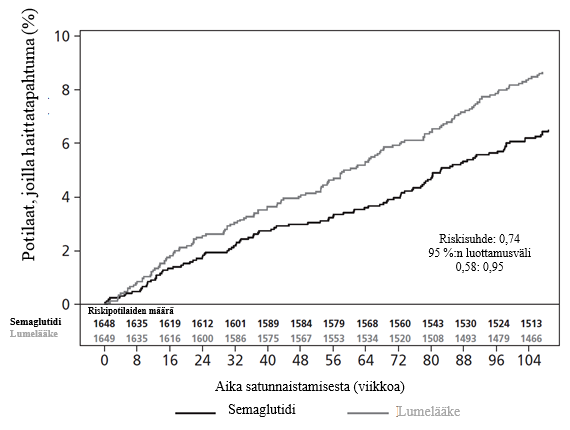
Kuva 9. Kaplan-Meier-kuvaaja: aika ensimmäiseen yhdistettyyn päätetapahtumaan: sydän- ja verisuonikuolema, ei-fataali sydäninfarkti tai ei-fataali aivohaveri (SUSTAIN 6)
STEP-HFpEF ja STEP-HFpEF-DM: Toiminnallisia lopputuloksia koskevat tutkimukset potilailla, joilla oli sydämen vajaatoiminta ja säilynyt ejektiofraktio ja joista osalla oli tyypin 2 diabetes
Kahdessa 52 viikon pituisessa kaksoissokkoutetussa kliinisessä tutkimuksessa 529 potilasta, joilla oli lihavuuteen liittyvä sydämen vajaatoiminta ja säilynyt ejektiofraktio (STEP-HFpEF), ja 616 potilasta, joilla oli lihavuuteen liittyvä sydämen vajaatoiminta ja säilynyt ejektiofraktio sekä tyypin 2 diabetes (STEP-HFpEF-DM), satunnaistettiin saamaan tavanomaisen hoidon lisäksi kerran viikossa joko semaglutidia 2,4 mg:n annoksella tai lumelääkettä.
Semaglutidia arvioineissa HFpEF-tutkimuksissa NYHA (New York Heart Association) -luokkaan II luokiteltiin lähtötilanteessa 66,2 % STEP-HFpEF-tutkimuksen potilaista ja 70,6 % STEP-HFpEF-DM-tutkimuksen potilaista, NYHA-luokkaan III 33,6 % STEP-HFpEF-tutkimuksen potilaista ja 29,2 % STEP-HFpEF-DM-tutkimuksen potilaista sekä NYHA-luokkaan IV 0,2 % STEP-HFpEF-tutkimuksen potilaista ja 0,2 % STEP-HFpEF-DM-tutkimuksen potilaista. Iän keskiarvo oli 68 vuotta kummassakin tutkimuksessa, vasemman kammion ejektiofraktion (LVEF) mediaani oli STEP-HFpEF-tutkimuksessa 57,0 % ja STEP-HFpEF-DM-tutkimuksessa 56,0 % ja painoindeksin keskiarvo oli STEP-HFpEF-tutkimuksessa 38,5 kg/m2 ja STEP-HFpEF-DM-tutkimuksessa 37,9 kg/m2. STEP-HFpEF-tutkimuksen osallistujista 56,1 % oli naisia, kun taas STEP-HFpEF-DM-tutkimuksessa naisia oli 44,3 %. Suuri osa potilaista sai sydän- ja verisuonitautilääkkeitä. Näistä noin 81 % sai diureetteja, noin 81 % beetasalpaajia, noin 34 % angiotensiinikonvertaasin (ACE:n) estäjiä ja noin 45 % angiotensiinireseptorin salpaajia.
STEP-HFpEF-DM-tutkimuksessa potilaat saivat myös tavanomaista glukoosipitoisuutta pienentävää lääkehoitoa. Näistä 32,8 % sai natriumin- ja glukoosinkuljettajaproteiini 2:n estäjää (SGLT-2:n estäjää) ja 20,8 % insuliinia.
2,4 mg:n annoksella käytetyn semaglutidin hoitovaikutusta sydämen vajaatoiminnan oireisiin arvioitiin Kansas City Cardiomyopathy Questionnaire ‑kyselylomakkeen Clinical Summary Score pisteytyksellä (KCCQ-CSS), joka käsittää oireisiin (esiintymistiheyteen ja kuormittavuuteen) liittyvän osion ja fyysisen toimintakyvyn rajoittumiseen liittyvän osion. Pistemäärien vaihteluväli on 0–100, jossa suurempi pistemäärä tarkoittaa parempaa terveydentilaa. 2,4 mg:n annoksella käytetyn semaglutidin hoitovaikutusta 6 minuutin kävelymatkaan (6MWD) arvioitiin 6 minuutin kävelytestillä (6MWT). KCCQ-CSS- ja 6MWD-tulosten lähtöarvojen perusteella tutkittava populaatio oli erittäin oireista.
Kummassakin tutkimuksessa 2,4 mg:n semaglutidiannosten vaikutus sekä KCCQ-CSS- että 6-MWD-tuloksiin oli parempi kuin lumelääkkeen (taulukko 12). Sekä sydämen vajaatoiminnan oireisiin että fyysiseen toimintakykyyn liittyviä hyötyjä havaittiin.
Taulukko 12 6MWD-kävelymatkaan, KCCQ-CSS-pistemäärään ja painoon liittyvät tulokset kahdessa 52 viikon pituisessa satunnaistetussa tutkimuksessa (STEP-HFpEF ja STEP-HFpEF-DM)
| STEP-HFpEF | STEP-HFpEF-DM | |||
| Semaglutidi 2,4 mg | Lumelääke | Semaglutidi 2,4 mg | Lumelääke | |
| Koko analyysijoukko (N) | 263 | 266 | 310 | 306 |
| KCCQ-CSS (pistemäärä) | ||||
| Lähtötaso (keskiarvo)1 | 57,9 | 55,5 | 58,8 | 56,4 |
| Muutos lähtötasosta2 | 16,6 | 8,7 | 13,7 | 6,4 |
Ero lumelääkkeeseen verrattuna2 [95 %:n luottamusväli] | 7,8 [4,8; 10,9] | 7,3 [4,1; 10,4] | ||
| Potilaat (%), joilla merkityksellinen muutos3 | 43,2 | 32,5 | 42,7 | 30,5 |
| 6MWD (metriä) | ||||
| Lähtötaso (keskiarvo)1 | 319,6 | 314,6 | 279,7 | 276,7 |
| Muutos lähtötasosta2 | 21,5 | 1,2 | 12,7 | -1,6 |
Ero lumelääkkeeseen verrattuna2 [95 %:n luottamusväli] | 20,3 [8,6; 32,1] | 14,3 [3,7; 24,9] | ||
| Potilaat (%), joilla merkityksellinen muutos4 | 47,9 | 34,7 | 43,8 | 30,6 |
| Paino | ||||
| Lähtötaso (kg)1 | 108,3 | 108,4 | 106,4 | 105,2 |
| Muutos lähtötasosta (%)2 | -13,3 | -2,6 | -9,8 | -3,4 |
| Ero (%) lumelääkkeeseen verrattuna2 [95 %:n luottamusväli] | -10,7 [-11,9; -9,4] | -6,4 [-7,6; -5,2] | ||
1Havaittu keskiarvo.
2 Arvioitu käyttäen ANCOVA-mallia, jossa on käytetty moni-imputointia (KCCQ- ja 6MWD-tulosten osalta myös useita imputointitapoja [composite imputation]). Malli perustuu kaikkiin tietoihin riippumatta satunnaistetun hoidon keskeyttämisestä, muun lihavuuslääkityksen aloittamisesta tai lihavuusleikkauksesta.
3 Merkityksellinen potilaskohtaisen muutoksen kynnysarvon ollessa STEP-HFpEF-tutkimuksessa 17,2 pistettä ja STEP-HFpEF-DM-tutkimuksessa 16,3 pistettä (arvot on saatu ankkurimenetelmällä [anchor-based method], joka perustuu yhden luokan paranemiseen PGI-S-mittarilla [tutkittavan yleisarvio terveydentilastaan]). Prosenttiosuudet perustuvat niihin tutkittaviin, joilta on käynnin kohdalla saatavilla havainto.
4 Merkityksellinen potilaskohtaisen muutoksen kynnysarvon ollessa STEP-HFpEF-tutkimuksessa 22,1 metriä ja STEP-HFpEF-DM-tutkimuksessa 25,6 metriä (arvot on saatu ankkurimenetelmällä [anchor-based method], jossa tutkittavan yleisarvio muutoksesta [PGI-C] oli ”kohtalaisesti parempi”). Prosenttiosuudet perustuvat niihin tutkittaviin, joilta on käynnin kohdalla saatavilla havainto.
Semaglutidihoidolla saavutettu etu lumelääkkeeseen verrattuna oli johdonmukainen kaikissa alaryhmissä, jotka määriteltiin iän, sukupuolen, painoindeksin, rodun, etnisen taustan, maantieteellisen alueen, systolisen verenpaineen, vasemman kammion ejektiofraktion ja muun samanaikaisen sydämen vajaatoiminnan hoidon mukaan.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt lykkäyksen velvoitteelle toimittaa tutkimustulokset Wegovy-valmisteen käytöstä painonhallinnan hoidossa yhdessä tai useammassa pediatrisessa potilasryhmässä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
STEP TEENS: Painonhallinta nuorilla potilailla
68 viikon pituisessa kaksoissokkoutetussa tutkimuksessa 201 puberteetti-ikäistä 12 – < 18-vuotiasta nuorta, joilla oli lihavuus tai ylipaino ja vähintään yksi painoon liittyvä sairaus, satunnaistettiin suhteessa 2:1 saamaan semaglutidia tai lumelääkettä. Kaikki potilaat noudattivat vähäkalorista ruokavaliota ja olivat fyysisesti aktiivisempia koko tutkimuksen ajan.
Hoidon lopussa (viikolla 68) painoindeksi oli parantunut semaglutidilla enemmän ja kliinisesti merkittävästi lumelääkkeeseen verrattuna (ks. taulukko 13 ja kuva 10). Lisäksi suurempi osa semaglutidia saaneista potilaista saavutti ≥ 5 %:n, 10 %:n ja ≥ 15 %:n painon laskun kuin lumelääkettä saaneista (ks. taulukko 13).
Taulukko 13 STEP TEENS: Tulokset viikon 68 kohdalla
| Semaglutidi 2,4 mg | Placebo | |
| Koko analyysijoukko (N) | 134 | 67 |
| Painoindeksi | ||
| Lähtötaso (BMI) | 37,7 | 35,7 |
| Muutos (%) lähtötasosta1,2 | ‑16,1 | 0,6 |
| Ero (%) lumelääkkeeseen verrattuna1 [95 %:n luottamusväli] | ‑16,7 [‑20,3; ‑13,2]* | - |
| Lähtötaso (BMI-SDS) | 3,4 | 3,1 |
| BMI-SDS:n muutos lähtötasosta1 | ‑1,1 | ‑0,1 |
| Ero lumelääkkeeseen verrattuna1 [95 %:n luottamusväli] | ‑1,0 [‑1,3; ‑0,8] | - |
| Paino | ||
| Lähtötaso (kg) | 109,9 | 102,6 |
| Muutos (%) lähtötasosta1 | ‑14,7 | 2,8 |
| Ero (%) lumelääkkeeseen verrattuna1 [95 %:n luottamusväli] | ‑17,4 [‑21,1; ‑13,8] | - |
| Muutos (kg) lähtötasosta1 | ‑15,3 | 2,4 |
| Ero (kg) lumelääkkeeseen verrattuna1 [95 %:n luottamusväli] | ‑17,7 [‑21,8; ‑13,7] | - |
| Potilaat (%), jotka saavuttivat ≥ 5 %:n painon laskun3 | 72,5* | 17,7 |
| Potilaat (%), jotka saavuttivat ≥ 10 %:n painon laskun3 | 61,8 | 8,1 |
| Potilaat (%), jotka saavuttivat ≥ 15 %:n painon laskun3 | 53,4 | 4,8 |
| Vyötärön ympärysmitta (cm) | ||
| Lähtötaso | 111,9 | 107,3 |
| Muutos lähtötasosta1 | ‑12,7 | ‑0,6 |
| Ero lumelääkkeeseen verrattuna1 [95 %:n luottamusväli] | ‑12,1 [‑15,6; ‑8,7] | - |
| Systolinen verenpaine (mmHg) | ||
| Lähtötaso | 120 | 120 |
| Muutos lähtötasosta1 | ‑2,7 | ‑0,8 |
| Ero lumelääkkeeseen verrattuna1 [95 %:n luottamusväli] | ‑1,9 [‑5,0; 1,1] | - |
* p < 0,0001 (korjaamaton kaksipuolinen) paremmuuden osalta. 1 Arvioitu käyttäen ANCOVA-mallia, jossa on käytetty moni-imputointia. Malli perustuu kaikkiin tietoihin riippumatta satunnaistetun hoidon keskeyttämisestä, muun lihavuuslääkityksen aloittamisesta tai lihavuusleikkauksesta.
2 Tutkimuksen aikana satunnaistettu hoito lopetettiin pysyvästi 10,4 %:lla 2,4 mg semaglutidia saamaan satunnaistetuista potilaista ja 10,4 %:lla lumelääkeryhmään satunnaistetuista potilaista. Olettaen, että kaikki satunnaistetut potilaat jatkoivat hoitoa eivätkä saaneet muita lihavuuteen tarkoitettuja hoitoja, arvioidut painoindeksin muutokset satunnaistamisesta viikolle 68 olivat semaglutidi 2,4 mg:lle -17,9 % ja lumelääkkeelle 0,6 %. Arviot perustuvat toistomittausten sekamalliin sisältäen kaikki havainnot ensimmäiseen keskeyttämiseen asti.
3 Arvioitu logistisesta regressiomallista perustuen samaan imputointimenettelyyn kuin ensisijaisessa analyysissä.
Kuva 10. STEP TEENS: Painoindeksin keskimääräinen muutos (%) lähtötasosta viikkoon 68
Farmakokinetiikka
Luonnolliseen GLP-1:een verrattuna semaglutidin puoliintumisaika on pitkä (noin 1 viikko), minkä vuoksi semaglutidi sopii annettavaksi ihon alle kerran viikossa. Pääasiallinen puoliintumisaikaa pidentävä mekanismi on sitoutuminen albumiiniin, mikä pienentää yhdisteen munuaispuhdistumaa ja suojaa sitä metaboliselta hajoamiselta. Lisäksi semaglutidi on stabiili DPP-4-entsyymin hajotusvaikutusta vastaan.
Imeytyminen
Keskimääräinen semaglutidin vakaan tilan pitoisuus semaglutidin 2,4 mg:n ylläpitoannoksen jälkeen oli noin 75 nmol/l ja semaglutidin 7,2 mg:n ylläpitoannoksen jälkeen noin 236 nmol/l potilailla, joilla oli ylipaino (painoindeksi välillä ≥ 27 kg/m2 ja < 30 kg/m2) tai lihavuus (painoindeksi ≥ 30 kg/m2). Tiedot perustuvat faasin 3 tutkimuksiin, joissa 90 %:lla potilaista keskimääräiset pitoisuudet olivat 2,4 mg:n ylläpitoannoksen jälkeen 51–110 nmol/l ja 7,2 mg:n ylläpitoannoksen jälkeen 164–332 nmol/l. Semaglutidin vakaan tilan altistus lisääntyi suoraan verrannollisesti annoksen kanssa, joka oli 0,25–7,2 mg kerran viikossa. Vakaan tilan altistus oli vakaa ajan suhteen viikkoon 72 asti arvioituna. Altistus oli samaa luokkaa riippumatta siitä, annettiinko semaglutidi vatsan, reiden vai olkavarren ihon alle. Semaglutidin absoluuttinen biologinen hyötyosuus oli 89 %.
Jakautuminen
Ihon alle annetun semaglutidin keskimääräinen jakautumistilavuus tyypin 2 diabetespotilailla oli noin 12,4 l. Semaglutidi sitoutuu suuressa määrin plasman albumiiniin (> 99 %).
Metabolia/biotransformaatio
Ennen elimistöstä poistumista semaglutidi metaboloituu suuressa määrin peptidirungon proteolyyttisen pilkkoutumisen ja rasvahapposivuketjun sekventiaalisen beetaoksidaation kautta. Neutraali endopeptidaasi (NEP) -entsyymi tunnistettiin yhdeksi aktiivisista metaboloivista entsyymeistä.
Eliminaatio
Semaglutidiaines erittyy ensisijaisesti virtsan ja ulosteiden kautta. Noin 3 % annoksesta erittyi virtsaan muuttumattomana semaglutidina.
Semaglutidin puhdistuma potilailla, joilla oli ylipaino (painoindeksi ≥ 27 kg/m2 – < 30 kg/m2) tai lihavuus (painoindeksi ≥ 30 kg/m2), oli noin 0,05 l/h. Semaglutidin eliminaation puoliintumisaika on noin 1 viikko, joten sitä on verenkierrossa noin 7 viikon ajan viimeisen 2,4 mg:n annoksen jälkeen.
Erityisryhmät
Iäkkäät
Faasin 3 tutkimukset, joihin osallistui 18–86-vuotiaita potilaita, osoittivat, että ikä ei vaikuta semaglutidin farmakokinetiikkaan.
Sukupuoli, rotu ja etninen tausta
Sukupuoli, rotu (valkoihoinen, mustaihoinen tai afroamerikkalainen, aasialainen) ja etninen tausta (espanjalaistaustainen tai latinalaisamerikkalainen; ei-espanjalaistaustainen tai ei-latinalaisamerikkalainen) eivät vaikuttaneet semaglutidin farmakokinetiikkaan faasin 3a tutkimuksista peräisin olevien tietojen perusteella.
Paino
Paino vaikuttaa semaglutidialtistukseen. Suurempi paino pienentää altistusta; 20 %:n ero yksilöllisissä painoissa aiheuttaa noin 18 %:n eron altistuksessa. Kliinisissä tutkimuksissa arvioitujen altistusvasteiden perusteella viikoittaiset 2,4 mg:n ja 7,2 mg:n semaglutidiannokset tuottivat riittävän systeemisen altistuksen 54,4–251,2 kg:n painoalueella.
Munuaisten vajaatoiminta
Munuaisten vajaatoiminta ei vaikuttanut semaglutidin farmakokinetiikkaan kliinisesti merkittävässä määrin. Tämä osoitettiin antamalla 0,5 mg:n kerta-annos semaglutidia eriasteista munuaisten vajaatoimintaa (lievä, keskivaikea, vaikea tai dialyysiä vaativa) sairastaville potilaille ja vertaamalla tuloksia potilaisiin, joiden munuaiset toimivat normaalisti. Tämä osoitettiin myös potilailla, joilla oli ylipaino (painoindeksi ≥ 27 kg/m2 – < 30 kg/m2) tai lihavuus (painoindeksi ≥ 30 kg/m2) ja lievää tai keskivaikeaa munuaisten vajaatoimintaa faasin 3a tutkimuksista saatujen tietojen perusteella.
Maksan vajaatoiminta
Maksan vajaatoiminta ei vaikuttanut semaglutidialtistukseen millään tavalla. Semaglutidin farmakokinetiikkaa arvioitiin tutkimuksessa, jossa eriasteista maksan vajaatoimintaa (lievä, keskivaikea, vaikea) sairastaville potilaille annettiin 0,5 mg:n kerta-annos semaglutidia, ja tuloksia verrattiin potilaisiin, joiden maksa toimi normaalisti.
Esidiabetes ja diabetes
Faasin 3 tutkimuksista saatujen tietojen perusteella prediabeteksella ja diabeteksella ei ollut kliinisesti merkittävää vaikutusta semaglutidialtistukseen.
Immunogeenisuus
Semaglutidilla toteutetun hoidon yhteydessä ilmeni vain satunnaisesti semaglutidivasta-aineiden kehittymistä (ks. kohta Haittavaikutukset), eikä tämä vaste näyttänyt vaikuttavan semaglutidin farmakokinetiikkaan.
Pediatriset potilaat
Semaglutidin farmakokineettisiä ominaisuuksia arvioitiin kliinisessä tutkimuksessa 12 – < 18‑vuotiailla nuorilla potilailla, joilla oli lihavuus tai ylipaino ja vähintään yksi painoon liittyvä sairaus (124 potilasta, paino 61,1–211,9 kg). Semaglutidialtistus oli nuorilla vastaavanlainen kuin aikuisilla, joilla oli lihavuus tai ylipaino.
Semaglutidin turvallisuutta ja tehoa alle 12-vuotiaiden lasten hoidossa ei ole tutkittu.
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta tai genotoksisuutta koskevien konventionaalisten tutkimusten prekliiniset tulokset eivät viittaa erityiseen vaaraan ihmisille.
Jyrsijöillä todetut ei-letaalit kilpirauhasen C-solukasvaimet ovat GLP-1-reseptoriagonistien luokkavaikutus. Rotilla ja hiirillä tehdyissä, 2 vuotta kestäneissä karsinogeenisuustutkimuksissa kliinisesti merkityksellinen semaglutidialtistus aiheutti kilpirauhasen C-solukasvaimia. Muita hoitoon liittyviä kasvaimia ei havaittu. Jyrsijöiden C-solukasvaimet aiheutuivat ei-genotoksisella, erityisellä GLP-1-reseptorivälitteisellä mekanismilla, jolle jyrsijät ovat erityisen herkkiä. Havainnon merkityksen ihmiselle katsotaan olevan pieni, mutta sitä ei täysin voida jättää huomiotta.
Rotilla tehdyissä hedelmällisyystutkimuksissa semaglutidi ei vaikuttanut parittelukäyttäytymiseen eikä urosrottien hedelmällisyyteen. Naarasrottien kiimakierron havaittiin pidentyvän ja keltarauhasten (ovulaatioiden) lukumäärän hieman pienentyvän käytettäessä annoksia, joihin liittyi emon painon laskua.
Rotilla tehdyissä alkion- ja sikiönkehitystä koskeneissa tutkimuksissa semaglutidi aiheutti alkiotoksisuutta, kun sitä annettiin kliinisesti merkityksellistä altistusta pienempinä annoksina. Semaglutidi aiheutti emoille huomattavaa painon laskua ja heikensi alkioiden eloonjäämistä ja kasvua. Sikiöillä todettiin merkittäviä luuston ja sisäelinten epämuodostumia, mukaan lukien pitkiin luihin, kylkiluihin, nikamiin, häntään, verisuoniin ja aivokammioihin kohdistuneita vaikutuksia. Mekanistiset arvioinnit viittasivat siihen, että alkiotoksisuuteen vaikutti GLP-1-reseptorivälitteinen häiriö ravinteiden kulkeutumisessa ruskuaispussin kautta rotan sikiöille. Ruskuaispussin anatomiassa ja toiminnassa on lajikohtaisia eroja, eikä GLP-1-reseptori ilmenny muiden kädellisten ruskuaispussissa, joten pidetään epätodennäköisenä, että tällä mekanismilla olisi merkitystä ihmisille. Semaglutidin suoraa vaikutusta sikiöön ei kuitenkaan voida poissulkea.
Kaneilla ja cynomolgus-apinoilla tehdyissä kehitystoksisuustutkimuksissa kliinisesti merkityksellisen altistuksen todettiin aiheuttavan keskenmenojen lisääntymistä ja sikiöpoikkeavuuksien ilmaantuvuuden lievää nousua. Löydökset olivat yhteydessä emoihin, joilla esiintyi huomattavaa painon laskua (jopa 16 %). Ei ole tiedossa, liittyvätkö nämä vaikutukset emon vähentyneeseen ruoankulutukseen, joka on suora GLP-1-vaikutus.
Syntymänjälkeistä kasvua ja kehitystä arvioitiin cynomolgus-apinoilla. Poikaset olivat syntyessään hieman pienempiä, mutta kasvu tasoittui imetyksen aikana.
Nuorilla rotilla semaglutidi aiheutti sukupuolisen kypsymisen viivästymistä sekä uroksilla että naarailla. Tämä viive ei vaikuttanut kummankaan sukupuolen hedelmällisyyteen tai lisääntymiskapasiteettiin eikä aiheuttanut naarasrotille keskenmenoja.
Farmaseuttiset tiedot
Apuaineet
Esitäytetty kynä, FlexTouch
Dinatriumfosfaattidihydraatti
Propyleeniglykoli
Fenoli
Kloorivetyhappo (pH:n säätöön)
Natriumhydroksidi (pH:n säätöön)
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
Esitäytetty kynä, FlexTouch
Wegovy 0,25 mg FlexTouch injektioneste, liuos, esitäytetty kynä
Ennen käyttöä: 2 vuotta.
Ensimmäisen käytön jälkeen: 6 viikkoa. Säilytä alle 30 °C:n lämpötilassa tai jääkaapissa (2 °C‒8 °C).
Wegovy 0,5 mg FlexTouch injektioneste, liuos, esitäytetty kynä
Wegovy 1 mg FlexTouch injektioneste, liuos, esitäytetty kynä
Wegovy 1,7 mg FlexTouch injektioneste, liuos, esitäytetty kynä
Wegovy 2,4 mg FlexTouch injektioneste, liuos, esitäytetty kynä
Ennen käyttöä: 3 vuotta.
Ensimmäisen käytön jälkeen: 6 viikkoa. Säilytä alle 30 °C:n lämpötilassa tai jääkaapissa (2 °C‒8 °C).
Säilytys
Säilytä jääkaapissa (2 °C–8 °C). Älä säilytä lähellä jääkaapin kylmälevyä.
Ei saa jäätyä.
Esitäytetty kynä, FlexTouch
Pidä kynän suojus paikoillaan, kun et käytä kynää. Herkkä valolle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
WEGOVY FLEXTOUCH injektioneste, liuos, esitäytetty kynä
0,25 mg (L:ei) 1,5 ml (4x0,25 mg annos) (178,91 €)
0,5 mg (L:ei) 1,5 ml (4x0,5 mg annos) (178,91 €)
1 mg (L:ei) 3 ml (4x1 mg annos) (178,91 €)
1,7 mg (L:ei) 3 ml (4x1,7 mg annos) (259,71 €)
2,4 mg (L:ei) 3 ml (4x2,4 mg annos) (285,36 €)
PF-selosteen tieto
Esitäytetty kynä, FlexTouch (0,25, 0,5 mg) 1,5 ml:n esitäytetty kynä
1,5 ml:n sylinteriampulli (tyypin I lasia) on suljettu toisesta päästä kumisella männällä (klooributyyliä) ja toisesta päästä alumiinikorkilla, jossa on laminoitu kumisuljin (bromobutyyliä/polyisopreenia). Sylinteriampulli on esitäytetyssä, kertakäyttöisessä, polypropeenista, polyoksimetyleenistä, polykarbonaatista ja akrylonitriilibutadieenistyreenistä valmistetussa kynässä.
Esitäytetty kynä, FlexTouch (0,5, 1, 1,7 ja 2,4 mg) 3 ml:n esitäytetty kynä
3 ml:n sylinteriampulli (tyypin I lasia) on suljettu toisesta päästä kumisella männällä (klooributyyliä) ja toisesta päästä alumiinikorkilla, jossa on laminoitu kumisuljin (bromobutyyliä/polyisopreenia). Sylinteriampulli on esitäytetyssä, kertakäyttöisessä, polypropeenista, polyoksimetyleenistä, polykarbonaatista ja akrylonitriilibutadieenistyreenistä valmistetussa kynässä.
Pakkauskoot
Esitäytetty kynä, FlexTouch (0,25, 0,5, 1, ja 1,7 mg)
Pakkauskoko 1 esitäytetty kynä ja 4 kertakäyttöistä NovoFine Plus -neulaa.
Esitäytetty kynä, FlexTouch (2,4 mg)
Pakkauskoot:
1 esitäytetty kynä ja 4 kertakäyttöistä NovoFine Plus -neulaa.
3 esitäytettyä kynää ja 12 kertakäyttöistä NovoFine Plus -neulaa.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Kirkas ja väritön isotoninen liuos, pH = 7,4.
Käyttö- ja käsittelyohjeet
Wegovy-valmistetta ei saa käyttää, jos se ei ole kirkasta ja väritöntä.
Jäätynyttä kynää ei saa käyttää.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Esitäytetty kynä, FlexTouch
Tämä on moniannoskynä. Se sisältää 4 annosta. Neljän annoksen pistämisen jälkeen kynään voi jäädä liuosta jäljelle, vaikka lääke olisikin annosteltu oikein. Jäljellä oleva liuos ei riitä yhteen annokseen ja kynä on hävitettävä.
Potilaita tulee neuvoa hävittämään injektioneula paikallisten vaatimusten mukaisesti jokaisen pistoksen jälkeen ja säilyttämään Wegovy-kynä ilman injektioneulaa. Näin voidaan ehkäistä neulojen tukkeutuminen, kontaminoituminen, infektiot, liuoksen vuotaminen ja epätarkka annostus.
Kynä on tarkoitettu vain henkilökohtaiseen käyttöön.
Wegovy-valmistetta voidaan antaa 30G, 31G ja 32G kertakäyttöisillä, enintään 8 mm:n pituisilla neuloilla.
Korvattavuus
WEGOVY FLEXTOUCH injektioneste, liuos, esitäytetty kynä
0,25 mg 1,5 ml
0,5 mg 1,5 ml
1 mg 3 ml
1,7 mg 3 ml
2,4 mg 3 ml
- Ei korvausta.
ATC-koodi
A10BJ06
Valmisteyhteenvedon muuttamispäivämäärä
16.02.2026
Yhteystiedot
 NOVO NORDISK FARMA OY
NOVO NORDISK FARMA OY Linnoitustie 6
02600 Espoo
020 762 5300
www.novonordisk.fi
