RELFYDESS injektioneste, liuos 100 U/ml
Huomioitavaa

Tähän lääkevalmisteeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti turvallisuutta koskevaa uutta tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä lääkkeen haittavaikutuksista. Ks. kohdasta Haittavaikutukset, miten haittavaikutuksista ilmoitetaan.
Vaikuttavat aineet ja niiden määrät
100 yksikköä/ml Clostridium botulinum ‑bakteerin tuottamaa tyypin A botuliinitoksiinia, joka ei sisällä kompleksoivia proteiineja.
Vahvuutta kuvaavat yksiköt ovat spesifisiä Relfydess-valmisteelle, eivätkä ne vastaa muiden botuliinitoksiinivalmisteiden yksikköjä.
Yksi injektiopullo sisältää 150 yksikköä 1,5 ml:ssa liuosta.
Apuaine, jonka vaikutus tunnetaan
Yksi millilitra liuosta sisältää 1,1 mg polysorbaattia 80.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, liuos (injektioneste).
Kliiniset tiedot
Käyttöaiheet
Relfydess on tarkoitettu ulkonäön seuraavien osa-alueiden tilapäiseen parantamiseen:
- otsan voimakkaan rypistyksen seurauksena kulmakarvojen väliin syntyvät keskisyvät tai syvät otsan pystyjuonteet
- leveimmän hymyn seurauksena ulompiin silmäkulmiin syntyvät keskisyvät tai syvät juonteet.
Valmistetta käytetään toiseen tai molempiin näistä käyttöaiheista alle 65-vuotiaille aikuisille potilaille, kun juonteiden syvyydellä on huomattava psykologinen vaikutus potilaaseen.
Annostus ja antotapa
Hoitokertoja saa olla enintään kerran kahdessatoista viikossa.
Tämän valmisteen tehoa ja turvallisuutta toistuvassa annostelussa ei ole tutkittu pidempään kuin 52 viikon ajan.
Jos muita botuliinitoksiinivalmisteita parhaillaan käytetään tai on käytetty niiden muihin käyttöaiheisiin, kumulatiivinen annos on otettava huomioon.
Annostus
Vahvuutta kuvaavat yksiköt ovat spesifisiä Relfydess-valmisteelle, eivätkä ne vastaa muiden botuliinitoksiinivalmisteiden yksikköjä.
Relfydess on käyttövalmis valmiste, jonka pitoisuus on 10 yksikköä per 0,1 ml. Käyttökuntoon saattaminen ei ole tarpeen.
Taulukko 1: Relfydess-valmisteen annostusohjeet
| Hoito | Suositeltu kokonaisannos | Annos per pistos |
| Otsan pystyjuonteiden hoito | 50 yksikköä (0,5 ml) | 5 pistosta; 1 pistos = 10 yksikköä (0,1 ml): 2 pistosta rypistäjälihaksen (corrugator) kummallekin puolelle ja 1 pistos nirsolihakseen (procerus) lähelle nenän ja otsan väliin jäävää aluetta (ks. kuva 1) |
| Ulompien silmäkulmien juonteiden hoito | 60 yksikköä (0,6 ml) | 6 pistosta; 1 pistos = 10 yksikköä (0,1 ml): 3 pistosta silmän kehälihaksen (orbicularis oculi) kummallekin puolelle (ks. kuva 2) |
| Otsan pystyjuonteiden ja ulompien silmäkulmien juonteiden samanaikainen hoito | 110 yksikköä (1,1 ml) | Yhteensä 11 pistosta otsan pystyjuonteiden ja ulompien silmäkulmien juonteiden samanaikaiseen hoitoon; 1 pistos = 10 yksikköä (0,1 ml) |
Yleistä tietoa
Jos hoito epäonnistuu tai hoidon teho heikkenee toistuvien pistosten jälkeen, on käytettävä vaihtoehtoisia hoitomenetelmiä. Jos hoitotulos ei ole onnistunut ensimmäisen hoitokerran jälkeen, voidaan harkita seuraavia toimenpiteitä:
- hoidon epäonnistumiseen johtaneiden syiden (esim. pistoksen pistäminen vääriin lihaksiin, virheellinen pistostekniikka ja toksiinia neutraloivien vasta-aineiden muodostuminen) analysointi
- tyypin A botuliinitoksiinihoidon tarpeen uudelleenarviointi.
Pediatriset potilaat
Relfydess-valmisteen tehoa ja turvallisuutta alle 18 vuoden ikäisten lasten hoidossa ei ole varmistettu.
Relfydess-valmisteen käyttöä alle 18 vuoden ikäisille potilaille ei suositella.
Iäkkäät potilaat
Relfydess-valmisteen käytöstä 65-vuotiaille ja sitä vanhemmille potilaille on vain vähän tietoa vaiheen 3 kliinisistä tutkimuksista.
Antotapa
Relfydess-hoitoa saavat antaa vain lääkärit, joilla on tähän hoitoon ja tarvittavien välineiden käyttöön vaadittava pätevyys ja perehtyneisyys. Annossa on noudatettava kansallisia ohjeita ja lakeja.
Lihakseen.
Annostus ja hoitovälit määräytyvät yksittäisen potilaan arvioidun vasteen mukaan, mutta enimmäisannoksia ei saa ylittää ja hoitokertojen välillä on oltava vähintään 12 viikkoa.
Kutakin injektiopulloa saa käyttää vain yhdelle potilaalle yhden hoitokerran aikana. Hoidon jälkeen käyttämättä jäänyt lääkevalmiste on hävitettävä.
Risti-infektioiden ehkäisemiseksi on noudatettava aseptista tekniikkaa ja tavanomaisia hoitokäytäntöjä. Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet injektiopullojen käsittelyyn ja hävittämiseen.
Vaikutuksen alkamiseen kuluvan ajan mediaani on 2–3 päivää, ja osa potilaista on raportoinut vaikutuksen alkaneen yhden päivän kuluessa. Hoidon tehon kestoksi on osoitettu 6 kuukautta, ja enintään 75 %:lla potilaista tilanne ei palaa lähtötilanteeseen.
Otsan pystyjuonteet
Aikuisille suositeltu annos otsan pystyjuonteiden hoitoon on yhteensä 50 yksikköä (0,5 ml). Annos annetaan viitenä samansuuruisena pistoksena (10 yksikköä eli 0,1 ml per pistos) lihakseen viiteen eri pistoskohtaan (ks. kuva 1): 2 pistosta rypistäjälihaksen (corrugator) kummallekin puolelle ja 1 pistos nirsolihakseen (procerus) lähelle nenän ja otsan väliin jäävää aluetta. Anatominen rakenne voi olla helpompi tunnistaa käsin tunnustelemalla, kun potilas rypistää otsaansa maksimaalisesti. Ennen pistosta ja sen aikana aseta peukalosi tai etusormesi tukevasti silmäkuopan reunan alapuolelle, jotta valmistetta ei vuoda silmäkuopan reunan alapuolelle. Neulan viisteen pitää osoittaa pistoksen aikana ylös ja mediaalisuuntaan.
Riippuluomen riskin pienentämiseksi on noudatettava seuraavia ohjeita:
- Vältä antamasta pistoksia lähelle yläluomen kohottajalihasta (levator palpebrae superioris), etenkin jos potilaan kulmakarvojen alasvetäjälihaksen kompleksi on suuri.
- Lateraaliseen rypistäjälihakseen (corrugator) annettavat pistokset pitää antaa vähintään 1 cm luisen silmäkuopan yläreunan yläpuolelle.
- Varmista, että pistettävä annos (tilavuus) on oikea.
- Kulmakarvojen yläpuolelle pistettäessä vältä pistämistä alle 1 cm:n etäisyydelle kulmakarvojen keskilinjoista.
Kuva 1: Pistoskohdat otsan pystyjuonteiden hoidossa
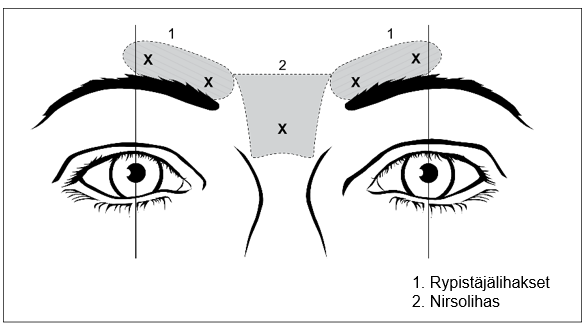
Ulompien silmäkulmien juonteet
Suositeltu annos aikuisille ulompien silmäkulmien juonteiden hoitoon on yhteensä 60 yksikköä (0,6 ml). Annos annetaan kuutena samansuuruisena pistoksena (10 yksikköä eli 0,1 ml per pistos) lihakseen kuuteen eri pistoskohtaan (ks. kuva 2: vaihtoehto 1 ja vaihtoehto 2): 3 pistosta (30 yksikköä eli 0,3 ml per pistos) silmän kehälihaksen (orbicularis oculi) kummallekin puolelle. Pistokset pitää antaa lateraaliseen orbicularis oculi ‑lihakseen siten, että neulan viiste osoittaa ylöspäin ja poispäin silmästä. Jos ulompien silmäkulmien alueella on juonteita ulompien silmäkulmien ylä- ja alapuolella, pistokset annetaan vaihtoehdon 1 mukaisesti. Jos ulompien silmäkulmien alueella on juonteita pääasiassa ulompien silmäkulmien alapuolella, pistokset annetaan vaihtoehdon 2 mukaisesti.
Kuva 2: Pistoskohdat ulompien silmäkulmien juonteiden hoidossa
| Vaihtoehto 1: Juonteita ulompien silmäkulmien ylä- ja alapuolella | Vaihtoehto 2: Juonteita ulompien silmäkulmien alapuolella |
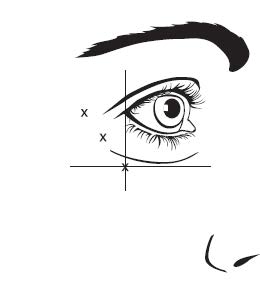
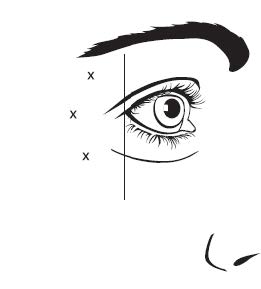
Ulomman silmäkulman anatomiset maamerkit voi olla helpompi tunnistaa käsin tunnustelemalla, kun potilas hymyilee maksimaalisesti. On varottava pistämästä pistosta isoon ja pieneen poskipäälihakseen (zygomaticus major/minor), jotta vältetään suupielen riippuminen ja epäsymmetrinen hymy.
Otsan pystyjuonteiden ja ulompien silmäkulmien juonteiden samanaikainen hoito
Otsan pystyjuonteiden ja ulompien silmäkulmien juonteiden samanaikaisessa hoidossa on noudatettava kummankin yksittäisen käyttöaiheen mukaisia annostus- ja anto-ohjeita siten, että kokonaisannos on 110 yksikköä (1,1 ml) Relfydess-valmistetta.
Otsan pystyjuonteiden hoitoon suositeltu annos on 50 yksikköä (0,5 ml). Annos annetaan viitenä samansuuruisena pistoksena (10 yksikköä eli 0,1 ml per pistos) lihakseen viiteen eri pistoskohtaan. Ulompien silmäkulmien juonteiden hoitoon suositeltu annos on 60 yksikköä (0,6 ml). Annos annetaan kuutena samansuuruisena pistoksena (10 yksikköä eli 0,1 ml per pistos) lihakseen kuuteen eri pistoskohtaan.
Vasta-aiheet
Tiedossa oleva yliherkkyys botuliinitoksiinivalmisteille tai kohdassa Apuaineet mainituille apuaineille.
Infektio ehdotetuissa pistoskohdissa.
Myasthenia gravis, Eaton–Lambertin oireyhtymä tai amyotrofinen lateraaliskleroosi.
Varoitukset ja käyttöön liittyvät varotoimet
Yleistä
Relfydess-valmistetta ei saa pistää verisuoneen.
Relfydess-valmistetta, kuten muitakaan lihakseen pistettäviä injektionesteitä, ei suositella potilaille, joilla on pidentynyt vuotoaika.
Suositellulla annoksella hoidetuilla potilailla voi esiintyä liiallista lihasheikkoutta.
Kutakin Relfydess-injektiopulloa saa käyttää vain yhdelle potilaalle yhden hoitokerran aikana.
Jäljelle jäänyt käyttämätön valmiste on hävitettävä kohdan Käyttö- ja käsittelyohjeet mukaisesti. Käyttämättä jääneen liuoksen inaktivoinnissa ja hävittämisessä on noudatettava erityisiä varotoimia (ks. kohta Käyttö- ja käsittelyohjeet).
Yliherkkyysreaktiot
Botuliinitoksiinivalmisteiden käytön yhteydessä on raportoitu vakavia ja/tai välittömiä yliherkkyysreaktioita, ja anafylaktisia reaktioita voi esiintyä hyvin harvoin (ks. kohta Haittavaikutukset). Tällaisia reaktioita ovat mm. anafylaksia, seerumitauti, nokkosihottuma, pehmytkudosturvotus ja hengenahdistus. Anafylaksian hoitoon tarvittavat välineet ja lääkkeet (mukaan lukien adrenaliini) on siksi oltava välittömästi saatavilla. Jos tällainen reaktio ilmenee, uusia Relfydess-pistoksia ei saa enää antaa ja asianmukainen lääketieteellinen hoito on aloitettava heti.
Toksiinin vaikutuksen leviäminen
Markkinoille tulon jälkeiset turvallisuustiedot muista hyväksytyistä botuliinitoksiinivalmisteista viittaavat siihen, että botuliinitoksiinin vaikutuksia (kuten kahtena näkeminen, näön sumeneminen ja riippuluomi) voidaan havaita myös muualla kehossa kuin paikallisesti annetun pistoksen pistoskohdassa (ks. kohta Haittavaikutukset). Lisäksi botuliinitoksiinin käytön yhteydessä on raportoitu hyvin harvoin toksiinin vaikutuksen leviämiseen etäälle pistoskohdasta mahdollisesti liittyviä haittavaikutuksia, joita voivat olla voimattomuus, yleistynyt lihasheikkous, nielemisvaikeudet, dysfonia, dysartria, virtsankarkailu ja hengitysvaikeudet. Nämä oireet ovat yhdenmukaisia botuliinitoksiinien vaikutusmekanismin kanssa, ja niitä on raportoitu tuntien tai viikkojen kuluttua pistoksesta.
Nielemis- ja hengitysvaikeudet voivat olla henkeä uhkaavia, ja toksiinin vaikutusten leviämiseen on raportoitu liittyneen kuolemia. Potilaat, joilla on ennestään nielemis- tai hengitysvaikeuksia, voivat olla alttiimpia näille komplikaatioille. Botuliinitoksiinihoidon jälkeen on raportoitu hyvin harvoin kuolemantapauksia, joissa potilaalla on ollut nielemishäiriö, keuhkosairaus tai merkittävää voimattomuutta. Siksi Relfydess-valmistetta ei suositella näille potilaille.
Potilaita tai heitä hoitavia henkilöitä on kehotettava ottamaan välittömästi yhteyttä lääkäriin, jos potilaalla ilmenee nielemis-, puhe- tai hengityselinsairauksia.
Aiemmin todetut neuromuskulaariset häiriöt
Relfydess-valmistetta on käytettävä varoen potilaille, joilla on neuromuskulaarisen transmission merkittävien häiriöiden riski tai kliinistä näyttöä sellaisista. Nämä potilaat voivat olla tavallista herkempiä botuliinitoksiinin kaltaisille aineille, ja hoidon jälkeen voi ilmetä liiallista lihasheikkoutta (mukaan lukien vaikea-asteiseen nielemishäiriöön ja hengitystoiminnan huononemiseen liittyviä systeemisiä vaikutuksia). Joissakin tapauksissa nielemisvaikeudet ovat kestäneet useita kuukausia ja vaatineet mahalaukkuruokintaletkun asentamisen.
Aiemmin todetut pistoskohdan sairaudet
Varovaisuutta on noudatettava, kun Relfydess-valmisteen ehdotetuissa pistoskohdissa on inflammaatio tai kun kohdelihaksissa on liiallista heikkoutta tai atrofiaa.
Varovaisuutta on noudatettava, kun Relfydess-hoitoa annetaan potilaille, joilla on merkittävää kasvojen epäsymmetrisyyttä, riippuluomi, liiallista ihon velttoutta (kuten dermatokalaasia, ks. kohta Farmakodynamiikka), syviä arpia ihossa tai iholla runsaasti talia.
Silmiin kohdistuvat haittavaikutukset
Botuliinitoksiinien käytön yhteydessä voi ilmetä kuivasilmäisyyttä, kyynelerityksen vähenemistä, silmien räpyttelyn vähenemistä ja sarveiskalvon häiriöitä. Jos kuivansilmäisyyden oireet (esim. silmien ärsytys, valonarkuus tai muutokset näkökyvyssä) jatkuvat, harkitse potilaan ohjaamista silmälääkärille. Botuliinitoksiinien käytön yhteydessä voi ilmetä lisääntynyttä kyynelvuotoa.
Lihasatrofia
On oletettavissa, että toistuvan botuliinihoidon jälkeen ilmenee lihasatrofiaa, joka on seurausta hoidettujen lihasten velttohalvauksesta.
Vasta-aineiden muodostuminen
Tiheämmällä antovälillä tai suurempina annoksina annetut pistokset voivat lisätä botuliinitoksiinia neutraloivien vasta-aineiden muodostumisen riskiä. Neutraloivien vasta-aineiden muodostuminen voi heikentää myöhemmän hoidon tehoa.
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Kalium- ja natriumpitoisuus
Tämä lääkevalmiste sisältää kaliumia alle 1 mmol (39 mg) per 150 yksikön injektiopullo eli sen voidaan sanoa olevan ”kaliumiton”.
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per 150 yksikön injektiopullo eli sen voidaan sanoa olevan ”natriumiton”.
Polysorbaatti 80 ‑sisältö
Tämä lääkevalmiste sisältää 1,6 mg polysorbaattia 80 per 150 yksikön injektiopullo, mikä vastaa 1,1 mg:aa/ml. Polysorbaatit saattavat aiheuttaa allergisia reaktioita.
Yhteisvaikutukset
Yhteisvaikutustutkimuksia ei ole tehty.
Relfydess-valmisteen ja aminoglykosidien tai muiden neuromuskulaarista transmissiota häiritsevien aineiden (esim. kuraren kaltaisten aineiden tai toisiin kohtiin annettavien muiden botuliinitoksiinivalmisteiden) samanaikaisessa käytössä on noudatettava varovaisuutta, sillä botuliinitoksiinin vaikutus voi voimistua.
Raskaus ja imetys
Raskaus
Tyypin A botuliinitoksiinin käytöstä raskaana oleville naisille ei ole riittävästi tietoja. Eläimillä tehdyissä tutkimuksissa ei ole havaittu suoria tai epäsuoria lisääntymistoksisia vaikutuksia, paitsi suurista annoksista aiheutuvaa toksisuutta emolle (ks. kohta Prekliiniset tiedot turvallisuudesta). Mahdollista riskiä ihmisille ei tunneta.
Relfydess-valmistetta ei pidä käyttää raskauden aikana eikä sellaisten naisten hoitoon, jotka voivat tulla raskaaksi ja jotka eivät käytä ehkäisyä.
Imetys
Ei tiedetä, erittyykö Relfydess ihmisillä äidinmaitoon. Relfydess-valmisteen erittymistä maitoon ei ole tutkittu eläimillä. Relfydess-valmistetta ei pidä käyttää imetyksen aikana.
Hedelmällisyys
Relfydess-valmisteen vaikutuksesta hedelmällisyyteen ei ole kliinistä tutkimustietoa. Eläimillä tehdyissä tutkimuksissa ei ole saatu näyttöä siitä, että tyypin A botuliinitoksiinilla olisi suoraa vaikutusta hedelmällisyyteen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Muilla botuliinitoksiinivalmisteilla on raportoitu olevan vähäinen tai kohtalainen vaikutus ajokykyyn ja/tai koneidenkäyttökykyyn. Relfydess-valmisteen käyttöön liittyy paikallisen lihasheikkouden tai näköhäiriöiden mahdollinen riski. Valmiste voi tilapäisesti heikentää ajokykyä tai kykyä käyttää koneita.
Haittavaikutukset
Yhteenveto turvallisuusprofiilista
Suurin osa haittavaikutuksista, joita raportoitiin kaikissa kehitysohjelman lumekontrolloiduissa tutkimuksissa ≥ 50 yksikköä saaneilla tutkittavilla yhden Relfydess-hoitokerran jälkeen, oli vaikeusasteeltaan lieviä tai keskivaikeita. Yleisimmin raportoituja haittavaikutuksia olivat pistoskohdan reaktiot, joita ilmeni noin 7 %:lla tutkittavista, ja päänsärky, jota ilmeni noin 5 %:lla tutkittavista.
Hoitoon/pistostekniikkaan liittyvät reaktiot ilmenivät yleensä ensimmäisen kuukauden aikana pistoksen jälkeen, ja ne olivat ohimeneviä.
Annettaessa samanaikaisesti hoitoa otsan pystyjuonteisiin ja ulompien silmäkulmien juonteisiin havaittujen haittavaikutusten luonne ja esiintyvyys olivat vastaavia kuin annettaessa potilaille vain toisen käyttöaiheen mukaista hoitoa.
Haittavaikutustaulukko
Haittavaikutukset on luokiteltu esiintyvyyden mukaan seuraavasti:
Hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Taulukko 2: Keskivaikeat tai vaikeat otsan pystyjuonteet
Seuraavia haittavaikutuksia havaittiin potilailla, joille annettiin Relfydess-valmistetta tasoittamaan tilapäisesti keskivaikeita tai vaikeita otsan pystyjuonteita.
| Elinjärjestelmäluokka | Esiintyvyys | Haittavaikutukset |
| Immuunijärjestelmä | Melko harvinainen | Yliherkkyys |
| Hermosto | Yleinen | Päänsärky |
| Silmät | Yleinen | Riippuluomi |
| Melko harvinainen | Näkökyvyn heikkeneminen, kuivasilmäisyys, silmien väsyminen | |
| Iho ja ihonalainen kudos | Melko harvinainen | Kulmakarvojen laskeutuminen, nokkosihottuma |
| Luusto, lihakset ja sidekudos | Melko harvinainen | Lihasheikkous, lihasspasmi |
| Yleisoireet ja antopaikassa todettavat haitat | Yleinen | Pistoskohdan reaktiot (esim. mustelmat, turvotus, kutina, kipu, epämukavuus, hematooma, yliherkkyys ja kuumotus) |
Taulukko 3: Keskivaikeat tai vaikeat ulompien silmäkulmien juonteet
Seuraavia haittavaikutuksia havaittiin potilailla, joille annettiin Relfydess-valmistetta tasoittamaan tilapäisesti keskivaikeita tai vaikeita ulompien silmäkulmien juonteita.
| Elinjärjestelmäluokka | Esiintyvyys | Haittavaikutukset |
| Immuunijärjestelmä | Melko harvinainen | Yliherkkyys |
| Hermosto | Yleinen | Päänsärky |
| Silmät | Melko harvinainen | Kuivasilmäisyys, silmien väsyminen, silmäluomen turvotus |
| Luusto, lihakset ja sidekudos | Melko harvinainen | Lihasheikkous |
| Yleisoireet ja antopaikassa todettavat haitat | Yleinen | Pistoskohdan reaktiot (esim. punoitus, kipu ja mustelmat) |
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Liian suurten annosten käyttäminen voi aiheuttaa etäällä antokohdasta ilmenevän ja syvällisen hermo-lihashalvauksen, johon liittyy monenlaisia oireita. Hengityksen tukeminen voi olla tarpeen, jos hengityslihakset halvaantuvat liian suurten annosten käytön seurauksena. Yliannostuksen yhteydessä potilasta on seurattava lääketieteellisesti useiden viikkojen ajan liiallisen lihasheikkouden tai lihashalvauksen oireiden ja löydösten varalta. Oireenmukainen hoito voi olla tarpeen.
Yliannostuksen oireet eivät välttämättä ilmene heti pistoksen jälkeen.
Sairaalahoitoon ottamista on harkittava, jos potilaalla on botuliinitoksiinin yliannostuksen oireita (esim. seuraavien yhdistelmä: lihasheikkous, riippuluomi, kahtena näkeminen, nielemis- ja puhehäiriöitä tai hengityslihasten halvaus).
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Muut perifeerisesti vaikuttavat lihasrelaksantit
ATC-koodi: M03AX01
Vaikutusmekanismi
Tyypin A botuliinitoksiinin ensisijainen farmakodynaaminen vaikutus on hoidetun lihaksen kemiallinen denervaatio, josta aiheutuu usean lihaksen aktiopotentiaalin mitattavissa oleva pieneneminen. Tämä aiheuttaa lihastoiminnan paikallista vähenemistä.
Lihakseen pistettäessä toksiini aiheuttaa kyseisen lihaksen halvaantumisen, mikä vähentää tilapäisesti lihastoimintaa. Vaikutus kestää pitkään, kunnes hermo-lihasliitoksen toiminta on palautunut ja lihastoiminta palautuu.
Kliininen teho ja turvallisuus
Jäljempänä esitetään tiedot vaiheen III lumekontrolloitujen READY‑1-, READY‑2- ja READY‑3-tutkimusten tuloksista. Yhteensä 1 012:ta potilasta hoidettiin kolmessa keskeisessä tutkimuksessa, joissa 806 potilasta sai Relfydess-hoitoa ja 206 potilasta sai lumelääkettä. Avoimeen pitkäaikaista turvallisuutta koskeneeseen tutkimukseen (READY‑4) osallistui lisäksi 902 potilasta, jotka saivat Relfydess-hoitoa. Kaikissa vaiheen III tutkimuksissa yhteensä 1 708:aa tutkittavaa hoidettiin Relfydess-valmisteella.
Vaikutuksen raportoitiin alkaneen yhden päivän kuluessa enintään 39 %:lla potilaista otsan pystyjuonteiden hoidossa ja 34 %:lla potilaista ulompien silmäkulmien juonteiden hoidossa. Vaikutuksen alkamiseen kuluneen ajan mediaani oli 2–3 päivää. Hoidon tehon kestoksi on osoitettu 6 kuukautta, ja enintään 75 %:lla potilaista tilanne ei palaa lähtötilanteeseen.
Potilaille, jotka saivat ≥ 50 yksikköä Relfydess-valmistetta, (yhteensä 1 699) tehtiin lääkevasta-ainemääritys lähtötilanteessa ja jokaisen hoitokerran jälkeen. Kliiniset tiedot viittaavat siihen, että joillakin henkilöillä pienet lääkevasta-ainetitterit ovat mahdollisia hoidon jälkeen; kaikkiaan 1,1 %:lla tutkittavista lääkevasta-ainemäärityksen tulos oli positiivinen. Relfydess-valmisteen immunogeenisuuden voidaan päätellä olevan vähäistä.
Otsan pystyjuonteet (READY‑1 ja READY‑3)
Kahdessa keskeisessä vaiheen III kaksoissokkoutetussa, lumekontrolloidussa monikeskustutkimuksessa 451 potilasta sai hoitoa otsan pystyjuonteisiin suositeltuna 50 yksikön annoksena. READY‑1-tutkimuksessa arvioitiin vain otsan pystyjuonteisiin annettua Relfydess-hoitoa. READY‑3-tutkimuksessa arvioitiin otsan pystyjuonteisiin ja ulompien silmäkulmien juonteisiin annettua samanaikaista hoitoa.
Ensisijainen teho oli vasteen saaneiden potilaiden osuus, kun vasteen saamisen määritelmänä oli pistemäärä 0 tai 1 otsan pystyjuonteiden vaikeusastetta kuvaavalla neliportaisella GL-ILA-asteikolla (GL‑ILA 4‑Point Photographic Scale) maksimaalisesti otsaa rypistettäessä. Arviointi tehtiin 1 kuukauden aikapisteessä tehdyllä tutkimuskäynnillä. Suurimmalla osalla tutkittavista sekä Relfydess-ryhmässä (74,5 %) että lumelääkeryhmässä (75,8 %) oli lähtötilanteessa tutkijan arvion mukaan vaikea-asteisia otsan pystyjuonteita. Potilaita, joiden iho oli hoidettavalla alueella tai silmäkuopan ympärillä liian velttoa, ei otettu mukaan tutkimuksiin. Vasteen saaneiden osuus oli yhden kuukauden aikapisteessä tilastollisesti merkitsevästi suurempi (p < 0,001) Relfydess-ryhmässä verrattuna lumelääkeryhmään (taulukko 4).
Taulukko 4: Tutkijan arvio otsan pystyjuonteiden hoidon onnistumisestaa (tutkittavien prosenttiosuus ja lukumäärä) yhden kuukauden aikapisteessäb kaksoissokkoutetuissa, lumekontrolloiduissa kliinisissä tutkimuksissa – modifioitu hoitoaikeen mukainen (mITT) potilasjoukkoc
| Tutkimus | Relfydess: 50 yksikköä otsan pystyjuonteisiin | Relfydess: 50 yksikköä otsan pystyjuonteisiin ja 60 yksikköä ulompien silmäkulmien juonteisiin | Lumelääke |
| READY‑1, vain otsan pystyjuonteiden hoito | 96,3 % N = 199 | - | 4,5 % N = 67 |
| READY‑3 ulompien silmäkulmien juonteiden ja otsan pystyjuonteiden samanaikainen hoito | 94,3 % N = 106 | 96,3 % N = 108 | 1,8 % N = 55 |
a Pistemäärä 0 (olematon) tai 1 (lievä) otsan pystyjuonteiden vaikeusastetta kuvaavalla GL‑ILA-asteikolla
b Päivä 30, ensisijainen tehon päätetapahtuma; p < 0,001
c Modifioituun hoitoaikeen mukaiseen (mITT) potilasjoukkoon kuuluivat kaikki satunnaistetut tutkittavat, joille annettiin tutkimusvalmistetta ja jotka analysoitiin satunnaistamismallin mukaisesti. Tutkittavat, joiden valokuviin ja luokitukseen perustuvat arvioinnit tehtiin yhden kuukauden aikapisteessä etäkäynnillä, suljettiin pois mITT-potilasjoukosta.
READY‑1-tutkimuksessa tutkittavien vaste (GL‑ILA-asteikon pistemäärä 0 tai 1 maksimaalisesti otsaa rypistettäessä) oli tilastollisesti merkitsevästi parempi Relfydess-hoidolla kuin lumelääkkeellä päivän 7 ja kuuden kuukauden aikapisteen välisenä aikana (p < 0,001), kuten taulukossa 5 esitetään.
Taulukko 5: Tutkijan reaaliaikaiseen arvioon perustuva otsan juonteiden vaikeusaste (GL‑ILA) READY‑1-tutkimuksessa – vasteen saaneiden osuudeta (%) pistoksen jälkeen, hoitoaikeen mukainen (ITT) potilasjoukkob
| Aikapiste pistoksen jälkeen | Relfydess (N = 223) | Lumelääke (N = 74) |
| GL-ILA | GL-ILA | |
| Päivä 7 | 93,2 % | 4,3 % |
| Päivä 14 | 96,4 % | 6,3 % |
| Kuukausi 1 | 96,4 % | 4,7 % |
| Kuukausi 2 | 92,9 % | 8,9 % |
| Kuukausi 3 | 73,7 % | 7,9 % |
| Kuukausi 4 | 53,7 % | 6,3 % |
| Kuukausi 5 | 39,7 % | 6,3 % |
| Kuukausi 6 | 23,6 % | 1,5 % |
a Määritelmänä otsan pystyjuonteiden vaikeusaste GL‑ILA-asteikolla arvioituna 2 (keskivaikea) tai 3 (vaikea) lähtötilanteessa ja 0 (olematon) tai 1 (lievä) tietyllä käynnillä
b Hoitoaikeen mukaiseen (ITT) potilasjoukkoon kuuluivat kaikki satunnaistetut tutkittavat, joille annettiin tutkimusvalmistetta ja jotka analysoitiin satunnaistamismallin mukaisesti.
Kun READY‑3-tutkimuksessa annettiin samanaikaisesti hoitoa otsan juonteisiin ja ulompien silmäkulmien juonteisiin, vaste (GL‑ILA-asteikolla arvioituna pistemäärä 0 tai 1 maksimaalisesti otsaa rypistettäessä) oli tilastollisesti merkitsevästi suurempi (nimellinen p‑arvo < 0,001) Relfydess-ryhmässä kuin lumelääkeryhmässä hoidon jälkeisten kuuden kuukauden ajan.
Ulompien silmäkulmien juonteet (READY‑2 ja READY‑3)
Kahdessa keskeisessä vaiheen III kaksoissokkoutetussa, lumekontrolloidussa monikeskustutkimuksessa 471 potilasta sai hoitoa ulompien silmäkulmien juonteisiin suositeltuina 60 yksikön annoksina. READY‑2-tutkimuksessa arvioitiin vain ulompien silmäkulmien juonteisiin annettua Relfydess-hoitoa. READY‑3-tutkimuksessa arvioitiin otsan pystyjuonteisiin ja ulompien silmäkulmien juonteisiin annettua samanaikaista hoitoa.
Ensisijainen teho oli vasteen saaneiden tutkittavien osuus, kun vasteen saamisen määritelmänä oli pistemäärä 0 tai 1 ulompien silmäkulmien juonteiden vaikeusastetta kuvaavalla neliportaisella LCL-ILA-asteikolla (LCL‑ILA 4‑Point Photographic Scale) maksimaalisesti hymyiltäessä. Arviointi tehtiin 1 kuukauden aikapisteessä tehdyllä tutkimuskäynnillä. Potilaita, joiden iho oli hoidettavalla alueella tai silmäkuopan ympärillä liian velttoa, ei otettu mukaan tutkimukseen. Vasteen saaneiden osuus oli yhden kuukauden aikapisteessä tilastollisesti merkitsevästi suurempi (p < 0,001) Relfydess-ryhmässä verrattuna lumelääkeryhmään (taulukko 6).
Taulukko 6: Tutkijan arvio ulompien silmäkulmien juonteiden hoidon onnistumisestaa (tutkittavien prosenttiosuus ja lukumäärä) yhden kuukauden aikapisteessäb kaksoissokkoutetuissa, lumekontrolloiduissa kliinisissä tutkimuksissa – modifioitu hoitoaikeen mukainen (mITT) potilasjoukkoc
| Tutkimus | Relfydess: 60 yksikköä ulompien silmäkulmien juonteisiin | Relfydess: 60 yksikköä ulompien silmäkulmien juonteisiin ja 50 yksikköä otsan pystyjuonteisiin | Lumelääke |
| READY‑2, vain ulompien silmäkulmien juonteiden hoito | 87,2 % N = 204 | - | 11,9 % N = 69 |
| READY‑3, ulompien silmäkulmien juonteiden ja otsan pystyjuonteiden samanaikainen hoito | 78,1 % N = 117 | 83,3 % N = 108 | 19,3 % N = 55 |
a Pistemäärä 0 (olematon) tai 1 (lievä) ulompien silmäkulmien juonteiden vaikeusastetta kuvaavalla LCL‑ILA-asteikolla
b Päivä 30, ensisijainen tehon päätetapahtuma; p < 0,001
c.Modifioituun hoitoaikeen mukaiseen (mITT) potilasjoukkoon kuuluivat kaikki satunnaistetut tutkittavat, joille annettiin tutkimusvalmistetta ja jotka analysoitiin satunnaistamismallin mukaisesti. Tutkittavat, joiden valokuviin ja luokitukseen perustuvat arvioinnit tehtiin yhden kuukauden aikapisteessä etäkäynnillä, suljettiin pois mITT-potilasjoukosta.
READY‑2-tutkimuksessa tutkittavien vaste (LCL-ILA-asteikon pistemäärä 0 tai 1 maksimaalisesti hymyiltäessä) oli tilastollisesti merkitsevästi parempi Relfydess-hoidolla kuin lumelääkkeellä päivän 7 ja kuuden kuukauden aikapisteen välisenä aikana (p ≤ 0,002), kuten taulukossa 7 esitetään.
Taulukko 7: Tutkijan reaaliaikaiseen arvioon perustuva ulompien silmäkulmien juonteiden vaikeusaste (LCL‑ILA) READY‑2-tutkimuksessa – vasteen saaneiden osuudeta (%) pistoksen jälkeen, hoitoaikeen mukainen (ITT) potilasjoukkob
Aikapiste pistoksen jälkeen | Relfydess (N = 230) | Lumelääke (N = 73) |
| LCL-ILA | LCL-ILA | |
| Päivä 7 | 82,5 % | 8,5 % |
| Päivä 14 | 89,7 % | 11,4 % |
| Kuukausi 1 | 87,5 % | 11,8 % |
| Kuukausi 2 | 76,3 % | 14,3 % |
| Kuukausi 3 | 59,8 % | 14,9 % |
| Kuukausi 4 | 45,7 % | 10,9 % |
| Kuukausi 5 | 32,1 % | 6,2 % |
| Kuukausi 6 | 23,3 % | 7,2 % |
a Määritelmänä ulompien silmäkulmien juonteiden vaikeusaste LCL‑ILA-asteikolla 2 (keskivaikea) tai 3 (vaikea) lähtötilanteessa ja 0 (olematon) tai 1 (lievä) tietyllä käynnillä
b Hoitoaikeen mukaiseen (ITT) potilasjoukkoon kuuluivat kaikki satunnaistetut tutkittavat, joille annettiin tutkimusvalmistetta ja jotka analysoitiin satunnaistamismallin mukaisesti.
Kun READY‑3-tutkimuksessa annettiin samanaikaisesti hoitoa otsan juonteisiin ja ulompien silmäkulmien juonteisiin, vaste (LCL‑ILA-asteikolla arvioituna pistemäärä 0 tai 1 maksimaalisesti hymyiltäessä) oli tilastollisesti merkitsevästi suurempi (nimellinen p‑arvo ≤ 0,007) Relfydess-ryhmässä kuin lumelääkeryhmässä kaikissa muissa hoidon jälkeisissä aikapisteissä paitsi 6 kuukauden kohdalla.
Tutkittavien tyytyväisyys ja psyykkinen toimintakyky
Tutkittavien psyykkistä toimintakykyä arvioitiin psyykkistä toimintakykyä kuvaavan FACE‑Q™-arvioinnin avulla.
FLTSQ (Facial Line Treatment Satisfaction Questionnaire) ‑kyselyn avulla arvioitiin tutkittavien tyytyväisyyttä otsan pystyjuonteiden ja/tai ulompien silmäkulmien juonteiden tilanteeseen sekä tutkittavien tyytyväisyyttä saamiinsa hoitoihin.
Psyykkisen toimintakyvyn arviointiin käytetyn FACE‑Q™-arvioinnin ja FLTSQ-kyselyn vastaukset osoittivat, että Relfydess-hoitoa saaneiden tutkittavien psyykkinen toimintakyky parani ja että he olivat kaikissa hoidon jälkeisissä aikapisteissä tyytyväisempiä saamiinsa hoitoihin ja ulkonäköönsä kuin lumelääkettä saaneet tutkittavat. FACE‑Q™-arvioinnin ja FLTSQ-kyselyn osoittama parantunut psyykkinen toimintakyky ja tutkittavien tyytyväisyys säilyivät kuuden kuukauden ajan hoidon jälkeen.
Avoin tutkimus (READY‑4)
Vaiheen III avoimessa monikeskustutkimuksessa (READY‑4) Relfydess-valmistetta annettiin kullakin hoitokerralla enintään 110 yksikköä ja kunkin käyttöaiheen mukaista hoitoa enintään neljä hoitokertaa (yhteensä enintään seitsemän hoitokertaa otsan pystyjuonteisiin ja/tai ulompien silmäkulmien juonteisiin 52 viikon aikana). 175 tutkittavan alaryhmän saatua neljä hoitosykliä otsan pystyjuonteisiin tutkijan viikon 4 aikapisteessä tekemän (tutkittavan maksimaalisesti otsaa rypistäessä) arvion perusteella vasteen saaneiden osuus oli säilynyt toistettujen hoitosyklien ajan 79,4 %:lla hoitosyklissä 1 ja 80,0 %:lla hoitosyklissä 4. Vastaavasti 186 tutkittavan alaryhmässä, joka sai ulompien silmäkulmien juonteisiin hoitoa neljä hoitosykliä, tutkittavan maksimaalisesti hymyillessä tehdyn arvioinnin perusteella vasteen saaneiden osuudet olivat 64,5 % hoitosyklissä 1 ja 60,2 % hoitosyklissä 4.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset Relfydess-valmisteen käytöstä maksimaalisen otsan rypistyksen aikana ilmenevien keskivaikeiden tai vaikeiden otsan pystyjuonteiden ja maksimaalisen hymyn aikana ilmenevien ulompien silmäkulmien juonteiden ulkonäön parantamiseksi tilapäisesti kaikissa pediatrisissa potilasryhmissä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Relfydess-valmistetta ei oletettavasti ole ääreisveressä mitattavissa olevina pitoisuuksina sen jälkeen, kun sitä on annettu pistoksena lihakseen suositeltuna annoksena. Sen vuoksi farmakokineettisiä tutkimuksia ei ole tehty.
Prekliiniset tiedot turvallisuudesta
Akuuttia toksisuutta, kroonista toksisuutta ja paikallista siedettävyyttä pistoskohdassa koskeneissa tutkimuksissa ei ole kliinisesti merkityksellisillä annostasoilla havaittu epätavallisia paikallisia tai systeemisiä haittavaikutuksia.
Kirjallisuustiedot osoittavat, että botuliinitoksiinien puoliintumisaika veressä on lyhyt ja diffuusio kudoksissa, myös istukan läpi, on vähäistä. Annoksilla, jotka olivat alle selvästi emoille toksisen tason, botuliinitoksiinilla ei ollut haitallisia vaikutuksia kaniinien hedelmällisyyteen tai lisääntymistoimintoihin. Botuliinitoksiinin antaminen päivittäin lihakseen tiineille rotille tai kaniineille organogeneesin aikana pienensi sikiöpainoa ja heikensi luuston luutumista, etenkin käytettäessä suurempia annoksia, joihin liittyi merkittävää toksisuutta emolle.
Farmaseuttiset tiedot
Apuaineet
Dinatriumvetyfosfaattidihydraatti
Natriumdivetyfosfaattidihydraatti
Kaliumkloridi
Natriumkloridi
Polysorbaatti 80
L‑tryptofaani
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
18 kuukautta
Säilytys
Säilytä jääkaapissa (2 °C–8 °C). Ei saa jäätyä. Pidä injektiopullot ulkopakkauksessa. Herkkä valolle.
Avaamattoman injektiopullon voidaan antaa lämmetä huoneenlämpöiseksi 25 °C:n lämpötilassa ja valolta suojattuna. Relfydess-valmisteen (avaamattoman injektiopullon) säilyvyydeksi on osoitettu enintään 24 tuntia huoneenlämmössä.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
RELFYDESS injektioneste, liuos
100 U/ml (L:ei) 150 U (1,5 ml) (132,48 €)
PF-selosteen tieto
Pakkaustyyppi/suljin
Tyypin I lasista valmistettu injektiopullo, bromobutyylitulppa ja alumiininen päällyssinetti, jossa on irti napsautettava polypropeeninen korkki.
Pakkauksen sisältö
Yksi injektiopullo sisältää 150 yksikköä tyypin A botuliinitoksiinia 1,5 ml:ssa liuosta.
Pakkauskoot:
Pakkauksessa on 1 tai 10 injektiopulloa Relfydess 100 yksikköä/ml injektionestettä, liuosta.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Kirkas, väritön tai vaaleankeltainen liuos.
Käyttö- ja käsittelyohjeet
Käyttämätön Relfydess-valmiste (injektiopullossa tai ruiskussa) on inaktivoitava laimennetulla natriumhypokloriittiliuoksella (0,1 % NaOCl) tai natriumhydroksidiliuoksella (1 % NaOH) heti potilaan hoidon jälkeen.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
BOTULIINITOKSIININ KÄSITTELYSSÄ ILMENEVIÄ VAARATAPAHTUMIA KOSKEVAT SUOSITUKSET
- Jos valmistetta pääsee vuotamaan tai läikkymään, se on pyyhittävä pois kuivalla, imukykyisellä materiaalilla, joka on hävitettävä paikallisten vaatimusten mukaisesti.
- Kontaminoituneet pinnat on puhdistettava laimennetulla hypokloriitti- tai natriumhydroksidiliuoksella, minkä jälkeen ne on kuivattava.
- Jos injektiopullo rikkoutuu, toimi edellä kuvatulla tavalla, kerää rikkoutuneet lasinpalaset huolellisesti ja pyyhi valmiste pois. Vältä viiltoja ihoon.
- Jos valmistetta joutuu kosketuksiin ihon kanssa, pese kyseinen alue saippualla ja vedellä.
- Jos valmistetta joutuu kosketuksiin silmien kanssa, huuhtele silmät huolellisesti runsaalla vedellä tai silmien huuhteluun tarkoitetulla liuoksella.
- Jos valmistetta joutuu kosketuksiin haavan, viillon tai rikkoutuneen ihon kanssa, huuhtele kyseinen alue huolellisesti runsaalla vedellä ja hakeudu lääkäriin.
Näitä käyttöä, käsittelyä ja hävittämistä koskevia ohjeita on noudatettava tarkoin.
Korvattavuus
RELFYDESS injektioneste, liuos
100 U/ml 150 U
- Ei korvausta.
ATC-koodi
M03AX01
Valmisteyhteenvedon muuttamispäivämäärä
01.04.2025
Yhteystiedot
Seminariegatan 21
SE-752 28 Uppsala
Sverige
+46 18 444 0330
www.galdermanordic.com
nordic@galderma.com
