IXCHIQ injektiokuiva-aine ja liuotin, liuosta varten
Huomioitavaa

Tähän lääkevalmisteeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti turvallisuutta koskevaa uutta tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä lääkkeen haittavaikutuksista. Ks. kohdasta Haittavaikutukset, miten haittavaikutuksista ilmoitetaan.
Vaikuttavat aineet ja niiden määrät
Käyttökuntoon saattamisen jälkeen yksi annos (0,5 ml) sisältää:
Chikungunya-viruksen (CHIKV) kanta Δ5nsP3 (elävä, heikennetty)* vähintään 3,0 log10 TCID50**
* Tuotettu Vero-soluissa
** Annos, joka infektoi 50 % kudosviljelmästä
Tämä tuote sisältää muuntogeenisiä organismeja (GMO).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektiokuiva-aine ja liuotin, liuosta varten.
Kliiniset tiedot
Käyttöaiheet
IXCHIQ on tarkoitettu aktiiviseen immunisaatioon chikungunya-viruksen (CHIKV) aiheuttaman taudin ehkäisemiseksi vähintään 12-vuotiailla henkilöillä.
Tämän rokotteen käytön tulee olla virallisten suositusten mukaista.
Annostus ja antotapa
Annostus
Vähintään 12-vuotiaat henkilöt
IXCHIQ annetaan yhtenä 0,5 ml annoksena.
Uudelleenrokotus (tehosteannos)
Uudelleenrokotuksen tarvetta ei ole osoitettu.
Alle 12-vuotiaat pediatriset potilaat
IXCHIQ:n turvallisuutta ja immunogeenisuutta alle 12-vuotiaiden lasten hoidossa ei ole varmistettu. Tietoja ei ole saatavilla alle 12-vuotiaista lapsista.
Antotapa
Vain lihaksensisäiseen injektioon injektion käyttökuntoon saattamisen jälkeen.
IXCHIQ pitää antaa lihaksensisäisesti hartialihakseen 2 tunnin kuluessa käyttökuntoon saattamisesta.
Rokotetta ei saa sekoittaa samaan ruiskuun muiden rokotteiden tai lääkevalmisteiden kanssa.
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet lääkevalmisteen saattamisesta käyttökuntoon ennen lääkkeen antoa.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Sairauden tai lääkehoidon , vuoksi immuunipuutteiset tai immunosuppressiiviset henkilöt (esim. pahanlaatuiset kasvaimet, kemoterapia, immunosupressiivinen hoito, synnynnäinen immuunikato, tai vakavasti immuunipuutteiset potilaat, joilla on HIV-infektio).
Varoitukset ja käyttöön liittyvät varotoimet
IXCHIQ-valmistetta tulee antaa vain, jos chikungunyatartunnan riski on huomattava ja vain, kun mahdollisia riskejä ja hyötyjä on harkittu tarkkaan (katso kohta Vasta-aiheet ja alla olevat tiedot).
IXCHIQ-valmisteen käyttöön liittyviä vakavia haittavaikutuksia on raportoitu erityisesti yli 65-vuotiailla sekä henkilöillä, joilla on useita kroonisia ja/tai huonossa hoitotasapainossa olevia sairauksia (katso kohta Haittavaikutukset). Vakava reaktogeenisuus ja chikungunyaa muistuttavat haittavaikutukset voivat johtaa yleiskunnon heikkenemiseen, kuten huonovointisuuteen ja vähentyneeseen ruokahaluun, olemassa olevien sairauksien pahenemiseen, sekavuuteen, enkefalopatiaan tai enkefaliittiin, mikä voi johtaa kaatuiluun, sairaalahoitoon ja kuolemaan. Rokotettuja on ohjeistettava hakeutumaan välittömästi lääkärin hoitoon, jos he kokevat rokotuksen jälkeen vakavaan reaktogeenisuuteen viittaavia tai chikungunyaa muistuttavia vakavia haittavaikutuksia.
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi annetun valmisteen nimi ja eränumero on kirjattava selkeästi.
Yliherkkyys ja anafylaksia
Asianmukaisen lääketieteellisen hoidon ja valvonnan on oltava aina helposti saatavilla, jos rokotteen antamisen jälkeen ilmenee anafylaktinen reaktio. Rokotuksen jälkeen suositellaan vähintään 15 minuutin pituista tarkkaa seurantaa.
Ahdistukseen liittyvät reaktiot
Rokotuksen yhteydessä voi ilmetä ahdistuneisuuteen liittyviä reaktioita, kuten vasovagaalisia reaktioita (pyörtyminen), hyperventilaatiota tai stressiin liittyviä reaktioita, jotka ovat psykogeeninen reaktio neulaan. On tärkeää, että käytössä on varotoimet pyörtymisen aiheuttamien vammojen välttämiseksi.
Samanaikainen sairaus
Rokotusta on lykättävä henkilöillä, joilla on akuutti vaikea kuumesairaus tai akuutti infektio. Lievän infektion ja/tai vaikean kuumeen esiintyminen ei saa viivästyttää rokotusta.
Trombosytopenia ja hyytymishäiriöt
Rokotetta tulee antaa varoen henkilöille, jotka saavat antikoagulanttihoitoa, tai henkilöille, joilla on trombosytopenia tai jokin hyytymishäiriö (kuten hemofilia), koska lihaksensisäisen injektion jälkeen näillä henkilöillä voi esiintyä verenvuotoa tai mustelmia.
Rokotteen tehon rajoitukset
IXCHIQ:n kyky estää chikungunya-viruksen aiheuttamaa sairautta perustuu serologiseen sijaispäätetapahtumaan (katso kohta Farmakodynamiikka). Kuten minkä tahansa rokotteen tapauksessa, rokote ei välttämättä aiheuta suojaavaa immuunivastetta kaikissa henkilöissä. Henkilökohtaisien suojausmenetelmien käytön jatkamista hyttysten pistoja vastaan suositellaan myös rokotuksen jälkeen.
Raskaus
Päätettäessä IXCHIQ:n käytöstä raskauden aikana on huomioitava henkilön riski saada luonnonvarainen CHIKV-tartunta, sikiöikä ja sikiölle tai vastasyntyneelle aiheutuva riski luonnonvaraisen CHIKV:n vertikaalisesta tartunnasta (katso kohta Raskaus ja imetys).
Verenluovutus
Rokoteviremiaa havaittiin 90 % potilaissa 3 päivää rokotuksen jälkeen. Osuus rokotetuista, joissa havaittiin virus, väheni 17 %:iin 7 päivässä IXCHIQ:n antamisen jälkeen, ja rokoteviremiaa ei havaittu ollenkaan 15 päivää rokotuksen jälkeen. Katso kohdat Raskaus ja imetys ja Haittavaikutukset.
IXCHIQ:lla rokotettujen henkilöiden ei pidä luovuttaa verta vähintään 4 viikkoon rokotuksen jälkeen.
Chikungunyan kaltaiset haittavaikutukset
IXCHIQ voi aiheuttaa vakavia tai pitkäkestoisia chikungunyan kaltaisia haittavaikutuksia (katso kohta Haittavaikutukset).
Enkefaliitti
Markkinoille saattamisen jälkeisessä käytössä IXCHIQ-valmistetta saaneilla on raportoitu ilmenneen enkefaliittia (mukaan lukien kuolemaan johtanut tapaus) (katso kohta Haittavaikutukset).
Natrium
Tämä lääkeaine sisältää alle 1 mmol natriumia (23 mg) annosta kohden, eli se on olennaisesti natriumiton.
Kalium
Tämä lääkeaine sisältää kaliumia alle 1 mmol (39 mg) annosta kohden, eli se on olennaisesti kaliumiton.
Tämä lääkea sisältää 25 mg sorbitolia jokaista 0,5 ml:n annosta kohden, mikä vastaa 0,036 mg sorbitolia/kg/0,5 ml. Muiden valmisteiden sekä ravinnosta saatavan sorbitolin (tai fruktoosin) additiivinen vaikutus on huomioitava.
Yhteisvaikutukset
Antaminen samanaikaisesti muiden rokotteiden kanssa
IXCHIQ:ta ei suositella annettavaksi samanaikaisesti muiden rokotteiden kanssa, koska tietoja turvallisuudesta ja immunogeenisuudesta IXCHIQ:ta annettaessa samanaikaisesti muiden rokotteiden kanssa ei ole saatavilla.
Immunoglobuliinien tai veren- tai plasmansiirron saaminen 3 kuukautta ennen tai enintään 1 kuukausi IXCHIQ-rokotteen antamisen jälkeen voi haitata odotettua immuunivastetta.
Raskaus ja imetys
Raskaus
Eläinkokeissa ei ole havaittu suoria tai epäsuoria haitallisia vaikutuksia lisääntymistoksisuuteen (ks. kohta Prekliiniset tiedot turvallisuudesta).
IXCHIQ:n käytöstä raskaana olevilla naisilla on rajallinen määrä tietoa. Nämä tiedot eivät riitä poissulkemaan IXCHIQ:n mahdollisia vaikutuksia raskauteen, alkion/sikiön kehitykseen, synnytykseen tai postnataaliseen kehitykseen.
Luonnonvaraisen CHIKV:n vertikaalinen tartunta vireemisestä raskaana olevasta henkilöstä synnytyksen aikana on yleistä ja voi aiheuttaa mahdollisesti tappavan CHIKV-sairauden vastasyntyneissä. Rokote viremiaa esiintyy ensimmäisen viikon aikana IXCHIQ:n antamisen jälkeen, ja viremia loppuu 14 päivässä rokotuksen jälkeen. Ei ole tiedossa, voiko rokotteen virus tarttua vertikaalisesti ja aiheuttaa haittavaikutuksia sikiössä tai vastasyntyneessä.
Päätettäessä IXCHIQ:n annosta raskauden aikana pitää huomioida henkilön riski altistua luonnonvaraiselle CHIKV:lle, sikiöikä ja sikiölle tai vastasyntyneelle aiheutuva riski luonnonvaraisen CHIKV:n vertikaalisesta tartunnasta.
Imetys
Ei ole tiedossa erittyykö IXCHIQ:ta äidinmaitoon. Imetetylle lapselle aiheutuvaa riskiä ei voida poissulkea. Imetyksen kehityksellisiä ja terveysvaikutuksia on harkittava äidin kliinisen tarpeen saada IXCHIQ ohella, samoin kuin mahdollisia IXCHIQ:n aiheuttamia haittavaikutuksia imetetylle lapselle.
Eläinkokeissa ei ole havaittu suoria tai epäsuoria haitallisia imetykseen liittyviä vaikutuksia (ks. kohta Prekliiniset tiedot turvallisuudesta).
Hedelmällisyys
Nimenomaisesti hedelmällisyyttä koskevia tutkimuksia ei ole tehty.
Eläinkokeissa ei ole havaittu haitallisia vaikutuksia naisten hedelmällisyyteen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
IXCHIQ-valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn. Jotkut kohdassa Haittavaikutukset mainituista vaikutuksista voivat kuitenkin tilapäisesti vaikuttaa ajokykyyn tai koneiden käyttökykyyn.
Haittavaikutukset
Yhteenveto turvallisuusprofiilista
Vähintään 18-vuotiaat aikuiset
IXCHIQ-valmisteen kokonaisturvallisuus perustuu kolmeeen USA:ssa 3 610:lle yli 18-vuotiaalle henkilöille suoritettuun vaiheen I ja III kliiniseen tutkimukseen. Osallistujat saivat yhden IXCHIQ-annoksen ja heitä seurattiin 6 kuukauden ajan.
Yleisimmät rokotuskohdan reaktiot olivat arkuus (10,8 %) ja kipu (6,1 %). Yleisimmät systeemiset haittavaikutukset olivat päänsärky (32 %), uupumus (29,4 %), lihaskipu (23,7 %), nivelkipu (16,6 %), kuume (13,8 %) ja pahoinvointi (11,4 %).
Vakavia haittavaikutuksia on ilmoitettu markkinoille saattamisen jälkeisessä käytössä erityisesti yli 65-vuotiailla miehillä, joilla on kroonisia sairauksia, kuten sydän- ja verisuonitauteja, diabetes tai krooninen munuaissairaus. Kyseisiin haittavaikutuksiin lukeutuivat neurologiset tapahtumat, kuten fataali enkefaliitti, yleiskunnon heikentyminen ja kroonisten sairauksien paheneminen (katso kohta Varoitukset ja käyttöön liittyvät varotoimet).
12–17-vuotiaat nuoret
Turvallisuutta 12–17-vuotiaissa nuorissa osallistujissa arvioitiin 502 osallistujassa Brasiliassa, jotka saivat yhden annoksen IXCHIQ-valmistetta 6 kuukauden seurannalla. 18,7 %:lla osallistujista oli ennestään vasta-aineita chikungunya-virukselle (94 nuorta).
Yleisimmät rokotuskohdan reaktiot 12–17-vuotiaissa nuorissa olivat arkuus (19,9 %) ja kipu (19,3 %). Yleisimmät systeemiset haittavaikutukset olivat päänsärky (51,0 %), lihaskipu (26,9 %), kuume (24,1 %), uupumus (22,3 %), pahoinvointi (15,9 %) ja nivelkipu (12,9 %).
Lähtötilanteessa seropositiiviset nuoret
Pyydettyjä systeemisiä haittavaikutuksia kokeneiden osallistujien osuus oli suurempi lähtötilanteessa seronegatiivisissa osallistujissa, jotka rokotettiin IXCHIQ:lla kuin lähtötilanteessa seropositiivisissa osallistujissa, jotka rokotettiin IXCHIQ:lla (67,9 % ja 44,7 %). Pyydettyjä paikallisia haittavaikutuksia ja pyytämättömiä haittavaikutuksia kokeneiden osallistujien osuus oli samankaltainen kunkin ositteen IXCHIQ-koelinjassa.
Laboratorioarvot
Vähintään 18-vuotiaat aikuiset
Yleisimmät epänormaalit laboratorioarvot olivat neutropenia (41,8 %), leukopenia (31,2 %), lymfopenia (22,3 %), lisääntynyt alaniiniaminotransferaasi (ALT: 15,5 %) ja lisääntynyt aspartaattiaminotransferaasi (AST: 11,7 %) (tiedot perustuvat IXCHIQ-valmistetta saaneen 372 potilaan immunogeenisuuden osajoukkoon).
12–17-vuotiaat nuoret
Yleisimmät epänormaalit laboratorioarvot olivat neutropenia (40,2 %), leukopenia (16,8 %) ja lymfosytopenia (11,6 %) (tiedot perustuvat IXCHIQ-valmistetta saaneen 328 potilaan immunogeenisuuden osajoukkoon).
Rokotteen viremia ja viruseritys
Rokotteen viruksen osoitettiin esiintyvän veressä ja virtsassa, ja se voi esiintyä myös muissa ruumiinnesteissä. Rokotteen viremiaa ja viruseritystä (mitattuna genomin monistamismenetelmillä) IXCHIQ-rokotuksen jälkeen arvioitiin yhdessä aikuisille tehdyssä kliinisessä tutkimuksessa (VLA1553-101). Viremiaa havaittiin 90 % potilaissa 3 päivää rokotuksen jälkeen. Se osuus rokotetuista, joissa havaittiin virusta, väheni 17 %:iin 7 päivässä IXCHIQ:n antamisen jälkeen, ja rokoteviremiaa ei havaittu ollenkaan 15 päivää rokotuksen jälkeen. Yksi osallistuja eritti virusta virtsaan 7 päivää rokotuksen jälkeen.
Luettelo haittavaikutuksista taulukkomuodossa
Haittavaikutukset luetellaan seuraavien yleisyysluokkien mukaan:
Hyvin yleinen: (≥ 1/10),
Yleinen: (≥ 1/100 – < 1/10),
Melko harvinainen: (≥ 1/1 000 – < 1/100),
Harvinainen: (≥ 1/10 000 – < 1/1 000),
Hyvin harvinainen: (<1/10 000).
Tuntematon: (ei voida arvioida saatavilla olevien tietojen perusteella).
Haittavaikutukset esitetään kussakin yleisyysluokassa alenevassa vakavuusjärjestyksessä.
Taulukko 1. Lääkkeen haittavaikutukset vähintään 12-vuotiaissa henkilöissä
| Elinjärjestelmä | Esiintymistiheys | Haittavaikutukset |
| Veri ja imukudos | Yleinen | Lymfadenopatiaa |
| Melko harvinainen | Trombosytopenia | |
| Umpierityshäiriöt | Harvinainen | Hypovoleeminen hyponatremiaa |
| Hermoston häiriöt | Hyvin yleinen | Päänsärky |
| Yleinen | Huimausb | |
| Melko harvinainen | Parestesia, pyörtyminen | |
| Harvinainen | Sekavuus | |
| Tuntematon | Enkefalopatia, enkefaliitti, aseptinen meningiitti | |
| Silmähäiriöt | Yleinen | Silmäkipub |
| Melko harvinainen | Sidekalvon hyperemiac | |
| Korvan ja sisäkorvan häiriöt | Melko harvinainen | Tinnitusa |
| Hengityselinten, rintakehän ja välikarsinan häiriöt | Melko harvinainen | Hengenahdistus |
| Ruoansulatuselimistön häiriöt | Hyvin yleinen | Pahoinvointi |
| Yleinen | Oksentelu, ripuli | |
| Ihon ja ihonalaisen kudoksen häiriöt | Yleinen | Ihottuma |
| Melko harvinainen | Hyperhidroosia | |
| Luuston, lihasten ja sidekudosten häiriöt | Hyvin yleinen | Lihaskipu, nivelkipu |
| Yleinen | Selkäkipua | |
| Yleisoireet ja antopaikassa todettavat haitat | Hyvin yleinen | Uupumus, kuume, pistoskohdan reaktiot (arkuus, kipu, punoitus, kovettuma, turvotus) |
| Yleinen | Vilunväreet | |
| Melko harvinainen | Asteniaa, perifeerinen turvotusa, pahoinvointi, ruokahalun väheneminen | |
| Tutkimukset | Hyvin yleinen | Alentunut valkosolumääräd, maksan toimintakokeen arvojen nousua,e |
a. ilmoitettu vain aikuisissa, ei ilmoitettu nuorissa
b. silmäkipu ja huimaus yleinen nuorissa, melko harvinainen aikuisissa
c. ilmoitettu vain nuorissa, ei ilmoitettu aikuisissa
d. sisältää: leukopenia (alentunut leukosyyttiluku), neutropenia (alentunut neutrofiililuku) ja lymfopenia (alentunut lymfosyyttiluku).
e. sisältää: lisääntynyt alaniiniaminotransferaasi (ALT) ja aspartaattiaminotransferaasi (AST).
Chikungunyan kaltaiset haittavaikutukset
Aikuiset
Tiettyjen chikungunyan kaltaisiksi haittavaikutuksiksi kutsuttujen haittavaikutusten yhdistelmiä arvioitiin jälkikäteen vaiheen I ja III kliinisten tutkimusten turvallisuustiedoista (N = 3 610). Chikungunyan kaltaiset haittavaikutukset määriteltiin laajasti, eli kuume (≥38 °C) ja vähintään yksi muu akuutin chikungunya-sairauden yhteydessä ilmoitettu oire, mukaan lukien nivelkipu tai niveltulehdus, lihaskipu, päänsärky, selkäkipu, ihottuma, lymfadenopatia, ja tietyt hermostolliset, sydämen tai silmien oireet, jotka esiintyivät 30 päivän kuluessa rokotuksesta riippumatta yksittäisten oireiden alkamisajankohdasta, vaikeusasteesta tai kestosta.
Chikungunyan kaltaisiksi haittavaikutuksiksi luokiteltavia haittavaikutuksien yhdistelmiä ilmoitettiin 12,1 %:ssa osallistujista. Näiden joukossa kuumeen yhdistelmä päänsäryn, uupumuksen, lihaskivun tai nivelkivun kanssa olivat yleisimmät. Kaikkia muita oireita ilmoitettiin vähemmässä kuin 10 %:ssa chikungunyan kaltaisista haittavaikutuksista. Ilmoitetut oireet olivat yleensä lieviä. 1,8 % osallistujista ilmoitti vähintään yhden vakavan oireen, yleisimmin kuumeen tai nivelkivun. Chikungunyan kaltaisten haittavaikutusten alkamisajan mediaani oli 3 päivää rokotuksen jälkeen, ja loppumisajan mediaani oli 4 päivää. Vähintään 30 päivää kestäviä pidempiaikaisia oireita esiintyi 0,4 %:ssa osallistujista.
12–17-vuotiaat nuoret
Chikungunyan kaltaiset haittavaikutukset nuorissa (12–17-vuotiaat) arvioitiin post hoc -analyysissa, joka suoritettiin 502 osallistujalle nuorille suunnatusta vaiheen III tutkimuksesta. Chikungunyan kaltaiset haittavaikutukset nuorissa määriteltiin seuraavasti: kuume (≥37,8 °C/100,0 °F) ja vähintään yksi muu akuutin chikungunya-sairauden yhteydessä ilmoitettu oire, mukaan lukien nivelkipu tai niveltulehdus, lihaskipu, päänsärky, tai tietyt hermostolliset tai silmien oireet, ihottuma tai tietyt iho-oireet, jotka esiintyivät 30 päivän kuluessa rokotuksesta riippumatta yksittäisten oireiden alkamisajankohdasta, vaikeusasteesta tai kestosta. Chikungunyan kaltaisia haittavaikutuksia ilmoitettiin 23,1 %:ssa nuorista. Näiden joukossa kuumeen yhdistelmä päänsäryn, lihaskivun, uupumuksen tai nivelkivun kanssa olivat yleisimmät. Kaikkia muita oireita ilmoitettiin vähemmässä kuin 10 %:ssa osallistujista. 3,6 % osallistujista ilmoitti vähintään yhden vaikean oireen, yleisimmin kuumeen tai päänsäryn. Chikungunyan kaltaisten haittavaikutusten mediaanialkamisaika oli 2 päivää rokotuksen jälkeen, ja mediaaniaika niiden loppumiseen oli 4 päivää. Pidempikestoisia chikungunyan kaltaisia haittavaikutuksia ei ilmoitettu nuorissa (eli vähintään yksi oire kestää ≥30 vuorokautta).
Lähtötilanteessa seropositiiviset nuoret
Chikungunyan kaltaisia haittavaikutuksia kokeneiden osallistujien osuus oli suurempi lähtötilanteessa seronegatiivisissa osallistujissa kuin lähtötilanteessa seropositiivisissa osallistujissa, jotka rokotettiin IXCHIQ:lla.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Kliinisissä tutkimuksissa ei ole raportoitu yliannostustapauksia. Yliannostustapauksissa suositellaan elintoimintojen seurantaa ja mahdollista oireenmukaista hoitoa.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Muut virusrokotteet, ATC-koodi: Ei vielä määritelty
Vaikutusmekanismi
IXCHIQ sisältää elävää heikennettyä ECSA/IOL-genotyypin CHIKV-virusta. Tarkkaa suojamekanismia CHIKV-tartuntaa ja/tai -tautia vastaan ei ole määritetty. IXCHIQ aiheuttaa neutraloivien vasta-aineiden muodostumista CHIKV-virusta vastaan.
Immunogeenisuus
IXCHIQ:lle ei ole saatavilla tehokkuustietoja. IXCHIQ:n kliininen tehokkuus pääteltiin rokotuksen jälkeisestä CHIKV-spesifisestä neutraloivien vasta-aineiden titteriraja-arvosta.
CHIKV-spesifinen neutraloivien vasta-aineiden titteriraja-arvo ≥150 μPRNT50 valittiin suojauksen sijaismarkkeriksi eli serovasteeksi. Tämä raja-arvo määritettiin kädellisille suoritetusta passiivisen tartunnan tutkimuksesta, jossa ≥150 titterin koe-eläimet olivat suojattuja luonnonvaraisille CHIKV-tartunnoille ja joiden veressä ei havaittu virusta 14 päivää altistuksen jälkeen. Lisäksi raja-arvoa tukevat ihmisillä suoritetun prospektiivisen seroepidemilogisen tutkimuksen tulokset.
VLA1553-301 oli placebokontrolloitu tutkimus, jossa arvioitiin immunogeenisuutta ja turvallisuutta yli 18-vuotiaissa yleisesti terveissä yksilöissä. Tutkimus suoritettiin Yhdysvalloissa. Tämän tutkimuksen osallistujia seurattiin 6 kuukauden ajan rokotuksen jälkeen. Vähintään 150 µPRNT50:n CHIKV-spesifisen vasta-ainetitterin eli serovasteluvun omaavien osallistujien osuus 28 päivää rokotuksen jälkeen IXCHIQ-koelinjan CHIKV-osallistujissa, jotka olivat negatiivisia CHIKV-viruksen neutraloivien vasta-aineiden osalta oli pääasiallinen päätetapahtuma.
Humoraalinen immuunivaste arvioitiin 362 osallistujassa (266 IXCHIQ-haarassa ja 96 placebohaarassa). Kaikki näistä osallistujista olivat negatiivisia lähtötilanteessa (ennen rokotusta) CHIKV-viruksen neutraloivien vasta-aineiden osalta. Tutkimuspopulaatio sisälsi 82 osallistujaa, jotka olivat iältään vähintään 65-vuotiaita (59 IXCHIQ-haarsssa ja 23 placebohaarassa).
VLA1553-321 oli placebokontrolloitu tutkimus, jossa arvioitiin immunogeenisuutta ja turvallisuutta 12–17-vuotiaissa yleisesti terveissä nuorissa. Tutkimus suoritettiin Brasiliassa, jossa chikungunya on endeeminen. Tämän tutkimuksen osallistujia seurattiin enintään 6 kuukauden ajan rokotuksen jälkeen. Pääasiallinen päätetapahtuma oli samankaltainen tutkimuksen VLA1553-301 kanssa.
Humoraalinen immuunivaste arvioitiin 351 osallistujassa (303 IXCHIQ-koelinjassa ja 48 placebokoelinjassa). 293 osallistujaa olivat lähtötilanteessa (ennen rokotusta) negatiivisia ja 58 osallistujaa positiivisia CHIKV-viruksen neutraloiville vasta-aineille.
Vasta-aineiden pysyvyyttä tutkittiin tutkimuksessa VLA1553-303 (tutkimuksen VLA1553-301 osallistujien osajoukon seuranta). Tietoja on saatavilla enintään 2 vuoden ajalta rokotuksen jälkeen. Tutkimuksessa VLA1553-321 seurataan 12–17-vuotiaiden nuorien potilasryhmää enintään 1 vuoden ajan rokotuksen jälkeen.
Serovasteluku
Aikuiset
Pivotaalitutkimuksessa VLA1553-301 98,9 %:lla osallistujista, joille annettiin IXCHIQ-rokote, esiintyi CHIKV-spesifisiä neutraloivia vasta-ainetittereitä tasolla ≥150 µPRNT50 28 päivää rokotuksen jälkeen. Tämä prosenttiosuus säilyi jopa 6 kuukautta rokotuksen jälkeen (96,3 %). Katso Taulukko 2. Vain 1,6 %:lla (n=4/251) IXCHIQ:lla rokotetuista osallistujista oli CHIKV-spesifisiä neutraloivia vasta-ainetittereitä tasolla ≥150 µPRNT50 päivänä 8. Yhdelläkään VLA1553-301:n placebohaaran osallistujalla ei ollut CHIKV-spesifistä vasta-ainevastetta tasolla ≥150 µPRNT50.
Taulukko 2. Serovasteluvut ajan kuluessa µPRNT50-analyysin mukaan tutkimuksessa VLA1553-301 (PP-populaatio)
Tutkimus | VLA1553-301 | |
Hoito | Placebo | IXCHIQ |
N=96 | N=266 | |
(n [95 %CI]) | (n (%) [95 %CI]) | |
Lähtötilanne, päivä 1 | 0 (0) | 0 (0) |
28 päivää rokotuksen jälkeen | 0 [0,0, 3,8] | 263 (98,9) [96,7, 99,8] |
6 kuukautta rokotuksen jälkeen | 0 [0,0, 4,0] | 233 (96,3) [93,1, 98,3] |
Lyhenteet: CI=luottamusväli; µPRNT50=50 % neutralisaatiotesti (micro plaque reduction neutralization test); PP=per protocol (populaatio)
12–17-vuotiaat nuoret
Nuorille suoritetussa tutkimuksessa VLA1553-321 98,8 %:lla (248/251) CHIKV-seronegatiivisista osallistujista, joille annettiin IXCHIQ-rokote, esiintyi CHIKV-spesifisiä neutraloivia vasta-ainetittereitä tasolla ≥150 µPRNT50 28 päivää rokotuksen jälkeen. Tämä prosenttiosuus säilyi jopa 6 kuukautta rokotuksen jälkeen (99,1 % (232/234)). 5,7 %:lla (n=14/245) IXCHIQ:lla rokotetuista CHIKV-seronegatiivisista osallistujista oli CHIKV-spesifisiä neutraloivia vasta-ainetittereitä tasolla ≥150 µPRNT50 päivänä 8. Valtaosalla CHIKV-seropositiivisista osallistujista (50/52) esiintyi CHIKV-spesifisiä neutraloivia vasta-ainetittereitä tasolla ≥150 µPRNT50 ennen IXCHIQ-rokotusta. Nämä prosenttiosuudet pysyivät samalla tasolla 28 päivää rokotuksen jälkeen (52/52) ja 6 kuukautta rokotuksen jälkeen (45/46).
Taulukko 3. Serovasteluvut ajan kuluessa µPRNT50-analyysin mukaan tutkimuksessa VLA1553-321 (PP-populaatio)
Tutkimus | VLA1553-321 | |||
Hoito | Placebo | IXCHIQ | ||
Seronegatiivinen N=42 | Seropositiivinen N=6 | Seronegatiivinen N=251 | Seropositiivinen N=52 | |
(n (%) [95 %CI]) | (n (%) [95 %CI]) | (n (%) [95 %CI]) | (n (%) [95 %CI]) | |
Lähtötilanne, päivä 1 | 0 (0) | 6 (100) | 0 (0) | 50 (96,2) |
28 päivää rokotuksen jälkeen | 1 (2,4 %) [0,1, 12,6] | 6 (100) [54,1, 100,0] | 248 (98,8) [96,5, 99,8] | 52 (100) [93,2, 100,0] |
6 kuukautta rokotuksen jälkeen | 0 (0 %) [0,0, 9,0] | 6 (100) [54,1, 100,0] | 232 (99,1) [96,9, 99,9] | 45 (97,8) [88,5, 99,9] |
Lyhenteet: CI=luottamusväli; µPRNT50=50 % mikroplakin vähentymiseen perustuva neutralisaatiotesti; PP=per protocol (populaatio)
Vasta-aineiden pysyvyys
Immuunivasteen pysyvyys arvioitiin 12 ja 24 kuukautta rokotuksen jälkeen VLA1553-303-tutkimuksessa. Kaikki osallistujat olivat negatiivisia lähtötilanteessa (ennen rokotusta) CHIKV-viruksen neutraloivien vasta-aineiden osalta. CHIKV-spesifisen neutraloivan vasta-ainevasteen tasolla ≥150 µPRNT50 omaavien osallistujien osuus oli 99,5 % (183/184) ja 97,1 % (268/276) 1 ja 2 vuotta rokotuksen jälkeen.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt lykkäyksen velvoitteelle toimittaa tutkimustulokset
IXCHIQ-rokotteen osalta yhdessä tai useammassa pediatrisen populaation osajoukossa aktiivisessa immunisaatiossa chikungunya-viruksen (CHIKV) aiheuttaman sairauden ehkäisemiseksi (katso pediatrista käyttöä koskevat tiedot kohdassa Annostus ja antotapa).
Farmakokinetiikka
Ei merkityksellinen rokotteille.
Prekliiniset tiedot turvallisuudesta
Toistuvan altistuksen aiheuttamaa toksisuutta, lisääntymis- ja kehitystoksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Lisääntymistoksisuuskoe naarasrotilla osoitti, että ennen ja jälkeen parittelun annettu IXCHIQ ei vaikuttanut lisääntymisparametreihin, synnytykseen eikä sikiön tai poikasen kehitykseen. Merkkejä IXCHIQ-spesifisten vasta-aineiden kulkeutumisesta istukan tai rintamaidon kautta havaittiin (katso kohta Raskaus ja imetys).
Farmaseuttiset tiedot
Apuaineet
Jauhe
Sakkaroosi
D-sorbitoli
L-metioniini
Magnesiumkloridi
Dikaliumvetyfosfaatti
Kaliumdivetyfosfaatti
Hiivassa (Saccharomyces cerevisiae) tuotettu yhdistelmä-DNA-tekniikalla valmistettu ihmisen albumiini (rHA)
Liuot in
Steriili injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
Avaamaton injektiopullo
2 vuotta.
Ei saa jäätyä.
Käyttökuntoon saattamisen jälkeen
Käyttökuntoon saattamisen jälkeen rokotteen on osoitettu säilyvän stabiilina 2 tunnin ajan joko jääkaappilämpötilassa (2–8 °C) tai huoneenlämmössä (15°C – 25°C). Tämän jälkeen käyttökuntoon saatettu rokote on hävitettävä.
Mikrobiologiselta kannalta rokote on käytettävä välittömästi ensimmäisen avaamisen jälkeen. Jos valmistetta ei käytetä välittömästi, käytönaikaiset säilytysajat ja säilytysolosuhteet ovat käyttäjän vastuulla.
Säilytys
Säilytä jääkaapissa (2–8 °C).
Ei saa jäätyä.
Säilytä alkuperäispakkauksessa. Herkkä valolle.
Kestoaikatutkimukset osoittavat rokotteen aineosien pysyvän stabiileina 24 tunnin ajan avaamattomissa injektiopulloissa 23–27 °C lämpötilassa. Tämän ajan jälkeen IXCHIQ-valmiste on käytettävä välittömästi tai hävitettävä. Nämä tiedot on tarkoitettu ainoastaan tiedoksi terveydenhuollon ammattilaisille väliaikaisten lämpötilapoikkeamien tapauksessa. Se ei ole suositeltava varastointi- tai toimituslämpötila.
Käyttökuntoon saatetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
IXCHIQ injektiokuiva-aine ja liuotin, liuosta varten
1 annos (ilman neulaa) (169,93 €)
PF-selosteen tieto
IXCHIQ-valmiste toimitetaan pakkauksessa, joka sisältää:
- Yhden annoksen injektiopullon (tyypin I lasia), joka sisältää rokotteen kylmäkuivattuna jauheena. Injektiopullo on suljettu kumitulpalla (bromobutyyli) ja alumiinisella repäistävällä korkilla, jossa on polypropeeninen turvasuljin.
- Yhden liuotteen, joka koostuu 0,5 ml:sta steriiliä injektionesteisiin käytettävää vettä esitäytetyssä ruiskussa, joka on suljettu kumitulpalla (Flurotec®) ja kärkisuojuksella (bromobutyyli) (pakattu ilman neuloja).
- Pakkauskoko: 1 injektiopullo jauhetta, 1 esitäytetty liuotinruisku ilman neuloja.
Valmisteen kuvaus:
Ennen käyttökuntoon saattamista kylmäkuivattu rokote on homogeeninen jauhe, joka on väriltään valkoisesta hieman kellertävään. Liuotin on kirkas ja väritön neste.
Käyttö- ja käsittelyohjeet
Valmistelu antamista varten
Rokote pitää saattaa käyttökuntoon ainoastaan toimitettua liuotinta käyttäen ennen antamista.
Käyttökuntoon saatettu rokote on kirkas, väritön tai kellertävä nesteliuos. Rokote on tarkastettava silmämääräisesti hiukkasten ja värimuutosten varalta ennen antoa, kun liuos ja pakkaus sen sallivat. Jos jompaa kumpaa havaitaan, rokotetta ei saa antaa.
Rokotteen käyttökuntoon saattamiseen on käytettävä sopivan pituista, vähintään 40 mm pituista (22-25G)-neulaa.
Ruisku on kertakäyttöinen.
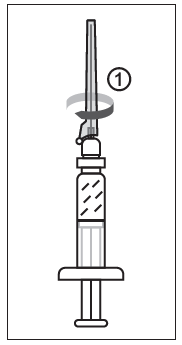
Kuva 1
1) Kun olet poistanut ruiskun korkin, kiinnitä neula ruiskun luer-liittimeen.
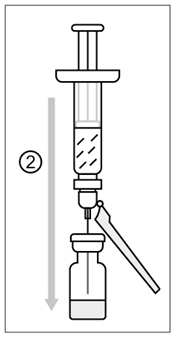
Kuva 2
2) Puhdista injektiopullon tulppa. Siirrä esitäytetyn ruiskun koko sisältö (liuote) hitaasti injektiopulloon (jauhe).
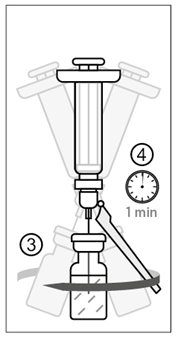
Kuva 3
3) Pyöritä injektiopulloa hellävaroen jauheen liuottamiseksi. Älä ravista injektiopulloa tai käännä sitä ylösalaisin.
4) Odota pyörittämisen jälkeen vähintään minuutin ajan rokotteen käyttökuntoon saattamiseksi loppuun.
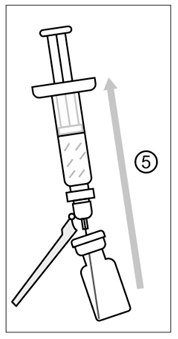
Kuva 4
5) Kun rokote on saatettu käyttökuntoon, kallista injektiopulloa hieman ja vedä koko käyttökuntoon saatettu rokote (0,5 ml) samaan ruiskuun. Älä käännä injektiopulloa ylösalaisin varmistaaksesi, että koko käyttökuntoon saatettu rokote saadaan vedetyksi ruiskuun.
Anna IXCHIQ käyttökuntoon saattamisen jälkeen lihaksensisäisesti kahden tunnin kuluessa. Jos käyttökuntoon saatettua rokotetta ei käytetä 2 tunnin kuluessa, hävitä se (ks. kohta Kestoaika).
Hävittäminen
Tämä tuote sisältää muuntogeenisiä organismeja (GMO).
Käyttämätön rokote tai jäte on hävitettävä paikallisten lääkejätteitä koskevien vaatimusten mukaisesti. Mahdollisesti läikkynyt rokote pitää siivota pois välittömästi ja desinfioida paikallisten käytäntöjen mukaisesti. Hävitä käytetty ruisku ja neula terävien esineiden keräysastiaan, kuten suljettavaan puhkaisunkestävään astiaan.
Korvattavuus
IXCHIQ injektiokuiva-aine ja liuotin, liuosta varten
1 annos
- Ei korvausta.
ATC-koodi
J07BP01
Valmisteyhteenvedon muuttamispäivämäärä
12.09.2025
Yhteystiedot
SE-105 21 Stockholm
Sverige
+46 8-121 015 00
www.valneva.com
Lääketieteellisissä kysymyksissä puh: +358 (0) 306 705 310 (arkisin klo 8-16) sekä sähköpostitse infofinland@valneva.com
