CATIOLANZE silmätipat, emulsio 50 mikrog/ml
Vaikuttavat aineet ja niiden määrät
1 ml silmätippaemulsiota sisältää 50 mikrogrammaa latanoprostia.
Yksi 0,3 ml:n kerta-annospakkaus silmätippaemulsiota sisältää 15 mikrogrammaa latanoprostia.
Yksi tippa sisältää noin 1,65 mikrogrammaa latanoprostia.
Apuaine(et), joiden vaikutus tunnetaan:
Yksi ml emulsiota sisältää 0,05 mg setalkoniumkloridia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Silmätipat, emulsio
Kliiniset tiedot
Käyttöaiheet
Catiolanze on tarkoitettu kohonneen silmänpaineen alentamiseen aikuispotilaille, joilla on avokulmaglaukooma tai silmän hypertensio.
Catiolanze on tarkoitettu kohonneen silmänpaineen alentamiseen vähintään 4-vuotiaille lapsille ja nuorille, joilla on silmän hypertensio ja lasten glaukooma.
Annostus ja antotapa
Annostus
Lapsipotilaat voivat käyttää Catiolanzea 4-vuotiaista alkaen aikuispotilaiden annostuksella.
Hoitosuositus on yksi silmätippa sairaaseen/-isiin silmään/-iin kerran vuorokaudessa.
Optimaalinen vaikutus saavutetaan annostelemalla Catiolanze iltaisin.
Catiolanze-valmistetta saa annostella enintään kerran vuorokaudessa, sillä useammin tapahtuvan annostelun on todettu heikentävän Catiolanzen silmänpainetta alentavaa vaikutusta.
Väliin jäänyt annos
Jos yksi annos jää väliin, hoitoa tulee jatkaa seuraavalla annoksella normaaliin tapaan.
Pediatriset potilaat
Catiolanze-valmisteen turvallisuutta alle nelivuotiailla lapsilla ei ole varmistettu, koska formulaatiosta (emulsio) ei ole tietoja. Tällä hetkellä saatavilla olevat turvallisuustiedot vaikuttavasta aineesta, latanoprostista, kuvataan kohdissa Haittavaikutukset ja Farmakodynamiikka.
Antotapa
Silmän pinnalle.
Vain kertakäyttöön.
Yhden kerta-annospakkauksen sisältö riittää molempien silmien hoitamiseen.
Kuten muitakin silmätippoja käytettäessä, mahdollisen elimistöön imeytymisen vähentämiseksi suositellaan kyynelpussin painamista sisemmästä silmänurkasta yhden minuutin ajan. Silmänurkkaa on painettava heti jokaisen tipan annostelun jälkeen.
Piilolinssit on poistettava ennen silmätippojen annostelua. Ne voi laittaa takaisin silmiin 15 minuutin kuluttua annostelusta.
Jos käytetään useampaa kuin yhtä paikallisesti silmään annosteltavaa lääkevalmistetta, lääkevalmisteiden antovälin on oltava vähintään 5 minuuttia. Catiolanze on annettava viimeiseksi (ks. kohta Yhteisvaikutukset).
Tämä lääkevalmiste on steriiliä valkoista nestettä, joka ei sisällä säilytysainetta. Yhden kerta-annospakkauksen sisältämä neste on käytettävä välittömästi pakkauksen avaamisen jälkeen tiputtamalla lääke sairaaseen silmään / sairaisiin silmiin. Koska steriiliyttä ei voida ylläpitää kerta-annospakkauksen avaamisen jälkeen, jäljelle jäänyt sisältö on hävitettävä välittömästi lääkkeen antamisen jälkeen.
Potilaita on neuvottava:
- varomaan koskettamasta pipetin kärjellä silmää tai silmäluomia
- käyttämään silmätippaemulsio välittömästi kerta-annospakkauksen avaamisen jälkeen ja hävittämään kerta-annospakkaus käytön jälkeen.
Vasta-aiheet
Yliherkkyys latanoprostille tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Silmän värin muuttuminen
Catiolanze voi vähitellen muuttaa silmien väriä lisäämällä ruskean pigmentin määrää värikalvossa. Ennen hoidon aloittamista potilaalle on kerrottava silmien pysyvän värinmuutoksen mahdollisuudesta. Toispuolinen hoito voi johtaa pysyvään heterokromiaan.
Latanoprostin aiheuttamaa silmien värinmuutosta on esiintynyt etupäässä potilailla, joilla on monivärinen värikalvo, esimerkiksi siniruskea, harmaa-ruskea, keltaruskea tai vihreä-ruskea. Latanoprostitutkimuksissa muutos ilmeni tavallisesti ensimmäisten 8 hoitokuukauden aikana, joskus harvemmin toisen tai kolmannen vuoden aikana mutta ei enää neljännen hoitovuoden jälkeen. Värikalvon pigmentaatiomuutosten eteneminen hidastuu ajan myötä ja pysähtyy viidenteen vuoteen mennessä. Lisääntyneen pigmentaation vaikutusta on arvioitu pisimmillään viiden vuoden ajan. Latanoprostin avoimessa 5-vuotisessa turvallisuustutkimuksessa värikalvon pigmentaatiomuutos ilmeni 33 %:lla potilaista (ks. kohta Haittavaikutukset). Värikalvon värinmuutos on useimmissa tapauksissa lievä eikä sitä usein havaita kliinisesti. Värikalvon värinmuutoksen ilmaantuvuus oli 7–85 % potilailla, joilla oli monivärinen värikalvo. Ilmaantuvuus oli suurin potilailla, joiden värikalvo oli keltaruskea. Värinmuutoksia ei ole havaittu lainkaan potilailla, joilla on tasaisen siniset silmät, ja muutoksia on todettu vain harvoin potilailla, joilla on tasaisen harmaat, vihreät tai ruskeat silmät.
Latanoprostihoidon aiheuttama värinmuutos johtuu värikalvon stroomassa olevien melanosyyttien lisääntyneestä melaniinisisällöstä, ei melanosyyttien määrän lisääntymisestä. Mustuaista ympäröivä ruskea pigmentaatio leviää tyypillisesti konsentrisesti hoidetun silmän reunaosia kohti, mutta myös koko värikalvo tai osa siitä voi muuttua ruskehtavammaksi. Värikalvon ruskean pigmentin ei ole havaittu lisääntyvän edelleen hoidon päätyttyä. Muutokseen ei ole liittynyt muita oireita eikä patologisia muutoksia tähän mennessä tehdyissä kliinisissä tutkimuksissa.
Latanoprostihoito ei ole vaikuttanut värikalvon neevuksiin eikä pilkkuihin. Latanoprostilla hoidettaessa ei pigmentin ole kliinisissä tutkimuksissa havaittu kertyvän trabekkelikudokseen eikä muualle silmän etukammioon. Latanoprostihoidon viisivuotisen kliinisen kokemuksen perusteella värikalvon lisääntyneellä pigmentaatiolla ei ole osoitettu kliinisesti haitallisia seurauksia. Catiolanze-hoitoa voidaan jatkaa, vaikka värikalvon pigmentaatiota ilmenisikin. Potilasta on kuitenkin seurattava säännöllisesti ja Catiolanze-hoito voidaan keskeyttää, jos kliininen tila sitä vaatii.
Krooninen sulkukulmaglaukooma
Kokemukset latanoprostin käytöstä kroonisessa sulkukulmaglaukoomassa, pseudofakiapotilaiden avokulmaglaukoomassa ja pigmenttiglaukoomassa ovat vähäisiä. Latanoprostista ei ole kokemuksia tulehduksellisessa ja neovaskulaarisessa glaukoomassa tai silmän tulehduksellisissa tiloissa. Latanoprostilla ei ole vaikutusta tai vain vähäinen vaikutus mustuaiseen, mutta kokemuksia sen käytöstä sulkukulmaglaukooman akuuttikohtauksissa ei ole. Siksi suositellaan, että Catiolanze-valmistetta käytetään näissä sairauksissa varoen, kunnes saadaan lisäkokemusta.
Kaihileikkaus
Tutkimustiedot latanoprostin käytöstä kaihileikkauksen perioperatiivisena aikana ovat vähäisiä. Varovaisuutta on noudatettava Catiolanze-valmisteen käytössä tällaisille potilaille.
Aiempi herpeskeratiitti sekä afakia- ja pseudofakiapotilaat
Catiolanze-valmistetta on käytettävä varovaisuutta noudattaen potilaille, joilla on ollut herpeskeratiitti. Käyttöä on vältettävä potilaille, joilla on aktiivinen herpes simplex -viruksen aiheuttama keratiitti sekä potilaille, joilla on ollut erityisesti prostaglandiinianalogeihin liittyvä uusiutuva herpeskeratiitti.
Makulaturvotus ja kystoidi makulaturvotus
Makulaturvotusta (ks. kohta Haittavaikutukset) on latanoprostihoidossa raportoitu esiintyvän pääasiassa afakiapotilailla ja pseudofakiapotilailla, joilla on repeytymä mykiökotelon takaosassa tai etukammiolinssit, sekä potilailla, joilla on kystoidin makulaturvotuksen tunnettuja riskitekijöitä (kuten diabeettinen retinopatia ja verkkokalvon laskimon tukos). Varovaisuutta on noudatettava Catiolanze-valmisteen käytössä potilailla, joilla on afakia; pseudofakia ja repeytymä mykiökotelon takaosassa tai etukammiolinssit; tai joilla on tunnettuja kystoidin makulaturvotuksen riskitekijöitä.
Värikalvon/suonikalvoston tulehdus
Catiolanze-valmistetta voidaan käyttää varovaisuutta noudattaen potilaille, joilla on värikalvon/suonikalvoston tulehdukselle tunnetusti altistavia riskitekijöitä.
Astmapotilaat
Kokemukset latanoprostin käytöstä astmapotilaille ovat vähäisiä, mutta myyntiluvan saamisen jälkeen muutamissa tapauksissa on ilmoitettu astman ja/tai hengenahdistuksen pahenemisesta latanoprostihoidossa. Siksi astmapotilaiden hoidossa on noudatettava varovaisuutta, kunnes asiasta on saatu riittävästi kokemusta (ks. myös kohta Haittavaikutukset).
Silmäkuoppaa ympäröivän ihon värjäytyminen
Silmäkuoppaa ympäröivän ihoalueen värjäytymistä on havaittu: useimmiten sitä on raportoitu japanilaispotilailla. Tähänastisen kokemuksen perusteella silmäkuoppaa ympäröivän ihon värjäytyminen ei ole pysyvää, ja se on joissakin tapauksissa hävinnyt latanoprostihoidon vielä jatkuessa.
Silmäripsien muutokset
Latanoprosti voi muuttaa vähitellen silmäripsiä ja ohuita ihokarvoja (vellus) hoidettavassa silmässä ja sitä ympäröivällä alueella; silmäripset tai karvat voivat pidentyä, paksuuntua, tummentua, tuuhentua, ja silmäripset voivat kasvaa väärään suuntaan. Silmäripsimuutokset korjaantuvat, kun latanoprostihoito lopetetaan.
Muuta
Latanoprostin samanaikaista käyttöä prostaglandiinien, prostaglandiinianalogien tai prostaglandiinijohdannaisten kanssa ei suositella (ks. kohta Yhteisvaikutukset).
Apuaine, joiden vaikutus tunnetaan
Catiolanze sisältää setalkoniumkloridia, joka voi aiheuttaa silmä-ärsytystä.
Yhteisvaikutukset
Yhteisvaikutustutkimuksia ei ole suoritettu aikuisilla.
Silmänpaineen paradoksaalista kohoamista on ilmoitettu, kun silmään on annettu kahta prostaglandiinianalogia samanaikaisesti. Siksi kahden tai useamman prostaglandiinin, prostaglandiinianalogin tai prostaglandiinijohdoksen käyttöä ei suositella.
Pediatriset potilaat
Yhteisvaikutustutkimuksia ei ole suoritettu pediatrisilla potilailla.
Raskaus ja imetys
Raskaus
Tämän lääkevalmisteen turvallisuutta raskaana oleville naisille ei ole varmistettu. Valmisteella saattaa olla mahdollisia haitallisia farmakologisia vaikutuksia raskauden kulkuun, syntymättömään tai vastasyntyneeseen lapseen. Tämän vuoksi Catiolanze-valmistetta ei pidä käyttää raskauden aikana.
Imetys
Latanoprosti ja sen metaboliitit saattavat siirtyä äidinmaitoon, minkä vuoksi Catiolanze-valmistetta ei pidä käyttää imettäville naisille tai imettäminen tulisi lopettaa.
Hedelmällisyys
Eläinkokeissa latanoprostin ei ole todettu vaikuttavan urosten tai naaraiden hedelmällisyyteen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Catiolanze-valmisteella on vähäinen vaikutus ajokykyyn ja koneidenkäyttökykyyn. Muiden silmälääkkeiden tavoin Catiolanze-silmätippojen annostelu voi aiheuttaa näkökyvyn tilapäistä sumenemista. Potilaiden pitäisi ajaa autoa tai käyttää koneita vasta kun näkökyky on ennallaan.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Suurin osa haittavaikutuksista liittyy silmiin. Säilytysainetta sisältävän latanoprostisilmätippaliuoksen avoimessa 5-vuotisessa turvallisuustutkimuksessa ilmeni värikalvon pigmentaatiomuutos 33 %:lla potilaista (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Muut silmiin kohdistuvat haittavaikutukset ovat yleensä ohimeneviä ja ilmenevät annostelun yhteydessä.
Catiolanze-valmisteelle spesifistä turvallisuustietoa on saatavana 330 potilaalta. Yleisimpiä haittavaikutuksia olivat silmien hyperemia (1,6 %) ja sidekalvon hyperemia (1,0 %). Erityisesti Catiolanze-valmisteella tehdyissä tutkimuksissa ei havaittu vakavia haittavaikutuksia.
Pitkän aikavälin turvallisuustietoja on saatavana vaiheen 3 tutkimuksesta, jossa 118 potilaalle annettiin Catiolanzea vähintään 360 päivän ajan. Pitkän aikavälin turvallisuusprofiili ei eronnut havainnoista ensimmäisten 3 kuukauden hoidon aikana. Yleisimmät silmään liittyvät haittavaikutukset, joita raportoitiin pitkäkestoisessa käytössä olivat silmien ja sidekalvon hyperemia (4,4 %), outo tunne silmässä (2,2 %) ja silmäripsien kasvu (2,2 %).
Taulukko haittavaikutuksista
Seuraavassa taulukossa esitetään haittavaikutukset säilytysainetta sisältävälle latanoprostisilmätippaliuokselle kliinisistä lääketutkimuksista ja markkinoille tulon jälkeisistä tiedoista. Catiolanze-silmätippaemulsiolla suoritetuissa kliinisissä lääketutkimuksissa havaitut haittavaikutukset, joiden esiintyvyys eroaa ensin mainituissa tutkimuksissa havaitusta, on esitetty taulukossa merkinnällä ¥.
Haittavaikutukset on luokiteltu esiintymistiheyksittäin seuraavasti: hyvin yleiset (≥ 1/10), yleiset (≥ 1/100, < 1/10), melko harvinaiset (≥ 1/1 000, < 1/100), harvinaiset (≥ 1/10 000, < 1/1 000) ja hyvin harvinaiset (< 1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä esiintymistiheyden arviointiin).
Elin- järjestelmä | Hyvin yleiset ≥ 1/10 | Yleiset ≥ 1/100, < 1/10 | Melko harvinaiset ≥ 1/1 000, < 1/100 | Harvinaiset ≥ 1/10 000, < 1/1 000 | Hyvin harvinaiset < 1/10 000 |
| Infektiot | Herpeskeratiitti*§ | ||||
| Hermosto | Päänsärky*, heitehuimaus* | ||||
| Silmät | Värikalvon hyperpigmentaatio | Lievä tai kohtalainen silmän sidekalvon verekkyys¥ Silmä-ärsytys (polttelu, karheus, kutina, pistely ja vierasesine- tuntemus ja outo tuntemus)¥; Pisteinen sarveiskalvotulehdus useimmiten oireeton; silmäkipu; Valonarkuus; Silmän sidekalvotulehdus* | Silmäluomien turvotus¥; silmäripsien ja ohuiden ihokarvojen (vellus) muutokset silmä luomessa (silmäripsien piteneminen, paksuneminen, pigmentaatio ja tuuheneminen)¥; silmäluomitulehdus¥; silmien kuivuminen; keratiitti*; näön hämärtyminen¥; makulaturvotus, mukaan lukien kystoidi makulaturvotus*; uveiitti* | Värikalvon tulehdus*, sarveiskalvon edeema*, sarveiskalvon eroosio, periorbitaalinen edeema, trikiaasi*, distikiaasi, iiriskysta*§, paikallistunut ihoreaktio silmäluomilla, silmäluomien ihon tummeneminen, silmän sidekalvon pseudopemfigoidi*§ | Periorbitaalisia ja luomimuutoksia, jotka johtavat yläluomen sulkuksen syvenemiseen |
| Sydän | Angina, sydämentykytys* | Epästabiili angina | |||
| Hengityselimet, rintakehä ja välikarsina | Astma*, hengenahdistus* | Astman paheneminen | |||
| Ruoansulatuselimistö | Pahoinvointi*, oksentelu* | ||||
| Iho ja ihonalaiskudos | Ihottuma | Kutina | |||
| Luusto, lihakset ja sidekudos | Lihaskipu*, nivelkipu* | ||||
| Yleisoireet ja antopaikassa todettavat haitat | Rintakipu* |
*Valmisteen markkinoille tulon jälkeen tunnistettu haittavaikutus
§ Haittavaikutuksen esiintyvyys arvioitu kolmen säännön (The Rule of 3) mukaan
¥ Haittavaikutuksen esiintyvyys arviotu erityisesti Catiolanze-silmätippaemulsiolla tehdyissä tutkimuksissa
Valikoituien haittavaikutusten kuvaus
Ei ole tietoa.
Pediatriset potilaat
Kahdessa lyhytkestoisessa kliinisessä tutkimuksessa (≤ 12 viikkoa), joihin osallistui 93 (25 ja 68) lasta, joita hoidettiin säilytysainetta sisältävällä latanoprostisilmätippaliuoksella, turvallisuusprofiili oli samanlainen kuin aikuisilla eikä uusia haittavaikutuksia todettu.
Myös lyhyen aikavälin turvallisuusprofiilit pediatristen potilaiden alaryhmissä olivat samanlaiset (ks. kohdat Annostus ja antotapa ja Farmakodynamiikka). Säilytysainetta sisältävällä latanoprostilla hoidetuilla lapsilla todettiin haittavaikutuksina nasofaryngiittia ja kuumetta useammin kuin aikuisilla.
Pediatrisilla potilailla ei ole tehty erityisesti Catiolanze-valmistetta koskevia tutkimuksia.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Silmän pinnalle laittamisen aiheuttama yliannostus on epätodennäköistä. Jos yliannostus tapahtuu, hoidon on oltava oireenmukaista.
Oireet
Silmän ärsytystä ja sidekalvon verekkyyttä lukuun ottamatta latanoprostin yliannostuksen ei tiedetä aiheuttavan muita silmään kohdistuvia haittavaikutuksia.
Hoito
Tämän lääkevalmisteen mahdollista yliannostusta hoidetaan oireenmukaisesti.
Pediatriset potilaat
Yllämainitut periaatteet pätevät myös yliannostuksen hoitoon pediatrisilla potilailla.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Silmätautien lääkkeet: Glaukoomalääkkeet ja mioosin aiheuttavat valmisteet.
ATC-koodi: S01EE01
Vaikutusmekanismi
Latanoprostin vaikuttava aine, F2α-prostaglandiinianalogi, on selektiivinen FP- prostanoidireseptoriagonisti, joka alentaa silmänpainetta lisäämällä kammionesteen poistumista.
Tutkimukset viittaavat siihen, että valmiste vaikuttaa pääasiallisesti lisäämällä uveoskleraalista ulosvirtausta, mutta myös ulosvirtauksen helpottumista (poistumisvastuksen vähenemistä) on raportoitu.
Farmakodynaamiikka
Silmänpaineen aleneminen alkaa noin kolmesta neljään tuntia annon jälkeen ja maksimivaikutus saavutetaan kahdeksasta kahteentoista tunnin kuluttua. Silmänpaine pysyy alentuneena vähintään 24 tuntia. Keskeiset tutkimukset ovat osoittaneet, että latanoprosti on tehokas monoterapiana. Lisäksi on tehty kliinisiä tutkimuksia yhdistelmäkäytöstä. Joissakin näistä tutkimuksista osoitettiin, että latanoprosti on tehokas yhdessä beetasalpaajien (timololin) kanssa. Lyhytaikaistutkimukset (1 tai 2 viikkoa) viittaavat siihen, että latanoprostin vaikutus on additiivinen yhdessä adrenergisten agonistien (dipivalyyliadrenaliini) ja suun kautta otettavien hiilihappoanhydraasiestäjien (asetatsoliamidi) kanssa sekä ainakin osittain additiivinen kolinergisten agonistien (pilokarpiini) kanssa.
Latanoprosti ei vaikuta merkitsevästi kammionestetuotantoon. Latanoprostin ei ole todettu vaikuttavan veri-kammioneste-esteeseen. Latanoprosti ei ole aiheuttanut fluoreseiinivuotoa ihmisen pseudofaakkisten silmien takakammiossa lyhytaikaishoidossa.Kliinisillä latanoprostiannoksilla ei ole todettu merkittäviä farmakologisia vaikutuksia sydän- ja verisuonijärjestelmään eikä hengityselimiin.
Kliininen teho ja turvallisuus
Catiolanze-valmisteen tehoa ja turvallisuutta on arviotu yhdessä keskeisessä vaiheen 3 tutkimuksessa.
Vaiheen 3 yksisokkoutetussa, satunnaistetussa, kontrolloidussa yhdenvertaisuustutkimuksessa arvioitiin Catiolanze-silmätippaemulsion turvallisuutta ja tehoa bentsalkoniyhdistesäilytysainetta sisältävään latanoprostisilmätippaliuokseen 386 aikuisella, joilla oli avokulmaglaukooma tai kohonnut silmänpaine. Ensisijainen päätetapahtuma oli silmänpaineen huippu ja pohja lähtötasolta hoitoryhmien välillä 12 viikon hoitojakson aikana, kun ennakkoon asetettu vähintään samanveroisuuden (non-inferiority) marginaali oli 1,5 mmHg. Ryhmien väliset demografiset ja sairaudelliset ominaisuudet olivat samankaltaisia iän kokonaiskeskiarvon ollessa 63,1 vuotta (keskihajonta 11,16). Suuri osa (61,5 %) tutkittavista oli naisia ja 96,4 % valkoisia. 75,8 %:lla (n = 291) potilaista oli primaarinen avokulmaglaukooma ja 21,1 %:lla (n = 81) kohonnut silmänpaine; loput potilaista sairastivat pseudoeksfoliatiivista glaukoomaa (2,1 %) ja pigmentaarista glaukoomaa (1,0 %).
Teho
Ensisijainen päätetapahtuma saavutettiin, sillä Catiolanzen vs. säilytysainetta sisältävän latanoprostin 0,005 % liuoksen yhdenvertaisuus osoitettiin viikon 12 kohdalla (ks. taulukko 1). Pienimmän neliösumman menetelmällä lasketut keskiarvot hoidon eroista Catiolanze-ryhmän ja säilytysainetta sisältävää latanoprostiliuosta saaneen ryhmän välillä huippu- ja pohja-aikapisteissä olivat Catiolanze-ryhmässä -0,6 (95 % luottamusväli -1,2; -0,1) ja latanoprostiliuosryhmässä -0,5 (95 % luottamusväli -1.0; 0.1).
Keskeisenä toissijaisena päätetapahtumana arvioitiin sarveiskalvon fluoreseiinivärjäyspisteiden muutosta lähtötasosta viikon 12 kohdalla modifioitua Oxfordin asteikkoa käyttäen tutkittavilla, joiden lähtötasopisteet olivat ≥ 1. Catiolanze osoitti paremmuutta vertailuryhmään nähden fluoreseiinivärjäyspisteiden paranemisessa viikon 12 kohdalla.
Taulukko 1 Tehotulokset: Havainnointitapausten (tutkittava silmä, FAS) MMRM
| Päätetapahtuma (viikon 12 arviointi) | Tulos | Catiolanze (N = 192) | Säilytysaineellinen latanoprostiliuos (N = 192) |
| Ensisijainen päätetapahtuma | Arviointi klo 9 | ||
| Silmänpaineen muutos lähtötasolta | N | 188 | 189 |
| LS-keskiarvo (SE) | -8,8 (0,25) | -8,2 (0,26) | |
| eron 95 % luottamusväli | -1,2; -0,1 | ||
| Arviointi klo 16 | |||
| N | 186 | 188 | |
| LS-keskiarvo (SE) | -8,6 (0,24) | -8,1 (0,25) | |
| eron 95 % luottamusväli | -1,0; 0,1 | ||
| Keskeinen toissijainen päätetapahtuma | N | 80 | 86 |
| CFS-pisteiden muutos lähtötasolta potilailla, joiden lähtötason CFS-pisteet ovat ≥1 | LS-keskiarvo (SE) | -0,71 (0,069) | -0,41 (0,077) |
| eron 95 % luottamusväli | -0,46; -0,13 | ||
| p-arvo | 0,0006 |
CFS, sarveiskalvon fluoreseiinivärjäys; CI, luottamusväli; FAS, täysi analyysijoukko; N, potilaiden lukumäärä; LS-keskiarvo: pienimmän neliösumman keskiarvo; MMRM, toistomittausten sekamallianalyysi; SE, keskihajonta.
Analyysi koskee kaikkia FAS-potilaita, joiden lähtötason CFS-pisteet ovat ≥ 1 Tilastollinen merkitsevyys (p < 0.05) lihavoitu.
Kuva Tehotulokset: Silmänpaineen RAW-keskimääräinen muutos lähtötasolta ja sen keskihajonta analyysikäynnin ja -ajan mukaisesti (tutkittava silmä, avoin tutkimuspopulaatio)
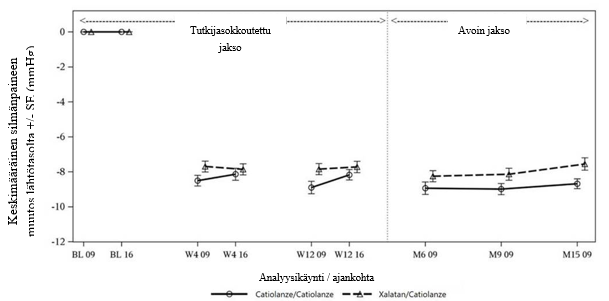
09/16 = klo 9 / klo 16; BL = lähtötaso; IOP = silmänpaine M = kuukausi; SE = keskihajonta; W = viikko.
Pediatriset potilaat
Catiolanze-silmätippaemulsiota ei ole tutkittu spesifisesti pediatrisilla potilailla.
Säilytysainetta sisältävän latanoprostisilmätippaliuoksen tuvallisuus ja teho ≤ 18-vuotiailla potilailla osoitettiin 12 viikkoa kestäneessä, kaksoissokkoutetussa kliinisessä tutkimuksessa, jossa latanoprostia verrattiin timololiin. Tutkimukseen osallistui 107 potilasta, joilla on silmän hypertensio ja lasten glaukooma. Tutkimukseen osallistuneiden vastasyntyneiden piti olla gestaatioiältään vähintään 36-viikkoisia. Potilaat saivat joko latanoprostia 50 mikrog/ml kerran vuorokaudessa tai timololia 0,5 % (tai alle 3-vuotiaat tutkittavat vaihtoehtoisesti 0,25 %) kahdesti vuorokaudessa. Ensisijainen tehomuuttuja oli keskimääräinen silmänpaineen (IOP) aleneminen viikon 12 kohdalla lähtöarvoon verrattuna. Keskimääräinen silmänpaineen aleneminen latanoprosti- ja timololiryhmissä oli samansuuruinen. Kaikissa tutkituissa ikäryhmissä (0–< 3-vuotiaat, 3–< 12-vuotiaat ja 12–18-vuotiaat) latanoprostia saaneiden keskimääräinen silmänpaineen aleneminen viikon 12 kohdalla oli samansuuruinen kuin timololiryhmässä. Hoidon tehoa koskevat tiedot ikäryhmän 0–< 3-vuotiaat osalta perustuvat kuitenkin vain 13:n latanoprostia saaneen tutkittavan tietoihin eikä kliinisessä lapsitutkimuksessa osoitettu oleellista tehoa 0–< 1-vuotiaiden ikäryhmän 4 potilaalla. Tietoja valmisteen käytöstä ennenaikaisesti syntyneillä (gestaatioiältään alle 36-viikkoisilla) ei ole.
Primaaria synnynnäistä/lapsuusiän glaukoomaa (PCG) sairastavien alaryhmässä silmänpaineen aleneminen oli saman suuruista sekä latanoprosti- että timololiryhmässä. Ei-PCG-tautimuotoa (esim. nuoruusiän avokulmaglaukooma, afaakkisen silmän glaukooma) sairastavien alaryhmässä tulokset olivat samanlaiset kuin PCG-ryhmässä.
Silmänpaineeseen kohdistuva vaikutus havaittiin ensimmäisen hoitoviikon jälkeen (ks. taulukko 2) ja vaikutus säilyi koko 12 viikkoa kestäneen tutkimuksen ajan samanlaisena kuin aikuisilla.
| Taulukko 2: Silmänpaineen aleneminen (mmHg) viikolla 12 lääkehoidon ja lähtötilanteen diagnoosin mukaan | ||||
| Latanoprosti n = 53 | Timololi n = 54 | |||
| Lähtötilanteen keskiarvo (SE) | 27,3 (0,75) | 27,8 (0,84) | ||
| Muutos lähtötilanteen keskiarvosta †(SE) viikolla 12 | -7,18 (0,81) | -5,72 (0,81) | ||
| p-arvo vs. timololi | 0,2056 | |||
| PCG n = 28 | Ei-PCG n = 25 | PCG n = 26 | Ei-PCG n = 28 | |
| Lähtötilanteen keskiarvo (SE) | 26,5 (0,72) | 28,2 (1,37) | 26,3 (0,95) | 29,1 (1,33) |
| Muutos lähtötilanteen keskiarvosta †(SE) viikolla 12 | -5,90 (0,98) | -8,66 (1,25) | -5,34 (1,02) | -6,02 (1,18) |
| p-arvo vs. timololi | 0,6957 | 0,1317 | ||
SE = Standard Error = keskivirhe
†Korjattu arvio, perustuu kovarianssianalyysiin (ANCOVA-malli).
Farmakokinetiikka
Latanoprosti (molekyylipaino 432,58) on isopropyyliesteriaihiolääke, joka on itsessään inaktiivinen, mutta joka hydrolysoiduttuaan latanoprostihapoksi muuttuu biologisesti aktiiviseksi.
Imeytyminen
Aihiolääke imeytyy hyvin sarveiskalvon läpi, ja kaikki kammionesteeseen siirtyvä latanoprosti hydrolysoituu sarveiskalvon läpäisyn aikana.
Jakautuminen
Ihmiselle tehdyt latanoprostitutkimukset osoittavat, että huippupitoisuus kammionesteessä saavutetaan noin 2 tunnin kuluttua paikalliskäytöstä. Paikalliskäytössä apinoilla latanoprosti jakautuu ensisijaisesti silmän etukammioon, sidekalvoon ja silmäluomiin. Takakammioon siirtyy vain erittäin pieniä lääkemääriä.
Biotransformaatio ja eliminaatio
Latanoprostihappo ei metaboloidu käytännöllisesti katsoen lainkaan silmässä, vaan pääasiassa maksassa. Puoliintumisaika plasmassa on ihmisellä 17 minuuttia. Eläintutkimuksissa päämetaboliiteilla, 1,2-dinor- ja 1,2,3,4-tetranormetaboliiteilla, ei ollut biologista vaikutusta lainkaan tai vaikutus oli vain vähäinen, ja ne kulkeutuivat pääasiassa virtsaan.
Pediatriset potilaat
Latanoprostihappopitoisuutta plasmassa selvitettiin avoimessa farmakokineettisessä tutkimuksessa, johon osallistui 22 aikuista ja 25 lasta (iältään vastasyntyneistä < 18-vuotiaisiin), joilla oli silmän hypertensio ja glaukooma. Kaikkien ikäryhmien potilaille annettiin latanoprostia 50 mikrog/ml yksi tippa vuorokaudessa vähintään 2 viikon ajan. Latanoprostihapon systeeminen altistus aikuisiin verrattuna oli suunnilleen 2 kertaa suurempi 3-< 12-vuotiaiden ryhmässä ja 6 kertaa suurempi alle 3-vuotiaiden ryhmässä, mutta systeemisten haittavaikutusten osalta laaja turvallisuusmarginaali säilyi (ks. kohta Yliannostus). Kaikissa ikäryhmissä mediaanihuippupitoisuus plasmassa saavutettiin 5 minuutin kuluttua annoksesta. Eliminaation puoliintumisajan mediaani plasmassa oli lyhyt (< 20 minuuttia), se oli samanlainen sekä lapsilla että aikuisilla, eikä vakaassa tilassa aiheuttanut latanoprostihapon kertymistä systeemiseen verenkiertoon.
Prekliiniset tiedot turvallisuudesta
Latanoprostin okulaarista ja systeemistä toksisuutta on tutkittu useilla eläinlajeilla. Latanoprosti on yleensä hyvin siedetty, ja silmään annetun kliinisen annoksen ja systeemisen toksisuuden terapeuttinen indeksi on vähintään 1 000-kertainen. Suuret, painokiloa kohti määritettävään kliiniseen annokseen verrattuna noin 100-kertaiset latanoprostiannokset lisäävät tutkitusti laskimonsisäisesti annosteltuna nukuttamattomien apinoiden hengitystiheyttä. Tämä on luultavasti osoitus lyhytkestoisesta bronkokonstriktiosta. Eläimillä tehdyissä tutkimuksissa latanoprostilla ei ole todettu herkistäviä ominaisuuksia.
Valmisteen ei ole todettu vaikuttavan toksisesti kaniinien ja apinoiden silmiin, kun annos on ollut enintään 100 mikrog/silmä/vrk (kliininen annos on noin 1,5 mikrog/silmä/vrk). Latanoprostin on kuitenkin osoitettu lisäävän värikalvon pigmentaatiota apinoilla. Pigmentaation lisääntymisen mekanismi näyttää perustuvan värikalvon melanosyyttien melaniinituotannon stimulaatioon ilman havaittavia proliferatiivisia muutoksia. Värikalvon värinmuutos voi olla pysyvä.
Pitkäaikaisissa latanoprostin silmätoksisuustutkimuksissa on myös osoitettu, että 6 mikrogrammaa latanoprostia silmää kohti vuorokaudessa suurentaa luomirakoa. Vaikutus on korjaantuva, ja sitä esiintyy kliinisen annostason ylittävillä annoksilla. Tätä vaikutusta ei ole tavattu ihmisellä.
28-päiväisessä silmätoksisuustutkimuksessa Catiolanze-valmisteen antaminen kahdesti päivässä 28 päivän ajan ei aiheuttanut merkittäviä paikallisia tai systeemisiä toksisia vaikutuksia kaneissa. Latanoprostihapon plasmapitoisuudet olivat mitättömiä 15 minuuttia viimeisen Catiolanze-annostuksen jälkeen.
Latanoprosti todettiin inaktiiviseksi bakteereilla tehdyissä takaisinmutaatiotesteissä, hiiren lymfooman geenimutaatiotestissä ja hiiren mikrotumatestissä. Ihmisen lymfosyyteissä havaittiin kromosomiaberraatioita in vitro. Samankaltaisia vaikutuksia havaittiin F2a-prostaglandiinilla (elimistön tuottama prostaglandiini), mikä osoittaa, että kyseessä on luokkavaikutus.
Rotilla tehdyt solun sisään ohjelmoitua DNA:n korjausmekanismia (unscheduled DNA synthesis) koskevat täydentävät in vitro / in vivo -mutageenisuustestit olivat negatiivisia ja osoittavat, ettei latanoprosti ole mutageeninen. Hiirillä ja rotilla tehdyt karsinogeenisuustutkimukset olivat negatiivisia.
Eläintutkimuksissa latanoprostin ei ole todettu vaikuttavan urosten eikä naaraiden hedelmällisyyteen. Rotilla tehdyssä alkiotoksisuustutkimuksessa laskimonsisäisesti annetun latanoprostin (5, 50 ja 250 mikrog/kg/vrk) ei havaittu aiheuttavan alkiotoksisuutta. Se vaikutti kuitenkin letaalisti kaniinin alkioihin, kun annos oli vähintään 5 mikrog/kg vuorokaudessa.
Latanoprostin 5 mikrog/kg:n vuorokausiannos (noin 100-kertainen kliiniseen annokseen verrattuna) aiheutti merkittävää alkio- ja sikiötoksisuutta, jolle oli ominaista myöhäisen resorption ja keskenmenojen lisääntynyt ilmaantuvuus ja sikiöpainon aleneminen.
Teratogeenisuusriskiä ei ole todettu.
Farmaseuttiset tiedot
Apuaineet
Keskipitkäketjuiset triglyseridit
Setalkoniumkloridi
Polysorbaatti 80
Glyseroli
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Ei ole
Kestoaika
3 vuotta.
Tämä lääkevalmiste on steriili valkoinen neste, joka ei sisällä säilöntäainetta. Kerta-annospakkaus ei ole enää steriili, kun se on avattu.
Avatut kerta-annospakkaukset on hävitettävä välittömästi käytön jälkeen.
Säilytys
Säilytä alle 30 °C:ssa.
Alumiinipussin avaamisen jälkeen kerta-annospakkauksia on säilytettävä pussissa haihtumisen estämiseksi sekä valolta suojaamiseksi.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
CATIOLANZE silmätipat, emulsio
50 mikrog/ml (L:ei) 30 x 0,3 ml (14,86 €), 90 x 0,3 ml (43,40 €)
PF-selosteen tieto
Matalatiheyksisestä polyetyleenistä valmistetut kerta-annospakkaukset suljetussa alumiini-polyetyleenifoliopussissa.
Yksi kerta-annospakkaus sisältää 0,3 ml. Yhdessä pussissa on 5 kerta-annospakkausta.
Pakkauskoot: 30, 60, 90 tai 120 kerta-annospakkausta
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Emulsio on valkoista nestettä, jonka pH on 4,0‑5,5 ja osmolariteetti 250‑310 mOsm/kg.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
CATIOLANZE silmätipat, emulsio
50 mikrog/ml 30 x 0,3 ml, 90 x 0,3 ml
- Ylempi erityiskorvaus (100 %). Glaukooma (114).
- Peruskorvaus (40 %).
ATC-koodi
S01EE01
Valmisteyhteenvedon muuttamispäivämäärä
09.02.2024
Yhteystiedot
Kelloportinkatu 1
33100 Tampere
03 284 8111
www.santen.fi
