FLUARIX TETRA injektioneste, suspensio, esitäytetty ruisku 15 mikrog HA/0,5 ml
Vaikuttavat aineet ja niiden määrät
Influenssavirus (inaktivoitu, fragmentit) seuraavista kannoista*:
A/Victoria/4897/2022 (H1N1)pdm09 ‑kannan kaltainen virus (A/Victoria/4897/2022, IVR-238) 15 mikrogrammaa HA:ta**
A/Thailand/8/2022 (H3N2) ‑kannan kaltainen virus (A/Thailand/8/2022, IVR-237)
15 mikrogrammaa HA:ta**
B/Austria/1359417/2021 ‑kannan kaltainen virus (B/Austria/1359417/2021, BVR-26) 15 mikrogrammaa HA:ta**
B/Phuket/3073/2013 ‑kannan kaltainen virus (B/Phuket/3073/2013, villi tyyppi) 15 mikrogrammaa HA:ta**
per 0,5 ml:n annos
* monistettu terveiden kanaparvien hedelmöitetyissä munissa
** hemagglutiniini
Rokote vastaa Maailman terveysjärjestön (WHO) suositusta (pohjoinen pallonpuolisko) ja EU:n suositusta kaudelle 2024/2025.
Fluarix Tetra ‑rokotteessa voi olla jäämiä valmistusprosessissa käytettävistä aineista eli kananmunasta (esim. ovalbumiini, kanan proteiinit), formaldehydistä, gentamisiinisulfaatista ja natriumdeoksikolaatista (ks. kohta Vasta-aiheet).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, suspensio, esitäytetty ruisku.
Kliiniset tiedot
Käyttöaiheet
Fluarix Tetra on tarkoitettu käytettäväksi aikuisten ja 6 kuukautta täyttäneiden lasten aktiiviseen immunisointiin rokotteen sisältämien influenssa A ‑viruksen kahden alatyypin ja influenssa B ‑viruksen kahden kannan aiheuttamaa influenssaa vastaan (ks. kohta Farmakodynamiikka).
Fluarix Tetra ‑rokotteen käytön täytyy perustua virallisiin suosituksiin.
On suositeltavaa uusia rokotus vuosittain ajankohtaisella rokotteella, sillä immuniteetti heikkenee rokotuksen jälkeisen vuoden aikana, ja kiertävät influenssakannat voivat muuttua vuosittain.
Annostus ja antotapa
Annostus
Aikuiset: 0,5 ml
Pediatriset potilaat
6 kuukautta täyttäneet lapset: 0,5 ml
Alle 9-vuotiaille lapsille, joita ei ole aiemmin rokotettu influenssaa vastaan, täytyy antaa toinen annos aikaisintaan 4 viikon kuluttua.
Alle 6 kuukauden ikäiset lapset: Fluarix Tetra ‑rokotteen turvallisuutta ja tehoa alle 6 kuukauden ikäisten lasten hoidossa ei ole varmistettu.
Antotapa
Rokote annetaan injektiona lihakseen.
Varotoimet ennen lääkevalmisteen käsittelyä tai antoa
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet lääkevalmisteen saattamisesta käyttökuntoon ennen lääkkeen antoa.
Vasta-aiheet
Yliherkkyys vaikuttaville aineille tai kohdassa Apuaineet mainituille apuaineille tai mille tahansa aineelle, josta voi olla jäämiä valmisteessa, kuten kananmunalle (ovalbumiini, kanan proteiinit), formaldehydille, gentamisiinisulfaatille ja natriumdeoksikolaatille.
Rokotusta on lykättävä, jos potilaalla on kuumetauti tai akuutti infektio.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Hyvän kliinisen käytännön mukaan potilaan esitiedot (etenkin tiedot aiemmista rokotuksista ja mahdollisista haittatapahtumista) käydään läpi ja hänelle tehdään terveystarkastus ennen rokottamista.
Kuten kaikkia pistettäviä rokotteita annettaessa, on aina oltava valmius ripeään, asianmukaiseen lääketieteelliseen hoitoon ja valvontaan siltä varalta, että rokotteen annon jälkeen kehittyy anafylaksiakohtaus.
Vasta-ainevaste voi olla riittämätön, jos potilaalla on endogeeninen tai iatrogeeninen immunosuppressiotila.
Fluarix Tetra ei suojaa kaikilta mahdollisilta influenssaviruskannoilta. Fluarix Tetra on tarkoitettu suojaamaan rokotteen valmistuksessa käytetyiltä viruskannoilta ja niitä läheisesti muistuttavilta kannoilta.
Kuten kaikkien rokotteiden yhteydessä, kaikille rokotetuille ei välttämättä kehity suojaavaa immuunivastetta.
Fluarix Tetra ‑rokotetta ei saa missään tilanteessa antaa verisuoneen.
Kuten kaikki lihakseen annettavat rokotteet, Fluarix Tetra on annettava varoen, jos potilaalla on trombosytopenia tai jokin hyytymishäiriö. Näillä potilailla voi esiintyä verenvuotoa, kun valmiste on annettu lihakseen.
Pyörtymistä voi esiintyä minkä tahansa rokotuksen jälkeen tai jopa ennen rokotusta, etenkin nuorilla. Kyseessä on psykogeeninen reaktio neulanpistoon. Tähän voi liittyä monia neurologisia löydöksiä kuten ohimeneviä näköhäiriöitä, parestesiaa ja toonis-kloonisia raajaliikkeitä potilaan toipuessa. On tärkeää ryhtyä varotoimiin pyörtymisestä johtuvien vammojen ehkäisemiseksi.
Vaikutus serologisiin testeihin
Ks. kohta Yhteisvaikutukset.
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per annos eli sen voidaan sanoa olevan ”natriumiton”.
Tämä lääkevalmiste sisältää kaliumia alle 1 mmol (39 mg) per annos, eli sen voidaan sanoa olevan ”kaliumiton”.
Yhteisvaikutukset
Fluarix Tetra voidaan antaa samanaikaisesti pneumokokkipolysakkaridirokotteen kanssa 50 vuotta täyttäneille potilaille (ks. kohta Farmakodynamiikka).
Fluarix Tetra voidaan antaa samanaikaisesti adjuvanttia sisältävän vyöruusurokotteen (Shingrix) tai koronavirustautiin 2019 (COVID-19) käytettävien mRNA-rokotteiden kanssa (ks. kohta Farmakodynamiikka).
Jos Fluarix Tetra annetaan yhtä aikaa toisen pistettävän rokotteen kanssa, rokotteet on aina annettava eri pistoskohtiin.
Pistoskohdan kivun esiintymistiheyttä ilmoitettiin inaktivoitua nelivalenttista influenssarokotetta (Fluarix Tetra) ja 23-valenttista pneumokokkipolysakkaridirokotetta (PPV23) yhtä aikaa saaneilla henkilöillä yhtä yleisesti kuin pelkkää PPV23-rokotetta saaneilla ja yleisemmin kuin pelkkää Fluarix Tetra -rokotetta saaneilla.
Samanaikaisesti Shingrix-rokotteen ja Fluarix Tetra -rokotteen saaneilla henkilöillä esiintyi väsymystä, päänsärkyä, lihaskipua, nivelkipua, maha-suolikanavan oireita (mukaan lukien pahoinvointia, oksentelua, ripulia ja/tai vatsakipua) ja vilunväristyksiä yleisemmin kuin pelkkää Fluarix Tetra -rokotetta saaneilla henkilöillä.
Influenssarokotuksen jälkeen on todettu vääriä positiivisia tuloksia HIV1:n, hepatiitti C:n ja etenkin HTLV1:n vasta-aineita mittaavissa serologisissa ELISA-testeissä. Western Blot ‑tekniikka paljastaa väärät positiiviset ELISA-testitulokset. Ohimenevät väärät positiiviset reaktiot voivat johtua rokotteen tuottamasta IgM-vasteesta.
Raskaus ja imetys
Raskaus
Inaktivoituja influenssarokotteita voidaan antaa raskauden kaikissa vaiheissa. Turvallisuudesta on saatavilla enemmän tietoa toisen ja kolmannen raskauskolmanneksen ajalta kuin ensimmäisen kolmanneksen ajalta. Inaktivoitujen influenssarokotteiden maailmanlaajuiseen käyttöön perustuvat tiedot eivät kuitenkaan viittaa siihen, että rokote aiheuttaisi haittaa sikiölle tai äidille.
Imetys
Fluarix Tetra ‑rokotetta voidaan käyttää imetyksen aikana.
Hedelmällisyys
Hedelmällisyyttä koskevia tietoja ei ole saatavilla.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Fluarix Tetra ‑rokotteella ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Kliiniset tutkimukset
Turvallisuusprofiilin yhteenveto
Rokotuksen jälkeen kaikissa ikäryhmissä ilmoitettiin yleisimpänä paikallisena haittavaikutuksena pistoskohdan kipua (15,6–40,9 %).
18 vuotta täyttäneillä aikuisilla yleisimmin ilmoitettuja rokotuksen jälkeen esiintyneitä yleisluonteisia haittavaikutuksia olivat väsymys (11,1 %), päänsärky (9,2 %) ja lihaskipu (11,8 %).
6–17-vuotiailla yleisimmin ilmoitettuja rokotuksen jälkeen esiintyneitä yleisluonteisia haittavaikutuksia olivat väsymys (12,6 %), lihaskipu (10,9 %) ja päänsärky (8,0 %).
3–5-vuotiailla yleisimmin ilmoitettuja rokotuksen jälkeen esiintyneitä yleisluonteisia haittavaikutuksia olivat uneliaisuus (9,8 %) ja ärtyneisyys (11,3 %).
6 kuukauden – 3 vuoden ikäisillä yleisimmin ilmoitettuja rokotuksen jälkeen esiintyneitä yleisluonteisia haittavaikutuksia olivat ärtyneisyys/ärtyisyys (14,9 %) ja ruokahaluttomuus (12,9 %).
Haittavaikutustaulukko
Fluarix Tetra ‑rokotteen käytön yhteydessä eri ikäryhmissä ilmoitetut haittavaikutukset kutakin annosta kohti esitetään seuraavia yleisyysluokkia käyttäen:
Hyvin yleinen (≥ 1/10)
Yleinen (≥ 1/100, < 1/10)
Melko harvinainen (≥ 1/1 000, < 1/100)
Harvinainen (≥ 1/10 000, < 1/1 000)
Hyvin harvinainen (< 1/10 000)
Aikuiset
Aikuisilla toteutetussa kliinisessä Fluarix Tetra ‑tutkimuksessa arvioitiin haittavaikutusten ilmaantuvuutta 18 vuotta täyttäneillä tutkittavilla, jotka saivat yhden annoksen Fluarix Tetra ‑rokotetta (N = 3 036) tai Fluarix-rokotetta (kolmivalenttinen influenssarokote) (N = 1 010).
Seuraavia haittavaikutuksia on ilmoitettu per annos:
Elinjärjestelmä | Yleisyys | Haittavaikutukset |
Hermosto | Yleinen | Päänsärky |
Melko harvinainen | Heitehuimaus1 | |
Ruoansulatuselimistö | Yleinen | Ruoansulatuskanavan oireet (mm. pahoinvointi, oksentelu, ripuli ja/tai vatsakipu) |
Iho ja ihonalainen kudos | Yleinen | Hikoilu2 |
Luusto, lihakset ja sidekudos | Hyvin yleinen | Lihaskipu |
Yleinen | Nivelkipu | |
Yleisoireet ja antopaikassa todettavat haitat | Hyvin yleinen | Pistoskohdan kipu, väsymys |
Yleinen | Pistoskohdan punoitus, pistoskohdan turvotus, vilunväristykset, kuume, pistoskohdan kovettuma2 | |
Melko harvinainen | Pistoskohdan verenpurkauma1, pistoskohdan kutina1 |
1Ilmoitettu spontaanisti haittavaikutuksena
2Ilmoitettu aiemmissa Fluarix-tutkimuksissa
Lapset (ikä 6 kuukautta – < 18 vuotta)
Kahdessa kliinisessä tutkimuksessa arvioitiin Fluarix Tetra ‑rokotteen reaktogeenisuutta ja turvallisuutta lapsilla, jotka saivat vähintään yhden annoksen Fluarix Tetra ‑rokotetta tai vertailurokotetta.
Yhteen tutkimukseen otettiin 3 – < 18 vuoden ikäisiä lapsia, jotka saivat Fluarix Tetra ‑rokotetta (N = 915) tai Fluarix-rokotetta (N = 912). Toiseen tutkimukseen otettiin 6 – < 36 kuukauden ikäisiä lapsia, jotka saivat Fluarix Tetra ‑rokotetta (N = 6 006) tai vertailurokotetta, joka ei ollut influenssarokote (N = 6 012) (ks. kohta Farmakodynamiikka).
Seuraavia haittavaikutuksia on ilmoitettu per annos:
Elinjärjestelmä | Haittavaikutukset | Esiintymistiheys | ||
6 – < 36 (kk) | 3 – < 6 (vuotta) | 6 – < 18 (vuotta) | ||
Aineenvaihdunta ja ravitsemus | Ruokahaluttomuus | Hyvin yleinen | Yleinen | Ei tied. |
Psyykkiset häiriöt | Ärtyneisyys/ärtyisyys | Hyvin yleinen | Hyvin yleinen | Ei tied. |
Hermosto | Uneliaisuus | Hyvin yleinen | Yleinen | Ei tied. |
Päänsärky | Ei tied. | Ei tied. | Yleinen | |
Ruoansulatuselimistö | Ruoansulatuskanavan oireet (mm. pahoinvointi, ripuli, oksentelu ja/tai vatsakipu) | Ei tied. | Ei tied. | Yleinen |
Iho ja ihonalainen kudos | Ihottuma1 | Ei ilm. | Melko harvinainen | Melko harvinainen |
Luusto, lihakset ja sidekudos | Lihaskipu | Ei tied. | Ei tied. | Hyvin yleinen |
Nivelkipu | Ei tied. | Ei tied. | Yleinen | |
Yleisoireet ja antopaikassa todettavat haitat | Kuume (≥ 38,0 °C) | Yleinen | Yleinen | Yleinen |
Väsymys | Ei tied. | Ei tied. | Hyvin yleinen | |
Pistoskohdan kipu | Hyvin yleinen | Hyvin yleinen | Hyvin yleinen | |
Pistoskohdan punoitus | Hyvin yleinen | Hyvin yleinen | Hyvin yleinen | |
Pistoskohdan turvotus | Yleinen | Hyvin yleinen | Hyvin yleinen | |
Vilunväristykset | Ei tied. | Ei tied. | Yleinen | |
Pistoskohdan kutina1 | Ei ilm. | Melko harvinainen | Melko harvinainen | |
Pistoskohdan kovettuma2 | Ei tied. | Yleinen | Yleinen | |
Ei tied. = ei kysytty tässä ikäryhmässä
Ei ilm. = ei ilmoitettu
1Ilmoitettu spontaanisti haittavaikutuksena
2Ilmoitettu aiemmissa Fluarix-tutkimuksissa
Markkinoille tulon jälkeen ilmoitetut tiedot
Seuraavia haittavaikutuksia on todettu Fluarix- ja/tai Fluarix Tetra ‑rokotteiden markkinoille tulon jälkeisessä seurannassa1.
Elinjärjestelmä | Yleisyys | Haittatapahtumat |
Veri ja imukudos | Harvinainen | Ohimenevä lymfadenopatia |
Immuunijärjestelmä | Harvinainen | Allergiset reaktiot (myös anafylaktiset reaktiot) |
Hermosto | Harvinainen | Neuriitti, akuutti disseminoitunut enkefalomyeliitti, Guillain–Barrén oireyhtymä2 |
Iho ja ihonalainen kudos | Harvinainen | Nokkosihottuma, kutina, punoitus, angioedeema |
Yleisoireet ja antopaikassa todettavat haitat | Harvinainen | Influenssan kaltainen sairaus, yleinen sairaudentunne |
1Kolme Fluarix-rokotteen influenssakannoista on mukana myös Fluarix Tetra ‑rokotteessa.
2Guillain–Barrén oireyhtymää on ilmoitettu spontaanisti Fluarix- ja Fluarix Tetra ‑rokotusten jälkeen, mutta syy-yhteyttä rokotusten ja Guillain–Barrén oireyhtymän välillä ei ole todettu.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista
seuraavalle taholle:
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Yliannostus ei todennäköisesti aiheuta mitään odottamattomia vaikutuksia.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Influenssarokotteet, ATC-koodi: J07BB02
Vaikutusmekanismi
Fluarix Tetra ‑valmisteella toteutetaan aktiivinen immunisaatio rokotteen sisältämiä neljää influenssaviruskantaa vastaan (kaksi A-alatyyppiä ja kaksi B-kantaa).
Fluarix Tetra indusoi humoraalista vasta-ainemuodostusta hemagglutiniineja vastaan. Nämä vasta-aineet neutraloivat influenssaviruksia.
Kun hemagglutinaatiota inhiboivien (HI) vasta-aineiden titterit on mitattu inaktivoituja influenssaviruksia sisältävän rokotteen annon jälkeen, vasta-ainetitterit eivät ole korreloineet spesifisesti suojaan influenssataudilta. HI-vasta-ainetittereitä on kuitenkin käytetty rokotteen tehon mittarina. Joissakin ihmisellä toteutetuissa altistustutkimuksissa HI-vasta-ainetitterit, joiden arvo on ollut ≥ 1:40, ovat tuottaneet suojan influenssataudilta jopa 50 %:lle tutkittavista.
Farmakodynaamiset vaikutukset
Teho 6–35 kuukauden ikäisillä lapsilla:
Fluarix Tetra ‑rokotteen tehoa arvioitiin kliinisessä D-QIV-004-tutkimuksessa. Kyseessä oli satunnaistettu, havainnoijasokkoutettu tutkimus, jonka vertailurokote ei ollut influenssarokote ja joka toteutettiin vuosien 2011–2014 influenssakausina. Terveet, 6–35 kk ikäiset tutkittavat satunnaistettiin suhteessa 1:1 saamaan Fluarix Tetra ‑rokotetta (N = 6 006) tai vertailurokotetta, joka ei ollut influenssarokote (N = 6 012). Lapset saivat 1 annoksen (jos heidät oli rokotettu aiemmin influenssaa vastaan) tai 2 annosta noin 28 päivän välein.
Fluarix Tetra ‑rokotteen tehon arviointiperusteena oli teho käänteiskopioijaentsyymiä hyödyntävällä polymeraasiketjureaktiolla (RT-PCR) vahvistetun influenssa A- ja/tai influenssa B ‑taudin ehkäisyssä (keskivaikeat tai vaikeat tapaukset ja kaikki vaikeusasteet) taudin aiheuttaneesta kausi-influenssakannasta riippumatta. Viikosta 2 rokotuksen jälkeen aina influenssakauden loppuun asti (noin 6 kk myöhemmin) tutkittavilta otettiin nenästä pyyhkäisynäytteitä kaikkien influenssan kaltaisten oireiden jälkeen, ja näytteet testattiin RT-PCR-tekniikalla influenssa A:n ja/tai B:n varalta. Kaikki RT-PCR-positiiviset näytteet testattiin edelleen soluviljelmässä. Tällöin arvioitiin elinkykyisyys ja se, vastasivatko viruskannat rokotteen viruskantoja.
Fluarix Tetra saavutti rokotteen tehon ennalta määritellyt ensisijaiset ja toissijaiset tavoitteet, jotka esitetään taulukossa 1.
Taulukko 1: Fluarix Tetra: Kohtausprosentit ja rokotteen teho 6–35 kk ikäisillä lapsilla (tutkimussuunnitelman mukainen tehon ATP-kohortti – aika tapahtumaan)
Fluarix Tetra | Aktiivinen vertailuvalmiste1 | Rokotteen teho | ||||||
N2 | n3 | Kohtausprosentti (n/N) (%) | N2 | n3 | Kohtausprosentti (n/N) (%) | % | lv | |
Influenssa, kaikki vaikeusasteet6 | ||||||||
RT-PCR-testillä vahvistettu | 5 707 | 344 | 6,03 | 5 697 | 662 | 11,62 | 49,8 | 41,8; 56,84 |
Viljelyllä vahvistettu | 5 707 | 303 | 5,31 | 5 697 | 602 | 10,57 | 51,2 | 44,1; 57,65 |
Viljelyllä vahvistettu, rokotteen kantoja vastaava | 5 707 | 88 | 1,54 | 5 697 | 216 | 3,79 | 60,1 | 49,1; 69,05 |
Keskivaikea tai vaikea influenssa7 | ||||||||
RT-PCR-testillä vahvistettu | 5 707 | 90 | 1,58 | 5 697 | 242 | 4,25 | 63,2 | 51,8; 72,34 |
Viljelyllä vahvistettu | 5 707 | 79 | 1,38 | 5 697 | 216 | 3,79 | 63,8 | 53,4; 72,25 |
Viljelyllä vahvistettu, rokotteen kantoja vastaava | 5 707 | 20 | 0,35 | 5 697 | 88 | 1,54 | 77,6 | 64,3; 86,65 |
RT-PCR-testillä vahvistettu alahengitysteiden tauti | 5 707 | 28 | 0,49 | 5 697 | 61 | 1,07 | 54,0 | 28,9; 71,05 |
RT-PCR-testillä vahvistettu akuutti välikorvatulehdus | 5 707 | 12 | 0,21 | 5 697 | 28 | 0,49 | 56,6 | 16,7; 78,85 |
lv: luottamusväli
1Lapsille annettiin ikää vastaava vertailurokote, joka ei ollut influenssarokote.
2Tutkittavien määrä tehon ja tapahtumaan kuluneen ajan ATP-kohortissa. Tähän kohorttiin otettiin tutkittavat, jotka täyttivät kaikki soveltuvuuskriteerit, joita seurattiin tehon suhteen ja jotka noudattivat tutkimussuunnitelmaa kyseiseen episodiin asti.
3Tutkittavat, jotka ilmoittivat vähintään yhden tapauksen raportointiaikana
4Kaksitahoinen 97,5 % luottamusväli
5Kaksitahoinen 95 % luottamusväli
6 Influenssa (kaikki vaikeusasteet) määriteltiin influenssan kaltaiseksi tautiepisodiksi (ts. kuume ≥ 38 °C ja jokin seuraavista kriteereistä: yskä, nuha, nenän tukkoisuus tai hengitysvaikeus) tai influenssavirusinfektion seuraukseksi (akuutti välikorvatulehdus tai alahengitysteiden tauti).
7 Keskivaikeiden tai vaikeiden influenssatapausten ryhmä oli influenssan (kaikki vaikeusasteet) alaryhmä, jossa täyttyi jokin seuraavista kriteereistä: kuume > 39 °C, lääkärin toteama akuutti välikorvatulehdus, lääkärin toteama alahengitystieinfektio, lääkärin toteamat vakava keuhkojenulkoinen komplikaatio, teho-osastohoito tai lisähapen tarve yli 8 tunnin ajan.
Eksploratiivisiin analyyseihin otettiin mukaan koko rokotettu kohortti, johon kuului 12 018 tutkittavaa (N = 6 006 Fluarix Tetra -ryhmässä, N = 6 012 verrokkiryhmässä). Fluarix Tetra esti tehokkaasti kunkin näistä 4 kannasta aiheuttamaa keskivaikeaa tai vaikeaa influenssaa (taulukko 2) siitä huolimatta, että kahden rokotekannan (A/H3N2 ja B/Victoria) antigeenit poikkesivat merkittävästi kiertävän viruksen antigeeneistä.
Taulukko 2: Fluarix Tetra: Kohtausprosentit ja rokotteen teho RT-PCR-testillä vahvistetun keskivaikean tai vaikean taudin estossa A-influenssan alatyyppien ja B-influenssakantojen mukaan 6–35 kk ikäisillä lapsilla (koko rokotettu kohortti)
Fluarix Tetra | Aktiivinen vertailuvalmiste1 | Rokotteen teho | ||||||
Kanta | N2 | n3 | Kohtausprosentti (n/N) (%) | N2 | n3 | Kohtausprosentti (n/N) (%) | % | 95 % lv |
A | ||||||||
H1N14 | 6 006 | 13 | 0,22 | 6 012 | 46 | 0,77 | 72,1 | 49,9; 85,5 |
H3N25 | 6 006 | 53 | 0,88 | 6 012 | 112 | 1,86 | 52,7 | 34,8; 66,1 |
B | ||||||||
Victoria6 | 6 006 | 3 | 0,05 | 6 012 | 15 | 0,25 | 80,1 | 39,7; 95,4 |
Yamagata7 | 6 006 | 22 | 0,37 | 6 012 | 73 | 1,21 | 70,1 | 52,7; 81,9 |
lv: luottamusväli
1Imeväisille annettiin ikää vastaava vertailurokote, joka ei ollut influenssarokote.
2Tutkittavien määrä koko rokotetussa kohortissa
3Tutkittavat, jotka ilmoittivat vähintään yhden tapauksen raportointiaikana
4–7Antigeeneiltään rokotetta vastaavien kantojen osuus oli A/H1N1-viruksen kohdalla 84,8 %, A/H3N2-viruksen kohdalla 2,6 %, B/Victoria-viruksen kohdalla 14,3 % ja B/Yamagata-viruksen kohdalla 66,6 %.
RT-PCR-testillä vahvistettujen tapausten (kaikki vaikeusasteet) kohdalla Fluarix Tetra myös pienensi yleislääkärikäynnin riskiä 47 % (suhteellinen riski [RR] 0,53 [95 % lv 0,46; 0,61], eli 310 käyntiä vs. 583 käyntiä) ja päivystyskäynnin riskiä 79 % (RR 0,21 [95 % lv 0,09; 0,47], eli 7 käyntiä vs. 33 käyntiä). Antibioottien käyttö väheni 50 % (RR 0,50 [95 % lv 0,42; 0,60], eli 172 tutkittavaa vs. 341 tutkittavaa).
Teho 18–64 vuoden ikäisillä aikuisilla
Kliinisessä tutkimuksessa, johon osallistui yli 7 600 tutkittavaa Tshekissä ja Suomessa, arvioitiin Fluarixin tehoa viljelyllä vahvistettuja A- ja/tai B-influenssatapauksia vastaan tilanteissa, joissa viruksen antigeenit vastasivat rokotteen viruskantojen antigeenejä.
Tutkittavia seurattiin influenssan kaltaisen taudin varalta, ja tautitapaukset vahvistettiin viljelyllä (tulokset, ks. taulukko 3). Influenssan kaltainen tauti määriteltiin tilanteeksi, jossa tutkittavalla oli vähintään yksi yleisoire (kuume ≥ 37,8 °C ja/tai lihaskipu) ja vähintään yksi hengitystieoire (yskä ja/tai nielukipu).
Taulukko 3: Kohtausprosentit ja rokotteen teho torjua tautitapauksia, joiden yhteydessä oli näyttöä influenssa A- tai B-infektiosta, 18–64 vuoden ikäisillä aikuisilla (koko rokotettu kohortti)
Kohtausprosentit (n/N)1 | Rokotteen teho (95 % lv2) | |||||
N | n | % | % | AR3 | YR4 | |
Antigeeneiltään vastaava, viljelyllä vahvistettu influenssa5 | ||||||
Fluarix | 5 103 | 49 | 1,0 | 66,9 | 51,9 | 77,4 |
Lume | 2 549 | 74 | 2,9 | - | - | - |
Kaikki viljelyllä vahvistetut influenssatapaukset (vastaavat, ei-vastaavat ja tyypittämättömät)6 | ||||||
Fluarix | 5 103 | 63 | 1,2 | 61,6 | 46,0 | 72,8 |
Lume | 2 549 | 82 | 3,2 | - | - | - |
1n/N: tapausmäärä/tutkittavien kokonaismäärä
2lv: luottamusväli
3AR: alaraja
4YR: yläraja
5Rokotteen antigeenejä vastaavia, viljelyllä vahvistettuja A/New Caledonia/20/1999 (H1N1)- tai B/Malaysia/2506/2004 ‑influenssakantojen tapauksia ei esiintynyt Fluarix-ryhmässä eikä lumeryhmässä.
622:sta lisätapauksesta 18 oli ei-vastaavia ja 4 oli tyypittämättömiä; 15:ssä näistä 22 tapauksesta kyseessä oli A (H3N2) (11 tapausta Fluarix-ryhmässä ja 4 tapausta lumeryhmässä).
Tässä tutkimuksessa arvioitiin myös immunogeenisuutta.
Taulukko 4: Titterien geometriset keskiarvot (geom. ka) ja serokonversioprosentit rokotuksen jälkeen
Aikuiset (18–64 v) | Fluarix1 N = 291 |
Geom. ka (95 % lv) | |
A/H1N1 | 541,0 (451,0; 649,0) |
A/H3N2 | 133,2 (114,6; 154,7) |
B (Victoria) | 242,8 (210,7; 279,7) |
Serokonversioprosentti (95 % lv) | |
A/H1N1 | 76,3 % (71,0; 81,1) |
A/H3N2 | 73,9% (68,4; 78,8) |
B (Victoria) | 85,2% (80,6; 89,1) |
lv: luottamusväli
1mukana A/H1N1, A/H3N2 ja B (Victoria-tyyppi)
Rokotuksen jälkeiset seroprotektioprosentit olivat A/H1N1-viruksen suhteen 97,6 %, A/H3N2-viruksen suhteen 86,9 % ja B-viruksen (Victoria) suhteen 96,2 %.
Immunogeenisuus lapsilla ja aikuisilla:
Fluarix Tetra ‑rokotteen immunogeenisuutta arvioitiin hemagglutinaatiota inhiboivien (HI) vasta-aineiden titterin geometrisen keskiarvon (geom. ka) perusteella 28 vrk kuluttua viimeisestä annoksesta (lapset) tai päivänä 21 (aikuiset) ja HI-serokonversioprosentin perusteella (resiprokaalisen titterin 4-kertaistuminen tai nousu havaitsemisrajan alittavalta tasolta [< 10] tasolle ≥ 40).
Tutkimuksessa D-QIV-004 (6–35 kk ikäisillä lapsilla) arviointi toteutettiin 1 332 lapsen alakohortissa (johon kuului 753 lasta Fluarix Tetra ‑ryhmästä ja 579 lasta verrokkiryhmästä). Tulokset esitetään taulukossa 5.
D-QIV-004-tutkimuksessa arvioitiin 2 annoksen rokotussarjan vaikutusta immuunivasteeseen tilanteessa, jossa tutkittaville annettiin 1 vuoden kuluttua uusintarokotuksena 1 annos Fluarix Tetra ‑rokotetta D-QIV-009-tutkimuksessa. Tässä tutkimuksessa todettiin, että 6–35 kk ikäisillä lapsilla saavutettiin 7 päivän kuluessa rokotuksesta immunologinen muistivaste kaikkia neljää rokotekantaa kohtaan.
Fluarix Tetran immunogeenisuuden vertailukelpoisuutta Fluarix-rokotteeseen arvioitiin lapsilla tutkimuksessa D-QIV-003 (kussakin hoitoryhmässä noin 900 iältään 3 – < 18 vuoden ikäistä lasta, jotka saivat 1 tai 2 annosta jompaakumpaa rokotetta) ja aikuisilla tutkimuksessa D-QIV-008 (noin 1 800 iältään vähintään 18-vuotiasta tutkittavaa sai 1 annoksen Fluarix Tetra ‑rokotetta ja noin 600 tutkittavaa sai 1 annoksen Fluarix-rokotetta). Fluarix Tetra tuotti molemmissa tutkimuksissa vähintään samanveroisen immuunivasteen kuin Fluarix-rokotteiden kolmea yhteistä viruskantaa kohtaan sekä Fluarixia paremman immuunivasteen Fluarix Tetra ‑rokotteessa lisäksi olevaa B-viruskantaa vastaan. Tulokset esitetään taulukossa 5.
Taulukko 5: Fluarix Tetra: Titterien geometriset keskiarvot (geom. ka) ja serokonversioprosentit rokotuksen jälkeen lapsilla (ikä 6–35 kk; 3 – < 18 v) ja 18 vuotta täyttäneillä aikuisilla (tutkimussuunnitelman mukainen ATP-kohortti)
Lapset 6–35 kk (D-QIV-004) | ||||
Fluarix Tetra | Verrokit1 | |||
N = 750–753 | N’ = 742–746 | N = 578–579 | N’ = 566–568 | |
Geom. ka2 (95 % lv) | Serokonversioprosentti2 (95 % lv) | Geom. ka2 (95 % lv) | Serokonversioprosentti2 (95 % lv) | |
A/H1N1 | 165,3 (148,6; 183,8) | 80,2 % (77,2; 83,0) | 12,6 (11,1; 14,3) | 3,5 % (2,2;5,4) |
A/H3N2 | 132,1 (119,1; 146,5) | 68,8 % (65,3; 72,1) | 14,7 (12,9; 16,7) | 4,2 % (2,7;6,2) |
B (Victoria) | 92,6 (82,3; 104,1) | 69,3 % (65,8; 72,6) | 9,2 (8,4; 10,1) | 0,9 % (0,3;2,0) |
B (Yamagata) | 121,4 (110,1; 133,8) | 81,2 % (78,2; 84,0) | 7,6 (7,0; 8,3) | 2,3 % (1,2;3,9) |
3 – < 18 v ikäiset lapset (D-QIV-003) | ||||
Fluarix Tetra | Fluarix3 | |||
N = 791 | N’ = 790 | N = 818 | N’ = 818 | |
Geom. ka (95 % lv) | Serokonversioprosentti (95 % lv) | Geom. ka (95 % lv) | Serokonversioprosentti (95 % lv) | |
A/H1N1 | 386,2 (357,3; 417,4) | 91,4 % (89,2; 93,3) | 433,2 (401,0; 468,0) | 89,9 % (87,6; 91,8) |
A/H3N2 | 228,8 (215,0; 243,4) | 72,3 % (69,0; 75,4) | 227,3 (213,3; 242,3) | 70,7 % (67,4; 73,8) |
B (Victoria) | 244,2 (227,5; 262,1) | 70,0 % (66,7; 73,2) | 245,6 (229,2; 263,2) | 68,5 % (65,2; 71,6) |
B (Yamagata) | 569,6 (533,6; 608,1) | 72,5 % (69,3; 75,6) | 224,7 (207,9; 242,9) | 37,0 % (33,7; 40,5) |
18 vuotta täyttäneet aikuiset (D-QIV-008) | ||||
Fluarix Tetra | Fluarix3 | |||
N = 1 809 | N’ = 1 801 | N = 608 | N’ = 605 | |
Geom. ka (95 % lv) | Serokonversioprosentti (95 % lv) | Geom. ka (95 % lv) | Serokonversioprosentti (95 % lv) | |
A/H1N1 | 201,1 (188,1; 215,1) | 77,5 % (75,5;79,4) | 218,4 (194,2; 245,6) | 77,2 % (73,6; 80,5) |
A/H3N2 | 314,7 (296,8; 333,6) | 71,5 % (69,3;73,5) | 298,2 (268,4; 331,3) | 65,8 % (61,9; 69,6) |
B (Victoria) | 404,6 (386,6; 423,4) | 58,1 % (55,8;60,4) | 393,8 (362,7; 427,6) | 55,4 % (51,3; 59,4) |
B (Yamagata) | 601,8 (573,3; 631,6) | 61,7 % (59,5;64,0) | 386,6 (351,5; 425,3) | 45,6 % (41,6; 49,7) |
lv: luottamusväli
N = Tutkittavat, joista saatavilla rokotuksen jälkeisiä tietoja (titterien geometrisia keskiarvoja varten)
N’ = Tutkittavat, joista saatavilla sekä rokotusta edeltäviä, että rokotuksen jälkeisiä tietoja (serokonversioprosentteja varten)
1 käytössä vertailurokote, joka ei ollut influenssarokote
2 immunogeenisuuden alakohorttiin perustuvat tulokset
3 B (Yamagata) ‑kanta ei ollut mukana Fluarix-rokotteessa
Rokotteen anto samanaikaisesti pneumokokkipolysakkaridirokotteiden kanssa:
Kliinisessä tutkimuksessa D-QIV-010, johon osallistui 356 iältään vähintään 50-vuotiasta influenssan ja pneumokokkitautien komplikaatioiden riskiryhmään kuuluvaa aikuista, tutkittaville annettiin Fluarix Tetra ‑rokote ja 23-valenttinen pneumokokkipolysakkaridirokote (PPV23) joko yhtä aikaa tai erikseen. Ennalta määrätyssä ensisijaisessa analyysissä arvioitiin immuunivastetta kaikkia neljää Fluarix Tetra ‑rokotekantaa kohtaan ja kuutta PPV23-rokotteen pneumokokkiserotyyppiä (1, 3, 4, 7F, 14 ja 19A) kohtaan ja todettiin, että immuunivaste oli vertailukelpoinen molemmissa hoitoryhmissä. Kun deskriptiivisessä analyysissä arvioitiin vielä kuutta muuta pneumokokkirokotteen serotyyppiä (5, 6B, 9V, 18C, 19F ja 23F), immuunivaste oli molemmissa ryhmissä samaa luokkaa; 91,7–100 % erillisten rokotuskertojen ryhmän tutkittavista ja 90,7–100 % samanaikaisesti rokotteet saaneen ryhmän tutkittavista saavutti seroprotektiiviset vasta-ainetasot näitä serotyyppejä vastaan.
Samanaikainen annostelu adjuvanttia sisältävän vyöruusurokotteen (Shingrix) kanssa:
Kliinisessä tutkimuksessa Zoster-004, 828 vähintään 50-vuotiasta aikuista satunnaistettiin saamaan kaksi Shingrix-rokoteannosta kahden kuukauden välein joko niin, että yksi Fluarix Tetra -rokoteannos annettiin samanaikaisesti ensimmäisellä rokotuskerralla (N=413) tai niin, että yksi Fluarix Tetra -rokoteannos annettiin eri aikaan (N=415). Vasta-ainevasteet kullekin rokotteelle olivat samanlaiset riippumatta siitä annosteltiinko ne samanaikaisesti vai eri ajankohtana. Kaikille neljälle Fluarix Tetra -rokotteen sisältämälle kannalle osoitettiin lisäksi immunologinen yhdenvertaisuus samanaikaisen ja eriaikaisen annostelun välillä hemagglutinaatiota inhiboivien (HI) vasta-aineiden GMT:n suhteen.
Samanaikainen annostelu COVID-19 mRNA-rokotteen kanssa:
Kliinisessä tutkimuksessa Zoster-091, 988 vähintään 18-vuotiasta aikuista saivat Fluarix Tetra ‑rokotetta ja monovalenttista COVID-19 mRNA-1273-tehosterokotetta (50 mikrogrammaa) joko yhtä aikaa (N=498) tai eri aikaan siten, että rokotteet annettiin kahden viikon välein (N=490). Vasta-ainevasteet kullekin rokotteelle olivat samanlaiset antoaikataulusta riippumatta. Immunologinen yhdenvertaisuus samanaikaisen ja eriaikaisen annostelun välillä osoitettiin kaikille neljälle Fluarix Tetra -rokotteen sisältämälle kannalle hemagglutinaatiota inhiboivien (HI) vasta-aineiden GMT:n suhteen ja ja COVID-19 mRNA-1273-tehosterokotteelle anti-S-proteiinivasta-aineen GMC:n suhteen.
Farmakokinetiikka
Ei oleellinen.
Prekliiniset tiedot turvallisuudesta
Akuuttia toksisuutta, paikallista siedettävyyttä, toistuvan altistuksen aiheuttamaa toksisuutta sekä lisääntymis- ja kehitystoksisuutta koskevien konventionaalisten tutkimusten nonkliiniset tulokset eivät viittaa erityiseen vaaraan ihmisille.
Farmaseuttiset tiedot
Apuaineet
Natriumkloridi
Dinatriumfosfaattidodekahydraatti
Kaliumdivetyfosfaatti
Kaliumkloridi
Magnesiumkloridiheksahydraatti
α-tokoferyylivetysuksinaatti
Polysorbaatti 80
Oktoksinoli-10
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Koska yhteensopimattomuustutkimuksia ei ole tehty, lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
1 vuosi
Säilytys
Säilytä jääkaapissa (2 °C – 8 °C).
Ei saa jäätyä.
Säilytä alkuperäispakkauksessa. Herkkä valolle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
FLUARIX TETRA injektioneste, suspensio, esitäytetty ruisku
15 mikrog HA/0,5 ml (L:ei) 10 x 1 annos (ilman neulaa) (94,67 €)
PF-selosteen tieto
0,5 ml suspensiota esitäytetyssä ruiskussa (tyypin I lasia), jossa männän tulppa (butyylikumia) ja kuminen kärkikorkki.
Esitäytetyn ruiskun kärkikorkki ja kuminen männän tulppa ovat valmistettu synteettisestä kumista.
Pakkauskoot 1 ja 10, neuloilla tai ilman.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Suspensio on väritön ja hieman opalisoiva.
Käyttö- ja käsittelyohjeet
Rokotteen on annettava lämmetä huoneenlämpöiseksi ennen käyttöä.
Ravista ennen käyttöä. Tarkista valmiste silmämääräisesti ennen antoa.
Esitäytetyn ruiskun käyttöohje
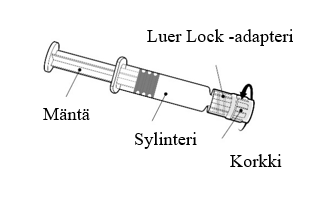 | Pidä kiinni ruiskun sylinteristä, ei männästä. Poista ruiskun korkki kiertämällä vastapäivään. |
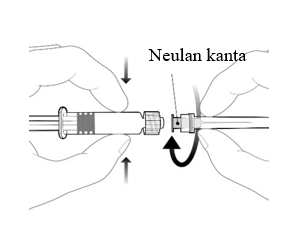 | Neula kiinnitetään ruiskuun yhdistämällä neulan kanta Luer Lock -adapteriin ja kiertämällä neulaa neljänneskierros myötäpäivään, kunnes neula tuntuu kiinnittyvän ruiskuun. Älä vedä ruiskun mäntää ulos sylinteristä. Jos mäntä irtoaa sylinteristä, älä anna rokotetta. |
Hävitys
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
FLUARIX TETRA injektioneste, suspensio, esitäytetty ruisku
15 mikrog HA/0,5 ml 10 x 1 annos
- Ei korvausta.
ATC-koodi
J07BB02
Valmisteyhteenvedon muuttamispäivämäärä
09.04.2024
Yhteystiedot
 GLAXOSMITHKLINE OY
GLAXOSMITHKLINE OY Porkkalankatu 20 A
00180 Helsinki
010 303 030
www.glaxosmithkline.fi
