FLUENZ nässpray, suspension
Kvalitativ och kvantitativ sammansättning
Reassortant influensavirus* (levande, försvagat) av följande tre stammar**:
A/Victoria/4897/2022 (H1N1)pdm09-liknande stam
(A/Norway/31694/2022, MEDI 369815) 107,0±0,5 FFU***
A/Croatia/10136RV/2023 (H3N2)-liknande stam
(A/Perth/722/2024, MEDI 392611) 107,0±0,5 FFU***
B/Austria/1359417/2021-liknande stam
(B/Austria/1359417/2021, MEDI 355292) 107,0±0,5 FFU***
.......................................................................................................per 0,2 ml dos
* Förökade i fertiliserade hönsägg från friska hönsbesättningar.
** Producerade i VERO‑celler genom omvänd genteknik. Denna produkt innehåller genetiskt modifierade organismer (GMO).
*** Fluorescerande fokusenheter.
Detta vaccin uppfyller rekommendationen från WHO (norra hemisfären) och EU:s beslut för säsongen 2025/2026.
Vaccinet kan innehålla spår av följande ämnen: äggproteiner (t.ex. äggalbumin) och gentamicin. Den högsta mängden äggalbumin är mindre än 0,024 mikrogram per dos om 0,2 ml (0,12 mikrogram per ml), se avsnitt Kontraindikationer.
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Nässpray, suspension
Kliniska uppgifter
Terapeutiska indikationer
Fluenz är avsett för aktiv immunisering för att förebygga influensasjukdom hos barn och ungdomar från 2 år upp till 18 år.
Fluenz ska användas i enlighet med officiella rekommendationer.
Dosering och administreringssätt
Dosering
Barn och ungdomar från 2 år till < 18 år
Den rekommenderade dosen är 0,2 ml administrerad som 0,1 ml i vardera näsborre.
För barn 2 till 8 år som inte tidigare har vaccinerats mot säsongsbunden influensa ska en andra dos ges efter ett intervall på minst 4 veckor.
Spädbarn och småbarn < 2 år
Fluenz ska inte användas av spädbarn och småbarn under 2 år av säkerhetsmässiga skäl på grund av en ökad frekvens av sjukhusinläggningar och väsande andning i denna population (se avsnitt Biverkningar).
Administreringssätt
Endast för nasal användning.
Fluenz får inte injiceras under några omständigheter.
Fluenz administreras som en uppdelad dos i båda näsborrarna. Efter administrering av halva dosen i en näsborre administreras den andra halvan av dosen i den andra näsborren omedelbart eller strax därefter. Patienten kan andas normalt medan vaccinet administreras – han/hon behöver inte andas in aktivt eller dra in luft.
För detaljerade anvisningar om beredning och administrering se avsnitt Särskilda anvisningar för destruktion och övrig hantering.
Kontraindikationer
- Överkänslighet mot de aktiva substanserna eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen eller mot gentamicin (en möjlig restsubstans).
- Svår allergisk reaktion (t.ex. anafylaxi) mot ägg eller äggproteiner (t.ex. äggalbumin).
- Barn och ungdomar med klinisk immunbrist på grund av ett tillstånd eller på grund av immunsuppressiv behandling, såsom akuta och kroniska leukemier, lymfom, symtomatisk hiv‑infektion, brister i det cellulära immunförsvaret och höga doser av kortikosteroider. Fluenz är inte kontraindicerat hos personer med asymtomatisk hiv‑infektion eller personer som får lokala/inhalerade kortikosteroider eller systemiska kortikosteroider i låg dos eller hos dem som får kortikosteroider som ersättningsbehandling, t.ex. för binjurebarksvikt.
- Barn och ungdomar under 18 år som får salicylatbehandling (på grund av sambandet mellan Reyes syndrom och salicylater och infektion med influensa av vildtyp) (se avsnitt Interaktioner).
Varningar och försiktighet
Spårbarhet
För att underlätta spårbarhet av biologiska läkemedel ska läkemedlets namn och tillverkningssatsnummer dokumenteras.
Överkänslighet och anafylaxi
Liksom för de flesta vacciner ska lämplig medicinsk behandling och övervakning alltid finnas tillgänglig för att hantera en anafylaktisk reaktion eller en svår överkänslighetsreaktion efter administrering av Fluenz.
Samtidig sjukdom och kroniska tillstånd
Fluenz ska inte ges till barn och ungdomar med allvarlig astma eller som för närvarande har väsande andning, eftersom dessa personer inte har studerats tillräckligt i kliniska studier (se avsnitt Biverkningar).
Administrering av Fluenz ska senareläggas för personer med en akut allvarlig febersjukdom eller akut infektion. En lindrig infektion och/eller låggradig feber utgör inte skäl att senarelägga vaccination.
Vaccination ska också senareläggas för personer med nästäppa, på grund av den potentiella minskningen av vaccinupptag och avsaknaden av effektdata i denna population. Lindriga förkylningssymtom utan nästäppa utgör inte skäl att senarelägga vaccination.
Personer med nedsatt immunförsvar
Personer som vaccineras ska informeras om att Fluenz är ett vaccin baserat på ett levande, försvagat virus, vilket potentiellt kan överföras till personer med nedsatt immunförsvar. Vaccinerade personer ska, när så är möjligt, försöka undvika nära kontakt med personer med kraftigt nedsatt immunförsvar (t.ex. mottagare av benmärgstransplantat, vilka kräver isolering) under 1–2 veckor efter vaccinationen. I kliniska studier har det påvisats att den högsta förekomsten av utsöndring av vaccinvirus inträffade 2–3 dagar efter vaccination. Under omständigheter där kontakt med personer med kraftigt nedsatt immunförsvar inte kan undvikas ska den potentiella risken för överföring av influensavaccinvirus vägas mot risken att förvärva och överföra influensavirus av vildtyp. Effekten av Fluenz för att förebygga influensasjukdom hos personer med nedsatt immunförsvar har inte utvärderats (se avsnitt Biverkningar).
Allmänt
Fluenz får inte injiceras under några omständigheter.
Det finns inga data angående säkerheten vid intranasal administrering av Fluenz till barn med icke åtgärdade kraniofaciala missbildningar.
Interaktioner
Fluenz får inte administreras till barn och ungdomar som får salicylatbehandling (se avsnitt Kontraindikationer). Salicylater ska inte användas till barn och ungdomar under 4 veckor efter vaccination, om detta inte är medicinskt indicerat, eftersom Reyes syndrom har rapporterats efter användning av salicylater under infektion med influensa av vildtyp.
Fluenz kan administreras samtidigt med levande, försvagade vacciner: mässling, påssjuka, röda hund, vattkoppor och oralt administrerat poliovirus.
Samtidig administrering av Fluenz med inaktiverade vacciner har inte studerats.
Samtidig användning av Fluenz och antivirala ämnen som är aktiva mot influensa A‑ och/eller B‑virus har inte utvärderats. Baserat på möjligheten att antivirala ämnen mot influensa kan minska effekten av Fluenz rekommenderas dock att vaccinet inte administreras förrän 48 timmar efter avslutad behandling med antivirala ämnen som är aktiva mot influensa. Administrering av antivirala ämnen som är aktiva mot influensa inom två veckor efter vaccinering kan påverka vaccinsvaret.
Om antivirala ämnen som är aktiva mot influensa och Fluenz administreras samtidigt ska omvaccinering övervägas baserat på klinisk bedömning.
Fertilitet, graviditet och amning
Graviditet
Det finns en måttlig mängd data från användning av Fluenz hos gravida kvinnor. Man fann inga bevis för signifikanta biverkningar hos modern hos 138 gravida kvinnor med dokumenterat intag av Fluenz i en databas över sjukvårdsförsäkringsanspråk i USA.
I mer än 300 fallrapporter i AstraZenecas säkerhetsdatabas för vaccinadministrering till gravida kvinnor observerades inget ovanligt mönster av graviditetskomplikationer eller fosterpåverkan.
Även om djurstudier inte visar några direkta eller indirekta skadliga reproduktionstoxikologiska effekter, och data som framkommit efter det att produkten släppts på marknaden inte tyder på att det finns anledning till oro vid oavsiktlig administrering av vaccinet, rekommenderas inte Fluenz under graviditet.
Amning
Begränsade tillgängliga data tyder på att Fluenz inte utsöndras i bröstmjölk. Eftersom det finns begränsade data för att utvärdera effekterna på det ammade spädbarnet och eftersom vissa virus utsöndras i bröstmjölk, ska Fluenz inte användas under amning.
Fertilitet
Det finns inga data avseende Fluenz möjliga effekter på manlig och kvinnlig fertilitet.
Effekter på förmågan att framföra fordon och använda maskiner
Fluenz har ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner.
Biverkningar
Sammanfattning av säkerhetsprofilen
Säkerhetsdata rörande användning av Fluenz baseras på data från kliniska studier av Fluenz med över 29 000 barn och ungdomar i åldern 2 till 17 år, säkerhetsstudier efter godkännande för försäljning med över 84 000 barn och ungdomar i åldern 2 till 17 år och data från kliniska studier av tetravalent vaccin mot influensa (levande, försvagat, nasalt) med över 2 000 barn och ungdomar i åldern 2 till 17 år. Ytterligare erfarenhet finns efter användning av Fluenz och/eller tetravalent vaccin mot influensa (levande, försvagat, nasalt) på marknaden.
I kliniska studier var säkerhetsprofilen för Fluenz och tetravalent vaccin mot influensa (levande, försvagat, nasalt) liknande.
Den vanligaste biverkningen som observerades i kliniska studier var nästäppa och rinnsnuva.
Lista över biverkningar i tabellform
Biverkningsfrekvenserna är ordnade enligt MedDRA-klassificeringen av organsystem. Inom varje organsystemklass ordnas biverkningarna enligt minskande frekvens och sedan enligt minskande allvarlighetsgrad. Biverkningsfrekvenserna definieras som: mycket vanliga (≥ 1/10), vanliga (≥ 1/100, < 1/10), mindre vanliga (≥ 1/1 000, < 1/100), sällsynta (≥ 1/10 000, < 1/1 000), mycket sällsynta (< 1/10 000) och ingen känd frekvens (kan inte beräknas från tillgängliga data).
Tabell 1 Biverkningar
| MedDRA-klassificering av organsystem | Biverkning | Frekvens |
| Immunsystemet | Överkänslighetsreaktioner (inklusive ansiktsödem, urtikaria) | Mindre vanliga |
| Anafylaktiska reaktioner | Mycket sällsynta | |
| Metabolism och nutrition | Minskad aptit | Mycket vanliga |
| Centrala och perifera nervsystemet | Huvudvärk | Vanliga |
| Guillain‑Barrés syndrom | Ingen känd frekvensa | |
| Andningsvägar, bröstkorg och mediastinum | Nästäppa/rinnsnuva | Mycket vanliga |
| Näsblod | Mindre vanliga | |
| Hud och subkutan vävnad | Hudutslag | Mindre vanliga |
| Muskuloskeletala systemet och bindväv | Myalgi | Vanliga |
| Allmänna symtom och/eller symtom vid administreringsstället | Sjukdomskänsla | Mycket vanliga |
| Feber | Vanliga | |
| Medfödda och/eller genetiska störningar | Förvärrade symtom på Leighs syndrom (mitokondriell encefalomyopati) | Ingen känd frekvensa |
a Efter godkännande för försäljning
Pediatrisk population
I en aktivt kontrollerad klinisk studie (MI‑CP111) observerades en ökad frekvens av sjukhusinläggningar (oavsett orsak) inom 180 dagar efter den sista vaccindosen hos spädbarn och småbarn i åldern 6‑11 månader (6,1 % Fluenz kontra 2,6 % injicerbart influensavaccin). De flesta sjukhusinläggningar var orsakade av gastrointestinala infektioner och luftvägsinfektioner som inträffade mer än 6 veckor efter vaccinationen. Frekvensen sjukhusinläggningar ökade inte hos mottagare av Fluenz i åldern 12 månader och äldre. I samma studie observerades en ökad frekvens väsande andning inom 42 dagar hos spädbarn och småbarn i åldern 6‑23 månader (5,9 % Fluenz kontra 3,8 % injicerbart influensavaccin). Frekvensen väsande andning ökade inte hos mottagare av Fluenz i åldern 2 år och äldre. Fluenz är inte avsett för användning till spädbarn och småbarn under 2 år (se avsnitt Dosering och administreringssätt).
Samtidig sjukdom och kroniska tillstånd
I en studie (D153‑P515) med barn i åldern 6 till 17 år med astma (Fluenz: n = 1 114, trivalent injicerbart influensavaccin: n = 1 115) förelåg inga signifikanta skillnader mellan behandlingsgrupperna gällande incidensen av astmaexacerbationer, genomsnittligt toppexspirationsflöde, astmasymtompoäng eller poäng för uppvaknande nattetid. Incidensen för väsande andning inom 15 dagar efter vaccinationen var lägre hos personer som vaccinerades med Fluenz jämfört med personer som vaccinerades med inaktiverat vaccin (19,5 % jämfört med 23,8 %, P = 0,02).
I en studie med barn och ungdomar i åldern 9 till 17 år med måttlig till svår astma (Fluenz: n = 24, placebo: n = 24) fanns det inte någon skillnad i primärt säkerhetskriterium, förändring av förutsagd forcerad exspiratorisk volym på 1 sekund (FEV1) uppmätt före och efter vaccinationen mellan de båda behandlingsarmarna.
Även om säkerheten för barn och ungdomar med lindrig till måttlig astma har fastställts är data från barn med andra lungsjukdomar eller kronisk kardiovaskulär, metabolisk sjukdom eller njursjukdom eller andra bakomliggande kroniska medicinska tillstånd begränsade. I en studie med vuxna i åldern 60 år och äldre (n = 3 242) hade en stor andel av personerna bakomliggande, kroniska medicinska tillstånd (87 %), inklusive hjärtsjukdomar (15 %), sjukdomar i andningsvägar, bröstkorg och mediastinum (13 %) och diabetes mellitus (9,6 %). Säkerhetsprofilen för Fluenz hos dessa personer var jämförbar med den säkerhetsprofil som observerades hos personer utan dessa tillstånd.
Personer med nedsatt immunförsvar
Hos hiv-positiva barn (n =24) och hiv-negativa barn (n = 25) i åldern 1 till 7 år och hos hiv-positiva barn och ungdomar i åldern 5 till 17 år som fick stabil antiretroviral behandling (Fluenz: n = 122, trivalent injicerbart vaccin: n = 121) var frekvensen och tiden för utsöndringen av vaccinvirus jämförbar med den som ses hos friska individer. Inga negativa effekter på mängden hiv-virus eller CD4-antal kunde identifieras efter administrering av Fluenz.
Tjugo barn och ungdomar i åldern 5 till 17 år med lindrigt till måttligt nedsatt immunförsvar (som behandlades med kemoterapi och/eller strålbehandling eller som nyligen hade behandlats med kemoterapi) randomiserades 1:1 till antingen Fluenz eller placebo. Frekvensen och tiden för utsöndringen av vaccinvirus hos dessa barn och ungdomar med nedsatt immunförsvar var jämförbara med de som ses hos friska barn och ungdomar.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta‑riskförhållande. Hälso‑ och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till:
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Överdosering med Fluenz är osannolikt eftersom vaccinet levereras i en förfylld näspipett för engångsbruk. Administrering av en högre än rekommenderad dos av Fluenz rapporterades sällan och biverkningsprofilen var jämförbar med den som observerades med den rekommenderade dosen av Fluenz.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Vacciner, vaccin mot influensa, ATC‑kod: J07BB03
Verkningsmekanism
Fluenz är ett trivalent vaccin som innehåller tre influensavirusstammar som är anpassade till kyla (cold-adapted; ca), temperaturkänsliga (temperature-sensitive; ts) och försvagade (attenuated; att): en A/(H1N1)‑stam, en A/(H3N2)‑stam och en B‑stam (från Victoria-linjetyp). Efter intranasal administrering replikeras Fluenz i nasofarynx och inducerar immunsvar mot de tre influensavirusstammar som vaccinet innehåller.
Klinisk effekt
Effektdata för Fluenz i den pediatriska populationen består av 9 kontrollerade studier, omfattande över 20 000 spädbarn och småbarn, barn och ungdomar, utförda under 7 influensasäsonger. Fyra placebokontrollerade studier inkluderade omvaccination den andra säsongen. Fluenz har i 3 aktivt kontrollerade studier med injicerbart influensavaccin visats vara överlägset. Se tabell 2 och 3 för en sammanfattning av effektresultat i den pediatriska populationen.
Tabell 2 Effekt av Fluenz efter 2 doser mot odlingsbekräftad influensasjukdom i placebokontrollerade pediatriska studier
| Studie-nummera | Region | Ålders-intervallb | Antal studie-deltagare | Influensa-säsong | Effekt (95 % KI) Matchade stammar | Effekt (95 % KI) Alla stammar, oavsett matchning | |
| D153‑P502 | Europa | 6 till 35 M | 1 616 | 2000–2001 | 85,4 % (74,3, 92,2) | 85,9 % (76,3, 92,0) | |
| D153‑P504 | Afrika, Latin-amerika | 6 till 35 M | 1 886 | 2001 | 73,5 %(63,6, 81,0)c | 72,0 % (61,9, 79,8)c | |
| D153‑P513 | Asien/ Oceanien | 6 till 35 M | 1 041 | 2002 | 62,2 %(43,6, 75,2) | 48,6 % (28,8, 63,3) | |
| D153‑P522 | Europa, Asien/ Oceanien, Latin-amerika | 11 till 23 M | 1 150 | 2002–2003 | 78,4 %(50,9, 91,3) | 63,8 % (36,2, 79,8) | |
| D153‑P501 | Asien/ Oceanien | 12 till 35 M | 2 764 | 2000–2001 | 72,9 %(62,8, 80,5) | 70,1 % (60,9, 77,3) | |
| AV006 | USA | 15 till 71 M | 1 259c | 1996–1997 | 93,4 %(87,5, 96,5) | N/A | |
| a Per protokoll-population, om inte annat anges; inga studiedeltagare hade tidigare vaccinerats mot influensa b Åldersintervall enligt beskrivningen i studieprotokollet. M = månader. c Data som presenteras gäller studiedeltagare som fick två doser (ITT-population). | |||||||
I de kliniska studierna AV006 och D153-P504 utvärderades effekten av en enkeldos av Fluenz hos tidigare ovaccinerade barn i åldern 15–71 månader (n = 288) och i åldern 6–35 månader (n = 1 877). Effekten mot odlingsbekräftad influensa orsakad av någon matchad stam var 88,8 % (95 % KI: 64,5, 96,5) respektive 57,7 % (95 % KI: 44,7, 67,9).
Den uppskattade effekten av Fluenz mot alla matchade stammar hos barn som fått 2 doser år 1 och omvaccinering år 2 var 100 % (95 % KI: 38,2, 100; n = 1 110) i AV006, 84,3 % (95 % KI: 70,1, 92,4; n = 1 265) i D153-P501, 88,7 % (95 % KI: 82,0, 93,2; n = 1 090) i D153-P502 och 73,6 % (95 % KI: 33,3, 91,2; n = 680) i D153-P504.
Den uppskattade effekten av Fluenz mot alla matchade stammar hos barn som fått 2 doser år 1 och placebo år 2 var lägre: 56,2 % (95 % KI: 30,5, 72,7; n = 1 253) i D153-P501 och 57,0 % (95 % KI: 6,1, 81,7; n = 718) i D153-P504.
Tabell 3 Relativ effekt av Fluenz mot odlingsbekräftad influensasjukdom i aktivt kontrollerade pediatriska studier med injicerbart influensavaccin
| Studie-nummera | Region | Ålders-intervallb | Antal studie-deltagare | Influensa-säsong | Förbättrad effekt (95 % KI) Matchade stammar | Förbättrad effekt (95 % KI) Alla stammar, oavsett matchning |
| MI‑CP111 | USA, Europa, Asien/Oceanien | 6 till 59 M | 7 852c | 2004–2005 | 44,5 %(22,4, 60,6) | 54,9 %(45,4, 62,9)d |
| D153‑P514 | Europa | 6 till 71 M | 2 085e | 2002–2003 | 52,7 % (21,6, 72,2) | 52,4 % (24,6, 70,5)f |
| D153‑P515 | Europa | 6 till 17 Å | 2 211g | 2002–2003 | 34,7 % (3,9, 56,0) | 31,9 % (1,1, 53,5) |
| a Per protokoll-population b Åldersintervall enligt beskrivningen i studieprotokollet. M = månader. Å = år. c Data som presenteras gäller studiedeltagare som fick två doser om de var ovaccinerade eller hade okänd vaccinationshistoria eller en dos om de hade vaccinerats tidigare. d Fluenz visade 55,7 % (39,9, 67,6) färre fall än injicerbart influensavaccin hos 3 686 spädbarn och småbarn i åldern 6–23 månader och 54,4 % (41,8, 64,5) färre fall hos 4 166 barn i åldern 24–59 månader. e Data som presenteras gäller studiedeltagare som tidigare hade haft återkommande luftvägsinfektioner och som fått två doser av intranasalt influensavaccin jämfört med studiedeltagare som fått två doser av injicerbart influensavaccin. f Fluenz visade 64,4 % (1,4, 88,8) färre fall än injicerbart influensavaccin hos 476 spädbarn och småbarn i åldern 6–23 månader och 48,2 % (12,7, 70,0) färre fall hos 1 609 barn i åldern 24–71 månader. g Data som presenteras gäller studiedeltagare som hade klinisk diagnos på astma och som fått en dos av intranasalt influensavaccin jämfört med studiedeltagare som fått en dos av injicerbart influensavaccin. | ||||||
Farmakokinetiska egenskaper
Ej relevant.
Prekliniska säkerhetsuppgifter
Gängse studier avseende allmäntoxicitet, reproduktionseffekter och effekter på utveckling, lokal tolerans samt neurovirulens visade inte några särskilda risker för människa.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Sackaros
Dikaliumfosfat
Kaliumdivätefosfat
Gelatin
Argininhydroklorid
Mononatrium‑glutamatmonohydrat
Vatten för injektioner
Inkompatibiliteter
Då blandbarhetsstudier saknas får detta vaccin inte blandas med andra läkemedel.
Hållbarhet
15 veckor
Särskilda förvaringsanvisningar
Förvaras i kylskåp (2°C–8°C).
Får ej frysas.
Ljuskänsligt. Förvara näspipetten i ytterkartongen.
Före användning får vaccinet tas ut ur kylskåpet under en period av högst 12 timmar vid en temperatur på högst 25 °C. Stabilitetsdata indikerar att vaccinkomponenterna är stabila under 12 timmar vid förvaring vid temperaturer från 8 °C till 25 °C. Vid slutet av denna period ska Fluenz användas omedelbart eller kasseras.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
FLUENZ nenäsumute, suspensio
0,2 ml (36,20 €), 10 x 0,2 ml (-)
PF-selosteen tieto
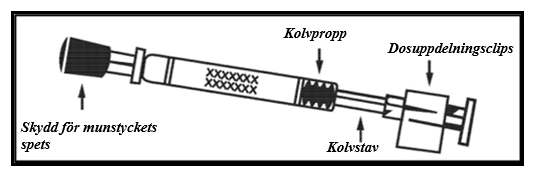
Fluenz levereras som en nässpray, suspension (0,2 ml) i en näspipett för engångsbruk (typ 1‑glas) med munstycke (av polypropylen med överföringsventil av polyetylen), skyddande lock för munstyckets spets (syntetiskt gummi), kolvstav, kolvpropp (butylgummi) och ett dosuppdelningsclips.
Förpackningsstorlek: 1 eller 10 näspipetter.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Läkemedlets utseende:
Färglös till blekgul, genomskinlig till opalskimrande suspension med ett pH på cirka 7,2. Små, vita partiklar kan finnas.
Särskilda anvisningar för destruktion och övrig hantering
Administrering
Fluenz är för engångsbruk och endast avsett för nasal användning.
- Får inte användas med injektionsnål. Får inte injiceras.
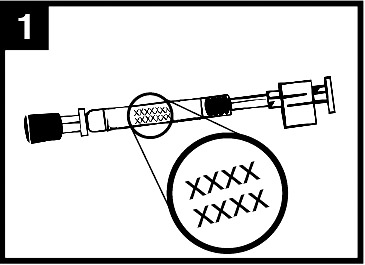
- Använd inte Fluenz om utgångsdatumet har passerats eller om näspipettenverkar vara skadad, t.ex. om kolven är lös eller har lossnat från näspipetteneller om det finns tecken på läckage.
- Kontrollera utseendet på vaccinet före administrering. Suspensionen ska vara färglös till blekgul, genomskinlig till lätt grumlig. Små, vita partiklar kan finnas.
- Fluenz administreras som en uppdelad dos i båda näsborrarna.
- Efter administrering av halva dosen i en näsborre administreras den andra halvan av dosen i den andra näsborren omedelbart eller strax därefter.
- Patienten kan andas normalt medan vaccinet administreras – han/hon behöver inte andas in aktivt eller dra in luft.
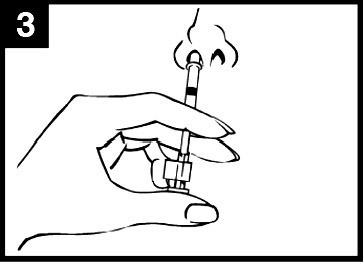
- I administreringsdiagrammet för Fluenz (figur 1) finns steg‑för‑steg‑anvisningar för administrering.
Figur 1 Administrering av Fluenz
 | 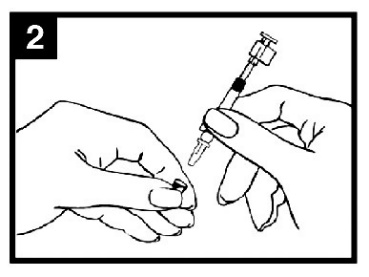 |  |
| Kontrollera utgångsdatumet Produkten ska inte användas efter datumet på pipettens etikett. | Förbered pipetten Ta bort skyddet för munstyckets spets. Ta inte bort dosuppdelningsclipset i pipettens andra ände. | Placera pipetten Patienten placeras i upprätt ställning och spetsen placeras precis innanför näsborrens kant för att säkerställa att Fluenz levereras i näsan. |
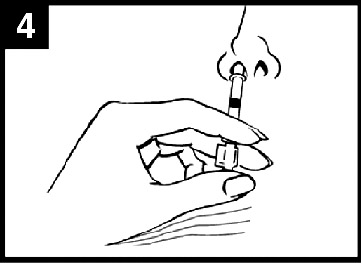 | 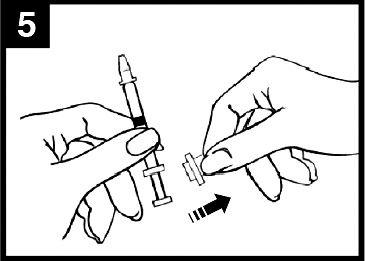 | 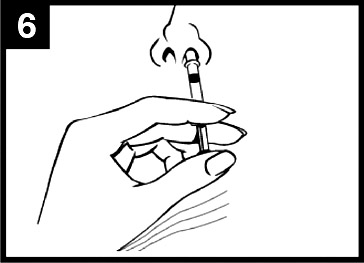 |
| Tryck in kolven Tryck in kolven med en enda rörelse så snabbt som möjligt tills dosuppdelningsclipset hindrar vidare intryckning. | Ta bort dosuppdelningsclipset För administrering i den andra näsborren, kläm ihop och ta bort dosuppdelningsclipset från kolven. | Spraya i den andra näsborren Placera spetsen precis innanför kanten på den andra näsborren och tryck in kolven med en enda rörelse så snabbt som möjligt för att leverera det återstående vaccinet. |
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar för medicinskt avfall.
Ersättning
FLUENZ nenäsumute, suspensio
0,2 ml, 10 x 0,2 ml
- Ei korvausta.
Atc-kod
J07BB03
Datum för översyn av produktresumén
09.07.2025
Yhteystiedot
Keilaranta 18
02150 Espoo
010 23 010
www.astrazeneca.fi
