FINLEE dispergoituva tabletti 10 mg
Vaikuttavat aineet ja niiden määrät
Yksi dispergoituva tabletti sisältää dabrafenibimesilaattia määrän, joka vastaa 10 mg dabrafenibia.
Apuaine, jonka vaikutus tunnetaan
Yksi dispergoituva tabletti sisältää < 0,00078 mg bentsyylialkoholia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Dispergoituva tabletti.
Kliiniset tiedot
Käyttöaiheet
Matala‑asteinen gliooma
Finlee yhdistelmänä trametinibin kanssa on tarkoitettu sellaisten vähintään 1 vuoden ikäisten pediatristen potilaiden hoitoon, joilla on BRAF V600E ‑mutaatiopositiivinen matala‑asteinen gliooma ja jotka tarvitsevat systeemistä hoitoa.
Korkea‑asteinen gliooma
Finlee yhdistelmänä trametinibin kanssa on tarkoitettu sellaisten vähintään 1 vuoden ikäisten pediatristen potilaiden hoitoon, joilla on BRAF V600E ‑mutaatiopositiivinen korkea‑asteinen gliooma ja jotka ovat aiemmin saaneet vähintään yhtä säde‑ ja/tai solunsalpaajahoitoa.
Ehto
Hoidon aloittavan ja hoitoa seuraavan lääkärin tulee olla perehtynyt syöpälääkkeiden käyttöön.
Annostus ja antotapa
Syövän hoitoon perehtyneen lääkärin on aloitettava Finlee‑hoito ja valvottava sen toteuttamista.
Ennen Finlee-hoidon aloittamista BRAF V600E ‑mutaatio on vahvistettava kyseiseen käyttötarkoitukseen soveltuvalla CE-merkityllä in vitro -diagnostisella (IVD) lääkinnällisellä laitteella. Jos CE-merkittyä IVD-laitetta ei ole saatavilla, BRAF V600E -mutaatio on arvioitava vaihtoehtoisella validoidulla testillä.
Finlee‑valmistetta käytetään yhdessä trametinibin (jauhe oraaliliuosta varten) kanssa. Trametinibin annostus, ks. kyseisen valmisteen valmisteyhteenveto.
Finlee‑valmistetta ei saa korvata muilla dabrafenibivalmistemuodoilla, sillä bioekvivalenssia ei todettu (ks. kohta Farmakokinetiikka).
Annostus
Suositeltu kahdesti vuorokaudessa otettava Finlee‑annos määräytyy potilaan painon perusteella (taulukko 1).
Taulukko 1 Painon mukainen annostus
| Paino* | Suositeltu annos (mg dabrafenibia) kahdesti vuorokaudessa | Suositeltu annos (10 mg:n tablettien määrä) kahdesti vuorokaudessa |
| 8–9 kg | 20 mg | 2 |
| 10–13 kg | 30 mg | 3 |
| 14–17 kg | 40 mg | 4 |
| 18–21 kg | 50 mg | 5 |
| 22–25 kg | 60 mg | 6 |
| 26–29 kg | 70 mg | 7 |
| 30–33 kg | 80 mg | 8 |
| 34–37 kg | 90 mg | 9 |
| 38–41 kg | 100 mg | 10 |
| 42–45 kg | 110 mg | 11 |
| 46–50 kg | 130 mg | 13 |
| ≥ 51 kg | 150 mg | 15 |
*Paino pyöristetään tarvittaessa lähimpään kilogrammaan. Alle 8 kg painavien potilaiden suositusannosta ei ole määritetty. Finlee‑valmisteen kanssa yhdessä käytettävän trametinibihoidon annostusohjeet, ks. trametinibin (jauhe oraaliliuosta varten) valmisteyhteenvedon kohdat ”Annostus” ja ”Antotapa”. | ||
Hoidon kesto
Finlee‑hoitoa jatketaan, kunnes tauti etenee tai potilaalla ilmenee liiallista toksisuutta. Yli 18‑vuotiaita glioomapotilaita koskevia tietoja on vain vähän, minkä vuoksi hoidon jatkamisen aikuisiällä on perustuttava lääkärin arvioon potilaan yksilöllisistä hyödyistä ja riskeistä.
Väliin jääneet tai myöhästyneet annokset
Jos Finlee‑annos jää väliin, se otetaan vain, jos seuraavan annoksen suunniteltuun ajankohtaan on yli 6 tuntia aikaa. Jos potilas oksentaa Finlee‑valmisteen ottamisen jälkeen, lisäannosta ei pidä ottaa ja seuraava annos otetaan seuraavana suunniteltuna ajankohtana.
Annoksen sovittaminen
Haittavaikutukset saattavat vaatia annoksen pienentämistä, hoidon keskeyttämistä tai hoidon lopettamista (ks. taulukot 2 ja 3).
Jos hoitoon liittyviä haittoja esiintyy, sekä dabrafenibin että trametinibin annosta on pienennettävä samanaikaisesti tai hoidot on keskeytettävä tai lopetettava. Poikkeustapaukset, joissa vain toisen valmisteen annoksen muuttaminen on tarpeen, on esitetty jäljempänä seuraavien haittojen yhteydessä: uveiitti, muut RAS‑mutaatiopositiiviset syövät kuin ihosyöpä (liittyy ensisijaisesti dabrafenibiin), vasemman kammion ejektiofraktion pieneneminen, verkkokalvon laskimotukos, verkkokalvon pigmenttiepiteelin irtauma ja interstitiaalinen keuhkosairaus/pneumoniitti (liittyy ensisijaisesti trametinibiin).
Annoksen sovittamista tai hoidon keskeyttämistä ei suositella, jos potilaalle ilmaantuu haittavaikutuksena ihomaligniteetti (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Taulukko 2 Annoksen sovittaminen haittavaikutuksen vaikeusasteen mukaan (kuumetta lukuun ottamatta)
| Vaikeusaste (CTCAE)* | Suositeltu dabrafenibiannoksen sovittaminen |
| 1. tai 2. aste (siedettävissä) | Hoitoa jatketaan ja potilaan tilaa seurataan kliinisen tilanteen mukaan. |
| 2. aste (kestämätön) tai 3. aste | Hoito keskeytetään, kunnes vaikeusaste on laskenut tasolle 0–1. Hoitoa jatketaan yhtä annostasoa pienemmällä annoksella. Annostasosuositukset, ks. taulukko 3. |
| 4. aste | Hoito lopetetaan pysyvästi tai keskeytetään, kunnes vaikeusaste on laskenut tasolle 0–1. Hoitoa jatketaan yhtä annostasoa pienemmällä annoksella. Annostasosuositukset, ks. taulukko 3. |
| *Kliinisten haittavaikutusten vaikeusaste on määritetty CTCAE‑kriteerien (Common Terminology Criteria for Adverse Events) mukaan. | |
Taulukko 3 Annostasosuositukset annoksen pienentämiseen haittavaikutuksen yhteydessä
| Paino | Suositeltu annos (mg dabrafenibia) kahdesti vuorokaudessa | Pienennetty annos (10 mg:n tablettien määrä) kahdesti vuorokaudessa | ||
| 1. pienennystaso | 2. pienennystaso | 3. pienennystaso | ||
| 8–9 kg | 20 mg | 1 | Ei mahdollinen | Ei mahdollinen |
| 10–13 kg | 30 mg | 2 | 1 | Ei mahdollinen |
| 14–17 kg | 40 mg | 3 | 2 | 1 |
| 18–21 kg | 50 mg | 3 | 2 | 1 |
| 22–25 kg | 60 mg | 4 | 3 | 2 |
| 26–29 kg | 70 mg | 5 | 4 | 2 |
| 30–33 kg | 80 mg | 5 | 4 | 3 |
| 34–37 kg | 90 mg | 6 | 5 | 3 |
| 38–41 kg | 100 mg | 7 | 5 | 3 |
| 42–45 kg | 110 mg | 7 | 6 | 4 |
| 46–50 kg | 130 mg | 9 | 7 | 4 |
| ≥ 51 kg | 150 mg | 10 | 8 | 5 |
| Finlee-hoito on lopetettava pysyvästi, jos potilas ei siedä 10 mg:n annosta kahdesti vuorokaudessa tai kolmen pienennyksen jälkeistä annosta. | ||||
Kun potilaan haittavaikutukset on saatu tehokkaasti hallintaan, voidaan harkita annoksen nostamista uudelleen samojen annostasojen kautta kuin annosta pienennettäessä. Dabrafenibiannos ei saa ylittää taulukossa 1 esitettyä suositeltua annosta.
Annosmuutokset valikoitujen haittavaikutusten kohdalla
Kuume
Dabrafenibi‑ ja trametinibihoito on keskeytettävä, jos potilaan ruumiinlämpö on ≥ 38 °C. Kuumeilun toistuessa hoito voidaan keskeyttää myös ensimmäisten kuumeen oireiden ilmaannuttua. Hoito kuumelääkkeillä, kuten ibuprofeenilla tai parasetamolilla on aloitettava. Oraalisten kortikosteroidien käyttöä on harkittava tapauksissa, joissa kuumelääkkeet ovat riittämättömiä. Potilaan infektio‑oireet ja ‑löydökset on arvioitava ja tarvittaessa hoidettava paikallisten hoitokäytäntöjen mukaan (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Hoito on aloitettava uudelleen, kun potilas on ollut oireeton vähintään 24 tunnin ajan joko (1) samalla annoksella tai (2) yhtä pienemmällä annoksella, jos kuume oli toistuvaa ja/tai siihen liittyi muita vaikeita oireita, kuten nestehukka, verenpaineen lasku tai munuaisten vajaatoiminta.
Annosmuutoksia koskevat poikkeukset (kun vain toisen valmisteen annosta pienennetään) valikoitujen haittavaikutusten osalta
Uveiitti
Annosta ei tarvitse muuttaa uveiitin takia, jos silmätulehdus saadaan pidettyä hallinnassa tehokkailla paikallishoidoilla. Jos uveiitti ei reagoi silmän paikalliseen hoitoon, dabrafenibihoito on tauotettava, kunnes silmätulehdus on parantunut, ja aloitettava uudelleen yhtä annostasoa pienemmällä annoksella. Trametinibin annosta ei tarvitse muuttaa yhdistelmähoidossa dabrafenibin kanssa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Muut RAS‑mutaatiopositiiviset syövät kuin ihosyöpä
Hyötyjä ja riskejä on punnittava ennen dabrafenibihoidon jatkamista, jos potilaalla on muu RAS‑mutaatiopositiivinen syöpä kuin ihosyöpä. Trametinibin annosta ei ole tarpeen muuttaa yhdistelmähoidossa dabrafenibin kanssa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Vasemman kammion ejektiofraktion (LVEF) pieneneminen / vasemman kammion toimintahäiriö
Jos potilaalla esiintyy > 10 %:n absoluuttinen vasemman kammion ejektiofraktion lasku lähtötasoon verrattuna ja ejektiofraktio alittaa hoitolaitoskohtaisen viitealueen alarajan, katso trametinibin annosmuutosohjeet trametinibin (jauhe oraaliliuosta varten) valmisteyhteenvedosta (kohta Annostus ja antotapa). Dabrafenibin annosta ei tarvitse muuttaa yhdistelmähoidossa trametinibin kanssa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Verkkokalvon laskimotukos ja verkkokalvon pigmenttiepiteelin irtauma
Jos potilas ilmoittaa uusista näköhäiriöistä, kuten keskeisen näön heikkenemisestä, näön hämärtymisestä tai näön menetyksestä, milloin tahansa dabrafenibin ja trametinibin yhdistelmähoidon aikana, katso trametinibin annosmuutosohjeet trametinibin (jauhe oraaliliuosta varten) valmisteyhteenvedosta (kohta Annostus ja antotapa). Dabrafenibin annosta ei tarvitse muuttaa yhdistelmähoidossa trametinibin kanssa vahvistetun verkkokalvon laskimotukoksen tai verkkokalvon pigmenttiepiteelin irtauman takia.
Interstitiaalinen keuhkosairaus/pneumoniitti
Jos dabrafenibia ja trametinibia yhdistelmähoitona saavalla potilaalla epäillään kliinisten tutkimusten aikana interstitiaalista keuhkosairautta tai pneumoniittia ja myös jos potilaalla on uusia tai eteneviä keuhko‑oireita ja ‑löydöksiä, kuten yskää, hengenahdistusta, hypoksiaa, nestettä keuhkopussissa tai infiltraatteja, katso trametinibin annosmuutosohjeet trametinibin (jauhe oraaliliuosta varten) valmisteyhteenvedosta (kohta Annostus ja antotapa). Dabrafenibin annosta ei tarvitse muuttaa yhdistelmähoidossa trametinibin kanssa interstitiaalisen keuhkosairauden tai pneumoniitin takia.
Erityisryhmät
Maksan vajaatoiminta
Annosta ei tarvitse sovittaa lievässä maksan vajaatoiminnassa. Keskivaikeasta tai vaikeasta maksan vajaatoiminnasta ei ole kliinistä tutkimustietoa, joten annoksen sovittamisen tarvetta ei voida arvioida (ks. kohta Farmakokinetiikka). Dabrafenibi ja sen metaboliitit poistuvat elimistöstä ensisijaisesti metaboloitumalla maksassa ja erittymällä sappeen, joten keskivaikea ja vaikea maksan vajaatoiminta voivat suurentaa lääkeainealtistusta. Dabrafenibin käytössä on noudatettava varovaisuutta keskivaikeassa tai vaikeassa maksan vajaatoiminnassa.
Munuaisten vajaatoiminta
Annosta ei tarvitse sovittaa lievässä tai keskivaikeassa munuaisten vajaatoiminnassa. Vaikeasta munuaisten vajaatoiminnasta ei ole kliinistä tutkimustietoa, joten annoksen sovittamisen tarvetta ei voida arvioida (ks. kohta Farmakokinetiikka). Dabrafenibin käytössä on noudatettava varovaisuutta vaikeassa munuaisten vajaatoiminnassa.
Pediatriset potilaat
Dabrafenibi‑trametinibiyhdistelmähoidon turvallisuutta ja tehoa alle 1 vuoden ikäisten lasten hoidossa ei ole varmistettu. Tietoja ei ole saatavilla. Eläinkokeissa, joissa dabrafenibia on annettu nuorille eläimille, on tullut esiin vaikutuksia, joita ei havaittu täysikasvuisilla eläimillä (ks. kohta Prekliiniset tiedot turvallisuudesta). Pediatrisia potilaita koskevia pitkän aikavälin tietoja on toistaiseksi vain vähän.
Antotapa
Finlee on tarkoitettu otettavaksi suun kautta.
Finlee otetaan ilman ruokaa vähintään 1 tunti ennen ateriaa tai 2 tuntia aterian jälkeen (ks. kohta Farmakokinetiikka). Rintamaitoa ja/tai äidinmaidonkorviketta voidaan antaa tarpeen mukaan, jos potilas ei siedä paasto‑olosuhteita.
On suositeltavaa, että Finlee‑annokset otetaan joka päivä samaan aikaan noin 12 tunnin välein. Kerran vuorokaudessa otettava trametinibiannos on otettava samaan aikaan joka päivä joko Finlee‑valmisteen aamuannoksen tai ilta‑annoksen yhteydessä.
Jos potilas ei kykene nielemään ja hänellä on nenä‑mahaletku, Finlee‑tabletit voidaan antaa suspensiona letkun kautta.
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet suspension valmistuksesta ja annosta.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Finlee on tarkoitettu käytettäväksi yhdessä trametinibin (jauhe oraaliliuosta varten) kanssa, koska dabrafenibi- ja trametinibimonoterapian tehoa koskevat tiedot ovat rajalliset BRAF V600 -mutaatiopositiivisen gliooman hoidossa. Trametinibin valmisteyhteenvetoon on perehdyttävä ennen hoidon aloittamista. Lisätiedot trametinibihoitoon liittyvistä varoituksista ja varotoimista, ks. trametinibin valmisteyhteenveto.
BRAF V600E ‑testaus
Dabrafenibin tehoa ja turvallisuutta ei ole varmistettu villityypin BRAF‑geeniä ilmentävän gliooman hoidossa. Dabrafenibia ei pidä käyttää, jos potilaalla on villityypin BRAF‑geeniä ilmentävä gliooma (ks. kohta Farmakodynamiikka).
Uudet maligniteetit
Uusia maligniteetteja (ihomaligniteetteja ja muita maligniteetteja) saattaa esiintyä, kun dabrafenibia käytetään yhdessä trametinibin kanssa.
Ihomaligniteetit
Dabrafenibin ja trametinibin yhdistelmällä hoidetuilla aikuispotilailla on todettu ihomaligniteetteja, kuten ihon okasolusyöpää (mukaan lukien keratoakantooma) ja uusia primaarimelanoomia (ks. kohta Haittavaikutukset). Dermatologinen tutkimus tulisi tehdä ennen dabrafenibihoidon aloittamista ja kuukausittain hoidon aikana sekä kuuden kuukauden ajan hoidon jälkeen. Seurantaa on jatkettava kuuden kuukauden ajan dabrafenibihoidon lopettamisen jälkeen tai kunnes aloitetaan jokin muu syöpälääkitys.
Epäilyttävät ihomuutokset on poistettava kirurgisesti. Hoitoa ei tarvitse muuttaa. Potilaita on kehotettava ottamaan heti yhteys lääkäriin, jos uusia ihomuutoksia ilmaantuu.
Muut syöpäsairaudet kuin ihosyöpä
In vitro ‑tutkimuksissa on havaittu mitogeenien aktivoiman proteiinikinaasin (MAP‑kinaasin) signaloinnin paradoksaalista aktivoitumista villityypin BRAF‑geeniä ilmentävissä soluissa, joissa oli RAS‑mutaatioita, kun solut altistettiin BRAF:n estäjille. Tämä voi lisätä muiden syöpien kuin ihosyöpien riskiä dabrafenibialtistuksen yhteydessä (ks. kohta Haittavaikutukset), kun potilaalla on RAS‑mutaatioita. RAS‑mutaatioihin liittyviä syöpäsairauksia on raportoitu aikuisilla tehdyissä kliinisissä tutkimuksissa toisen BRAF:n estäjän käytön yhteydessä (kroonista myelomonosyyttistä leukemiaa ja muualla kuin iholla esiintyvää levyepiteelikarsinoomaa pään ja kaulan alueella) käytettäessä dabrafenibia yksinään (haiman adenokarsinooma, sappiteiden adenokarsinooma) sekä dabrafenibin ja trametinibin yhdistelmäkäytössä (kolorektaalisyöpä, haimasyöpä).
Dabrafenibihoidon hyötyjä ja riskejä on arvioitava ennen hoidon aloittamista potilailla, joilla on aiemmin ollut tai joilla parhaillaan on RAS‑mutaatioihin liittyvä syöpä. Potilaat on seulottava piilevien, olemassa olevien maligniteettien varalta.
Kun dabrafenibihoito lopetetaan, muiden kuin ihon sekundaaristen/uusiutuvien pahanlaatuisten kasvaimien ilmaantumista on seurattava 6 kuukauden ajan tai kunnes toinen antineoplastinen hoito aloitetaan. Poikkeavat löydökset on hoidettava hoitokäytännön mukaisesti.
Verenvuoto
Dabrafenibin ja trametinibin yhdistelmää käyttävillä aikuisilla ja pediatrisilla potilailla on raportoitu verenvuototapahtumia (ks. kohta Haittavaikutukset). Dabrafenibin ja trametinibin yhdistelmää käyttävillä aikuispotilailla on esiintynyt merkittäviä verenvuototapahtumia ja kuolemaan johtaneita verenvuotoja. Näiden tapahtumien mahdollisuutta ei ole varmistettu potilailla, joilla on alhainen trombosyyttiarvo (< 75 E9/l), sillä tällaiset potilaat suljettiin pois kliinisistä tutkimuksista. Samanaikainen antitromboottinen lääkitys tai antikoagulanttihoito saattaa suurentaa verenvuotoriskiä. Jos verenvuotoa esiintyy, potilasta on hoidettava kliinisen tilanteen mukaisesti.
Näön heikkeneminen
Dabrafenibin ja trametinibin yhdistelmää käyttävillä pediatrisilla potilailla on raportoitu silmäoireita, kuten uveiittia ja iridosykliittiä (ks. kohta Haittavaikutukset). Joissakin tapauksissa oireiden alkamiseen on kulunut useita kuukausia. Kliinisissä tutkimuksissa silmäoireita, kuten uveiittia, iridosykliittiä ja iriittiä, on raportoitu aikuispotilailla, jotka ovat saaneet dabrafenibihoitoa. Mahdollisten silmäoireiden (kuten näön muutosten, valonarkuuden ja silmäkivun) esiintymistä on tarkkailtava rutiinimaisesti hoidon aikana.
Annoksen sovittaminen ei ole tarpeen, mikäli paikallishoidot ovat riittäviä hillitsemään silmätulehdusta. Mikäli silmän paikallishoidolla ei saada riittävää vastetta uveiitin hoidossa, dabrafenibihoito keskeytetään, kunnes silmätulehdusoireet ovat hävinneet. Dabrafenibihoitoa voidaan tällöin jatkaa yhtä annostasoa pienemmällä annoksella. Trametinibin annosta ei tarvitse muuttaa yhdistelmähoidossa dabrafenibin kanssa uveiittidiagnoosin jälkeen.
Vogt-Koyanagi-Haradan oireyhtymään viittaavia biokulaarista panuveiittia tai biokulaarista iridosykliittiä on raportoitu dabrafenibia trametinibin kanssa yhdistelmähoitona saaneilla potilailla. Dabrafenibihoito on keskeytettävä, kunnes silmätulehdusoireet ovat hävinneet, ja harkittava silmälääkärin puoleen kääntymistä. Systeeminen kortikosteroidihoito voi olla tarpeen.
Verkkokalvon laskimotukoksia ja verkkokalvon pigmenttiepiteelin irtaumia saattaa esiintyä dabrafenibin ja trametinibin yhdistelmähoidossa. Ks. trametinibin (jauhe oraaliliuosta varten) valmisteyhteenveto (kohta Varoitukset ja käyttöön liittyvät varotoimet). Dabrafenibin annosta ei tarvitse muuttaa yhdistelmähoidossa trametinibin kanssa verkkokalvon laskimotukos‑ tai verkkokalvon pigmenttiepiteelin irtaumadiagnoosin jälkeen.
Kuume
Kliinisissä dabrafenibitutkimuksissa aikuispotilailla ja pediatrisilla potilailla on ilmoitettu kuumetta (ks. kohta Haittavaikutukset). Vakavia ei‑infektioperäisiä kuumetapahtumia esiintyi (tällaisiksi tapahtumiksi todettiin kuume, johon liittyi voimakkaita vilunväristyksiä, nestehukkaa, verenpaineen laskua ja/tai prerenaalisen syyn aiheuttamaa akuuttia munuaisten vajaatoimintaa potilailla, joiden munuaiset olivat toimineet normaalisti lähtötilanteessa). Dabrafenibin ja trametinibin yhdistelmää saaneilla pediatrisilla potilailla mediaaniaika kuumeen ensimmäiseen ilmaantumiseen oli 1,5 kk. Dabrafenibin ja trametinibin yhdistelmää saaneista aikuispotilaista, joilla oli leikattavaksi soveltumaton tai metastasoitunut melanooma ja joille kehittyi kuume, noin puolella kuumeen ensimmäinen ilmaantuminen tapahtui ensimmäisen hoitokuukauden aikana ja noin kolmasosalla todettiin vähintään kolme kuumetapahtumaa. Potilaat, joilla vakavia ei‑infektioperäisiä kuumetapahtumia esiintyi, reagoivat hyvin hoidon keskeyttämiseen ja/tai annoksen pienentämiseen ja tukihoitotoimenpiteisiin.
Dabrafenibi‑ ja trametinibihoito on keskeytettävä, jos potilaan ruumiinlämpö on ≥ 38 °C (ks. kohta Farmakodynamiikka). Toistuvassa kuumeilussa hoito voidaan keskeyttää myös ensimmäisten kuumeen oireiden ilmaannuttua. Hoito kuumelääkkeillä, kuten ibuprofeenilla tai parasetamolilla, on aloitettava. Oraalisten kortikosteroidien käyttöä on harkittava tapauksissa, joissa kuumelääkkeet ovat riittämättömiä. Potilaan infektio‑oireet ja ‑löydökset on arvioitava. Hoito voidaan aloittaa uudelleen kuumeen laskettua. Jos kuumeeseen liittyy muita vaikeita oireita tai löydöksiä, hoitoa on jatkettava pienemmällä annoksella kuumeen laskettua ja kun se on kliinisesti tarkoituksenmukaista (ks. kohta Annostus ja antotapa).
Vasemman kammion ejektiofraktion (LVEF) pieneneminen / vasemman kammion toimintahäiriö
Dabrafenibin ja trametinibin yhdistelmähoidon on todettu pienentävän vasemman kammion ejektiofraktiota sekä aikuisilla että pediatrisilla potilailla (ks. kohta Haittavaikutukset). Pediatrisilla potilailla toteutetuissa kliinisissä tutkimuksissa mediaaniaika vasemman kammion ejektiofraktion ensimmäiseen pienenemiseen oli noin 1 kuukausi. Aikuispotilailla toteutetuissa kliinisissä tutkimuksissa mediaaniaika vasemman kammion toimintahäiriön ja sydämen vajaatoiminnan ensimmäiseen ilmaantumiseen ja vasemman kammion ejektiofraktion ensimmäiseen pienenemiseen oli 2–5 kuukautta.
Potilailla, jotka käyttävät dabrafenibia yhdessä trametinibin kanssa, on raportoitu yksittäisiä myokardiitista johtuvia akuutteja vaikeita vasemman kammion toimintahäiriöitä. Potilaat toipuivat täysin, kun hoito lopetettiin. Lääkäreiden pitää ottaa huomioon myokardiitin mahdollisuus potilailla, joille ilmaantuu uusia tai pahenevia sydämeen liittyviä löydöksiä tai oireita. Lisätiedot, ks. trametinibin (jauhe oraaliliuosta varten) valmisteyhteenveto (kohta Varoitukset ja käyttöön liittyvät varotoimet). Dabrafenibin annosta ei tarvitse muuttaa yhdistelmähoidossa trametinibin kanssa.
Munuaisten vajaatoiminta
Munuaisten vajaatoimintaa on todettu ≤ 1 %:lla aikuispotilaista, joita on hoidettu dabrafenibilla yhdessä trametinibin kanssa. Aikuispotilailla todettuihin tapauksiin liittyi yleensä kuumetta ja nestehukkaa ja potilaat reagoivat hyvin hoidon keskeyttämiseen ja tavanomaisiin tukitoimenpiteisiin. Myös granulomatoottista nefriittiä on raportoitu aikuispotilailla. Potilaan seerumin kreatiniinia on säännöllisesti seurattava hoidon aikana. Jos kreatiniiniarvo nousee, potilaan kliininen tila saattaa vaatia hoidon keskeyttämistä. Dabrafenibia ei ole tutkittu munuaisten vajaatoiminnassa (kreatiniini > 1,5 x ULN), joten varovaisuutta on noudatettava näillä potilailla (ks. kohta Farmakokinetiikka).
Maksaan liittyvät tapahtumat
Kliinisissä tutkimuksissa aikuisilla ja pediatrisilla potilailla on raportoitu maksaan kohdistuvia haittavaikutuksia, kun dabrafenibia on käytetty yhdessä trametinibin kanssa (ks. kohta Haittavaikutukset). Potilaiden maksan toimintaa suositellaan seurattavan neljän viikon välein kuuden kuukauden ajan hoidon aloittamisen jälkeen. Maksa‑arvojen seurantaa voidaan jatkaa myös tämän jälkeen kliinisen tarpeen mukaan.
Verenpaineen muutokset
Kliinisissä tutkimuksissa dabrafenibin ja trametinibin yhdistelmää käyttäneillä potilailla on raportoitu sekä hypertensiota että hypotensiota (ks. kohta Haittavaikutukset). Verenpaine on mitattava lähtötilanteessa, ja sitä on seurattava hoidon aikana. Hypertensiota on tarvittaessa hoidettava tavanomaisella hoidolla.
Interstitiaalinen keuhkosairaus/pneumoniitti
Kliinisissä tutkimuksissa aikuispotilailla on raportoitu interstitiaalista keuhkosairautta ja pneumoniittia, kun dabrafenibia on käytetty yhdessä trametinibin kanssa. Lisätiedot, ks. trametinibin (jauhe oraaliliuosta varten) valmisteyhteenveto.
Ihottuma
Kliinisissä tutkimuksissa on havaittu ihottumaa 49 %:lla pediatrisista potilaista, kun dabrafenibia on käytetty yhdessä trametinibin kanssa (ks. kohta Haittavaikutukset). Suurimmassa osassa näistä tapauksista ihottuman vaikeusaste oli 1 tai 2, eikä se vaatinut hoidon keskeyttämistä eikä annoksen pienentämistä.
Vaikeat ihoon kohdistuvat haittavaikutukset
Dabrafenibin ja trametinibin yhdistelmähoidon aikana aikuispotilailla on ilmoitettu vaikeita ihoon kohdistuneita haittavaikutuksia, mukaan lukien Stevens–Johnsonin oireyhtymää ja DRESS‑reaktioita (lääkereaktio, johon liittyy eosinofiliaa ja systeemisiä oireita), jotka voivat olla henkeä uhkaavia tai johtaa kuolemaan. Ennen hoidon aloitusta potilaille on kerrottava ihoreaktioiden oireista ja löydöksistä, ja heitä on seurattava niiden varalta tarkoin. Jos vaikeisiin ihoon kohdistuviin haittavaikutuksiin viittaavia oireita ja löydöksiä esiintyy, dabrafenibin ja trametinibin käyttö on lopetettava.
Rabdomyolyysi
Rabdomyolyysia on raportoitu aikuispotilailla, jotka ovat käyttäneet dabrafenibia yhdessä trametinibin kanssa. Rabdomyolyysin oireet ja löydökset vaativat asianmukaista kliinistä selvittelyä ja tarvittaessa hoitoa. Lisätiedot, ks. trametinibin (jauhe oraaliliuosta varten) valmisteyhteenveto.
Haimatulehdus
Kliinisissä tutkimuksissa dabrafenibin ja trametinibin yhdistelmällä hoidetuilla aikuisilla ja pediatrisilla potilailla on raportoitu haimatulehdusta (ks. kohta Haittavaikutukset). Selittämätön vatsakipu on tutkittava heti, ja seerumin amylaasi‑ ja lipaasiarvot on tarkistettava. Potilaan tilaa on seurattava tarkoin, kun hoito aloitetaan uudelleen haimatulehdusepisodin jälkeen.
Syvä laskimotukos/keuhkoembolia
Keuhkoembolioita tai syviä laskimotukoksia saattaa esiintyä. Jos potilaalla ilmenee keuhkoembolian tai syvän laskimotukoksen oireita, kuten hengenahdistusta, rintakipua tai käsivarren tai jalan turvotusta, hänen on hakeuduttava välittömästi lääkärin hoitoon. Hoito on lopetettava pysyvästi, jos potilaalla on henkeä uhkaava keuhkoembolia.
Ruoansulatuselimistö
Dabrafenibin ja trametinibin yhdistelmällä hoidetuilla pediatrisilla potilailla on raportoitu koliittia ja enterokoliittia (ks. kohta Haittavaikutukset). Koliittia ja ruoansulatuskanavan perforaatioita (myös kuolemaan johtaneita tapauksia) on raportoitu dabrafenibia yhdessä trametinibin kanssa käyttäneillä aikuispotilailla. Lisätiedot, ks. trametinibin (jauhe oraaliliuosta varten) valmisteyhteenveto.
Sarkoidoosi
Dabrafenibin ja trametinibin yhdistelmällä hoidetuilla aikuispotilailla on ilmoitettu sarkoidoositapauksia. Haittavaikutukset ovat kohdistuneet pääasiassa ihoon, keuhkoihin, silmiin ja imusolmukkeisiin. Suurimmassa osassa tapauksia dabrafenibi‑ ja trametinibihoitoa jatkettiin. Sarkoidoosidiagnoosin yhteydessä on harkittava asianmukaista hoitoa.
Naiset, jotka voivat tulla raskaaksi / Miesten hedelmällisyys
Naisille, jotka voivat tulla raskaaksi, on annettava asianmukaista neuvontaa tehokkaista ehkäisymenetelmistä ennen hoidon aloittamista. Naisten, jotka voivat tulla raskaaksi, on käytettävä tehokasta ehkäisyä hoidon aikana ja 2 viikkoa dabrafenibihoidon päättymisen jälkeen ja 16 viikkoa trametinibihoidon päättymisen jälkeen. Dabrafenibia yhdessä trametinibin kanssa käyttäville miespotilaille on kerrottava mahdollisesta siittiötuotannon vähenemisestä, joka voi olla pysyvää (ks. kohta Raskaus ja imetys).
Hemofagosyyttinen lymfohistiosytoosi
Myyntiluvan myöntämisen jälkeen dabrafenibia ja trametinibia yhdistelmähoitona saavilla aikuispotilailla on havaittu hemofagosyyttista lymfohistiosytoosia (HLH). Käytettäessä dabrafenibia yhdessä trametinibin kanssa on noudatettava varovaisuutta. Jos potilaalla on vahvistettu HLH, on lopetettava dabrafenibin ja trametinibin yhdistelmähoidon antaminen ja aloitettava HLH:n hoito.
Tuumorilyysioireyhtymä
Dabrafenibin ja trametinibin yhdistelmähoidon käyttöön on liittynyt tuumorilyysioireyhtymää, joka voi johtaa kuolemaan (ks. kohta Haittavaikutukset). Tuumorilyysioireyhtymän riskitekijöitä ovat suuri kasvaintaakka, olemassa oleva krooninen munuaisten vajaatoiminta, oliguria, nestehukka, hypotensio ja hapan virtsa. Potilaita, joilla on tuumorilyysioireyhtymän riskitekijöitä, on seurattava huolellisesti ja profylaktista nesteytystä on harkittava. Tuumorilyysioireyhtymä on hoidettava viipymättä kliinisen tarpeen mukaan.
Muiden lääkkeiden vaikutukset dabrafenibiin
Dabrafenibi on CYP2C8:n ja CYP3A4:n substraatti. Näiden entsyymien voimakkaiden induktoreiden käyttöä on vältettävä, mikäli mahdollista, sillä ne voivat heikentää dabrafenibin tehoa (ks. kohta Yhteisvaikutukset).
Dabrafenibin vaikutukset muihin lääkkeisiin
Dabrafenibi on metaboloivien entsyymien induktori, mikä saattaa heikentää monien yleisesti käytettyjen lääkeaineiden tehoa (ks. esimerkkejä kohdasta Yhteisvaikutukset). Siksi on välttämätöntä tehdä lääkitysarvio dabrafenibihoitoa aloitettaessa. Dabrafenibin yhteiskäyttöä on yleensä syytä välttää sellaisten lääkeaineiden kanssa, jotka ovat tiettyjen metaboloivien entsyymien tai kuljetusproteiinien (ks. kohta Yhteisvaikutukset) herkkiä substraatteja, ellei tehon seuranta ja annoksen sovittaminen ole mahdollista.
Dabrafenibin anto samanaikaisesti varfariinin kanssa vähentää altistumista varfariinille. Varovaisuutta on syytä noudattaa ja ylimääräisiä INR (International Normalised Ratio) ‑määrityksiä suositellaan, kun dabrafenibia käytetään samanaikaisesti varfariinin kanssa ja kun dabrafenibihoito lopetetaan (ks. kohta Yhteisvaikutukset).
Dabrafenibin anto samanaikaisesti digoksiinin kanssa saattaa vähentää altistumista digoksiinille. Varovaisuutta on noudatettava ja digoksiinin lisäseurantaa suositellaan, kun digoksiinia (kuljetussubstraatti) käytetään samanaikaisesti dabrafenibin kanssa ja kun dabrafenibihoito lopetetaan (ks. kohta Yhteisvaikutukset).
Apuaineet
Kalium
Tämä lääkevalmiste sisältää kaliumia alle 1 mmol (39 mg) per enimmäisvuorokausiannos, eli sen voidaan sanoa olevan ”kaliumiton”.
Bentsyylialkoholi
Tämä lääkevalmiste sisältää < 0,00078 mg bentsyylialkoholia per dispergoituva tabletti.
Bentsyylialkoholi saattaa aiheuttaa allergisia reaktioita.
Alle 3‑vuotiaita potilaita on seurattava hengitystieoireiden varalta.
Potilaille, jotka ovat raskaana tai voivat tulla raskaaksi, on kerrottava apuaine bentsyylialkoholin aiheuttamasta mahdollisesta riskistä sikiölle; bentsyylialkoholi voi ajan mittaan kertyä elimistöön ja aiheuttaa metabolisen asidoosin.
Dispergoituvia dabrafenibitabletteja on käytettävä varoen potilaille, joilla on maksan tai munuaisten vajaatoiminta, sillä bentsyylialkoholi voi ajan mittaan kertyä elimistöön ja aiheuttaa metabolisen asidoosin.
Yhteisvaikutukset
Yhteisvaikutuksia on tutkittu vain aikuisille tehdyissä tutkimuksissa.
Muiden lääkkeiden vaikutus dabrafenibiin
Dabrafenibi on metaboloivien CYP2C8‑ ja CYP3A4‑entsyymien substraatti, ja sen aktiiviset metaboliitit, hydroksidabrafenibi ja desmetyylidabrafenibi, ovat CYP3A4‑entsyymin substraatteja. Siksi lääkeaineet, jotka ovat CYP2C8:n tai CYP3A4:n voimakkaita estäjiä, todennäköisesti suurentavat dabrafenibipitoisuuksia, ja näiden entsyymien voimakkaat induktorit puolestaan pienentävät dabrafenibipitoisuutta. Dabrafenibihoidon aikana on harkittava vaihtoehtoisten lääkkeiden käyttöä, mikäli mahdollista. Dabrafenibin käytössä on noudatettava varovaisuutta, jos voimakkaita estäjiä (esim. ketokonatsolia, gemfibrotsiilia, nefatsodonia, klaritromysiiniä, ritonaviiria, sakinaviiria, telitromysiiniä, itrakonatsolia, vorikonatsolia, posakonatsolia, atatsanaviiria) annetaan dabrafenibihoidon aikana. Dabrafenibin ja CYP2C8:n tai CYP3A4:n voimakkaiden induktoreiden (esim. rifampisiinin, fenytoiinin, karbamatsepiinin, fenobarbitaalin tai mäkikuisman [Hypericum perforatum]) yhteiskäyttöä on vältettävä.
Ketokonatsoli (CYP3A4:n estäjä) 400 mg kerran päivässä annettuna samanaikaisesti dabrafenibin kanssa suurensi dabrafenibin AUC‑arvoa 71 % ja Cmax‑arvoa 33 %, kun dabrafenibin annostus oli 75 mg kahdesti päivässä, verrattuna tilanteeseen, kun dabrafenibia annettiin yksinään. Näiden lääkkeiden samanaikainen anto suurensi hydroksidabrafenibin AUC‑arvoa 82 % ja desmetyylidabrafenibin AUC‑arvoa 68 %. Karboksidabrafenibin AUC‑arvo pieneni 16 %.
Gemfibrotsiili (CYP2C8:n estäjä) 600 mg kahdesti päivässä annettuna dabrafenibin kanssa suurensi dabrafenibin AUC‑arvoa 47 %, kun dabrafenibin annostus oli 75 mg kahdesti päivässä, verrattuna tilanteeseen, kun dabrafenibia annettiin yksinään. Dabrafenibin Cmax‑arvo ei muuttunut samanaikaisessa annossa. Altistuminen dabrafenibin metaboliiteille ei muuttunut kliinisesti merkittävästi (≤ 13 %) gemfibrotsiilin vaikutuksesta.
Rifampisiini (CYP3A4:n/CYP2C8:n induktori) 600 mg kerran päivässä annettuna yhdessä dabrafenibin 150 mg kahdesti päivässä kanssa aiheutti toistuvasti annetun dabrafenibin Cmax‑arvon (27 %) ja AUC‑arvon (34 %) alenemisen. Hydroksidabrafenibin kohdalla ei havaittu merkittävää muutosta AUC‑arvossa. Karboksidabrafenibin kohdalla AUC‑arvo suureni 73 % ja desmetyylidabrafenibin kohdalla AUC‑arvo aleni 30 %.
Toistuvasti annettu dabrafenibi 150 mg kahdesti päivässä yhteiskäytössä pH‑arvoa nostavan rabepratsolin 40 mg kerran päivässä kanssa aiheutti 3 %:n suurenemisen AUC‑arvossa ja 12 %:n alenemisen dabrafenibin Cmax‑arvossa. Näiden muutosten dabrafenibin AUC‑ ja Cmax‑arvoissa ei katsota olevan kliinisesti merkittäviä. Lääkevalmisteiden, jotka muuttavat pH‑arvoa ruoansulatuskanavan ylemmässä osassa (esim. protonipumpun estäjät, H2‑ reseptorisalpaajat, antasidit), ei odoteta vähentävän dabrafenibin hyötyosuutta.
Dabrafenibin vaikutus muihin lääkkeisiin
Dabrafenibi on entsyymi‑induktori, ja se lisää lääkeaineita metaboloivien entsyymien, kuten CYP3A4:n, CYP2C‑entsyymien ja CYP2B6:n, ja mahdollisesti myös kuljetusproteiinien synteesiä. Tämä pienentää näiden entsyymien metaboloimien lääkeaineiden pitoisuuksia plasmassa ja saattaa vaikuttaa myös joihinkin kuljetusproteiinien kuljettamiin lääkeaineisiin. Plasman pitoisuuksien pieneneminen voi heikentää näiden lääkeaineiden tehoa tai tehdä ne tehottomiksi. Näiden lääkeaineiden aktiivisten metaboliittien muodostuminen saattaa myös lisääntyä. Mahdollisia indusoituvia entsyymejä ovat CYP3A maksassa ja suolistossa, CYP2B6, CYP2C8, CYP2C9, CYP2C19 ja UGT:t (glukuronidien konjugaatiosta vastaavat entsyymit). Kuljetusproteiini P‑gp ja myös muut kuljetusproteiinit, kuten MRP‑2, saattavat indusoitua. Rosuvastatiinilla tehdyn kliinisen tutkimuksen havaintojen perusteella OATP1B1/1B3‑ ja BCRP‑kuljetusproteiinien indusoituminen ei ole todennäköistä.
Dabrafenibi lisäsi CYP2B6‑ ja CYP3A4‑entsyymien määrää annoksesta riippuvasti in vitro. Kliinisessä lääkeaineiden yhteisvaikutustutkimuksessa suun kautta otetun midatsolaamin (CYP3A4:n substraatti) Cmax‑arvo pieneni 47 % ja AUC‑arvo 65 %, kun sitä annettiin samanaikaisesti toistuvien dabrafenibiannosten kanssa.
Dabrafenibi yhdessä varfariinin kanssa pienensi S‑varfariinin AUC‑arvoa 37 % ja R‑varfariinin AUC‑arvoa 33 % verrattuna tilanteeseen, kun varfariinia annettiin yksinään. S‑varfariinin Cmax‑arvo suureni 18 % ja R‑varfariinin Cmax‑arvo suureni 19 %.
Yhteisvaikutukset monien metaboloitumalla tai aktiivisen kuljetuksen kautta eliminoituvien lääkeaineiden kanssa ovat todennäköisiä. Näiden lääkkeiden käyttöä on vältettävä tai niiden käytössä on noudatettava varovaisuutta, jos niiden terapeuttinen teho on potilaalle erittäin tärkeää eikä annoksen sovittamista ole helppo toteuttaa tehoa ja plasman lääkeainepitoisuuksia seuraamalla. Parasetamoliin liittyvien maksavaurioiden riskin epäillään suurenevan, jos potilaat saavat samanaikaisesti entsyymi‑induktoreita.
Yhteisvaikutuksia voi todennäköisesti esiintyä hyvin monien lääkeaineiden kanssa, mutta niiden voimakkuus vaihtelee. Lääkeaineryhmiä, joihin dabrafenibi voi vaikuttaa, ovat muun muassa:
- Analgeetit (esim. fentanyyli, metadoni)
- Antibiootit (esim. klaritromysiini, doksisykliini)
- Syöpälääkkeet (esim. kabatsitakseli)
- Antikoagulantit (esim. asenokumaroli, varfariini, ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
- Epilepsialääkkeet (esim. karbamatsepiini, fenytoiini, primidoni, valproiinihappo)
- Psykoosilääkkeet (esim. haloperidoli)
- Kalsiumkanavan salpaajat (esim. diltiatseemi, felodipiini, nikardipiini, nifedipiini, verapamiili)
- Sydänglykosidit (esim. digoksiini, ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
- Kortikosteroidit (esim. deksametasoni, metyyliprednisoloni)
- HIV‑lääkkeet (esim. amprenaviiri, atatsanaviiri, darunaviiri, delavirdiini, efavirentsi, fosamprenaviiri, indinaviiri, lopinaviiri, nelfinaviiri, sakinaviiri, tipranaviiri)
- Hormonaaliset ehkäisyvalmisteet (ks. kohta Raskaus ja imetys)
- Rauhoittavat lääkkeet (esim. diatsepaami, midatsolaami, tsolpideemi)
- Immunosuppressantit (esim. siklosporiini, takrolimuusi, sirolimuusi)
- CYP3A4‑entsyymin välityksellä metaboloituvat statiinit (esim. atorvastatiini, simvastatiini).
Induktio alkaa todennäköisesti, kun dabrafenibia on annettu toistuvina annoksina 3 vuorokauden ajan. Dabrafenibihoidon lopettamisen jälkeen induktiovaikutus häviää vähitellen, jolloin CYP3A4:n, CYP2B6:n, CYP2C8:n, CYP2C9:n ja CYP2C19:n, UDP‑glukuronosyylitransferaasin (UGT) ja kuljetusproteiinien herkkien substraattien (esim. P‑gp ja MRP‑2) pitoisuudet saattavat suurentua. Potilaiden tilaa on seurattava haittavaikutusten varalta, ja näiden lääkeaineiden annosta voidaan joutua sovittamaan.
Dabrafenibi on vaikutusmekanisminsa perusteella CYP3A4:n estäjä in vitro. Ensimmäisinä hoitopäivinä saatetaan sen vuoksi havaita ohimenevä CYP3A4:n toiminnan estyminen.
Dabrafenibin vaikutukset muiden aineiden kuljetusjärjestelmiin
Dabrafenibi on ihmisen orgaanisten anionien kuljettajapolypeptidien (OATP) 1B1 (OATP1B1), OATP1B3 ja BCRP estäjä in vitro. Kun aikuispotilaille annettiin kerta‑annos rosuvastatiinia (kuljettajapolypeptidien OATP1B1, OATP1B3 ja BCRP substraatti) samanaikaisesti toistuvien dabrafenibiannosten kanssa, nousi rosuvastatiinin Cmax‑arvo 2,6‑kertaiseksi, kun taas AUC‑arvo muuttui vain minimaalisesti (7 %:n nousu). Rosuvastatiinin Cmax‑arvon nousulla ei todennäköisesti ole kliinistä merkitystä.
Ks. lisäksi ohjeet trametinibin yhteisvaikutuksista muiden lääkevalmisteiden kanssa trametinibin (jauhe oraaliliuosta varten) valmisteyhteenvedon kohdista Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset.
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi / Raskauden ehkäisy naisilla
Naisten, jotka voivat tulla raskaaksi, on käytettävä tehokasta ehkäisyä hoidon aikana ja 2 viikkoa dabrafenibihoidon päättymisen jälkeen ja 16 viikkoa trametinibihoidon päättymisen jälkeen.
Dabrafenibi saattaa heikentää suun kautta tai systeemisesti otettujen hormonaalisten ehkäisyvalmisteiden tehoa, joten tehokasta vaihtoehtoista ehkäisymenetelmää, kuten estemenetelmää, on käytettävä (ks. kohta Yhteisvaikutukset).
Raskaus
Ei ole olemassa tietoja dabrafenibin käytöstä raskaana oleville naisille. Eläinkokeissa on havaittu lisääntymistoksisuutta ja alkion‑ ja sikiönkehitykseen kohdistuvia, myös epämuodostumia aiheuttavia, vaikutuksia (ks. kohta Prekliiniset tiedot turvallisuudesta). Dabrafenibia ei pidä antaa raskaana oleville naisille, paitsi jos hoidon odotettu hyöty äidille on suurempi kuin mahdollinen sikiölle aiheutuva riski. Jos potilas tulee raskaaksi dabrafenibihoidon aikana, hänelle on kerrottava mahdollisesta sikiöön kohdistuvasta vaarasta. Ks. lisäksi trametinibia koskevat tiedot trametinibin (jauhe oraaliliuosta varten) valmisteyhteenvedosta (kohta Raskaus ja imetys).
Imetys
Ei tiedetä, erittyykö dabrafenibi ihmisen rintamaitoon. Imetettävään lapseen kohdistuvia riskejä ei voida poissulkea. On päätettävä, lopetetaanko rintaruokinta vai lopetetaanko dabrafenibihoito ottaen huomioon rintaruokinnasta aiheutuvat hyödyt lapselle ja hoidosta koituvat hyödyt äidille.
Hedelmällisyys
Ihmistä koskevia tietoja ei ole dabrafenibin käytöstä trametinibin kanssa. Dabrafenibi saattaa heikentää miehen ja naisen hedelmällisyyttä, sillä eläinkokeissa on havaittu urosten ja naaraiden sukupuolielimiin kohdistuvia vaikutuksia (ks. kohta Prekliiniset tiedot turvallisuudesta). Dabrafenibia yhdessä trametinibin kanssa käyttäville miespotilaille on kerrottava mahdollisesta siittiötuotannon vähenemisestä, joka voi olla pysyvää. Ks. lisätietoja trametinibin (jauhe oraaliliuosta varten) valmisteyhteenvedosta.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Dabrafenibilla on vähäinen vaikutus ajokykyyn ja koneidenkäyttökykyyn. Potilaan kliininen tila ja dabrafenibin haittavaikutusprofiili on otettava huomioon, kun arvioidaan potilaan kykyä selviytyä harkintakykyä ja motorisia tai kognitiivisia taitoja vaativista tehtävistä. Potilaille on kerrottava, että mahdollinen väsymys, huimaus ja silmäoireet voivat vaikuttaa näihin toimintoihin.
Haittavaikutukset
Yhteenveto turvallisuustiedoista
Kliinisissä tutkimuksissa dabrafenibin ja trametinibin yhdistelmällä hoidettujen pediatristen potilaiden yleisimmät haittavaikutukset (raportoitu ≥ 20 %:lla) olivat kuume (70 %), ihottuma (49 %), päänsärky (47 %), oksentelu (40 %), väsymys (36 %), ihon kuivuus (35 %), ripuli (34 %), verenvuoto (34 %), pahoinvointi (29 %), aknetyyppinen dermatiitti (29 %), vatsakipu (28 %), neutropenia (26 %), yskä (24 %) ja transaminaasiarvojen suureneminen (22 %). Yleisimmin raportoidut vaikeat (3. tai 4. asteen) haittavaikutukset olivat neutropenia (15 %), kuume (11 %), transaminaasiarvojen suureneminen (6 %) ja painonnousu (5 %). Pitkäaikaistietoja pediatristen potilaiden kasvusta ja luuston kypsymisestä on tällä hetkellä vain vähän (ks. kohta Prekliiniset tiedot turvallisuudesta).
Turvallisuusprofiili pediatrisilla potilailla oli laajalti yhdenmukainen aikuispotilailla aiemmin todetun turvallisuusprofiilin kanssa. Seuraavia haittavaikutuksia on toistaiseksi raportoitu vain aikuispotilailla, joita on hoidettu dabrafenibikapseleilla ja trametinibitableteilla: ihon okasolusyöpä, seborrooinen keratoosi, perifeerinen neuropatia (mukaan lukien sensorinen ja motorinen neuropatia), lymfedeema, suun kuivuus, aktiininen keratoosi, munuaisten vajaatoiminta (yleisiä); melanooma, ihopolyypit, sarkoidoosi, korioretinopatia, pneumoniitti, akuutti munuaisten vajaatoiminta, munuaistulehdus, sydämen vajaatoiminta, vasemman kammion toimintahäiriö, interstitiaalinen keuhkosairaus, rabdomyolyysi (melko harvinaisia); ruoansulatuskanavan perforaatio, hemofagosyyttinen lymfohistiosytoosi (harvinaisia); tuumorilyysioireyhtymä, myokardiitti, Stevens–Johnsonin oireyhtymä, DRESS‑reaktio (lääkereaktio, johon liittyy eosinofiliaa ja systeemisiä oireita), tatuointeihin liittyvät ihoreaktiot (yleisyys tuntematon). Lisäksi aikuispotilailla on raportoitu Vogt-Koyanagi-Haradan oireyhtymään viittaavia biokulaarista panuveiittia tai biokulaarista iridosykliittiä.
Haittavaikutustaulukko
Dabrafenibin ja trametinibin yhdistelmän turvallisuutta on arvioitu 171 pediatrisen potilaan yhdistetyssä turvallisuuspopulaatiossa, joka sisälsi potilaita kahdesta tutkimuksesta. Potilailla oli BRAF V600 ‑mutaatiopositiivisia pitkälle edenneitä kiinteitä kasvaimia. Tutkimukseenottohetkellä potilaista neljä (2,3 %) oli 1 – < 2‑vuotiaita, 39 (22,8 %) oli 2 – < 6‑vuotiaita, 54 (31,6 %) oli 6 – < 12‑vuotiaita ja 74 (43,3 %) oli 12 – < 18‑vuotiaita. Hoidon keskikesto oli 2,3 vuotta.
Haittavaikutukset (taulukko 4) on lueteltu alla MedDRA‑elinjärjestelmäluokittain ja yleisyyden mukaan seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000) ja yleisyys tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin). Haittavaikutukset on esitetty kussakin yleisyysluokassa vakavuuden mukaan alenevassa järjestyksessä.
Taulukko 4 Dabrafenibin ja trametinibin yhdistelmähoitoon liittyvät haittavaikutukset
| Infektiot | |
| Hyvin yleinen | Kynnenvierustulehdus, nenänielutulehdus*1 |
| Yleinen | Virtsatieinfektio, selluliitti |
| Hyvän‑ ja pahanlaatuiset kasvaimet (mukaan lukien kystat ja polyypit) | |
| Hyvin yleinen | Ihon papillooma |
| Veri ja imukudos | |
| Hyvin yleinen | Neutropenia*2, anemia, leukopenia* |
| Yleinen | Trombosytopenia* |
| Immuunijärjestelmä | |
| Yleinen | Yliherkkyys |
| Aineenvaihdunta ja ravitsemus | |
| Yleinen | Nestehukka, ruokahalun heikkeneminen |
| Hermosto | |
| Hyvin yleinen | Päänsärky, huimaus*3 |
| Silmät | |
| Yleinen | Näön hämärtyminen, näköhäiriöt, uveiitti*4 |
| Melko harvinainen | Verkkokalvon irtauma, periorbitaalinen turvotus |
| Sydän | |
| Yleinen | Ejektiofraktion pieneneminen, bradykardia* |
| Melko harvinainen | Eteis-kammiokatkos5 |
| Verisuonisto | |
| Hyvin yleinen | Verenvuoto*6 |
| Yleinen | Hypertensio, hypotensio |
| Hengityselimet, rintakehä ja välikarsina | |
| Hyvin yleinen | Yskä* |
| Yleinen | Hengenahdistus |
| Ruoansulatuselimistö | |
| Hyvin yleinen | Vatsakipu*, ummetus, ripuli, pahoinvointi, oksentelu |
| Yleinen | Haimatulehdus, suutulehdus |
| Melko harvinainen | Koliitti* |
| Iho ja ihonalainen kudos | |
| Hyvin yleinen | Aknetyyppinen dermatiitti*7, ihon kuivuus*8, kutina, ihottuma*9, punoitus |
| Yleinen | Yleistynyt eksfoliatiivinen dermatiitti*10, hiustenlähtö, käsi‑jalkaoireyhtymä, follikuliitti, ihomuutokset, pannikuliitti, hyperkeratoosi, valoherkkyys*11 |
| Melko harvinainen | Akuutti kuumeinen neutrofiilinen dermatoosi12, ihon fissuurat, yöhikoilu, voimakas hikoilu |
| Luusto, lihakset ja sidekudos | |
| Hyvin yleinen | Nivelkipu, raajakipu |
| Yleinen | Lihaskipu*, lihasspasmit*13 |
| Yleisoireet ja antopaikassa todettavat haitat | |
| Hyvin yleinen | Kuume*, väsymys*14, painonnousu |
| Yleinen | Limakalvotulehdus, kasvojen turvotus*, vilunväristykset, perifeerinen edeema, influenssankaltainen sairaus |
| Tutkimukset | |
| Hyvin yleinen | Transaminaasiarvojen suureneminen*15 |
| Yleinen | Hyponatremia, hypofosfatemia, hyperglykemia, veren AFOS‑pitoisuuden suureneminen, GGT‑arvon suureneminen, veren kreatiinikinaasipitoisuuden suureneminen |
*Kuvaa yläkäsitettä, joka kattaa vähintään kaksi kliinisesti samankaltaisiksi katsottua MedDRA‑haittavaikutustermiä. 1 nenänielutulehdus sisältää nielutulehduksen 2 neutropenia sisältää neutrofiiliarvon pienenemisen ja kuumeisen neutropenian 3 huimaus sisältää kiertohuimauksen 4 uveiitti sisältää iridosykliitin 5 eteis-kammiokatkos sisältää ensimmäisen asteen eteis-kammiokatkoksen 6 verenvuoto sisältää nenäverenvuodon, hematurian, kontuusion, hematooman, INR‑arvon suurenemisen, peräaukon verenvuodon, kanyylikohdan verenvuodon, aivoverenvuodon, ekkymoosin, ekstraduraalihematooman, ruoansulatuskanavan verenvuodon, hematoketsian, petekiat, toimenpiteen jälkeisen verenvuodon, peräsuolen verenvuodon, veren punasoluarvon pienenemisen, ruoansulatuskanavan yläosan verenvuodon, kohtuverenvuodon, runsaan kuukautisvuodon sekä purppuran 7 aknetyyppinen dermatiitti sisältää aknen ja pustulaarisen aknen 8 ihon kuivuus sisältää kseroosin ja kseroderman 9 ihottuma sisältää makulopapulaarisen ihottuman, pustulaarisen ihottuman, punoittavan ihottuman, papulaarisen ihottuman ja makulaarisen ihottuman 10 yleistynyt eksfoliatiivinen dermatiitti sisältää ihon kesimisen ja eksfoliatiivisen dermatiitin 11 valoherkkyys sisältää valoherkkyysreaktion ja auringonpolttaman 12 akuuttia kuumeista neutrofiilistä dermatoosia esiintyy myös dabrafenibimonoterapian (Tafinlar) haittavaikutuksena 13 lihasspasmit sisältää tuki‑ ja liikuntaelimistön jäykkyyden 14 väsymys sisältää huonovointisuuden ja astenian 15 transaminaasiarvojen suureneminen sisältää ASAT‑arvon suurenemisen, ALAT‑arvon suurenemisen ja hypertransaminasemian | |
Valikoitujen haittavaikutusten kuvaus
Painonnousu
Painonnousua on raportoitu ainoastaan pediatrisilla potilailla. Painonnousua raportoitiin haittavaikutuksena 16 %:lla pediatrisista potilaista; 3. asteen tapauksia raportoitiin 5 %:lla potilaista, ja painonnousu johti hoidon lopettamiseen 0,6 %:lla potilaista. Mediaaniaika ensimmäiseen painonnousun raportointiin oli dabrafenibin ja trametinibin yhdistelmää saaneilla pediatrisilla potilailla 3,5 kk. Potilaista 36 %:lla havaittiin lähtötilanteeseen verrattuna painonnousu, joka vastasi ≥ 2:n iänmukaisen BMI (body mass index, painoindeksi) ‑persentiililuokan nousua.
Verenvuoto
Verenvuototapahtumia havaittiin 34 %:lla pediatrisista potilaista ja 3. asteen tapahtumia 1,2 %:lla potilaista. Yleisintä verenvuototapahtumaa (nenäverenvuoto) raportoitiin 18 %:lla pediatrisista potilaista. Mediaaniaika ensimmäisen verenvuototapahtuman ilmaantumiseen pediatrisilla potilailla oli 2,6 kk. Dabrafenibia yhdessä trametinibin kanssa saaneilla aikuispotilailla on esiintynyt verenvuototapahtumia, joihin on kuulunut myös merkittäviä verenvuototapahtumia ja kuolemaan johtaneita verenvuotoja.
Samanaikainen antitromboottinen lääkitys tai antikoagulanttihoito saattaa suurentaa verenvuotoriskiä. Jos verenvuotoa esiintyy, potilasta hoidetaan kliinisen tilanteen mukaisesti (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Vasemman kammion ejektiofraktion (LVEF) pieneneminen / vasemman kammion toimintahäiriö
Vasemman kammion ejektiofraktion pienenemistä on raportoitu 5,3 %:lla pediatrisista potilaista ja 3. asteen tapahtumia < 1 %:lla potilaista. Mediaaniaika vasemman kammion ejektiofraktion pienenemisen ensimmäiseen ilmaantumiseen oli noin 1 kk.
Dabrafenibin kliinisiin tutkimuksiin ei otettu mukaan potilaita, joiden LVEF oli tutkimuskeskuksen oman viitealueen alarajan alapuolella. Dabrafenibia on käytettävä trametinibin kanssa varoen potilailla, joilla on sairauksia, jotka voivat heikentää vasemman kammion toimintaa (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet). Ks. trametinibin (jauhe oraaliliuosta varten) valmisteyhteenveto (kohta Varoitukset ja käyttöön liittyvät varotoimet).
Kuume
Kliinisissä tutkimuksissa on ilmoitettu kuumetta, kun dabrafenibia on käytetty yhdessä trametinibin kanssa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Kuumetta ilmoitettiin 70 %:lla pediatrisista potilaista ja 3. asteen tapahtumia 11 %:lla potilaista. Aikuisilla kuumepotilailla noin puolet kuumetapahtumista ilmaantui ensimmäisen hoitokuukauden aikana ja noin kolmasosalla tapahtumia oli vähintään kolme. Aikuisten yhdistetyssä turvallisuuspopulaatiossa 1 %:lla dabrafenibia ainoana hoitona saaneista potilaista esiintyi vakavia kuumetapahtumia, joihin ei liittynyt infektiota. Tällaisiksi tapahtumiksi todettiin kuume, johon liittyi voimakkaita vilunväristyksiä, nestehukkaa, verenpaineen laskua ja/tai prerenaalisen syyn aiheuttamaa akuuttia munuaisten vajaatoimintaa potilailla, joiden munuaiset olivat toimineet normaalisti lähtötilanteessa. Nämä vakavat kuumetapahtumat, joihin ei liittynyt infektiota, ilmaantuivat yleensä ensimmäisen hoitokuukauden aikana. Potilaat, joilla vakavia ei‑infektioperäisiä kuumetapahtumia esiintyi, reagoivat hyvin hoidon keskeyttämiseen ja/tai annoksen pienentämiseen ja tukihoitotoimenpiteisiin (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Maksaan liittyvät tapahtumat
Aikuispotilailla ja pediatrisilla potilailla toteutetuissa kliinisissä tutkimuksissa on raportoitu maksaan liittyviä haittavaikutuksia, kun dabrafenibia on käytetty yhdessä trametinibin kanssa. Pediatrisessa turvallisuuspopulaatiossa ALAT‑arvon suureneminen (raportoitiin 13 %:lla potilaista) ja ASAT‑arvon suureneminen (raportoitiin 16 %:lla potilaista) olivat hyvin yleisiä tapahtumia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Ks. lisätietoja trametinibin (jauhe oraaliliuosta varten) valmisteyhteenvedosta.
Verenpaineen muutokset
Hypertensiota raportoitiin 2,3 %:lla pediatrisista potilaista ja 3. asteen tapahtumia 1,2 %:lla potilaista. Mediaaniaika ensimmäisen hypertensiotapahtuman ilmaantumiseen pediatrisilla potilailla oli 5,4 kk.
Hypotensiota raportoitiin 4,1 %:lla pediatrisista potilaista ja 3. asteen tapahtumia 2,3 %:lla potilaista. Mediaaniaika ensimmäisen hypotensiotapahtuman ilmaantumiseen pediatrisilla potilailla oli 2,2 kk.
Verenpaine on mitattava hoitoa aloitettaessa, ja sitä on seurattava hoidon aikana, ja tarvittaessa hypertensio on pidettävä hallinnassa tavanomaisella hoidolla (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Nivelkipu
Nivelkipua raportoitiin hyvin yleisesti dabrafenibin ja trametinibin yhdistelmän käytön yhteydessä yhdistetyissä aikuisten ja pediatristen potilaiden turvallisuuspopulaatioissa. Pediatrisessa turvallisuuspopulaatiossa nivelkipua raportoitiin 13 %:lla pediatrisista potilaista; potilaista < 1 %:lla nivelkipu oli vaikeudeltaan 3. astetta. Aikuispotilaista 25 %:lla raportoitiin nivelkipua, mutta nivelkivun vaikeusasteluokka oli yleensä 1 tai 2, ja 3. asteen tapaukset olivat melko harvinaisia (< 1 %).
Hypofosfatemia
Hypofosfatemiaa on raportoitu yleisesti dabrafenibin ja trametinibin yhdistelmän käytön yhteydessä yhdistetyssä aikuisten turvallisuuspopulaatiossa 4 %:lla potilaista ja yhdistetyssä pediatrisessa turvallisuuspopulaatiossa 5,8 %:lla potilaista. Huomioitavaa on, että 3. asteen tapahtumia esiintyi 1 %:lla aikuispotilaista. Pediatrisilla potilailla esiintyi vain 1. ja 2. vaikeusasteluokan hypofosfatemiaa.
Haimatulehdus
Haimatulehdusta raportoitiin 1,2 %:lla pediatrisista potilaista; potilaista < 1 %:lla haimatulehdus oli vaikeudeltaan 3. astetta. Aikuisilla toteutetuissa kliinisissä tutkimuksissa esiintyi yksi haimatulehdustapahtuma metastasoitunutta melanoomaa sairastaneella potilaalla. Tämä haimatulehdus kehittyi ensimmäisenä dabrafenibin antopäivänä ja toistui, kun hoito aloitettiin uudelleen pienennetyllä annoksella. Selittämätön vatsakipu on tutkittava heti, ja seerumin amylaasi‑ ja lipaasiarvot on tarkistettava. Potilaan tilaa on seurattava tarkoin, kun hoito aloitetaan uudelleen haimatulehdusepisodin jälkeen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Ihon maligniteetit
Aikuisten yhdistetyssä turvallisuuspopulaatiossa ihon okasolusyöpää esiintyi 2 %:lla dabrafenibia ja trametinibia yhdistelmähoitona saaneista potilaista ja mediaaniaika okasolusyövän ilmaantumiseen oli 18–31 viikkoa. Mediaaniaika ensimmäisen ihon okasolusyövän toteamiseen oli 223 vrk (vaihteluväli 56–510 vrk). Kaikki aikuispotilaat, joille kehittyi ihon okasolusyöpä tai uusi primaarimelanooma, jatkoivat hoitoa ilman annosmuutoksia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Muut syöpäsairaudet kuin ihosyöpä
MAP‑kinaasisignaloinnin aktivoituminen BRAF:n estäjille altistuneissa villityypin BRAF‑soluissa voi lisätä muiden syöpien kuin ihosyövän riskiä, myös sellaisten, joissa esiintyy RAS‑mutaatioita (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Muita syöpiä kuin ihosyöpää esiintyi < 1 %:lla dabrafenibin ja trametinibin yhdistelmähoitoa saaneista aikuisten yhdistetyn turvallisuuspopulaation potilaista. Dabrafenibin ja trametinibin yhdistelmähoidon yhteydessä on esiintynyt RAS‑välitteisiä syöpäsairauksia. Potilaiden tilaa on seurattava kliinisen tarpeen mukaan.
Munuaisten vajaatoiminta
Kuumeeseen liittyvän prerenaalisen atsotemian aiheuttamaa munuaisten vajaatoimintaa tai granulomatoottista nefriittiä esiintyi aikuispotilailla melko harvoin. Dabrafenibia ei kuitenkaan ole tutkittu potilailla, joilla oli munuaisten vajaatoimintaa (kreatiniini > 1,5 x viitearvojen yläraja). Tällaisissa tapauksissa on noudatettava varovaisuutta (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty‑haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Kliinisissä tutkimuksissa ei ole raportoitu akuutteja yliannostusoireita pediatrisilla potilailla, jotka saivat dabrafenibia yhdessä trametinibin kanssa. Yliannostukseen ei ole spesifistä hoitoa. Yliannostustapauksissa on annettava asianmukaista tukihoitoa ja potilaan tilaa on seurattava tarpeen mukaan.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: antineoplastiset lääkeaineet, proteiinikinaasin estäjät, B‑Raf seriini‑treoniinikinaasin (BRAF) estäjät, ATC‑koodi: L01EC02
Vaikutusmekanismi
Dabrafenibi on RAF‑kinaasien estäjä. BRAF:n onkogeeniset mutaatiot johtavat RAS/RAF/MEK/ERK‑reitin konstitutiiviseen aktivaatioon. Yleisin BRAF‑mutaatio on V600E, joka on tunnistettu 19 %:ssa lasten matala‑asteisista glioomista ja noin 5 %:ssa lasten korkea‑asteisista glioomista.
Käyttö yhdessä trametinibin kanssa
Trametinibi on reversiibeli, erittäin selektiivinen, mitogeenin aktivoiman solunulkoisen signaalin säätelykinaasi 1:n (MEK1:n) ja MEK2:n aktivaation ja kinaasiaktiivisuuden allosteerinen estäjä. MEK‑proteiinit ovat ERK‑kinaasin signalointireitin osia. Ihmisen syövissä tämän reitin aktivoivat usein BRAF-proteiinin mutatoituneet muodot, jotka aktivoivat MEK-proteiineja. Trametinibi estää BRAF:n aiheuttaman MEK:n aktivoitumisen ja estää siten MEK-kinaasiaktiivisuutta.
Trametinibi ja dabrafenibi estävät siis kahta tämän reitin kinaasia (MEK ja RAF), ja tästä syystä yhdistelmä estää reittiä samanaikaisesti. Trametinibin ja dabrafenibin yhdistelmän on osoitettu rajoittavan kasvua BRAF V600 ‑mutaatiopositiivisissa syöpäsolulinjoissa in vitro ja viivästyttävän resistenssin kehittymistä in vivo BRAF V600 ‑mutaatiopositiivisissa ksenografteissa.
Farmakodynaamiset vaikutukset
Biokemiallisissa analyyseissä saadut prekliiniset tiedot osoittivat, että dabrafenibi estää BRAF‑kinaaseja, joissa on aktivoivia mutaatioita kodonissa 600 (taulukko 5).
Taulukko 5 Dabrafenibin eri RAF‑kinaaseja estävä teho
| Kinaasi | Estävä pitoisuus (IC50) (nM) |
| BRAF V600E | 0,65 |
| BRAF WT | 3,2 |
| CRAF WT | 5,0 |
Kliininen teho ja turvallisuus
Pediatriset potilaat
Dabrafenibi‑trametinibiyhdistelmähoidon kliinistä tehoa ja turvallisuutta BRAF V600 ‑mutaatiopositiivista glioomaa sairastavilla 1 – < 18‑vuotiailla pediatrisilla potilailla arvioitiin avoimessa, kliinisessä, vaiheen II monikeskustutkimuksessa (EudraCT 2015‑004015‑20). Potilaat, joilla oli matala‑asteinen gliooma (WHO:n vuoden 2016 luokituksen asteet 1 ja 2) ja jotka tarvitsivat systeemistä hoitoa, satunnaistettiin suhteessa 2:1 saamaan dabrafenibi‑trametinibihoitoa tai karboplatiini‑vinkristiinihoitoa. Potilaat, joilla oli uusiutunut tai hoitoon reagoimaton korkea‑asteinen gliooma (WHO:n vuoden 2016 luokituksen asteet 3 ja 4) otettiin yksihaaraiseen dabrafenibi‑trametinibikohorttiin.
BRAF‑mutaatiostatus todettiin prospektiivisesti paikallisella testillä; jos paikallista testausta ei ollut saatavilla, käytettiin keskuslaboratorion reaaliaikaista PCR‑testiä (polymeraasiketjureaktiotesti). Lisäksi BRAF V600E ‑mutaatio vahvistettiin tutkimalla saatavilla olevat kasvainnäytteet retrospektiivisesti keskuslaboratoriossa.
Dabrafenibin ja trametinibin annostus kliinisessä tutkimuksessa riippui potilaan iästä ja painosta: suun kautta annetun dabrafenibin annostus oli < 12‑vuotialle 2,625 mg/kg kahdesti vuorokaudessa ja 12 vuotta täyttäneille 2,25 mg/kg kahdesti vuorokaudessa, ja suun kautta annetun trametinibin annostus oli < 6‑vuotiaille 0,032 mg/kg kerran vuorokaudessa ja 6 vuotta täyttäneille 0,025 mg/kg kerran vuorokaudessa. Dabrafenibin enimmäisannokseksi asetettiin 150 mg kahdesti vuorokaudessa ja trametinibin enimmäisannokseksi 2 mg kerran vuorokaudessa. Karboplatiinin ja vinkristiinin annostus perustui ikään ja kehon pinta‑alaan: karboplatiinin annostus oli 175 mg/m2 ja vinkristiinin annostus 1,5 mg/m2; molemmat valmisteet annettiin infuusioina kerran viikossa. Karboplatiinilla ja vinkristiinillä toteutettiin ensin yksi 10 viikon induktiohoitojakso ja sen jälkeen kahdeksan 6 viikon ylläpitohoitojaksoa.
Ensisijainen tehon päätetapahtuma oli molemmissa kohorteissa kokonaisvasteprosentti (ORR; vahvistettujen täydellisten vasteiden [CR] ja osittaisten vasteiden [PR] summa). Vaste arvioitiin riippumattomasti, matala‑asteisen gliooman kohortissa vuoden 2017 RANO‑kriteerien perusteella ja korkea‑asteisen gliooman kohortissa vuoden 2010 RANO‑kriteerien perusteella. Ensisijainen analyysi toteutettiin, kun kummankin kohortin kaikki potilaat olivat saaneet hoitoa vähintään 32 viikon ajan. Lopullinen analyysi toteutettiin 2 vuotta tutkimukseenoton päättymisen jälkeen molemmissa kohorteissa.
Pediatristen potilaiden BRAF‑mutaatiopositiivinen matala‑asteinen gliooma (WHO:n luokituksen asteet 1 ja 2)
Matala‑asteisen gliooman kohortissa 110 potilasta satunnaistettiin saamaan dabrafenibi‑trametinibihoitoa (n = 73) tai karboplatiini‑vinkristiinihoitoa (n = 37). Iän mediaani oli 9,5 vuotta; potilaista 34 (30,9 %) oli iältään 12 kk – < 6 vuotta, 36 (32,7 %) oli 6 – < 12 vuotta ja 40 (36,4 %) oli 12 – < 18 vuotta. 60 % potilaista oli naispuolisia. Suurimmalla osalla potilaista (80 %) oli ensidiagnoosin hetkellä 1. asteen gliooma. Yleisimmät kasvaintyypit olivat pilosyyttinen astrosytooma (30,9 %), gangliogliooma (27,3 %) ja tarkemmin määrittelemätön matala‑asteinen gliooma (18,2 %). Etäpesäkealueita oli 9 potilaalla (8,2 %). Aiempia leikkauksia raportoitiin 91 potilaalla (82,7 %); näistä potilaista 28:lla (25,5 %) viimeisin kirurginen toimenpide oli ollut resektio. Systeemisten kortikosteroidien käyttöä raportoitiin 44 potilaalla (41,5 %).
Ensisijaisen analyysin ajankohtana dabrafenibi‑trametinibiryhmän kokonaisvasteprosentti parani tilastollisesti merkitsevästi verrattuna karboplatiini‑vinkristiiniryhmään. Lisäksi myöhempi hierarkkinen testaus osoitti tilastollisesti merkitsevän paranemisen etenemisvapaan elossaolon (PFS) suhteen solunsalpaajahoitoon verrattuna (taulukko 6).
Ensisijaisen analyysin ajankohtana (kun kaikki potilaat olivat saaneet hoitoa vähintään 32 viikon ajan tai keskeyttäneet tutkimukseen osallistumisen) kokonaiselossaoloa (OS) koskevat tiedot olivat vielä epäkypsät (karboplatiini‑vinkristiiniryhmässä raportoitiin yksi kuolema).
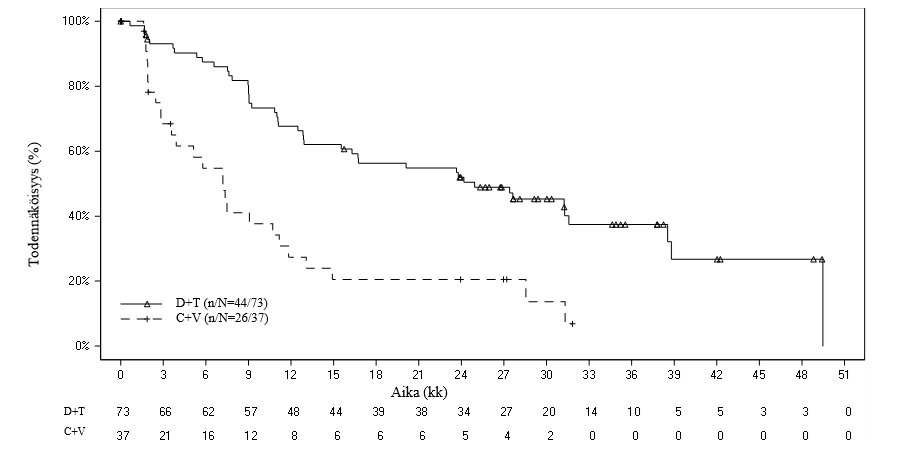
Taulukko 6 Riippumattomaan arviointiin perustuva vaste ja etenemisvapaa elossaolo G2201-avaintutkimuksessa (matala‑asteisen gliooman kohortti, ensisijainen analyysi)
Dabrafenibi + trametinibi (D + T) N = 73 | Karboplatiini + vinkristiini (C + V) N = 37 | |
| Paras kokonaisvaste | ||
| Täydellinen vaste (CR), n (%) | 2 (2,7) | 1 (2,7) |
| Osittainen vaste (PR), n (%) | 32 (43,8) | 3 (8,1) |
| Vakaa tauti (SD), n (%) | 30 (41,1) | 15 (40,5) |
| Etenevä tauti (PD), n (%) | 8 (11,0) | 12 (32,4) |
| Ei tiedossa, n (%) | 1 (1,4) | 6 (16,2)1 |
| Kokonaisvasteprosentti (ORR) | ||
| ORR (CR + PR), (95 %:n lv) | 46,6 % (34,8–58,6 %) | 10,8 % (3,0–25,4 %) |
| Vetosuhde (OR)2, p-arvo | 7,19 (2,3–22,4), p < 0,001 | |
| Riskiero | 35,8 % (20,6–51,0) | |
| Etenemisvapaa elossaolo (PFS) | ||
| Mediaani (kk), (95 %:n lv) | 20,1 (12,8 – ei arv.) | 7,4 (3,6–11,8) |
| Riskitiheyssuhde (95 %:n lv), p‑arvo | 0,31 (0,17–0,55), p < 0,001 | |
ei arv. = ei arvioitavissa. 1 Neljä C + V ‑hoitoon satunnaistettua potilasta keskeytti tutkimukseen osallistumisen ennen hoidon aloittamista. 2 Vetosuhde (D + T vs. C + V) ja 95 %:n lv on laskettu logistisella regressiolla hoidon ollessa ainoa kovariaatti (ts. vasteen havaitsemisen todennäköisyys D + T ‑ryhmässä vs. vasteen havaitsemisen todennäköisyys C + V ‑ryhmässä). Vetosuhde > 1 on D + T ‑hoidolle suotuisa. | ||
Lopullisen analyysin ajankohtana (seurannan keston mediaani: 39,0 kk) riippumattomaan arviointiin perustuva kokonaisvasteprosentti oli 54,8 % D+T-ryhmässä ja 16,2 % C+V-ryhmässä vetosuhteen ollessa 6,26. Analyysi vahvisti myös, että etenemisvapaa elossaolo (PFS) parani solunsalpaajahoitoon verrattuna riippumattoman arvioinnin perusteella, ja taudin etenemisen / kuoleman riski pieneni arviolta 64 % (riskitiheyssuhde 0,36). Etenemisvapaan elossaolon (PFS) mediaani oli D+T-ryhmässä 24,9 kk ja C+V-ryhmässä 7,2 kk. Kummassakaan ryhmässä ei raportoitu uusia kuolemantapauksia lopullisen analyysin ajankohtana.
Kuva 1 Riippumattomaan arviointiin perustuvaa etenemisvapaata elossaoloa G2201-avaintutkimuksessa kuvaavat Kaplan–Meier‑käyrät (matala‑asteisen gliooman kohortti, lopullinen analyysi)
Pediatristen potilaiden BRAF‑mutaatiopositiivinen korkea‑asteinen gliooma (WHO:n luokituksen asteet 3 ja 4)
Yksihaaraiseen korkea‑asteisen gliooman kohorttiin otettiin 41 potilasta, joilla oli uusiutunut tai hoitoon reagoimaton korkea‑asteinen gliooma. Potilaat saivat dabrafenibi‑trametinibihoitoa. Iän mediaani oli 13,0 vuotta; potilaista 5 (12,2 %) oli iältään 12 kk – < 6 vuotta, 10 (24,4 %) oli 6 – < 12 vuotta ja 26 (63,4 %) oli 12 – < 18 vuotta. 56 % potilaista oli naispuolisia. Ensidiagnoosin hetkellä gliooma oli 20 potilaalla (48,8 %) histologista astetta 4; 13 potilaalla (31,7 %) astetta 3; neljällä potilaalla (9,8 %) astetta 2; kolmella potilaalla (7,3 %) astetta 1; yhdeltä potilaalta (2,4 %) puuttui tieto histologisesta asteesta. Yleisimmät kasvaintyypit olivat glioblastoma multiforme (31,7 %), anaplastinen pleomorfinen ksantoastrosytooma (14,6 %), tarkemmin määrittelemätön korkea‑asteinen gliooma (9,8 %) ja pleomorfinen ksantoastrosytooma (9,8 %). Aiempia leikkauksia raportoitiin 40 potilaalla (97,6 %); näistä potilaista 24:llä (58,5 %) viimeisin kirurginen toimenpide oli ollut resektio. Aiempi syövän solunsalpaajahoito raportoitiin 33 potilaalla (80,5 %). Aiempi sädehoito raportoitiin 37 potilaalla (90,2 %). Systeemisten kortikosteroidien käyttöä tutkimushoidon aikana raportoitiin 24 potilaalla (58,5 %).
Lopullisen analyysin ajankohtana (seuranta-ajan mediaani: 45,2 kk) riippumattomaan arviointiin perustuva kokonaisvasteprosentti oli 56,1 % (23/41; 95 %:n lv 39,7–71,5): täydellinen vaste saavutettiin 14 potilaalla (34,1 %) ja osittainen vaste 9 potilaalla (22,0 %). Vasteen keston mediaani oli 27,4 kk (95 %:n lv 9,2 – ei arvioitavissa).
Farmakokinetiikka
Dabrafenibin farmakokineettisiä ominaisuuksia on määritetty pääasiassa aikuispotilailla, jotka käyttivät kiinteää valmistemuotoa (kapseleita). Dabrafenibin farmakokinetiikkaa painon mukaan määritetyn kerta‑annoksen tai toistuvien annosten jälkeen arvioitiin myös 243 pediatrisella potilaalla. Populaatiofarmakokineettisen analyysin potilaista 61 oli iältään 1 – < 6‑vuotiaita, 77 oli 6– < 12‑vuotiaita ja 105 oli 12 – < 18‑vuotiaita. Puhdistuma oli verrattavissa aikuisilla todettuun puhdistumaan. Painon todettiin olevan dabrafenibipuhdistuman merkittävä kovariaatti. Ikä ei ollut merkittävä lisäkovariaatti. Pediatristen potilaiden farmakokineettiset dabrafenibialtistukset suositelluilla painon mukaisilla annoksilla asettuivat aikuisilla havaittujen altistusten vaihteluvälille.
Imeytyminen
Dispergoituvista dabrafenibitableteista valmistettu suspensio imeytyi nopeasti: mediaaniaika plasman huippupitoisuuteen oli 1,5 tuntia annoksesta. Suun kautta annettujen dabrafenibikapseleiden absoluuttinen biologinen hyötyosuus oli keskimäärin 94,5 %. Suspension biologinen hyötyosuus on oletettavasti 20 % pienempi. Kapselimuotoista valmistetta käyttäneillä aikuispotilailla havaittiin toistuvien annosten aikana altistuksen pienenemistä, mikä johtui todennäköisesti siitä, että lääkeaine indusoi omaa metaboliaansa. Kumuloitumissuhde eli 18. päivän ja 1. päivän AUC‑arvojen suhde oli 0,73 (keskiarvo).
Dabrafenibialtistus (Cmax ja AUC) suureni suorassa suhteessa annokseen 12–300 mg:n kerta‑annosten jälkeen, mutta kaksi kertaa vuorokaudessa annettujen toistuvien annosten jälkeen altistus suureni vähemmän kuin suhteessa annokseen.
Pediatrisessa avaintutkimuksessa vakaan tilan Cmax‑arvon geometrinen keskiarvo (%CV) oli matala‑asteisen gliooman kohortissa 1 330 ng/ml (93,5 %) ja korkea‑asteisen gliooman kohortissa 1 520 ng/ml (65,9 %). Vakaan tilan AUCtau‑arvon geometrinen keskiarvo (%CV) oli matala‑asteisen gliooman kohortissa 4 910 ng*h/ml (54,0 %) ja korkea‑asteisen gliooman kohortissa 4 300 ng*h/ml (44,7 %).
Ruoan vaikutus
Terveillä aikuisilla vapaaehtoisilla tehdyissä tutkimuksissa dispergoituvista tableteista valmistetun suspension (150 mg kerta-annos) annostelu vähärasvaisen ja vähäkalorisen aterian kanssa pienensi dabrafenibin biologista hyötyosuutta (Cmax-arvo pieneni 35 % ja AUC-arvo 29 %) ja hidasti dabrafenibin imeytymistä verrattuna annosteluun paasto‑olosuhteissa.
Jakautuminen
Dabrafenibi sitoutuu ihmisen plasman proteiineihin ja sitoutumisaste on 99,7 %. Vakaan tilan aikainen jakautumistilavuus laskimoon annetun mikroannoksen jälkeen oli aikuisilla 46 litraa.
Biotransformaatio
Dabrafenibi metaboloituu pääasiassa CYP2C8:n ja CYP3A4:n välityksellä hydroksidabrafenibiksi, joka hapettuu edelleen CYP3A4:n välityksellä karboksidabrafenibiksi. Karboksidabrafenibi voi dekarboksyloitua muiden kuin entsymaattisten prosessien kautta desmetyylidabrafenibiksi. Karboksidabrafenibi erittyy sappeen ja virtsaan. Desmetyylidabrafenibia saattaa muodostua myös suolistossa ja se voi imeytyä takaisin. Desmetyylidabrafenibi metaboloituu CYP3A4:n välityksellä oksidatiivisiksi metaboliiteiksi. Hydroksidabrafenibin terminaalinen puoliintumisaika vastaa lähtöaineen puoliintumisaikaa, joka on 10 tuntia, mutta karboksi‑ ja desmetyylimetaboliittien puoliintumisajat olivat pitempiä (21–22 tuntia). Pediatrisilla potilailla keskimääräinen metaboliitin ja kanta‑aineen AUC‑arvojen suhdetta kuvaava arvo (%CV) oli kapselien tai dispergoituvista tableteista valmistetun suspension toistuvan annon jälkeen hydroksidabrafenibilla 0,64 (28 %), karboksidabrafenibilla 15,6 (49 %) ja desmetyylidabrafenibilla 0,69 (62 %). Altistuksen, suhteellisen voimakkuuden ja farmakokineettisten ominaisuuksien perusteella sekä hydroksi‑ että desmetyylidabrafenibi myötävaikuttavat todennäköisesti dabrafenibin kliiniseen tehoon, mutta karboksidabrafenibilla ei todennäköisesti ole merkittävää vaikutusta.
Eliminaatio
Dabrafenibin terminaalinen puoliintumisaika laskimoon annetun yksittäisen mikroannoksen jälkeen oli aikuispotilailla 2,6 tuntia. Dabrafenibin suun kautta dispergoituvina tabletteina otetun kerta‑annoksen terminaalinen puoliintumisaika oli 11,5 tuntia (CV 67,7 %) terveillä aikuisilla vapaaehtoisilla tehdyssä tutkimuksessa. Pediatrisilla potilailla (mediaanipaino 38,7 kg) dabrafenibin näennäinen puhdistuma oli 11,8 l/h (CV 49 %).
Dabrafenibi eliminoituu suun kautta otetun annoksen jälkeen pääasiassa metaboloitumalla CYP3A4‑ ja CYP2C8‑entsyymien välityksellä. Dabrafenibista peräisin oleva materiaali erittyi pääasiassa ulosteeseen. 71 % suun kautta otetusta annoksesta erittyi ulosteeseen ja 23 % annoksesta erittyi ainoastaan metaboliitteina virtsaan.
Yhteisvaikutukset muiden lääkevalmisteiden kanssa
Muiden lääkevalmisteiden vaikutus dabrafenibiin
Dabrafenibi on ihmisen P‑glykoproteiinin (P‑gp:n) ja ihmisen BCRP:n substraatti in vitro. Näillä kuljetusproteiineilla on hyvin vähäinen vaikutus suun kautta otetun dabrafenibin hyötyosuuteen ja eliminoitumiseen, ja kliinisesti merkittävien yhteisvaikutusten riski P‑gp:n tai BCRP:n estäjien kanssa on vähäinen. Dabrafenibin tai sen kolmen päämetaboliitin ei osoitettu olevan P‑gp:n estäjiä in vitro.
Dabrafenibin vaikutus muihin lääkevalmisteisiin
Vaikka dabrafenibi ja sen metaboliitit hydroksidabrafenibi, karboksidabrafenibi ja desmetyylidabrafenibi olivat ihmisen orgaanisten anionien kuljettajien (OAT) 1 ja OAT3 estäjiä in vitro ja dabrafenibin ja sen desmetyylimetaboliitin havaittiin olevan orgaanisten kationien kuljettaja 2:n (OCT2:n) estäjiä in vitro, on näihin kuljettajiin liittyvä lääkeaineyhteisvaikutusten riski minimaalinen dabrafenibin ja sen metaboliittien kliinisen altistuksen perusteella.
Erityisryhmät
Maksan vajaatoiminta
Aikuispotilaita koskeva populaatiofarmakokineettinen analyysi osoittaa, että lievästi koholla olevat bilirubiini‑ ja/tai ASAT‑arvot (NCI [National Cancer Institute] ‑luokituksen mukaan) eivät vaikuta merkittävästi suun kautta otetun dabrafenibin puhdistumaan. Bilirubiini‑ ja ASAT‑arvoihin perustuva lievä maksan vajaatoiminta ei vaikuttanut merkittävästi myöskään dabrafenibimetaboliittien pitoisuuteen plasmassa. Keskivaikeaa tai vaikeaa maksan vajaatoimintaa sairastavista potilaista ei ole tutkimustietoa. Koska dabrafenibi ja sen metaboliitit eliminoituvat ensisijaisesti metaboloitumalla maksassa ja erittymällä sappeen, dabrafenibin käytössä on noudatettava varovaisuutta, jos potilaalla on keskivaikea tai vaikea maksan vajaatoiminta (ks. kohta Annostus ja antotapa).
Munuaisten vajaatoiminta
Aikuispotilaita koskeva populaatiofarmakokineettinen analyysi viittaa siihen, ettei lievä munuaisten vajaatoiminta vaikuta suun kautta otetun dabrafenibin puhdistumaan. Vaikka tiedot keskivaikeasta munuaisten vajaatoiminnasta ovat vähäiset, niiden perusteella näyttäisi siltä, ettei kliinisesti merkityksellistä vaikutusta ole. Vaikeaa munuaisten vajaatoimintaa sairastavista potilaista ei ole tutkimustietoa (ks. kohta Annostus ja antotapa).
Etninen tausta
Aikuispotilaita koskevassa populaatiofarmakokineettisessä analyysissä ei havaittu merkittäviä eroja dabrafenibin farmakokinetiikassa aasialaisten ja valkoihoisten potilaiden välillä. Tietoja ei ole riittävästi, jotta muiden etnisten taustojen mahdollista vaikutusta dabrafenibin farmakokinetiikkaan voitaisiin arvioida.
Sukupuoli
Aikuisia ja pediatrisia potilaita koskeneiden populaatiofarmakokineettisten analyysien perusteella dabrafenibin arvioitu puhdistuma oli naispuolisilla potilailla hieman pienempi, mutta eroa ei pidetty kliinisesti merkittävänä.
Prekliiniset tiedot turvallisuudesta
Dabrafenibilla ei ole tehty karsinogeenisuustutkimuksia. Dabrafenibi ei ollut mutageeninen eikä klastogeeninen bakteereissa ja viljellyissä nisäkässoluissa tehdyissä in vitro ‑testeissä eikä jyrsijöiden mikrotumatestissä in vivo.
Rotilla tehdyissä naaraiden hedelmällisyyttä, varhaista alkionkehitystä sekä alkion‑ ja sikiönkehitystä selvittelevissä yhdistetyissä tutkimuksissa tiineiden naaraiden munasarjojen keltarauhasten määrät pienenivät annostuksen ollessa 300 mg/kg/vrk (noin 3‑kertainen altistus verrattuna ihmisen kliiniseen altistukseen AUC‑arvon perusteella), mutta kiimakiertoon, paritteluun tai hedelmällisyysindekseihin kohdistuvia vaikutuksia ei havaittu. Yksilönkehitykseen kohdistuvaa toksisuutta, kuten alkiokuolleisuutta ja kammioväliseinän vaurioita ja muutoksia kateenkorvan muodossa havaittiin annostasolla 300 mg/kg/vrk ja luuston kehityksen viivästymistä sekä sikiön painon laskua annostasolla ≥ 20 mg/kg/vrk (≥ 0,5‑kertainen altistus verrattuna ihmisen kliiniseen altistukseen AUC‑arvon perusteella).
Dabrafenibin vaikutuksia urosten hedelmällisyyteen ei ole tutkittu. Toistuvilla annoksilla tehdyissä tutkimuksissa havaittiin kuitenkin rottien ja koirien kivesten degeneraatiota/depleetiota (altistuksen ollessa ≥ 0,2‑kertainen verrattuna ihmisen kliiniseen altistukseen AUC‑arvon perusteella). Rottien ja koirien kivesmuutokset olivat havaittavissa vielä 4 viikon toipumisjakson jälkeen (ks. kohta Raskaus ja imetys).
Sydän‑ ja verisuonivaikutuksia, kuten sepelvaltimoiden degeneraatiota/nekroosia ja/tai verenvuotoa, sydämen eteis‑kammioläppien hypertrofiaa/verenvuotoa ja eteisten fibrovaskulaarista proliferaatiota havaittiin koirilla (altistuksen ollessa ≥ 2‑kertainen verrattuna ihmisen kliiniseen altistukseen AUC‑arvon perusteella). Fokaalista valtimoiden/perifeeristen verisuonten tulehdusta havaittiin hiirillä eri kudoksissa (altistuksen ollessa ≥ 0,6‑kertainen ihmisen kliiniseen altistukseen verrattuna). Rotilla havaittiin maksavaltimoiden degeneraation ja spontaanin sydänlihassolujen degeneraation ja tulehduksen (spontaanin kardiomyopatian) ilmaantuvuuden lisääntymistä (altistuksen ollessa ≥ 0,5‑kertainen ihmisen kliiniseen altistukseen verrattuna). Maksaan kohdistuvia vaikutuksia, mukaan lukien hepatosellulaarinen nekroosi ja tulehdus, havaittiin hiirillä (altistuksen ollessa ≥ 0,6‑kertainen ihmisen kliiniseen altistukseen verrattuna). Keuhkojen bronkoalveolaarinen tulehdus havaittiin useilla koirilla annostasolla ≥ 20 mg/kg/vrk (≥ 9‑kertainen altistus verrattuna ihmisen kliiniseen altistukseen AUC‑arvon perusteella), ja siihen liittyi pinnallinen ja/tai vaikeutunut hengitys.
Dabrafenibia saaneilla koirilla ja rotilla on havaittu korjautuvia hematologisia vaikutuksia. Enintään 13 viikkoa kestäneissä tutkimuksissa havaittiin koirilla ja rotilla retikulosyyttien ja/tai punasolumassan vähenemistä (kun altistus oli koirilla ≥ 10‑kertainen ja rotilla 1,4‑kertainen ihmisen kliiniseen altistukseen verrattuna).
Rotilla tehdyissä nuorten eläinten toksisuustutkimuksissa havaittiin kasvuun kohdistuvia vaikutuksia (pitkien luiden lyhenemistä), munuaistoksisuutta (kertymiä tubuluksissa, munuaiskuoren kystien ja tubulusten basofilian ilmaantuvuuden lisääntymistä sekä korjautuvaa urea‑ ja/tai kreatiniinipitoisuuden suurenemista) sekä kivestoksisuutta (degeneraatiota ja siementiehyiden laajenemista) (≥ 0,2 ‑kertainen altistus verrattuna ihmisen kliiniseen altistukseen AUC‑arvon perusteella).
Dabrafenibi oli fototoksista in vitro hiirten 3T3 fibroblastien NRU‑testissä (Neutral Red Uptake) ja in vivo suun kautta otetuilla ≥ 100 mg/kg annoksilla (> 44‑kertainen altistus verrattuna ihmisen kliiniseen altistukseen Cmax‑arvon perusteella) karvattomilla hiirillä tehdyssä fototoksisuustutkimuksessa.
Käyttö yhdessä trametinibin kanssa
Kun koirille annettiin tutkimuksessa dabrafenibin ja trametinibin yhdistelmää 4 viikon ajan, niillä havaittiin maha‑suolikanavan haittojen ja kateenkorvan imukudoksen solukkuuden vähenemisen merkkejä, kun altistukset olivat pienempiä kuin pelkkää trametinibia saaneilla koirilla. Muutoin havaittiin samankaltaisia haittoja kuin vertailukelpoisissa monoterapiatutkimuksissa.
Farmaseuttiset tiedot
Apuaineet
Mannitoli (E421)
Mikrokiteinen selluloosa (E460)
Krospovidoni (E1202)
Hypromelloosi (E464)
Asesulfaamikalium (E950)
Magnesiumstearaatti (E470b)
Keinotekoinen marja‑aromi (maltodekstriini, propyleeniglykoli [E1520], keinotekoiset aromit, trietyylisitraatti [E1505], bentsyylialkoholi [E1519])
Piidioksidi, kolloidinen, vedetön (E551)
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
Dispergoituva tabletti
2 vuotta.
Dispergoituvista tableteista valmistettu suspensio
Käytettävä 30 minuutin kuluessa annoksen valmistamisesta.
Säilytys
Tämä lääkevalmiste ei vaadi lämpötilan suhteen erityisiä säilytysolosuhteita.
Säilytä alkuperäispakkauksessa. Herkkä kosteudelle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
FINLEE dispergoituva tabletti
10 mg (L:ei) 420 kpl (2x210, 2 annosmittaa) (3590,69 €)
PF-selosteen tieto
Läpinäkymätön valkoinen HDPE‑purkki, jossa on polypropeenista valmistettu turvasuljin (kierrekorkki) ja piidioksidigeeliä kuivatusaineena.
Yhdessä purkissa on 210 dispergoituvaa tablettia ja kaksi 2 g:n kuivatusainesäiliötä. Potilaita on ohjeistettava pitämään kuivatusainesäiliöt purkissa ja olemaan nielemättä niitä.
Pakkauksissa on:
- 1 purkki (210 dispergoituvaa tablettia) ja 2 annosmittaa.
- 2 purkkia (420 dispergoituvaa tablettia) ja 2 annosmittaa.
Annosmittojen tilavuus on 30 ml, ja niissä on tilavuusmerkinnät 5 ml:n välein.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Valkoinen tai kellertävä, pyöreä, kaksoiskupera tabletti, jonka toiselle puolelle on kaiverrettu ”D” ja toiselle puolelle ”NVR”. Koko 6 mm.
Käyttö- ja käsittelyohjeet
Suspension valmistaminen dispergoituvista tableteista
- Pane lääkärin määräämä annos dispergoituvia Finlee‑tabletteja annosmittaan, jossa on noin 5 ml tai 10 ml hiilihapotonta juomavettä.
- Hiilihapottoman juomaveden määrä riippuu dispergoituvien tablettien määrästä. Jos annos on 1–4 dispergoituvaa tablettia, käytä noin 5 ml vettä; jos annos on 5–15 dispergoituvaa tablettia, käytä noin 10 ml vettä.
- Voi kestää 3 minuuttia (tai kauemmin), että tabletit hajoavat täydellisesti.
- Sekoita tabletti‑vesiseosta varovasti ruostumattomasta teräksestä valmistetun teelusikan varsiosalla ja anna suspensio potilaalle välittömästi.
- Anna suspensio viimeistään 30 minuutin kuluttua sen valmistamisesta (tablettien täydellisestä hajoamisesta). Jos valmistamisesta on kulunut yli 30 minuuttia, suspensiota ei saa käyttää.
- Annosmittaan jää suspension annon jälkeen tablettijäämiä, joita voi olla vaikea havaita. Lisää tyhjään annosmittaan noin 5 ml hiilihapotonta juomavettä. Sekoita ruostumattomasta teräksestä valmistetun teelusikan varsiosalla, jotta annosmittaan jääneistä hiukkasista muodostuu uusi suspensio. Anna annosmitan sisältö kokonaan potilaalle.
Anto syöttöletkulla tai mittaruiskulla
- Kun suspensio on valmis, vedä se kokonaan annosmitasta ruiskuun, joka soveltuu syöttöletkun kanssa käytettäväksi tai suun kautta tapahtuvaan antoon.
- Jos suspensio annetaan syöttöletkun kautta, huuhtele syöttöletku hiilihapottomalla juomavedellä ennen antamista ja ruiskuta suspensio letkuun valmistajan ohjeiden mukaisesti. Huuhtele syöttöletku hiilihapottomalla juomavedellä antamisen jälkeen.
- Jos suspensio annetaan mittaruiskulla suun kautta, pane ruisku potilaan suuhun siten, että ruiskun kärki koskettaa jommankumman posken sisäpintaa. Paina mäntä hitaasti pohjaan asti niin, että potilas saa koko annoksen.
Katso täydelliset ja kuvitetut käyttöohjeet pakkausselosteen lopusta kohdasta ”Käyttöohjeet”.
Hävittäminen
Annosmittaa voidaan käyttää enintään 4 kuukauden ajan ensimmäisen käyttökerran jälkeen. 4 kuukauden kuluttua annosmitta voidaan hävittää talousjätteiden mukana.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
FINLEE dispergoituva tabletti
10 mg 420 kpl
- Ylempi erityiskorvaus (100 %). Dabrafenibi ja trametinibi: Melanooman, gliooman ja keuhkosyövän hoito erityisin edellytyksin (1509).
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Dabrafenibi ja trametinibi: Dabrafenibin ja trametinibin yhdistelmähoito aikuisille, kun kyseessä BRAF V600 - mutaatiopositiivisen melanooman hoito erityisin edellytyksin (3024).
ATC-koodi
L01EC02
Valmisteyhteenvedon muuttamispäivämäärä
21.01.2026
Yhteystiedot
 NOVARTIS FINLAND OY
NOVARTIS FINLAND OY Revontulenkuja 1
02100 Espoo
010 613 3200
www.novartis.fi
Lääkeinformaatiopalvelu 010 6133 210,
medinfo.nordics@novartis.com
