ABRYSVO pulver och vätska till injektionsvätska, lösning
Observera
▼ Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning. Se avsnitt Biverkningar om hur man rapporterar biverkningar.
Kvalitativ och kvantitativ sammansättning
Efter beredning innehåller en dos (0,5 ml):
stabiliserat prefusion F-antigen från RSV-subgrupp A1,2 60 mikrogram
stabiliserat prefusion F-antigen från RSV-subgrupp B1,2 60 mikrogram
(RSV-antigen)
1Glykoprotein F stabiliserat i prefusionskonformation.
2Framställt i ovarialceller från kinesisk hamster med rekombinant DNA-teknik.
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Pulver och vätska till injektionsvätska, lösning.
Kliniska uppgifter
Terapeutiska indikationer
Abrysvo är avsett för:
- Passivt skydd mot nedre luftvägssjukdom orsakad av respiratoriskt syncytievirus (RSV eller RS-virus) för spädbarn från födseln upp till 6 månaders ålder genom immunisering av modern under graviditet. Se avsnitt Dosering och administreringssätt och Farmakodynamiska egenskaper.
- Aktiv immunisering av personer från 18 år och äldre för att förebygga nedre luftvägssjukdom orsakad av RSV.
Vaccinet ska användas i enlighet med officiella rekommendationer.
Dosering och administreringssätt
Dosering
Gravida personer
En engångsdos på 0,5 ml ska administreras mellan gestationsvecka 24 och 36 (se avsnitt Varningar och försiktighet och Farmakodynamiska egenskaper).
Personer 18 år och äldre
En engångsdos på 0,5 ml ska administreras.
Behovet av revaccinering har inte fastställts.
Personer med nedsatt immunförsvar
En engångsdos på 0,5 ml ska administreras. Behov av en andra dos har inte fastställts (se avsnitt Farmakodynamiska egenskaper).
Pediatrisk population
Säkerhet och effekt för Abrysvo för barn (från födseln till under 18 år) har ännu inte fastställts. Det finns begränsade data för gravida ungdomar och deras spädbarn (se avsnitt Farmakodynamiska egenskaper).
Administreringssätt
Abrysvo är avsett för intramuskulär injektion i överarmens deltamuskel.
Vaccinet ska inte blandas med andra vacciner eller läkemedel.
Anvisningar om beredning och hantering av läkemedlet före administrering finns i avsnitt Särskilda anvisningar för destruktion och övrig hantering.
Kontraindikationer
Överkänslighet mot de aktiva substanserna eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen.
Varningar och försiktighet
Spårbarhet
För att underlätta spårbarhet av biologiska läkemedel ska läkemedlets namn och tillverkningssatsnummer dokumenteras.
Överkänslighet och anafylaxi
Lämplig medicinsk behandling och övervakning ska alltid finnas till hands i händelse av en anafylaktisk reaktion efter administrering av vaccinet.
Ångestrelaterade reaktioner
Ångestrelaterade reaktioner, däribland vasovagala reaktioner (synkope), hyperventilering eller stressrelaterade reaktioner kan förekomma i samband med själva vaccinationsförfarandet som en psykogen respons på nålinjektionen. Det är viktigt att försiktighetsåtgärder vidtas för att undvika skada vid svimning.
Samtidig sjukdom
Vid akut, svår febersjukdom ska vaccinationen skjutas upp. Vaccinationen behöver emellertid inte skjutas upp vid en lindrigare infektion, t.ex. förkylning.
Trombocytopeni och koagulationsrubbningar
Abrysvo ska ges med försiktighet till personer med trombocytopeni eller en koagulationsrubbning eftersom blödning eller uppkomst av blåmärken kan förekomma efter intramuskulär administrering till dessa personer.
Personer med nedsatt immunförsvar
Säkerhet och immunogenicitet har utvärderats för personer med nedsatt immunförsvar, inklusive personer som får immunsuppressiv behandling (se avsnitt Biverkningar och Farmakodynamiska egenskaper). Effekten av Abrysvo kan vara lägre hos personer med nedsatt immunförsvar.
Personer vars graviditet ännu inte nått vecka 24
Abrysvo har inte studerats hos gravida innan gestationsvecka 24. Eftersom spädbarnets skydd mot RSV beror på överföring av antikroppar från modern via placenta ska Abrysvo administreras mellan gestationsvecka 24 och 36 (se avsnitt Dosering och administreringssätt och Farmakodynamiska egenskaper).
Begränsningar av vaccineffekten
Liksom med alla vacciner utvecklas inte ett skyddande immunsvar hos alla vaccinerade personer.
Hjälpämnen
Detta läkemedel innehåller mindre än 1 mmol (23 mg) natrium per dos, d.v.s. är näst intill ”natriumfritt”.
Abrysvo innehåller polysorbat 80. Polysorbat 80 kan orsaka överkänslighetsreaktioner.
Interaktioner
Abrysvo kan administreras samtidigt som:
- vaccin mot säsongsinfluensa, antingen med adjuvanterat standarddosvaccin eller icke-adjuvanterat högdosvaccin
- mRNA-vaccin mot covid-19, tillsammans med eller utan icke-adjuvanterat högdosvaccin mot influensa.
Ett intervall på minst två veckor rekommenderas mellan administrering av Abrysvo och vaccin mot stelkramp, difteri och kikhosta, acellulärt (Tdap). Det bedömdes som säkert att ge Abrysvo och Tdap samtidigt till friska kvinnor som inte var gravida. Immunsvaren vid samtidig administrering med RSV A, RSV B, difteri och stelkramp var non-inferior jämfört mot de som framkallades när vaccinerna gavs separat. Däremot var immunsvaret för pertussiskomponenterna lägre när vaccinerna administrerades samtidigt jämfört med när de administrerades separat, och uppfyllde inte kriterierna för non-inferiority. Den kliniska betydelsen av detta fynd är inte känd.
Fertilitet, graviditet och amning
Graviditet
Data från gravida kvinnor (mer än 4 000 exponeringar) tyder inte på risk för missbildningstoxicitet och inte heller på foster/neonatal toxicitet.
Djurstudier av Abrysvo tyder inte på direkta eller indirekta reproduktionstoxikologiska effekter (se avsnitt Prekliniska säkerhetsuppgifter).
I en fas 3-studie (studie 1) var de rapporterade biverkningarna hos mödrar inom 1 månad efter vaccineringen likartade i Abrysvo-gruppen (14 %) och i placebogruppen (13 %).
Inga säkerhetssignaler detekterades hos spädbarn upp till 24 månaders ålder. Incidenserna av biverkningar som rapporterades inom 1 månad efter spädbarnens födsel var likartade i Abrysvo-gruppen (38 %) och i placebogruppen (35 %). De utfall som huvudsakligen undersöktes vid födseln i Abrysvo-gruppen jämfört med i placebogruppen inkluderade prematur födsel (207 (6 %) respektive 172 (5 %)), låg födelsevikt (186 (5 %) respektive 158 (4 %)) och medfödda missbildningar (205 (6 %) respektive 245 (7 %)).
Amning
Det är okänt om Abrysvo utsöndras i bröstmjölk. Inga biverkningar av Abrysvo har påvisats hos nyfödda som ammades av vaccinerade mödrar.
Fertilitet
Det finns inga tillgängliga data från människa om effekten av Abrysvo på fertilitet.
Djurstudier visar inga direkta eller indirekta skadliga effekter med avseende på honors fertilitet (se avsnitt Prekliniska säkerhetsuppgifter).
Effekter på förmågan att framföra fordon och använda maskiner
Abrysvo har ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner.
Biverkningar
Sammanfattning av säkerhetsprofilen
Gravida personer
Hos gravida kvinnor i gestationsvecka 24–36 var de vanligaste rapporterade biverkningarna smärta vid vaccinationsstället (41 %), huvudvärk (31 %) och myalgi (27 %). Majoriteten av de lokala och systemiska reaktionerna hos mödrar som deltog var milda till måttliga och gick över inom 2–3 dagar.
Personer 18 år och äldre
Hos personer i åldern 18 år och äldre var de vanligaste rapporterade biverkningarna utmattning (23 %), huvudvärk (20 %), smärta vid vaccinationsstället (19 %) och myalgi (16 %). Majoriteten av reaktionerna var milda till måttliga och gick över inom 1 ‑ 2 dagar.
Tabell över biverkningar
Säkerheten för administrering av en engångsdos av Abrysvo till gravida kvinnor i gestationsvecka 24 ‑ 36 (n = 3 698) och till personer 18 år och äldre (n = 20 275) har utvärderats i kliniska prövningar.
Biverkningarna listas enligt följande frekvenskategorier:
mycket vanliga (≥ 1/10)
vanliga (≥ 1/100, < 1/10)
mindre vanliga (≥ 1/1 000, < 1/100)
sällsynta (≥ 1/10 000, < 1/1 000)
mycket sällsynta (< 1/10 000)
ingen känd frekvens (kan inte beräknas från tillgängliga data).
De rapporterade biverkningarna listas efter organsystem med fallande allvarlighetsgrad.
Tabell 1 Biverkningar efter administrering av Abrysvo
| Organsystem | Biverkningar gravida personer ≤ 49 år | Biverkningar personer ≥ 18 år |
| Blodet och lymfsystemet | ||
| lymfkörtelförstoring | sällsynta | sällsynta |
| Immunsystemet | ||
| anafylaxi | mycket sällsynta | |
| överkänslighetsreaktioner (innefattar hudutslag och urtikaria) | sällsynta | sällsynta |
| Centrala och perifera nervsystemet | ||
| huvudvärk | mycket vanliga | mycket vanliga |
| Guillain-Barrés syndrom | mycket sällsynta | |
| Muskuloskeletala systemet och bindväv | ||
| myalgi | mycket vanliga | mycket vanliga |
| artralgi | vanliga | |
| Allmänna symtom och/eller symtom vid administreringsstället | ||
| utmattning | mycket vanliga | |
| smärta vid vaccinationsställe | mycket vanliga | mycket vanliga |
| rodnad vid vaccinationsställe | vanliga | vanliga |
| svullnad vid vaccinationsställe | vanliga | vanliga |
| pyrexi | mindre vanliga | |
| klåda vid vaccinationsställe | sällsynta | |
| blåmärke vid vaccinationsställe | sällsynta | |
| hematom vid vaccinationsställe | sällsynta | |
Särskilda populationer
Personer med nedsatt immunförsvar som är 18 år eller äldre
Reaktogeniciteten överensstämde med den kända profilen för Abrysvo. Det förekom inga oväntade fynd avseende säkerheten.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till:
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Överdosering av Abrysvo är osannolikt eftersom den ges som en engångsdos.
Det finns ingen specifik behandling mot överdosering av Abrysvo. I händelse av en överdos ska personen övervakas och ges symtomatisk behandling vid behov.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Vacciner, övriga vacciner mot virusinfektioner, ATC-kod: J07BX05
Verkningsmekanism
Abrysvo innehåller två rekombinanta stabiliserade RSV prefusion F-antigener som representerar subgrupperna RSV‑A och RSV‑B. Prefusion F är det primära målet för neutraliserande antikroppar som blockerar RSV-infektion. Efter intramuskulär administrering framkallar prefusion F-antigenerna ett immunsvar som skyddar mot RSV‑associerad nedre luftvägssjukdom.
Hos spädbarn som fötts av mödrar som vaccinerats med Abrysvo mellan gestationsvecka 24 och 36 kommer skyddet mot RSV-associerad nedre luftvägssjukdom från RSV-neutraliserande antikroppar som överförts via placenta. Vuxna i åldern 18 år och äldre skyddas genom aktiv immunisering.
Klinisk effekt
Spädbarn från födseln till 6 månaders ålder genom aktiv immunisering av gravida personer
Studie 1 var en randomiserad (1:1), dubbelblindad, placebokontrollerad fas3-multicenterstudie för att utvärdera effekten av en engångsdos Abrysvo i förebyggandet av RSV‑associerad nedre luftvägssjukdom hos spädbarn som fötts av gravida personer som vaccinerats mellan gestationsvecka 24 och 36. Behovet av omvaccinering vid efterföljande graviditeter har inte fastställts.
RSV-associerad nedre luftvägssjukdom definierades som ett sjukvårdsbesök för personer med RSV bekräftad genom omvänt transkriptaspolymeraskedjereaktion (RT-PCR) och med ett eller fler av följande respiratoriska symtom: snabb andning, låg syremättnad (SpO2 < 95 %) och indragen bröstkorg. Allvarlig RSV-associerad nedre luftvägssjukdom definierades som RSV-associerad nedre luftvägssjukdom som även uppfyllde minst ett av följande kriterier: mycket snabb andning, låg syremättnad (SpO2 < 93 %), syretillförsel via nasal högflödesgrimma eller mekanisk ventilation, intagning på intensivvårdsavdelning i > 4 timmar och/eller oförmåga att svara/medvetslöshet.
I denna studie randomiserades 3 711 gravida personer med okomplicerade enkelbördsgraviditeter till Abrysvo-gruppen och 3 709 till placebogruppen.
Vaccineffekten (VE) definierades som den relativa riskreduktionen för effektmåttet i Abrysvo-gruppen jämfört med placebogruppen för spädbarn som fötts av gravida personer som fått den tilldelade interventionen. Vid den primära analysen fanns det två primära effektmått som bedömdes parallellt, allvarlig RSV‑positiv nedre luftvägssjukdom som krävde sjukvård och RSV‑positiv nedre luftvägssjukdom som krävde sjukvård, och som uppträdde inom 90, 120, 150 eller 180 dagar efter födseln.
Av de gravida kvinnor som fick Abrysvo var 65 % vita, 20 % hade afrikanskt eller afroamerikanskt ursprung och 29 % var latinamerikaner. Medianåldern var 29 år (intervall 16–45 år), 0,2 % av deltagarna var under 18 år och 4,3 % var under 20 år. Mediangestationsåldern vid vaccination var 31 veckor och 2 dagar (intervall 24 veckor och 0 dagar till 36 veckor och 4 dagar). Spädbarnets mediangestationsålder vid födseln var 39 veckor och 1 dag (intervall 27 veckor och 3 dagar till 43 veckor och 6 dagar).
Vaccineffekten presenteras i tabell 2 och 3.
Tabell 2 Vaccineffekten för Abrysvo mot allvarlig nedre luftvägssjukdom orsakad av RSV som krävde sjukvård – hos spädbarn från födseln till 6 månaders ålder genom aktiv immunisering av gravida personer – studie 1
| Tidsperiod | Abrysvo antal fall N = 3 495 | Placebo antal fall N = 3 480 | VE % (KI)a |
| 90 dagar | 6 | 33 | 81,8 (40,6; 96,3) |
| 120 dagar | 12 | 46 | 73,9 (45,6; 88,8) |
| 150 dagar | 16 | 55 | 70,9 (44,5; 85,9) |
| 180 dagar | 19 | 62 | 69,4 (44,3; 84,1) |
KI = konfidensintervall, VE = vaccineffekt
a 99,5 % KI vid 90 dagar, 97,58 % KI vid senare intervall
Tabell 3 Vaccineffekten för Abrysvo mot nedre luftvägssjukdom orsakad av RSV som krävde sjukvård – hos spädbarn från födseln till 6 månaders ålder genom aktiv immunisering av gravida personer – studie 1
| Tidsperiod | Abrysvo antal fall N = 3 495 | Placebo antal fall N = 3 480 | VE % (KI)a |
| 90 dagar | 24 | 56 | 57,1 (14,7; 79,8) |
| 120 dagar | 35 | 81 | 56,8 (31,2; 73,5) |
| 150 dagar | 47 | 99 | 52,5 (28,7; 68,9) |
| 180 dagar | 57 | 117 | 51,3 (29,4; 66,8) |
KI = konfidensintervall, VE = vaccineffekt
a 99,5 % KI vid 90 dagar, 97,58 % KI vid senare intervall
Vaccineffekten utifrån gestationsåldern analyserades post-hoc. För allvarlig nedre luftvägssjukdom som krävde sjukvård och som uppkom inom 180 dagar, var vaccineffekten 57,2 % (95 % KI 10,4; 80,9) för kvinnor som vaccinerades tidigt i graviditeten (24 till < 30 veckor) och 78,1 % (95 % KI 52,1; 91,2) för kvinnor som vaccinerades sent under den kvalificerade graviditetsperioden (30 till 36 veckor). För nedre luftvägssjukdom som krävde sjukvård, och som uppkom inom 180 dagar, var vaccineffekten 30,9 % (95 % KI -14,4; 58,9) för kvinnor som vaccinerades tidigt i graviditeten (24 till < 30 veckor) och 62,4 % (95 % KI 41,6; 76,4) för kvinnor som vaccinerades sent under den kvalificerade graviditetsperioden (30 till 36 veckor).
Aktiv immunisering av personer 60 år och äldre
Studie 2 var en randomiserad, dubbelblindad, placebokontrollerad fas 3-multicenterstudie för att utvärdera Abrysvos effekt i förebyggandet av RSV‑associerad nedre luftvägssjukdom hos personer som är 60 år och äldre.
RSV-associerad nedre luftvägssjukdom definierades som RT‑PCR-bekräftad RSV-sjukdom med två eller fler eller tre eller fler av följande respiratoriska symtom inom 7 dagar efter symtomdebut och som varar i mer än 1 dag under samma sjukdom: nytt eller förvärrat halsont, hosta, väsande andning, sputumproduktion, andfåddhet eller takypné (≥ 25 andetag/min eller 15 % ökning från vilobaslinjen).
Deltagarna randomiserades (1:1) till att få Abrysvo (n = 18 487) eller placebo (n = 18 479). Registreringen stratifierades efter ålder, 60–69 år (63 %), 70–79 år (32 %) och ≥ 80 år (5 %). Personer som hade stabila kroniska underliggande tillstånd kunde delta i denna studie och 52 % av deltagarna hade minst 1 förspecificerat tillstånd; 16 % av deltagarna rekryterades med stabila kroniska kardiopulmonella tillstånd som astma (9 %), kroniskt obstruktiv lungsjukdom (7 %) eller hjärtsvikt (2 %). Personer med nedsatt immunförsvar var inte kvalificerade för studien.
Det primära målet var att utvärdera vaccineffekt (VE), definierat som den relativa riskreduktionen för en första episod av RSV-associerad nedre luftvägssjukdom i Abrysvo-gruppen jämfört med placebogruppen under den första RSV-säsongen.
Av deltagarna som fick Abrysvo var 51 % män och 80 % vita, 12 % hade afrikanskt eller afroamerikanskt ursprung och 42 % var latinamerikaner. Medianåldern för deltagarna var 67 år (intervall 59–95 år).
I slutet av den första RSV-säsongen visade analysen statistiskt signifikant effekt för Abrysvo för reduktion av RSV-associerad nedre luftvägssjukdom med ≥ 2 symtom och med ≥ 3 symtom.
Vaccineffekten i slutet av den första RSV-säsongen (medianvärde för uppföljningstid på 7,4 månader) presenteras i tabell 4.
Tabell 4 Vaccineffekt för Abrysvo mot RSV-sjukdom – aktiv immunisering av personer i åldern 60 år och äldre – studie 2
| Effektmått | Abrysvo | Placebo | VE (%) (95 % KI) | |||
| N | n | N | n | |||
| Första episod av RSV-associerad sjukdom i nedre luftvägarna med ≥ 2 symtoma | Totalt | 18 058 | 15 | 18 076 | 43 | 65,1 (35,9; 82,0) |
| Ålder 60–69 år | 11 305 | 10 | 11 351 | 25 | 60,0 (13,8; 82,9) | |
| Ålder 70–79 år | 5 750 | 4 | 5 742 | 12 | 66,7 (-10,0; 92,2) | |
| Med ≥ 1 betydande underliggande tillstånd | 9 377 | 8 | 9 432 | 22 | 63,6 (15,2; 86,0) | |
| Första episod av RSV-associerad sjukdom i nedre luftvägarna med ≥ 3 symtomb | Totalt | 18 058 | 2 | 18 076 | 18 | 88,9 (53,6; 98,7) |
| Ålder 60–69 år | 11 305 | 2 | 11 351 | 11 | 81,8 (16,7; 98,0) | |
| Ålder 70–79 år | 5 750 | 0 | 5 742 | 4 | 100 (-51,5; 100,0) | |
| Med ≥ 1 betydande underliggande tillstånd | 9 377 | 2 | 9 432 | 11 | 81,8 (16,7; 98,0) | |
KI – konfidensintervall, RSV – respiratoriskt syncytievirus, VE – vaccineffekt
N = antal deltagare, n = antal fall
a I en explorativ analys av RSV-subgrupp A (Abrysvo n = 3, placebo n = 16) var VE 81,3 % (KI 34,5; 96,5) och i RSV-subgrupp B (Abrysvo n = 12, placebo n = 26) var VE 53,8 % (KI 5,2; 78,8).
b I en explorativ analys av RSV-subgrupp A (Abrysvo n = 1, placebo n = 5) var VE 80,0 % (KI -78,7; 99,6) och i RSV-subgrupp B (Abrysvo n = 1, placebo n = 12) var VE 91,7 % (KI 43,7; 99,8).
Vaccineffekt i subgruppen med deltagare som var 80 år och äldre (995 deltagare i Abrysvo-gruppen och 981 deltagare placebogruppen) kan inte fastställas på grund av det låga totala antalet ackumulerade fall (7 fall av RSV-associerad nedre luftvägssjukdom med ≥ 2 symtom och 3 fall av RSV-associerad nedre luftvägssjukdom med ≥ 3 symtom).
Effekt mot RSV-associerad nedre luftvägssjukdom sett över två RSV-säsonger hos personer i åldern 60 år och äldre
Sett över två RSV-säsonger med ett medianvärde för uppföljningstid på 16,4 månader var vaccineffekten mot RSV‑associerad nedre luftvägssjukdom med ≥ 2 symtom 58,8 % (95 % KI 43,0; 70,6, 54 fall i Abrysvo-gruppen och 131 fall i placebogruppen) och 81,5 % med ≥ 3 symtom (95 % KI 63,3; 91,6, 10 fall i Abrysvo-gruppen och 54 fall i placebogruppen). Vaccineffekten mot RSV‑associerad nedre luftvägssjukdom orsakad av RSV-A och RSV-B var 66,3 % (95 % KI 47,2; 79,0) respektive 50,0 % (95% KI 18,5; 70,0) för fall med ≥ 2 symtom på nedre luftvägssjukdom och 80,6 % (95 % KI 52,9; 93,4) respektive 86,4 % (95 % KI 54,6; 97,4) för fall med ≥ 3 symtom på nedre luftvägssjukdom.
Sett över två RSV-säsonger överensstämde analyserna av vaccineffekt i subgrupperna efter ålder och betydande underliggande tillstånd med vaccineffekten i slutet av den första RSV-säsongen och stödjer en stabil och enhetlig vaccineffekt i olika ålders- och riskgrupper.
Immunogenicitet hos personer mellan 18 och 59 år
Studie 3 var en randomiserad, dubbelblind, placebokontrollerad fas 3-multicenterstudie för att bedöma säkerheten och immunogenicitet för Abrysvo hos personer mellan 18 och 59 år som ansågs löpa hög risk för att utveckla allvalrig nedre luftvägssjukdom orsakad av RSV. Studie 3 inkluderade individer med kronisk lungsjukdom (inklusive astma), kardiovaskulär sjukdom (exklusive isolerad hypertoni), njursjukdom, leversjukdom samt neurologisk, hematologisk eller metabolisk sjukdom (inklusive diabetes mellitus och hyper-/hypotyreos). Deltagarna randomiserades (2:1) till att få en engångsdos av Abrysvo (n = 437) eller placebo (n = 217).
Demografin i studie 3 var generellt lika med avseende på ålder, ras och etnicitet för deltagare som fick Abrysvo jämfört med deltagare som fick placebo. 53 % var mellan 18 och 49 år och 47 % var mellan 50 och 59 år. Vaccin- och placebogrupperna var lika i det avseendet att deltagarna hade minst ett förspecificerat medicinskt tillstånd, vilket innefattade 53 % med ≥ 1 kronisk lungsjukdom, 8 % med ≥ 1 kardiovaskulär sjukdom, 42 % med diabetes och 31 % med ≥ 1 annan sjukdom (leversjukdom, njursjukdom, neurologisk, hematologisk eller annan metabolisk sjukdom).
Vaccinets effekt hos personer mellan 18 och 59 år är härledd genom immunobridging till studie 2 där vaccinet uppvisade effekt hos personer i åldern 60 år och äldre. Kriterierna för non‑inferiority uppfylldes för högriskindivider mellan 18 och 59 år jämfört med en slumpmässigt utvald immunogenicitetsundergrupp (extern kontrollgrupp) med personer ≥ 60 år från studie 2 för förhållandet mellan RSV-neutraliserande geometriska medeltitrar (GMT) enligt de nedre gränserna för de tvåsidiga 95-procentiga konfidensintervallen > 0,667 (1,5-faldig marginal för non-inferiority), och för skillnaden i seroresponsfrekvens enligt de nedre gränserna för de tvåsidiga 95-procentiga konfidensintervallen > -10 % för både RSV A och RSV B.
Tabell 5 Jämförelse av modelljusterade RSV-neutraliserande titer (GMT) vid 1 månad efter vaccination med Abrysvo, 18 till 59 år med hög risk (studie 3) jämfört med 60 år och äldre (studie 2)
| Studie 3 18‑59 år med hög risk | Studie 2 ≥ 60 år | ANCOVA-jämförelse | |||
| RSV-subgrupper | n | Justerad GMT (95 % KI) | n | Justerad GMT (95 % KI) | Justerad GMR (95 % KI) |
| A | 435 | 41 097 (37 986; 44 463) | 408 | 26 225 (24 143; 28 486) | 1,57 (1,396; 1,759) |
| B | 437 | 37 416 (34 278; 40 842) | 408 | 24 680 (22 504; 27 065) | 1,52 (1,333; 1,725) |
KI – konfidensintervall, GMR – geometrisk medelkvot, GMT – geometrisk medeltiter
Tabell 6 Jämförelse av seroresponsfrekvens för RSV-neutraliserande titer vid 1 månad efter vaccination med Abrysvo, 18 till 59 år med hög risk (studie 3) jämfört med 60 år och äldre (studie 2)
| Studie 3 18‑59 år med hög risk | Studie 2 ≥ 60 år | Jämförelse | |||
| RSV-subgrupper | n/N (%) | 95 % KI | n/N (%) | 95 % KI | Skillnad (95 % KI) |
| A | 405/435 (93) | 90,3; 95,3 | 359/408 (88) | 84,4; 91,0 | 5,1 (1,2; 9,2) |
| B | 408/437 (93) | 90,6; 95,5 | 347/408 (85) | 81,2; 88,4 | 8,3 (4,2; 12,6) |
KI – konfidensintervall
Immunogenicitet hos personer med nedsatt immunförsvar som är 18 år eller äldre
Studie 4 (C3671023 substudie B) var en öppen, icke jämförande multicenterstudie i fas 3 för att utvärdera säkerhet och immunogenicitet för Abrysvo hos personer med nedsatt immunförsvar som är 18 år eller äldre. Forskningspersonerna hade följande sjukdomshistorik: organtransplantation (njure, lever, lunga eller hjärta) minst 3 månader före rekrytering; njursjukdom i slutstadiet och under hemodialysbehandling; autoimmuna inflammatoriska sjukdomar som behandlades med aktiv immunmodulerande behandling; framskriden icke-småcellig lungcancer under aktiv immunmodulerande behandling. Forskningspersonerna fick 2 doser Abrysvo med ett intervall på 1 månad.
En enda dos Abrysvo var tillräckligt för att framkalla stabila neutraliserande svar, som låg ungefär 8 eller 9 gånger högre än utgångsvärdet, mot RSV A och RSV B hos forskningspersoner som var 18 år eller äldre och hade immunsupprimerande tillstånd (n=188). Behandlingssvaren ökade inte ytterligare med en andra dos Abrysvo 1 månad efter den första dosen.
Pediatrisk population
Europeiska läkemedelsmyndigheten har senarelagt kravet att skicka in studieresultat för Abrysvo för barn i åldern 2 till yngre än 18 år i förebyggandet av nedre luftvägssjukdom som orsakas av RSV (information om pediatrisk användning finns i avsnitt Dosering och administreringssätt).
Farmakokinetiska egenskaper
Ej relevant.
Prekliniska säkerhetsuppgifter
Gängse studier avseende allmäntoxicitet och reproduktionseffekter och effekter på utveckling visade inte några särskilda risker för människa.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Pulver
Trometamol
Trometamolhydroklorid
Sackaros
Mannitol (E 421)
Polysorbat 80 (E 433)
Natriumklorid
Saltsyra (för pH-justering)
Vätska
Vatten för injektionsvätskor
Inkompatibiliteter
Då blandbarhetsstudier saknas får detta läkemedel inte blandas med andra läkemedel.
Hållbarhet
4 år
Den oöppnade injektionsflaskan är stabil i 5 dagar om den förvaras i en temperatur mellan 8 °C‑30 °C. Efter denna tidsperiod ska Abrysvo användas eller kasseras. Denna information är endast avsedd som vägledning för hälso- och sjukvårdspersonal vid tillfälliga temperaturskillnader.
Efter beredning
Abrysvo ska användas omedelbart efter beredning eller inom 4 timmarvid förvaring 15 °C ‑ 30 °C. Får ej frysas.
Kemisk och fysikalisk stabilitet vid användning har visats för 4 timmar mellan 15 °C och 30 °C. Ur mikrobiologisk synvinkel ska produkten användas omedelbart. Om den inte används omedelbart ansvarar användaren för förvaringsförhållanden och förvaringstid före användning.
Särskilda förvaringsanvisningar
Förvaras i kylskåp (2 ºC ‑ 8 ºC).
Får ej frysas. Kassera om kartongen har varit fryst.
Förvaringsanvisningar för läkemedlet efter beredning finns i avsnitt Hållbarhet.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
ABRYSVO injektiokuiva-aine ja liuotin, liuosta varten
1 annos (1 injektiopullon liitin, 1 neula) (228,93 €)
PF-selosteen tieto
Injektionsflaska med antigen till Abrysvo (pulver) och förfylld spruta med vätska
Pulver för 1 dos i en injektionsflaska (glas typ 1 eller motsvarande) med en propp (syntetisk bromobutylgummi eller syntetisk klorobutylgummi) och ett snäpplock.
Vätska för 1 dos i en förfylld spruta (glas typ 1) med en propp (syntetisk klorobutylgummi) och skyddshätta (syntetisk gummiblandning av isopren/bromobutyl).
Flaskadapter
Injektionsflaska med antigen till Abrysvo (pulver) och injektionsflaska med vätska
Pulver för 1 dos i en injektionsflaska (glas typ 1 eller motsvarande) med en propp (syntetisk bromobutylgummi eller syntetisk klorobutylgummi) och ett snäpplock.
Vätska för 1 dos i en injektionsflaska (glas typ 1 eller motsvarande) med en propp (syntetiskt bromobutylgummi) och ett snäpplock.
Förpackningsstorlekar
Förpackning med 1 injektionsflaska med pulver (antigen), 1 förfylld spruta med vätska och 1 flaskadapter, med 1 nål eller utan nålar (förpackning med 1 dos).
Förpackning med 5 injektionsflaskor med pulver (antigen), 5 förfyllda sprutor med vätska och 5 flaskadaptrar, med 5 nålar eller utan nålar (förpackning med 5 doser).
Förpackning med 10 injektionsflaskor med pulver (antigen), 10 förfyllda sprutor med vätska och 10 flaskadaptrar, med 10 nålar eller utan nålar (förpackning med 10 doser).
Förpackning med 5 injektionsflaskor med pulver (antigen) och 5 injektionsflaskor med vätska (förpackning med 5 doser).
Förpackning med 10 injektionsflaskor med pulver (antigen) och 10 injektionsflaskor med vätska (förpackning med 10 doser).
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Läkemedlets utseende:
Pulvret är vitt.
Vätskan är klar och färglös.
Särskilda anvisningar för destruktion och övrig hantering
Hantering av injektionsflaska med antigen till Abrysvo (pulver), förfylld spruta med vätska och flaskadapter
Abrysvo måste beredas före administrering genom att tillsätta all vätska som finns i den förfyllda sprutan till injektionsflaskan som innehåller pulver, med hjälp av flaskadaptern.
Vaccinet får endast beredas med den medföljande vätskan.
Förberedelse inför administrering
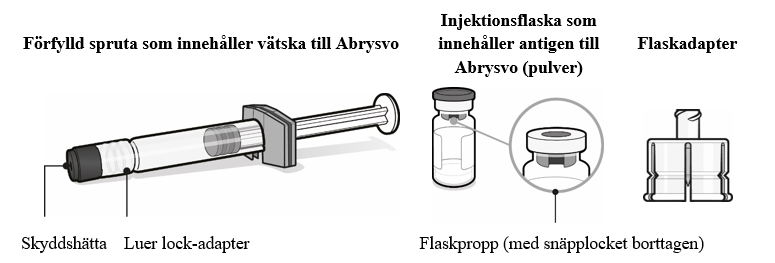
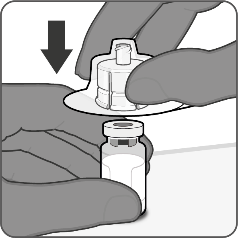 | Steg 1. Sätt fast flaskadaptern
|
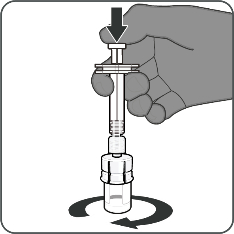 | Steg 2. Bered pulverkomponenten (antigen) för att bilda Abrysvo
|
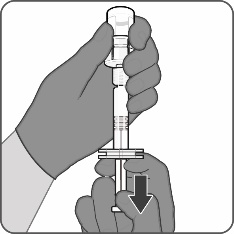 | Steg 3. Dra upp det beredda vaccinet
|
Det beredda vaccinet är en klar, färglös lösning. Kontrollera vaccinet visuellt med avseende på stora partiklar och missfärgningar före administrering. Använd inte vaccinet om det innehåller stora partiklar eller är missfärgat.
Hantering av injektionsflaska med antigen till Abrysvo (pulver) och injektionsflaska med vätska
Injektionsflaskan med antigen till Abrysvo (pulver) får endast beredas med injektionsflaskan med vätska som tillhandahålls för att bilda Abrysvo.
Förberedelse inför administrering
- Använd en steril nål och steril spruta. Dra upp allt innehåll från injektionsflaskan som innehåller vätska och injicera allt innehåll som finns i sprutan in i injektionsflaskan som innehåller pulver.
- Snurra injektionsflaskan försiktigt i en cirkelrörelse tills pulvret är helt upplöst. Skaka inte.
- Dra upp 0,5 ml från injektionsflaskan som innehåller det beredda vaccinet.
Det beredda vaccinet är en klar, färglös lösning. Kontrollera vaccinet visuellt med avseende på stora partiklar och missfärgningar före administrering. Använd inte vaccinet om det innehåller stora partiklar eller är missfärgat.
Kassering
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Ersättning
ABRYSVO injektiokuiva-aine ja liuotin, liuosta varten
1 annos
- Ei korvausta.
Atc-kod
J07BX05
Datum för översyn av produktresumén
04.09.2025
Yhteystiedot
 PFIZER OY
PFIZER OY Tietokuja 4
00330 Helsinki
09 430 040
www.pfizer.fi
etunimi.sukunimi@pfizer.com
