THALIDOMIDE BMS kapseli, kova 50 mg
Vaikuttavat aineet ja niiden määrät
Yksi kapseli sisältää 50 mg talidomidia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Kova kapseli.
Kliiniset tiedot
Käyttöaiheet
Thalidomide BMS yhdessä melfalaanin ja prednisonin kanssa on tarkoitettu ensilinjan hoidoksi sellaisille potilaille, joilla on hoitamaton multippeli myelooma, jotka ovat iältään ≥ 65-vuotiaita tai joille ei voida antaa suuria annoksia kemoterapiaa.
Thalidomide BMS ‑valmistetta määrätään ja annetaan Thalidomide BMS ‑valmisteen raskauden ehkäisyohjelman mukaisesti (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Ehto
Talidomidihoito on aloitettava ja sitä on seurattava sellaisten lääkärien valvonnassa, joilla on asiantuntemus immunomodulatoristen lääkeaineiden tai solunsalpaajien käytöstä ja jotka ymmärtävät täysin talidomidihoitoon liittyvät vaaratekijät ja seurantavaatimukset (ks. SPC, kohta 4.4). Lääkkeen määrääminen ja toimittaminen naisille, jotka voivat tulla raskaaksi, on rajoitettu 30 päivän lääkitykseen yhdellä reseptillä, ja hoidon jatkaminen vaatii uuden lääkemääräyksen. Naisille, jotka voivat tulla raskaaksi, kirjoitettu lääkemääräys on voimassa seitsemän (7) päivää lääkemääräyksen kirjoittamisesta.
Annostus ja antotapa
Hoito on aloitettava ja sitä on seurattava sellaisten lääkärien valvonnassa, joilla on asiantuntemus immunomodulatoristen lääkeaineiden tai solunsalpaajien käytöstä ja jotka ymmärtävät täysin talidomidihoitoon liittyvät vaaratekijät ja seurantavaatimukset (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Annostus
Suositeltava talidomidiannos on 200 mg/vrk suun kautta.
Maksimimäärä eli 12 kuuden viikon (42 vuorokauden) mittaista sykliä pitää käyttää.
Taulukko 1: Talidomidin aloitusannokset yhdessä melfalaanin ja prednisonin kanssa
Ikä (vuotta) | ANC* (/mikrol) | Verihiutalemäärä (/mikrol) | Talidomidia,b | Melfalaanic,d,e | Prednisonif | |
≤ 75 | ≥ 1 500 | JA | ≥ 100 000 | 200 mg/vrk | 0,25 mg/kg/vrk | 2 mg/kg/vrk |
≤ 75 | < 1 500 – ≥ 1 000 | TAI | < 100 000 – ≥ 50 000 | 200 mg/vrk | 0,125 mg/kg/vrk | 2 mg/kg/vrk |
> 75 | ≥ 1 500 | JA | ≥ 100 000 | 100 mg/vrk | 0,20 mg/kg/vrk | 2 mg/kg/vrk |
> 75 | < 1 500 –≥ 1 000 | TAI | < 100 000 – ≥ 50 000 | 100 mg/vrk | 0,10 mg/kg/vrk | 2 mg/kg/vrk |
* ANC: absoluuttinen neutrofiiliarvo
a Talidomidia annetaan kerran vuorokaudessa ennen nukkumaan menoa kunkin 42 vuorokauden mittaisen syklin vuorokausina 1–42.
b Talidomidiin yhdistetyn sedatiivisen vaikutuksen vuoksi anto ennen nukkumaan menoa parantaa tunnetusti yleensä siedettävyyttä.
c Melfalaania annetaan kerran vuorokaudessa kunkin 42 vuorokauden mittaisen syklin vuorokausina 1–4.
d Melfalaanin annostusta pienennetään 50 % munuaisten vajaatoiminnassa, joka on keskivaikea (kreatiniinin puhdistuma, CrCl ≥ 30 mutta < 50 ml/min) tai vaikea (CrCl < 30 ml/min).
e Melfalaanin enimmäisannos vuorokaudessa: 24 mg (≤ 75‑vuotiaat) tai 20 mg (> 75‑vuotiaat).
f Prednisonia annetaan kerran vuorokaudessa kunkin 42 vuorokauden mittaisen syklin vuorokausina 1‑4.
Potilaita pitää seurata seuraavien oireiden varalta: tromboemboliset tapahtumat, perifeerinen neuropatia, vaikeat ihoreaktiot, bradykardia, synkopee, uneliaisuus, neutropenia ja trombosytopenia (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset). Annoksen siirtäminen myöhäisemmäksi, pienentäminen tai lääkityksen keskeyttäminen NCI CTC (National Cancer Institute Common Toxicity Criteria) ‑asteesta riippuen voi olla tarpeen.
Jos annoksen unohtumisesta on kulunut alle 12 tuntia, potilas voi ottaa annoksen. Jos annoksen tavallisesta ottamisajankohdasta on kulunut yli 12 tuntia, potilaan tulee jättää annos väliin ja ottaa seuraava annos tavalliseen aikaan seuraavana päivänä.
Tromboemboliset tapahtumat
Tromboosin estolääkitystä pitää antaa vähintään viiden ensimmäisen hoitokuukauden ajan erityisesti niille potilaille, joilla on ylimääräisiä tromboosin riskitekijöitä. Profylaktista tromboosia estäviä lääkevalmisteita, kuten pienen molekyylipainon hepariinit tai varfariinit, pitää suositella. Päätös profylaktisen tromboosin estolääkityksen käytöstä pitää tehdä sen jälkeen, kun potilaan riskitekijät on huolella arvioitu (katso Varoitukset ja käyttöön liittyvät varotoimet, Yhteisvaikutukset ja Haittavaikutukset).
Jos potilaalla esiintyy mikä tahansa tromboembolinen tapahtuma, hoito täytyy keskeyttää ja tavallinen antikoagulanttihoito aloittaa. Kun potilaan tila on stabiloitunut antikoagulanttihoidolla, ja mahdolliset tromboembolisen tapahtuman aiheuttamat komplikaatiot on hoidettu, talidomidihoito voidaan aloittaa uudelleen alkuperäisellä annoksella haitta-hyötysuhteen arvioinnin tuloksen mukaan. Potilaan antikoagulanttihoitoa pitää jatkaa talidomidihoidon aikana.
Neutropenia
Veren valkosolumäärää ja erittelyä pitää seurata jatkuvasti syöpäsairauksia koskevien ohjeistojen mukaisesti erityisesti, jos potilas saattaa olla tavanomaista alttiimpi neutropenialle. Annoksen siirtäminen myöhäisemmäksi, pienentäminen tai lääkityksen keskeyttäminen NCI CTC ‑asteesta riippuen voi olla tarpeen.
Trombosytopenia
Verihiutalemäärää pitää seurata jatkuvasti syöpäsairauksia koskevien ohjeistojen mukaisesti. Annoksen siirtäminen myöhäisemmäksi, pienentäminen tai lääkityksen keskeyttäminen NCI CTC ‑asteesta riippuen voi olla tarpeen.
Perifeerinen neuropatia
Perifeerisestä neuropatiasta johtuvat annosmuutokset on selitetty taulukossa 2.
Taulukko 2: Suositeltavat annosmuutokset talidomidiin liittyvässä neuropatiassa multippelin myelooman ensilinjan hoitona.
Neuropatian vaikeusaste | Annoksen ja hoidon muutos |
Aste 1 (parestesia, heikkous ja/tai refleksien heikkeneminen) ilman toimintakyvyn heikkenemistä | Potilaan seurantaa jatketaan kliinisillä tutkimuksilla. Annoksen pienentämistä pitää harkita, jos oireet pahenevat. Annoksen pienentäminen ei kuitenkaan välttämättä johda oireiden lievittymiseen. |
Aste 2 (häiritsee toimintaa, mutta ei päivittäisiä askareita) | Annosta vähennetään tai hoito keskeytetään, ja potilaan seurantaa jatketaan kliinisillä ja neurologisilla tutkimuksilla. Jos potilaan tila ei parane tai neuropatia pahenee, hoito keskeytetään. Jos neuropatia lievenee asteeseen 1 tai parempaan tilaan, hoito voidaan aloittaa uudelleen, jos haitta-hyötysuhde on lupaava. |
Aste 3 (häiritsee päivittäisiä askareita) | Hoito keskeytetään. |
Aste 4 (invalidisoiva neuropatia) | Hoito keskeytetään |
Allergiset reaktiot ja vaikeat iho-oireet
Talidomidihoidon keskeyttämistä tai lopettamista on harkittava asteen 2–3 ihottuman tapauksessa. Talidomidihoito on lopetettava angioedeeman, anafylaktisen reaktion, asteen 4 ihottuman tai kesivän tai rakkulaisen ihottuman tapauksessa sekä Stevens-Johnsonin oireyhtymää (SJS), toksista epidermaalista nekrolyysiä (TEN) tai lääkkeeseen liittyvää yleisoireista eosinofiilistä reaktiota (DRESS) epäiltäessä, eikä hoitoa saa aloittaa uudelleen, jos hoito on lopetettu näiden reaktioiden vuoksi.
Iäkkäät potilaat
Iäkkäille ≤ 75‑vuotiaille potilaille ei ole erityisiä annosmuutoksia koskevia suosituksia. Iältään > 75‑vuotiaille potilaille talidomidin suositeltu aloitusannos on 100 mg vuorokaudessa. Melfalaanin aloitusannosta pienennetään iäkkäille > 75‑vuotiaille potilaille lähtötilanteen luuydinreservin ja munuaisten toiminnan perusteella. Suositeltu melfalaanin aloitusannos on luuydinreservin mukaan 0,1‑0,2 mg/kg vuorokaudessa; tätä annosta pienennetään lisäksi 50 %, jos potilaalla on keskivaikea (kreatiniinin puhdistuma, CrCl ≥ 30 – < 50 ml/min) tai vaikea (CrCl < 30 ml/min) munuaisten vajaatoiminta. Melfalaanin enimmäisannos vuorokaudessa > 75‑vuotiaille potilaille on 20 mg (ks. taulukko 1).
Potilaat, joiden munuais- tai maksatoiminta on heikentynyt
Thalidomide BMS ‑valmistetta ei ole virallisesti tutkittu munuaisten tai maksan vajaatoimintaa sairastavilla potilailla. Näille potilaille ei ole erityisiä annossuosituksia. Voimakkaasta elinten vajaatoiminnasta kärsiviä potilaita on seurattava tarkasti haittavaikutusten varalta.
Pediatriset potilaat
Ei ole asianmukaista käyttää Thalidomide BMS ‑valmistetta pediatristen potilaiden multippelin myelooman hoitoon.
Antotapa
Thalidomide BMS pitää ottaa kerta-annoksena juuri ennen nukkumaanmenoa uneliaisuutta aiheuttavan vaikutuksen vuoksi. Kapseleita ei saa avata eikä murskata (ks. kohta Käyttö- ja käsittelyohjeet).
On suositeltavaa, että kapselia läpipainopakkauksesta poistettaessa painetaan vain toisesta päästä sen deformoitumisen tai rikkoutumisen riskin vähentämiseksi.
Vasta-aiheet
- Yliherkkyys talidomidille tai kohdassa Apuaineet mainituille apuaineille.
- Raskaana olevat naiset (ks. kohta Raskaus ja imetys).
- Naiset, jotka voivat tulla raskaaksi, elleivät kaikki raskauden ehkäisyohjelman ehdot täyty (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Raskaus ja imetys.).
- Miespuoliset potilaat, jotka eivät pysty noudattamaan vaadittuja ehkäisytoimenpiteitä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet.).
Varoitukset ja käyttöön liittyvät varotoimet
Teratogeeniset vaikutukset Talidomidi on voimakas teratogeeni ihmisellä, ja se aiheuttaa usein vakavia ja hengenvaarallisia sikiövaurioita. Talidomidia ei saa koskaan antaa naisille, jotka ovat raskaana eikä naisille, jotka saattavat tulla raskaaksi elleivät raskauden ehkäisyohjelman kaikki ehdot täyty. Kaikkien mies- ja naispuolisten potilaiden täytyy täyttää raskauden ehkäisyohjelman ehdot. |
Kriteerit naisille, jotka eivät voi tulla raskaaksi
Naispuolisen potilaan tai miespuolisen potilaan naispuolisen partnerin voidaan olettaa tulevan raskaaksi, ellei vähintään yksi seuraavista kriteereistä täyty:
- ikä ≥ 50 vuotta ja kuukautiset luonnollisesti poissa vähintään 1 vuoden ajan (syöpähoitoa seuraava tai imetyksen aikainen amenorrea ei poissulje raskaaksi tulon mahdollisuutta)
- erikoistuneen gynekologin vahvistama ennenaikainen munasarjojen toimintahäiriö
- aikaisempi molemminpuolinen munanjohtimen ja munasarjan poisto tai kohdunpoisto
- XY‑genotyyppi, Turnerin oireyhtymä, kohdun synnynnäinen puuttuminen.
Neuvonta
Talidomidi on kontraindisoitu naisille, jotka voivat tulla raskaaksi, elleivät kaikki seuraavista ehdoista täyty:
- nainen ymmärtää sikiölle aiheutuvan teratogeenisen riskin
- nainen ymmärtää tehokkaan ehkäisyn tarpeen ilman keskeytyksiä vähintään 4 viikkoa ennen hoidon aloittamista, koko hoidon ajan ja vähintään 4 viikkoa hoidon päättymisen jälkeen
- vaikka nainen, joka voi tulla raskaaksi, olisi amenorreeinen, hänen täytyy noudattaa tehokkaasta ehkäisystä annettuja ohjeita
- naisen pitää pystyä noudattamaan tehokasta ehkäisyä
- naiselle on kerrottu raskauden mahdollisista seurauksista sekä tarpeesta ottaa nopeasti yhteyttä lääkäriinsä, mikäli raskautta on syytä epäillä, ja hän myös ymmärtää nämä
- nainen ymmärtää tarpeen aloittaa hoito heti kun talidomidia annetaan negatiivisen raskaustestin jälkeen
- nainen ymmärtää 4 viikon välein tehtävän raskaustestin tarpeen ja suostuu siihen, paitsi jos hänelle on vahvistetusti tehty sterilisaatio (munanjohtimet)
- nainen ilmoittaa ymmärtävänsä talidomidin käyttöön liittyvät vaarat ja tarpeelliset varotoimenpiteet.
Koska talidomidia esiintyy spermassa, talidomidia käyttävien miespotilaiden on varotoimenpiteenä täytettävä seuraavat kriteerit:
- hänen on ymmärrettävä teratogeeninen riski, mikäli hän on seksuaalisessa kanssakäymisessä raskaana olevan naisen kanssa tai sellaisen naisen kanssa, joka voi tulla raskaaksi
- hänen on ymmärrettävä kondomin käytön tarpeellisuus (vaikka miehelle olisi tehty vasektomia) hoidon aikana, annoksen keskeytyksen aikana, ja vähintään 7 päivän ajan hoidon päättymisen jälkeen, mikäli hän on seksuaalisessa kanssakäymisessä raskaana olevan tai mahdollisesti raskaaksi tulevan naisen kanssa, joka ei käytä tehokasta ehkäisyä
- hänen on ymmärrettävä, että jos naispuolinen kumppani tulee raskaaksi hänen talidomidihoitonsa aikana tai 7 päivän sisällä talidomidihoidon päättymisen jälkeen, hänen on ilmoitettava asiasta hoitavalle lääkärilleen välittömästi, ja että naispuolisen kumppanin on suositeltavaa mennä arviointia ja neuvoja varten lääkäriin, joka on erikoistunut teratologiaan tai jolla on siitä kokemusta.
Lääkkeen määrääjän täytyy varmistaa, että:
- potilas noudattaa raskauden ehkäisyohjelmaa ja siihen liittyviä ehtoja ja hän on vahvistanut tai hänen on vahvistettu ymmärtävän niitä koskevat tiedot riittävän hyvin
- potilas on ilmoittanut hyväksyvänsä edellä mainitut ehdot.
Ehkäisy
Naisten, jotka voivat tulla raskaaksi, täytyy käyttää yhtä tehokasta ehkäisymenetelmää vähintään 4 viikkoa ennen talidomidihoidon aloittamista, hoidon aikana sekä vähintään 4 viikon ajan hoidon päättymisen jälkeen, vaikka annos keskeytettäisiin, ellei potilas pidättäydy sukupuoliyhdynnästä täysin ja jatkuvasti, mikä vahvistetaan joka kuukausi. Jos potilas ei käytä tehokasta ehkäisymenetelmää, hänet täytyy ohjata asianmukaisesti pätevälle terveydenhuollon ammattilaiselle ehkäisyneuvontaa varten, jotta ehkäisy voidaan aloittaa.
Seuraavat ovat esimerkkejä tehokkaista ehkäisymenetelmistä:
- implantti
- levonorgestreeliä vapauttava kohdunsisäinen ehkäisin (IUD)
- medroksiprogesteroniasetaattidepotinjektio
- sterilisaatio (munanjohtimet)
- seksuaalinen kanssakäyminen vain sellaisen miespuolisen partnerin kanssa, jolle on tehty vasektomia, mikä täytyy vahvistaa kahdella negatiivisella sperma-analyysillä
- ovulaation estävät progestiinitabletit (esim. desogestreeli).
Oraalisten yhdistelmäehkäisytablettien käyttö ei ole suositeltavaa, koska laskimoperäinen veritulppariski on suurentunut multippelia myeloomaa (MM) sairastavilla potilailla (ks. kohta Yhteisvaikutukset). Jos potilas tällä hetkellä käyttää oraalisia yhdistelmäehkäisytabletteja, hänen pitää vaihtaa ne johonkin edellä mainituista tehokkaista menetelmistä. Laskimoperäisen veritulpan vaara jatkuu 4‑6 viikkoa oraalisten yhdistelmäehkäisytablettien lopettamisen jälkeen.
Raskaustestit
Naisille, jotka voivat tulla raskaaksi, on tehtävä lääkärin valvonnan alaisuudessa raskaustestit, joiden minimiherkkyys on 25 mIU/ml, kuten seuraavassa on esitetty. Tämä vaatimus koskee myös niitä naisia, jotka voivat tulla raskaaksi ja jotka noudattavat täydellistä ja jatkuvaa pidättyvyyttä.
Ennen hoidon aloittamista
Raskaustesti on tehtävä lääkärin valvonnassa konsultaation yhteydessä, kun talidomidia määrätään tai 3 vuorokauden aikana ennen lääkettä määräävän lääkärin luona käyntiä, kun potilas on käyttänyt tehokasta ehkäisyä vähintään 4 viikkoa. Testin pitää varmistaa, että potilas ei ole raskaana, kun hän aloittaa talidomidihoidon.
Seuranta ja hoidon päättyminen
Raskaustesti on toistettava lääkärin valvonnassa 4 viikon välein mukaan lukien 4 viikkoa hoidon päättymisen jälkeen, paitsi jos naiselle on vahvistetusti tehty sterilisaatio (munanjohtimet). Nämä raskaustestit tehdään niillä käyntikerroilla, kun lääke määrätään tai 3 vuorokauden aikana ennen lääkettä määräävän lääkärin luona käyntiä.
Miehet
Koska talidomidia esiintyy spermassa, miespuolisten potilaiden täytyy varotoimenpiteenä käyttää kondomia hoidon aikana, annoksen keskeytyksen aikana ja vähintään 7 päivän ajan hoidon päättymisen jälkeen, jos heidän kumppaninsa on raskaana tai nainen, joka voi tulla raskaaksi eikä käytä tehokasta ehkäisyä.
Miespuolisten potilaiden ei tule luovuttaa spermaa tai siittiöitä hoidon aikana (ei myöskään annoksen keskeytyksen aikana) eikä vähintään 7 päivään talidomidihoidon päättymisen jälkeen.
Muut varotoimenpiteet
Potilaille täytyy kertoa, ettei tätä lääkettä saa koskaan antaa muille, ja että heidän pitää palauttaa kaikki käyttämättömät kapselit apteekkiin hoidon päätyttyä.
Potilaat eivät saa luovuttaa verta hoidon aikana (hoitotauot mukaan lukien) eikä vähintään 7 päivään talidomidihoidon päättymisen jälkeen.
Terveydenhuollon ammattilaisten ja huoltajien on läpipainolevyjä tai kapseleita käsitellessään käytettävä kertakäyttöisiä käsineitä. Naisten, jotka ovat raskaana tai epäilevät olevansa raskaana, ei pidä käsitellä läpipainolevyjä tai kapseleita (ks. Kohta Käyttö- ja käsittelyohjeet).
Koulutusmateriaali, lääkkeen määräämiseen ja antoon liittyvät rajoitukset
Myyntiluvan haltija toimittaa terveydenhuollon ammattilaisille koulutusmateriaalia, joka sisältää varoituksia talidomidin teratogeenisuudesta, neuvoja raskaudenehkäisystä ennen hoidon alkamista ja tietoa raskaustestien tekemisen välttämättömyydestä, auttaakseen potilaita välttämään sikiön altistumista talidomidille. Lääkkeen määräävän lääkärin on kerrottava potilaalle odotettavissa olevasta teratogeenisesta riskistä ja raskaudenehkäisyyn liittyvistä tarkoin noudatettavista toimenpiteistä, jotka on määritetty raskaudenehkäisyohjelmassa, sekä annettava potilaalle asianmukainen koulutusesite, potilaskortti ja/tai vastaava kansallisen toimivaltaisen viranomaisen kanssa sovitun mukaisesti. Kunkin maan kansallisen toimivaltaisen viranomaisen kanssa sovitusti on otettu käyttöön kontrolloitu käyttöönoton ohjelma, joka käsittää potilaskortin ja/tai vastaavan menetelmän käytön lääkkeen määräämisen ja/tai toimittamisen kontrollia varten sekä käyttöaihetta koskevien tietojen keräämisen kyseisellä kansallisella alueella tapahtuvan käyttöaiheesta poikkeavan käytön seuraamista varten. Raskaustestin, lääkkeen määräämisen ja lääkkeen toimittamisen tulisi mieluiten tapahtua samana päivänä. Naisille, jotka voivat tulla raskaaksi, talidomidi tulee toimittaa 7 vuorokauden kuluessa lääkkeen määräämisestä ja lääkärin valvoman raskaustestin negatiivisen tuloksen jälkeen. Lääkettä saa määrätä naisille, jotka voivat tulla raskaaksi, enintään 4 viikon hoitojaksoa varten hyväksyttyjen käyttöaiheiden annostusohjelmien mukaisesti (ks. kohta Annostus ja antotapa). Muille potilaille lääkettä saa määrätä enintään 12 viikon hoitojaksoa varten.
Amenorrea
Talidomidin käyttöön saattaa liittyä kuukautishäiriöitä, amenorrea mukaan lukien. Talidomidihoidon aikana esiintyvän amenorrean on oletettava johtuvan raskaudesta kunnes on lääketieteellisesti vahvistettu, että potilas ei ole raskaana. Tarkkaa mekanismia, jolla talidomidi voi aiheuttaa amenorreaa, ei ole selvitetty. Ilmoitetut tapaukset esiintyivät nuorilla (keskimäärin 36‑vuotiailla) naisilla (ennen vaihdevuosia), jotka saivat talidomidia muissa kuin multippeliin myeloomaan liittyvissä käyttöaiheissa, ja joilla kuukautiset loppuivat 6 kk kuluessa hoidon aloittamisesta ja alkoivat kun talidomidihoito lopetettiin. Hormoneja arvioivissa dokumentoiduissa tapausraporteissa amenorrean tapahtuma liitettiin estradiolin pienentyneisiin tasoihin ja kohonneisiin FSH/LH‑hormonitasoihin. Tutkittaessa munasarjavasta-aineet olivat negatiiviset ja prolaktiinitason raja-arvot olivat normaalit.
Sydän ja verisuonisto
Sydäninfarkti
Sydäninfarkteja on raportoitu talidomidia saavilla potilailla, erityisesti niillä, joilla tiedetään olevan riskitekijöitä. Potilaita, joilla tiedetään olevan sydäninfarktin riskitekijöitä, aikaisemmin esiintynyt tromboosi mukaan lukien, täytyy tarkkailla huolellisesti ja ryhtyä toimenpiteisiin pyrkimyksenä minimoida kaikki riskitekijät, joihin voidaan vaikuttaa (esim. tupakointi, hypertensio ja hyperlipidemia).
Laskimon ja valtimon tromboemboliset tapahtumat
Talidomidihoitoa saavilla potilailla on laskimotromboembolian (kuten syvän laskimotukoksen ja keuhkoveritulpan) ja valtimotromboembolian (kuten sydäninfarktin ja aivoverisuonitapahtumien) lisääntynyt riski (ks. kohta Haittavaikutukset). Riski vaikuttaa olevan suurin 5 ensimmäisen hoitokuukauden aikana.
Tromboosin estolääkityksen ja annostuksen/antikoagulanttihoidon suositukset annetaan kohdassa Annostus ja antotapa.
Aiemmat tromboemboliset tapahtumat tai samanaikainen erytropoieettisten tai muiden aineiden, kuten hormonikorvauslääkkeiden, käyttäminen voi myös lisätä näiden potilaiden tromboembolian vaaraa. Sen vuoksi näitä aineita pitää antaa varoen multippelia myeloomaa sairastaville potilaille, jotka saavat talidomidia prednisonin ja melfalaanin kanssa. Erityisesti hemoglobiinipitoisuuden nousun yli 12 g/dl pitää johtaa erytropoieettisten lääkeaineiden annon keskeytykseen. Toimenpiteisiin pitää ryhtyä pyrkimyksenä minimoida kaikki riskitekijät, joihin voidaan vaikuttaa (esim. tupakointi, hypertensio ja hyperlipidemia).
Potilaita ja lääkäreitä neuvotaan tarkkaavaisuuteen tromboembolian merkkien ja oireiden suhteen. Potilaita pitää kehottaa hakeutumaan lääkärin hoitoon, jos heille kehittyy sellaisia oireita, kuten hengästyminen, rintakipu, turvotus käsivarsissa tai säärissä.
Kilpirauhassairaudet
Kilpirauhasen vajaatoimintatapauksia on raportoitu. Kilpirauhasen toimintaan vaikuttavien samanaikaisten sairauksien saamista optimaaliseen hoitotasapainoon suositellaan ennen hoidon aloittamista. Kilpirauhasen toiminnan seurantaa suositellaan hoitoa aloitettaessa ja hoidon aikana.
Perifeerinen neuropatia
Perifeerinen neuropatia on hyvin yleinen, mahdollisesti vakava talidomidihoidon haittavaikutus, joka voi johtaa pysyviin vaurioihin (ks. kohta Haittavaikutukset). Vaiheen 3 tutkimuksessa mediaaniaika ensimmäiseen neuropatiatapaukseen oli 42,3 viikkoa.
Jos potilaalla ilmenee perifeeristä neuropatiaa, on noudatettava kohdassa Annostus ja antotapa annettuja annoksen ja aikataulun muuttamista koskevia ohjeita.
Potilaita on suositeltavaa tarkkailla neuropatian oireiden varalta. Oireita ovat parestesia, dysestesia, kivut, epänormaali koordinaatio tai heikkous.
On suositeltavaa, että potilaille tehdään kliiniset ja neurologiset tutkimukset ennen talidomidihoidon aloittamista ja että rutiininomainen seuranta on säännöllistä koko hoidon ajan. Neuropatiaan tunnetusti liittyviä lääkevalmisteita pitää käyttää varoen talidomidihoitoa saavien potilaiden kohdalla (ks. kohta Yhteisvaikutukset).
Talidomidi saattaa myös pahentaa olemassa olevaa neuropatiaa, eikä sitä tästä syystä pidä käyttää potilailla, joilla on perifeerisen neuropatian kliinisiä löydöksiä tai oireita, elleivät kliiniset hyödyt ole haittoja suuremmat.
Synkopee, bradykardia ja eteis-kammiokatkos
Potilaita pitää seurata synkopeen, bradykardian ja eteis-kammiokatkoksen varalta; annoksen pienentäminen tai lääkityksen lopettaminen voi olla tarpeen.
Keuhkoverenpainetauti
Talidomidilla hoidettujen potilaiden keskuudessa on raportoitu keuhkoverenpainetautitapauksia, joista osa johti kuolemaan. Potilaat on arvioitava taustalla olevan sydämeen ja keuhkoihin liittyvän sairauden merkkien ja oireiden varalta ennen talidomidihoidon aloittamista ja sen aikana.
Hematologiset sairaudet
Neutropenia
Haittavaikutuksena raportoitu asteen 3 tai 4 neutropenia oli yleisempää multippelia myeloomaa sairastavilla potilailla, jotka saivat melfalaanin, prednisonin ja talidomidin yhdistelmää (MPT), kuin potilailla, jotka saivat melfalaanin ja prednisonin (MP) yhdistelmää: 42,7 % vs. 29,5 % (IFM 99‑06 ‑tutkimus). Talidomidin käytön yhteydessä raportoitiin markkinoille tulon jälkeen haittavaikutuksina mm. kuumeista neutropeniaa ja pansytopeniaa. Potilaita pitää tarkkailla, ja annoksen siirtäminen myöhäisemmäksi, pienentäminen tai lääkityksen keskeyttäminen saattaa olla tarpeen (ks. kohta Annostus ja antotapa).
Trombosytopenia
Trombosytopeniaa, mukaan luettuna asteiden 3 tai 4 haittavaikutuksia, on raportoitu multippelia myeloomaa sairastavilla potilailla, jotka saivat melfalaanin, prednisonin ja talidomidin (MPT) yhdistelmää. Potilaita pitää tarkkailla, ja annoksen siirtäminen myöhäisemmäksi, pienentäminen tai lääkityksen keskeyttäminen saattaa olla tarpeen (ks. kohta Annostus ja antotapa). Potilaita ja lääkäreitä kehotetaan tarkkailemaan verenvuodon merkkejä ja oireita, petekiat, nenäverenvuoto ja ruoansulatuselimistön verenvuoto mukaan lukien, erityisesti silloin, kun käytetään samanaikaista, helposti verenvuotoa aiheuttavaa lääkevalmistetta (ks. kohdat Yhteisvaikutukset ja Haittavaikutukset).
Maksasairaudet
Maksahäiriöitä, pääasiassa poikkeavia maksakokeiden tuloksia, raportoitiin. Hepatosellulaariset ja kolestaattiset poikkeavuudet eivät noudattaneet erityistä kaavaa, ja joissakin tapauksissa niitä esiintyi yhdessä. Suurin osa reaktioista esiintyi kahden ensimmäisten hoitokuukauden aikana ja hävisi itsestään ilman hoitoa, kun talidomidin käyttö lopetettiin. Potilaan maksan toimintaa pitää seurata, etenkin jos potilaalla on ennestään maksasairaus tai hän käyttää samanaikaisesti maksan toimintahäiriöille altistavaa lääkevalmistetta (ks. kohta Haittavaikutukset).
Allergiset reaktiot ja vaikeat iho-oireet
Talidomidin käytön yhteydessä on raportoitu allergisia reaktioita mukaan lukien angioedeema, anafylaktinen reaktio ja vaikeita ihoreaktioita mukaan lukien Stevens-Johnsonin oireyhtymää (SJS), toksista epidermaalista nekrolyysiä (TEN) ja lääkkeeseen liittyvää yleisoireista eosinofiilistä reaktiota (DRESS). Lääkettä määräävien lääkärien on kerrottava potilaille tällaisten reaktioiden merkeistä ja oireista ja neuvottava potilaita hakeutumaan lääkärinhoitoon välittömästi, jos niitä ilmenee. Talidomidihoidon keskeyttämistä tai lopettamista on harkittava asteen 2–3 ihottuman tapauksessa. Talidomidihoito on lopetettava angioedeeman, anafylaktisen reaktion, asteen 4 ihottuman tai kesivän tai rakkulaisen ihottuman tapauksessa sekä SJS:ää, TEN:iä tai DRESS:iä epäiltäessä, eikä hoitoa saa aloittaa uudelleen, jos hoito on lopetettu näiden reaktioiden vuoksi (ks. kohdat Annostus ja antotapa ja Haittavaikutukset).
Uneliaisuus
Talidomidi aiheuttaa hyvin yleisesti uneliaisuutta. Potilaita pitää kehottaa välttämään tilanteita, missä uneliaisuus voi aiheuttaa ongelmia, ja kysymään lääkärin neuvoa ennen muiden tunnetusti uneliaisuutta aiheuttavien lääkevalmisteiden ottamista. Potilaita pitää seurata ja annosta on mahdollisesti pienennettävä.
Potilaille pitää kertoa vaarallisiin tehtäviin tarvittavien henkisten ja/tai fyysisten kykyjen mahdollisesta heikkenemisestä (ks. kohta Vaikutus ajokykyyn ja koneidenkäyttökykyyn).
Tuumorilyysioireyhtymä
Niillä potilailla, joiden kasvaintaakka on ollut suuri ennen hoitoa, on tuumorilyysioireyhtymän vaara. Näiden potilaiden tilaa tulee seurata tarkoin ja asianmukaisia varotoimenpiteitä on noudatettava.
Infektiot
Potilaita pitää tarkkailla vaikeiden infektioiden varalta, sepsis ja septinen sokki mukaan lukien.
Talidomidia saavien potilaiden keskuudessa on raportoitu viruksen reaktivaatiotapauksia, mukaan lukien vakavia vyöruusun tai B‑hepatiittiviruksen (HBV) reaktivaatiotapauksia.
Osasta vyöruusun reaktivaatiotapauksista seurasi laajalle levinnyt vyöruusu, joka edellytti talidomidihoidon väliaikaista keskeyttämistä ja riittävää antiviraalista hoitoa.
Osa HBV‑reaktivaatiotapauksista eteni maksan akuutiksi vajaatoiminnaksi ja johti talidomidihoidon lopettamiseen. B‑hepatiittivirustilanne on määritettävä ennen talidomidihoidon aloittamista. Positiivisen HBV‑infektiotestituloksen saavien potilaiden on suositeltavaa keskustella B‑hepatiitin hoitoon erikoistuneen lääkärin kanssa.
Potilaita joilla on aiemmin ollut infektio on seurattava tarkasti viruksen reaktivaation, mukaan lukien aktiivisen HBV‑infektion, merkkien ja oireiden varalta koko hoidon ajan.
Progressiivinen multifokaalinen leukoenkefalopatia (PML)
Talidomidin käytön yhteydessä on ilmoitettu progressiivisista multifokaalisista leukoenkefalopatiatapauksista (PML), mukaan lukien kuolemantapaukset. Progressiivisesta multifokaalisesta leukoenkefalopatista on saatu ilmoituksia useita kuukausia tai vuosia talidomidihoidon aloittamisen jälkeen. Tapauksia on yleensä saatu potilaista, jotka ovat käyttäneet samanaikaisesti deksametasonia tai jotka ovat saaneet aiemmin jotakin muuta immunosuppressiivista solunsalpaajahoitoa. Lääkäreiden on seurattava potilaita säännöllisesti ja otettava PML huomioon tehdessään erotusdiagnoosia potilaille, joilla on uusia tai pahenevia neurologisia oireita tai kognitiivisia tai käyttäytymiseen liittyviä merkkejä tai oireita. Lisäksi potilaita on neuvottava kertomaan hoidostaan kumppanilleen tai hoitajilleen, sillä he saattavat huomata oireita, joista potilas ei itse ole tietoinen.
Progressiivisen multifokaalisen leukoenkefalopatian selvittämisen tulee perustua neurologiseen tutkimukseen, aivojen magneettikuvaukseen sekä JC-viruksen DNA:n analyysiin aivo-selkäydinnesteestä polymeraasiketjureaktiomenetelmällä (PCR:llä) tai aivobiopsiaan JCV:n testaamiseksi. Negatiivinen tulos PCR-tutkimuksesta JC-viruksen osalta ei sulje PML:ää pois. Lisäseuranta ja -arviointi voivat olla tarpeen, jos vaihtoehtoista diagnoosia ei voida vahvistaa.
Jos progressiivista multifokaalista leukoenkefalopatiaa epäillään, hoito on keskeytettävä siihen saakka, kunnes PML on suljettu pois. Jos progressiivinen multifokaalinen leukoenkefalopatia diagnosoidaan, talidomidihoita on lopetettava pysyvästi.
Akuutti myelooinen leukemia (AML) ja myelodysplastiset oireyhtymät (MDS)
Akuutin myelooisen leukemian ja myelodysplastisen oireyhtymän tilastollisesti merkitsevää lisääntymistä havaittiin eräässä kliinisessä tutkimuksessa potilailla, joiden multippelia myeloomaa ei ole aikaisemmin hoidettu ja jotka saavat melfalaanin, prednisonin ja talidomidin (MPT) yhdistelmää. Riski lisääntyi ajan myötä ja oli kahden vuoden kuluttua noin 2 % ja kolmen vuoden kuluttua noin 4 %. Uusien primaarikasvainten lisääntymistä havaittiin potilailla, joilla oli äskettäin diagnosoitu multippeli myelooma ja jotka saivat lenalidomidia. Invasiivisten uusien primaarikasvainten joukossa havaittiin myelodysplastisia oireyhtymiä/akuuttia myelooista leukemiaa potilailla, jotka saivat lenalidomidia yhdistelmänä melfalaanin kanssa tai välittömästi suuren melfalaaniannoksen ja autologisen kantasolusiirron jälkeen.
Sekä talidomidihoidon hyödyt että akuutin myelooisen leukemian ja myelodysplastisen oireyhtymän riski on otettava huomioon ennen kuin talidomidin, prednisonin ja melfalaanin yhdistelmähoito aloitetaan. Lääkärien on arvioitava potilaat huolellisesti ennen hoitoa ja hoidon aikana käyttämällä tavanomaista syöpäseulontaa ja potilaille on aloitettava hoito, jos se todetaan aiheelliseksi.
Munuaisten tai maksan vajaatoimintaa sairastavat potilaat
Terveillä vapaaehtoisilla ja multippelia myeloomaa sairastavilla potilailla tehtyjen tutkimusten mukaan munuaisten tai maksan toiminnalla ei ole merkitsevää vaikutusta talidomidiin (ks. kohta Farmakokinetiikka). Tätä ei kuitenkaan ole muodollisesti tutkittu munuaisten tai maksan vajaatoimintaa sairastavilla potilailla, ja siksi vaikeaa munuaisten tai maksan vajaatoimintaa sairastavia potilaita pitää seurata tarkasti kaikkien mahdollisten haittatapahtumien varalta.
Yhteisvaikutukset
Talidomidi on heikko sytokromi P450‑isoentsyymien substraatti ja näin ollen kliinisesti merkittävät interaktiot sellaisten lääkevalmisteiden kanssa, jotka estävät ja/tai indusoivat tätä entsyymijärjestelmää, ovat epätodennäköisiä. Talidomidin ei-entsymaattisesta hydrolyysista, joka on sen ensisijainen puhdistumamekanismi, voidaan päätellä, että talidomidin ja muiden lääkkeiden välisten vaikutusten riski on vähäinen.
Muiden lääkeaineiden lisääntynyt sedatiivinen vaikutus
Talidomidilla on sedatiivinen vaikutus, mikä voi voimistaa anksiolyyttien, hypnoottien, antipsykoottien, H1-antihistamiinien, opiaattijohdannaisten, barbituraattien ja alkoholin aiheuttamaa sedatiivista vaikutusta. Varovaisuutta pitää noudattaa, kun talidomidia annetaan yhdessä uneliaisuutta aiheuttavien lääkevalmisteiden kanssa.
Bradykardiset vaikutukset
Koska talidomidi saattaa aiheuttaa bradykardiaa, varovaisuutta pitää noudattaa sellaisten lääkevalmisteiden kohdalla, joilla on sama farmakodynaaminen vaikutus, esimerkiksi lääkeaineet, joiden tiedetään aiheuttavan kääntyvien kärkien takykardiaa, beetasalpaajat tai antikoliiniesteraasit.
Lääkevalmisteet, joiden tiedetään aiheuttavan perifeeristä neuropatiaa
Lääkevalmisteita, joiden tiedetään liittyvän perifeeriseen neuropatiaan (esim. vinkristiini ja bortetsomibi), pitää käyttää varoen potilailla, jotka saavat talidomidia.
Hormonaaliset ehkäisyvalmisteet
Talidomidi ei vaikuta hormonaalisiin ehkäisyvalmisteisiin. Noretindronin ja etinyyliestradiolin farmakokineettiset profiilit 1,0 mg noretindronia sisältävän ja 0,75 mg etinyyliestradiolia sisältävän yhden annoksen antamisen jälkeen tutkittiin 10 terveen naisen kohdalla. Tulokset olivat samankaltaiset ilman talidomidia tai samanaikaisesti annetun 200 mg/vrk talidomidiannoksen kanssa kuin vakaan tilan tasossa. Hormonaalisten yhdistelmäehkäisytablettien käyttö ei kuitenkaan ole suositeltavaa lisääntyneen laskimoveritulpan vaaran vuoksi.
Varfariini
Kun talidomidia annettiin toistuvana annoksena 200 mg kerran vuorokaudessa 4 vuorokauden ajan, sillä ei ollut mitään vaikutusta INR (international normalized ratio) -arvoihin terveissä vapaaehtoisissa. Mutta, koska syöpäpotilailla laskimotukosriski on suurentunut ja koska varfariinin metaboloituminen kiihtyy kortikosteroidien kanssa, INR‑arvoja pitää seurata huolellisesti talidomidi-prednisoni -yhdistelmähoidon aikana sekä ensimmäisten viikkojen ajan näiden hoitojen päättymisen jälkeen.
Digoksiini
Talidomidilla ei ole yhteisvaikutusta digoksiinin kanssa. Talidomidin 200 mg:n toistuvilla annoksilla ei ollut mitään näkyvää vaikutusta digoksiinin kerta-annoksen farmakokinetiikkaan 18 terveen miespuolisen vapaaehtoisen kohdalla. Lisäksi yksittäisellä 0,5 mg digoksiiniannoksella ei ollut mitään näkyvää vaikutusta talidomidin farmakokinetiikkaan. Ei tiedetä, onko vaikutus erilainen multippelia myeloomaa sairastavilla potilailla.
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi / Ehkäisy miehille ja naisille
Naisten, jotka voivat tulla raskaaksi, täytyy käyttää yhtä tehokasta ehkäisymenetelmää vähintään 4 viikkoa ennen hoidon aloittamista, hoidon aikana mukaan lukien annoksen keskeytyksen aikana ja vähintään 4 viikkoa hoidon päättymisen jälkeen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Jos talidomidihoitoa saava nainen tulee raskaaksi, hoito täytyy lopettaa välittömästi, ja potilas pitää ohjata arviointia ja neuvoja varten lääkärin luokse, joka on erikoistunut teratologiaan tai jolla on kokemusta teratologiasta.
Koska talidomidia esiintyy spermassa, miespuolisten potilaiden on varotoimenpiteenä käytettävä kondomia hoidon aikana, annoksen keskeytyksen aikana ja vähintään 7 päivän ajan hoidon päättymisen jälkeen, jos hän on seksuaalisessa kanssakäymisessä raskaana olevan naisen kanssa tai naisen kanssa, joka voi tulla raskaaksi eikä käytä tehokasta ehkäisyä. Näin on tehtävä myös siinä tapauksessa, että miehelle on tehty vasektomia.
Jos mies raskauden alkaessa käyttää talidomidia, naispuolisen kumppanin pitää mennä arviointia ja neuvoja varten lääkäriin, joka on erikoistunut teratologiaan tai jolla on siitä kokemusta.
Raskaus
Talidomidi on vasta-aiheista raskauden aikana ja naisille, jotka voivat tulla raskaaksi, elleivät kaikki raskauden ehkäisyohjelman ehdot täyty (ks. kohta Vasta-aiheet).
Talidomidi on voimakas teratogeeni ihmisellä, ja se aiheuttaa usein (noin 30 %) vakavia ja hengenvaarallisia sikiövaurioita, kuten ylä- ja/tai alaraajojen epämuodostumaa (amelia, fokomelia, hemimelia), mikrotiaa sekä ulomman korvakäytävän poikkeavuutta (aukoton tai puuttuva), keski- ja sisäkorvan leesioita (harvinaisempia), okulaarisia leesioita (anoftalmia, mikroftalmia), synnynnäistä sydänsairautta sekä munuaisvaurioita. Myös muita harvoin esiintyviä poikkeavuuksia on esiintynyt.
Imetys
Ei tiedetä, erittyykö talidomidi ihmisen rintamaitoon. Eläinkokeissa on havaittu, että talidomidia erittyy rintamaitoon. Tästä syystä rintaruokinta on lopetettava talidomidihoidon ajaksi.
Hedelmällisyys
Kaniineilla tehty tutkimus ei osoittanut minkäänlaista vaikutusta hedelmällisyyslukuihin uroksissa tai naaraissa. Uroksissa havaittiin kuitenkin kivesten rappeutumista.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Thalidomide BMS ‑valmisteella on suositeltuina annoksina vähäinen tai kohtalainen vaikutus ajokykyyn ja koneiden käyttökykyyn.
Talidomidi saattaa aiheuttaa väsymystä (hyvin yleinen), huimausta (hyvin yleinen), uneliaisuutta (hyvin yleinen) ja näön hämärtymistä (yleinen) (ks. kohta Haittavaikutukset). Potilaita pitää kehottaa olemaan ajamatta autoa, käyttämättä koneita tai tekemättä vaarallisia tehtäviä talidomidihoidon aikana, jos heillä esiintyy väsymystä, huimausta, uneliaisuutta tai näön hämärtymistä.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Useimpien talidomidia käyttävien potilaiden voidaan olettaa kokevan haittavaikutuksia.
Talidomidin sekä melfalaanin ja prednisonin yhteiskäyttöön liittyviä yleisimmin esiintyviä haittavaikutuksia ovat: neutropenia, leukopenia, ummetus, uneliaisuus, parestesia, perifeerinen neuropatia, anemia, lymfopenia, trombosytopenia, huimaus, dysestesia, vapina ja perifeerinen edeema.
Edellä lueteltujen haittavaikutusten lisäksi talidomidin ja deksametasonin yhteiskäyttö muissa kliinisissä tutkimuksissa aiheutti hyvin yleisenä haittavaikutuksena väsymystä, yleisinä haittavaikutuksina ohimeneviä iskeemisiä tapahtumia, synkopeeta, kiertohuimausta (vertigo), hypotensiota, mielialan vaihtelua, ahdistusta, näön hämärtymistä, pahoinvointia ja dyspepsiaa sekä melko harvinaisina haittavaikutuksina aivohalvauksia, divertikkelin perforaatioita, peritoniittia, ortostaattista hypotensiota ja bronkiittia.
Talidomidin sekä melfalaanin ja prednisonin tai deksametasonin yhteiskäyttöön liittyviä kliinisesti merkittävimpiä haittavaikutuksia ovat mm: syvä laskimotukos ja keuhkoveritulppa, perifeerinen neuropatia, vaikeat ihoreaktiot, mukaan lukien Stevens-Johnsonin oireyhtymä ja toksinen epidermaalinen nekrolyysi, lääkkeeseen liittyvä yleisoireinen eosinofiilinen reaktio, synkopee, bradykardia ja huimaus (ks. kohdat Annostus ja antotapa, Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset).
Haittavaikutustaulukko
Taulukossa 3 on lueteltu vain ne keskeisessä tutkimuksessa havaitut ja markkinoille tulon jälkeisiin kokemuksiin perustuvat haittavaikutukset, joiden syy-yhteys lääkevalmisteeseen voidaan kohtuullisesti osoittaa. Ilmoitetut esiintymistiheydet perustuvat havaintoihin keskeisestä komparatiivisesta kliinisestä tutkimuksesta, jossa tutkittiin talidomidin vaikutusta yhdessä melfalaanin ja prednisonin kanssa potilaisiin, joiden multippelia myeloomaa ei aikaisemmin ollut hoidettu.
Esiintymistiheydet on määritelty seuraavasti: hyvin yleinen (≥1/10), yleinen (≥1/100, <1/10), melko harvinainen (≥1/1 000, <1/100), harvinainen (≥1/10 000, <1/1 000), hyvin harvinainen (<1/10 000) ja tuntematon (koska saatavissa oleva tieto ei riitä arviointiin). Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Taulukko 3: Haittavaikutukset, joista raportoitiin markkinoille tulon jälkeisessä käytössä sekä keskeisessä kliinisessä tutkimuksessa, jossa talidomidia käytettiin yhdessä melfalaanin ja prednisonin kanssa
Elinjärjestelmä | Yleisyys | Haittavaikutus |
Infektiot | Yleinen | Keuhkokuume |
Tuntematon | Vaikeat infektiot (esim. kuolemaan johtava sepsis, mukaan lukien septinen sokki)†, Virusinfektiot, mukaan lukien vyöruusu ja B-hepatiittiviruksen reaktivaatio† | |
Hyvän- ja pahanlaatuiset kasvaimet (mukaan lukien kystat ja polyypit) | Yleinen | Akuutti myelooinen leukemia*^ |
Melko harvinainen | Myelodysplastinen oireyhtymä*^ | |
Tuntematon | Tuumorilyysioireyhtymä† | |
Veri ja imukudos | Hyvin yleinen | Neutropenia, leukopenia, anemia, lymfopenia, trombosytopenia |
Yleinen | Kuumeinen neutropenia†, pansytopenia† | |
Immuunijärjestelmä | Tuntematon | Allergiset reaktiot (yliherkkyys, angioedeema, anafylaktinen reaktio, urtikaria)† |
Umpieritys | Tuntematon | Hypotyreoosi† |
Psyykkiset häiriöt | Yleinen | Sekavuus, masennus |
Hermosto | Hyvin yleinen | Perifeerinen neuropatia*, vapina, huimaus, parestesiat, dysestesia, uneliaisuus |
Yleinen | Kouristukset†, epänormaali koordinaatio | |
Tuntematon | Posteriorinen reversiibeli enkefalopatiaoireyhtymä (PRES)*†, Parkinsonin taudin oireiden paheneminen† | |
Kuulo ja tasapainoelin | Yleinen | Kuulon heikkeneminen tai kuurous† |
Sydän | Yleinen | Sydämen vajaatoiminta, bradykardia |
Melko harvinainen | Sydäninfarkti†, eteisvärinä†, eteis-kammiokatkos† | |
Verisuonisto | Yleinen | Syvä laskimotukos* |
Hengityselimet, rintakehä ja välikarsina | Yleinen | Keuhkoveritulppa*, interstitiaalinen keuhkosairaus, bronkopneumopatia, dyspnea |
Tuntematon | Keuhkoverenpainetauti† | |
Ruoansulatuselimistö | Hyvin yleinen | Ummetus |
Yleinen | Oksentelu, suun kuivuminen | |
Melko harvinainen | Suolitukos† | |
Tuntematon | Maha-suolikanavan perforaatio†, pankreatiitti†, ruoansulatuselimistön verenvuoto† | |
Maksa ja sappi | Tuntematon | Maksasairaudet† |
Iho ja ihonalainen kudos | Yleinen | Toksisten iho-oireiden puhkeaminen, ihottuma, kuiva iho |
Tuntematon | Stevens-Johnsonin oireyhtymä*,†, toksinen epidermaalinen nekrolyysi*,†, lääkkeeseen liittyvä yleisoireinen eosinofiilinen reaktio*,†, leukosytoklastinen vaskuliitti† | |
Munuaiset ja virtsatiet | Yleinen | Munuaisten vajaatoiminta† |
Sukupuolielimet ja rinnat | Tuntematon | Seksuaalinen toimintahäiriö†, kuukautishäiriöt, mukaan lukien amenorrea† |
Yleisoireet ja antopaikassa todettavat haitat | Hyvin yleinen | Perifeerinen edeema |
Yleinen | Kuume, voimattomuus, huonovointisuus |
* Ks. kohta Haittavaikutukset Valikoitujen haittavaikutusten kuvaukset.
† Tunnistettu markkinoille tulon jälkeisistä tiedoista.
^ Akuuttia myelooista leukemiaa ja myelodysplastista oireyhtymää raportoitiin esiintyneen yhdessä kliinisessä tutkimuksessa potilailla, joiden multippelia myeloomaa ei ollut aikaisemmin hoidettu ja jotka saivat melfalaanin, prednisonin ja talidomidin yhdistelmää (MPT).
Valikoitujen haittavaikutusten kuvaukset
Veri ja imukudos
Hematologisten häiriöiden haittavaikutukset ilmoitetaan vertailuryhmään verrattuna, sillä vertaimella on merkittävä vaikutus näihin haittavaikutuksiin (taulukko 4).
Taulukko 4: Melfalaanin, prednisonin (MP) sekä melfalaanin, prednisonin ja talidomidin (MPT) yhdistelmien hematologisten haittavaikutusten vertailu tutkimuksessa IFM 99‑06 (ks. kohta Farmakodynamiikka)
n (% potilaista) | ||
MP (n = 193) | MPT (n = 124) | |
Asteet 3 ja 4* | ||
Neutropenia | 57 (29,5) | 53 (42,7) |
Leukopenia | 32 (16,6) | 32 (25,8) |
Anemia | 28 (14,5) | 17 (13,7) |
Lymfopenia | 14 (7,3) | 15 (12,1) |
Trombosytopenia | 19 (9,8) | 14 (11,3) |
* WHO:n kriteeri
Kuumeinen neutropenia ja pansytopenia ovat talidomidin markkinoille tulon jälkeisiin kokemuksiin liittyviä haittavaikutuksia, joita ei esiintynyt keskeisessä tutkimuksessa.
Teratogeenisyys
Kohdunsisäisen kuoleman ja vaikeiden synnynnäisten vaurioiden, etenkin fokomelian, riski on erittäin suuri. Talidomidia ei saa käyttää missään vaiheessa raskauden aikana (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Raskaus ja imetys).
Laskimon ja valtimon tromboemboliset tapahtumat
Laskimotromboembolian (kuten syvän laskimotromboosin ja keuhkoembolian) ja valtimotromboembolian (esim. sydäninfarkti ja aivoverisuonitapahtuma) suurentunutta riskiä on raportoitu talidomidihoitoa saavilla potilailla (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Perifeerinen neuropatia
Perifeerinen neuropatia on hyvin yleinen, mahdollisesti vakava talidomidihoidon haittavaikutus, joka voi johtaa pysyviin vaurioihin (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Perifeeristä neuropatiaa esiintyy yleensä pitkäaikaisen, kuukausia kestäneen käytön jälkeen. Sitä on kuitenkin esiintynyt myös suhteellisen lyhytaikaisenkin käytön jälkeen. Hoidon lopettamiseen, keskeyttämiseen tai annoksen pienentämiseen johtavien neuropatiatapausten esiintyminen lisääntyy kumulatiivisen annoksen ja hoidon keston myötä. Oireet saattavat puhjeta vasta jonkin ajan kuluttua talidomidihoidon päättymisen jälkeen, ja ne saattavat hävitä hitaasti tai ei ollenkaan.
Posteriorinen reversiibeli enkefalopatiaoireyhtymä (PRES)/reversiibeli posteriorinen leukoenkefalopatiaoireyhtymä (RPLS)
PRES-/RPLS-tapauksia on raportoitu. Oireita ja löydöksiä olivat näköhäiriöt, päänsärky, kouristukset ja psyykkisen tilan muutokset, joihin saattoi liittyä hypertensiota. PRES:n/RPLS:n diagnoosi on varmistettava aivokuvauksella. Suurimpaan osaan raportoiduista tapauksista liittyi tunnettuja PRES:n/RPLS:n riskitekijöitä, mukaan lukien hypertensio, munuaisten vajaatoiminta ja samanaikainen suuriannoksinen kortikosteroidihoito ja/tai solunsalpaajahoito.
Akuutti myelooinen leukemia (AML) ja myelodysplastiset oireyhtymät (MDS)
Akuuttia myelooista leukemiaa ja myelodysplastista oireyhtymää raportoitiin yhdessä kliinisessä tutkimuksessa potilailla, joiden multippelia myeloomaa ei ollut aikaisemmin hoidettu ja jotka saivat melfalaanin, prednisonin ja talidomidin yhdistelmää (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Allergiset reaktiot ja vaikeat iho-oireet
Talidomidin käytön yhteydessä on raportoitu allergisten reaktioiden tapauksia mukaan lukien angioedeema, anafylaktinen reaktio ja vaikeat ihoreaktiot, kuten Stevens-Johnsonin oireyhtymä (SJS), toksinen epidermaalinen nekrolyysi (TEN) ja lääkkeeseen liittyvä yleisoireinen eosinofiilinen reaktio (DRESS). Angioedeemaa, anafylaktista reaktiota, SJS:ää, TEN:iä tai DRESS:iä epäiltäessä talidomidin käyttöä ei saa aloittaa uudestaan (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Iäkkäät potilaat
Talidomidia 100 mg kerran vuorokaudessa saaneiden > 75‑vuotiaiden potilaiden haittavaikutusprofiili oli ilmoitusten mukaan samankaltainen kuin talidomidia 200 mg kerran vuorokaudessa saaneiden ≤ 75‑vuotiaiden potilaiden haittavaikutusprofiili (ks. taulukko 3). Yli 75‑vuotiailla potilailla vakavien haittavaikutusten riski saattaa kuitenkin olla yleisempi.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen
hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Julkaisuissa on raportoitu 18:sta yliannostustapauksesta, joissa annokset ovat olleet jopa 14,4 grammaa. Kolmessatoista tapauksessa potilaat olivat ottaneet pelkkää talidomidia 350–4 000 mg:n suuruisina annoksina. Näillä potilailla ei joko esiintynyt lainkaan oireita tai heidän oireensa olivat uneliaisuuden, ärtyneisyyden, huonovointisuuden ja/tai päänsäryn kaltaisia. Yhdellä 2-vuotiaalla lapsella, joka otti 700 mg lääkettä, todettiin uneliaisuuden ja ärtyneisyyden lisäksi epänormaali jalkapohjaheijaste. Kuolemantapauksista ei ole tullut ilmoituksia ja kaikki yliannostuksen saaneet potilaat selvisivät ilman jälkiseurauksia. Talidomidin yliannostukseen ei ole erityistä vastalääkettä. Yliannostustapauksessa potilaan vitaalitoimintoja pitää seurata ja verenpaine ja hengitystoiminta pitää ylläpitää sopivalla oireenmukaisella hoidolla.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: immunosuppressantit, muut immunosuppressantit, ATC‑koodi: L04AX02.
Talidomidi sisältää kiraalisen keskuksen ja sitä käytetään kliinisesti (+)‑(R)‑ ja (‑)‑(S)‑talidomidin raseemisena seoksena. Talidomidin vaikutuskirjoa ei ole täysin määritelty.
Vaikutusmekanismi
Talidomidilla on immunomodulatorista, anti-inflammatorista ja mahdollista antineoplastista vaikutusta. Tiedot in vitro- ja kliinisistä tutkimuksista viittaavat siihen, että talidomidin immunomodulatorinen, anti-inflammatorinen ja antineoplastinen vaikutus saattaa liittyä tuumorinekroositekijä-alfan (TNF‑α) liialliseen tuotannon voimakkaaseen estoon sekä leukosyyttien migraatioon ja antiangiogeeniseen vaikutukseen liittyvien tiettyjen solupinnan adheesiomolekyylien säätelyyn sekä antiangiogeeniseen vaikutukseen. Talidomidi on myös sentraalisesti vaikuttava hypnoottinen sedatiivi (ei-barbituraatti). Sillä ei ole minkäänlaista antibakteerista vaikutusta.
Kliininen teho ja turvallisuus
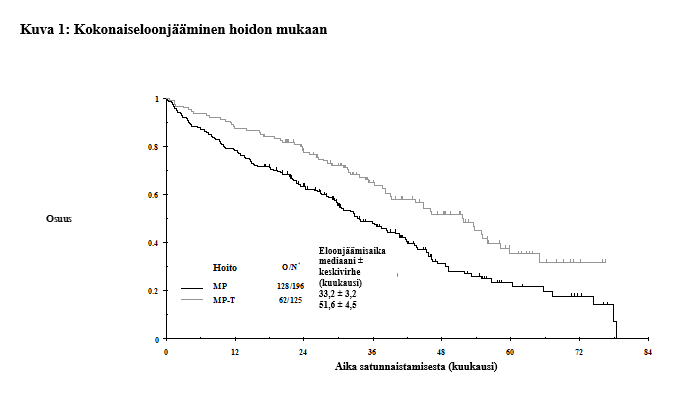
Tulokset vaiheen 3 satunnaistetusta, avoimesta, rinnakkaisryhmillä tehdystä monikeskustutkimuksesta IFM 99‑06 ovat osoittaneet eloonjäämisetua, kun talidomidia käytetään yhdessä melfalaanin ja prednisonin kanssa 12 kuuden viikon sykliä vastadiagnosoidun multippelin myelooman hoidossa. Tässä tutkimuksessa potilaiden ikä oli 65‑75 vuotta, joista 41 % (183/447) oli 70‑vuotiaita tai vanhempia. Talidomidin annoksen mediaani oli 217 mg ja > 40 % potilaista sai 9 sykliä. Melfalaanin annos oli 0,25 mg/kg/vrk ja prednisonin 2 mg/kg/vrk päivinä 1‑4 jokaisessa 6 viikon syklissä.
Protokollan mukaisen analyysin lisäksi tehtiin myös päivitys IFM 99‑06 -tutkimusta varten, mistä saatiin ylimääräisen 15 kuukauden seurantatiedot. Kokonaiseloonjäämisen (OS) mediaani oli MPT‑ryhmissä 51,6 ± 4,5 ja MP-ryhmissä 33,2 ± 3,2 kuukautta (97,5 % CI 0,42‑0,84). Tämä 18 kuukauden ero oli tilastollisesti merkittävä. Kuolemanriskin pienenemisen riskisuhde MPT-haarassa on 0,59, 97,5 % luottamusvälillä 0,42‑0,84 ja p-arvo < 0,001 (ks. kuva 1).
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset talidomidin käytöstä kaikkien pediatristen potilasryhmien hoidossa multippelissa myeloomassa (ks. kohta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Imeytyminen
Talidomidi absorboituu hitaasti oraalisen annon jälkeen. Huippupitoisuus plasmassa saavutetaan 1‑5 tunnin kuluttua annosta.Samanaikainen ruokailu hidasti imeytymistä, mutta ei muuttanut sen kokonaismäärää.
Jakautuminen
Plasmassa (+)‑(R)‑ ja (‑)‑(S)‑enantiomeerit olivat 55 %:sti ja 65 %:sti proteiineihin sitoutuneena. Talidomidia esiintyy miespuolisten potilaiden spermassa samantasoisessa pitoisuudessa kuin plasmassa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Ikä, sukupuoli, munuaisten toiminta ja veren kemialliset muuttujat eivät vaikuta merkitsevästi talidomidin jakaantumiseen.
Biotransformaatio
Talidomidi metaboloituu lähes yksinomaan ei-entsymaattisen hydrolyysin kautta. 80 % verenkiertoon päätyneestä talidomidista on plasmassa muuttumattomana. Virtsaan muuttumatonta talidomidia erittyy vain vähän (< 3 % annoksesta). Plasmassa ja erityisesti virtsassa on talidomidin lisäksi siitä ei-entsymaattisten, hydrolyyttisten prosessien tuloksena syntyneitä N‑(o‑karboksibentsoyyli)glutarimidia ja ftalyyli-isoglutamiinia. Oksidatiivinen metabolia ei vaikuta merkitsevästi talidomidin kokonaismetaboliaan. Talidomidi metaboloituu sytokromi P450:n katalysoimana hyvin vähäisessä määrin maksassa. In vitro -tiedot osoittavat, että prednisoni saattaa aiheuttaa entsyymi-induktiota, mikä voisi alentaa muiden lääketuotteiden samanaikaisen käytön aiheuttamaa systeemistä altistumista. Näiden tutkimustulosten merkitystä in vivo ei tunneta.
Eliminaatio
Talidomidin keskimääräinen puoliintumisaika plasmassa oraalisen 50‑400 mg kerta-annoksen jälkeen oli 5,5‑7,3 tuntia. Suun kautta annettavan, radioaktiivisesti merkityn talidomidin 400 mg:n kerta-annoksen keskimääräinen kokonaistalteenotto oli 93,6 % annetusta annoksesta päivään 8 mennessä. Suurin osa radioaktiivisesti merkitystä annoksesta erittyi 48 tunnin kuluessa annostelusta. Tärkein eritysreitti oli virtsa (> 90 %), kun taas erittyminen ulosteen kautta oli vähäistä.
Kehon painon ja talidomidin arvioidun puhdistuman välinen suhde on lineaarinen. Multippelia myeloomaa sairastavilla potilailla, joiden paino oli 47‑133 kg, talidomidin puhdistuma vaihteli välillä noin 6‑12 l/h, joka osoitti talidomidin lisääntynyttä puhdistumaa 0,0621 l/h kehon painon 10 kg:n nousua kohden.
Lineaarisuus/ei-lineaarisuus
Systeeminen kokonaisaltistus (AUC) on verrannollinen annokseen kerta-annoksilla. Farmakokinetiikan aikariippuvuudesta ei ole havaintoja.
Maksan ja munuaisten vajaatoiminta
Talidomidin metabolia maksan sytokromi P450 -järjestelmän kautta on vähäistä eikä muuttumatonta talidomidia erity munuaisten kautta. Munuaisten (CrCl) ja maksan toiminnan (veren kemia) mittaukset osoittavat munuaisten ja maksan toiminnan vaikuttavan vain vähäisesti talidomidin farmakokinetiikkaan. Näin ollen maksan tai munuaisten vajaatoiminnan ei odoteta vaikuttavan talidomidin metaboliaan. Tiedot potilaista, joilla on loppuvaiheen munuaissairaus, eivät osoita mitään munuaisten vaikutusta talidomidin farmakokinetiikkaan.
Prekliiniset tiedot turvallisuudesta
Uroskoiralla havaittiin yhden vuoden lääkityksen jälkeen korjautuvia sappitukoksia tiehyissä altistuksen ollessa yli 1,9 kertaa ihmisen altistus.
Hiiri- ja rottatutkimuksissa havaittiin pienentynyt trombosyyttimäärä. Rottatutkimus näyttää liittyvän talidomidiin ja tutkimuksessa altistus oli yli 2,4 kertaa ihmisen altistus. Tämä trombosyyttimäärän pieneneminen ei aiheuttanut kliinisiä oireita.
Vuoden kestäneessä koiratutkimuksessa naaraskoirilla havaittiin laajentuneet ja/tai siniseksi värjäytyneet maitorauhaset ja pidentynyt kiima altistuksen ollessa vastaavasti 1,8‑kertainen ja yli 3,6‑kertainen ihmisen altistukseen verrattuna. Tutkimustulosten merkitystä ihmisten suhteen ei tunneta.
Talidomidin vaikutusta kilpirauhasen toimintaan arvioitiin sekä rotilla että koirilla. Koirissa ei havaittu mitään vaikutusta, mutta rotilla oli näkyvää annosriippuvaista laskua kokonais- ja vapaassa T4:ssä, mikä oli yhdenmukaisempaa naaraspuolisilla rotilla.
Mutageenisia tai geenitoksisia vaikutuksia ei ole ilmennyt, kun talidomidia on analysoitu tavanomaisessa geenitoksisuustestisarjassa. Karsinogeenisuudesta ei havaittu viitteitä, kun altistus oli noin 15‑kertainen (hiirillä), 13‑kertainen (urosrotilla) ja 39‑kertainen (naarasrotilla) suositellun aloitusannoksen arvioituun kliiniseen AUC‑arvoon nähden.
Eläinkokeet ovat osoittaneet lajien välisiä eroavaisuuksia alttiudessa talidomidin teratogeenisille vaikutuksille. Ihmisillä talidomidi on todistetusti teratogeeninen.
Kaniineilla tehty tutkimus ei osoittanut minkäänlaista vaikutusta hedelmällisyyslukuihin uroksissa tai naaraissa. Uroksissa havaittiin kuitenkin kivesten rappeutumista.
Kaniineilla tehty peri- ja postnataalinen tutkimus, jossa talidomidia annettiin enintään 500 mg/kg/päivä, aiheutti keskenmenoja, lisäsi kuolleena syntyneiden poikasten määrää ja laski poikasten elinkykyisyyttä imetysaikana. Poikasilla, joiden emoja oli hoidettu talidomidilla, oli enemmän keskenmenoja, vähäisempi painonnousu, muutoksia oppimiskyvyssä ja muistissa, vähentynyt hedelmällisyys ja pienentynyt raskausindeksi.
Farmaseuttiset tiedot
Apuaineet
Kapselin sisältö
Tärkkelys, esigelatinoitu
magnesiumstearaatti
Kapselin kuori
gelatiini
titaanidioksidi (E171)
Painomuste
sellakka
musta rautaoksidi (E172)
propyleeniglykoli
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
5 vuotta
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
THALIDOMIDE BMS kapseli, kova
50 mg (L:ei) 28 fol (442,48 €)
PF-selosteen tieto
PVC/PCTFE/alumiininen läpipainopakkaus, jossa on 14 kapselia.
Pakkauskoot: 28 kapselia (kahdessa läpipainopakkauksessa) taitettavassa levyssä.
Valmisteen kuvaus:
Valkoinen himmeä kapseli, jossa merkintä ”Thalidomide BMS 50 mg”.
Käyttö- ja käsittelyohjeet
Kapseleita ei saa avata eikä murskata. Jos talidomidi jauhetta joutuu iholle, iho on pestävä välittömästi ja huolellisesti saippualla ja vedellä. Jos talidomidia joutuu limakalvoille, altistunut alue on huuhdeltava huolellisesti vedellä.
Terveydenhuollon ammattilaisten ja huoltajien on läpipainolevyjä tai kapseleita käsitellessään käytettävä kertakäyttöisiä käsineitä. Käsineet on tämän jälkeen riisuttava varovasti ihon altistumisen välttämiseksi ja laitettava suljettavaan polyeteenimuovipussiin, joka hävitetään paikallisten vaatimusten mukaisesti. Kädet on tämän jälkeen pestävä huolellisesti saippualla ja vedellä. Naisten, jotka ovat raskaana tai epäilevät olevansa raskaana, ei pidä käsitellä läpipainolevyjä tai kapseleita (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Kaikki käyttämättömät kapselit on palautettava hoidon päätyttyä apteekkiin.
Korvattavuus
THALIDOMIDE BMS kapseli, kova
50 mg 28 fol
- Ei korvausta.
ATC-koodi
L04AX02
Valmisteyhteenvedon muuttamispäivämäärä
21.01.2025
Yhteystiedot
09 2512 1244
www.bms.com/fi
medinfo.finland@bms.com
