ORGOVYX tabletti, kalvopäällysteinen 120 mg
Huomioitavaa

Tähän lääkevalmisteeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti turvallisuutta koskevaa uutta tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä lääkkeen haittavaikutuksista. Ks. kohdasta Haittavaikutukset, miten haittavaikutuksista ilmoitetaan.
Vaikuttavat aineet ja niiden määrät
Yksi kalvopäällysteinen tabletti sisältää 120 mg relugoliksia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Kalvopäällysteinen tabletti.
Kliiniset tiedot
Käyttöaiheet
Orgovyx on tarkoitettu aikuispotilaille edenneen hormoniherkän eturauhassyövän hoitoon.
Ehto
Hoito on aloitettava ja toteutettava eturauhassyövän lääkehoitoon perehtyneen erikoislääkärin valvonnassa.
Annostus ja antotapa
Orgovyx-hoidon aloittaa ja sitä valvoo erikoislääkäri, jolla on kokemusta eturauhassyövän lääkehoidosta.
Annostus
Orgovyx-hoito aloitetaan 360 mg:n latausannoksella (kolme tablettia) ensimmäisenä päivänä, jonka jälkeen otetaan 120 mg:n annos (yksi tabletti) kerran päivässä suunnilleen samaan kellonaikaan.
Koska relugoliksi ei aiheuta testosteronipitoisuuksien suurenemista, hoidon alussa ei tarvita antiandrogeenilisää suojaamaan suurilta testosteronipitoisuuksilta.
Annosmuutokset P‑gp:n estäjien käytön yhteydessä
Orgovyx-valmisteen samanaikainen anto suun kautta otettavien P‑glykoproteiinin (P‑gp) estäjien kanssa ei ole suositeltavaa. Jos samanaikainen anto on välttämätöntä, Orgovyx otetaan ensin, ja annosten välissä on pidettävä vähintään 6 tunnin tauko (ks. kohta Yhteisvaikutukset). Orgovyx-hoito voidaan keskeyttää enintään 2 viikoksi, jos tarvitaan lyhyt hoitokuuri P‑gp:n estäjillä.
Annosmuutokset P‑gp:n ja voimakkaan CYP3A:n indusoijan käytön yhteydessä
Orgovyx-valmisteen samanaikainen anto P‑gp:n ja voimakkaan sytokromi P450 (CYP) 3A:n indusoijan kanssa ei ole suositeltavaa. Jos samanaikainen anto on välttämätöntä, Orgovyx-annos on suurennettava 240 mg:aan kerran päivässä. P‑gp:n ja voimakkaan CYP3A:n indusoijan käytön lopettamisen jälkeen palataan suositeltuun Orgovyx-annokseen 120 mg kerran päivässä (ks. kohta Yhteisvaikutukset).
Annosten jääminen väliin
Jos Orgovyx-annos unohtuu, se on otettava heti, kun potilas muistaa asian. Jos annos jää väliin yli 12 tunniksi, väliin jäänyttä annosta ei saa ottaa, vaan tavanomaista annosaikataulua jatketaan seuraavana päivänä.
Jos Orgovyx-hoito keskeytetään yli 7 päiväksi, Orgovyx-valmisteen ottaminen on aloitettava uudelleen 360 mg:n latausannoksella ensimmäisenä päivänä ja sen jälkeen 120 mg:n annoksella kerran päivässä.
Erityisryhmät
Iäkkäät
Annosta ei tarvitse muuttaa iäkkäille potilaille (ks. kohta Farmakokinetiikka).
Munuaisten vajaatoiminta
Annosta ei tarvitse muuttaa potilaille, joilla on lievä tai keskivaikea munuaisten vajaatoiminta. Varovaisuus on tarpeen vaikeaa munuaisten vajaatoimintaa sairastavien potilaiden hoidossa (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Maksan vajaatoiminta
Annosta ei tarvitse muuttaa potilaille, joilla on lievä tai keskivaikea maksan vajaatoiminta (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Pediatriset potilaat
Ei ole asianmukaista käyttää Orgovyx-valmistetta alle 18 vuoden ikäisille lapsille ja nuorille käyttöaiheeseen, joka on edenneen hormoniherkän eturauhassyövän hoito.
Antotapa
Suun kautta.
Orgovyx voidaan ottaa ruuan kanssa tai ilman ruokaa (ks. kohta Farmakokinetiikka). Tabletit otetaan tarvittaessa jonkin nesteen kera ja niellään kokonaisina.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Vaikutus QT/QTc-ajan pidentymiseen
Androgeenideprivaatiohoito saattaa pidentää QT‑aikaa.
Jos potilaalla on aiemmin esiintynyt QT‑ajan pidentymistä tai hänellä on tälle altistavia riskitekijöitä, tai jos potilas saa samanaikaisesti lääkevalmisteita, jotka saattavat pidentää QT‑aikaa (ks. kohta Yhteisvaikutukset), lääkärin on arvioitava hyöty-riskisuhde, mukaan lukien kääntyvien kärkien takykardian mahdollisuus, ennen Orgovyx-hoidon aloittamista.
Perusteellinen QT/QTc-tutkimus osoitti, ettei relugoliksilla ollut luontaista vaikutusta QT‑ajan pidentymiseen (ks. kohta Haittavaikutukset).
Sydän- ja verisuonisairaudet
Sydän- ja verisuonisairauksia, kuten sydäninfarkteja ja aivohalvauksia, on raportoitu lääketieteellisessä kirjallisuudessa androgeenideprivaatiohoitoa saaneilla potilailla. Siksi kaikki kardiovaskulaariset riskitekijät on otettava huomioon.
Luuntiheyden muutokset
Testosteronituotannon pitkäkestoiseen estoon on liittynyt luuntiheyden pienenemistä miehillä, joille on tehty kivesten poisto tai jotka ovat saaneet GnRH-agonisti- tai GnRH-antagonistihoitoa. Luuntiheyden pieneneminen saattaa johtaa osteoporoosiin tai luunmurtumariskin suurenemiseen potilailla, joilla on muita riskitekijöitä.
Maksan vajaatoiminta
Relugoliksilla tehtyihin pitkäkestoisiin kliinisiin tutkimuksiin ei ole otettu mukaan potilaita, joilla tiedetään tai epäillään olevan maksasairaus. Lievää, ohimenevää alaniiniaminotransferaasi- ja aspartaattiaminotransferaasipitoisuuksien (ALAT ja ASAT) suurenemista on havaittu, mutta tähän ei liittynyt bilirubiinipitoisuuden suurenemista eikä kliinisiä oireita (ks. kohta Haittavaikutukset). Maksan toiminnan seurantaa hoidon aikana suositellaan potilaille, joilla tiedetään tai epäillään olevan maksasairaus. Relugoliksin farmakokinetiikkaa ei ole arvioitu potilailla, joilla on vaikea maksan vajaatoiminta (ks. kohta Farmakokinetiikka).
Vaikea munuaisten vajaatoiminta
Relugoliksialtistus saattaa suureta jopa 2-kertaiseksi potilailla, joilla on vaikea munuaisten vajaatoiminta (ks. kohta Farmakokinetiikka). Koska pienempää relugoliksiannosta ei ole saatavilla, varovaisuus on aiheellista annettaessa vaikeaa munuaisten vajaatoimintaa sairastaville potilaille 120 mg:n relugoliksiannos kerran päivässä. Ei tiedetä, missä määrin relugoliksi poistuu hemodialyysillä.
Prostataspesifisen antigeenin (PSA) seuranta
Orgovyx-valmisteen tehoa on seurattava kliinisin parametrein ja seerumin prostataspesifisen antigeenin (PSA) pitoisuuden avulla.
Natrium
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per kalvopäällysteinen tabletti eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Muiden lääkevalmisteiden mahdollinen vaikutus relugoliksialtistukseen
Kliiniset tutkimukset P-gb:n estäjien (erytromysiini ja atsitromysiini) sekä P-gb:n ja voimakkaiden CYP3A:n indusoijien (rifampisiini) samanaikaisen annon yhteisvaikutuksista ovat osoittaneet vaikuttavan relugoliksialtistukseen kliinisesti merkitsevästi. Taulukossa 1 on yhteenveto samanaikaisesti annettujen lääkevalmisteiden vaikutuksesta relugoliksialtistukseen ja sen mukaiset annostussuositukset. Luettelo sisältää myös odotetun vaikutuksen sekä muita sellaisia lääkevalmisteita, joilla on mahdollisesti yhteisvaikutuksia, koskevat suositukset.
P‑gp:n estäjät
Orgovyx-valmisteen ja suun kautta otettavien P‑gp:n estäjien samanaikainen käyttö ei ole suositeltavaa. Relugoliksi on P‑gp:n substraatti (ks. kohta Farmakokinetiikka).
Jos kerran tai kahdesti päivässä suun kautta otettavien P‑gp:n estäjien samanaikainen anto on välttämätöntä, Orgovyx on otettava ensin ja suun kautta otettava P‑gp:n estäjä sitten 6 tunnin jälkeen. Potilasta on seurattava tiheämmin haittavaikutusten varalta. Vaihtoehtoisesti Orgovyx-hoito voidaan keskeyttää enintään 2 viikoksi lyhyen P‑gp:n estäjäkuurin (esim. tiettyjen makrolidiantibioottien) ajaksi. Jos Orgovyx-hoito keskeytetään yli 7 päiväksi, Orgovyx-valmisteen ottaminen on aloitettava uudelleen 360 mg:n latausannoksella ensimmäisenä päivänä ja sen jälkeen 120 mg:n annoksella kerran päivässä (ks. kohta Annostus ja antotapa).
Lääkeaineet, jotka ovat sekä P‑gp:n indusoijia että voimakkaita CYP3A:n indusoijia
Orgovyx-valmisteen samanaikainen anto sekä P‑gp:tä että voimakkaasti CYP3A:ta indusoivien aineiden kanssa ei ole suositeltavaa
Jos samanaikainen anto on välttämätöntä, Orgovyx-annosta on suurennettava (ks. kohta Annostus ja antotapa). Sekä P‑gp:tä että voimakkaasti CYP3A:ta indusoivien aineiden käytön lopettamisen jälkeen on palattava suositeltuun Orgovyx-annokseen kerran päivässä.
Muut lääkevalmisteet
Relugoliksin farmakokinetiikassa ei havaittu kliinisesti merkitseviä eroja, kun relugoliksia annettiin samanaikaisesti vatsahappojen vähentämiseksi käytettävien lääkkeiden kanssa.
Koska androgeenideprivaatiohoito saattaa pidentää QT‑aikaa, Orgovyx-valmisteen samanaikainen käyttö sellaisten lääkevalmisteiden kanssa, joiden tiedetään pidentävän QT‑aikaa, tai sellaisten lääkevalmisteiden kanssa, jotka voivat aiheuttaa kääntyvien kärkien takykardiaa, kuten luokan IA (esim. kinidiini, disopyramidi) tai luokan III (esim. amiodaroni, sotaloli, dofetilidi, ibutilidi) rytmihäiriölääkkeet, metadoni, moksifloksasiini ja psykoosilääkkeet, on arvioitava huolellisesti (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Taulukko 1. Samanaikaisesti annettujen lääkevalmisteiden vaikutus relugoliksialtistukseen (Cmax, AUC0-inf) ja suositukset
| Yhteisvaikutuksia aiheuttavan lääkkeen annosohjelma | Relugoliksin annosohjelma | Muutos relugoliksin AUC0-inf-arvossa | Muutos relugoliksin Cmax-arvossa | Suositus |
| Lääkevalmisteet, jotka ovat suun kautta otettavan P-gp:n estäjiä | ||||
erytromysiini 500 mg neljä kertaa vuorokaudessa, monta annosta (P-gp:n estäjä ja kohtalainen CYP3A4:n estäjä) | 120 mg:n kerta-annos | 3,5-kertainen ↑ | 2,9-kertainen ↑ | Orgovyx-valmisteen samanaikaista käyttöä erytromysiinin, atsitromysiini ja muiden suun kautta otettavien P-gp:n estäjien kanssa ei suositella. Jos samanaikainen käyttö kerran tai kahdesti päivässä otettavien P-gp:n estäjien kanssa on välttämätöntä (esim. atsitromysiini), Orgovyx otetaan ensin ja P-gp:n estäjä erikseen vähintään 6 tunnin kuluttua. Potilaita seurataan tiheämmin haittavaikutusten varalta. |
atsitromysiini 500 mg:n kerta-annos (P-gp:n estäjä) | 120 mg:n kerta-annos | *1,5-kertainen ↑ | *1,6-kertainen ↑ | |
atsitromysiini 500 mg kerta-annos 6 tunnin kuluttua relugoliksin annosta (P-gp:n estäjä) | 1,4-kertainen ↑ | 1,3-kertainen ↑ | ||
Muut lääkevalmisteet, jotka ovat P-gp:n estäjiä (näihin kuitenkaan rajoittumatta): Infektiolääkkeet atsitromysiini erytromysiini klaritromysiini gentamysiini tetrasykliini Sieni-infektiolääkkeet ketokonatsoli, itrakonatsoli Verenpainelääkkeet karvediloli verapamiili Rytmihäiriölääkkeet amiodaroni dronedaroni propafenoni kinidiini Rasitusrintakipua lievittävät lääkkeet ranolatsiini Immuunisalpaajat siklosporiini HIV- tai HCV-proteaasin estäjät ritonaviiri telapreviiri | Orgovyx-valmisteen terapeuttinen annos | Odotettu: ↑ Katso myös erytromysiiniä ja atsitromysiiniä koskevan kliinisen tutkimuksen tulokset (yllä). | Odotettu: ↑ Katso myös erytromysiiniä ja atsitromysiiniä koskevan kliinisen tutkimuksen tulokset (yllä). | |
| Lääkevalmisteet, jotka ovat CYP3A4:n estäjiä | ||||
vorikonatsoli 200 mg kahdesti vuorokaudessa, monta annosta (voimakas CYP3A4:n estäjä) | 120 mg:n kerta-annos | 12 % ↑ | 18 % ↓ | Annosmuutoksia ei suositella, kun relugoliksia käytetään samanaikaisesti CYP3A4:n estäjien kanssa, jotka eivät estä P-gp:tä. |
flukonatsoli 200 mg kerran vuorokaudessa, monta annosta (kohtalainen CYP3A4:n estäjä) | 40 mg:n kerta-annos | 19 %↑ | 44 % ↑ | |
atorvastatiini 80 mg kerran vuorokaudessa, monta annosta (heikko CYP3A4:n estäjä) | 40 mg:n kerta-annos | 5 %↓ | 22 %↓ | |
| Lääkevalmisteet, jotka ovat sekä P-gp:n indusoijia että voimakkaita CYP3A4:n indusoijia | ||||
rifampisiini 600 mg kerran vuorokaudessa, monta annosta | 40 mg:n kerta-annos | 55 %↓ | 23 %↓ | Orgovyx-valmisteen samanaikaista käyttöä voimakkaan CYP3A4:n ja P-gp:n indusoijan kanssa ei suositella, koska se voi pienentää relugoliksin AUC- ja Cmax-arvoja ja saattaa siten heikentää Orgovyx-valmisteen hoitovaikutusta. Annoksen suurentamista suositellaan, jos samanaikainen anto on välttämätöntä (ks. kohta Annostus ja antotapa). |
Lääkevalmisteet, jotka ovat sekä P-gp:n indusoijia että voimakkaita CYP3A4:n indusoijia (näihin kuitenkaan rajoittumatta): Androgeenireseptorin estäjä apalutamidi Epilepsialääkkeet karbamatsepiini fenytoiini fenobarbitaali Infektiolääkkeet rifampisiini rifabutiini Rohdosvalmisteet mäkikuisma (Hypericum perforatum) HIV- tai HCV-proteaasin estäjät ritonaviiri Muut kuin nukleosidirakenteiset kääteiskopioijaentsyymin estäjät efavirentsi | Orgovyx-valmisteen terapeuttinen annos | Odotettu: ↓ Katso myös erytromysiiniä ja atsitromysiiniä koskevan kliinisen tutkimuksen tulokset (yllä). | Odotettu: ↓ Katso myös erytromysiiniä ja atsitromysiiniä koskevan kliinisen tutkimuksen tulokset (yllä). | |
| Käyttö yhdessä muiden edenneen hormoniherkän eturauhassyövän hoitoon tarkoitettujen lääkkeiden kanssa | ||||
abirateroni (ei CYP3A4:n ja/tai P-gp:n estäjä/indusoija) | Orgovyx-valmisteen terapeuttinen annos | Odotettu: ↔ | Odotettu: ↔ | Abirateronin ja dosetakselin ei tiedetä olevan entsyymien estäjiä/indusoijia ja relugoliksin metaboliaa ja kuljettamista edistäviä kuljettaja-aineita. Kliinisesti merkitseviä vaikutuksia ei ole odotettavissa eikä Orgovyx-valmisteen annosta tarvitse muuttaa. |
dosetakseli (ei CYP3A4:n ja/tai P-gp:n estäjä/indusoija) | Orgovyx-valmisteen terapeuttinen annos | Odotettu: ↔ | Odotettu: ↔ | |
darolutamidi (heikko CYP3A4:n indusoija) | Orgovyx-valmisteen terapeuttinen annos | Odotettu: ↔ | Odotettu: ↔ | Darolutamidi on heikko CYP3A4:n indusoija. Altistuksen mahdollisen pienenemisen ei kuitenkaan odoteta olevan kliinisesti merkityksellinen. Orgovyx-valmisteen annosta ei tarvitse muuttaa. |
entsalutamidi (voimakas CYP3A4:n indusoija ja P-gp:n estäjä) | Orgovyx-valmisteen terapeuttinen annos | Odotettu: ↔ | Odotettu: ↔ | Entsalutamidi saattaa pienentää (CYP3A4:n induktio) ja/tai suurentaa (P-gp:n esto) relugoliksialtistusta. Vähäiset tiedot (n = 20) vaiheen 3 tutkimuksesta, jossa miespotilaat saivat samanaikaisesti 120 mg:n annoksen relugoliksia ja 80-160 mg:n annoksen entsalutamidia enintään 266 päivän ajan, osoittivat, etteivät relugoliksin minimipitoisuudet plasmassa muuttuneet kliinisesti merkitsevästi lisättäessä entsalutamidi pelkkään relugoliksihoitoon. Täten annosmuutoksia ei suositella annettaessa relugoliksia samanaikaisesti entsalutamidin kanssa. |
apalutamidi (P-gp:n indusoija ja voimakas CYP3A4:n indusoija) | Orgovyx-valmisteen terapeuttinen annos | Odotettu: ↓ | Odotettu: ↓ | Kliinisessä tutkimuksessa Orgovyx-valmisteen 120 mg:n annos kerran vuorokaudessa (ilman apalutamidia) ja Orgovyx-valmisteen 240 mg:n annos kerran vuorokaudessa (yhdessä apalutamidin 240 mg:n kerran vuorokaudessa annoksen kanssa) johti samankaltaisiin Ctrough-arvoihin. Orgovyx-annoksen suurentamista suositellaan, jos apalutamidin samanaikainen anto on välttämätöntä (ks. kohta Annostus ja antotapa). |
Lyhenteet: HIV: HI-virus, HCV: hepatiitti C -virus.
*: Atsitromysiinin ja relugoliksin samanaikaisen annon havaittiin suurentavan relugoliksialtistuksen pitoisuus-aikakäyrän mediaanin jopa 5-kertaiseksi ensimmäisen kolmen tunnin kuluttua annosta. Kuuden tunnin annosvälin jälkeen relugoliksialtistuksen pitoisuus-aikakäyrän mediaani suureni enintään 1,6-kertaiseksi ensimmäisen kolmen tunnin kuluessa annosta.
Relugoliksin mahdollinen vaikutus muiden lääkevalmisteiden altistukseen
Relugoliksi on heikko CYP3A-välitteisen metabolian indusoija ja BCRP:n sekä P-gb:n estäjä in vitro. Taulukossa 2 on yhteenveto samanaikaisesti annetun relugoliksin vaikutuksesta midatsolaami-, rosuvastatiini- ja dabigatraanialtistukseen ja sen mukaiset annostussuositukset. Luettelo sisältää myös relugoliksin odotetun mahdollisen yhteisvaikutuksen muiden lääkevalmisteiden kanssa.
In vitro -tutkimukset
Sytokromi P450 (CYP) -entsyymit: Relugoliksi ei ole CYP1A2:n, CYP2B6:n, CYP2C8:n, CYP2C9:n, CYP2C19:n, CYP2D6:n tai CYP3A4:n estäjä eikä CYP1A2:n tai CYP2B6:n indusoija kliinisesti merkitsevillä plasmapitoisuuksilla.
Kuljettajajärjestelmät: Relugoliksi ei ole OATP1B1:n, OATP1B3:n, OATP2B1:n, OAT1:n, OAT3:n, OCT2:n, MATE1:n, MATE2-K:n eikä BSEP:n estäjä kliinisesti merkitsevillä plasmapitoisuuksilla.
Taulukko 2. Relugoliksin vaikutus samanaikaisesti annetun lääkevalmisteen altistukseen (Cmax, AUC0-inf) ja suositukset
| Relugoliksin annosohjelma | Lääkkeen annosohjelma | Muutos lääkkeen AUC0-inf-arvossa | Muutos lääkkeen Cmax-arvossa | Suositus |
| Lääkevalmisteet, jotka ovat CYP3A:n substraatteja | ||||
| 120 mg kerran vuorokaudessa, monta annosta | midatsolami 5 mg:n kerta-annos (herkkä CYP3A:n substraatti) | 22 % ↓ | 14 % ↓ | Midatsolamin ja muiden CYP3A:n substraattien annosta ei tarvitse muuttaa. Kliinisesti merkitseviä yhteisvaikutuksia muiden CYP3A:n substraattien kuin midatsolaamin kanssa ei ole odotettavissa. Jos hoitovaikutus heikentyy, lääkevalmisteiden (esim. statiinien) annoksia voidaan titrata toivottujen hoitovaikutusten saavuttamiseksi. |
| Lääkevalmisteet, jotka ovat BCRP:n substraatteja | ||||
| 120 mg kerran vuorokaudessa, monta annosta | rosuvastatiini 10 mg:n kerta-annos (herkkä BCRP:n ja OATP1B1:n substraatti) | 27 % ↓ | 34 % ↓ | Rosuvastatiinialtistuksen pienenemistä ei pidetä kliinisesti merkityksellisenä. Rusuvastatiinin annoksia voidaan kuitenkin titrata toivottujen hoitovaikutusten saavuttamiseksi. Relugoliksin vaikutusta muihin BCRP:n substraatteihin ei ole arvioitu, eikä sen merkitystä muille BCRP:n substraateille tunneta. |
| Lääkevalmisteet, jotka ovat P-gp:n substraatteja | ||||
| 120 mg:n kerta-annos | dabigatraanieteksilaatti 150 mg:n kerta-annos (P-gp:n substraatti) | 17 % ↑ | 18 % ↑ | Dabigatraanialtistuksen suurenemista ei pidetä kliinisesti merkityksellisenä. Siksi relugoliksin 120 mg:n annoksella ei ole odotettavissa kliinisesti merkityksellisiä vaikutuksia muihin P‑gp:n substraatteihin. Kun otetaan huomioon se, ettei relugoliksin 360 mg:n latausannosta ole testattu, on suositeltavaa, ettei relugoliksin latausannosta anneta samaan aikaan muiden P-gp:n substraattien kanssa. |
| Käyttö yhdessä muiden edenneen hormoniherkän eturauhassyövän hoitoon tarkoitettujen lääkkeiden kanssa | ||||
| Orgovyx-valmisteen terapeuttinen annos | abirateroni (CYP3A4:n substraatti) | Odotettu: ↔ | Odotettu: ↔ | Kliinisesti merkitseviä muutoksia altistuksissa ei ole odotettavissa, eikä abirateronin, entsalutamidin, apalutamidin, darolutamidin tai dosetakselin annosta tarvitse muuttaa annettaessa niitä samanaikaisesti relugoliksin kanssa. |
| Orgovyx-valmisteen terapeuttinen annos | Docetaxel (CYP3A4:n substraatti) | Odotettu: ↔ | Odotettu: ↔ | |
| Orgovyx-valmisteen terapeuttinen annos | Darolutamide (CYP3A:n, P-gp:n ja BCRP:n substraatti) | Odotettu: ↔ | Odotettu: ↔ | |
| Orgovyx-valmisteen terapeuttinen annos | Enzalutamide (CYP2C8:n ja CYP3A4:n substraatti) | Odotettu: ↔ | Odotettu: ↔ | |
| Orgovyx-valmisteen terapeuttinen annos | Apalutamide (CYP2C8:n ja CYP3A4:n substraatti) | Odotettu: ↔ | Odotettu: ↔ | |
Raskaus ja imetys
Tämä lääkevalmiste ei ole tarkoitettu naisille, jotka voivat tulla raskaaksi. Sitä ei pidä käyttää naisille, jotka ovat tai saattavat olla raskaana tai jotka imettävät (ks. kohta Käyttöaiheet).
Ehkäisy
Ei tiedetä, esiintyykö relugoliksia tai sen metaboliitteja siemennesteessä. Eläinkokeissa tehtyjen löydösten ja valmisteen vaikutusmekanismin perusteella hoidon aikana ja 2 viikon ajan Orgovyx-valmisteen viimeisen annoksen jälkeen on käytettävä tehokasta ehkäisyä, jos potilas on sukupuoliyhteydessä naisen kanssa, joka voi tulla raskaaksi.
Raskaus
On vain vähän tietoja relugoliksin käytöstä raskaana oleville naisille. Eläinkokeissa on havaittu, että relugoliksialtistus raskauden varhaisvaiheessa voi suurentaa keskenmenoriskiä (ks. kohta Prekliiniset tiedot turvallisuudesta). Farmakologisten vaikutusten perusteella haitallisia vaikutuksia raskauden aikana ei voida poissulkea.
Imetys
Ei-kliinisten tutkimusten tulokset viittaavat siihen, että relugoliksi erittyy imettävien rottien maitoon (ks. kohta Prekliiniset tiedot turvallisuudesta). Tietoja ei ole saatavilla siitä, esiintyykö relugoliksia tai sen metaboliitteja ihmisen rintamaidossa, tai sen vaikutuksista rintaruokittuun imeväiseen. Vastasyntyneeseen/imeväiseen kohdistuvia vaikutuksia ei voida poissulkea.
Hedelmällisyys
Eläinkokeissa tehtyjen löydösten ja valmisteen vaikutusmekanismin perusteella Orgovyx saattaa heikentää miesten hedelmällisyyttä (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Orgovyx-valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn. Väsymys ja heitehuimaus ovat hyvin yleisiä (väsymys) ja yleisiä (heitehuimaus) haittavaikutuksia, jotka saattavat vaikuttaa ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Relugoliksihoidon aikana yleisimmin havaittuja haittavaikutuksia ovat testosteronipitoisuuden pienenemisen fysiologiset vaikutukset, kuten kuumat aallot (54 %), tuki- ja liikuntaelinten kipu (30 %) ja väsymys (26 %). Muita hyvin yleisiä haittavaikutuksia ovat ripuli ja ummetus (kumpikin 12 %).
Haittavaikutustaulukko
Taulukossa 3 luetellut haittavaikutukset on luokiteltu esiintyvyyden ja elinjärjestelmäluokan mukaan. Haittavaikutukset on esitetty kussakin esiintyvyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä. Esiintyvyydet on määritelty seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000) tai tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Taulukko 3. Kliinisissä tutkimuksissa ja myyntiin tulon jälkeen raportoidut haittavaikutukset
| Veri ja imukudos | |
| Yleinen | Anemia |
| Umpieritys | |
| Yleinen | Gynekomastia |
| Psyykkiset häiriöt | |
| Yleinen | Unettomuus |
| Masennus | |
| Hermosto | |
| Yleinen | Heitehuimaus |
| Päänsärky | |
| Sydän | |
| Melko harvinainen | Sydäninfarkti |
| Tuntematon | QT-ajan pidentyminen (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset) |
| Verisuonisto | |
| Hyvin yleinen | Kuumat aallot |
| Yleinen | Korkea verenpaine |
| Ruoansulatuselimistö | |
| Hyvin yleinen | Ripulia |
| Ummetus | |
| Yleinen | Pahoinvointi |
| Iho ja ihonalainen kudos | |
| Yleinen | Liikahikoilu |
| Ihottuma | |
| Melko harvinainen | Nokkosihottuma |
| Angioedeema | |
| Luusto, lihakset ja sidekudos | |
| Hyvin yleinen | Tuki- ja liikuntaelinten kipub |
| Melko harvinainen | Osteoporoosi/osteopenia |
| Sukupuolielimet ja rinnat | |
| Yleinen | Sukupuolivietin väheneminen |
| Yleisoireet ja antopaikassa todettavat haitat | |
| Hyvin yleinen | Väsymysc |
| Tutkimukset | |
| Yleinen | Painonnousu |
| Glukoosipitoisuuden suureneminend | |
| Triglyseridipitoisuuden suureneminend | |
| Veren kolesterolipitoisuuden suureneminene | |
| Melko harvinainen | Aspartaattiaminotransferaasipitoisuuden suureneminen |
| Alaniiniaminotransferaasipitoisuuden suureneminend | |
a Sisältää ripulin ja koliitin
b Sisältää nivelkivun, selkäkivun, raajakivun, tuki- ja liikuntaelinten kivun, lihaskivun, luukivun, niskakivun, niveltulehduksen, tuki- ja liikuntaelinten jäykkyyden, ei-sydänperäisen rintakivun, selkärankakivun ja tuki- ja liikuntaelinten tuntemukset
c Sisältää väsymyksen ja voimattomuuden
d Asteen 3/4 suurenemista havaittiin kliinisten laboratoriotestien seurannassa (ks. alla)
e > asteen 2 kolesterolipitoisuuden suurenemista ei raportoitu
Tiettyjen haittavaikutusten kuvaus
Laboratorioparametrien muutokset
Vaiheen 3 tutkimuksessa (N = 622) enintään 1 vuoden kestäneen hoidon aikana havaitut laboratorioarvojen muutokset olivat samankaltaisia Orgovyx-valmisteen ja aktiivisena vertailuvalmisteena käytetyn GnRH-agonistin (leuproreliinin) osalta. Orgovyx-hoidon jälkeen 1,4 %:lla potilaista, joiden arvot olivat normaalit ennen hoitoa, raportoitiin ALAT- ja/ tai ASAT-pitoisuuksia, jotka olivat vähintään 3 kertaa yli viitealueen ylärajan (ULN). Asteen 3/4 ALAT-pitoisuuden suurenemista raportoitiin 0,3 %:lla Orgovyx-hoitoa saaneista potilaista ja asteen 3/4 ASAT-pitoisuuden suurenemista 0 %:lla Orgovyx-hoitoa saaneista potilaista. Bilirubiinipitoisuuden suurenemiseen liittyviä tapahtumia ei esiintynyt.
Hemoglobiinipitoisuus pieneni 10 g/l:lla enintään 1 vuoden kestäneen hoidon aikana. Merkittävää hemoglobiinipitoisuuden pienenemistä (≤ 105 g/l) havaittiin 4,8 %:lla potilaista ja asteen 3/4 pienenemistä 0,5 %:lla potilaista Orgovyx-hoidon jälkeen. Asteen 3/4 glukoosipitoisuuden suurenemista havaittiin 2,9 %:lla potilaista ja asteen 3/4 triglyseridipitoisuuden suurenemista 2,0 %:lla potilaista.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Orgovyx-valmisteen yliannostukseen ei ole tunnettua vastalääkettä. Yliannostuksen sattuessa Orgovyx-valmisteen käyttö on lopetettava ja on ryhdyttävä yleisiin tukitoimiin, kunnes kliininen toksisuus on vähentynyt tai hävinnyt, huomioiden valmisteen puoliintumisaika 61,5 tuntia. Yliannostuksesta aiheutuvia haittavaikutuksia ei ole vielä havaittu. Tällaisten vaikutusten odotetaan muistuttavan kohdassa Haittavaikutukset lueteltuja haittavaikutuksia. Ei tiedetä, poistuuko relugoliksi hemodialyysillä.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: endokrinologiset lääkeaineet, hormoniantagonistit ja vastaavat valmisteet, ATC-koodi: L02BX04
Vaikutusmekanismi
Relugoliksi on ei-peptidi GnRH-antagonisti, joka sitoutuu kilpailevasti GnRH-reseptoreihin aivolisäkkeen etulohkossa estäen natiivia GnRH:ta sitoutumasta ja signaloimasta luteinisoivan hormonin (LH) ja follikkelia stimuloivan hormonin (FHS) erittymistä.
Tämän seurauksena testosteronin tuotanto kiveksissä vähenee. Ihmisillä FSH- ja LH-pitoisuudet pienenevät nopeasti Orgovyx-hoidon aloittamisen jälkeen ja testosteronipitoisuudet vähenevät fysiologisia pitoisuuksia pienemmiksi.
Hoitoon ei liity FSH- ja LH-pitoisuuksien suurenemista aluksi ja sen myötä testosteronipitoisuuden suurenemista (”mahdollinen oireinen flare-ilmiö”), jota on havaittu GnRH-analogihoidon alussa.
Hoidon lopettamisen jälkeen aivolisäke- ja sukupuolirauhashormonien pitoisuudet palaavat fysiologisiin pitoisuuksiin.
Kliininen teho ja turvallisuus
Orgovyx-valmisteen turvallisuutta ja tehoa arvioitiin satunnaistetussa, avoimessa HERO-tutkimuksessa aikuisilla miehillä, joilla oli edennyt androgeeniherkkä eturauhassyöpä ja jotka tarvitsivat vähintään vuoden kestoisen androgeenideprivaatiohoidon ja joille leikkaus- tai sädehoito ei sopinut parantavaksi hoidoksi. Tutkimukseen soveltuvilla potilailla oli joko näyttöä biokemiallisesta (PSA) tai kliinisestä relapsista parantavaksi hoidoksi tarkoitetun paikallisen primaarisen intervention jälkeen tai heille ei sopinut toisen vaiheen (salvage) leikkaus, heillä oli äskettäin diagnosoitu androgeeniherkkä etäpesäkkeinen tauti tai edennyt paikallinen tauti, jonka parantuminen primaarilla leikkaus- tai sädehoidolla oli epätodennäköistä. Tutkimukseen soveltuvien potilaiden ECOG (Eastern Cooperative Oncology Group) -toimintakykyluokka oli 0 tai 1. Potilaita, joiden tauti eteni hoitojakson aikana, kannustettiin jatkamaan tutkimuksessa, ja tarpeen mukaan he saattoivat saada tutkijan määräämää sädehoitoa. Jos PSA-pitoisuudet suurenivat, potilaiden oli mahdollista saada entsalutamidia PSA-pitoisuuden nousun vahvistamisen jälkeen tai dosetakselia tutkimuksen aikana.
Tehon ensisijainen vastemuuttuja oli lääkkeellisen kastraation yleisyys, jonka määritelmänä oli seerumin testosteronipitoisuuden pieneneminen ja pysyminen kastraatiotasolla (< 50 ng/dl) päivään 29 mennessä ja 48 viikkoa kestävän hoidon ajan. Lisäksi arvioitiin, oliko relugoliksi vähintään samanveroinen (non-inferior) leuproreliiniin verrattuna (ks. Taulukko 3). Muut tärkeimmät toissijaiset päätetapahtumat olivat kastraation yleisyys päivinä 4 ja 15, kastraation yleisyys testosteronipitoisuudella < 20 ng/dl mitattuna päivänä 15 ja PSA-vasteosuus päivänä 15 (ks. taulukko 4).
Yhteensä 934 potilasta satunnaistettiin saamaan Orgovyx-valmistetta tai leuproreliinia (suhteessa 2:1) 48 viikon ajan:
- Orgovyx-valmistetta suun kautta: 360 mg:n latausannos ensimmäisenä päivänä, minkä jälkeen päivittäin 120 mg:n annos.
- Leuproreliinia 22,5 mg:n injektio (tai 11,25 mg Japanissa, Taiwanissa ja Kiinassa) ihon alle 3 kuukauden välein.
Potilasjoukon (N = 930) mediaani-ikä oli kummassakin hoitoryhmässä 71 vuotta (vaihteluväli 47–97 vuotta). Etninen jakauma oli seuraava: 68 % valkoihoisia, 21 % aasialaisia, 4,9 % tummaihoisia ja 5 % muita. Taudin levinnäisyysasteet olivat seuraavat: 32 % etäpesäkkeinen (M1), 31 % paikallisesti edennyt (T3/4 NX M0 tai mikä tahansa T N1 M0), 28 % paikallinen (T1 tai T2 N0 M0) ja 10 % ei ollut luokiteltavissa.
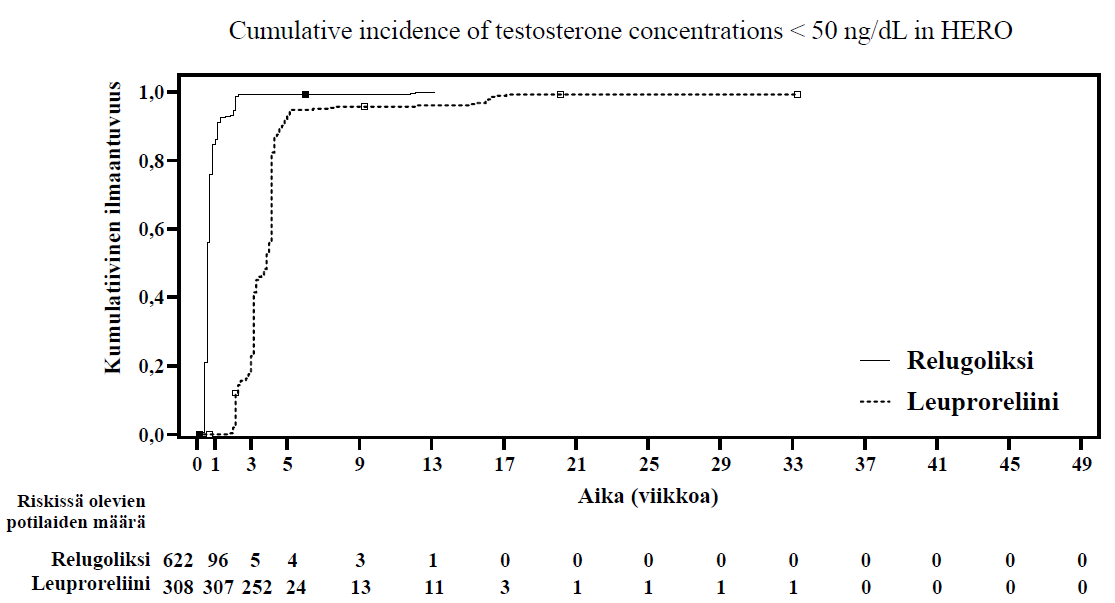
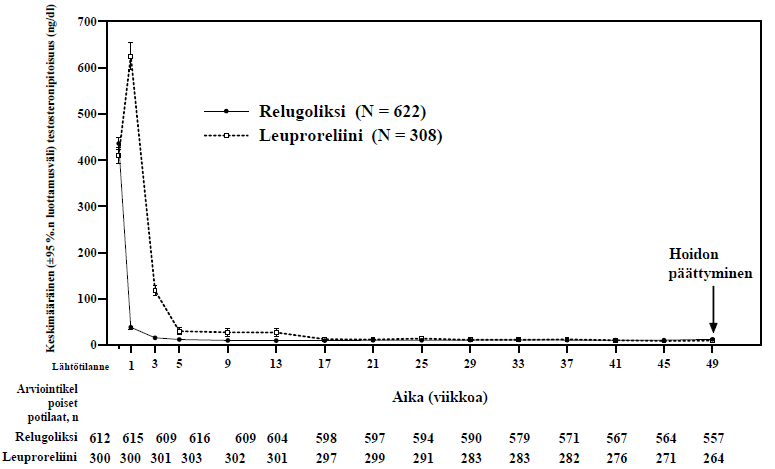
Orgovyx-valmisteen ensisijaiset tehoa koskevat tulokset leuproreliiniin verrattuna seerumin testosteronipitoisuuden kastraatiotason (T < 50 ng/dl) saavuttamisessa ja sen pysymisessä on esitetty taulukossa 4 ja kuvassa 1. Lähtötilanteen testosteronipitoisuudet sekä Orgovyx-valmisteen ja leuproreliinin aikaansaama testosteronipitoisuuden pieneneminen ajan suhteen 48 viikkoa kestäneen hoitojakson aikana on esitetty kuvassa 2.
Taulukko 4. Lääkkeellisen kastraation yleisyys (testosteronipitoisuudet < 50 ng/dl) viikon 5 päivästä 1 (päivä 29) viikon 49 päivään 1 (päivä 337) HERO-tutkimuksessa
| Orgovyx 360/120 mg | Leuproreliini 22,5 tai 11,25 mga | |
| Hoidettujen määrä | 622b | 308b |
| Vasteen saaneiden osuus (95 %:n luottamusväli)c | 96,7 % (94,9 %; 97,9 %) | 88,8 % (84,6 %; 91,8 %) |
| Ero leuproreliiniin verrattuna (95 %:n luottamusväli) | 7,9 % (4,1 %; 11,8 %)d p-arvo < 0,0001 |
a 22,5 mg:n annos Euroopassa ja Pohjois-Amerikassa; 11,25 mg:n annos Aasiassa. Kastraation yleisyys niiden potilaiden alaryhmässä, jotka saivat 22,5 mg leuproreliinia (n = 264) oli 88,0 % (95 %:n luottamusväli: 83,4 %; 91,4 %).
b Kummassakin hoitohaarassa oli kaksi potilasta, jotka eivät saaneet tutkimushoitoa ja joita ei otettu mukaan.
c Kaplan-Meierin estimaatit ryhmän sisällä.
d Vähintään samanarvoisuuden (non-inferiority) marginaali oli –10 %.
Kuva 1: Testosteronipitoisuuksien < 50 ng/dl kumulatiivinen ilmaantuvuus HERO-tutkimuksessa
Kuva 2: Testosteronipitoisuudet lähtötilanteesta viikolle 49 (keskiarvo ja 95 %:n luottamusväli) HERO-tutkimuksessa
Yhteenveto tärkeimpien toissijaisten päätetapahtumien tuloksista on esitetty taulukossa 5.
Taulukko 5. Yhteenveto tärkeimmistä toissijaisista päätetapahtumista
| Toissijainen päätetapahtuma | Orgovyx (N = 622) | Leuproreliini (N = 308) | p-arvo |
| Kumulatiivinen todennäköisyys testosteronipitoisuuden pienenemiselle < 50 ng/dl ennen annostusta päivänä 4 | 56,0 | 0,0 | < 0,0001 |
| Kumulatiivinen todennäköisyys testosteronin pienenemiselle < 50 ng/dl ennen annostusta päivänä 15 | 98,7 | 12,1 | < 0,0001 |
| Niiden potilaiden osuus, joilla oli PSA-vaste päivänä 15 ja tämän vahvistus päivänä 29 | 79,4 | 19,8 | < 0,0001 |
| Kumulatiivinen todennäköisyys testosteronin pienenemiselle < 20 ng/dl ennen annostusta päivänä 15 | 78,4 | 1,0 | < 0,0001 |
Lyhenteet: PSA = prostataspesifinen antigeeni.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset Orgovyx-valmisteen käytöstä edenneen hormoniherkän eturauhassyövän hoidossa kaikissa pediatrisissa potilasryhmissä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Suun kautta kerran otetun 360 mg:n latausannoksen jälkeen relugoliksin keskimääräinen (± keskihajonta [± SD]) AUC0–24-arvo oli 985 (± 742) ng.hr/ml ja Cmax-pitoisuus 215 (± 184) ng/ml. Kerran päivässä otetun 120 mg:n annoksen jälkeen relugoliksin keskimääräinen (± SD) vakaan tilan Cmax-pitoisuus oli 70 (± 65) ng/ml, Cavg-arvo (keskimääräinen pitoisuus plasmassa 24 tunnin annostusvälin aikana) 17,0 (± 7) ng/ml ja Ctrough-pitoisuus 10,7 (± 4) ng/ml.
Relugoliksialtistuksen kertymä kerran päivässä annetun 120 mg:n relugoliksiannoksen jälkeen on noin 2‑kertainen. Kun relugoliksia annetaan kerran päivässä sen jälkeen, kun on annettu 360 mg:n latausannos ensimmäisenä antopäivänä, relugoliksin vakaa tila saavutetaan päivään 7 mennessä.
Imeytyminen
Suun kautta annettu relugoliksi imeytyy ensisijaisesti suolistossa olevan P-gp:n välityksellä, jonka substraatti relugoliksi on. Suun kautta annettu relugoliksi imeytyy nopeasti saavuttaen määritettävän pitoisuuden 0,5 tunnissa annoksen jälkeen, minkä jälkeen esiintyy yksi tai useampi imeytymishuippu. Mediaaniaika (vaihteluväli) relugoliksin Cmax-pitoisuuden (tmax) saavuttamiseen on 2,25 tuntia (0,5–5,0 tuntia). Relugoliksin absoluuttinen biologinen hyötyosuus on 11,6 %.
Kun relugoliksia annettiin 120 mg:n kerta-annos runsaskalorisen ja runsasrasvaisen aterian (noin 800–1 000 kaloria, joista 500 rasvoista, 220 hiilihydraateista ja 124 proteiineista) nauttimisen jälkeen, AUC0–∞-arvo pieneni 19 % ja Cmax-pitoisuus 21 %. Relugoliksialtistuksen pienenemistä ruoan yhteydessä ei pidetä kliinisesti merkityksellisenä, joten Orgovyx-valmistetta voidaan antaa aterioista riippumatta (ks. kohta Annostus ja antotapa).
Jakautuminen
Relugoliksi sitoutuu 68–71-prosenttisesti plasman proteiineihin, pääasiassa albumiiniin ja vähemmässä määrin happamaan α1‑glykoproteiiniin. Keskimääräinen kokoveren ja plasman välinen suhde on 0,78. Näennäisen jakautumistilavuuden (Vz) perusteella relugoliksi jakautuu laajasti kudoksiin. Arvioitu jakautumistilavuus vakaassa tilassa (Vss) on 3 900 l.
Biotransformaatio
In vitro - tutkimukset viittaavat siihen, että relugoliksin oksidatiivista metaboliaa maksassa ensisijaisesti edistävät CYP‑entsyymit olivat CYP3A4/5 (45 %) > CYP2C8 (37 %) > CYP2C19 (< 1 %) ja oksidatiiviset metaboliitit CYP3A4/5:n muodostama metaboliitti‑A ja CYP2C8:n muodostama metaboliitti‑B.
Eliminaatio
Noin 19 % imeytyneestä relugoliksista eliminoituu muuttumattomana vaikuttavana aineena virtsaan ja 80 % eliminoituu usean biotransformaatioreitin kautta, kuten CYP3A:n ja CYP2C8:n sekä usean vähemmän merkittävän metaboliareitin kautta, ja vähäinen osa erittyy sapen kautta muuttumattomana lääkevalmisteena ja/tai metaboliitteina. Noin 38 % annetusta annoksesta erittyy metaboliitteina (muina kuin metaboliitti-C:nä) ulosteeseen ja virtsaan. Suoliston mikroflooran muodostama metaboliitti‑C on ensisijainen metaboliitti ulosteessa (51 %) ja edelleen kuvastaa imeytymätöntä lääkeainetta.
Lineaarisuus/ei-lineaarisuus
Relugoliksiin liittyy enemmän kuin annosvasteinen altistus noin alle 80 mg:n annoksilla, mikä vastaa suolistossa olevan P‑gp:n annosriippuvaista saturaatiota ja suolistossa olevan P‑gp:n effluksin vastaavaa vähenevää osuutta suun kautta otetun relugoliksin biologiseen hyötyosuuteen annoksen suuretessa. Suolistossa olevan P‑gp:n saturaation myötä relugoliksin imeytymistä hallitsee suuremmassa määrin passiivinen diffuusio ja relugoliksialtistus suurenee annosvasteisesti 80–360 mg:n annosalueella. Suolistossa olevan P‑gp:n saturaatio suuremmilla relugoliksiannoksilla on osoitettu relugoliksialtistuksen annosvasteisella suurenemisella voimakkaan P‑gp:n estäjän (ja kohtalaisen CYP3A:n estäjän) erytromysiinin yhteydessä, jolloin altistuksen suureneminen oli vähäisempää 120 mg:n annoksella verrattuna relugoliksin pienempiin annoksiin (20 tai 40 mg) (ks. kohta Yhteisvaikutukset).
Erityisryhmät
Populaatiofarmakokineettiset (PopPK) ja PopPK/farmakodynaamiset analyysit viittaavat siihen, etteivät ikä, rotu tai etninen tausta, kehon koko (paino tai painoindeksi) tai syövän levinneisyysaste aiheuta kliinisesti merkityksellisiä eroja relugoliksin altistukseen tai testosteronipitoisuuksiin.
Munuaisten vajaatoiminta
40 mg:n relugoliksiannoksilla tehtyjen erityisesti munuaisten vajaatoimintaa koskevien tutkimusten perusteella relugoliksialtistus (AUC0-t) suureni 1,5‑kertaiseksi keskivaikeaa munuaisten vajaatoimintaa sairastavilla potilailla ja enintään 2,0-kertaiseksi vaikeaa munuaisten vajaatoimintaa sairastavilla potilailla verrattuna tutkittaviin, joiden munuaisten toiminta on normaali. Suurenemisia ei pidetä kliinisesti merkityksellisinä keskivaikeaa munuaisten vajaatoimintaa sairastavilla potilailla. Vaikeaa munuaisten vajaatoimintaa sairastavilla potilailla varovaisuus on tarpeen annettaessa relugoliksia 120 mg:n annos kerran päivässä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Loppuvaiheen munuaissairauden (joko hemodialyysilla tai ilman) vaikutusta relugoliksin farmakokinetiikkaan ei ole arvioitu. Ei tiedetä, missä määrin relugoliksi poistuu hemodialyysilla.
Maksan vajaatoiminta
Kun relugoliksia annettiin yksi 40 mg:n annos, relugoliksin kokonaisaltistus (AUC0–∞) pieneni 31 % potilailla, joilla oli lievä maksan vajaatoimista, tai oli vastaavanlainen potilailla, joilla oli keskivaikea maksan majaatoiminta, verrattuna tutkittaviin, joiden maksan toiminta oli normaali. Relugoliksin keskimääräinen eliminaation puoliintumisaika oli vastaavanlainen lievää tai keskivaikeaa maksan vajaatoimintaa sairastavilla ja terveillä verrokeilla.
Annosta ei tarvitse muuttaa potilaille, joilla on lievä tai keskivaikea maksan vajaatoiminta (ks. kohta Annostus ja antotapa). Relugoliksin farmakokinetiikkaa ei ole arvioitu potilailla, joilla on vaikea maksan vajaatoiminta.
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta, genotoksisuutta ja karsinogeenisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille lukuun ottamatta jäljempänä käsiteltyjä.
Ihmisen GnRH-reseptorin suhteen siirtogeenisillä hiirillä relugoliksin anto suun kautta vähensi eturauhasen ja rakkularauhasen painoa annoksilla, jotka olivat ≥ 3 mg/kg kahdesti päivässä 28 päivän ajan. Relugoliksin vaikutukset olivat ohimeneviä, paitsi kivesten paino, joka ei täysin palautunut 28 päivässä lääkkeen lopettamisen jälkeen. Nämä siirtogeenisillä hiirillä havaitut vaikutukset liittyvät todennäköisesti relugoliksin farmakodynamiikkaan; näiden havaintojen merkitystä ihmisille ei kuitenkaan tiedetä. Apinoilla tehdyssä 39 viikkoa kestäneessä toistuvan altistuksen aiheuttamaa toksisuutta koskevassa tutkimuksessa ei havaittu merkittäviä vaikutuksia koiraiden lisääntymiselimiin suun kautta annetuilla annoksilla, jotka olivat enintään 50 mg/kg/vrk (noin 36 kertaa suurempia kuin ihmisten altistus suositellulla annoksella 120 mg päivässä AUC-arvon perusteella). Relugoliksi (annoksilla ≥ 1 mg/kg) pienensi LH-pitoisuuksia kastroiduilla jaavanmakakikoirailla; relugoliksin pienentävää vaikutusta LH- ja sukupuolihormoneihin ei kuitenkaan arvioitu kastroimattomilla jaavanmakakeilla 39 viikkoa kestäneessä toksisuustutkimuksessa. Siksi ei tiedetä, mikä merkitys ihmisille on lisääntymiselimiin kohdistuvan vaikutuksen puuttumisesta kastroimattomilla jaavanmakakikoirailla.
Tiineillä kaniineilla, joille annettiin relugoliksia suun kautta organogeneesin aikana, havaittiin keskenmenoja ja koko poikueen menetystä altistuspitoisuuksilla (AUC), jotka olivat pienempiä kuin ihmisille suositellulla annoksella 120 mg/vrk saavutetut altistuspitoisuudet. Rotilla ei havaittu alkion- ja sikiönkehitykseen kohdistuvia vaikutuksia; relugoliksilla ei ole kuitenkaan merkittäviä yhteisvaikutuksia GnRH-reseptorien kanssa kyseisessä lajissa.
Kun imettäville rotille annettiin kerta-annos radioaktiivisesti leimattua relugoliksia 30 mg/kg synnytyksen jälkeen 14. päivänä, maidossa todetut relugoliksin ja/tai metaboliittien pitoisuudet olivat jopa 10 kertaa suurempia kuin plasmassa todetut pitoisuudet 2 tuntia annoksen jälkeen ja pitoisuudet vähenivät pieniksi 48 tunnin kuluessa annosta. Suurin osa maidossa olevasta relugoliksista peräisin olevasta radioaktiivisuudesta muodostui muuttumattomasta relugoliksista.
Ympäristöön kohdistuvien riskien arviointitutkimukset ovat osoittaneet, että relugoliksi saattaa aiheuttaa vesiympäristöön kohdistuvan riskin (ks. kohta Käyttö- ja käsittelyohjeet).
Farmaseuttiset tiedot
Apuaineet
Mannitoli (E421)Natriumtärkkelysglykolaatti (E468)
Hydroksipropyyliselluloosa (E463)
Magnesiumstearaatti (E572)
Hypromelloosi (E464)
Titaanidioksidi (E171)
Punainen rautaoksidi (E172)
Karnaubavaha (E903)
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
4 vuotta
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
ORGOVYX tabletti, kalvopäällysteinen
120 mg (L:ei) 30 kpl (155,65 €)
PF-selosteen tieto
Orgovyx kalvopäällysteiset tabletit toimitetaan purkissa. Yksi suuritiheyksisestä polyeteenistä (HDPE) valmistettu purkki sisältää 30, 33, 90 tai 95 kalvopäällysteistä tablettia ja kuivausaineen, ja se on suljettu induktiosaumatulla polypropeenista (PP) valmistetulla turvakorkilla.
Pakkauskoot 30, 33, 90 (kolme 30 tabletin pakkausta tai yksi 90 tabletin pakkaus) ja 95 kalvopäällysteistä tablettia.
Orgovyx kalvopäällysteiset tabletit toimitetaan myös alumiini/alumiini/-läpipainopakkauksissa, joissa on 30 ja 90 kalvopäällysteistä tablettia.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Haalean punainen, mantelinmuotoinen, kalvopäällysteinen tabletti (11 mm [pituus] × 8 mm [leveys]), jonka toisella puolella on merkintä ”R” ja toisella puolella ”120”.
Käyttö- ja käsittelyohjeet
Tämä lääkevalmiste saattaa aiheuttaa ympäristöriskin (ks. kohta Prekliiniset tiedot turvallisuudesta). Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
ORGOVYX tabletti, kalvopäällysteinen
120 mg 30 kpl
- Ylempi erityiskorvaus (100 %). Eturauhassyöpä (116).
- Peruskorvaus (40 %).
ATC-koodi
L02BX04
Valmisteyhteenvedon muuttamispäivämäärä
29.09.2025
Yhteystiedot
 ACCORD HEALTHCARE OY
ACCORD HEALTHCARE OY Oksasenkatu 10 A 6
00100 Helsinki
Suomi
010 231 4180
