TAVNEOS kapseli, kova 10 mg
Huomioitavaa
▼Tähän lääkevalmisteeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti turvallisuutta koskevaa uutta tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä lääkkeen haittavaikutuksista. Ks. kohdasta Haittavaikutukset, miten haittavaikutuksista ilmoitetaan.
Vaikuttavat aineet ja niiden määrät
Yksi kova kapseli sisältää 10 mg avakopaania.
Apuaine, jonka vaikutus tunnetaan
Yksi kova kapseli sisältää 245 mg makrogoliglyserolihydroksistearaattia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Kapseli, kova
Kliiniset tiedot
Käyttöaiheet
Tavneos on tarkoitettu yhdessä rituksimabia tai syklofosfamidia sisältävän hoito-ohjelman kanssa aikuispotilaille vaikean aktiivisen granulomatoottisen polyangiitin (GPA) tai mikroskooppisen polyangiitin (MPA) hoitoon (ks. kohta Annostus ja antotapa).
Ehto
Valmiste on tarkoitettu käytettäväksi käyttöaiheessa mainitun sairauden diagnosointiin ja hoitoon perehtyneen lääkärin ohjauksessa ja seurannassa.
Annostus ja antotapa
Hoidon saa aloittaa vain GPA:n tai MPA:n diagnosointiin ja hoitoon perehtynyt lääkäri, ja hoito on toteutettava tällaisen lääkärin valvonnassa (ks, kohta Varoitukset ja käyttöön liittyvät varotoimet).
Annostus
Suositeltu annos on 30 mg Tavneos-valmistetta (kolme 10 mg:n kovaa kapselia) suun kautta kahdesti vuorokaudessa, aamuisin ja iltaisin, ruoan kanssa.
Tavneos-valmisteen kanssa on annettava samanaikaisesti rituksimabia tai syklofosfamidia seuraavasti:
- rituksimabia laskimoon kerran viikossa 4 viikon ajan tai
- syklofosfamidia laskimoon tai suun kautta 13 tai 14 viikon ajan, minkä jälkeen atsatiopriinia tai mykofenolaattimofetiilia suun kautta ja
- glukokortikoideja kliinisen tarpeen mukaan.
Tarkemmat tiedot annoksista ja samanaikaisesta glukokortikoidihoidosta sekä tiedot lääkeyhdistelmien tehosta ja turvallisuudesta, ks. kohdat Haittavaikutukset ja Farmakodynamiikka.
Kliinisistä tutkimuksista saadut tiedot rajoittuvat 52 viikon altistukseen ja sitä seuranneeseen 8 viikon tarkkailujaksoon.
Annoksen unohtuminen
Jos potilas unohtaa ottaa annoksen, se on otettava mahdollisimman pian, paitsi jos seuraavan aikataulun mukaisen annoksen ottamiseen on alle kolme tuntia. Jos seuraavan annoksen ottamiseen on alle kolme tuntia, unohtunut annos jätetään väliin.
Hoidon muuttaminen
Hoito on arvioitava kliinisesti uudelleen ja keskeytettävä tilapäisesti, jos:
- alaniiniaminotransferaasiarvo (ALAT) tai aspartaattiaminotransferaasiarvo (ASAT) on yli 3‑kertainen viitealueen ylärajaan (ULN) nähden.
Hoito on keskeytettävä tilapäisesti, jos:
- ALAT tai ASAT on > 5 × ULN
- potilaalle kehittyy leukopenia (valkosoluarvo < 2 × 109/l), neutropenia (neutrofiiliarvo < 1 × 109/l) tai lymfopenia (lymfosyyttiarvo < 0,2 × 109/l)
- potilaalla on jokin aktiivinen, vakava infektio (joka vaatii sairaalahoitoa tai pitkään jatkuvaa sairaalahoitoa).
Hoitoa voidaan jatkaa:
- kun arvot ovat normalisoituneet sekä yksilöllisen hyöty-riskiarvion perusteella.
Jos hoitoa jatketaan, on maksan transaminaasiarvoja ja kokonaisbilirubiiniarvoa seurattava tiiviisti.
Hoidon lopettamista pysyvästi on harkittava, jos:
- ALAT tai ASAT on > 8 × ULN
- ALAT tai ASAT on > 5 × ULN yli 2 viikon ajan
- ALAT tai ASAT on > 3 × ULN ja kokonaisbilirubiini on > 2 × ULN tai INR-arvo (international normalised ratio) on > 1,5
- ALAT tai ASAT on > 3 × ULN ja potilaalla esiintyy väsymystä, pahoinvointia, oksentelua, vatsan oikean yläneljänneksen kipua tai arkuutta, kuumetta, ihottumaa ja/tai eosinofiliaa (> 5 %)
- avakopaanin ja maksan toimintahäiriön on vahvistettu liittyvän toisiinsa.
Erityisryhmät
Iäkkäät
Annosta ei tarvitse muuttaa iäkkäille potilaille (ks. kohta Farmakokinetiikka).
Maksan vajaatoiminta
Annosta ei tarvitse muuttaa potilaille, joilla on lievä tai keskivaikea maksan vajaatoiminta (ks. kohta Farmakokinetiikka).
Avakopaania ei ole tutkittu vaikeaa maksan vajaatoimintaa (Child–Pugh-luokka C) sairastavilla potilailla, eikä sen käyttämistä tässä potilasryhmässä siksi suositella.
Munuaisten vajaatoiminta
Annosta ei tarvitse muuttaa munuaistoiminnan perusteella (ks. kohta Farmakokinetiikka).
Avakopaania ei ole tutkittu neutrofiilien sytoplasmavasta-aineisiin (ANCA) liittyvää vaskuliittia sairastavilla potilailla, joiden glomerulusten laskennallinen suodatusnopeus (eGFR) on alle 15 ml/min/1,73 m² ja jotka joko saavat dialyysihoitoa tai tarvitsevat dialyysihoitoa tai plasmanvaihtoa.
Alveolaarisena verenvuotona ilmenevä vaikea sairaus
Avakopaania ei ole tutkittu potilailla, joilla on alveolaarisena verenvuotona ilmenevä vaikea sairaus.
Pediatriset potilaat
Avakopaanin turvallisuutta ja tehoa nuorten (12–17 vuoden ikäisten) hoidossa ei ole vielä varmistettu. Saatavissa olevan tiedon perusteella, joka on kuvattu kohdissa Haittavaikutukset ja Farmakodynamiikka, ei voida antaa suosituksia annostuksesta. Avakopaanin turvallisuutta ja tehoa alle 12 vuoden ikäisten lasten hoidossa ei ole vielä varmistettu. Tietoja ei ole saatavilla.
Antotapa
Tämä lääkevalmiste on tarkoitettu otettavaksi suun kautta.
Kovat kapselit on otettava ruoan kanssa ja nielaistava kokonaisina veden kera, eikä niitä saa murskata, pureskella tai avata.
Avakopaanihoitoa saavien potilaiden on vältettävä greipin ja greippimehun nauttimista (ks. kohta Yhteisvaikutukset).
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Maksatoksisuus
Vakavaa maksan transaminaasi- ja kokonaisbilirubiiniarvojen suurenemista on todettu haittavaikutuksina potilailla, jotka ovat saaneet avakopaania yhdessä syklofosfamidin (ja sen jälkeen atsatiopriinin tai mykofenolaatin) tai rituksimabin sekä trimetopriimin ja sulfametoksatsolin kanssa.
Markkinoille tulon jälkeen on raportoitu lääkkeen aiheuttamia maksavaurioita ja sappitiekatoa (vanishing bile duct syndrome, VBDS), mukaan lukien kuolemaan johtaneita tapauksia (ks. kohta Haittavaikutukset).
Maksan transaminaasiarvot ja kokonaisbilirubiiniarvo on tarkistettava ennen hoidon aloittamista.
Avakopaanin määräämistä on vältettävä, jos potilaalla on merkkejä maksasairaudesta, kuten kohonnut ALAT- tai ASAT-arvo tai alkalinen fosfataasiarvo [AFOS] tai kokonaisbilirubiiniarvo > 3 x ULN.
Potilaiden maksan transaminaasiarvoja ja kokonaisbilirubiiniarvoa on seurattava vähintään 4 viikon välein hoidon aloittamisen jälkeen ensimmäisten 6 hoitokuukauden ajan ja sen jälkeenkliinisen tarpeen mukaan (ks. kohta Annostus ja antotapa).
Veri ja immuunijärjestelmä
Valkosoluarvo on tarkistettava ennen hoidon aloittamista ja potilaita on seurattava kliinisen tarpeen mukaan ja osana potilaan perussairauden rutiiniseurantaa (ks. kohta Annostus ja antotapa).
Avakopaanihoitoa ei saa aloittaa, jos valkosoluarvo on < 3,5 × 109/l, neutrofiiliarvo < 1,5 × 109/l tai lymfosyyttiarvo < 0,5 × 109/l.
Avakopaanihoitoa saavia potilaita on kehotettava ilmoittamaan välittömästi kaikista infektioon viittaavista oireista, odottamattomista mustelmista, verenvuodoista ja kaikista muista luuytimen vajaatoiminnan merkeistä.
Vakavat infektiot
Vakavia infektioita on raportoitu potilailla, jotka ovat saaneet GPA:n tai MPA:n hoitoon yhdistelmälääkitystä, kuten avakopaania yhdessä rituksimabin tai syklofosfamidin kanssa (ks. kohta Haittavaikutukset).
Potilaat on arvioitava vakavien infektioiden varalta.
Avakopaania ei ole tutkittu potilailla, joilla on hepatiitti B‑, hepatiitti C‑ tai ihmisen immuunikatovirusinfektio (HIV). Potilaiden on kerrottava lääkärille ennen hoidon aloittamista ja hoidon aikana diagnosoidusta tuberkuloosista tai hepatiitti B‑, hepatiitti C‑ tai HIV-infektiosta. Noudata varovaisuutta hoitaessasi potilaita, joilla on aiemmin todettu tuberkuloosi, hepatiitti B, hepatiitti C tai HIV-infektio.
Avakopaani ei vähennä solukalvoa tuhoavan kompleksin (C5b‑9) tai terminaalisen komplementtikompleksin (TCC) muodostumista. Avakopaanin kliinisen tutkimusohjelman aikana ei ole todettu yhtään Neisseria meningitidis ‑tapausta. Seuraa potilaita, jotka saavat hoitoa ANCA-vaskuliittiin, Neisseria-infektioiden oireiden ja löydösten varalta tavanomaisten käytäntöjen mukaisesti.
Pneumocystis jirovecii ‑keuhkokuumeen estohoito
Pneumocystis jirovecii ‑keuhkokuumeen estohoitoa suositellaan aikuisille GPA- tai MPA-potilaille avakopaanihoidon aikana tarpeen mukaan paikallisten kliinisten hoitokäytäntöjen mukaisesti.
Rokotukset
Elävien rokotteiden käytön turvallisuutta avakopaanihoidon jälkeen ei ole tutkittu.
Anna rokotukset mieluiten ennen avakopaanihoidon aloittamista tai sairauden inaktiivisessa vaiheessa.
Angioedeema
Avakopaanihoitoa saavilla potilailla on raportoitu angioedeemaa (ks. kohta Haittavaikutukset).
Potilaiden on kerrottava lääkärille kaikista angioedeemaan viittaavista oireista, joita voivat olla esimerkiksi kasvojen, huulten tai kielen turvotus, puristava tunne nielussa tai hengitysvaikeudet.
Avakopaanihoito on lopetettava, jos angioedeemaa esiintyy.
Yhteisvaikutukset voimakkaiden CYP3A4:n indusorien kanssa
Voimakkaiden CYP3A4-entsyymin indusorien (esim. karbamatsepiini, entsalutamidi, mitotaani, fenobarbitaali, fenytoiini, rifampisiini ja mäkikuisma) käyttämistä samanaikaisesti avakopaanin kanssa on vältettävä (ks. kohta Yhteisvaikutukset).
Avakopaanihoitoa ei saa antaa potilaille, joiden odotetaan tarvitsevan pitkäkestoista hoitoa näillä lääkevalmisteilla.
Jos lyhytkestoinen yhteiskäyttö on välttämätöntä potilaalla, joka käyttää jo avakopaania, potilasta on seurattava huolellisesti sairauden uudelleenaktivoitumisen varalta.
Sydänhäiriöt
GPA- ja MPA-potilailla on sydänhäiriöiden, kuten sydäninfarktin, sydämen vajaatoiminnan ja sydämen vaskuliitin riski.
Sydänhäiriöitä on raportoitu vakavina haittatapahtumina (SAE) avakopaanihoitoa saaneilla potilailla. Hoito-ohjelmaan, joka perustuu yhteiskäyttöön syklofosfamidin ja sen jälkeen atsatiopriinin kanssa, voi liittyä suurempi sydänhäiriöiden riski kuin hoito-ohjelmaan, joka perustuu yhteiskäyttöön rituksimabin kanssa.
Maligniteetit
Immuunijärjestelmään vaikuttavat lääkevalmisteet saattavat suurentaa maligniteettien riskiä. Kliinisiä tietoja on toistaiseksi saatavana vain vähän (ks. kohta Farmakodynamiikka).
Makrogoliglyserolihydroksistearaatti
Tämä lääkevalmiste sisältää makrogoliglyserolihydroksistearaattia, joka saattaa aiheuttaa vatsavaivoja ja ripulia.
Yhteisvaikutukset
Avakopaani on CYP3A4:n substraatti. Tämän entsyymin indusorien tai estäjien samanaikainen käyttö voi vaikuttaa avakopaanin farmakokinetiikkaan.
Voimakkaiden CYP3A4:n indusorien vaikutus avakopaaniin
Avakopaanin ja rifampisiinin (voimakas CYP3A4-entsyymin indusori) yhteiskäyttö pienensi avakopaanin pitoisuus-aikakäyrän alle jäävää aluetta (AUC) noin 93 % ja huippupitoisuutta plasmassa (Cmax) noin 79 %. Tämä yhteisvaikutus voi heikentää avakopaanin tehoa, joten voimakkaiden CYP3A4-entsyymin indusorien (esim. karbamatsepiini, entsalutamidi, mitotaani, fenobarbitaali, fenytoiini, rifampisiini ja mäkikuisma) käyttämistä samanaikaisesti avakopaanin kanssa on vältettävä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Avakopaanihoitoa ei saa antaa potilaille, joiden odotetaan tarvitsevan pitkäkestoista hoitoa näillä lääkevalmisteilla. Jos lyhytkestoinen yhteiskäyttö on välttämätöntä potilaalla, joka käyttää jo avakopaania, potilasta on seurattava huolellisesti sairauden uudelleenaktivoitumisen varalta.
Kohtalaisen voimakkaiden CYP3A4:n indusorien vaikutus avakopaaniin
Noudata varovaisuutta, jos määräät kohtalaisen voimakkaita CYP3A4:n indusoreja (esim. bosentaani, efavirentsi, etraviriini ja modafiniili) käytettäväksi samanaikaisesti avakopaanin kanssa, ja arvioi avakopaanihoidon hyöty-riskisuhde huolellisesti.
Voimakkaiden CYP3A4:n estäjien vaikutus avakopaaniin
Avakopaanin ja itrakonatsolin (voimakas CYP3A4-entsyymin estäjä) yhteiskäyttö suurensi avakopaanin AUC-arvon noin 2,2-kertaiseksi ja Cmax-arvon noin 1,9-kertaiseksi. Siksi voimakkaita CYP3A4-entsyymin estäjiä (esim. bosepreviiri, klaritromysiini, konivaptaani, indinaviiri, itrakonatsoli, ketokonatsoli, lopinaviiri/ritonaviiri, mibefradiili, nefatsodoni, nelfinaviiri, posakonatsoli, ritonaviiri, sakinaviiri, telapreviiri, telitromysiini ja vorikonatsoli) on käytettävä varoen potilailla, jotka saavat avakopaanihoitoa. Avakopaanialtistuksen suurenemisen takia potilaita on seurattava haittavaikutusten lisääntymisen varalta.
Greippi ja greippimehu voivat suurentaa avakopaanin pitoisuutta, joten avakopaanihoitoa saavien potilaiden on vältettävä greipin ja greippimehun nauttimista.
Avakopaanin vaikutukset muihin lääkevalmisteisiin
Avakopaani on kohtalaisen voimakas CYP3A4:n estäjä in vivo ja saattaa suurentaa altistusta plasmassa samanaikaisesti käytettäville lääkevalmisteille, jotka ovat CYP3A4:n substraatteja (esim. alfentaniili, siklosporiini, dihydroergotamiini, ergotamiini, fentanyyli, sirolimuusi ja takrolimuusi). Potilaita on hoidettava samanaikaisten lääkevalmisteiden valmisteyhteenvetojen mukaisesti. Annosten pienentäminen tai haittavaikutusten seuranta voi olla tarpeen.
Kliinisessä tutkimuksessa avakopaanin ja simvastatiinin, joka on herkkä CYP3A4-substraatti, samanaikainen käyttö lisäsi simvastatiinin systeemistä kokonaisaltistusta (AUC) 3,5-kertaiseksi ja Cmax-arvoa 3,2-kertaiseksi. Katso simvastatiinin valmisteyhteenvedosta asianmukaiset annoksen mukautukset.
Makrogoliglyserolihydroksistearaatin vaikutus herkkiin P-glykoproteiinin (P-gp) substraatteihin
Mahdollisuutta, että apuaineena käytetyllä makrogoliglyserolihydroksistearaatilla on kliinisesti merkittävä vaikutus herkkiin P-gp:n substraatteihin, joiden biologinen hyötyosuus on suhteellisen pieni (esim. dabigatraanieteksilaatti), ei voida poissulkea. Noudata varovaisuutta, jos käytät avakopaanihoitoa saaville potilaille P-gp:n substraatteja, joiden biologinen hyötyosuus on pieni.
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi / Raskaus
Ei ole olemassa tietoja avakopaanin käytöstä raskaana oleville naisille.
Eläinkokeissa on havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta).
Avakopaanin käyttöä ei suositella raskauden aikana eikä sellaisten naisten hoitoon, jotka voivat tulla raskaaksi ja jotka eivät käytä ehkäisyä.
Imetys
Avakopaania ei ole mitattu imettävien eläinten maidosta, mutta sitä on havaittu imettävien eläinten jälkeläisten plasmassa ilman havaittavia vaikutuksia jälkeläisiin (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vastasyntyneeseen/imeväiseen kohdistuvia riskejä ei voida poissulkea. On päätettävä, lopetetaanko rintaruokinta vai lopetetaanko avakopaanihoito ottaen huomioon rintaruokinnasta aiheutuvat hyödyt lapselle ja hoidosta koituvat hyödyt äidille.
Hedelmällisyys
Avakopaanin vaikutuksesta ihmisen hedelmällisyyteen ei ole tietoja. Eläinkokeissa ei havaittu urosten eikä naaraiden hedelmällisyyden heikentymistä (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Tavneos-valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Yleisimpiä haittavaikutuksia ovat pahoinvointi (23,5 %), päänsärky (20,5 %), valkosoluarvon pieneneminen (18,7 %), ylähengitystieinfektio (14,5 %), ripuli (15,1 %), oksentelu (15,1 %) ja nenänielutulehdus (15,1 %).
Yleisimpiä vakavia haittavaikutuksia ovat maksan toiminnan poikkeavuudet (5,4 %) ja keuhkokuume (4,8 %).
Haittavaikutustaulukko
ANCA-vaskuliittia koskeneessa vaiheen 3 avaintutkimuksessa ja markkinoille saattamisen jälkeen avakopaanihoitoa saaneilla potilailla todetut haittavaikutukset on lueteltu taulukossa 1 elinjärjestelmäluokan (SOC) ja yleisyyden perusteella.
Yleisyydet on määritelty seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100) ja tuntematon (koska saatavilla oleva tieto ei riitä esiintyvyyden arviointiin). Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Taulukko 1: Haittavaikutukset
| Elinjärjestelmäluokka | Hyvin yleinen (≥ 1/10) | Yleinen (≥ 1/100, < 1/10) | Melko harvinainen (≥ 1/1 000, < 1/100) | Tuntematon |
|---|---|---|---|---|
| Infektiot | Ylähengitystieinfektio Nenänielutulehdus
| Keuhkokuume Nuha Virtsatieinfektio Sinuiitti Bronkiitti Gastroenteriitti Alahengitystieinfektio Selluliitti Herpes zoster Influenssa Suun kandidiaasi Suun herpes Välikorvatulehdus | ||
| Veri ja imukudos | Neutropenia1 | |||
| Hermosto | Päänsärky | |||
| Ruoansulatuselimistö1 | Pahoinvointi Ripuli Oksentelu | Ylävatsakipu | ||
| Maksa ja sappi | Maksan toimintakoearvojen suureneminen1,2 | Lääkkeiden aiheuttama maksavaurio1, sappitiekato1 | ||
| Iho ja ihonalainen kudos | Angioedeema1 | |||
| Tutkimukset | Valkosoluarvon pieneneminen3 | Veren kreatiinifosfokinaasiarvon suureneminen1 |
1. Ks. kohta ”Valikoitujen haittavaikutusten kuvaus”.
2. Alaniiniaminotransferaasiarvon suureneminen, veren kokonaisbilirubiiniarvon suureneminen, poikkeava maksan toiminta, gammaglutamyylitransferaasiarvon suureneminen, maksaentsyymiarvojen suureneminen, transaminaasiarvojen suureneminen.
3. Mukaan lukien leukopenia.
Valikoitujen haittavaikutusten kuvaus
Maksatoksisuus
Vaiheen 3 avaintutkimuksessa, jossa hoitoa annettiin 330 potilaalle, 13,3 %:lla avakopaaniryhmän potilaista ja 11,6 %:lla prednisoniryhmän potilaista todettiin haittavaikutuksena maksan toimintakoearvojen suurenemista.
Vaiheen 3 tutkimuksen avakopaaniryhmässä ilmoitettiin maksan toimintakoearvojen suurenemista, ja siihen sisältyivät hepatiitti (1,2 %); kolestaattinen hepatiitti (0,6 %), jonka kohdalla yksi potilas ilmoitti diagnoosiksi sekä hepatiitin että kolestaattisen hepatiitin, maksasoluvaurio (0,6 %) yhdellä potilaalla, jolla todettiin oireeton hepatiitti; sytolyysi ja anikteerinen kolestaasi, johon ei liittynyt maksasolujen vajaatoimintaa.
Vaiheen 3 avaintutkimuksessa maksan ja sapen häiriöiksi luokiteltavat haittatapahtumat olivat yleisempiä potilailla, joiden hoito-ohjelma perustui yhteiskäyttöön syklofosfamidin ja sen jälkeen atsatiopriinin kanssa (10,2 %), kuin tutkittavilla, joiden hoito-ohjelma perustui yhteiskäyttöön rituksimabin kanssa (3,7 %).
Tutkimuslääkevalmisteen käyttö keskeytettiin tai lopetettiin pysyvästi maksan toimintakoearvojen suurenemisen takia 5,4 %:lla avakopaaniryhmän potilaista ja 3,0 %:lla prednisoniryhmän potilaista. Maksan toimintakoearvojen suurenemista raportoitiin vakavana haittavaikutuksena 5,4 %:lla avakopaaniryhmän potilaista ja 3,7 %:lla prednisoniryhmän potilaista. Kaikki vakavat maksatapahtumat korjaantuivat sen jälkeen, kun avakopaanihoito ja/tai muiden mahdollisesti maksatoksisten lääkevalmisteiden (kuten trimetopriimin ja sulfametoksatsolin) käyttö lopetettiin.
Markkinoille tulon jälkeen on raportoitu lääkkeen aiheuttamia maksavaurioita ja sappitiekatoa (vanishing bile duct syndrome, VBDS) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Neutropenia
Vaiheen 3 avaintutkimuksessa neutropeniaa raportoitiin 4 potilaalla (2,4 %:lla) kussakin hoitoryhmässä.
Sekä prednisoniryhmässä että avakopaaniryhmässä raportoitiin yksi agranulosytoositapaus.
Avakopaaniryhmän potilaalla todettiin luuydinbiopsiassa sentraalinen neutropenia, joka korjaantui itsestään ilman lisähoitoa.
Kreatiinifosfokinaasiarvon suureneminen
Vaiheen 3 avaintutkimuksessa kuudella (3,6 %) avakopaaniryhmän potilaista ja yhdellä (0,6 %) prednisoniryhmän potilaista todettiin haittavaikutuksena kreatiinifosfokinaasiarvon (CK) suurenemista.
Yliherkkyys, mukaan lukien angioedeema
Vaiheen 3 avaintutkimuksessa kahdella (1,2 %) avakopaaniryhmän potilaista todettiin haittavaikutuksena angioedeemaa. Yksi potilas tarvitsi tapahtuman vuoksi sairaalahoitoa. Avakopaanihoito tauotettiin, ja molemmat tapaukset korjaantuivat ilman jälkitiloja. Avakopaanihoito aloitettiin uudelleen yhdellä potilaalla, eikä angioedeema uusiutunut.
Ruoansulatuskanavan häiriöt
Vaiheen 3 avaintutkimuksessa ruoansulatuskanavan häiriöiksi luokiteltavia haittavaikutuksia todettiin 74,6 %:lla potilaista, joiden hoito-ohjelma perustui avakopaanin yhteiskäyttöön syklofosfamidin ja sen jälkeen atsatiopriinin kanssa, ja 53,3 %:lla tutkittavista, joiden hoito-ohjelma perustui yhteiskäyttöön rituksimabin kanssa.
Erityisryhmät
Pediatriset potilaat
Vaiheen 3 tutkimuksessa tutkittiin yhteensä kolmea nuorta, joista yksi oli mukana prednisoniryhmässä ja kaksi avakopaaniryhmässä. Tietoja alle 12 vuoden ikäisistä lapsista ei ole (ks. kohta Farmakodynamiikka).
Iäkkäät potilaat
Turvallisuusprofiili oli kliinisissä tutkimuksissa samankaltainen ≥ 65‑vuotiailla potilailla ja < 65‑vuotiailla aikuispotilailla.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Avakopaanitutkimuksissa terveille tutkittaville annettiin enintään 200 mg:n kokonaisvuorokausiannoksia (100 mg kahdesti vuorokaudessa) 7 vuorokauden ajan ilman näyttöä annosta rajoittavasta toksisuudesta. Yliannostustapauksessa suositellaan potilaan seurantaa haittavaikutusten oireiden tai löydösten varalta ja asiamukaisen oireenmukaisen hoidon ja tukihoidon antamista.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Komplementin estäjät, ATC-koodi: L04AJ05
Vaikutusmekanismi
Avakopaani on ihmisen komplementti 5a ‑reseptorin (C5aR1 tai CD88) selektiivinen salpaaja, joka estää kilpailevasti C5aR1:n ja anafylatoksiini C5a:n välistä yhteisvaikutusta.
Avakopaanin aikaansaama spesifinen ja selektiivinen C5aR1:n salpaus vähentää C5a:n tulehdusta edistäviä vaikutuksia, kuten neutrofiilien aktivaatiota, migraatiota ja kiinnittymistä pienten verisuonten tulehduskohtiin, verisuonten endoteelisolujen vetäytymistä ja läpäisevyyttä.
Farmakodynaamiset vaikutukset
Avakopaani salpaa C5a:n indusoimaa CD11b:n (integriini alfa‑M) tehostussäätelyä avakopaania saaneiden ihmisten neutrofiileissä. CD11b helpottaa neutrofiilien kiinnittymistä verisuonten endoteelin pintaan, joka on yksi vaskuliitin tautiprosessin vaiheista.
Kliininen teho ja turvallisuus
Aktiivista vertailuvalmistetta hyödyntäneessä, satunnaistetussa, kaksoissokkoutetussa, kahdella lumelääkkeellä toteutetussa vaiheen 3 avain- ja monikeskustutkimuksessa (ADVOCATE) hoitoa annettiin 52 viikon ajan yhteensä 330 potilaalle, jotka olivat vähintään 13‑vuotiaita ja sairastivat granulomatoottista polyangiittia (GPA) (54,8 %) tai mikroskooppista polyangiittia (MPA) (45,2 %).
ADVOCATE-tutkimuksen tutkimusasetelma on esitetty kuvassa 1.
Kuva 1: ADVOCATE-tutkimuksen tutkimusasetelma
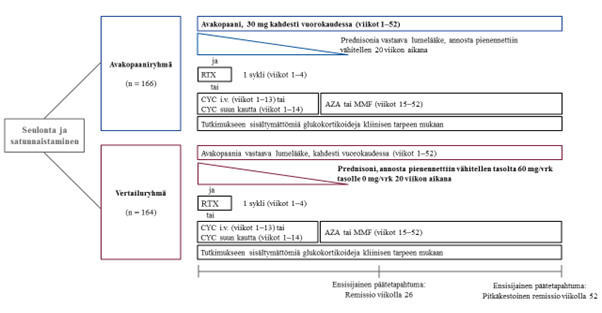
AZA = atsatiopriini; CYC = syklofosfamidi; i.v. = laskimoon; MMF = mykofenolaattimofetiili; RTX = rituksimabi
Potilaat satunnaistettiin hoitoryhmiin suhteessa 1:1:
- Avakopaaniryhmä (N = 166): potilaat saivat 30 mg avakopaania kahdesti vuorokaudessa 52 viikon ajan sekä prednisonia vastaavaa lumelääkettä, jonka annosta pienennettiin vähitellen 20 viikon aikana.
- Vertailuryhmä (N = 164): Potilaat saivat avakopaania vastaavaa lumelääkettä kahdesti vuorokaudessa 52 viikon ajan sekä prednisonia (annosta pienennettiin vähitellen tasolta 60 mg/vrk tasolle 0 mg/vrk 20 viikon aikana).
Molempien ryhmien kaikki potilaat saivat tavanomaista immunosuppressiivista hoitoa eli joko:
- rituksimabia laskimoon annoksena 375 mg/m² kerran viikossa 4 viikon ajan tai
- syklofosfamidia laskimoon 13 viikon ajan (15 mg/kg mutta enintään 1,2 g 2–3 viikon välein), ja sen jälkeen viikosta 15 alkaen atsatiopriinia suun kautta annoksena 1 mg/kg vuorokaudessa, joka titrattiin tasolle 2 mg/kg vuorokaudessa (Atsatiopriinin sijasta voitiin käyttää mykofenolaattimofetiilia annoksena 2 g vuorokaudessa. Jos potilas ei sietänyt mykofenolaattimofetiilia tai sitä ei ollut saatavilla, voitiin käyttää enteropäällysteistä mykofenolaattinatriumia tavoiteannoksena 1 440 mg/vrk.) tai
- syklofosfamidia suun kautta 14 viikon ajan (2 mg/kg vuorokaudessa), ja sen jälkeen atsatiopriinia tai mykofenolaattimofetiilia/-natriumia suun kautta viikosta 15 alkaen (sama hoito‑ohjelma kuin laskimoon annettavalla syklofosfamidilla).
Ensimmäisen rituksimabi-infuusion yhteydessä annettiin 100 mg metyyliprednisolonia tai vastaavaa ennen rituksimabi-infuusion aloittamista. Glukokortikoidien antaminen esilääkityksenä oli sallittua toisen, kolmannen ja neljännen rituksimabi-infuusion yhteydessä.
Syklofosfamidin, atsatiopriinin ja mykofenolaatin annosten pienentäminen tai säätäminen sallittiin sen varmistamiseksi, että näiden lääkevalmisteiden käytön turvallisuus voitiin maksimoida tavanomaisin keinoin.
Tutkimuksessa käytettiin seuraavaa glukokortikoidiannoksen pienentämisaikataulua (taulukko 2).
Taulukko 2: Glukokortikoidiannoksen pienentämisaikataulu – prednisoniannos (mg/vrk)
| Tutkimuksen päivä | Avakopaani | Vertailuvalmiste | |
| Kaikki | ≥ 55 kg | < 55 kg | |
| 1–7 | 0 | 60 | 45 |
| 8–14 | 0 | 45 | 45 |
| 15–21 | 0 | 30 | 30 |
| 22–42 | 0 | 25 | 25 |
| 43–56 | 0 | 20 | 20 |
| 57–70 | 0 | 15 | 15 |
| 71–98 | 0 | 10 | 10 |
| 99–140 | 0 | 5 | 5 |
| ≥ 141 | 0 | 0 | 0 |
Tutkimukseen sisältymättömien glukokortikoidien käyttöä tuli välttää mahdollisimman paljon tutkimuksen aikana, paitsi jos glukokortikoidit olivat ehdottoman välttämättömiä jonkin niitä vaativan sairauden (kuten lisämunuaisen vajaatoiminnan) hoitoon. Potilaille, joiden ANCA-vaskuliitti paheni tai uusiutui tutkimuksen aikana, voitiin kuitenkin antaa kestoltaan rajattu glukokortikoidikuuri.
Jotta hoitoryhmät olisivat tasapainossa, potilaat ositettiin satunnaistamisvaiheessa 3 tekijän perusteella:
- äskettäin diagnosoitu tai uusiutunut ANCA-vaskuliitti
- proteinaasi 3 (PR3) ‑positiivinen tai myeloperoksidaasi (MPO) -positiivinen ANCA-vaskuliitti
- saa joko rituksimabia laskimoon, syklofosfamidia laskimoon tai syklofosfamidia suun kautta.
Hoitoryhmät olivat keskenään hyvin tasapainossa lähtötilanteen demografisten tietojen ja sairauden ominaispiirteiden osalta (taulukko 3).
Taulukko 3: Valikoidut lähtötilanteen ominaisuudet vaiheen 3 ADVOCATE-avaintutkimuksessa (hoitoaikeen mukainen populaatio)
| Demografiset tiedot | Avakopaani (N = 166) | Vertailuvalmiste (N = 164) |
| Ikä seulontavaiheessa | ||
| Keskiarvo (SD), vuotta | 61 (14,6) | 61 (14,5) |
| Vaihteluväli, vuotta | 13–83 | 15–88 |
| ANCA-vaskuliitin tila, n (%) | ||
| Äskettäin diagnosoitu | 115 (69,3) | 114 (69,5) |
| Uusiutunut | 51 (30,7) | 50 (30,5) |
| ANCA-positiivisuus, n (%) | ||
| PR3 | 72 (43,4) | 70 (42,7) |
| MPO | 94 (56,6) | 94 (57,3) |
| ANCA-vaskuliitin tyyppi, n (%) | ||
| Granulomatoottinen polyangiitti (GPA) | 91 (54,8) | 90 (54,9) |
| Mikroskooppinen polyangiitti (MPA) | 75 (45,2) | 74 (45,1) |
| BVAS-pisteet | ||
| Keskiarvo (SD) | 16,3 (5,87) | 16,2 (5,69) |
| eGFR | ||
| Keskiarvo (SD), ml/min/1,73 m2 | 50,7 (30,96) | 52,9 (32,67) |
| Aiempi glukokortikoidien käyttö (seulonnan aikana) | ||
| n (%) | 125 (75,3) | 135 (82,3) |
| Keskiarvo (SD), prednisoniekvivalentti annos (mg) | 907 (1 145,9) | 978 (1 157,5) |
ANCA = neutrofiilien sytoplasma‑autovasta-aine; BVAS = Birmingham Vasculitis Activity Score; MPO = myeloperoksidaasi; PR3 = proteinaasi 3, SD = keskihajonta
Tutkimuksen tavoitteena oli selvittää, onko avakopaani tehokas hoito ANCA-vaskuliittia sairastaville potilaille siten, että glukokortikoidien käyttöä voidaan samalla vähentää turvallisuuden tai tehon vaarantumatta.
Ensisijaisena tavoitteena oli arvioida edellä kuvattujen hoito-ohjelmien tehoa remission saavuttamisessa ja ylläpidossa ANCA-vaskuliittia sairastavilla potilailla seuraavien kahden ensisijaisen päätetapahtuman perusteella:
- niiden potilaiden osuus, joiden sairaus on remissiossa eli jotka ovat saavuttaneet Birmingham Vasculitis Activity Score (BVAS) ‑pistearvon 0 ja jotka eivät käytä glukokortikoideja ANCA-vaskuliitin hoitoon viikkoa 26 edeltävien 4 viikon aikana
- niiden potilaiden osuus, jotka ovat saavuttaneet pitkäkestoisen remission eli joiden sairaus on pysynyt remissiossa viikosta 26 viikkoon 52 ilman relapsia ja joiden BVAS-pistearvo on 0 ja jotka eivät käytä glukokortikoideja ANCA-vaskuliitin hoitoon viikkoa 52 edeltävien 4 viikon aikana.
Nämä kaksi ensisijaista päätetapahtumaa testattiin sekventiaalisesti yhdenvertaisuuden ja paremmuuden suhteen gatekeeping-menettelyllä, jotta tyypin I virhe pysyi tasolla 0,05.
Tutkimuksen tulokset on esitetty taulukossa 4.
Taulukko 4: Remissio viikolla 26 ja pitkäkestoinen remissio viikolla 52 vaiheen 3 ADVOCATE-avaintutkimuksessa (hoitoaikeen mukainen populaatio)
Avakopaani N = 166 n (%) | Vertailuvalmiste N = 164 n (%) | Arvioitu hoitoero, %a | |
| Remissio viikolla 26 | 120 (72,3) | 115 (70,1) | 3,4 |
| 95 %:n lv | 64,8; 78,9 | 62,5; 77,0 | −6,0; 12,8 |
| Pitkäkestoinen remissio viikolla 52 | 109 (65,7) | 90 (54,9) | 12,5b |
| 95 %:n lv | 57,9; 72,8 | 46,9; 62,6 | 2,6; 22,3 |
lv = luottamusväli
a Kaksitahoiset 95 %:n luottamusvälit lasketaan korjaamalla tiedot satunnaistamisen ositustekijöiden suhteen.
b Paremmuuden p-arvo = 0,013 (kaksitahoinen)
Todettu teho oli johdonmukainen olennaisissa alaryhmissä, joita olivat äskettäin diagnosoitua tautia ja uusiutunutta tautia sairastavat potilaat, PR3-positiivinen ja MPO-positiivinen ANCA, GPA ja MPA, sekä miehet ja naiset. Tehotulokset taustahoidon mukaan on esitetty taulukossa 5.
Taulukko 5: Remissio viikolla 26 ja pitkäkestoinen remissio viikolla 52 vaiheen 3 ADVOCATE-avaintutkimuksessa taustahoidon mukaan (hoitoaikeen mukainen populaatio)
Avakopaani n/N (%) | Vertailuvalmiste n/N (%) | Prosentuaalinen ero, 95 %:n lva | |
| Remissio viikolla 26 | |||
| Potilaat, jotka saivat rituksimabia laskimoon | 83/107 (77,6) | 81/107 (75,7) | 1,9 (−9,5; 13,2) |
| Potilaat, jotka saivat syklofosfamidia laskimoon tai suun kautta | 37/59 (62,7) | 34/57 (59,6) | 3,1 (−14,7; 20,8) |
| Pitkäkestoinen remissio viikolla 52 | |||
| Potilaat, jotka saivat rituksimabia laskimoon | 76/107 (71,0) | 60/107 (56,1) | 15,0 (2,2; 27,7) |
| Potilaat, jotka saivat syklofosfamidia laskimoon tai suun kautta | 33/59 (55,9) | 30/57 (52,6) | 3,3 (−14,8; 21,4) |
a Kaksitahoiset 95 %:n luottamusvälit (lv) lasketaan suhteiden erolle (avakopaani miinus vertailuvalmiste) Waldin menetelmällä.
Glukokortikoiditoksisuus
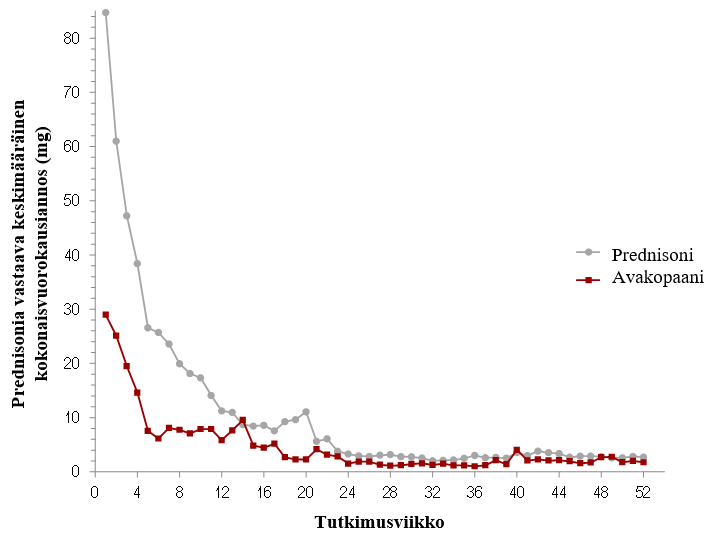
Vaiheen 3 ADVOCATE-avaintutkimuksessa prednisoniekvivalentin keskimääräinen kumulatiivinen kokonaisannos päivän 1 ja hoidon päättymisen välisenä aikana oli vertailuryhmässä noin 2,3‑kertaisesti suurempi kuin
avakopaaniryhmässä (3 846,9 mg vs. 1 675,5 mg).
Avakopaania käyttäneistä potilaista 86,1 % sai tutkimukseen kuulumattomia glukokortikoideja lähtötilanteesta viikolle 26. Vertailuryhmässä glukokortikoidien käyttö johtui pääasiassa tutkimussuunnitelman mukaisesta prednisonikuurista.
Kuva 2: Prednisonia vastaava glukokortikoidien keskimääräinen kokonaisvuorokausiannos (mg) potilasta kohti tutkimusviikon mukaan hoitoryhmittäin ADVOCATE-tutkimuksessa (hoitoaikeen mukainen populaatio)
Glukokortikoiditoksisuusindeksillä (GTI) arvioidaan glukokortikoideihin liittyvää sairastavuutta, ja siihen sisältyvät seuraavat mittaukset: painoindeksi, glukoosinsieto, lipidit, steroidimyopatia, ihotoksisuus, neuropsykiatrinen toksisuus ja infektiot. Suurempi GTI-arvo tarkoittaa suurempaa glukokortikoiditoksisuutta. GTI-arvoon sisältyy kumulatiivisen pahenemisen pistearvo (CWS), joka mittaa kumulatiivista toksisuutta ajan kuluessa, sekä kohentumisen kokonaispistearvo (AIS), joka mittaa sekä toksisuuden lievittymistä että pahenemista ajan kuluessa.
Yhteenveto GTI-arvoista (CWS ja AIS) avakopaaniryhmässä verrattuna vertailuryhmään on esitetty taulukossa 6. GTI-mittaukset olivat tutkimuksen toissijaisia päätetapahtumia, eikä niitä kontrolloitu multiplisiteetin suhteen.
Taulukko 6: Glukokortikoiditoksisuusindeksin tulokset vaiheen 3 ADVOCATE-avaintutkimuksessa (hoitoaikeen mukainen populaatio)
Avakopaani N = 166 | Vertailuvalmiste N = 164 | Ryhmien välinen ero, 95 %:n lv | ||
| Kumulatiivisen pahenemisen pisteet (CWS) | ||||
| Viikko 13 (pienimmän neliösumman keskiarvo) | 25,7 | 36,6 | −11,0 (−19,7; −2,2) | |
| Viikko 26 (pienimmän neliösumman keskiarvo) | 39,7 | 56,6 | −16,8 (−25,6; −8,0) | |
| Kohentumisen kokonaispisteet (AIS) | ||||
| Viikko 13 (pienimmän neliösumman keskiarvo) | 9,9 | 23,2 | −13,3 (−22,2; −4,4) | |
| Viikko 26 (pienimmän neliösumman keskiarvo) | 11,2 | 23,4 | −12,1 (−21,1; −3,2) | |
Pediatriset potilaat
Vaiheen 3 ADVOCATE-avaintutkimuksessa tutkittiin yhteensä kolmea nuorta: kaksi oli mukana avakopaaniryhmässä ja yksi vertailuryhmässä. Toinen avakopaaniryhmän nuorista keskeytti hoidon munuaisvaskuliitin pahenemisen takia. Toinen avakopaania saanut nuori potilas suoritti hoidon loppuun ja saavutti viikolla 26 remission, joka säilyi viikolle 52.
Vertailuryhmässä mukana olleen nuoren hoito keskeytyi ehkäisyvaatimusten noudattamatta jättämisen takia.
Euroopan lääkevirasto on myöntänyt lykkäyksen velvoitteelle toimittaa tutkimustulokset avakopaanin käytöstä ANCA-vaskuliitin hoidossa yhdessä tai useammassa pediatrisessa potilasryhmässä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Imeytyminen
Kun avakopaani otetaan ilman ruokaa, sen huippupitoisuus plasmassa (Cmax) saavutetaan noin 2 tunnin mediaaniajassa (tmax). Avakopaanin systeemisen altistuksen on todettu suurentuvan suurin piirtein annosriippuvaisesti annosalueella 10–30 mg.
Kun 30 mg kapselimuotoista avakopaania annetaan yhdessä runsaasti rasvaa ja energiaa sisältävän aterian kanssa, plasman avakopaanialtistus (AUC) suurenee noin 72 % ja tmax viivästyy noin 3 tunnilla, mutta Cmax ei muutu.
Jakautuminen
Avakopaani ja M1-metaboliitti sitoutuvat plasman proteiineihin (esim. albumiiniin ja happamaan α‑1-glykoproteiiniin) palautuvasti ja yli 99,9‑prosenttisesti. Näennäinen jakautumistilavuus on suuri (Vz/F 3 000–11 000 l), mikä osoittaa vaikuttavan aineen jakautuvan kudoksiin laajalti.
Biotransformaatio
Avakopaani eliminoituu pääasiassa ensivaiheen metabolian kautta. Kun radioaktiivisesti merkittyä avakopaania annettiin suun kautta, pääosa vaikuttavaan aineeseen liittyvistä aineista erittyi ulosteeseen ensivaiheen metaboliitteina. Kaikista plasmassa todetuista vaikuttavaan aineeseen liittyvistä aineista noin 12 % oli verenkierrossa olevaa päämetaboliittia (M1), joka on avakopaanin monohydroksyloitunut aineenvaihduntatuote. Tämä metaboliitti muodostaa altistuksesta kanta‑aineelle 30–50‑prosenttia, ja sen vaikutus C5aR1:een on suurin piirtein samaa luokkaa kuin avakopaanin. Sytokromi P450 (CYP) 3A4 on tärkein avakopaanin puhdistumasta ja M1-metaboliitin muodostumisesta ja puhdistumasta vastaava entsyymi.
Avacopanin kliininen yhteisvaikutus herkän CYP3A4-substraatin simvastatiinin kanssa on kuvattu kohdassa Yhteisvaikutukset. Avakopaani on heikko CYP2C9:n estäjä, sillä se suurentaa hieman koelääkkeenä käytetyn vaikuttavan aineen selekoksidin AUC-arvoa (1,15-kertaiseksi).
Avakopaani ei estä muita CYP-entsyymejä eikä indusoi CYP-entsyymejä in vitro.
Avakopaani esti yleisiä kuljettajaproteiineja vain vähän tai ei lainkaan in vitro. Siksi kliinisesti merkitykselliset yhteisvaikutukset ovat epätodennäköisiä, kun avokopaania annetaan samanaikaisesti sellaisten lääkeaineiden kanssa, jotka ovat näiden kuljettajaproteiinien substraatteja tai estäjiä.
Eliminaatio
Populaatiofarmakokineettisen analyysin perusteella avakopaanin näennäinen kokonaispuhdistuma (CL/F) on 16,3 l/h (95 %:n lv: 13,1–21,1 l/h). Populaatiofarmakokineettisen analyysin perusteella terminaalisen eliminaation puoliintumisajan mediaani on 510 tuntia (21 vuorokautta). Kun avakopaanin käyttö lopetetaan vakaan tilan saavuttamisen jälkeen, avakopaanin jäännöspitoisuuden plasmassa odotetaan pienenevän noin 20 %:iin, < 10 %:iin ja < 5 %:iin vakaan tilan enimmäispitoisuudesta, kun viimeisestä annoksesta on kulunut noin 4 viikkoa, 7 viikkoa ja 10 viikkoa.
Kun radioaktiivisesti merkittyä avakopaania annettiin suun kautta, 77 % radioaktiivisuudesta erittyi ulosteeseen ja 10 % virtsaan, ja 7 % radioaktiivisesta annoksesta erittyi muuttumattomana avakopaanina ulosteeseen ja < 0,1 % virtsaan. Nämä tulokset viittaavat siihen, että avakopaanin pääasiallinen puhdistumareitti on metaboloituminen, jonka jälkeen metaboliitit erittyvät sapen kautta ulosteeseen, ja että avakopaanin erittyminen suoraan virtsaan tai ulosteeseen sapen kautta on hyvin vähäistä.
Erityisryhmät
Iäkkäät
Populaatiofarmakokineettisessä analyysissa iän (aikuisilla) ei todettu vaikuttavan merkittävästi plasman avakopaanialtistukseen. Kliinisistä tutkimuksista on kuitenkin saatu vain vähän farmakokineettistä tietoa yli 75‑vuotiaista potilaista. Annosta ei tarvitse muuttaa iäkkäille potilaille (ks. kohta Annostus ja antotapa).
Maksan vajaatoiminta
Avakopaanin farmakokineettisiä ominaisuuksia on tutkittu 16 potilaalla, joilla oli lievä (Child–Pugh-luokka A) tai keskivaikea (Child–Pugh-luokka B) maksan vajaatoiminta. Normaaleihin verrokkeihin nähden avakopaanin tai sen M1-päämetaboliitin altistuksessa (Cmax-arvon ja AUC-arvon keskimääräinen suhde ≤ 1,3) ei todettu mitään farmakologisesti merkityksellisiä eroja, joten annoksen muuttaminen ei ole tarpeen (ks. kohta Annostus ja antotapa).
Avakopaania ei ole tutkittu vaikeaa maksan vajaatoimintaa (Child–Pugh-luokka C) sairastavilla potilailla (ks. kohta Annostus ja antotapa).
Munuaisten vajaatoiminta
Populaatiofarmakokineettisen analyysin perustella plasman avakopaanialtistus on samaa luokkaa munuaisten vajaatoimintapotilailla ja terveillä tutkittavilla. Siksi annosta ei tarvitse muuttaa munuaistoiminnan perusteella (ks. kohta Annostus ja antotapa).
Avakopaania ei ole tutkittu ANCA-vaskuliittia sairastavilla potilailla, joiden eGFR on alle 15 ml/min/1,73 m² ja jotka joko saavat dialyysihoitoa tai tarvitsevat dialyysihoitoa tai plasmanvaihtoa.
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta, genotoksisuutta ja karsinogeenisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Hedelmällisyys ja varhaisvaiheen alkionkehitys
Avakopaani ei vaikuttanut uros- eikä naarashamsterien lisääntymistoimintoihin (hedelmällisyyteen) eikä varhaisvaiheen kehitykseen, kun suun kautta annetut annokset olivat enintään 6,8‑kertaisia kliiniseen AUC-arvoon nähden.
Alkion- ja sikiönkehitys
Avakopaani ei ollut teratogeeninen, kun sitä annettiin suun kautta hamstereille ja kaniineille. Hamstereilla todettiin luustomuutosten (lyhyt ylimääräinen torakolumbaalinen kylkiluu) ilmaantuvuuden suurenemista altistuksella, joka oli 5,3‑kertainen kliiniseen AUC-arvoon nähden. Kaniineilla avakopaani oli toksinen emoille (haitallisia kliinisiä löydöksiä ja keskenmenoja) mutta ei sikiöille, kun altistus oli 0,6‑kertainen kliiniseen AUC-arvoon nähden.
Pre- ja postnataalinen kehitys
Avakopaani ei aiheuttanut hamsterien naaraspuolisille jälkeläisille haittavaikutuksia altistuksilla, jotka olivat enintään 6,3‑kertaisia kliiniseen AUC-arvoon nähden, kun sitä annettiin hamstereille tiineyden aikana ja imetysaikana vieroitukseen saakka. Uroksilla todettiin esinahan eriytymisen lievää viivästymistä altistuksilla, jotka olivat 3,7‑kertaisia kliiniseen AUC-arvoon nähden. Tämän yksittäisen löydöksen toksikologisen merkityksen katsottiin olevan vähäinen, eikä siihen liittynyt lisääntymistoimintojen heikentymistä.
Plasman avakopaanipitoisuuksien analyyseissa avakopaania havaittiin imettävien emojen ja imetettävien poikasten plasmassa, mikä viittaa siihen, että avakopaani todennäköisesti erittyy imettävien hamsterien maitoon.
Karsinogeenisuus
Avakopaanin karsinogeenisuutta arvioitiin 2 vuoden pituisessa tutkimuksessa sekä rotilla että hamstereilla.
Avakopaania saaneilla urosrotilla todettiin kilpirauhasen C‑soluadenoomien ilmaantuvuuden lievää suurenemista, mutta se ei ollut tilastollisesti merkitsevää ja ilmaantuvuus pysyi historiallisella viitealueella. Avakopaani ei ollut karsinogeeninen hamsterilla, joka on farmakologisesti merkityksellinen laji.
Farmaseuttiset tiedot
Apuaineet
Kapselin sisältö
Makrogoliglyserolihydroksistearaatti
Makrogoli (4000)
Kapselin kuori
Liivate
Punainen rautaoksidi (E172)
Keltainen rautaoksidi (E172)
Titaanidioksidi (E171)
Polysorbaatti 80
Painomuste
Musta rautaoksidi (E172)
Shellakka
Kaliumhydroksidi
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
4 vuotta
Säilytys
Tämä lääkevalmiste ei vaadi lämpötilan suhteen erityisiä säilytysolosuhteita. Säilytä alkuperäispurkissa. Herkkä valolle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
TAVNEOS kapseli, kova
10 mg (L:ei) 180 kpl (6153,35 €)
PF-selosteen tieto
HDPE‑purkki, jossa on turvasuljin ja induktiosinetti.
Pakkauskoot: 30 tai 180 kovaa kapselia tai monipakkaus, jossa 540 kovaa kapselia (3 pakkausta, joissa 180).
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Kapseli, jossa on keltainen runko-osa ja vaaleanoranssi yläosa ja johon on painettu mustalla musteella ”CCX168”.
Kapselin pituus on 22 mm ja halkaisija 8 mm (koko 0).
Käyttö- ja käsittelyohjeet
Ei erityisvaatimuksia.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
TAVNEOS kapseli, kova
10 mg 180 kpl
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Avakopaani: Aikuisten vaikean aktiivisen granulomatoottisen polyangiitin (GPA) tai mikroskooppisen polyangiitin (MPA) hoito yhdessä rituksimabia tai syklofosfamidia sisältävän hoito-ohjelman kanssa erityisin edellytyksin (3084).
ATC-koodi
L04AJ05
Valmisteyhteenvedon muuttamispäivämäärä
15.01.2025
Yhteystiedot
Gustav III:s Boulevard 46
SE-169 73 Solna
Sverige
+46 8 558 066 00
www.viforpharma.se
Info.nordic@viforpharma.com
