ROCLANDA silmätipat, liuos 50 mikrog/ml+200 mikrog/ml
Vaikuttavat aineet ja niiden määrät
Yksi ml liuosta sisältää 50 mikrogrammaa latanoprostia ja 200 mikrogrammaa netarsudiilia (mesylaattina).
Apuaine, jonka vaikutus tunnetaan
Yksi ml liuosta sisältää 200 mikrogrammaa bentsalkoniumkloridia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Silmätipat, liuos (silmätipat).
Kliiniset tiedot
Käyttöaiheet
Roclanda on tarkoitettu kohonneen silmänpaineen alentamiseen primaarista avokulmaglaukoomaa tai okulaarista hypertensiota sairastaville aikuispotilaille, joilla prostaglandiini- tai netarsudiilimonoterapia ei alenna kohonnutta silmänpainetta riittävästi.
Ehto
Hoidon saavat aloittaa valmisteyhteenvedossa mainittuun indikaatioon perehtyneet lääkärit.
Annostus ja antotapa
Roclanda-hoidon saa aloittaa vain silmälääkäri tai silmätauteihin erikoistunut terveydenhuollon ammattilainen.
Annostus
Suositeltu annos on yksi tippa hoidettavaan silmään / hoidettaviin silmiin kerran vuorokaudessa iltaisin. Potilaan ei pidä tiputtaa yhtä tippaa enempää hoidettavaan silmään / hoidettaviin silmiin päivässä.
Jos yksi annos jää väliin, hoitoa on jatkettava seuraavalla annoksella illalla.
Pediatriset potilaat
Roclanda-valmisteen turvallisuutta ja tehoa alle 18 vuoden ikäisten lasten hoidossa ei ole varmistettu.
Tietoja ei ole saatavilla.
Antotapa
Silmän pinnalle.
Tiedot latanoprosti + netarsudiili -yhdistelmään liittyvistä mahdollisista yhteisvaikutuksista on annettu kohdassa Yhteisvaikutukset. Jos latanoprosti + netarsudiilia käytetään samanaikaisesti muiden paikallisesti käytettävien silmälääkevalmisteiden kanssa, lääkevalmisteiden annon välillä on oltava vähintään viisi minuuttia. Netarsudiilin vasodilatoivien ominaisuuksien takia muut silmätipat on annettava ennen latanoprosti + netarsudiilia. Silmävoiteet annostellaan viimeiseksi.
Piilolinssit on otettava pois silmistä ennen latanoprosti + netarsudiilin tiputusta, ja ne voidaan laittaa takaisin 15 minuutin kuluttua annostelusta (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Kuten kaikkia silmätippoja käytettäessä, mahdollisen systeemisen imeytymisen vähentämiseksi on suositeltavaa painaa kyynelpussia mediaalisessa silmäkulmassa (kyynelkanavan sulkeminen) yhden minuutin ajan. Tämä tehdään välittömästi kunkin tipan tiputuksen jälkeen.
Silmätippapullon kärjen koskettamista silmään, ympäröiviin rakenteisiin, sormiin tai muihin pintoihin on vältettävä liuoksen kontaminoitumisen välttämiseksi. Kontaminoituneen liuoksen käyttö saattaa aiheuttaa vakavan silmävaurion ja sen seurauksena näönmenetyksen.
Vasta-aiheet
Yliherkkyys vaikuttaville aineille tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Värikalvon pigmentoituminen
Latanoprosti saattaa vähitellen muuttaa silmien väriä lisäämällä ruskean pigmentin määrää värikalvossa. Potilaille on ennen hoidon aloittamista kerrottava, että pysyvä silmien värin muutos on mahdollinen. Toispuoleinen hoito voi aiheuttaa pysyvän silmien erivärisyyden.
Lisääntyneellä värikalvon pigmentaatiolla ei ole osoitettu olevan negatiivisia kliinisiä jälkiseurauksia, ja hoitoa latanoprostia sisältävillä lääkevalmisteilla voidaan jatkaa, jos pigmentoitumista ilmenee. Potilaita on kuitenkin seurattava säännöllisesti, ja jos kliininen tilanne niin edellyttää, hoito latanoprostia sisältävillä lääkevalmisteilla voidaan lopettaa.
Herpeskeratiitti
Latanoprostia sisältäviä lääkevalmisteita on käytettävä varoen potilaille, joilla on aiemmin ollut herpeskeratiitti, ja niitä ei pidä käyttää potilaille, joilla on aktiivinen herpeskeratiitti tai joilla on ollut prostaglandiinianalogeihin liittyviä toistuvia herpeskeratiitteja.
Makulaturvotuksen riski
Latanoprostia sisältäviin lääkevalmisteisiin liittyvää makulaturvotusta on raportoitu pääasiassa afakiapotilailla, pseudoafakiapotilailla, joilla on mykiönkotelon takaosan repeämä tai silmän etukammion tekomykiö, ja potilailla, joilla on rakkulaisen makulaturvotuksen tunnettuja riskitekijöitä (kuten diabeettinen retinopatia tai verkkokalvon laskimotukos). Latanoprostia sisältäviä lääkevalmisteita on käytettävä varoen afakiapotilaille, pseudoafakiapotilaille, joilla on mykiönkotelon takaosan repeämä tai silmän etukammion tekomykiö, ja potilaille, joilla on rakkulaisen makulaturvotuksen tunnettuja riskitekijöitä.
Värikalvotulehduksen / suonikalvoston tulehduksen riski
Latanoprostia sisältäviä lääkevalmisteita voidaan käyttää varoen potilaille, joilla on tunnettuja värikalvotulehdukselle / suonikalvoston tulehdukselle altistavia riskitekijöitä.
Astman pahentuminen
Latanoprostin käytöstä astmaa sairastaville potilaille on niukasti tietoa, mutta markkinoille tulon jälkeen on raportoitu muutamia tapauksia, joissa potilaan astma on pahentunut ja/tai potilaalla on esiintynyt hengenahdistusta. Astmapotilaita on siksi hoidettava varoen, kunnes yhdistelmästä on saatu riittävästi kokemusta.
Periorbitaalinen ihon värjäytyminen
Periorbitaalista ihon värjäytymistä on havaittu latanoprostia sisältävien lääkevalmisteiden käytön aikana. Suurin osa raporteista on koskenut japanilaisia potilaita. Tähänastisen kokemuksen perusteella periorbitaalinen ihon värjäytyminen ei ole pysyvää, ja joissain tapauksissa se on hävinnyt latanoprostihoitoa jatkettaessa.
Silmäripsien muutokset
Hoito latanoprostia sisältävillä lääkevalmisteilla saattaa vähitellen aiheuttaa muutoksia silmäripsissä sekä hoidettavan silmän ja sitä ympäröivän alueen velluskarvoituksessa. Muutoksiin kuuluvat ripsien tai vellusten pituuden, paksuuden, pigmentaation ja määrän lisääntyminen sekä silmäripsien kasvusuunnan muuttuminen. Silmäripsien muutokset korjautuvat, kun hoito lopetetaan.
Retikulaarinen epiteliaalinen sarveiskalvon turvotus
Retikulaarista epiteliaalista sarveiskalvon turvotusta (reticular epithelial corneal edema, RECE) on raportoitu netarsudiilia sisältävien lääkevalmisteiden annon jälkeen, etenkin potilailla, joilla on ennestään ollut olemassa sarveiskalvon turvotusta tai joille on aiemmin tehty silmäleikkaus. Retikulaarinen epiteliaalinen sarveiskalvon turvotus häviää tyypillisesti netarsudiilia sisältävien lääkevalmisteiden käytön lopettamisen myötä. Potilasta on kehotettava ilmoittamaan hoitavalle lääkärilleen, mikäli hänellä ilmenee näön heikentymistä tai silmäkipua Roclanda-valmistetta käyttäessään.
Roclanda-valmisteen tehoa yli 12 kuukauden käytössä ei ole tutkittu.
Apuaine, jonka vaikutus tunnetaan
Bentsalkoniumkloridi
Tämä lääkevalmiste sisältää bentsalkoniumkloridia.
Bentsalkoniumkloridin on raportoitu aiheuttavan silmä-ärsytystä ja kuivasilmäisyyden oireita, ja se saattaa vaikuttaa kyynelkalvoon ja sarveiskalvon pintaan. Sen tiedetään värjäävän pehmeitä piilolinssejä. Varovaisutta on noudatettava käytettäessä sitä kuivasilmäisille potilaille ja potilaille, joilla sarveiskalvo on vaurioitunut.
Pitkäaikaisessa käytössä potilaita pitää seurata.
Yhteisvaikutukset
In vitro -yhteisvaikutustutkimukset ovat osoittaneet, että saostumista voi esiintyä, kun tiomersaalia sekoitetaan latanoprosti + netarsudiilin kanssa. Muut silmätipat on annettava vähintään 5 minuuttia erillään (ks. kohta Annostus ja antotapa).
In vitro -tutkimusten mukaan netarsudiili saattaa estää CYP450-isoentsyymejä sarveiskalvossa. Kliinistä näyttöä paikallisista farmakokineettisistä yhteisvaikutuksista ei kuitenkaan ole tähän mennessä havaittu.
Paradoksaalista silmänpaineen kohoamista on raportoitu kahden prostaglandiinianalogin samanaikaisen silmään annon jälkeen. Siksi kahden tai useamman prostaglandiinin, prostaglandiinianalogin tai prostaglandiinijohdannaisen käyttöä ei suositella.
Raskaus ja imetys
Raskaus
Ei ole olemassa tietoja tai on vain vähän tietoja latanoprosti + netarsudiilin käytöstä raskaana oleville naisille.
Raskauden aikaisia vaikutuksia ei ole odotettavissa, sillä netarsudiilin systeeminen altistus on merkityksetöntä (ks. kohta Farmakokinetiikka). Eläinkokeissa, joissa netarsudiilia on annettu laskimoon, ei ole havaittu suoria tai epäsuoria lisääntymistoksisia vaikutuksia kliinisesti merkittävillä altistuksilla (ks. kohta Prekliiniset tiedot turvallisuudesta).
Latanoprostilla on mahdollisesti haitallisia farmakologisia vaikutuksia raskauden aikana ja/tai sikiölle/vastasyntyneelle (ks. kohta Prekliiniset tiedot turvallisuudesta).
Siksi latanoprosti + netarsudiilia ei pidä käyttää raskauden aikana.
Imetys
Ei tiedetä, erittyykö/erittyvätkö netarsudiili/metaboliitit ihmisen rintamaitoon. Vaikka ei ole odotettavissa vaikutuksia vastasyntyneisiin tai imeväisiin, sillä netarsudiilin systeemisen altistuksen rintaruokkivalle naiselle odotetaan olevan merkityksetön, ei kuitenkaan merkittäviä kliinisiä tietoja ole saatavilla (ks. kohta Farmakokinetiikka).
Latanoprosti ja sen metaboliitit saattavat erittyä ihmisen rintamaitoon. On päätettävä lopetetaanko rintaruokinta vai lopetetaanko Roclanda-hoito ottaen huomioon rintaruokinnasta aiheutuvat hyödyt lapselle ja hoidosta koituvat hyödyt äidille.
Hedelmällisyys
Ei ole olemassa tietoa netarsudiilin vaikutuksista miesten tai naisten hedelmällisyyteen. Ei kuitenkaan ole odotettavissa vaikutuksia, sillä netarsudiilin systeeminen altistus on merkityksetön (ks. kohta Farmakokinetiikka). Eläinkokeissa latanoprostin ei ole havaittu vaikuttavan urosten tai naaraiden hedelmällisyyteen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Roclanda-valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn.
Jos näkö hämärtyy tilapäisesti tippoja silmään tiputettaessa, potilaan on odotettava näön kirkastumista, ennen kuin hän ajaa tai käyttää koneita.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Yleisimmät kliinisissä tutkimuksissa havaitut haittavaikutukset olivat sidekalvon verekkyys (46 %:lla potilaista), tiputuspaikan kipu (14 %), pyörresarveiskalvo (12 %) ja silmän kutina (7 %). Kliinisissä tutkimuksissa ei raportoitu vakavia haittavaikutuksia.
Taulukko haittavaikutuksista
Seuraavia haittavaikutuksia on raportoitu latanoprosti + netarsudiililla, kerran vuorokaudessa annettuna, sekä latanoprosti- ja netarsudiilikomponenttien kliinisissä tutkimuksissa ja markkinoille tulon jälkeisessä seurannassa. Haittavaikutukset on esitetty MedDRA-elinjärjestelmäluokittain. Kussakin elinjärjestelmäluokassa haittavaikutukset on luokiteltu seuraavien esiintyvyysluokkien mukaan: hyvin yleinen (≥1/10), yleinen (≥1/100, <1/10), melko harvinainen (≥1/1 000, <1/100), harvinainen (≥1/10 000, <1/1 000), hyvin harvinainen (<1/10 000) tai tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
| Elinjärjestelmäluokka | Esiintyvyys | Haittavaikutukset |
|---|---|---|
| Infektiot | Harvinainen | Herpeskeratiitti2 |
| Immuunijärjestelmä | Melko harvinainen | Yliherkkyys |
| Hermosto | Melko harvinainen | Päänsärky, Tahattomat lihassupistukset, Huimaus, Näkökenttäpuutokset3 |
| Silmät | Hyvin yleinen | Sidekalvon verekkyys1, Pyörresarveiskalvo1, Tiputuspaikan kipu, Värikalvon hyperpigmentaatio2, Silmäripsien ja silmäluomen velluskarvoituksen muutokset (silmäripsien pituuden, paksuuden, pigmentaation ja määrän lisääntyminen)2 |
| Yleinen | Sidekalvon verenvuoto, Näön hämärtyminen, Kyynelvuodon lisääntyminen, Silmäluomen punoitus, Silmän kutina, Silmän ärsytys, Huonontunut näöntarkkuus, Silmäluomen turvotus, Pistemäinen sarveiskalvotulehdus, Sarveiskalvosairaus, Sidekalvon turvotus, Allerginen sidekalvotulehdus, Silmäkipu, Kuivasilmäisyys, Vierasesineen tunne silmässä, Silmäluomen reunan karstoittuminen, Silmäluomitulehdus, Tiputuspaikan punoitus, Epämiellyttävä tunne tiputuspaikassa, Sarveiskalvon värjäymä vitaalivärjäyksessä | |
| Melko harvinainen | Silmäluomien kutina, Sidekalvosairaus, Sarveiskalvon samentuma, Silmän rähmiminen, Sarveiskalvon saostumat, Sidekalvotulehdus, Hankinnainen kyynelteiden ahtauma, Silmätulehdus, Silmän parestesia, Sidekalvon follikkelit, Silmän turvotus, Meibomin rauhasen toimintahäiriö, Sarveiskalvon pigmentaatio, Kaksoiskuvat, Ei-infektioosi sidekalvotulehdus, Poikkeava tunne silmässä, Sarveiskalvotulehdus, Taittovirhe, Etukammion valotie, Sidekalvon ärsytys, Kohonnut silmänpaine, Silmäluomen ihottuma, Silmäluomien ihon kuivuus, Silmäripsien kasvu, Kyynelerityksen häiriö, Värikalvotulehdus, Näkökyvyn heikkeneminen, Sarveiskalvodystrofia, Tiputuspaikan kuivuus, Tiputuspaikan kutina, Tiputuspaikan reaktio, Laitteeseen liittyvä silmäkomplikaatio, Väsymys, Tiputuspaikan parestesia, Makulaturvotus mukaan lukien rakkulainen makulaturvotus2, Suonikalvoston tulehdus2 Okulaarinen verekkyys Diabeettinen retinopatia3, Silmäallergia3 Epämiellyttävä tunne silmässä, Silmäluomisairaus3, Luomenreunan uloskääntymä3, Linssin samentuma3, Silmien väsyminen3, Episkleeran verekkyys3, Valorenkaiden näkeminen3, Etukammiotulehdus3, Sokeus3, Sidekalvolaskos, Silmäluomien ekseema3, Glaukooma3, Värikalvon kiinnikkeet3, Värikalvon pullistuma3, Okulaarinen hypertensio3, Tiputuspaikan ärsytys3, Lasittuneet silmät3, Tiputuspaikan turvotus3, Sidekalvon värjäymä3, Näköhermonpään cup/disc-suhteen suureneminen3, Madaroosi3, Silmäluomen pigmentaatio, Silmäsairaus, Verkkokalvon verenvuoto, Valonarkuus | |
| Harvinainen | Sarveiskalvon turvotus2, Sarveiskalvon eroosio2, Periorbitaalinen turvotus2, Trikiaasi2, Distikiaasi2, Värikalvon kysta2, Silmäluomien paikallinen ihoreaktio2, Silmäluomien ihon tummuminen2, Sidekalvon pseudopemfigoidi2 | |
| Hyvin harvinaiset: | Periorbitaalisista ja silmäluomien muutoksista johtuva luomivaon syventyminen2 | |
| Tuntematon | Retikulaarinen epiteliaalinen sarveiskalvon turvotus3 | |
| Sydän | Melko harvinainen | Angina pectoris2, Sydämentykytys2 |
| Hyvin harvinaiset: | Epävakaa angina pectoris2 | |
| Ruoansulatuselimistö | Melko harvinainen | Pahoinvointi, Oksentelu |
| Hengityselimet, rintakehä ja välikarsina | Melko harvinainen | Nenäverenvuoto, Nenän tukkoisuus, Epämukava tunne nenässä3, Nenäkipu3 Astma2, Hengenahdistus2 |
| Harvinainen | Astman pahentuminen2 | |
| Iho ja ihonalainen kudos | Yleinen | Kosketusihottuma |
| Melko harvinainen | Jäkälöityminen, Kuiva iho, Punoitus, Ihosairaus, Allerginen ihottuma3 Petekiat, Ihottuma | |
| Harvinainen | Kutina2 | |
| Luusto, lihakset ja sidekudos | Melko harvinainen | Leukakipu, Lihaskipu2, Nivelkipu2, Polykondriitti3, Lihasheikkous, Sjögrenin oireyhtymä |
| Yleisoireet ja antopaikassa todettavat haitat | Melko harvinainen | Rintakipu2 |
| Vammat, myrkytykset ja hoitokomplikaatiot | Melko harvinainen | Ekskoriaatio3 |
1 Ks. lisätietoja kohdasta Valikoitujen haittavaikutusten kuvaus.
2 Latanoprostimonoterapiassa havaittu haittavaikutus.
3 Netarsudiilimonoterapiassa havaittu haittavaikutus.
Valikoitujen haittavaikutusten kuvaus
Sidekalvon verekkyys
Sidekalvon verekkyys oli yleisin kliinisissä tutkimuksissa raportoitu latanoprosti + netarsudiili -hoitoon liittyvä haittavaikutus. Sen katsotaan liittyvän Rho-kinaasin estäjien lääkevalmisteluokan vasodilaatiovaikutukseen. Sidekalvon verekkyys oli tyypillisesti vaikeusasteeltaan lievää ja satunnaista. Suhteellisen pieni joukko tutkittavia, joilla esiintyi keskivaikeaa tai vaikeaa verekkyyttä, keskeytti kuitenkin tutkimuksen tämän haittavaikutuksen takia (5 % tutkittavista faasin 3 kliinisissä tutkimuksissa).
Pyörresarveiskalvo
Pyörresarveiskalvo ilmeni noin 13 %:lla potilaista kontrolloiduissa faasin 3 kliinisissä tutkimuksissa. Latanoprosti + netarsudiili -hoitoa saaneilla potilailla havaittu pyörresarveiskalvo todettiin ensimmäisen kerran 4 viikon päivittäisen annon jälkeen. Tämä haittavaikutus ei aiheuttanut ilmeisiä näön toiminnallisia muutoksia potilailla. Suurin osa pyörresarveiskalvotapauksista hävisi hoidon lopettamisen jälkeen. Pyörresarveiskalvon esiintyvyys oli suurempaa tietyissä alaryhmissä: iäkkäillä (≥ 65‑vuotiailla) verrattuna ei-iäkkäisiin (18,8 % vs. 11,5 %), miehillä verrattuna naisiin (18,8 % vs. 13 %) ja valkoihoisilla verrattuna muihin rotuihin (21,7 % vs. 2,5 %).
Värikalvon pigmentoituminen
Roclanda sisältää latanoprostia, joka on prostaglandiini F2α ‑analogi. Suurin osa latanoprostiin liittyvistä haittavaikutuksista kohdistuvat silmiin. Latanoprostilla tehdyssä 5 vuoden pituisessa turvallisuustutkimuksessa 33 %:lla potilaista ilmeni värikalvon pigmentoitumista (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Silmien värin muuttumista on havaittu etupäässä potilailla, joilla on moniväriset eli sinisenruskeat, harmaanruskeat, kellanruskeat tai vihreänruskeat värikalvot. Latanoprostilla tehdyissä tutkimuksissa muutos alkoi ilmetä yleensä ensimmäisten 8 hoitokuukauden kuluessa, ja vain harvoin toisena tai kolmantena hoitovuonna. Sitä ei ole havaittu neljännen hoitovuoden jälkeen. Värikalvon pigmentoituminen hidastuu ajan myötä ja pysyy stabiilina 5 vuoden ajan. Pigmentaation lisääntymisen vaikutusta ei ole arvioitu yli 5 vuoden ajanjaksolla. Värikalvon värimuutos on useimmissa tapauksissa lievä ja jää usein havaitsematta kliinisissä puitteissa. Potilailla, joilla on moniväriset silmät, haittavaikutuksen ilmaantuvuus on 7–85 %. Ilmaantuvuus on suurin potilailla, joiden värikalvo on kellanruskea. Potilailla, joiden silmien väri on tasaisen sininen, ei ole havaittu muutoksia, ja potilailla, joiden silmät ovat tasaisen harmaat, vihreät tai ruskeat, niitä esiintyy vain harvoin.
Värimuutos johtuu värikalvon strooman melanosyyttien melaniinipitoisuuden suurenemisesta, ei melanosyyttien määrän lisääntymisestä. Mustuaista ympäröivä ruskea pigmentti leviää tavallisesti samankeskisesti ulospäin, mutta värikalvo voi myös muuttua rusehtavammaksi kokonaan tai osittain. Värikalvon ruskean pigmentin ei ole havaittu lisääntyvän enempää hoidon päätyttyä. Kliinisissä tutkimuksissa tähän ilmiöön ei ole toistaiseksi todettu liittyvän oireita eikä patologisia muutoksia.
Hoito ei ole vaikuttanut värikalvon neevuksiin eikä pisamiin. Kliinisissä tutkimuksissa ei ole havaittu pigmentin kertymistä trabekkelivyöhykkeelle eikä muualle etukammioon.
Muut erityisryhmät
Iäkkäät potilaat
Pyörresarveiskalvoa lukuun ottamatta (ks. edellä) latanoprosti + netarsudiilin turvallisuusprofiilissa ei ole havaittu eroja < 65‑vuotiaiden tutkittavien ja ≥ 65‑vuotiaiden tutkittavien välillä.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Systeemisen altistuksen latanoprosti + netarsudiilin netarsudiilikomponentille on osoitettu olevan merkityksetöntä paikallisen silmään annon jälkeen.
Latanoprostin yliannostuksen yhteydessä ei ole havaittu muita silmiin kohdistuvia haittavaikutuksia kuin silmien ärsytystä ja sidekalvon verekkyyttä.
Jos latanoprostia niellään vahingossa, seuraavista tiedoista saattaa olla hyötyä: yksi pullo sisältää 125 mikrogrammaa latanoprostia. Yli 90 % lääkeaineesta metaboloituu maksassa ensikierron aikana. Terveillä tutkittavilla 3 mikrog/kg:n infuusio laskimoon ei aiheuttanut oireita, mutta 5,5–10 mikrog/kg:n annos aiheutti pahoinvointia, vatsakipua, huimausta, väsymystä, kuumia aaltoja ja hikoilua. Apinoilla enintään 500 mikrog/kg:n latanoprostiannosten infuusio laskimoon ei aiheuttanut vakavia verenkiertoelimiin kohdistuvia haittoja.
Apinoilla latanoprostin laskimonsisäiseen antoon on liittynyt ohimenevää keuhkoputkien supistumista. Keskivaikeaa astmaa sairastavilla potilailla latanoprostin paikallinen anto silmään kliinistä latanoprostiannosta seitsemän kertaa suurempana annoksena ei kuitenkaan aiheuttanut keuhkoputkien supistumista.
Latanoprosti + netarsudiilin paikallisen yliannostuksen tapauksessa silmä(t) voidaan huuhdella vesijohtovedellä. Yliannostuksen hoito käsittää elintoimintoja tukevan ja oireenmukaisen hoidon.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Silmätautien lääkkeet, glaukoomalääkkeet ja mioosin aiheuttavat valmisteet, ATC-koodi: S01EE51
Vaikutusmekanismi
Roclanda sisältää kahta vaikuttavaa ainetta: latanoprostia ja netarsudiilia. Nämä kaksi komponenttia alentavat silmänpainetta lisäämällä kammionesteen ulosvirtausta. Vaikka sekä latanoprosti että netarsudiili alentavat silmänpainetta lisäämällä kammionesteen ulosvirtausta, niiden vaikutusmekanismit ovat erilaisia.
Eläimillä ja ihmisillä tehdyt tutkimukset viittaavat siihen, että Rho-kinaasin estäjä netarsudiilin pääasiallinen vaikutusmekanismi on ulosvirtauksen lisääntyminen trabekkelisolujen kautta. Nämä tutkimukset viittaavat myös siihen, että netarsudiili alentaa silmänpainetta alentamalla episkleeran laskimopainetta.
Eläimillä ja ihmisillä tehdyt tutkimukset viittaavat siihen, että prostaglandiini F2α ‑analogi latanoprostin pääasiallinen vaikutusmekanismi on uveoskleraalisen ulosvirtauksen lisääntyminen, vaikkakin ulosvirtauksen on ihmisillä raportoitu jossain määrin helpottuvan (ulosvirtausvastuksen pienenentymisen vuoksi).
Kliininen teho ja turvallisuus
Roclanda-valmistetta arvioitiin kolmessa satunnaistetussa, kaksoissokkoutetussa faasin 3 kliinisessä tutkimuksessa, joihin osallistui 1 686 avokulmaglaukoomaa ja okulaarista hypertensiota sairastavaa potilasta. Tutkimuksiin 301 ja 302 otettiin tutkittavia, joiden silmänpaine oli < 36 mmHg, ja niissä verrattiin kerran vuorokaudessa annetun latanoprosti + netarsudiilin ja kerran vuorokaudessa annettujen netarsudiili 0,02 %- ja latanoprosti 0,005 % ‑monoterapioiden silmänpainetta alentavia vaikutuksia. Hoidon kesto oli 12 kuukautta tutkimuksessa 301 ja 3 kuukautta tutkimuksessa 302. Tutkittavien mediaani-ikä oli 66 vuotta (vaihteluväli 18–99 vuotta). Tutkimuksessa 303 arvioitiin latanoprosti + netarsudiilin tehoa silmänpaineen alentamisessa verrattuna bimatoprosti 0,03 % / timololi 0,5 % -valmisteeseen. Hoito kesti 6 kuukautta.
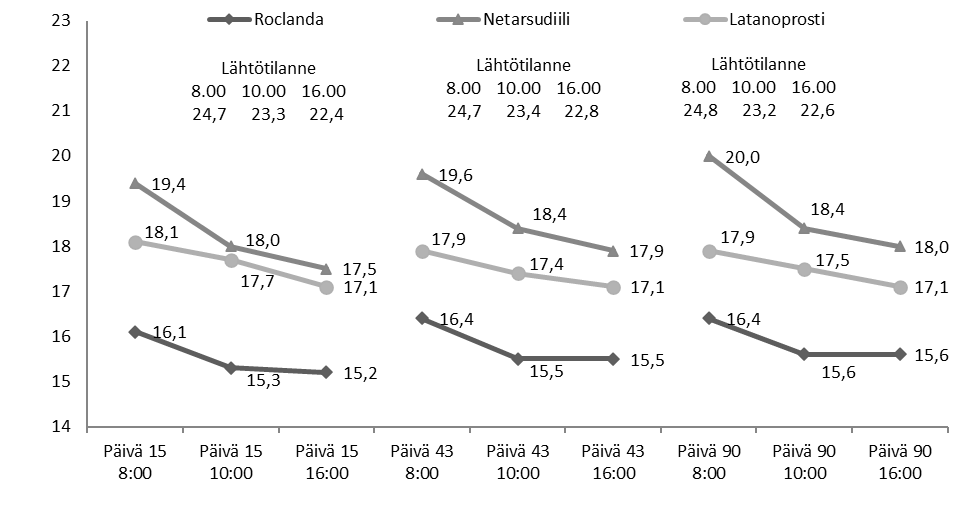
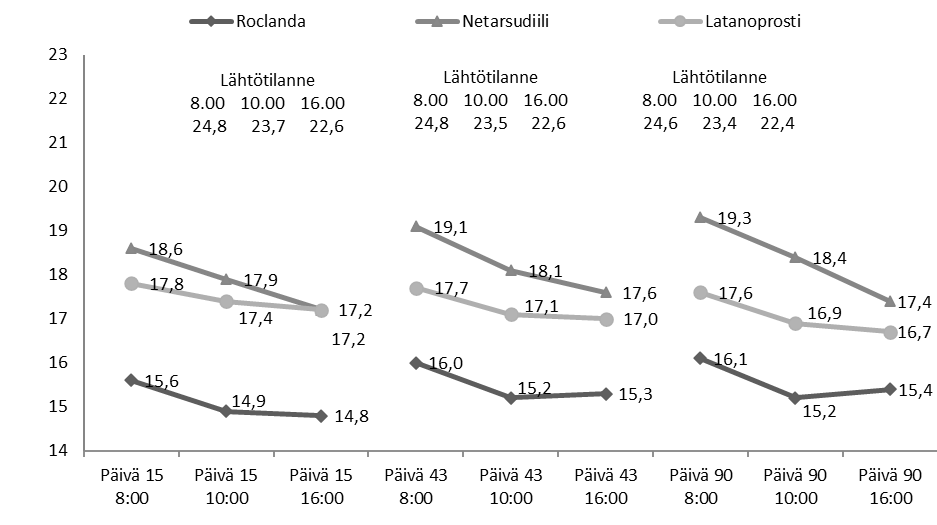
Tutkimusten 301 ja 302 tarkoitus oli osoittaa latanoprosti + netarsudiilin paremmuus kerran vuorokaudessa iltaisin annettuna suhteessa kerran vuorokaudessa annettaviin netarsudiili 0,02 %- ja latanoprosti 0,005 % ‑komponentteihin. Tehon ensisijainen mittari oli silmänpaineen pienimmän neliösumman (LS) keskiarvo kunakin yhdeksänä mittausajankohtana, jotka olivat klo 8.00, 10.00 ja 16.00 päivinä 15, 43 ja 90. Latanoprosti + netarsudiilin keskimääräinen silmänpainetta alentava vaikutus oli 1–3 mmHg suurempi kuin netarsudiili 0,02 %- tai latanoprosti 0,005 % ‑monoterapiassa koko 3 kuukauden hoitojakson ajan (kuvat 1 ja 2). Tutkimuksessa 301 latanoprosti + netarsudiilin silmänpainetta alentava vaikutus säilyi ja oli tilastollisesti parempi koko 12 kuukauden hoitojakson ajan. Erot silmänpaineen LS-keskiarvossa olivat kaikissa tapauksissa kliinisesti merkittäviä ja tilastollisesti merkitseviä (p < 0,0001) kuukauden 3 loppuun saakka. Faasin 3 tutkimuksiin otetuista tutkittavista silmänpaine oli ≥ 27 mmHg noin 30 %:lla (132 tutkittavalla latanoprosti + netarsudiili ‑hoitoryhmissä, 136 tutkittavalla latanoprostiryhmissä ja 143 tutkittavalla netarsudiiliryhmissä). Näillä tutkittavilla latanoprosti + netarsudiilin silmänpainetta alentava teho oli kaikkina ajankohtina tilastollisesti merkitsevästi parempi kuin kummankin komponenttinsa. Tutkimusten yhteistuloksissa yhdistelmävalmiste alensi silmänpainetta 1,7–3,7 mmHg enemmän kuin pelkkä latanoprosti ja 3,4–5,9 mmHg enemmän kuin pelkkä netarsudiili.
Kuva 1: Tutkimuksen 301 keskimääräinen hoitoryhmän mukainen silmänpaine (mmHg) sekä keskimääräistä silmänpainetta koskevat hoitoerot
 | |||||||||
latanoprosti + netarsudiili vs. netarsudiili 95 %:n luottamusväli | 3,0
(2,5, 3,6) | 3,0
(2,4, 3,6) | 2,4
(1,9, 3,0) | 3,2
(2,6, 3,8) | 2,9
(2,3, 3,5) | 2,3
(1,7, 2,8) | 3,1
(2,5, 3,8) | 3,2
(2,5, 3,8) | 2,0
(1,4, 2,6) |
latanoprosti + netarsudiili vs. latanoprosti 95 %:n luottamusväli | 2,3
(1,7, 2,8) | 2,6
(2,0, 3,2) | 2,3
(1,8, 2,9) | 1,7
(1,1, 2,4) | 1,9
(1,3, 2,5) | 1,7
(1,1, 2,2) | 1,5
(0,9, 2,1) | 1,7
(1,1, 2,3) | 1,3
(0,7, 1,9) |
Silmänpaineen LS-keskiarvo kunakin lähtötilanteen jälkeisenä ajankohtana perustui lähtötilanteen silmänpaineen mukaan korjattuun kovarianssianalyysiin, ja se käsitti kaikkien satunnaistettujen tutkittavien (238 latanoprosti + netarsudiili ‑ryhmässä, 244 netarsudiiliryhmässä ja 236 latanoprostiryhmässä) havaitut tiedot.
Kuva 2: Tutkimuksen 302 keskimääräinen hoitoryhmän mukainen silmänpaine (mmHg) sekä keskimääräistä silmänpainetta koskevat hoitoerot
| |||||||||
latanoprosti + netarsudiili vs. netarsudiili 95 %:n luottamusväli | 3,4
(2,8, 3,9) | 2,7
(2,2, 3,2) | 2,2
(1,7, 2,8) | 3,2
(2,6, 3,8) | 2,9
(2,3, 3,4) | 2,3
(1,8, 2,9) | 3,6
(3,0, 4,2) | 2,8 (2,3, 3,4) | 2,4
(1,9, 2,9) |
latanoprosti + netarsudiili vs. latanoprosti 95 %:n luottamusväli | 2,0
(1,5, 2,6) | 2,4
(1,9, 2,9) | 1,9
(1,3, 2,4) | 1,5
(0,9, 2,1) | 1,9
(1,3, 2,4) | 1,6
(1,0, 2,1) | 1,5
(0,9, 2,2) | 2,0
(1,4, 2,5) | 1,5
(1,0, 2,1) |
Silmänpaineen LS-keskiarvo kunakin lähtötilanteen jälkeisenä ajankohtana perustui lähtötilanteen silmänpaineen mukaan korjattuun kovarianssianalyysiin, ja se käsitti kaikkien satunnaistettujen tutkittavien (245 latanoprosti + netarsudiili -ryhmässä, 255 netarsudiiliryhmässä ja 250 latanoprostiryhmässä) havaitut tiedot.
Faasin 3 tutkimuksissa latanoprosti + netarsudiili -hoitoryhmissä mukana olleista noin 67 % oli valkoihoisia ja 30 % mustaihoisia tai afroamerikkalaisia. Yli puolet oli iältään ≥ 65‑vuotiaita. Pyörresarveiskalvon ilmaantuvuutta lukuun ottamatta (ks. kohta Haittavaikutukset) turvallisuusprofiilissa ei havaittu muita eroja rotujen ja ikäryhmien välillä.
Tutkimuksissa 301 ja 302 loppuun asti olleiden tutkittavien osuus oli pienempi latanoprosti + netarsudiili- ja netarsudiilihoitoryhmissä kuin latanoprostiryhmässä. Haittavaikutuksista johtuva keskeyttämisprosentti tutkimusten yhteistuloksissa kuukauden 3 kohdalla oli 8,7 % latanoprosti + netarsudiili -hoitoryhmissä vs. 7,6 % netarsudiiliryhmissä ja 1,0 % latanoprostiryhmissä. Haittavaikutuksista johtuva keskeyttämisprosentti tutkimuksessa 301 kuukauden 12 kohdalla oli 19,7 % latanoprosti + netarsudiili -hoitoryhmässä, 21,7 % netarsudiiliryhmässä ja 1,7 % latanoprostiryhmässä. Suurin osa keskeytyksistä liittyi silmätapahtumiin. Useimmin raportoitu keskeyttämiseen liittynyt haittatapahtuma latanoprosti + netarsudiili -ryhmässä oli sidekalvon verekkyys (7,6 % kuukauden 12 kohdalla). Useimmat latanoprosti + netarsudiili -ryhmässä raportoidut silmiin kohdistuneet haittatapahtumat olivat vaikeusasteeltaan lieviä.
Tutkimus 303 oli prospektiivinen, kaksoissokkoutettu, satunnaistettu, aktiivikontrolloitu ja rinnakkaisryhmiä käyttävä 6 kuukauden pituinen monikeskustutkimus, jossa arvioitiin latanoprosti + netarsudiilin turvallisuutta ja tehoa silmänpaineen alentamisessa verrattuna bimatoprosti + timololiin 430 tutkittavalla, joiden silmänpaine oli kohonnut. Tutkittavat satunnaistettiin saamaan suunnitellussa yhdistelmäannosta käyttävässä hoito-ohjelmassa joko latanoprosti + netarsudiilia yksi tippa (218 tutkittavaa) kerran päivässä (QD) joka ilta molempiin silmiin (OU) tai vertailuvalmistetta bimatoprosti + timololia (212 tutkittavaa) yksi tippa QD joka ilta OU noin 180 päivän ajan lääkityskatkon jälkeen.
Ensisijainen tehon päätetapahtuma oli latanoprosti + netarsudiilin vertailu bimatoprosti + timololiin keskimääräisen silmänpaineen suhteen tiettyinä ajankohtina viikolla 2, viikolla 6 ja kuukautena 3. Ensisijainen analyysi suoritettiin hoitoaikeen mukaiselle (ITT) populaatiolle imputoiden Markovin Monte Carlo (MCMC) -menetelmällä. Tämä analyysi osoitti kliinisen yhdenveroisuuden (non-inferioriteetin) latanoprosti + netarsudiilia sisältävälle silmäliuokselle verrattuna bimatoprosti + timololiin seuraavasti: annostus QD ITT-populaatiossa, 95 % luottamusvälin ylärajan ero (latanoprosti + netarsudiili – bimatoprosti + timololi) ≤ 1,5 mmHg kaikissa 9 ajankohdassa ja ≤ 1,0 mmHg suurimmassa osassa (6/9) ajankohdista viikosta 2 kuukauteen 3 täyttäen onnistumiskriteerit. Raja-arvo kliiniselle yhdenveroisuudelle latanoprosti + netarsudiilille QD verrattuna bimatoprosti + timololille QD (ryhmien välinen ero ≤ 1,5 mmHg) osoitettiin protokollan mukaisessa (PP) populaatiossa 8 ajankohdassa 9:stä (8.00, 10.00 ja 16.00) viikolla 2 ja kuukauteen 3 asti käyttäen MCMC-menetelmää. Kliinistä yhdenveroisuutta ei kuitenkaan saavutettu kaikkialla, koska viikon 6 ajankohdassa 8.00 95 % luottamusvälin yläraja oli 1,55. Yleisesti ottaen silmänpaineen aleneminen keskimäärin oli samanlainen koko päivän ajan, noin 9,5 mmHg sekä latanoprosti + netarsudiili- että bimatoprosti + timololi -hoitoryhmässä.
Tutkimushoidon keskeytysosuus hoidon aikana ilmenneen haittatapahtuman (TEAE, treatment-emergent adverse event) vuoksi oli yhteensä 11,2 %. Latanoprosti + netarsudiili QD -hoitoryhmässä tutkimushoidon keskeytti TEAE:n vuoksi useampi tutkittava (20,2 %) kuin bimatoprosti + timololi QD -ryhmässä (1,9 %). Suurin osa keskeyttämiseen johtaneista TEAE-tapahtumista oli silmän TEAE-tapahtumia. Mitään vakavia hoitoon liittyviä haittatapahtumia ei raportoitu missään hoitoryhmässä, ja turvallisuusprofiili on yhdenmukainen latanoprosti + netarsudiilin ja/tai pelkästään latanoprostin tai pelkästään netarsudiilin tunnetun turvallisuusprofiilin kanssa.
Latanoprosti + netarsudiilin tehoa ja turvallisuutta sellaisten potilaiden hoidossa, joilla on sarveiskalvon epiteelin vaurio tai samanaikaisia silmäsairauksia, esim. pseudoeksfoliaatio ja pigmenttidispersio-oireyhtymä, ei ole varmistettu.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset Roclanda-valmisteen käytöstä kohonneen silmänpaineen alentamiseen avokulmaglaukoomaa tai okulaarista hypertensiota sairastavilla potilailla kaikissa pediatrisissa potilasryhmissä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Imeytyminen
Systeemistä altistusta netarsudiilille ja sen aktiiviselle metaboliitille AR‑13503:lle arvioitiin 18 terveellä tutkittavalla sen jälkeen, kun netarsudiilia vahvuudella 200 mikrog/ml oli annettu paikallisesti silmään kerran vuorokaudessa (yksi tippa kumpaankin silmään aamuisin) 8 päivän ajan. Plasmassa ei ollut havaittavia netarsudiilipitoisuuksia (määrityksen alaraja [LLOQ] 0,100 ng/ml) annoksen jälkeen päivinä 1 ja 8. Aktiivista metaboliittia havaittiin plasmassa vain kerran yhdellä potilaalla, pitoisuudella 0,11 ng/ml 8 tuntia annoksen jälkeen päivänä 8.
Latanoprosti (molekyylipaino 432,58) on isopropyyliesterimuotoinen aihiolääke, joka on itse inaktiivinen. Hydrolysoiduttuaan latanoprostihapoksi se muuttuu biologisesti aktiiviseksi. Aihiolääke imeytyy hyvin sarveiskalvon läpi ja kaikki kammionesteeseen siirtyvä lääke hydrolysoituu sarveiskalvon läpäisyn aikana. Tutkimukset ihmisillä osoittavat, että huippupitoisuus kammionesteessä saavutetaan noin 2 tunnin kuluttua paikallisesta annosta. Apinoilla paikallisesti annettu latanoprosti jakautui pääasiassa silmän etukammioon, sidekalvoon ja silmäluomiin. Takakammioon latanoprostia kulkeutui vain erittäin pieniä määriä.
Biotransformaatio
Paikallisesti silmään annettu netarsudiili metaboloituu esteraasien avulla silmässä aktiiviseksi AR‑13503-metaboliitiksi.
Latanoprostihappo ei metaboloidu käytännöllisesti katsoen lainkaan silmässä. Sen metabolia tapahtuu pääasiassa maksassa. Ihmisellä puoliintumisaika plasmassa on 17 minuuttia. Tärkeimmillä metaboliiteilla, 1,2‑dinorilla ja 1,2,3,4‑tetranorilla, havaittiin eläintutkimuksissa hyvin vähän tai ei lainkaan biologista aktiivisuutta, ja ne erittyivät pääasiassa virtsaan.
Prekliiniset tiedot turvallisuudesta
Netarsudiili
Netarsudiilin farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta, genotoksisuutta ja kehitystoksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille. Haittoja on koe-eläimillä todettu vain silloin, kun on käytetty altistusta, joka ylittää suurimman ihmisille käytettävän annostuksen niin huomattavasti, että asialla on kliinisen käytön kannalta vain vähäinen merkitys.
Tiineille rotille ja kaniineille organogeneesin aikana laskimoon annettu netarsudiilimesylaatti ei aiheuttanut haitallisia alkio-/sikiövaikutuksia kliinisesti merkittävillä systeemisillä pitoisuuksilla. Tiineillä rotilla 0,1 mg/kg/vrk ei aiheuttanut emoon tai alkioon/sikiöön kohdistuvia haittavaikutuksia, kun taas 0,3 mg/kg/vrk ja sitä suuremmat annokset lisäsivät alkion kiinnittymisen jälkeisiä keskenmenoja ja heikensivät sikiöiden elinkelpoisuutta. Tiineillä kaniineilla 3 mg/kg/vrk ei aiheuttanut emoon tai alkioon/sikiöön kohdistuvia haittavaikutuksia, kun taas 5 mg/kg/vrk ja sitä suuremmat annokset lisäsivät alkion kiinnittymisen jälkeisiä keskenmenoja ja alensivat sikiöiden painoa.
Eläimillä ei ole tehty pitkäaikaistutkimuksia, joissa olisi arvioitu netarsudiilin mahdollista karsinogeenisuutta.
Netarsudiili ei ollut mutageeninen bakteerien mutaatiokokeessa, hiiren lymfoomakokeessa eikä rotan mikrotumatestissä.
Netarsudiililla ja sen aktiivisella metaboliitilla AR‑13503:lla havaittiin olevan mahdollisia fototoksisia vaikutuksia modifioidussa 3T3 NRU‑PT -määrityksessä in vitro, jossa aallonpituus pidennettiin sisältämään UVB-valo.
Latanoprosti
Latanoprostin silmätoksisuutta ja systeemistä toksisuutta on tutkittu useilla eläinlajeilla. Latanoprosti on yleensä hyvin siedetty, ja silmään annettavan kliinisen annoksen ja systeemisen toksisuuden välinen turvallisuusmarginaali on vähintään 1 000‑kertainen. Laskimoon annettujen suurten latanoprostiannosten, jotka olivat kliiniseen annokseen nähden noin 100‑kertaisia suhteessa painoon, todettiin lisäävän nukuttamattomien apinoiden hengitystiheyttä. Tämä johtui todennäköisesti lyhytkestoisesta keuhkoputkien supistumisesta. Eläinkokeissa latanoprostin ei ole todettu aiheuttavan herkistymistä.
Kaniineilla ja apinoilla ei ole havaittu silmätoksisia vaikutuksia enintään 100 mikrog/silmä/vrk:n annoksilla (kliininen annos on noin 1,5 mikrog/silmä/vrk). Latanoprostin on kuitenkin osoitettu lisäävän värikalvon pigmentaatiota apinoilla. Pigmentoitumismekanismi näyttää perustuvan värikalvon melanosyyttien melaniinituotannon stimulaatioon, johon ei liity havaittavia proliferatiivisia muutoksia. Värikalvon värimuutos saattaa olla pysyvä.
Pitkäaikaisissa silmätoksisuutta koskevissa tutkimuksissa on myös osoitettu, että 6 mikrog/silmä/vrk:n latanoprostiannokset suurentavat luomirakoa. Vaikutus on korjautuva, ja sitä esiintyy kliinistä annostusta suuremmilla annoksilla. Tätä vaikutusta ei ole havaittu ihmisellä.
Latanoprosti todettiin negatiiviseksi bakteereilla tehdyissä takaisinmutaatiotesteissä, hiiren lymfooman geenimutaatiotestissä ja hiiren mikrotumatestissä. Ihmisen lymfosyyteissä havaittiin kromosomipoikkeavuuksia in vitro. Prostaglandiini F2α:lla, joka on luontaisesti esiintyvä prostaglandiini, on havaittu samankaltaisia vaikutuksia, joten kyseessä on todennäköisesti luokkavaikutus.
Rotilla tehtyjen odottamatonta DNA-synteesiä koskeneiden ylimääräisten in vitro / in vivo ‑mutageenisuustestien tulokset olivat negatiivisia, mikä viittaa siihen, ettei latanoprostilla ole mutageenisiä vaikutuksia. Hiirillä ja rotilla tehtyjen karsinogeenisuustutkimusten tulokset olivat negatiivisia.
Eläinkokeissa latanoprostin ei ole havaittu vaikuttavan urosten tai naaraiden hedelmällisyyteen. Rotilla tehdyssä alkiotoksisuutta koskevassa tutkimuksessa laskimoon annettujen latanoprostiannosten (5, 50 ja 250 mikrog/kg/vrk) ei havaittu olevan alkiotoksisia. Kaniineilla latanoprosti aiheutti kuitenkin alkiokuolemia vähintään 5 mikrog/kg/vrk:n annoksilla.
Annos 5 mikrog/kg/vrk (noin 100-kertainen kliininen annos) aiheutti merkittävää alkio- ja sikiötoksisuutta, joka ilmeni myöhäisten resorptioiden ja keskenmenojen yleistymisenä ja sikiöiden painon pienenemisenä.
Teratogeenisia vaikutuksia ei ole havaittu.
Farmaseuttiset tiedot
Apuaineet
Bentsalkoniumkloridi
Mannitoli (E 421)
Boorihappo
Natriumhydroksidi (E 524) (pH:n säätöä varten)
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta.
Avattu pullo: 4 viikkoa pullon avaamisen jälkeen. Säilytä alle 25 °C.
Säilytys
Säilytä jääkaapissa (2 °C – 8 °C). Säilytä alkuperäispakkauksessa. Herkkä valolle.
Avatun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
ROCLANDA silmätipat, liuos
50 mikrog/ml+200 mikrog/ml (L:ei) 2,5 ml (16,57 €), 3 x 2,5 ml (48,59 €)
PF-selosteen tieto
Roclanda toimitetaan läpinäkyvässä, matalatiheyksisestä polyeteenistä valmistetussa pullossa (2,5 ml liuosta 4 ml:n säiliössä), jossa on matalatiheyksisestä polyeteenistä valmistettu kärki, valkoinen polypropeenikierrekorkki ja avaamattomuuden osoittava sinetti.
Pakkaus sisältää 1 tai 3 pulloa. Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Kirkas, väritön liuos, pH 5 (suunnilleen).
Osmolaliteetti: 280 mOsm/kg.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
ROCLANDA silmätipat, liuos
50 mikrog/ml+200 mikrog/ml 2,5 ml, 3 x 2,5 ml
- Ylempi erityiskorvaus (100 %). Glaukooma (114).
- Peruskorvaus (40 %).
ATC-koodi
S01EE51
Valmisteyhteenvedon muuttamispäivämäärä
14.08.2025
Yhteystiedot
Kelloportinkatu 1
33100 Tampere
03 284 8111
www.santen.fi